Пониженные тромбоциты при туберкулезе
Обновлено: 23.04.2024
Геморрагические заболевания — это патологические состояния системы крови, которые не редкие. В этой группе лидирует тромбоцитопеническая пурпура, случаи заболевания которой составляют, по статистике, от 43% до 50% во всех возрастных группах населения.
Тромбоцитопеническая пурпура у детей – болезнь, при которой в периферической крови уменьшается количество тромбоцитов, что является результатом иммунного конфликта между тромбоцитами и антигеном; при этом размеры селезенки остаются нормальными.
В последнее время увеличивается число детей с этим диагнозом, большинство из них – девочки. Рассматриваемая болезнь является приобретенной, даже если малыш родился с симптомами тромбоцитопенической пурпуры.
Формы заболевания:
Иммунные формы:
- изоиммунные
- аутоиммунные
- гетероиммунные
- трансиммунные
Изоиммунная тромбоцитопеническая пурпура возникает после переливания крови, если есть групповая несовместимость тромбоцитарных антигенов матери и плода. Аутоиммунная форма возникает от выработки антител на неизмененные тромбоциты. Гетероиммунная форма заключается в изменении антигенной структуры тромбоцита вследствие действия вирусов, лекарств и прочих факторов. Трансиммунная форма становится следствием прохождения антитромбоцитарных антител от матери с тромбоцитопенической пурпурой, к ребенку через плаценту.
Оценивая тяжесть криза, нужно учитывать выраженность геморрагического синдрома, отсутствие или наличие кровоизлияний и профузных кровотечений в органы, важные для жизнедеятельности человека, а также, насколько выражена постгеморрагическая анемия. Течение болезни может быть острым или хроническим. Хронической тромбоцитопеническая пурпура считается, если она длится от полугода.
Что провоцирует / Причины Тромбоцитопенической пурпуры у детей:
На сегодня зафиксировано больше пятидесяти лекарственных веществ, которые могут спровоцировать гаптеновую, гетероиммунную тромбоцитопеническую пурпуру. Некоторые из них:
- хинидин
- хинин
- сульфаниламиды
- фуросемид
- дипиридамол
- салицилаты
- парацетамол
- бетта-блокаторы
- тиазиды
- цефалоспорины
- ампициллин
- ванкомицин и пр.
Аутоиммунная ТПП возникает от срыва иммунологической толерантности к собственному антигену тромбоцитов.
Патогенез (что происходит?) во время Тромбоцитопенической пурпуры у детей:

Пониженное количество эритроцитов в крови ребенка
Антитромбоцитарные антитела взаимодействуют с определенными антигенными детерминантами тромбоцитарной мембраны. При тромбоцитопенической пурпуре у маленьких пациентов иногда обнаруживают тромбоциты с выраженным гранулярным аппаратом и повышенным содержанием в альфа-гранулах серотонина, но его освобождение нарушается.
Поскольку количество и качество тромбоцитов становится ненормальным, это влечет за собой изменения происходят и в сосудистой стенке. Снижается содержание тромбоцитарного фактора роста. А также происходит разрушение эндотелиоцитов под действием антитромбоцитарных антител, из-за чего признаки геморрагического синдрома начинают проявляться еще больше.
Патогенез у разных детей может отличаться, что нужно учитывать при диагностике и выборе методов и средств лечения.
Симптомы Тромбоцитопенической пурпуры у детей:
Типичным является резкое появление пурпуры. Это генерализированный геморрагический синдром микроциркуляторного типа, который выражен в зависимости от числа тромбоцитов в периферической крови. Значение имеет, если количество тромбоцитов меньше 100 000/мкл. Важно знать, что кровоточивость бывает, если их число менее 50 000/мкл.
Геморрагический синдром проявляется внутрикожными кровоизлияниями, кровоизлияниями в склеры, слизистые оболочки, десневыми и носовыми кровотечениями, течениями крови из матки, удаленного зуба, гематурией, меленой (редко).
Типичные черты пурпуры у детей:
- несимметричность, полихромность, спонтанность возникновения кровоизлияний
- неадекватность кровоизлияний степени внешних влияющих факторов
- полиморфность кровоизлияний
Самым тяжелым (но очень редким) осложнением болезни считается кровоизлияние в головной мозг. Среди факторов риска выделяют такие:
- кровоизлияния в склеру
- кровоточивость слизистых оболочек
- кровотечения
- кровоизлияния в сетчатку глаза
- генерализованный кожный геморрагический синдром с локализацией петехий на лице
- прием ребенком средств, ухудшающих функцию тромбоцитов
- интенсивные и травмирующие диагностические процедуры
- снижение количество тромбоцитов до уровня 20 000 / мкл и меньше
Проявления кровоизлияния в мозг могут быть различными, зависят от того, в какую зону оно произошло. Чаще всего у ребенка появляются такие признаки:
- головокружение
- головная боль
- коматозные состояния
- менингеальные симптомы
- рвота
- очаговая неврологическая симптоматика
Кроме геморрагического синдрома, при тромбоцитопенической пурпуре не выявляют признаки интоксикации, гепатоспленомегалию или лимфоаденопатию. Геморрагический синдром является единственным проявлением болезни.
Диагностика Тромбоцитопенической пурпуры у детей:
При подозрении на первичную иммунную тромбоцитопеническую пурпуру нужно определить тип кровоточивости, постараться выяснить возможные факторы-провокаторы и преморбидный фон. Проводят оценку родословной. Собирая анамнез, врач узнает у родителей об эпизодах кровоточивости, которые проявлялись до тромбоцитопении у ребенка. Важны сведения об эпизодах кровоточивости у родителей, братьев и сестер.
Следующий этап диагностики – осмотр с целью выявления сопутствующих болезней. Обращают внимание на нарушение слуха, аномалии скелета, чтобы выявить врожденную дисплазию или же патологию соединительной ткани.
Манжеточная проба для диагностики ТПП у детей
Выполняется она так: ребенку на плечо накладывается манжета аппарата, используемого для измерения АД. На протяжении 10 минут в этой манжете врач поддерживает давление, которое на 10-15 мм рт. ст. выше минимального артериального давления ребенка (это нужно выяснить до начала проведения пробы). Если после десяти минут у ребенка на месте наложения манжеты появились мелкие кровоизлияния в виде точек, которые называются в специализированной медицинской литературе петихиями, то результат пробы врач объявляет как положительный. Это плохой признак.
Положительная проба Румпеля-Лееде-Кончаловского (это второе название данного метода диагностики) применяется не только при подозрении на первичную иммунную тромбоцитопеническую пурпуру. Она указывает на то, что хрупкость капиляров повышена. А это может быть при васкулитах, ревматизме, заражении крови, инфекционном эндокардите, ревматизме, сыпном тифе, цинге. Потому при положительном результате этой пробы не стоит сразу думать о ТПП у ребенка. Нужны дополнительные диагностические методы.
В каких случаях пробы не проводятся
Проведение проб врачи не назначают, если у ребенка есть генерализированный кожный геморрагический синдром, если кровоточат слизистые, и особенно если ребенку до 3-х лет.
Популярные методы диагностики
Ребенку проводят клинический анализ крови, обязательно нужно подсчитывать количество ретикулоцитов и тромбоцитов. Определяют длительность кровотечения. Также среди актуальных диагностических методов называют пункцию костного мозга и анализ миелограммы. При тромбоцитопенической пурпуре миелограмма показывает, что количество мегакариоцитов нормальное или повышено. Это говорит о тромболитическом характере тромбоцитопении.
Исследование костного мозга – метод диагностики, который нужен, чтобы избежать ошибок в диагностике (и, как следствие, назначения неадекватного лечения малышу). Если, например, при остром лейкозе у ребенка ему ставят диагноз ТПП, назначают лечения такими препаратами как глюкокортикоиды (монотерапия), то прогноз болезни становится только хуже.
Если проводится стернальная пункция, то родители и медперсонал должны успокоить маленького пациента, потому что повышение интракраниального давления может вызвать кровоизлияние внутри черепа. Успокоение достигается приемом седативных средств перед проведением пункции. Применяется также быстрая техника аспирации костного мозга, это актуально особенно для детей с повышенной возбудимостью. В иных случаях нужно решать вопрос, исходя из имеющейся ситуации с больным ребенком.
Необходимо морфологическое исследование тромбоцитов у больного и его родителей (вероятно также у братьев и сестер при их наличии), чтобы исключить неиммунные микро-и макроцитарные наследственные тромбоцитопатии, например:
Обязательно исследуют функциональную способность тромбоцитов у ребенка, если количество выявленных тромбоцитов составляет больше 80 тыс / мкл. То же самое нужно сделать для сиблингов, матери и отца малыша.
Оценивают состояние коагуляционного звена гемостаза по таким показателям:
Информацию, полученную благодаря исследованиям этих составляющих системы гемостаза, учитывают, решая вопрос о спленэктомии и при прогнозировании эффективности этого метода.
Дополнительные методы исследования
- антитромбоцитарные анти-ДНК
- биохимические показатели крови
- антикардиолипиновые антитела
- тестирование на вирусы гепатита
- уровни иммуноглобулинов
- рентгенография органов грудной клетки
- анализы мочи
- цитогенетическое исследование
- УЗИ щитовидной железы, органов брюшной полости
Дифференциальная диагностика при подозрении на тромбоцитопеническую пурпуру
Наука не доказала, что применяемые на сегодняшний день тесты точные. По наличию тромбоцитопении нельзя определить первичную иммунную ТПП, нужно уточнять ее причины. Потому при диагностике тромбоцитопенической пурпуры нужно, прежде всего, исключить целый список болезней, а также синдромов, которые могут в своих клинических проявлениях иметь такой страшный и опасный для детей симптом как тромбоцитопения.
Иммунные ТПП у детей могут быть не только лишь первичными. Их отличаются от других болезней и патологических состояний. С тромбоцитопенией протекают такие болезни и состояния:
ТП по причине недостаточного образования тромбоцитов
- Наследственные формы ТПП
- Тромбоцитопатии, сочетающиеся с тромбоцитопенией
- Коагулопатии потребления
- ТП при наследственных аномалиях обмена веществ
- Тромбоцитопения при врожденных аномалиях сосудов
- ТПП при лучевой болезни
Дифференциальная диагностика проводится с такими болезнями:
Лечение Тромбоцитопенической пурпуры у детей:
Пир любых проявлениях геморрагического синдрома ребенка нужно госпитализировать. Когда болезнь находится в острой фазе, обязательно следует придерживаться постельного режима, чтобы свести к нулю вероятность получения совсем небольших травм, которые могут нести опасность при данном диагнозе. Режим расширяется, как только интенсивность геморрагического синдрома у ребенка или подростка становится меньше. Это нужно делать постепенно, как и при геморрагическом васкулите у детей. Если повышенной кровоточивости нет, образ жизни ребенка во время лечения всё равно должен быть спокойным, без риска травматизации (даже небольшой).
Диета при тромбоцитопенической пурпуре у детей
Ребенок должен питаться полноценно, в соответствии с нормам по возрасту, чтобы все необходимые ингредиенты сочетались в рационе гармонично. Врачи часто назначают детям диету 5. Глюкокортикостероиды оказывают катаболический эффект и отражаются на минеральном обмене, потому детям нужна диета, в которой будут богатые белком продукты и соли кальция.
Если у ребенка постгеморрагическая анемия и повышенная кровоточивость, им нужно много пить. Пищу принимают в охлажденном виде. Большие порции запрещены. Лучше давать ребенку протертые блюда.
В случаях неонатальной ТПП младенца нужно на протяжении 2-3 недель кормить молоком от донора. Потом ребенка разрешают кормить молоком матери, но нужно контролировать количество тромбоцитов в крови больного малыша.
Если диагноз первичной иммунной тромбоцитопении не оставляет сомнений, врачи должны решить, проводить лечение или нет. Цель терапии заключается в избежании тяжелых кровотечений, которые могут угрожать жизни, на протяжении течения тромбоцитопении. При осложнениях принимают вопрос о немедленном лечении, что не зависит от количества тромбоцитов. Если нет осложнений, родители полагаются на решение гематолога.
У детей чаще всего бывает острая тромбоцитопеническая пурпура, может быть выздоровление без видимых причин. Если нет кровотечений, то за больным ребенком устанавливается наблюдение со стороны врача и родителей. Если нет нарастания кожного геморрагического синдрома, то глюкокортикостероиды для лечения не нужны. В таких случаях геморрагии на коже исчезают на протяжении от 7 до 10 суток. В разные сроки количество тромбоцитов в крови приходит в норму, соответствующую возрасту. Сроки индивидуальны для каждого конкретного случая.
В прошлом и сейчас кортикостероиды – это базовое лечение детей с тромбоцитопенической пурпурой.
Действие кортикостероидов:
- десенсибилизирующее
- противовоспалительное
- иммуносупрессивная активность
- антиаллергическое
При назначении кортикостероидов число тромбоцитов становится выше, поскольку срабатывают комплексные механизмы. Также действие этой группы препаратов заключается в нарушении связывания аутоантител с аутоантигеном. Потому ГК влияют на все этапы патогенеза и все звенья при ТПП у детей.
В ходе терапии необходимо исследование антитромбоцитарных антител в сыворотке крови и на поверхности тромбоцитов. Это нужно, чтобы оценить эффективность лечения и составить прогноз.
Симптоматическая терапия при тромбоцитопенической пурпуре у детей
Такое лечение показано, если у маленького пациента есть кожные геморрагии и неглубокая тромбоцитопения. Новорожденным с нетяжелой кровоточивостью необходимо лечение симптомов (проявлений болезни). Прописывают эпсилон-аминокапроновую кислоту, которую нужно применять 4 раза в день внутрь по 0,05 г/кг тела ребенка. Но перед приемом нужно исключить ДВС-синдром. Может применяться также кальция пантотенат 3 раза в сутки внутрь по 0,01 грамма. Эффективен и этамзилат натрия, который ребенку дают внутрь по 3 раза в сутки, доза составляет 0,05 г/кг на 1 прием.
Спленэктомия
Этот метод является не обязательным для каждого больного ребенка. Показания для назначения:
- угроза опасных для жизни малыша кровотечений
- некупирующееся кровотечение
- глубокая тромбоцитопения (число тромбоцитов меньше 30 тыс / мкл)
При хронической ТПП у детей показания к плановой спленэктомии – это отсутствие стойкой ремиссии, даже если были проведены повторные курсы лечения глюкокортикостероидами. Спленэктомия после лечения глюкокортикостероидами, может сказаться по-разному, в зависимости от разных факторов. Признаки того, что спленэктомия дает эффект: короткие курсы ГК терапии, начальная доза глюкокортикостероидов не меньше 2 мг/кг, проведение спленэктомии в период клинической ремиссии и т.д.
Если плановая спленэктомия была проведена ребенку по нужным показаниям, то ремиссия бывает у 98 больных из 100. Только 2% больных остаются с прежними симптомами.
Профилактика Тромбоцитопенической пурпуры у детей:
1. Диспансерное наблюдение при острой тромбоцитопенической пурпуре у детей необходимо на протяжении пяти лет. При хронической форме малыша наблюдают, пока он не будет по возрасту переведен во взрослую поликлинику.
2. Если у малыша резко выражен геморрагический синдром, то двигательный режим ограничивают. Нужно запретить даже игры на улице. Спорт запрещен, даже если число тромбоцитов менее 100 000 / мкл и геморрагический синдром выражен по-минимуму. Это позволяет избежать травматизации.
3. Из диеты исключают блюда с содержанием уксусов, например, майонез и любые маринады. Также ребенку нельзя кушать овощные консервы и консервированные продукты промышленного изготовления, потому что в их составе может быть аспирин, именуемый иначе салицилатом. Не всегда это указано на упаковке. Аспирин и уксус снижают функцию тромбоцитов. Нужно при построении диеты исключить из рациона малыша пищевые аллергены, потому что они могут увеличить степень тромбоцитопении. Пища должна быть богата витаминами С, Р, А.
4. Если тромбоцитопения сохраняется, но нет геморрагического синдрома, лечение не нужно, но в качестве профилактики двигательный режим нужно ограничить. При активном образе жизни ребенка необходимой будет симптоматическая профилактическая терапия. Нужно чередовать курсы фитотерапии с ангиопротекторами.
Профилактическая фитотерапия проводится такими травами:
- тысячелистник
- крапива двудомная
- зайцегуб опьяняющий
- зверобой
- пастушья сумка
- кукурузные рыльца
- водяной перец
- земляника
Среди ангиопротекторов эффективность доказали аскорутин, дицинон, магнум С, траумель. Первый из этих препаратов дают ребенку 3 раза в день по одному драже. Дицинон принимается так же. Магнус С нужно давать 1 раз в день. А траумель дают ребенку 3 раза в сутки по одной таблетке. Решение о приеме в профилактических целях этих препаратов должен принимать лечащий врач.
Составляющие фитосбора меняют в зависимости от того, какие сопутствующие болезни есть у ребенка. Когда заканчивают курс ГК, в терапию добавляют корень солодки.
5. Ребенку с тромбоцитопенической пурпурой не дают аспирин и антикоагулянты и/или антиагреганты, запрещено УВЧ, под запретом нитрофураны, УФО.
6. На протяжении 3-5 лет ребенку нельзя переезжать в страну/регион с другим климатом.
7. Если геморрагический синдром минимально выражен, а количество тромбоцитов меньше 100 тыс / мкл, то запрещены внутримышечные инъекции детям.
8. Нужно планово осматривать ребенка, чтобы выявить хронические очаги инфекции, провести их санацию.
9. Необходима профилактика ОРВИ у детей.
10. Профилактические прививки больным тромбоцитопенической пурпурой детям проводят только при ремиссии симптомов.
К каким докторам следует обращаться если у Вас Тромбоцитопеническая пурпура у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Тромбоцитопенической пурпуры у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Кровь при туберкулезе. Гематологические показатели туберкулеза.
В результате интоксикации, изменения реактивности организма и тканевых повреждений у больных туберкулезом наступают различные по характеру сдвиги в кроветворной системе. Существенную роль играют при этом не столько форма, сколько фаза и динамика процесса. При ограниченных и малоактивных его формах количество эритроцитов обычно находится в пределах нормы и отсутствуют признаки анемии. При массивных инфильтратах или творожистой пневмонии, при распространенном казеозном лимфадените, специфическом поражении кишечника, вовлечении в процесс печени, селезенки, костного мозга, а также после больших легочных или послеоперационных кровотечений отмечаются падение количества эритроцитов и изменение их морфологии (олиго- и полихромазия), а иногда мегалобластическая, апластическая или анемия смешанного типа (мегалобластическая и железодефицитная). При этом увеличивается содержание не вполне созревших эритроцитов — ретикулоцитов (свыше 0,5—1 % ) и количество кровяных пластинок (более 250 000—300 000). Подобным образом изменяется и эритропоэтическая функция костного мозга.
Чаще и в большей мере при туберкулезе, но главным образом при выраженных, прогрессирующих и осложненных его формах изменяется лейкограмма. В части случаев может отмечаться умеренный лейкоцитоз (до 10000—15 000 лейкоцитов), реже лейкопения. Так, Е. Л. Кан (1972) наблюдала лейкопению у 20,7% больных с ограниченными и легко протекавшими формами процесса и у 12,5% — при деструктивном и прогрессирующем туберкулезе легких.
Наиболее часто сдвиги наступают в лейкоцитарной формуле. Увеличивается количество нейтрофилов как в абсолютном, так и в относительном выражении за счет палочкоядерных форм (до 15—20%). Одновременно уменьшается содержание лимфоцитов (до 8—15%). При выраженном и затянувшемся инфильтративном процессе и обширном бронхогенном обсеменении появляется патологическая зернистость нейтрофилов. При диссеминации, по наблюдениям Н. Н. Боброва (1950) и Н. А. Шмелева (1959), нарастает моноцитоз (до 10—18%).
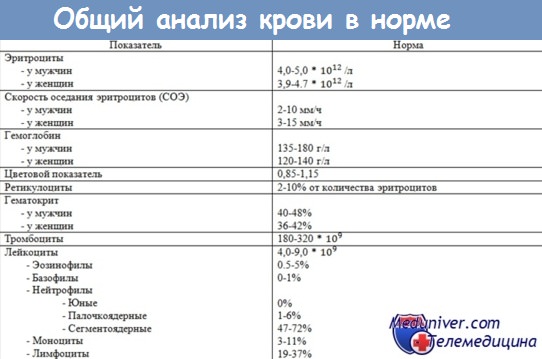
Заслуживает внимания указание на увеличение абсолютного количества базофилов при активном туберкулезном процессе. Тромбоцитарный профиль периферической крови характеризуется увеличением удельного веса форм раздражения и дегенеративных элементов, что обусловлено степенью активности процесса и интоксикации.
Таким образом, отдельные фазы туберкулеза легких характеризуются следующими гематологическими синдромами.
Фаза инфильтрации: умеренный или значительный лейкоцитоз, выраженный сдвиг пейтрофилов влево, нормальное или повышенное содержание нейтрофилов с патологической зернистостью, умеренное или значительное ускорение РОЭ, смещение тромбоцитограммы вправо за счет повышения содержания форм раздражения и дегенеративных элементов.
Фаза распада: небольшой лейкоцитоз или нормальное количество лейкоцитов, увеличение процента нейтрофилов с патологической зернистостью и сдвигом влево, иногда с появлением миелоцитов, уменьшение количества эозинофилов и лимфоцитов, значительное ускорение РОЭ.
Фаза гематогенной диссеминации: нормальное количество лейкоцитов, абсолютный и относительный моноцитоз.
Фаза рассасывания: увеличение количества эозинофилов и лимфоцитов, отсутствие ядерного сдвига влево.
Фаза уплотнения: нормальные показатели гемограммы, иногда лимфоцитоз.
Гемограмма у больных туберкулезом изменяется в процессе лечения. В благоприятных случаях нормализуется количественный и качественный состав кровяных клеток. Такие положительные сдвиги наступают обычно спустя 2—3 мес, т. е. через более длительный срок после исчезновения лихорадки и других симптомов интоксикации. Гематологические сдвиги исчезают тем быстрее, чем успешнее терапевтическое вмешательство, т. е. чем скорее прекращается интоксикация, рассасываются очаги и зоны инфильтрации, закрываются каверны, прекращается бацилловыделение.
Вместе с тем следует иметь в виду воздействие на гемопоэз различных антибактериальных препаратов. Они нередко вызывают эозинофилию, в отдельных случаях — лейкоцитоз, а чаще лейкопению; иногда при этом угнетается образование нейтрофилов вплоть до аграпулоцитоза и может стимулироваться лимфоидно-ретикулярная реакция. Эти изменения наступают в результате аллергизирующего или токсического действия препаратов на костный мозг.
При развитии агранулоцитоза необходимо прекратить прием вызвавшего его медикамента. Аллергизация к препарату определяется лабораторными пробами (тест Шелли, реакция Уанье). Назначение нуклеината натрия или пентоксила, кортикостероидных гормонов, поливитаминов, гемотрансфузии способствует восстановлению костно-мозгового кроветворения.
Таким образом, систематический гематологический контроль и правильный анализ полученных при этом результатов имеют существенное значение для оценки клинического состояния больного, динамики процесса и эффективности применяемого лечения. Гематологические данные приобретают определенное значение и при дифференциальной диагностике туберкулеза и других заболеваний органов дыхания.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Тромбоцитопения у гематологических больных - показания к коррекции
В онкогематологии причиной тромбоцитопении могут являться побочные эффекты цитостатической терапии, опухолевая инфильтрация костного мозга или его замещение лейкемическим клоном, спленомегалия, аутоиммунные процессы. Кроме того, необходимо помнить, что тромбоцитопения может быть следствием побочного действия сопутствующей терапии или проявлением синдрома ДВС (диссеминированного внутрисосудистого свертывания).
Кроме изменения количества тромбоцитов, возможно и нарушение их функции, что также может приводить к клинически значимым последствиям. Нарушение функции тромбоцитов, заключающееся в снижении их способности к агрегации и тромбообразованию, может наблюдаться при остром миелолейкозе, множественной миеломе, макроглобулинемии Вальденстрема, моноколональных гаммапатиях.
Первые заместительные трансфузии тромбоцитов при тромбоцитопении были проведены в 50-х годах прошлого века у пациентов с острыми лейкозами, получающими цитостатическую терапию. Уже к 60-м годам исследователями из Национального Института Рака США (NCI) была выявлена четкая зависимость между уровнем тромбоцитов в период индукции ремиссии и риском гибели от геморрагических осложнений. Также была показана способность донорских тромбоцитов снижать риск развития тяжелых кровотечений или прекращать уже начавшиеся тромбоцитопенические кровотечения.
Кроме того, было отмечено, что донорские тромбоциты более эффективны для предотвращения, чем для лечения уже начавшегося кровотечения.
Донорские тромбоциты для заместительных трансфузий могут быть получены двумя основными методами. В одном случае богатую тромбоцитами плазму получают при центрифугировании 1 дозы (400 мл) цельной донорской крови. Полученный продукт обычно содержит около 0,5—0,6 • 10" тромбоцитов. Для адекватной заместительной поддержки необходимо 6—8 доз данного продукта от соответствующего количества доноров, в связи с чем в зарубежной литературе он получил название multiple-donors platelets (тромбоциты множественных доноров).
Как показывают некоторые исследования, при использовании тромбоплазмы чаще и раньше развиваются аллоиммунизация и рефрактерность (отсутствие клинического эффекта) к трансфузиям донорских тромбоцитов. Кроме того, большее количество доноров увеличивает риск заражения гемотрансмиссивными инфекциями. Необходимо учитывать и тот факт, что различен и контингент доноров, сдающих кровь для получения тромбоплазмы и тромбоконцентрата с сепаратора. К получению тромбоконцентрата на сепараторе обычно допускаются кадровые доноры, в то время как цельную кровь, из которой в дальнейшем получают тромбоплазму, могут сдавать и однократно обратившиеся люди.
Как показывает исследование, проведенное в США, риск обнаружить гемотрансмиссивную вирусную инфекцию у доноров, сдающих кровь на сепараторе, на 50 % ниже, чем у доноров, сдающих цельную кровь для приготовления тромбоплазмы.
Необходимо четко разграничить два понятия — профилактические и терапевтические трансфузии тромбоцитов. Под профилактическими трансфузиями понимается введение донорских тромбоцитов для предотвращения развития кровотечений, в то время как терапевтические трансфузии проводятся пациентам, уже имеющим клинически выраженное кровотечение, с целью его остановки. Как отмечено ранее, более эффективны профилактические трансфузии.
При наличии перечисленных выше признаков профилактические трансфузии начинают при уровне тромбоцитов ниже 20•10 9 /л. Как показывают некоторые исследования, использование больших доз тромбоцитов позволяет увеличить интервал между трансфузиями. Однако даже эти показания считаются некоторыми исследователями слишком либеральными. Согласно данным J. Gmur и соавт., повышения частоты тяжелых кровотечений не происходит и в случае, если профилактические трансфузии проводятся лишь при уровне тромбоцитов менее 5•10 9 /л и отсутствии лихорадки и кровоточивости или при уровне менее 10•10 9 /л и наличии этих признаков. В двух рандомизированных исследованиях было показано, что риск развития выраженных кровотечений у больных острым лейкозом не отличается, если профилактические трансфузии начинаются при уровне тромбоцитов менее 10•10 9 /л или менее 20•10 9 /л. Такой подход позволяет статистически значимо снизить потребность в донорских тромбоцитах.
Эффективность трансфузий оценивают с использованием скорригированного прироста тромбоцитов (СПТ):
СПТ = (абс. прирост тромбоцитов, 10 9 /л) х (площадь поверхности тела, м2)/(количество перелитых тромбоцитов, 10 11 ).
Через 18—24 ч после трансфузии СПТ обычно составляет 10—20. Более низкий показатель может свидетельствовать о повышенном потреблении или разрушении тромбоцитов либо о неадекватности их получения и хранения. Последняя причина не будет рассматриваться в дальнейшем, однако ее необходимо заподозрить в случае, если не удается получить достаточного СПТ у нескольких пациентов, получавших трансфузии тромбоцитов из одной и той же станции переливания крови.
Причиной недостаточного СПТ может являться наличие у пациента инфекции и/или лихорадки, что обусловлено повышенным потреблением тромбоцитов (даже без лабораторных признаков коагулопатии потребления). Также причиной низкого СПТ может быть секвестрация тромбоцитов в селезенке, особенно при спленомегалии. Одной из причин рефрактерности является выработка антител к тромбоцитам, ассоциированная с лекарственными веществами. Ряд препаратов способен присоединяться к специфическим белкам мембраны тромбоцитов, вызывая их временное структурное изменение или действуя в качестве гаптена, что приводит к выработке антител.
Другим важным фактором, приводящим к рефрактерности к трансфузиям тромбоцитов, является выработка антител к антигенам доноров (HLA-A и HLA-В, АВ-Н системы). Данные о риске развития и факторах, предрасполагающих к аллоиммунизации, противоречивы. Как показывает большинство исследований, около 50—90 % больных, получающих множественные трансфузии, имеют аллоиммунизацию. В то же время возрастание доли аллоиммунизированных больных одновременно с увеличением количества трансфузий донорских тромбоцитов показано далеко не во всех исследованиях. Более того, у части пациентов аллоиммунизация не развивается, несмотря на множественные переливания компонентов крови. К сожалению, при развитии аллоиммунизации даже при использовании в дальнейшем HLA совместимых донорских тромбоцитов добиться их прироста удается далеко не всегда. В связи с этим предпочтительным является не борьба с уже развившейся аллоиммунизацией, а ее профилактика.
Как показывают исследования, совместимость по системе AB0 и резус-фактору не является абсолютно обязательной при трансфузиях тромбоцитов, так как не было показано, что такая несовместимость приводит к нарушению функции или структурным изменениям тромбоцитов. Такой подход позволяет значительно расширить возможности для трансфузий, не ограничивая пул доноров только совместимыми по группе крови с реципиентом. В то же время при наличии выбора предпочтительно использование AB0 совместимых тромбоцитов, так как в рандомизированном исследовании было показано, что многократное переливание AB0 несовместимых тромбоцитов хотя и не приводит к рефрактерности, но снижает СПТ.
В последние годы широко исследуются альтернативные пути борьбы с тромбоцитопенией у онкологических пациентов. Большое количество ростовых факторов и цитокинов было тестировано с этой целью (Г-КСФ и ГМ-КСФ, ИЛ-1, -3, -6, -11, c-kit-лиганд и т. д.). До настоящего времени только ИЛ-11 был одобрен в качестве препарата, назначаемого при тромбоцитопениях, однако его эффект в основном доказан при незначительном снижении уровня тромбоцитов. Исследования, посвященные эффективности рекомбинантного тромбопоэтина (c-mpl-лиганд), в настоящее время практически прекращены из-за его способности индуцировать развитие антител к эндогенному тромбопоэтину, что сопровождается развитием тромбоцитопении даже у здоровых доноров. В качестве альтернативы трансфузиям донорских тромбоцитов исследуют эффективность лиофилизированных тромбоцитов и их мембран, модифицированных эритроцитов, синтетических липосом, состоящих из фосфолипидов и гликопептидных комплексов тромбоцитов и т. д.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Основные компоненты гемостаза:
— факторы коагуляции— белки, в основном вырабатываемые в печени и участвующие в каскаде коагуляции;
— тромбоциты— клеточные элементы крови, концентрирующиеся и формирующие процесс агрегации в области повреждения и образующие первичный тромб;
— фибринолитические факторы— ферменты, участвующие в лизисе сгустка крови после процессов заживления и регенерации поврежденных тканей;
— ингибиторы— факторы коагуляции, которые помогают локализовать сгусток в месте повреждения и препятствуют развитию генерализации процесса тромбообразования в сосудах всего организма;
— клетки эндотелия сосудов— выстилающие внутреннюю поверхность сосуда эпителиальные клетки. В неповрежденном состоянии сосудов и тканей они обеспечивают нормальный ток крови, в случае травматизации последних они генерируют выработку биологически активных веществ: факторов коагуляции и фибринолиза.
Все эти компоненты должны быть сбалансированы и находиться под жестким контролем.
— сосудистый ответ— сужение поврежденного кровеносного сосуда;
— тромбоциты— образование тромбоцитарного тромба (первоначальный гемостаз);
— коагуляция— матрица фибрина стабилизирует тромб;
— фибринолиз— предотвращает чрезмерный прирост тромба и проводит его возможную ликвидацию.
Тромбоциты
/ukr/8/1.jpg)
Тромбоциты образуются при фрагментации цитоплазмы мегакариоцитов— огромных полиплоидных костномозговых клеток, возникающих посредством эндомитоза. При этом происходит 3–5 циклов удвоения хромосом без разделения цитоплазмы. После выхода из костного мозга примерно треть тромбоцитов секвестрируется в селезенке, а оставшиеся две трети циркулируют в кровотоке 7–10 сут. При уменьшении количества тромбоцитов число, размер и плоидность мегакариоцитов возрастают, что способствует повышению образования тромбоцитов. Этот процесс регулируется тромбопоэтином (ТПО), рецептор которого кодируется протоонкогеном MPL. Тромбопоэтин— главный регулятор их производства, вырабатывается преимущественно в печени и почках. Он секретируется постоянно в небольших количествах и связывается с циркулирующими тромбоцитами. Тромбоциты— наиболее мелкие среди элементов крови, их размер составляет 3,0–0,5 микрона. У тромбоцита нет ядра, но имеется большое количество гранул (до 200) различного строения. Все структуры, имеющие строение гранул, называются грануломером, а все негранулярные компоненты цитоплазмы— гиаломером; на цитомембране имеются рецепторы для факторов свертывания крови. Грануломер содержит митохондрии, частицы гликогена, отдельные рибосомы, единичные короткие цистерны гранулярной эндоплазматической сети, элементы комплекса Гольджи и гранулы нескольких типов.
a-гранулы содержат: гликопротеины (фибронектин, фибриноген, фактор Виллебранда), белки, связывающие гепарин (фактор 4 тромбоцитов регулирует проницаемость сосудов, выход кальция из костей, хемотаксис нейтрофилов и эозинофилов, нейтрализует гепарин), b-тромбоглобулин; факторы роста (тромбоцитарный фактор роста, трансформирующий фактор роста b); факторы свертывания и тромбоспондин (тромбоспондин усиливает адгезию и агрегацию тромбоцитов; тромбопластин, фактор V, GMP-140— белок семейства селектинов, рецептор адгезии). На внутренней поверхности мембраны имеются рецепторы для факторов свертывания.
d-гранулы (плотные гранулы, или тельца)— немногочисленные (до пяти) мембранные пузырьки диаметром 250—300 нм с плотным матриксом, который иногда располагается в них эксцентрично. Матрикс содержит АДФ, АТФ, Са2+, Mg2+, пирофосфат, гистамин, серотонин. Последний не синтезируется тромбоцитами, а поглощается ими из крови.
l-гранулы или азурофильные гранулы— мелкие (диаметр 200–250 нм) пузырьки, содержащие ферменты. Рассматриваются как лизосомы.
Плазмолемма тромбоцитов покрыта снаружи толстым (от 50 до 150–200нм) слоем гликокаликса с высоким содержанием гликозаминогликанов и гликопротеинов. Она содержит многочисленные рецепторы, опосредующие действие веществ, активирующих и ингибирующих функции тромбоцитов, обусловливающие их прикрепление (адгезию) к эндотелию сосудов и агрегацию (склеивание друг с другом). Наиболее важными из них в функциональном отношении являются рецепторные гликопротеины I (субъединицы Ia, Ib, Ic), II (субъединицы IIа, IIb), III (субъединицы IIIа, IIIb), IV, V, рецепторы к АДФ, адреналину, тромбину, фактору Ха, фактору агрегации тромбоцитов, коллагену, которые обусловливают адгезивные и агрегационные функции тромбоцитов.
Гиаломер содержит две системы трубочек (канальцев) и большую часть элементов цитоскелета. При соприкосновении с поверхностью, отличающейся по своим свойствам от эндотелия, тромбоцит активируется, распластывается и у него появляется до 10 зазубрин и отростков, которые могут в 5–10 раз превышать диаметр тромбоцита. Наличие этих отростков важно для остановки кровотечения.
Формы тромбоцитов: юные, зрелые, старые, дегенеративные и гигантские.
Функции тромбоцитов. Процесс транс-формации активированных тромбо-цитов в устойчивый тромб является единым процессом, который можно разделить на четыре этапа: адгезию, агрегацию, уплотнение и секрецию. В инертном виде тромбоциты не слипаются со стенкой сосуда. При повреждении сосудистой стенки происходит выброс субэндотелиальных продуктов, таких как коллаген. Тромбоциты адгезируются с коллагеном и формируют гемостатически эффективный тромб. Это взаимодействие может быть инициировано фактором Виллебранда. Привлечение большего числа происходит при тромбоцито-тромбоцитарном контакте, который инициируется в основном через фибриногеновый рецептор, GPIIb-IIIa. Адгезивный процесс приводит к секреции содержимого гранул, превращая неплотно соединенное скопление тромбоцитов в однородную массу. Секреция содержимого гранул вызывается сигналом, прошедшим сквозь мембрану тромбоцита, с последующим притоком и высвобождением кальция. Содержимое гранул имеет высокую концентрацию внутри тромба и находится близко к поверхности первичного тромба, что обусловливает нормальный процесс коагуляции на поверхности тромбоцита. Это является основой для начала формирования фибринового сгустка— фазы вторичного гемостаза. Затем вступают АДФ и тромбоксан А2. Тромбоксан А2 формируется в результате внутриклеточного метаболизма арахидоновой кислоты, которая окисляется циклооксигеназой в эндопероксиды. Эндопероксиды затем подвергаются воздействию тромбоксанового фермента, и в результате образуется тромбоксан А2. Тромбоксан А2 в жидком состоянии является потенциальным инициатором агрегации тромбоцитов.
Классификация дефектов гемостаза:
1. Тромбоцитопения— уменьшение числа тромбоцитов.
2. Тромбоцитопатия— нарушение функции тромбоцитов.
3. Патология коагуляционного гемостаза— нарушение концентрации факторов свертывания и их функциональной активности.
4. Вазопатия— патология кровеносных сосудов.
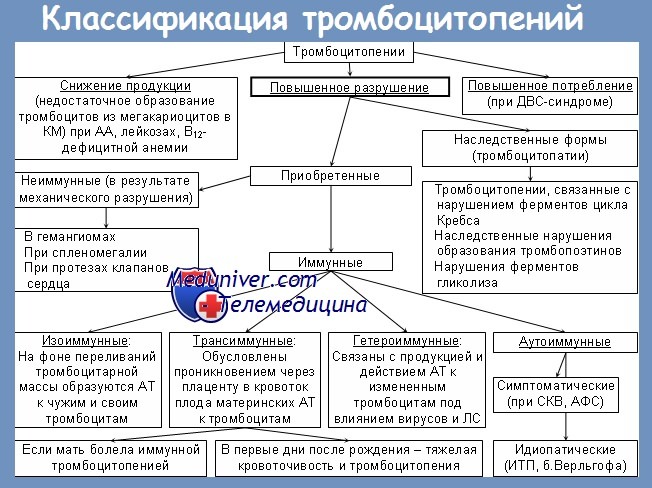
Тромбоцитопении— это группа заболеваний и синдромов, объединенных общим признаком: наличием геморрагического синдрома, развивающегося в результате снижения числа кровяных пластинок в периферической крови менее 150 ґ 109/л. Тромбоцитопения может выступать в качестве самостоятельного заболевания (первичная) либо симптома других болезней (вторичная).
Механизмы развития тромбоцитопений могут быть различными.
1. Недостаточное образование тромбоцитов может быть следствием угнетения пролиферации клеток костного мозга при наличии:
— наследственных заболеваний: конституционной панцитопении (апластическая анемия Фанкони) и амегакариоцитарной тромбоцитопении с другими врожденными пороками;
— приобретенной патологии: инфильтрации костного мозга (лейкоз, метастазы, миелофиброз, туберкулез), а также при апластической анемии, мегалобластной анемии.
2. Уменьшение количества тромбоцитов:
— приеме миелосупрессивных медикаментов (цитостатики);
— приеме таких препаратов: тиазидные диуретики, эстрогены, интерферон;
— пароксизмальной ночной гемоглобинурии;
3. Повышенное разрушение тромбоцитов:
— врожденные неиммунные причины: преэклампсия у матери, инфекции;
— врожденные иммунные причины: идиопатическая тромбоцитопеническая пурпура (у матери), медикаменты;
— приобретенные неиммунные причины: инфекции, синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), медикаменты, гемолитико-уремический синдром;
— приобретенные иммунные причины: ауто- и аллоантитела.
Аутоантитела: системная красная волчанка, неходжкинская лимфома, инфекции, медикаменты (хинин, гепарин), идиопатические.
Аллоантитела: посттрансфузионная пурпура, акушерские осложнения.
4. Депонирование тромбоцитов:
5. Повышенное потребление кровяных пластинок развивается в результате потери тромбоцитов:
Клиническая картина
Характерным проявлением снижения количества тромбоцитов является геморрагический диатез петехиально-пятнистого типа. Характерно появление на коже и слизистых оболочках мелких безболезненных, без признаков воспаления мелкоточечных геморрагических высыпаний— петехий и/илипятнистых (диаметром около 1–2 см), ненапряженных, не расслаивающих ткани геморрагий— синячков. Появление петехий и синячков легко провоцируется минимальным травмированием микрососудов— трением одежды, легкими ушибами, инъекциями. Кроме того, при этом типе кровоточивости могут возникать повторные носовые кровотечения (эпистаксис), кровотечения из желудочно-кишечного тракта, метроррагии, гематурия. Наиболее тяжелыми последствиями геморрагического диатеза петехиально-пятнистого типа являются кровоизлияния в сетчатку глаз с потерей зрения и кровоизлияния в головной мозг и его оболочки.
/ukr/9/3.jpg)
Степень выраженности проявлений геморрагического диатеза зависит от уровня тромбоцитов. Хотя нижней границей уровня тромбоцитов принято считать показатель 150 ґ 109/л, спонтанное кровотечение вследствие одной только тромбоцитопении обычно не возникает до тех пор, пока количество тромбоцитов не станет ниже 50 ґ 109/л, и реально появляется только при падении этого показателя ниже уровня20 ґ 109/л. Однако при наличии местной или генерализованной инфекции, лихорадочных состояний тяжелое кровотечение может возникнуть и при более высоком содержании тромбоцитов. Спонтанные кровотечения при тромбоцитопении обычно начинаются со слизистых оболочек, особенно полости рта и десен. Типична локализация геморрагических высыпаний на нижних конечностях и нижней половине туловища, главным образом по передней поверхности брюшной стенки. Особенно часто геморрагии впервые появляются в местах сжатия или трения кожи одеждой. Могут появляться серьезные спонтанные кровотечения в суставы, мышцы, подкожную клетчатку, ретроперитонеально. Появление кровоизлияний на верхней половине туловища и особенно на лице, слизистой ротовой полости, в конъюнктиве является прогностически неблагоприятным признаком, свидетельствующим о высокой вероятности кровоизлияния в головной мозг.
/ukr/9/1.jpg)
/ukr/9/2.jpg)
Диагностика
/ukr/9/4.jpg)
1. Было ли у вас когда-нибудь кровотечение:
— после экстракции зуба;
— спонтанное носовое кровотечение;
— какое проводилось лечение;
— у женщин— выраженость менструального кровотечения.
2. Имели ли вы похожие на кровотечение проблемы?
3. Возникал ли у вас геморрагический диатез на коже? Какое лечение вы получали?
4. Какие медикаменты принимали вообще?
5. Наличие других болезней:
— инфекции (ВИЧ, гепатит C).
При обследовании пациента необходимо обратить внимание на следующие критерии:
— стадии геморрагических диатезов— новые, несколько дней назад;
— локализация— кожа, слизистые оболочки.
Лабораторная диагностика. Нормальное содержание тромбоцитов 150—400 ґґ 109/л. PLT обнаруживается автоматизированными кровяными панелями.
Определение числа тромбоцитов вручную проводится в обязательном порядке при следующих состояниях: тяжелая тромбоцитопения, после химиотерапии или облучения, при идиопатической тромбоцитопении, ДВС-синдроме, тромбоцитарной тромбоцитопенической пурпуре.
Функциональные тромбоцитарные тесты
Время кровотечения. Принцип метода заключается в измерении длительности кровотечения из ранки на коже мочки уха, мякоти ногтевой фаланги пальца руки или верхней трети ладонной поверхности предплечья, наносимой автоматическим ланцетом, обычным плоским или скарификатором. Описаны варианты тестов, при проведении которых учитывается не только длительность кровотечения, но и объем теряемой крови. Ориентировочно он может быть оценен по количеству и величине пятен крови на фильтровальной бумаге, которой промокают выступающие капли крови.
— Метод Дюке— определяется длительность кровотечения из поверхностных микрососудов мочки уха после нарушения их целостности с помощью плоского ланцета или скарификатора. Нормальные величины: 2–5 мин (не более).
— Метод Айви: определяется длительность кровотечения из надрезов кожи ладонной поверхности предплечья после наложения манжетки. Рассчитывают среднее время кровотечения по трем ранкам.
Клиническое значение: время кровотечения удлиняется при выраженных тромбоцитопениях, болезни Виллебранда, тяжелых формах некоторых тромбоцитопатий. При нарушениях свертываемости крови (гемофилиях) оно обычно остается нормальным или удлиняется лишь слегка. Может быть удлинено при тяжелых формах тромбогеморрагического синдрома и значительной гепаринемии.
Функциональные тромбоцитарные тесты
1. Агрегация тромбоцитов.
2. Адгезия тромбоцитов.
3. Реакция тромбоцитов.
4. Антитела к тромбоцитам.
Скрининговые тесты и показатели для оценки гемостаза
1. Количество тромбоцитов.
2. Время кровотечения.
3. Активированное частично тромбопластиновое время (свертывания).
4. Протромбиновое время (свертывания).
5. Если причина тромбоцитопении неизвестна— анализ костного мозга (цитология, гистология).
Лечение тромбоцитопениив зависимостиот причины заболевания
Недостаточность витамина B12 и/или фолиевой кислоты— соответствующий курс терапии.
Медикаментозно индуцированная тромбоцитопения— прекратить прием препаратов, которые ее вызвали.
Переливания тромбоцитов в зависимости от риска геморрагических осложнений при тромбоцитопении: пациентам с гематологическими и онкологическими болезнями, если количество тромбоцитов 10–20 ґ 109/л; при наличии нескольких факторов риска— количество тромбоцитов должно быть >> 40 ґ 109/л.
/ukr/10/1.jpg)
Идиопатическая тромбоцитопеническая пурпура. Глюкокортикоиды назначаются в дозе 1,0 мг/кг массы тела в сутки (в пересчете на преднизолон) на протяжении 3–4 недель до купирования геморрагического синдрома. Признаками эффективности терапии являются отсутствие новых геморрагических высыпаний и/или прекращение кровотечения. Уровень тромбоцитов начинает повышаться на 5–6-й день после начала лечения. В дальнейшем доза постепенно снижается (по 5 мг в неделю). Однако они обладают рядом побочных эффектов.
/ukr/10/2.jpg)
При неполном или неудовлетворительном эффекте от терапии глюкокортикоидами в течение нескольких месяцев (обычно 3–4) возникают показания к использованию мероприятий второй линии терапии— выполнению лечебной спленэктомии. Это паллиативный метод, обеспечивающий продление жизни тромбоцитов за счет устранения органа, являющегося источником выработки антитромбоцитарных антител и местом их разрушения. Проведение спленэктомии у 75 % пациентов приводит к практическому выздоровлению. Показаниями к спленэктомии являются:
— неэффективность терапии на протяжении 3–6 месяцев: некупируемый геморрагический синдром или его возобновление на фоне снижения дозы глюкокортикоидов;
— количество тромбоцитов 10 ґ 109/л при отсутствии геморрагического синдрома;
— отсутствие тенденции при количестве кровяных пластинок менее 30 ґ 109/л к росту на протяжении 3 месяцев при активномлечении.
При неэффективности проводимой терапии применяют цитостатики (винкристин, циклофосфамид, азатиоприн и т.д.) на протяжении 2–3–5 месяцев в комбинации с глюкокортикоидами. Эффект наступает через 1,5–2 месяца, после чего кортикостероиды постепенно отменяют.
Современные методы лечения тромбоцитопении
Тромбопоэтин— эндогенный цитокин, вызывающий мегакариоцитарний рост и образование тромбоцитов. Специфически связывается TПO-рецептором и играет центральную роль в выживании и пролиферации гемопоэтических клеток-предшественников.
Nplate (ромиплостим) является протеином, стимулирующим тромбопоэз— пептид-Fc-синтетаза, который активизирует внутриклеточные транскрипционные пути прироста и созревания в костном мозге кости мегакариоцитов, приводящие к увеличению числа тромбоцитов через рецепторы TПO, механизм, аналогичный эндогенному TПO.
Nplate особо показан для лечения тромбоцитопении у больных хронической иммунной (идиопатической) тромбоцитопенической пурпурой, которые имеют недостаточный ответ на кортикостероиды, иммуноглобулины или спленэктомию.
Рекомендованная начальная доза препарата составляет 1 мкг/кг еженедельно в подкожных инъекциях, затем регулируют еженедельную дозу, пока количество тромбоцитов не достигнет ≥ 50 ґ 109/л, по мере необходимости для сокращения риска кровотечения.
При тромбоцитопении очень важным является выяснение причины или болезни, которая ее вызвала. В связи с большим количеством причин диагностика заболевания является сложной.
Лечение тромбоцитопении проводят в зависимости от причины ее возникновения.
Читайте также:

