Поражение надпочечников при вич
Обновлено: 19.04.2024
Цитомегаловирусная инфекция (ЦМВИ) занимает одно из первых мест в структуре вторичных заболевании у больных ВИЧ-инфекцией. Многие вопросы морфологии ЦМВИ, взаимосвязь морфологических изменений в органах и клинических проявлений заболевания остаются малоизученными. Несмотря на тяжесть и высокую частоту цитомегаловирусного поражения надпочечников у больных ВИЧ-инфекцией, клинико-морфологические характеристики данной патологии в отечественной литературе рассмотрены крайне скупо. Цель настоящей работы состояла в определении морфологических особенностей цитомегаловирусного поражения надпочечников у больных ВИЧ-инфекцией и сопоставлении полученных данных с клинической картиной заболевания. С 1966 по 2000 г. проведено патологоанатомическое исследование 95 умерших взрослых больных ВИЧинфекцией, из которых 85 имели стадию ВИЧ-инфекции П1В (СПИД). Цитомегаловирусная патология надпочечников выявлена у 42 пациентов. В статье дана морфологическая характеристика, указано на различную локализацию, характер и распространенность патологического процесса в надпочечниках. Полученные данные сопоставляются с клинической картиной заболевания. На основании проведенных клинико-морфологических исследований подчеркивается стадийность патологического процесса в надпочечниках с полным разрушением ткани органа при отсутствии адекватного лечения. Соотвественно указывается на необходимость при выявлении клинических и лабораторных признаков снижения гормональной функции коры надпочечников у больных манифестной ЦМВИ раннего проведения этиотропной и заместительной терапии, позволяющей остановить процесс на начальных стадиях своего развития.
Ключевые слова
Для цитирования:
For citation:
Отличительной чертой цитомегаловирусной инфекции (ЦМВИ) у ВИЧ-инфицированных больных является генерализованный характер патологического процесса, каждая из локализаций которого имеет свои особенности морфогенеза и клиники [1]. На сегодняшний день многие вопросы морфологии ЦМФИ, взаимосвязь морфологических изменений в органах и клинических проявлений заболевания остаются малоизученными. Несмотря на тяжесть и высокую частоту поражения надпочечников цитомегаловирусной природы у больных ВИЧ-инфекцией, характеристика данной патологии в отечественной литературе не представлена. Во многих зарубежных работах указывается на отсутствие четкой связи между патоморфологи- ческими изменениями в надпочечниках и клиническими признаками надпочечниковой недостаточности |2-5]. Авторы, указывая процент деструкции ткани органа, не упоминают о динамике и характере патологического процесса, лежащего в основе выявленного поражения.
Цель настоящей работы состояла в определении морфологических особенностей цитомегаловирусного поражения надпочечников у больных ВИЧ- инфекцией и сопоставлении полученных данных с клинической картиной заболевания.
Материалы и методы
С 1996 по 2000 г. нами проведено патологоанатомическое исследование 95 умерших взрослых больных ВИЧ-инфекцией, из которых 85 страдали различными вторичными заболеваниями и соответственно имели стадию ВИЧ-инфекции IIIB (СПИД), а у 10 больных - ВИЧ-инфекция была на стадии первичных проявлений (11Б, 11В), и они погибли от причин, не связанных с основным заболеванием. Больные наблюдались в МГЦ СПИДа (руководитель А. И. Мазус) на базе инфекционной клинической больницы № 2 Москвы.
Цитомегаловирусная патология надпочечников была выявлена у 42 пациентов, из них 40 (95,2%) мужчин и 2 (4,8%) женщины. Возраст больных составил от 10 до 75 лет (в среднем 36,3 ± 2,3 года).
Был проведен ретроспективный анализ амбулаторных карт и историй болезни больных данной группы.
Морфологическим подтверждением цитомегаловирусного поражения органов считали обнаружение в тканях цитомегалической трансформации клеток (световая микроскопия; окраска гематоксилином и эозином, по Романовскому-Гимзе). Природу морфологических изменений подтверждали выявлением ДНК цитомегаловируса в исследуемых тканях методом полимеразной цепной реакции (ПЦР). При жизни больного основанием для постановки диагноза манифестной ЦМВИ служило наличие высокого титра ДНК цитомегаловируса в клетках крови (1:1000 (4+) и выше в 10 5 лейкоцитов). Качественное и количественное определение ДНК ЦМВ в крови и тканях пораженных органов осуществляли с помощью метода ПЦР (руководитель группы ПЦР-диагностики СНИЛЭП СПИД ст. науч. сотр. Г. А. Шипулин).
Пациентов с манифестной ЦМВИ обследовали на наличие маркеров других оппортунистических заболеваний (пневмоцистоза, туберкулеза, герпесвирусных и грибковых инфекций, токсоплазмоза).
Исследование иммунного статуса, в частности определение абсолютного и процентного содержания С04+-лимфоцитов-хелперов, осуществляли с помощью моноклональных антител ("Becton Diskisan", США) методом непрямой проточной цитофлюорометрии (ст. науч. сотр. Л. В. Серебровская).
17 больных ЦМВИ получили этиотропное лечение цимевеном (ганцикловиром) по следующей схеме: терапевтический курс - 5 мг/кг 2 раза в сутки внутривенно в течение 21 дня с переходом на поддерживающий курс - 5 мг/кг 1 раз в сутки внутривенно или 3 г/сут перорально.
Результаты и их обсуждение
У 42 пациентов поражение надпочечников было обусловлено ЦМВИ в качестве моно- или мик- стинфекции. Среди других вторичных заболеваний надпочечников в 9 случаях был диагностирован милиарный туберкулез, в 3 - токсоплазмоз, по 1 случаю - атипичный туберкулез, саркома Капоши и криптококкоз. Среди умерших пациентов с диагнозом СПИДа цитомегаловирусный адреналит имел место у 49,4% больных. Напротив, ни у одного из пациентов, имевших ранние стадии ВИЧ-инфекции и погибших от "случайных причин", патологии надпочечников не обнаружено. Среди пациентов с манифестной ЦМВИ патология надпочечников выявлена в 62,9% случаев.
Исходя из различной локализации патологических изменений, обусловленных ЦМВИ, в надпочечниках, мы разделили полученный материал на 3 группы. В 1-ю группу были включены 7 пациентов, у которых имело место поражение мозгового слоя органа. Ко 2-й группе мы отнесли 23 случая, где патологический процесс затрагивал мозговой слой и глубокие отделы коры. В 3-ю группы включили 12 случаев с цитомегаловирусным поражением всех слоев коры и мозгового вещества надпочечников.
При гистологическом исследовании в мозговом слое надпочечников у больных 1-й группы определяли очаговую и диффузную лейколимфоцитарную инфильтрацию, сопровождающуюся мелкими или обширными некрозами (рис. 1). Ткань чаще выгля-
Рис. I. Очаговая воспалительная инфильтрация, некрозы и типичные ЦМК в мозговом слое надпочечника.
Здесь и на рис. 2-5 окраска гематоксилином и эозином.
дела бесструктурной, иногда в виде контуров клеток в состоянии растворения и мелкозернистого распада. Среди некрозов и воспалительных инфильтратов выявляли отдельные или множественные цитомегалические клетки (ЦМК) с крупными внутриядерными включениями, разнообразных форм и размеров. Вены мозгового слоя из-за некрозов стенок были нечеткими и не всегда определялись; просветы и стенки сохранных сосудов содержали множественные ЦМК (рис. 2). В отдельных случаях мозговое вещество было деформировано тяжистой соединительной тканью, среди которой были островки сохранных клеток паренхимы и единичные "ареактивные" ЦМК. Только в 1 наблюдении типичные ЦМК располагались в мозговом слое рассеянно, без какой-либо воспалительной клеточной инфильтрации.
Изменения у больных 2-й группы имели схожий характер, проявляясь лейколимфоцитарной инфильтрацией мозгового слоя с полосчатым или сплошным распространением на сетчатую или даже пучковую зоны коры (рис. 3). Большая часть вещества мозгового слоя и глубоких отделов коркового была подвергнута деструктивным изменениям в виде цитолиза и мелкозернистого распада клеток. Среди клеточного детрита и воспалительных инфильтратов закономерно выявляли полиморфные ЦМК. В отдельных случаях инфильтра-
Рис. 2. Цитомегаловирусный венулит центральной вены, распространенные некрозы и цитомегаловирусная трансформация мозгового вещества надпочечника.
ция с некрозами, отеком и ЦМК-метаморфозом носила очаговый характер в виде разбросанных очажков в мозговом слое и сетчатой зоне коры. В большинстве сохранных клеток отчетливо определяли различной степени выраженности дистрофические изменения, мелкие очаги цитолиза и крупные участки с дискомплексацией клеток в разных отделах коры и мозгового вещества. Было отмечено резкое расширение просветов вен мозгового слоя с деструктивными изменениями стенок, пристеночными тромбами и ЦМК в эндотелии и просветах сосудов. Нередко значительная часть мозгового слоя и сетчатой зоны коры выглядела бесструктурной, пропитанной фибрином и лейколимфоцитарными инфильтратами. При окраске по Ван-Гизону выявляли соединительную ткань в виде прослоек, дающую выросты в нижние отделы коркового вещества. Среди разрастаний соединительной ткани встречались ЦМК и островки сохранившихся клеток с резко выраженными дистрофическими изменениями.
Материал 3-й группы представлен случаями поражения надпочечников с обширной лейколимфоцитарной инфильтрацией мозгового слоя, распространяющейся в виде полос на сетчатую, пучковую и клубочковую зоны коры, с захватом местами и капсулы. В зонах инфильтрации присутствовали некротизированная ткань в состоянии зернистого распада и отека, а также полиморфные ЦМК (рис. 4). Во всех случаях площадь поражения мозгового вещества преобладала. Из зон коркового вещества наиболее выраженные изменения отмечали в сетчатой и пучковой зонах. В них характер воспалительной инфильтрации с преобладанием полиморфно-ядерных лейкоцитов отличался от воспалительной реакции в мозговом веществе, представленной очаговыми лимфоплазмоцитарными инфильтратами и ЦМК. Было зафиксировано 7 случаев массивной лейкоцитарной инфильтрации всех отделов мозгового и коркового вещества надпочечников с некрозами большей части коры при сохранении лишь мелких островков дистрофически измененных клеток в пучковой зоне (рис. 5). Здесь же имело место обилие ЦМК как среди некрозов паренхимы, так и в некротизированных стенках крупных вен, капсуле и сосудах клетчатки. Два случая характеризовались фиброзом мозгового слоя, распространяющимся в виде выростов на всю кору. Среди фиброзной ткани определяли ЦМК, рассеянную или густую лимфоплазмоцитарную инфильтрацию, скопления фибробластов и гистиоцитов. Очажки лейкоцитарной инфильтрации с некрозами и ЦМК встречали лишь в сохранившихся группах клеток коры. Капсула надпочечников была утолщена, склерозирована и непосредственно переходила в
Рис. 3. Воспалительная инфильтрация, некрозы и цитомегаловирусная трансформация в мозговом слое и глубоких отделах коркового вещества надпочечника.
Рис. 4. Распространенная лимфолейкоцитарная инфильтрация и цитомегаловирусная трансформация коры надпочечника.
фиброзно-измененную клетчатку, где обнаруживали воспалительные инфильтраты и ЦМК в просветах и стенках сосудов.
Ретроспективный анализ клинических проявлений заболевания у ВИЧ-инфицированных больных с патологией надпочечников показал следующее. Все пациенты имели заключительную стадию ВИЧ-инфекции - 111В (СПИД), глубокую иммуносупрессию со снижением в 92,9% случаев абсолютного количества СО4+-лимфоцитов - менее 50 кл/мм 3 , в среднем 24,0 ± 0,2 кл/мм 3 (норма 600-1900 кл/мм 3 ) и относительного содержания - менее 5% (норма 35-65%). У 88,1% пациентов ЦМВИ носила генерализованный характер с поражением нескольких органов и систем. Помимо патологии надпочечников, имели место некротический ретинит (11 случаев), эрозивно-язвенные колит или энтероколит (И), эзофагит (9), гастрит (3), панкреатит (5), гепатит (3), интерстициальная пневмония (6), миокардит (6), некротический энцефаловентрикулит (8), полирадикулопатия (5), а также менингит, миелит, нефрит. У 5 больных, причиной смерти которых были иные оппортунистические заболевания, ЦМВИ проявилась только поражением надпочечников, и диагноз данной патологии был поставлен посмертно. Отметим, что эти пациенты при жизни имели более низкий титр ДНК ЦМВ в крови (1:10 (2+)- 1:100 (3+)).
У пациентов всех 3 групп независимо от преимущественной локализации патологического процесса в надпочечниках еще до развития клинически выраженных органных поражений (ретинита, колита, пневмонии и др.) имел место длительный (в среднем 3,2 ± 0,2 мес) продромальный период, характерными проявлениями которого были "немотивированное" повышение температуры тела, значительное снижение массы тела, существенное уменьшение аппетита, выраженная слабость, постоянная усталость. Лихорадочная реакция была ремиттирующего типа с повышением температуры тела не ниже 38°С (у 1/3 больных температура тела достигала 39°С). Потеря массы тела составляла не менее 10- 15% от первоначальной массы пациентов. В ряде случаев масса тела снижалась на 15-20 кг.
На момент разгара заболевания цитомегаловирусной этиологии независимо от преимущественной клинической формы инфекции у пациентов отмечали следующие симптомы. Имела место ремиттирующего или неправильного типа лихорадка с повышением температуры тела в 90,5% случаев до 39- 40°С. Снижение массы в 92,9% случаев достигало 20% и более массы тела, развивалась кахексия. Все больные обращали внимание на крайне выраженную общую слабость и мышечную слабость в нижних конечностях. В ряде случаев больные с трудом могли себя обслуживать. Снижение аппетита достигало степени анорексии. Четверть пациентов предъявляли жалобы на тошноту, у части из них была рвота, более половины больных имели расстройство стула. Пациенты отмечали нарушение сна, снижение настроения, ухудшение памяти, появление раздражительности, вялости, адинамии. У части больных зафиксирована ортостатическая гипотензия при нормальных цифрах артериального давления в покое. В последние дни жизни больных давление снижалось и в 71,5% случаев находилось в пределах 90-80/50-40 мм рт. ст., а в последние часы жизни оно падало до 60-50/40-30 мм рт. ст. с увеличением ЧСС до 110-130 в минуту. Гиперпигментация кожи, носившая генерализованный характер, была выявлена лишь в 2 случаях.
При проведении этиотропной терапии, в частности больным с цитомегаловирусным ретинитом, по окончании лечебного курса была зафиксирована не только положительная динамика со стороны сетчатки глаза по данным офтальмоскопии, но и нормализация температуры тела, повышение массы тела, значительное уменьшение слабости, появление аппетита, восстановление работоспособности пациента.
Поражение надпочечников следует отнести к числу частых патологий у больных СПИДом. Во всех наблюдениях патологический процесс имел двусторонний характер, причем в 7 (16,7%) случаях было отмечено обширное поражение надпочечников с почти полным разрушением паренхимы.
Несмотря на тяжесть и высокую частоту поражения надпочечников цитомегаловирусной природы у больных ВИЧ-инфекцией, в исследуемой группе клинический диагноз надпочечниковой недостаточности не был поставлен ни в одном случае. В то же время ретроспективная оценка картины за-
Рис. 5. Диффузная воспалительная инфильтрация, некрозы и цитомегаловирусная трансформация всех слоев надпочечника. Ув. 160.
болевания у наблюдавшихся нами пациентов позволяла выделить симптомокомплекс, указывающий на возможную патологию надпочечников: прогрессирующая общая и мышечная слабость, значительное похудание, анорексия, гипотония в сочетании с нарушением работы кишечника и рядом психических отклонений. Основная причина, по которой столь классический комплекс клинических проявлений хронической надпочечниковой недостаточности не связывался с возможным поражением железы, состояла в наличии у больных интоксикационного синдрома, тяжелой клинически явной патологии других внутренних органов и в непроведении соответствующих диагностических тестов.
Согласно представленному материалу посмертных исследований, первичные изменения в надпочечниках всегда развиваются в мозговом слое и глубоких отделах коры, распространяясь от центра к периферии органа. Это доказывают наблюдения почти полного разрушения мозгового вещества надпочечника при относительной сохранности коры. Обращало на себя внимание постоянное специфическое поражение сосудов надпочечников, причем нередко патология затрагивала сосуды всех калибров, включая сосуды капсулы и окружающей надпочечник клетчатки. По нашему мнению, патологический процесс, связанный с ЦМВИ, начинался в мозговом слое и сетчатом слое коры органа распространенными некрозами стенок вен с тромбозом и цитомегаловирусной трансформацией эндотелия. В результате имело место очаговое или почти полное разрушение ткани, причем вены из- за массивных некрозов и воспалительной инфильтрации не контурировались, за исключением крупных и центральной, где изменения чаще всего проявлялись очаговыми некрозами стенок с наличием ЦМК в стенках или эндотелии. Наиболее характерным на ранних стадиях ЦМВИ является острое экссудативно-деструктивное воспаление, развивающееся под действием полиморфно-ядерных лейкоцитов. По мере разрушения паренхимы надпочечников и перехода процесса к фиброзным преобразованиям клеточный состав инфильтратов редеет и принимает характер мононуклеарного. Вероятно, клеточная реакция не полностью идентична на различных стадиях основного заболевания, что может зависеть от реактивности клеток, определяющих инициацию, а также дальнейшее развитие воспалительного процесса. Наиболее сохранной является клубочковая зона, однако в 4 наблюдениях было отмечено значительное повреждение и этой части коры как следствие прогрессирования специфического процесса у больных, не получивших этиотропного лечения.
До настоящего времени остается неясным, в какой период заболевания цитомегаловирусной этиологии развивается поражение надпочечников. Является ли адреналит одним из заключительных этапов болезни или данная патология имеет место еще в ранние сроки ЦМВИ, в период "предвестников" при развитии "немотивированной" выраженной слабости, повышенной утомляемости, резкого похудания.
Заключение
Две трети пациентов с манифестной ЦМВИ страдали патологией надпочечников, а у 1 больного развитие надпочечниковой недостаточности явилось непосредственной причиной его гибели. Поэтому при наличии у больного высокой концентрации цитомегаловируса в крови, а также соответствующих вышеперечисленных жалоб необходимо обращать внимание на повышение уровня калия, снижение уровня натрия и хлоридов в крови, а также проводить гормональное исследование для прямого подтверждения снижения функциональной активности надпочечников.
Данные гистологических исследований в указанных 3 группах больных демонстрируют последовательные стадии патологического процесса в надпочечниках с полным разрушением ткани органа при отсутствии адекватного лечения. Поэтому выявление клинических и лабораторных признаков снижения гормональной функции коры надпочечников у больных манифестной ЦМВИ требует как можно более раннего проведения этиотропной и заместительной терапии, которая позволит остановить процесс на начальных стадиях своего развития.
Российский научно-методический центр по профилактике и борьбе со СПИДом (руководитель Академик РАМН, профессор В. В. Покровский), Москва
Инфекционная клиническая больница №2, г. Москва (главный врач Мясников В. А.)
Отличительной чертой цитомегаловирусной инфекции (ЦМВИ) у больных является генерализованный характер патологического процесса, каждая из локализаций которого имеет свои особенности морфогенеза и клиники [1]. На сегодняшний день многие вопросы морфологии ЦМВИ, взаимосвязь морфологических изменений в органах и клинических проявлений заболевания остаются малоизученными. Несмотря на тяжесть и высокую частоту поражения надпочечников у больных характеристика данной патологии в отечественной литературе не представлена. Во многих зарубежных работах указывается на отсутствие четкой связи между патоморфологическими изменениями в надпочечниках и клиническими признаками надпочечниковой недостаточности [2, 3, 4, 5]. При этом авторы, указывая процент деструкции ткани органа, совершенно не говорят о динамике и характере патологического процесса, лежащего в основе выявленного поражения.
Цель настоящей работы
состояла в определении морфологических особенностей цитомегаловирусного поражения надпочечников у больных и сопоставлении полученных данных с клинической картиной заболевания.
Материалы и методы
С 1996 по 2001 гг. нами проведено патологоанатомическое исследование 95 умерших взрослых больных из которых 85 страдали различными вторичными заболеваниями и, соответственно, имели стадию IIIВ (СПИД), а у 10 была на стадии первичных проявлений (IIБ, IIВ), и они погибли от причин, не связанных с основным заболеванием. Больные наблюдались в МГЦ СПИД на базе ИКБ №2 г. Москвы (руководитель центра Мазус А. И.).
Цитомегаловирусная патология надпочечников была выявлена у 42 пациентов. Среди них мужчин 40 (95.2%) и женщин 2 (4,8%). Больные находились в возрасте от 10 до 75 лет (средний возраст 36.3 ± 2.3 лет).
Был проведен ретроспективный анализ амбулаторных карт и историй болезни больных данной группы.
Морфологическим подтверждением цитомегаловирусного поражения органов считали обнаружение в тканях цитомегалической трасформации клеток (световая микроскопия; окраска гематоксилином и эозином, по Романовскому Гимзе). Природу морфологических изменений подтверждали выявлением ДНК ЦМВ в исследуемых тканях методом ПЦР. При жизни больного основанием для постановки диагноза манифестной ЦМВИ служило наличие высокого титра ДНК ЦМВ в клетках крови (1:1000 (4+) и выше в 105 лейкоцитах). Качественное и количественное определение ДНК ЦМВ в крови и тканях пораженных органов осуществляли с помощью метода полимеразной цепной реакции (руководитель группы СНИЛЭП СПИД с. н. с. Шипулин Г. А.).
Пациентов с манифестной ЦМВИ обследовали на наличие маркеров других оппортунистических заболеваний (пневмоцистоза, туберкулеза, герпесвирусных и грибковых инфекций, токсоплазмоза).
17 больных ЦМВИ получили этиотропное лечение цимевеном (ганцикловиром) по схеме: терапевтический курс 5 мг/кг х 2 р/сут в/в в течение 21 дня с переходом на поддерживающий курс 5 мг/кг х 1 р/сут в/в или 3г/сут реr оs.
Результаты
Исходя из различной локализации патологических изменений, обусловленных ЦМВИ, в надпочечниках, мы разделили полученный материал на три группы. В первую группу были включены 7 пациентов, у которых имело место поражение мозгового слоя органа. Ко второй группе мы отнесли 23 случая, где патологический процесс затрагивал мозговой слой и глубокие отделы коры. Третью группу составили 12 случаев с цитомегаловирусным поражением всех слоев коры и мозгового вещества надпочечников.
Изменения у второй группы больных имели схожий характер, проявляясь лейколимфоцитарной инфильтрацией мозгового слоя с полосчатым или сплошным распространением на сетчатую или даже пучковую зоны коры (рис. 3). Большая часть вещества мозгового слоя и глубоких отделов коркового было подвергнуто деструктивным изменениям в виде цитолиза и мелкозернистого распада клеток. Среди клеточного детрита и воспалительных инфильтратов закономерно выявляли полиморфные ЦМК. В отдельных случаях инфильтрация с некрозами, отеком и носила очаговый характер в виде разбросанных очажков в мозговом слое и сетчатой зоне коры. В большинстве сохранных клеток отчетливо определяли различной степени выраженности дистрофические изменения, мелкие очаги цитолиза и крупные участки с дискомплексацией клеток в разных отделах коры и мозгового вещества. Нами было отмечено резкое расширение просветов вен мозгового слоя с деструктивными изменениями стенок, пристеночными тромбами и ЦМК в эндотелии и просветах сосудов. Нередко, значительная часть мозгового слоя и сетчатой зоны коры выглядела бесструктурной, пропитанной фибрином и лейколимфоцитарными инфильтратами. При окраске по выявляли соединительную ткань в виде прослоек, дающую выросты в нижние отделы коркового вещества. Среди разрастаний соединительной ткани встречались ЦМК и островки сохранившихся клеток с резко выраженными дистрофическими изменениями.
Третья группа была представлена случаями поражения надпочечников с обширной лейколимфоцитарной инфильтрацией мозгового слоя, распространяющейся в виде полос на сетчатую, пучковую и клубочковую зоны коры, с захватом местами и капсулы. В зонах инфильтрации присутствовали некротизированная ткань в состоянии зернистого распада и отека, а также полиморфные ЦМК (рис. 4). Во всех случаях площадь поражения мозгового вещества преобладала. Из зон коркового вещества наиболее выраженные изменения отмечали в сетчатой и пучковой зонах. В них характер воспалительной инфильтрации с преобладанием полиморфноядерных лейкоцитов отличался от воспалительной реакции в мозговым веществе, представленной очаговыми лимфоплазмоцитарными инфильтратами и ЦМК. Были зафиксированы случаи массивной лейкоцитарной инфильтрации всех отделов мозгового и коркового вещества надпочечников с некрозами большей части коры, при сохранении лишь мелких островков дистрофически измененных клеток в пучковой зоне (рис. 5). Здесь же имело место обилие ЦМК как среди некрозов паренхимы, так и в некротизированных стенках крупных вен, капсуле и сосудах клетчатки. Два случая характеризовались фиброзом мозгового слоя, распространяющимся в виде выростов на всю кору. Среди фиброзной ткани определяли ЦМК, рассеянную или густую лимфоплазмоцитарную инфильтрацию, скопления фибробластов и гистиоцитов. Очажки лейкоцитарной инфильтрации с некрозами и ЦМК встречали лишь в сохранившихся группах клеток коры. Капсула надпочечников была утолщена, склерозированна и непосредственно переходила клетчатку, где обнаруживали воспалительные инфильтраты и цитомегалоклетки в просветах и стенках сосудов.
Ретроспективный анализ клинических проявлений заболевания у больных, с патологией надпочечников, показал следующее. Все пациенты имели заключительную стадию IIIВ (СПИД), глубокую иммуносупрессию со снижением в 92.9% случаев абсолютного количества менее 50 кл/мм 3 (в среднем, 24.0 ± 0.2 кл/мм 3 ) (норма и относительного содержания менее 5% (норма У 88.1% пациентов носила генерализованный характер с поражением нескольких органов и систем. Помимо патологии надпочечников имели место некротический ретинит в 11 случаях, колит или энтероколит (11), эзофагит (9), гастрит (3), панкреатит (5), гепатит (3), интерстициальная пневмония (6), миокардит (6), некротический энцефаловентрикулит (8), полирадикулопатия (5), а также менингит, миелит, нефрит. У пяти больных, причиной смерти которых были иные оппортунистические заболевания, проявилась только поражением надпочечников, и диагноз данной патологии был поставлен посмертно. Отметим, что эти пациенты при жизни имели более низкий титр ДНК ЦМВ в крови (1:10 (2+) 1:100 (3+)).
На момент разгара заболевания цитомегаловирусной этиологии, независимо от преимущественной клинической формы инфекции у пациентов отмечали следующие симптомы. Имела место ремитирующего или неправильного типа лихорадка с повышением температуры тела в 90.5% случаев Снижение веса достигало в 92.9% случаев двадцати и более процентов массы тела, развивалась кахексия. Все больные обращали внимание на крайне выраженную общую слабость и мышечную слабость в нижних конечностях. В ряде случаев больные с трудом могли себя обслуживать. Снижение аппетита достигало степени анорексии. Четверть пациентов предъявляла жалобы на тошноту, у части из них была рвота, более половины больных имело расстройство стула. Пациенты отмечали нарушение сна, снижение настроения, ухудшение памяти, появление раздражительности, вялости, адинамии. У части больных зафиксирована ортостатическая гипотензия при нормальных цифрах артериального давления в покое. В последние дни жизни больных давление снижалось и в 71.5% случаев находилось в пределах а в последние часы жизни оно падало с увеличением ЧСС в 1 мин. Гиперпигментация кожи, носившая генерализованный характер, была выявлена лишь в двух случаях.
При проведении этиотропной терапии, в частности, больным с по окончанию лечебного курса была зафиксирована положительная динамика не только со стороны сетчатки глаза по данным офтальмоскопии, но и нормализация температуры тела, повышение веса, значительное уменьшение слабости, появление аппетита, восстановление работоспособности пациента.
Поражение надпочечников следует отнести к числу частых патологией у больных СПИДом. Во всех наблюдениях патологический процесс имел двусторонний характер, причем в 7 случаях (16.7%) было отмечено обширное поражение надпочечников с почти полным разрушением паренхимы.
Несмотря на тяжесть и высокую частоту поражения надпочечников цитомегаловирусной природы у больных в исследуемой группе клинический диагноз надпочечниковой недостаточности не был поставлен ни в одном случае. В тоже время ретроспективная оценка картины заболевания у наблюдавшихся нами пациентов позволяла выделить симпатокомплекс, указывающий на возможную патологию надпочечников: прогрессирующая общая и мышечная слабость, значительное похудание, анорексия, гипотония в сочетании с нарушением работы кишечника и рядом психических отклонений. Основная причина, по которой столь классический комплекс клинических проявлений хронической надпочечниковой недостаточности не связывался с возможным поражением железы, состояла в наличии у больных интоксикационного синдрома, тяжелой клинически явной патологии других внутренних органов и в не проведении соответствующих диагностических тестов.
Согласно представленному материалу посмертных исследований, первичные изменения в надпочечниках всегда развиваются в мозговом слое и глубоких отделах коры, распространяясь от центра к периферии органа. Это доказывают наблюдения почти полного разрушения мозгового вещества надпочечника, при относительной сохранности коры. Обращало на себя внимание постоянное специфическое поражение сосудов надпочечников, причем нередко патология затрагивала сосуды всех калибров, включая сосуды капсулы и окружающей надпочечник клетчатки. По нашему мнению, патологический процесс, связанный с ЦМВИ, начинался в мозговом слое и сетчатом слое коры органа распространенными некрозами стенок вен с тромбозом и цитомегаловирусной трансформацией эндотелия. В результате имело место очаговое или почти полное разрушение ткани, причем вены массивных некрозов и воспалительной инфильтрации не контурировались, за исключением крупных и центральной, где изменения чаще всего проявлялись очаговыми некрозами стенок с наличием ЦМК в стенках или эндотелии. Наиболее характерным на ранних стадиях ЦМВИ является острое воспаление, развивающееся под действием лейкоцитов. По мере разрушения паренхимы надпочечников и перехода процесса к фиброзным преобразованиям, клеточный состав инфильтратов редеет и принимает характер мононуклеарного. Вероятно, клеточная реакция не полностью идентична на различных стадиях основного заболевания, что может зависеть от реактивности клеток, определяющих инициацию, а также дальнейшее развитие воспалительного процесса. Наиболее сохранной является клубочковая зона, однако, в 4 наблюдениях было отмечено значительное повреждение и этой части коры, как следствие прогрессирования специфического процесса у больных, не получивших этитропного лечения.
Заключение
Две трети пациентов с манифестной страдали патологией надпочечников, а у одного больного развитие надпочечниковой недостаточности явилось непосредственной причиной его гибели. Поэтому при наличии у больного высокой концетрации цитомегаловируса в крови, а также соответствующих, выше перечисленных жалоб необходимо обращать внимание на повышение уровня калия, снижение уровня натрия и хлоридов в крови, а также проводить гормональное исследование для прямого подтверждения снижения функциональной активности надпочечников.
Данные гистологических исследований в указанных трех группах больных демонстрируют последовательные стадии патологического процесса в надпочечниках с полным разрушением ткани органа при отсутствии адекватного лечения. Поэтому выявление клинических и лабораторных признаков снижения гормональной функции коры надпочечников у больных манифестной требует как можно более раннего проведения этиотропной и заместительной терапии, которая позволит остановить процесс на начальных стадиях своего развития.
Согласно данным клинических и морфологических исследований нельзя исключить, что именно надпочечники поражаются ЦМВ одними из первых, а в дальнейшем при генерализованной ЦМВИ именно тяжелый патологический процесс в надпочечниках является непосредственной причиной гибели больных.
Литература
1. Шахгильдян В. И. Клинико-лабораторная характеристика, диагностика и лечение цитомегаловирусной инфекции у больных Дис. канд. мед. наук. М., 1999.
2. Donovan D. S., Dluhy R. G. AIDS and its effect on the adrenal gland // Endocrinologist. 1993. V. 1.
3. Dore G. J., Marriott D. J., Duflou J. A. study of cytomegalovirus in AIDS autopsies: of and Aust. N Z J Med. 1995. V. 25, 5.
4. Pulakhandam U., Dinccsoy H. P. Cytomegalovirus adrenalitis and adrenal insufficiency in AIDS // Am. J. Clin. Pathol 1999. V. 93.
5. The medical management of AIDS (5th ed)/ed. by Sande M. A. and Volberding P. A., 1997. 515 p.
Резюме
О. А. Тишкевич, В. И. Шахгильдян, Ю. Г. Пархоменко особенности цитомегаловирусного поражения надпочечников у больных
Цитомегаловирусная инфекция занимает одно из первых мест в структуре вторичных заболеваний у больных Многие вопросы морфологии ЦМВИ, взаимосвязь морфологических изменений в органах и клинических проявлений заболевания остаются малоизученными. Несмотря на тяжесть и высокую частоту надпочечников у больных характеристики данной патологии в отечественной литературе рассмотрены крайне скупо. Цель настоящей работы состояла в определении морфологических особенностей цитомегаловирусного поражения надпочечников у больных и сопоставлении полученных данных с клинической картиной заболевания. С 1996 по 2001 гг. проведено патологоанатомическое исследование 95 умерших взрослых больных из которых 85 имели стадию IIIВ (СПИД). Цитомегаловирусная патология надпочечников выявлена у 42 пациентов. В статье дается морфологическая характеристика, указывается на различную локализацию, характер и распространенность патологического процесса в надпочечниках. Полученные данные сопоставляются с клинической картиной заболевания. На основании проведенных клинико-морфологических исследований подчеркивается стадийность патологического процесса в надпочечниках с полным разрушением ткани органа при отсутствии адекватного лечения. Соответственно, указывается на необходимость при выявлении клинических и лабораторных признаков снижения гормональной функции коры надпочечников у больных манифестной раннего проведения этиотропной и заместительной терапии, позволяющей остановить процесс на начальных стадиях своего развития.
Инфекционные болезни:
Популярные разделы сайта:
Влияние ВИЧ на легкие, суставы, надпочечники
ВИЧ обнаруживается в легких ВИЧ-инфицированных людей, страдающих пневмонией и в суставной жидкости пациентов, страдающих артритом. В легких необходимо рассматривать изменение проницаемости или другие токсичные эффекты вирусных белков, в особенности при пневмониях у детей.
Нужно учитывать роль цитотоксических Т-лимфоцитов, обладающих активностью в отношении ВИЧ. Вирус болезни висна-мэди вызывает пневмонию у овец. Кроме того, фибробласты, находящиеся в легких, могут подвергаться ВИЧ-инфицированию, и изоляты ВИЧ, выделенные из легких и крови одного и того же пациента, могут различаться.
Эти данные указывают на возможное патогенное действие в тканях легких определенных изолятов ВИЧ. Недавно был составлен обзор клинических симптомов, связанных с легочными нарушениями.
Присутствие антигенов ВИЧ в суставной жидкости и синовиальных оболочках также говорит о необходимости дальнейшего изучения возможного влияния ВИЧ на развитие сопутствующих артропатий.
Аналогичный козий лентивирус, вирус артрита-энцефалита коз, вызывает у коз заболевание, похожее на ревматоидный артрит у людей.
Также ВИЧ был выделен из надпочечников инфицированных людей (С. Walker и J. A. Levy, неопубликованные данные), и фетальные клетки надпочечников в культуре проявляли чувствительность к ВИЧ-инфекции. Цитокины, экспрессируемые инфицированными гематопоэтическими клетками, действуя на надпочечники, могут приводить к снижению их функций.
Однако большинство данных свидетельствует о том, что in vivo разрушение этой ткани связано с действием ЦМВ, а не ВИЧ. Тем не менее роль ВИЧ в развитии других эндокринных заболеваний и механизмы их патогенеза заслуживают дальнейшего изучения.
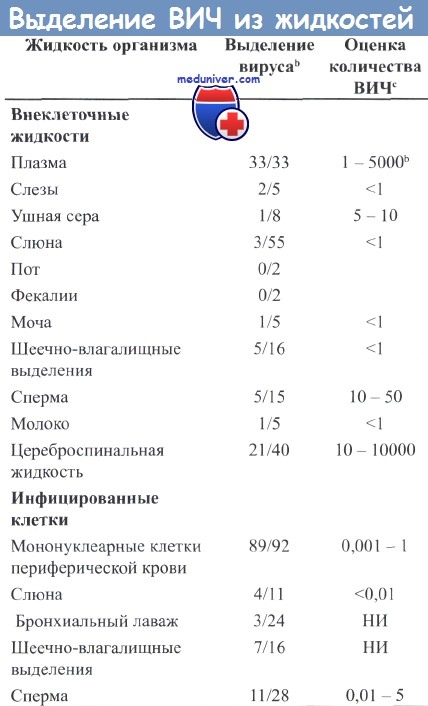
Для внеклеточных жидкостей значения соответствуют количеству инфекционных частиц на миллилитр; для инфицированных клеток значения представлены в виде процента от общего числа клеток. НИ - не известно.
b Количество случаев обнаружения инфекционных вирусов или инфицированных клеток на общее количество исследованных образцов.
с Высокое содержание соответствует симптомам развитого заболевания.
Инфекционные болезни:
Популярные разделы сайта:
Влияние ВИЧ на почки
Поражение почек ВИЧ, известное как ВИЧ-зависимая нефропатия (HIVAN), в настоящее время является третьей по распространенности причиной развития терминальной стадии заболевания почек у афроамериканцев в возрасте от 20 до 64 лет. Более 90% пораженных пациентов имеют африканское происхождение, что указывает на роль генетических факторов.
Классическая картина HIVAN характеризуется массивной протеинурией и быстро прогрессирующей терминальной стадией поражения почек у инфицированных пациентов. В почках наблюдаются процессы гломерулосклероза и поражения интерстициальной ткани канальцев с повреждением эпителиальных клеток и дилатацией канальцев с образованием микроцист.
Наблюдается гиперплазия эпителия канальцев или клубочков, а также образование внеклеточного матрикса в мезангии и интерстиции канальцев.
Несмотря на то, что нефропатия обычно развивается на поздних стадиях ВИЧ-инфекции, у некоторых пациентов это клиническое состояние может появляться вскоре после острой инфекции. Рассматриваются различные потенциальные вирусологические и иммунологические механизмы развития ВИЧ-зависимых нефрологических нарушений. Их можно наблюдать как при ВИЧ-1-, так и при ВИЧ-2-инфекции.
Этиология поражение почек ВИЧ. Считается, что предполагаемая причина развития HIVAN, как и в случае заболеваний ЦНС и кишечника, связана с действием либо самой ВИЧ-инфекции, либо токсических клеточных факторов. Вирус был обнаружен в клетках почек ВИЧ-инфицированных пациентов. С помощью лазерной микродиссекции показано присутствие ВИЧ в отдельных эпителиальных клетках почек, где он напоминал вирус, циркулирующий в крови, но, по-видимому, все же находился в составе отдельного резервуара.
Даже у пациентов, получающих противовирусное лечение, ВИЧ обнаруживается в эпителиальных клетках почек. Кроме того, было показано, что чувствительность эпителиальных клеток почек к инфицированию не зависит от CD4. Это может быть связано с действием специфического подтипа вируса. Происходит нарушение роста и жизнеспособности инфицированных клеток.
Другие исследователи показали, что ВИЧ-инфицирование эпителиальных клеток проксимальных канальцев приводит к развитию их апоптоза за счет активации каспаз и усиления экспрессии Fas. Мезангиальные и канальцевые клетки человека восприимчивы к вирусной инфекции и, по-видимому, экспрессируют CD4 и хемокиновые рецепторы. В этих работах было показано, что инфицирование Х4-вирусом вызывает гибель клеток канальцев. Этот процесс связан с действием вирусных белков gp120, gp41 или Tat.
Механизм проникновения вирусов в клетки почки до сих пор неизвестен. Обычно в почечном эпителии не наблюдается экспрессии рецепторов к хемокинам, за исключением случаев выращивания клеток в культуре in vitro.
Также было продемонстрировано инфицирование первичных и перевивных культур эндотелиальных и мезангиальных клеток клубочков и эпителиальных клеток клубочков вирусом Х4. При этом происходит выработка цитокинов, способствующих развитию гломерулосклероза (в частности, тромбоцитарного фактора роста, TGF-b, IL-6, TNF и IL-8).
В поддержку вирусной этиологии также говорит развитие нефропатии у мышей, экспрессирующих трансген ВИЧ в эпителиальных клетках почек. Кроме того, изучение приматов показало развитие гломерулосклероза и других почечных патологий у макак резус, при этом в клубочках обнаруживался вирус биотипа R5. Хотя основным заболеваниям почек при ВИЧ-инфекции является ВИЧЗН, также было описано развитие иммунокомплексного гломерулонефрита. Однако, в отличие от HIVAN, тяжесть иммунокомплексного поражения почек, по-видимому, не зависит от концентрации вируса или количества CD4+-Т-клеток и это заболевание редко встречается у пациентов африканского происхождения.

Исследование с помощью гибридизации in situ образца биопсии почек, полученного от ВИЧ-инфицированного пациента,
демонстрирующее экспрессию вирусной мРНК (стрелки) в эпителиальных клетках канальцев. Увеличение, х200.
Читайте также:

