Посев спермы при вич
Обновлено: 17.04.2024
В статье подробно рассказывается о процедуре очистки спермы, благодаря которой у ВИЧ-позитивных и дискордантных пар появляется возможность иметь здоровых детей.
Как и где вырабатываются сперматозоиды?
Сперматозоиды находятся в сперме.
В производстве спермы участвуют четыре органа, а именно яички, придатки яичек, семенные пузырьки и простата.
В сперме есть семенная жидкость, в которой находятся сперматозоиды и лейкоциты, которые могут содержать в себе ВИЧ.
Очистка спермы – это процедура отделения спермы от семенной жидкости. Данная процедура долгие годы использовалась в больницах по лечению бесплодия и банках спермы, чтобы помочь мужчинам увеличить продуктивность их спермы. Однако, методика промывки спермы с целью снижения или исключения возможности передачи инфекций, таких как ВИЧ, матери или ребенку начала развиваться только в последнее десятилетие.
Затем данный материал помещается в медицинскую центрифугу для отделения спермы от других входящих в нее компонентов: так как сперма, семенная жидкость и другие клетки обладают разной плотностью, они разделяются на три отдельных слоя.
Затем при помощи солевого раствора самые активные сперматозоиды выводятся на поверхность, где их и собирают.
Эту сперму дважды промывают в химическом растворе, чтобы удалить больше жидкости и уничтожить ВИЧ или любой другой вирус, который мог остаться на оболочке сперматозоидов.
Данный материал разделяют на две порции. Одна половина замораживается, другая – отправляется на анализ.
Все три составляющие материала (сперма, семенная жидкость и другие клетки) тестируются на наличие возбудителей инфекционных заболеваний, включая ВИЧ.
Если какая-нибудь из четырех составляющих содержит определяемое количество вируса, весь материал выбрасывается.
Если анализы покажут, что ни ВИЧ, ни какие-либо другие возбудители инфекции в материале не содержатся, то замороженную часть спермы можно будет использовать.
Очищенная сперма затем смешивается с раствором искусственной спермы, после чего ее можно использовать для оплодотворения.
Как оплодотворяется яйцеклетка?
Оплодотворение в пробирке, когда яйцеклетка оплодотворяется в лаборатории и после этого переносится в матку (более дорогостоящее, но потенциально менее опасное).
Интрацитоплазматическое впрыскивание спермы (ICSI), когда в яйцеклетку вводится только один сперматозоид.
Насколько это работает?
Процедура впервые применена для дискордантных пар в Милане, где было проведено около двух тысяч оплодотворений и десятки сотен процедур очистки спермы. До сих пор ни одна из женщин не стала ВИЧ-положительной, и естественно, то же можно сказать о детях. Самому старшему из детей, родившихся после подобной процедуры у дискордантной пары сейчас одинадцать лет.
Тем не менее, хотя очистка спермы снижает содержание в ней вируса до неопределяемого уровня, в ней всегда может оставаться небольшое количество ВИЧ. Так что даже в случае очистки спермы всегда остается маленький теоретический риск передачи вируса женщине. Впрочем, очистка спермы очевидно безопаснее, чем незащищенный секс.
Это значит, что любая пара должна быть совершенно уверена, что они готовы пойти на риск, неважно насколько маленький. Если они не готовы, то возможно, даже очистка спермы не самый подходящий для них вариант. Возможно, безопасным выходом для такой пары может стать искусственное оплодотворение с помощью донорской спермы.
Данные научных исследований
Согласно исследованиям, проведенным недавно в Великобритании, очистка спермы с последующим искусственным осеменением, возможно, является самым безопасным для ВИЧ-дискордантной пары способом зачатия ребенка. Доктор Джил Гилмор из Больницы Челси Вестминистер (Великобритания), и ее коллеги собрали данные о сперматозоидах, не-спермовых клетках и фракциях плазмы из образцов семени ВИЧ-позитивных пациентов-мужчин. Из всех трех элементов, сперматозоиды имели самый не значимый уровень СD4, CCR5, CXR4, и все фракции были негативны по вирусной РНК и провирусной ДНК. Исследователи заключили, что семенная плазма и не-спермовые клетки являлись основным резервуаром ВИЧ-РНК в семени. Они также заметили, что в следствие промывки спермитозной фракции, уровень ВИЧ-РНК может быть уменьшен до уровня ниже определяемого.
Высокое содержание вируса в сперме людей, инфицированных ВИЧ-1, выявляют на всех стадиях заболевания, и оно соответствует содержанию вируса в плазме. Определенной зависимости между содержанием вируса в сперме и количеством CD4+-клеток в крови не выявлено. В некоторых исследованиях наблюдали корреляцию между этими параметрами; в других обнаруживали только слабую зависимость.
Изучение во времени больных, у которых произошло развитие СПИДа, показало, что концентрация вируса в сперме в большинстве случаев существенно увеличивается по мере прогрессирования заболевания. Более высокая эффективность выделения вируса из спермы по мере уменьшения количества CD4+-клеток также подтверждает эти результаты. Более того, исследование динамики во времени показало, что у большинства ВИЧ-1-инфицированных людей вирус периодически появляется в сперме, и такое периодическое появление отражает перераспределение ВИЧ-1 между спермой и кровью.
Как отмечали выше в отношении содержания вируса в плазме, появление наибольшего количества инфекционного вируса в генитальных выделениях ожидается во время острой фазы инфицирования и после появления симптомов заболевания. В этом случае риск передачи вируса увеличивается, если мужчина с симптомами заболевания или с высоким содержанием вирусной РНК вступает в гетеросексуальные или гомосексуальные контакты. Из спермы выделяются как вызывающие образование синцития (SI) варианты вируса (Х4), так и не вызывающие образования синцития (NSI) варианты вируса (R5).
Большинство найденных вирусов, по-видимому, относятся к типу R5. В некоторых исследованиях РНК ВИЧ, связанная с клетками спермы, была обнаружена более чем в 80% исследованных образцов спермы, и содержание вируса там было ниже, чем в плазме. При наличии воспаления в половых путях или заболеваний, передающихся половым путем, концентрация ВИЧ в сперме увеличивается.
Другие исследования показали, что количество ВИЧ в сперме может не зависеть от степени вирусемии в плазме. Эти данные были получены при исследовании небольшой группы мужчин с высоким содержанием вируса в крови. Концентрация РНК в жидкой части спермы была сопоставима или превосходила таковую в плазме крови. Такие люди могут быть источником активного распространения вируса.
Количество вируса, выделяемого из спермы, было выше у мужчин с небольшим количеством CD4+-клеток. Тем не менее результаты различных исследований указывают на то, что наличие инфекционных вирусов, преимущественно восстановленных из инфицированных клеток, в семенной жидкости не обязательно соответствует клиническому состоянию больного.
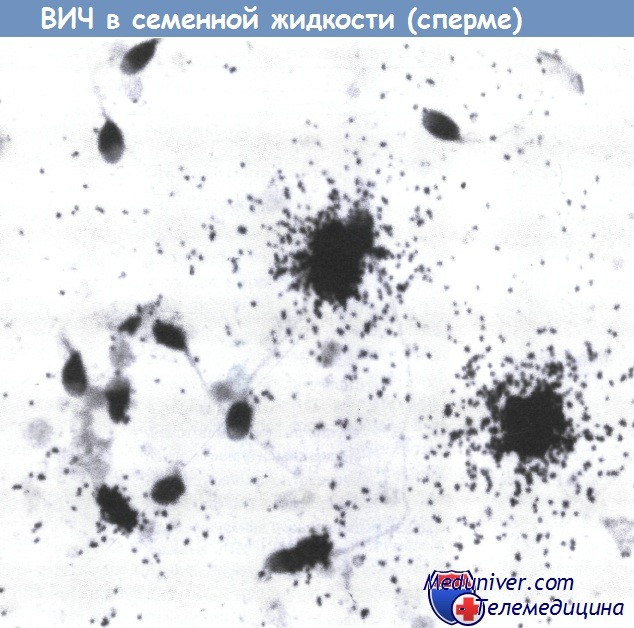
ВИЧ-инфицированные клетки, обнаруженные в семенной жидкости с помощью метода гибридизации in situ. Увеличение, х40.
Кроме того, концентрация РНК ВИЧ в сперме не коррелирует с количеством ВИЧ-специфичных CD8+ клеток. Эти и другие данные указывают на существование отдельного компартмента для ВИЧ в ткани семенников, где вирусы продуцируются некими другими клетками мужской половой системы. Существование компартмента ВИЧ-инфекции в семенниках подтверждается тем, что вирус, обнаруживаемый в сперме, не всегда совпадает по биологическому фенотипу или генотипу с вирусом, выделяемым из крови (например, R5 и Х4) у одного и того же инфицированного человека.
Кроме того, в одном исследовании было показано, что при еженедельном измерении в течение 10 недель концентрации ВИЧ у 28% исследованных мужчин вирус в сперме не удавалось определить, у других 28% пациентов вирус постоянно присутствовал в сперме, и у 44% лиц он периодически появлялся. При этом в период исследований концентрация вируса в плазме не изменялась. Сходным образом не обнаружили корреляции между вирусемией в плазме и концентрацией вируса (измеренной с помощью ПЦР с обратной транскрипцией) в сперме и слюне при одновременном исследовании всех трех жидкостей.
Очевидно прямое инфицирование или местное воспаление в различных тканях организма могут существенно влиять на количество обнаруживаемого там вируса. Реактивация цитомегаловирусной инфекции может увеличивать выброс ВИЧ в сперму. Наконец с помощью культуральных методов или ПЦР вирус находят в сперме пациентов, несмотря на проведение противовирусной терапии, даже при низком содержании вируса в плазме, вплоть до неопределяемого.
Эти данные, возможно, связаны с неспособностью некоторых лекарственных препаратов проникать через гематотестикулярный барьер и подчеркивают возможность передачи ВИЧ от инфицированного человека даже на фоне слабо выраженной вирусемии.
ВИЧ-инфицированные клетки в сперме
Очевидно, важной характеристикой генитальных выделений является наличие в них инфицированных вирусом клеток. В семенной жидкости их количество может варьировать от 0,01 до 5%. Сперма здоровых неинфицированных мужчин обычно содержит более 1 миллиона лейкоцитов/эякулят, но содержание и качественный состав клеток может существенно различаться в разные дни у одного и того же человека (D. Phillips, личная беседа).
Тем не менее ВИЧ-инфицированные клетки (>10 4 клеток/эякулят в некоторых случаях), по-видимому, являются более активным источником передачи, чем свободный инфекционный вирус. Кроме того, при наличии венерических заболеваний в семенной и вагинальной жидкостях обнаруживают значительно большее количество клеток воспалительного экссудата и, следовательно, клеток, инфицированных вирусом.
В одном исследовании ДНК провируса ВИЧ была обнаружена в клетках уретры при гонококковом уретрите, и количество зараженных клеток уменьшилось после лечения антибиотиками. К тому же в сперме, как и в крови, после длительной антиретровирусной терапии постоянно обнаруживают латентно инфицированные клетки. Необходимо выяснить их потенциальное значение в передаче заболевания.
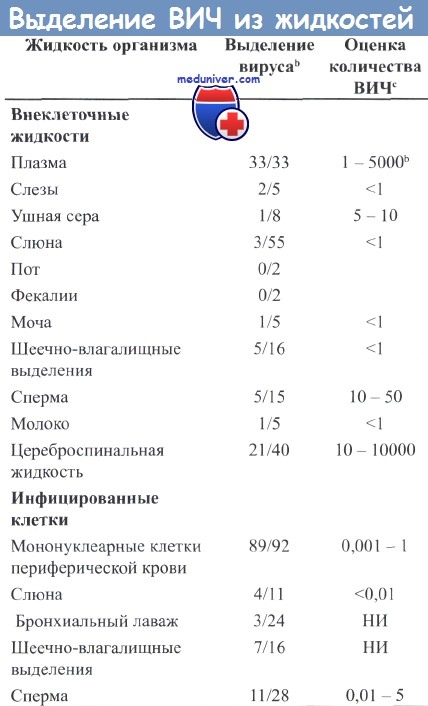
Для внеклеточных жидкостей значения соответствуют количеству инфекционных частиц на миллилитр; для инфицированных клеток значения представлены в виде процента от общего числа клеток. НИ - не известно.
b Количество случаев обнаружения инфекционных вирусов или инфицированных клеток на общее количество исследованных образцов.
с Высокое содержание соответствует симптомам развитого заболевания.

Обновлено: 10.03.2022
Бесплатная консультация или второе мнение врача-хирурга перед операцией в Клиническом госпитале на Яузе! подробнее
Запишитесь на ЭКО при ВИЧ-инфекции у мужчины
Обслуживание на двух языках: русский, английский.
Оставьте свой номер телефона, и мы обязательно перезвоним вам.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначить только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
В Клиническом госпитале на Яузе проводится ЭКО (экстракорпоральное оплодотворение) парам, в которых один из партнёров ВИЧ-инфицирован (так называемым дискордантным парам). Зачать и выносить здорового ребенка в таких случаях помогает применяемая нашими специалистами инновационная технология очистки спермы от вирусов, минимизирующая риск заражения ребенка и партнёрши ВИЧ-инфекцией. Вы можете стать счастливыми родителями здорового ребенка.
- При естественном зачатии от больного ВИЧ мужчины без каких-либо мер профилактики риск заражения плода и матери весьма высок
- Процедура специальной очистки спермы практически полностью очищает её от вирусов иммунодефицита, но не даёт 100% гарантии
- Проведение ИКСИ — введения отобранного сперматозоида в яйцеклетку в ходе процедуры ЭКО — дополнительно снижает риск инфицирования женщины и плода
Подготовка ВИЧ-инфицированного мужчины к ЭКО
Если у мужчины обнаружена ВИЧ-инфекция, репродуктологи нашего центра рекомендуют ему пройти специальную подготовку перед проведением ЭКО. ЭКО рекомендуется всем дискордантным парам, так как в случае естественного зачатия риск заражения плода значительно возрастает. Подготовка спермы партнера происходит в 2 этапа:
- сдача эякулята для выяснения активности сперматозоидов;
- повторная сдача спермы для проведения ее очистки.
Очистка спермы, во-первых, предупреждает заражение ВИЧ-инфекцией партнерши, а во-вторых, значительно повышает шансы на рождение здорового малыша.
Очистка мужской спермы
Метод очистки спермы состоит из двойного центрифугирования эякулятав специальной среде и последующей флотации.
Из очищенных данным способом сперматозоидов отбирается небольшая фракция для исследования на наличие РНК/ДНК вируса иммунодефицита человека типа 1 (ВИЧ-1). Основная часть очищенных сперматозоидов подвергается криоконсервации и может быть использована в программах ВРТ только после получения отрицательного результата теста на наличие РНК/ДНК ВИЧ-1.
Сперма, которая прошла подобную очистку, избавляется от вирусов иммунодефицита практически полностью.
Далее врачи нашего госпиталя приступают либо к процедуре искусственной инсеминации, либо к ЭКО с ИКСИ. ИКСИ подразумевает введение в цитоплазму яйцеклетки всего одного (самого качественного) сперматозоида, что не только увеличивает шансы оплодотворения, но и кардинально снижает риск заражения ВИЧ-инфекцией. К сожалению, в дискордантных парах с инфицированным ВИЧ мужчиной нередка ситуация, когда оплодотворяющая способность спермы недостаточна для искусственной инсеминации. В Клиническом госпитале на Яузе проводится экспертное исследование спермы мужчин (спермограмма).
Мужчине перед сдачей спермы для обследования и последующей очистки необходимо соблюдать половой покой не менее 3 и не более 5 дней, что способствует увеличению количества активных сперматозоидов и повышению шансов на оплодотворение.
Если после контрольного исследования спермы возникают сомнения в ее качестве либо в отношении присутствия в ней вирусов, врач рекомендует повторить процедуры отмывки спермы и последующее ЭКО через определенное время. При невозможности использования для оплодотворения спермы партнера рекомендуется использование донорской спермы.
Общая подготовка супругов
Ведение дискордантных пар с последующей искусственной инсеминацией либо экстракорпоральным оплодотворением с ИКСИ в Клиническом госпитале на Яузе полностью соответствует требованиям приказа МЗ РФ № 107Н от 30 августа 2012 года.
Всю необходимую информацию об очистке спермы, искусственной инсеминации или ЭКО дискордантная пара должна узнать от врача, который максимально подробно ответит на интересующие вопросы. Кроме того, репродуктолог обязан предупредить супругов не только о возможных осложнениях прохождения процедуры, но и о том, что применение вспомогательных репродуктивных технологий существенно повышает, но не гарантирует 100% результат зачатия и рождения здорового малыша.
При обнаружении ВИЧ-инфекции у женщины и желании ее родить здорового ребенка с помощью ЭКО, пациентку предупреждают, что данная процедура не проводится в инкубационный период и при обострении заболевания. Так как в эти периоды существенно возрастает риск передачи вируса плоду. У женщин процедура ЭКО проводится только в субклинической стадии или стадии стойкой ремиссии болезни.
Преимущества ЭКО в Клиническом госпитале на Яузе
- в процедуре участвует команда эмбриологов, генетиков и репродуктологов с большим опытом работы в области ВРТ;
- автоматизированная и эффективная система анализа спермы, высокая точность результатов спермограммы и качественный отбор активных сперматозоидов;
- тщательно разработанная программа ЭКО для ВИЧ-инфицированных пациентов;
- специальная технология очищения спермы от вирусов, гарантирующая максимальную защиту от ВИЧ-инфекции матери и будущего ребенка.
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Цены на ЭКО при ВИЧ-инфекции у мужчины
- Манипуляции
- Экстракорпоральное оплодотворение ооцитов (стандартное ЭКО) 19 600 руб.
- Введение сперматозоида в ооцит, ПИКСИ (дополнительно к ИКСИ) 12 000 руб.
- Оценка оплодотворения яйцеклеток 2 000 руб.
- Введение сперматозоида в ооцит, ИМСИ (дополнительно к ИКСИ) 14 000 руб.
- Введение сперматозоида в ооцит, ИКСИ (до 4 ооцитов) 20 000 руб.
- Введение сперматозоида в ооцит, ИКСИ (от 5 до 8 ооцитов) 24 500 руб.
- Введение сперматозоида в ооцит, ИКСИ (от 9 до 12 ооцитов) 34 500 руб.
- Введение сперматозоида в ооцит, ИКСИ (более 12 ооцитов) 39 500 руб.
- Внутриматочное введение спермы мужа (партнера) 15 000 руб.
- Внутриматочное введение спермы мужа (партнера) ПЛЮС 22 500 руб.
- Биопсия эмбриона, 1 эмбрион 12 000 руб.
- Биопсия эмбриона, каждый дополнительный эмбрион, свыше 1 6 000 руб.
- Вспомогательный хетчинг (рассечение блестящей оболочки) эмбриона 7 000 руб.
- Использование донорской спермы в программе ВРТ, 0,5 мл, 1 порция 16 000 руб.
- Подготовка к культивированию эмбрионов 3 000 руб.
- Культивирование эмбрионов 29 400 руб.
- Оценка развития эмбрионов 2 000 руб.
- Идентификация и оценка зрелости ооцитов 25 000 руб.
- Криоконсервация
- Криоконсервация эмбрионов, 1 крионоситель 10 000 руб.
- Криоконсервация эмбрионов, каждый последующий крионоситель 4 000 руб.
- Криоконсервация сперматозоидов 8 000 руб.
- Криоконсервация ооцитов, 1 крионоситель 18 000 руб.
- Криоконсервация ооцитов, каждый последующий крионоситель 4 000 руб.
- Использование витрифицированной донорской яйцеклетки (при условии проведения программы ЭКО в клинике), 1шт. 25 000 руб.
- Хранение
- Хранение витрифицированных эмбрионов (1 месяц) 1 200 руб.
- Хранение витрифицированных эмбрионов, ооцитов в отдельном криохранилище (1 месяц) 3 000 руб.
- Хранение витрифицированных ооцитов (1 месяц) 1 000 руб.
- Хранение криоконсервированной спермы (1 месяц) 1 200 руб.
- Хранение криоконсервированной спермы, ооцитов (1 год) 12 000 руб.
- Хранение криоконсервированной спермы в отдельном криохранилище (1 месяц) 3 000 руб.
- Разморозка
- Разморозка витрифицированных эмбрионов, 1 крионоситель 15 000 руб.
- Разморозка витрифицированных ооцитов, 1 ооцит 18 000 руб.
- Криолаборатория
- Донорский эмбрион (1 эмбрион) 83 500 руб.
- Использование в программах ВРТ генетически проверенного донорского эмбриона (1 эмбрион) 153 000 руб.
- Помощь на дому
- Прием (осмотр, консультация) врача-терапевта с выездом на дом в пределах МКАД 10 500 руб.
Внимание! Цены на сайте могут отличаться.
Пожалуйста, уточняйте актуальную стоимость у администраторов по телефону.
Наши специалисты:
ЗАПИСАТЬСЯ НА ПРИЁМ ОБРАТНЫЙ ЗВОНОК
Обслуживание на двух языках: русский, английский.
Оставьте свой номер телефона, и мы обязательно перезвоним вам.
Цель: оценить влияние антиретровирусной терапии на показатели спермограммы у мужчин, инфицированных ВИЧ.
Материалы и методы. Проведено проспективное исследование случай-контроль у 66 мужчин с ВИЧ-инфекцией, которые обратились для оценки фертильности. 1 группу исследования составил 51 мужчина, все из них принимающие АРВТ; 2 группу — 15 мужчин, не получавших АРВТ. Проведена оценка 97 и 25 образцов спермы соответственно. Статус пациентов по ВИЧ-инфекции оценивали на основании данных о стадии и фазе заболевания, об уровне вирусной нагрузки, CD3+, CD4+, CD8+ лимфоцитов и длительности АРВТ.
Ключевые слова
Об авторах
Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И.Кулакова
Россия
Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И.Кулакова
Россия
Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И.Кулакова
Россия
Список литературы
1. Краснопольская К.В., Назаренко Т.А., Гафуров Ю.Т. Место вспомогательных репродуктивных технологий в реализации репродуктивной функции у ВИЧ-инфицированных // Российский вестник акушера-гинеколога. 2013. № 3. С. 47–55. [Krasnopolskaya K.V., Nazarenko T.A., Gafurov Yu.T. Place of assisted reproductive technologyq in the implementation of reproductive function in HIV-infected. Russian Bulletin of Obstetrician-Gynecologist, 2013, No. 3, pp. 47–55 (In Russ.)].
2. Селимова Ф.Н., Перминова С.Г., Митюрина Е.В. и др. Реализация репродуктивной функции у мужчин с ВИЧ-инфекцией // Акушерство и гинекология. 2018. № 5. С. 36–43. [Selimova F.N., Perminova S.G., Mityurina E.V. et al. Realization of reproductive function in men with HIV infection. Obstetrics and Gynecology, 2018, No. 5, pp. 36–43 (In Russ.)].
3. Vernazza P., Hirschel B., Bernasconi E. et al. HIV transmission under highly active antiretroviral therapy. Lancet, 2008, Vol. 372, pp. 1806–1807.
4. Savasi V., Mandia L., Laoreti A. et al. Reproductive assistance in HIV serodiscordant couples. Hum. Reprod., 2013, Vol. 19, No. 2, pp. 136–150.
5. Nicopoullos J.D., Almeida P., Vourliotis M. et al. A decade of the sperm-washing programme: correlation between markers of HIV and seminal parameters. HIV Med., 2011, Vol. 12, No. 4, pp. 195–201.
6. Kehl S., Weigel M., Muller D. et al. HIV-1 infection and modern antiretroviral therapy impair sperm quality. Arch. Gynecol. Obstet., 2011, Vol. 284, No. 1, pp. 229–233.
7. Drobnis E., Nangia K. Impacts of medications on male fertility. Adv. Exp. Med. Biol., 2017, Vol. 1034, pp. 163–169.
8. Robbins W.A., Witt K.L., Haseman J.K. et al. Antiretroviral therapy effects on genetic and morphologic end points in lymphocytes and sperm of men with human immunodeficiency virus infection.J. Infect. Dis., 2001, Vol. 184, pp. 127–135.
9. Garrido N., Meseguer M., Remohì J. et al. Semen characteristics in Human Immunodeficiency Virus (HIV) and hepatitis C (HCV) seropositive males: Predictors of the success of viral removal after sperm washing. Hum. Reprod., 2005, Vol. 20, pp. 1028–1034.
10. Savasi V., Oneta M., Laoreti A. et al. Effects of antiretroviral therapy on sperm DNA integrity of HIV-1-infected men. Am. J. Men’s Health, 2018, Vol. 12, No. 6, pp. 1824–1831.
11. Evenson D.P. Sperm Chromatin Structure Assay (SCSA): 30 years of experience with the SCSA. In: Biological and clinical applications in male infertility and assisted reproduction, 2011, pp. 125–149.
12. Robinson L., Gallos I.D., Conner S.J. et al. The effect of sperm DNA fragmentation on miscarriage rates: a systematic review and meta-analysis. Hum. Reprod., 2012, Vol. 27, pp. 2908–2917.
13. Lewis W., Dalakas M. C. Mitochondrial toxicity of antiviral drugs. Nat. Med., 1995, Vol. 1, pp. 417–422.
14. Pavili L., Daudin M., Moinard N. et al. Decrease of mitochondrial DNA level in sperm from patients infected with human immunodeficiency virus-1 linked to nucleoside analogue reverse transcriptase inhibitors.Fertil. Steril., 2010, Vol. 94, No. 6, pp. 2151–2156.
15. White D.J., Mital D., Taylor S. et al. Sperm mitochondrial DNA deletions as a consequence of long term highly active antiretroviral therapy. AIDS, 2001, Vol. 15, pp. 1061–1062.
16. Руководство ВОЗ по исследованию и обработке эякулята человека / Пер. с англ. Н.П.Макарова, науч. ред. Л.Ф.Курило. М.: Капитал Принт, 2012. 5-е изд. 305 с. [Who guidelines for the study and treatment of human ejaculate, Transl. from English N.P.Makarov, Science ed. L.F.Kurilo. Moscow: Capital Print, 2012, 5th ed., 305 p. (in Russ.)].
17. Muller C.H., Coombs R.W., Krieger J.N. Effects of clinical stage and immunological status on semen analysis results in human immunodeficiency virus type 1-seropositive men. Andrologia, 1998, Vol. 30, Suppl. 1, pp. 15–22.
18. Dulioust E., Du A.L., Costagliola D. et al. Semen alterations in HIV-1-infected men. Hum. Reprod., 2002, Vol. 17, pp. 2112–2118.
19. Nicopoullos J.D., Almeida P.A., Ramsay J.W. et al. The effect of human immunodeficiency virus on sperm parameters and the outcome of intrauterine insemination following sperm washing.Hum. Reprod., 2004, Vol. 19, No. 12, pp. 2289–2297.
20. Dondero F., Rossi T., D’Offizi G. et al. Semen analysis in HIV seropositive men and in subjects at high risk for HIV infection. Hum. Reprod., 1996, Vol. 11, pp. 765–768.
21. Bujan L., Pasquier C., Labeyrie E. et al. Insemination with isolated and virologically tested spermatozoa is a safe way for HIV-1 virus sero-discordant couples with an infected male partner to have a child. Fertil. Steril., 2004, Vol. 82, pp. 857–862.
22. Pilatz A. et al. Semen quality in HIV patients under stable antiretroviral therapy is impaired compared to WHO 2010 reference values and on sperm proteome level. AIDS, 2014, Vol. 28, No. 6, pp. 875–882.
23. Van Leeuwen E. et al. Semen parameters of a semen donor before and after infection with human immunodeficiency virus type 1: case report. Hum. Reprod., 2004, Vol. 19, No. 12, pp. 2845–2853.
24. Van Leeuwen E. et al. Semen quality remains stable during 96 weeks of untreated human immunodeficiency virus-1 infection. Fertil. Steril., 2008, Vol. 90, No. 3, pp. 636–641.
25. Frainais C., Vialard F., Rougier N. et al. Impact of freezing/thawing technique on sperm DNA integrity in HIV-1 patients. Assist. Reprod. Genet., 2010, Vol. 27, No. 7, pp. 415–421.
ПЦР-анализ на сегодняшний день является одним из высокотехнологичных, доступных и эффективных методов молекулярной диагностики, применяемый в разных областях медицины. Чаще всего он используется для лабораторной диагностики инфекционных заболеваний человека, в том числе инфекций, передаваемых половым путём (ИППП), и выявления возбудителей урогенитальных инфекций, которые могут вызывать различные воспалительные заболевания органов мочеполовой системы у мужчин и женщин.
В этой статье речь пойдет о методе ПЦР для диагностики инфекций, передаваемых половым путем, при анализе спермы (эякулята). Какие инфекции можно определить в сперме, а какие нельзя? Какие еще материалы можно использовать для диагностики инфекций половой системы?
Среди преимуществ ПЦР как метода в сравнении с другими, традиционно используемыми для диагностики инфекционных заболеваний человека (иммуноферментный анализ, бактериологический посев, микроскопия), стоит отметить непосредственное обнаружение инфекционного агента в результате выявления специфического фрагмента ДНК или РНК возбудителя в исследуемом образце, а потому - возможность напрямую идентифицировать возбудителя инфекции, осуществлять раннюю диагностику, например, в инкубационном периоде, диагностировать заболевание не только в острой и хронической формах, но и выявлять скрытые (латентные) формы инфекций, протекающие без выраженных симптомов или бессимптомно, а также проводить скрининговые исследования, направленные как на определение уже имеющейся инфекционной патологии, так и выявление возможного носительства инфекций для оценки принадлежности пациента к группе риска.
Спектр возбудителей, выявляемых методом ПЦР, чрезвычайно широк, в связи с чем наибольшее распространение ПЦР-диагностика получила в гинекологической и урологической практике, в дерматовенерологии. Для диагностики большинства бактериальных и вирусных инфекций, выявления возбудителей ИППП, вызывающих заболевания, передаваемые половым путём (ЗППП), материалом для исследования служит, в основном, соскобное отделяемое слизистых оболочек мочеполовых органов: соскоб эпителиальных клеток из цервикального канала и поверхности шейки матки у женщин, соскоб из уретры (мочеиспускательного канала), выделения из половых органов - у мужчин и женщин. При обследовании на некоторые виды инфекций (ВИЧ, гепатиты В и С, вирус Эпштейна-Барр и др.) для анализа берут кровь. Для выявления цитомегаловирусной и герпетической инфекций можно исследовать мочу. Клиническим материалом для ПЦР-диагностики ИППП у мужчин может служить секрет предстательной железы и эякулят (сперма). В каждом конкретном случае выбор исследуемого биоматериала определяется диагностической задачей исследования.
В данной статье мы подробнее остановимся на диагностике ИППП у мужчин и возможности выявления возбудителей ЗППП и урогенитальных инфекций в эякуляте.
Инфекционно-воспалительные заболевания органов мужской репродуктивной системы могут явиться одной из возможных причин снижения мужской фертильности (способности к воспроизведению потомства), а урогенитальные инфекции их вызывающие - быть ассоциированы с мужским бесплодием.
К органам мужской репродуктивной системы относятся наружные и внутренние половые органы. К числу наружных относят половой член и мошонку. Внутренние половые органы представлены яичками с их оболочками и придатками, расположенными в мошонке, семявыносящими протоками и добавочными половыми железами, в числе которых предстательная железа (простата) - железисто-мышечный орган, охватывающий мочеиспускательный канал ниже мочевого пузыря, семенные пузырьки - парный железистый орган, расположенный над предстательной железой, и бульбоуретральные (Куперовы) железы - парные округлые железы небольшой величины, расположенные между пучками мышц мочеполовой диафрагмы. В яичках, являющихся парной половой железой, происходит образование мужских половых клеток - сперматозоидов и выработка мужских половых гормонов. Продукты секреции добавочных половых желез образуют семенную жидкость (семенную плазму, или спермоплазму), которая при смешении со сперматозоидами образует сперму. Придаток яичка (эпидидимис) тесно связан с яичком и служит резервуаром накопления спермы и созревания сперматозоидов, являясь частью семявыводящих путей. Семявыносящий проток представляет собой парный трубчатый орган, служащий для транспортировки сперматозоидов из эпидидимиса в семявыбрасывающий проток. При эякуляции (семяизвержении) происходит сокращение продольных мышечных волокон семявыносящего протока, сперматозоиды поступают в семявыносящий проток и смываются содержимым семенных пузырьков в уретру. Вклад секрета семенных пузырьков и предстательной железы в общий объём семенной жидкости составляет около 95% (примерно 35% приходится на секрет предстательной железы, 60% - на секрет семенных пузырьков), поэтому колебания объёма эякулята, в первую очередь, зависят от секрета добавочных половых желез. Тесная функциональная взаимосвязь всех органов мужской половой системы позволяет оценивать её состояние путём исследования эякулята. Среди лабораторных методов исследования анализ эякулята является важнейшим и, зачастую, - достаточным не только для оценки мужской фертильности, например, при анализе спермограммы, но и диагностики наиболее распространённых, репродуктивно значимых урогенитальных инфекций.
Наиболее частыми возбудителями инфекций мужского урогенитального тракта являются бактерии: гонококк (Neisseria gonorrhoea) - возбудитель гонореи, хламидии (Chlamydia trachomatis) - возбудитель урогенитального хламидиоза, трахомы и венерической лимфогранулемы, бледная трепонема (Treponema pallidum) - возбудитель сифилиса, микоплазмы (Mycoplasma genitalium и Mycoplasma hominis) и уреаплазмы (Ureaplasma urealyticum, Ureaplasma parvum), являющиеся инфекционными агентами воспалительных процессов в мочеполовых органах, а также простейшие, например, трихомонада (Trichomonas vaginalis) - возбудитель урогенитального трихомониаза, грибы, например, рода Candida, вызывающие урогенитальный кандидоз, и различные вирусы, среди которых вирусы простого герпеса 1 и 2 типов (ВПГ, Herpes simplex virus, HSV1 и HSV2) - возбудители генитального герпеса, цитомегаловирус (CMV), вирус папилломы человека (ВПЧ, HPV, Human papillomavirus), вирусы гепатита В (HBV), гепатита С (HCV), ВИЧ (HIV) и другие. Некоторые из перечисленных бактериальных возбудителей (гонококк, хламидии, бледная трепонема, генитальная микоплазма) являются патогенами, другие (уреаплазмы, энтерококки, стафилококки и ряд других) - принадлежат к группе условно-патогенных микроорганизмов, способных вызывать воспаление в половых органах при снижении иммунной защиты.
Вирусы и бактерии могут напрямую поражать сперматозоиды, приводя к изменению их подвижности. Так, например, известно, что Mycoplasma genitalium и Ureaplasma urealyticum, прикрепившиеся к головке и средней части сперматозоидов, негативно влияют не только на их подвижность, но и способность к оплодотворению яйцеклетки, проводимому в экспериментальных (in vitro) условиях. Повреждающее действие могут оказывать и продуцируемые микроорганизмами токсины. В ответ на инфекционный процесс развивается вторичное воспалительное повреждение, сопровождаемое образованием свободных радикалов и цитокинов, способных оказывать цитотоксическое воздействие на половые клетки. Кроме того, инфекции являются одним из факторов риска образования антиспермальных антител (АСАТ), направленных против различных частей сперматозоидов. Механизмом образования АСАТ на фоне воспалительного процесса является всё та же способность бактерий, вирусов и грибов прикрепляться к мембране сперматозоидов, вследствие чего происходит запуск аутоиммунных реакций. Присутствие АСАТ в эякуляте приводит к снижению его качественных и количественных характеристик: уменьшению концентрации и подвижности сперматозоидов, изменению морфологии половых клеток, их агглютинации, к изменению значений pH и вязкости семенной плазмы. Тем самым инфекции мочеполовых органов могут снижать репродуктивную функцию у мужчин.
Большинство возбудителей ИППП попадают в организм преимущественно половым путём. Наиболее часто инфекции выявляются у лиц молодого возраста, особенно тех, кто имеет большое число половых партнёров. При незащищенном половом акте высок риск заражения хламидиозом, гонореей, сифилисом, трихомониазом, гепатитами В и С, ВИЧ, герпесом, ВПЧ. Всего в настоящее время насчитывается более двадцати инфекций, которые передаются половым путём. Многие из них характеризуются высокой контагиозностью, а потому - быстрым распространением среди населения. К примеру, ежегодно в мире регистрируется около 90 миллионов новых случаев хламидийной инфекции, а восприимчивость к урогенитальному хламидиозу приближается к 100%. Следует помнить, что заражение ИППП может происходить при любом виде сексуальных контактов: анальном и оральном сексе, генитальном контакте без проникновения. Коварство этих инфекций заключается и в их возможности протекать без клинически выраженных симптомов. Согласно данным Всемирной организации здравоохранения (ВОЗ), 50 - 80% населения инфицировано вирусом папилломы человека, но лишь 1 - 2% лиц имеют клинические проявления этой инфекции. Бессимптомное вирусоносительство играет ключевую роль в распространении генитального герпеса: до 70% случаев передачи этого вируса и заражения им здоровых лиц происходит при бессимптомном характере болезни и наличии вируса герпеса у больного. Скрытый характер течения инфекции затрудняет возможность её выявления. Отсутствие со стороны мужчины должного внимания на появление у себя некоторых из признаков или симптомов начинающегося заболевания, несвоевременное обращение к врачу или неадекватное лечение, например, в случае предпринимаемого самолечения, могут способствовать переходу инфекции в хроническу форму и развитию хронического заболевания. Хроническую инфекцию труднее диагностировать, тяжелее лечить, к тому же последствия хронического инфекционно-воспалительного процесса в мочеполовых органах оказываются более тяжкими для мужского здоровья.
В зависимости от локализации инфекционного процесса чаще всего у мужчин развиваются уретрит (воспаление мочеиспускательного канала), цистит (воспаление мочевого пузыря), простатит (воспаление предстательной железы), эпидидимит (воспаление придатка яичка) и орхит (воспаление яичка). Острый эпидидимит может распространиться и на яички (эпидидимоорхит). Симптомы или признаки заболевания напрямую зависят от того, какой именно возбудитель инфекции попал в мужской организм и каково состояние иммунитета в целом. Наиболее частыми возбудителями инфекций, вызывающих уретрит, являются Chlamydia trachomatis, Neisseria gonorrhoea, Mycoplasma genitalium и Ureaplasma urealyticum. Среди сексуально активных молодых мужчин эпидидимит чаще вызывается Chlamydia trachomatis, Neisseria gonorrhoea и Trichomonas vaginalis. У мужчин старшего возраста и пожилых чаще обнаруживают условно-патогенную микрофлору (Mycoplasma hominis, Ureaplasma parvum и др.).
Симптомы урогенитальных заболеваний, вызываемых различными возбудителями ИППП, чаще всего не являются специфичными. При остром характере инфекционного-воспалительного процесса клиническая картина ИППП у мужчин может выражаться такими симптомами, как дискомфорт, зуд и жжение в области уретры, боль в промежности, нижней части живота и в области мошонки, болезненность при мочеиспускании (дизурия) и половых контактах (диспареуния), гиперемия и отёчность кожных покровов в области поражения, слизистые или гнойные выделения из уретры. В случае скрытой формы инфекции признаками заражения могут являться редкие, незначительные выделения из уретры. Сходство клинических проявлений многих урогенитальных инфекций вовсе не означает, что существует их одинаковое лечение, каждая инфекция требует индивидуальной медикаментозной терапии. Это диктует необходимость проведения лабораторного исследования, направленного на выявление и идентификацию возбудителей ИППП.
Одним из таких видов исследования, предлагаемых в нашей клинике для мужчин, является анализ эякулята с помощью молекулярно-биологического метода ПЦР. Исследование является скрининговым и представляет собой блок анализов ПЦР на инфекции в сперме. Предназначен для обнаружения в биоматериале специфических фрагментов ДНК основных возбудителей ИППП и урогенитальных инфекций мочеполового тракта у мужчин: Neisseria gonorrhoeae, Clamydia trachomatis, Trichomonas vaginalis, Mycoplasma genitalium, Mycoplasma hominis и Ureaplasma spp. Обследование не требует применения каких-либо инвазивных процедур, а потому может быть выполнено в кратчайшие сроки. Использование для этих целей современного высокочувствительного и высокоточного диагностического метода, каким является ПЦР-анализ, представляется в настоящее время неотъемлемой частью комплексного подхода в лабораторной оценке мужского репродуктивного здоровья.
Читайте также:

