Посевы крови при инфекционном эндокардите
Обновлено: 24.04.2024
Мы продолжаем обсуждение проблемы инфекционного эндокардита (см. "Мир Медицины" NN 9-10, 1998; 5-6, 1999; 9-10, 1999). О современных подходах к профилактике этого заболевания рассказывает ведущий научный сотрудник, руководитель отделения некоронарогенной патологии сердца СПб НИИ кардиологии МЗ РФ, доцент кафедры факультетской терапии, руководитель курса повышения квалификации врачей по кардиологии и функциональной диагностике факультета постдипломного обучения СПбГМУ им. акад. И.П. Павлова Виктор Васильевич Федоров.
Инфекционный эндокардит (ИЭ) - заболевание, характеризующееся полиморфизмом клинической симптоматики, разнообразием поражений многих органов и систем, трудностями выбора рациональной лечебной тактики и чрезвычайно серьезным прогнозом. Частота возникновения новых случаев ИЭ не имеет отчетливой тенденции к снижению, несмотря на уменьшение (в некоторых регионах мира) числа больных с ревматическими поражениями сердца и разработку мер профилактики ИЭ.
Delahaye F. и соавторы (1), проанализировавшие 116 госпитальных случаев ИЭ, пришли к неутешительным выводам: профилактика ИЭ не проводилась вообще у половины (47.0%) из числа нуждавшихся в ней пациентов, а осуществлялась правильно лишь у 15.7% больных. Наши наблюдения за 525 больными ИЭ, получавшими медицинскую помощь в стационарах Санкт-Петербурга, мало отличаются от представленных данных: антибактериальная профилактика осуществлялась у трети нуждавшихся в ней больных (33.7%) и только у каждого десятого пациента (9.9%) проводилась препаратами, имевшими адекватный антимикробный спектр, дозу и режим применения.
Современные представления о гетерогенности популяции больных ИЭ диктуют необходимость рассмотрения вопросов его профилактики в трех основных аспектах:
- профилактика ИЭ нативного клапана;
- профилактика ИЭ протезированного клапана;
- профилактика рецидива ИЭ после его успешного хирургического лечения
Наибольшее значение для врачей общей практики и кардиологов имеют вопросы профилактики ИЭ нативного клапана. В связи с этим в статье они обсуждаются более подробно. Риск ИЭ нативного клапана определяется:
- массивностью и длительностью бактериемии, возникающей после лечебно-диагностических манипуляций и процедур;
- состоянием эндотелия (клапанного и пристеночного), определяющим возможность фиксации и колонизации микробных тел;
- иммунологическим статусом макроорганизма
По мнению экспертов Американской Ассоциации кардиологов, профилактика ИЭ рекомендована после:
- стоматологических вмешательств, осложненных кровотечением;
- тонзилэктомии, аденоидэктомии;
- хирургического удаления участка слизистой оболочки желудочно-кишечного или респираторного тракта;
- склеротерапии варикозно расширенных вен пищевода и его дилатации;
- дилатации мочеточника;
- хирургического лечения патологии мочевыводящих путей (включая простатэктомию);
- длительной катетеризации мочевого пузыря, осложненной инфекцией;
- вагинальной гистерэктомии;
- инфицированных родов;
- рассечения и дренирования инфицированных тканей (2)
- не осложненных кровотечением стоматологических манипуляций;
- инъекции локальных анестетиков;
- введения тимпаностомической трубки;
- введения эндотрахеальной трубки;
- бронхоскопии мягким эндоскопом (с биопсией слизистой или без нее);
- пункции мочевого пузыря
- неинфицированной катетеризации уретры;
- работы кюреткой во влагалище;
- неосложненных родов и абортов, проводимых в лечебно-профилактическом учреждении;
- удаления внутриматочных спиралей;
- стерилизационных процедур;
- лапароскопии;
- удаления молочных зубов
Наиболее высок риск ИЭ у пациентов, имеющих:
- эпизоды ИЭ в анамнезе;
- имплантированный клапанный протез;
- врожденные пороки сердца "синего" типа;
- открытый артериальный проток;
- пороки митрального и аортального клапанов с регургитацией;
- дефект межжелудочковой перегородки;
- коарктацию аорты;
- ятрогенный аорто-пульмональный шунт
- и страдающих пороками сердца с оставшимися после хирургической коррекции резидуальными нарушениями
- пролапсом митрального клапана с регургитацней;
- "чистым" митральным стенозом;
- трикуспидальным пороком сердца;
- пульмональным стенозом;
- асимметричной гипертрофией межжелудочковой перегородки;
- дегенеративными болезнями клапанов в молодом возрасте
- и имеющие бикуспидальный аортальный клапан или комбинированный аортальный порок с минимальными гемодинамическими нарушениями;
- минимальные резидуальные нарушения в первые 6 месяцев после коррекции порока сердца (3)
- с пролапсом митрального клапана без регургитации;
- с пролапсом митрального клапана с регургитацией, определяемой только инструментальными методами;
- имеющих высокие изолированные дефекты межпредсердной перегородки;
- с коронарной болезнью сердца;
- с ревматическими поражениями сердца без клапанной дисфункции;
- перенесших аорто-коронарное шунтирование;
- имевших хирургическую коррекцию пороков сердца с минимальными резидуальными поражениями (спустя 6 месяцев после операции)
Таблица 1. Показания к профилактике инфекционного эндокардита
| Характеристика ятрогенной бактеримии | Риск инфекционного эндокардита | ||
| высокий | умеренный | минммальный | |
| Массивная, длительная | + | + | + |
| Массивная, кратковременная | + | + | - |
| Малая, длительная | + | +/- | - |
| Малая, кратковременная | + | - | - |
"-" - профилактика не показана;
"+/-" - профилактика осуществляется у лиц с дополнительными факторами риска (наркоманов, злоупотребляющих внутривенными инъекциями).
Таблица 2. Режимы профилактики инфекционного эндокардита (2)
| Режим | Препарат | Разовая доза | Пути введения | Способ применения |
| Стандартный | амоксициллин | 3.0 г 1.5 г | Per os | за 1 час до процедуры спустя 6 часов после назначения первой дозы |
| При наличии аллергии | эритромицин стеарат | 1.0 г 0.5 г | Per os | за 2 часa до процедуры спустя 6 часов после назначения первой дозы |
| При невозможности пероральной терапии | ампициллин | 2.0 г 1.0 г | в/м (в/в) | за 30 минут до процедуры спустя 6 часов после назначения первой дозы |
| При аллергии к пенициллину, амокссициллину, ампициллину и при невозможности приема пероральных препаратов | клиндамицин | 300.0 мг 150.0 мг | в/в | за 1 час до процедуры после приема первой дозы |
| При плановых операциях на мочеполовом и желудочно-кишечном трактах | ампициллин + гентамицин амоксициллин | 2.0 г 85 мг 1.5 г | в/в Per os | за 30 минут до процедуры спустя 6 часов после назначения первой дозы |
| При наличии аллергии к ампициллину, амоксициллину | ванкомицин + гентамицин | 1.0 г 80 мг | в/в | за 1 час до процедуры и через 8 часов после первой дозы |
Профилактика ИЭ протезированного клапана
Инфекционный эндокардит протезированного клапана (ИЭПК) - одна из самых грозных разновидностей гнойно-септических осложнений в кардиохирургии. Ранний ИЭПК возникает в первые 30 суток после операции с частотой 0.3-1.02 / 100 пациенто-лет; поздний - у 0.12-0.4% больных в год. Профилактика ИЭПК начинается почти сразу после операции и осуществляется у лиц с высоким риском в течение 4 недель, умеренным - 2 недель, минимальным - 5 суток после операции. Крайне высоким риском ИЭПК характеризуются больные:
- с клинико-бактериологической симптоматикой интраоперационной бактериемии - гектической лихорадкой в первые сутки после операции, сопровождающейся ознобами и проливными потами, имеющие положительную гемокультуру;
- оперированные по поводу активного ревматического вальвулита или инфекционного эндокардита;
- с длительностью искусственного кровообращения свыше 130 минут;
- с концентрацией С-реактивного белка в крови (СRВ) свыше 190 мг %
- после имплантации двух клапанов;
- при концентрации CRB 120-190 мг %
- после имплантации одного клапана;
- не имеющие признаков интраоперационной бактериемии;
- с концентрацией CRB менее 120 мг %
Профилактика рецидива ИЭ после его успешного хирургического лечения
Рецидив ИЭ - возникновение нового случая заболевания после успешного хирургического лечения - возможен у больных:
- с длительностью заболевания более 6 месяцев;
- при остром или подостром течении ИЭ;
- с клинико-бактериологическими признаками интраоперационной бактериемии;
- с концентрацией CRB более 90 мг %;
- с наличием микробных колоний на клапане
Ссылки:
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
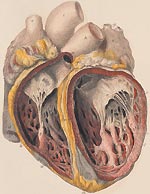
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Кардиология:
Анализы и алгоритм диагностики инфекционного эндокардита (ИЭ)
Симптомы и признаки эндокардита часто общие, а в случае локализованного процесса являются следствием отдаленного осложнения, а не отражением самой внутрисердечной инфекции. Следовательно, чтобы не пропустить ИЭ, нужно поддерживать высокий уровень подозрения. ИЭ можно предположить, если у пациента с лихорадкой присутствует один или несколько кардинальных признаков ИЭ: предрасполагающее поражение сердца или характерные изменения, бактериемия, эмболический синдром и доказательства активного эндокардиального процесса. Больные с предрасполагающими к ИЭ факторами, необъяснимой потерей массы тела, недомоганием, азотемией и анемией составляют группу пациентов с подозрением на ИЭ даже при отсутствии лихорадки.
Пациентов с искусственными клапанами сердца с лихорадкой или дисфункцией протеза также можно отнести к этой группе. Однако даже при типичных для эндокардита признаках для окончательной диагностики необходимы положительные результаты анализов гемокультуры или культуры из вегетаций либо эмболов (гистологическое исследование или определение ДНК микроорганизмов методом ПЦР), поскольку при отрицательной гемокультуре возможны и другие заболевания, имитирующие ИЭ: миксома предсердия, острая ревматическая лихорадка, СКВ или другие заболевания соединительной ткани и сосудов (системные васкулиты), марангический эндокардит, антифосфолипидный синдром, карциноидный синдром, гипернефрома с повышенным СВ и тромботическая тромбоцитопеническая пурпура.
Если использовать эти диагностические критерии в качестве руководства к терапии, то пациентов с возможным эндокардитом следует лечить так, как если бы они имели достоверный эндокардит. Требование одного большого и одного малого критерия или трех малых критериев для диагностики возможного эндокардита снижает потенциальную гипердиагностику ИЭ.
Тем не менее, поскольку с помощью ЭхоКГ невозможно отличить излеченные вегетации и другие массы на клапанах от активных инфицированных вегетаций, эти критерии не исключают неправильного определения пациентов с отрицательной гемокультурой как имеющих ИЭ, т.к. вегетации могут быть осложнением кахексии, злокачественных опухолей, скрытых заболеваний соединительной ткани и васкулитов, антифосфолипидного синдрома или ранее излеченного ИЭ. Чтобы использовать бактериемию, вызванную коагулазонегативным стафилококком или дифтероидами (микроорганизмами, которые могут вызвать ИЭ, но чаще загрязняют культуру крови), для подтверждения эндокардита, результаты культуры крови должны быть постоянно положительными либо должно быть доказано, что микроорганизмы, выделенные из нескольких спорадических положительных культур, представляют собой один клон.
а) Эхокардиография (ЭхоКГ). Включение в эти критерии результатов ЭхоКГ в качестве доказательств эндокардиальной инфекции свидетельствует о высокой чувствительности двухмерной ЭхоКГ и цветовой допплерографии, особенно если комбинируют биплановую или мулыиплановую ЧПЭхоКГ и ТТЭхоКГ, и относительно редких ложноположительных данных, когда опытные операторы используют специфические определения вегетаций. ЧПЭхоКГ имеет лучшее разрешение и позволяет визуализировать более мелкие вегетации по сравнению с ТТЭхоКГ. Чувствительность ТТЭхоКГ в определении вегетаций у пациентов с ЭНК составляет 65%, в то время как чувствительность ЧПЭхоКГ у таких пациентов — 85-95%.
АНА рекомендует проводить ЭхоКГ всем пациентам с подозреваемым ИЭ. ЭхоКГ не следует использовать как скрининговый метод диагностики ИЭ у произвольно взятых пациентов с положительной гемокультурой или в оценке больных с лихорадкой неясного генеза, когда клиническая вероятность ИЭ низкая.
Поскольку ценность ЧПЭхоКГ в диагностике эндокардита нативного клапана (ЭНК) у пациентов с бактериемией на 15% выше диагностической ценности ТТЭхоКГ, наиболее экономически эффективной стратегией (дополнительные годы жизни с поправкой на качество жизни) является следующая:
(1) если исходная вероятность ИЭ составляет < 2%, лечить бактериемию нужно без ЭхоКГ;
(2) если исходная вероятность ИЭ составляет 2-4%, следует выполнить ТТЭхоКГ;
(3) если исходная вероятность ИЭ составляет от 5 до 45%, вместо ТТЭхоКГ следует использовать ЧПЭхоКГ.
Если исходная вероятность ИЭ больше 45%, целесообразно лечить ИЭ без ЭхоКГ, хотя визуализация нужна для оценки осложнений и других рисков. В подходе к использованию ЭхоКГ применяют критерии, предлагаемые АНА.
Исследования показали, что среди пациентов с высокой исходной вероятностью ЭНК результаты ЧПЭхоКГ редко влияют на независимо принятые решения о терапии эндокардита, основанные па клинической картине и ТТЭхоКГ. Исключения — ситуации, когда ЧПЭхоКГ дает важную информацию, изменяющую стратегию и тактику лечения, включая случаи, когда ТТЭхоКГ технически невыполнима, но есть подозрение на ЭНК и выявлены S. aureus или энтерококковая бактериемия. У пациентов с клинически неосложненной катетер-ассоциированной бактериемией S. aureus, когда риск ИЭ варьирует от 6 до 23%, использование ЧПЭхоКГ для наблюдения за вегетациями и определения продолжительности терапии антибиотиками (4-6 нед vs 2 нед, т.е. лечить ИЭ или нет) является менее болезненным и более целесообразным, чем эмпирический выбор продолжительности лечения.
Несмотря па чувствительность ЧПЭхоКГ в определении вегетаций у пациентов с доказанным ИЭ, ЧПЭхоКГ только выявляет вегетации и дисфункцию клапана. Для определения причины их появления и диагноза нужно клиническое или прямое анатомическое и микробиологическое подтверждение. Кроме того, неинфицирован-ные вегетации, утолщение клапанов, разрывы хорд или клапанов, а также кальцификация клапана и узелки могут быть приняты за инфицированные вегетации, что указывает на специфические ограничения этого метода визуализации.
б) Установление возбудителя инфекционного эндокардита (ИЭ). Возбудителя ИЭ определяют, выделив инфекционный агент из крови или обнаружив его в вегетациях либо в эмболе. В условиях продолжающейся бактериемии при ИЭ нет преимуществ в изучении культуры крови. У пациентов с ИЭ, которые ранее не получали антибиотики и которые имеют положительный результат посева, результат будет таким же, вероятно, в 95% случаев всех посевов (по крайней мере одна из первых двух культур). Предшествующая антибактериальная терапия — главная причина отрицательной гемокультуры при ИЭ, особенно если этиологический возбудитель высокочувствителен к антибиотику. После применения антибиотиков в субтерапевтических дозах время, необходимое для возвращения к положительной гемокультуре, прямо связано с продолжительностью антимикробной терапии и чувствительностью этиологического возбудителя (от нескольких дней до 1 нед и более).
в) Бакпосев крови при инфекционном эндокардите (ИЭ). При подозрении на эндокардит рекомендуется в течение > 24 час взять три пробы крови (каждая из отдельной венопункции). Для каждой пробы следует подготовить емкость, содержащую аэробную среду, и емкость, содержащую гиогликолевый бульон (анаэробную среду). В каждую емкость следует поместить по крайней мере 10 мл крови. Если клинически стабильный пациент получал антимикробный препарат в течение последних нескольких педель, целесообразно отложить терапию, чтобы получить повторные культуры в последующие дни без лечения антибиотиками. Если эндокардит вызван грибами или необычными бактериями (Legionella spp. или Bartonella spp.), следует проконсультироваться с лабораторией для выбора оптимальных методов культивирования. Для подтверждения диагноза эндокардита, вызванного Brucella spp., Legionella spp., Bartonella spp., Chlamydia spp. или C. humetti, можно использовать серологические тесты.
Этих возбудителей или других, трудно определяемых в культуре крови возбудителей можно идентифицировать в крови или вегетациях, используя специальные методики, включая ПЦР и обнаружение антигена.
При оценке положительных культур крови следует отличать устойчивую бактериемию, которая типична для ИЭ, от транзиторной бактериемии. Если несколько культур крови, полученных в течение 24 час или более, положительны, следует предположить ИЭ. Идентификация микроорганизма также полезна в определении частоты этого заболевания. Возбудителей, ставших причиной ИЭ, подразделяют на тех, которые часто вызывают ИЭ, и тех, которые редко служат причиной ИЭ. Также выделяют микроорганизмы среднего диапазона, такие как энтерококки и S. aureus, наличие которых в крови не всегда свидетельствует об ИЭ. В оценке бактериемии помогает наличие или отсутствие альтернативных ее источников.
г) Лабораторные исследования. Анемия с нормохромными нормоцитарными эритроцитами, низким уровнем железа в сыворотке и низкой железосвязывающей способностью обнаруживается у 70-90% пациентов. Анемия прогрессирует при увеличении длительности заболевания, поэтому при остром ИЭ может отсутствовать. При подостром ИЭ количество лейкоцитов обычно в норме; при остром ИЭ, напротив, распространен лейкоцитоз с увеличением сегментоядерных гранулоцитов. Тромбоцитопения возможна, но редко. Скорость оседания эритроцитов (СОЭ) увеличивается в среднем до 55 мм/час почти у всех пациентов с ИЭ, за исключением пациентов с ХСН, почечной недостаточностью и внутрисосудистым свертыванием крови. В некоторых исследованиях часто указывают на иммунную стимуляцию или воспаление: циркулирующие иммунные комплексы, ревматоидный фактор, изменение уровней иммуноглобулинов, криоглобулинов и С-реактивного белка.
Хотя результаты этих исследований соответствуют степени активности заболевания, сами исследования дорогостоящи и неэффективны в диагностике ИЭ или мониторировании ответа на терапию. У пациентов с иммунокомплексным гломерулонефритом выявляют циркулирующие иммунные комплексы и снижение компонентов системы комплемента. Анализ мочи часто изменен, даже когда функция почек остается нормальной. Протеинурия и микрогематурия отмечаются у 50% пациентов.
д) Эхокардиография (ЭхоКГ). ЭхоКГ может помочь выявить пациентов с высоким риском осложнений или нуждающихся в хирургическом лечении и дает основную информацию по ведению пациента с ИЭ.
С помощью ДЭхоКГ можно визуализировать обтурирующие вегетации или признаки декомпенсированной ХСН и измерить дисфункцию клапана, а также почти всегда можно определить регургитацию уже на ранней стадии и ЭНК, и ЭИК (что не обязательно служит предиктором прогрессирующего ухудшения гемодинамики). Распространение инфекции за пределы створок клапана приводит к абсцессам клапанного кольца или смежных структур, микотическим аневризмам синуса Valsalva или МК, внутрисердечным фистулам и гнойному перикардиту. Абсцессы миокарда у пациентов с ЭНК или ЭИК легче определить с помощью ЧПЭхоКГ, чем при ТТЭхоКГ. Чувствительность и специфичность ТТЭхоКГ составляют 28% для ЭНК и 98% для ЭИК по сравнению с 87% и 95% ЧПЭхоКГ соответственно.
ЧПЭхоКГ также более чувствительный и точный метод, чем ТТЭхоКг, для распознавания субаортального инфекционного поражения и перфорации клапанов. С помощью ЧПЭхоКГ можно быстро оценить прогрессирующую ХСН, изменения проводимости, отражаемые на ЭКГ, сердечные шумы и признаки перикардита и принять соответствующее решение относительно терапии. В целях адекватного долгосрочного лечения морфологию клапана и его функцию, размеры вегетаций и функцию желудочков следует определять в конце лечения с помощью ТТЭхоКГ.
е) МРТ и КТ. С помощью этих методов идентифицируют параклапанное распространение инфекции, аневризмы корня аорты и фистулы, однако преимущества МРТ и КТ перед ЭхоКГ не установлены.
ж) Сцинтиграфия. Для выявления вегетаций и внутрисердечных абсцессов при ИЭ в экспериментах на животных пробовали использовать сцинтиграфию с цитратом галлия-67, гранулоцитами, меченными индием-111, и тромбоцитами, меченными индием-111, но этот метод оказался недостаточно чувствительным и анатомически неточным для клинического использования.
М.Н. ЗУБКОВ, доктор медицинских наук, профессор, вице-президент Межрегиональной ассоциации клинической микробиологии и антимикробнои химиотерапии (МАКМАХ) ЭТИОЛОГИЯ, ДИАГНОСТИКА, АНТИБИОТИКОТЕРАПИЯ И АНТИБИОТИКОПРОФИЛАКТИКА
Инфекционный эндокардит (ИЭ) - воспаление эндокарда микробной этиологии, сопровождающееся длительной бактериемией, подъемом температуры, шумами сердца, эмболиями и вегетациями (разрастания эндокарда), которые могут вызвать недостаточность клапанов или сужение клапанных отверстий, абсцессы миокарда и микотические аневризмы. По течению различают острый ИЭ (с быстро прогрессирующей клинической симптоматикой; чаще поражаются интактные клапаны, главным образом трехстворчатый и легочного ствола, реже аорты) и подострый ИЭ (с постепенным развитием, до нескольких недель и даже месяцев, с преимущественным поражением клапана аорты, реже митрального; при инъекционной наркомании вовлекается трехстворчатый клапан).
Заболеваемость ИЭ в среднем составляет 2-4 случая на 100 тыс. населения, а летальность достигает 21-50% в зависимости от локализации и характера поражения (левосторонний или правосторонний ИЭ, естественные или искусственные клапаны), стадии процесса (острый, подострый), вида возбудителя, сроков начала антимикробной терапии, сопутствующих заболеваний, тяжести осложнений, проведения оперативного лечения и др.
Факторами риска возникновения ИЭ являются наличие искусственных клапанов сердца; врожденный порок сердца; ревматические и другие приобретенные поражения клапанов; гипертрофическая кардиомиопатия; пролапс митрального клапана с клапанной регургитацией; любые диагностические и лечебные процедуры с применением катетеров, эндоскопических инструментов; стоматологические процедуры; операции, затрагивающие слизистую оболочку дыхательных путей, ЖКТ, мочевых путей при наличии инфекции данных органов; физиологические роды при инфекции родовых путей; наркомания.
Этиология ИЭ зависит от обстоятельств, способствовавших возникновению заболевания (естественные или искусственные клапаны, инъекционная наркомания, осложнение основного заболевания инфекционной природы).
ИЭ естественных клапанов в 45-65% случаев вызывается стрептококками (чаще S.viridans и S.bovis), в 5-18% - энтерококками, в 20-35% - стафилококками. При развитии сердечной недостаточности возрастает роль S.aureus, Enterococcus spp., S.pneumoniae, S.pyogenes. У наркоманов чаще поражается аортальный клапан, а ведущими возбудителями являются S.aureus (включая метициллинрезистентные штаммы), Pseudomonas aeuginosa, энтерококки. Значительно реже встречаются медленно растущие, трудно культивируемые грамотрицательные микроорганизмы: Haemophilus parainfluenzae, Haemophilus aphrophilus, Actinobacillus spp., Cardiobacterium spp., Eikinella corrodens, Kingella spp. (НАСЕК - по первым буквам названий микроорганизмов), а также Bartonella spp. (при болезни кошачьей царапины).
При ИЭ искусственных клапанов, возникшем в ранние сроки (менее 3 месяцев после операции), возбудителями являются (по мере убывания) стафилококки, энтеробактерии, P.aeruginoza, дифтероиды, грибы рода Candida и Aspergillus (в 9,6% случаев); а при позднем ИЭ (более 3 месячев после операции) - S.epidermidis, зеленящие стрептококки, энтерококки, S.aureus, грибы (4,3%).
Как осложнение инфекционного заболевания ИЭ может быть вызван бруцеллами, нейссериями, легионеллами, микобактериями, нокардиями, риккетсиями, хламидиями, микоплазмами.
Посев крови, по существу, является единственным специфическим методом лабораторной диагностики ИЭ. С одинаковым успехом можно исследовать как венозную, так и артериальную кровь вне зависимости от фазы подъема температуры. Посевы крови следует производить в первые сутки после установления диагноза: при подостром ИЭ - 2 и более раз с интервалом 12 часов, при остром ИЭ - 3 и более раз в течение часа. При отрицательных результатах первичных посевов проводят 2-3 дополнительных посева в течение 48 часов. Кровь берут раздельными венопункциями в объеме около 20 мл у взрослых и 5-10 мл - у детей. Нельзя исследовать кровь из постоянных сосудистых катетеров ввиду высокого риска контаминации посторонней микрофлорой.
Многократные посевы крови существенно повышают вероятность выделения гемокультуры и позволяют дифференцировать истинные патогены (при повторном выявлении микроорганизмов того же вида) от случайных контаминантов, наблюдаемых в 41,5% случаев. При этом среди гемокультур коагулазонегативных стафилококков удельный вес контаминантов достигает 81,9%, а среди изолятов зеленящих стрептококков - 49,3%, что связано с применением внутрисосудистых катетеров и других инвазивных вмешательств, а также с использованием высококачественных питательных сред для выделения гемокультур, обеспечивающих рост контаминантов кожи даже после тщательной ее дезинфекции перед венопункцией.
При отрицательных результатах посевов крови может возникнуть необходимость в использовании специальных питательных сред для выделения труднорастущих микроорганизмов (стрептококки с повышенной питательной потребностью, L-форм бактерии, НАСЕК) либо применении серологических методов и ПЦР-диагностики для индикации других возбудителей (Brucello spp., Neisseria spp., Legionella spp., Mycobacterium spp., Nocardia spp., Coxiella burnetii., Rickettsia spp., Bartonella spp., Chlamydia spp., Mycoplasma spp.).
Наиболее достоверным является микробиологическое исследование материалов, полученных во время операции или аутопсии. Согласно данным зарубежных авторов, проводивших микроскопическое, культуральное (посев) и гистологическое изучение операционных биоптатов вегетации в разные сроки от начала антибиотикотерапии, в течение первой недели частота выделения возбудителя снижается до 64%, на второй неделе - до 21%, а на третьей неделе результаты посевов становятся отрицательными. Однако при микроскопическом изучении препаратов, окрашенных по Граму, возбудитель можно обнаружить в 64-75% случаев на 4-6-й неделе лечения, и в 27% случаев - в течение 1-6 месяцев после его завершения. Отсюда следует, что положительные находки при микроскопии не обязательно свидетельствуют о неэффективности проводимой антибиотикотерапии.
Идентификацию микроорганизмов при ИЭ необходимо проводить до вида, так как это облегчает интерпретацию результатов при повторном выделении изолятов (дифференциация истинных возбудителей от контаминантов) и способствует правильному выбору тактики антимикробной терапии. Особенно важно дифференцировать S.bovis от других стрептококков, поскольку его обнаружение в крови у взрослых пациентов вне зависимости от наличия или отсутствия ИЭ может свидетельствовать о сопутствующем опухолевом процессе в ЖКТ, что требует проведения дополнительного обследования, включая колоноскопию (при отрицательном результате проводят повторное исследование через 6 месяцев).
Диагноз ИЭ может быть достоверно установлен либо на основании данных гистологического (и микробиологического) исследования операционного материала или аутопсии, подтверждающих наличие вегетаций или интракардиального абсцесса, либо по совокупности так называемых больших и малых клинических критериев.
Большие критерии
1. Выделение гемокультуры типичных микроорганизмов двукратно (зеленящие стрептококки, S.bovis, НАСЕК, либо внебольничные штаммы S.aureus или энтерококки при отсутствии первичного очага инфекции) или наличие стойкой бактериемии, вызванной другими микроорганизмами и подтвержденной повторным их выделением при посевах крови с интервалом 12 часов и более или положительными результатами посевов (не менее трех), произведенными в течение часа.
2. Наличие очевидных признаков поражения эндокарда по данным эхокардиографии (патологические наложения на клапанах или стенках камер сердца, интракардиальный абсцесс, псевдоаневризма и др.) или на основе выявления вновь обнаруженных симптомов клапанной регургитации (усиление или изменение предшествующих шумов сердца расценивается как неубедительный признак).
Малые критерии
1. Предрасположенность к ИЭ (наличие факторов риска).
2. Наличие лихорадки: >/=38°С.
3. Сосудистые проявления: крупные артериальные эмболы, легочные инфаркты, микотическая аневризма.
4. Иммунологические проявления: гломерулонефрит, узелки Ослера (болезненные эритематозные подкожные узелки вблизи кончиков пальцев), пятна Рота (округлые или овальные повреждения на сетчатке глаза с маленьким белым участком в центре), ревматоидный фактор.
5. Данные эхокардиографии, неоднозначно свидетельствующие о поражении эндокарда.
6. Микробиологические данные: положительный посев крови, не укладывающийся в рамки выше описанного большого критерия (исключая однократное выделение гемокультуры S.epidermidis, скорее всего свидетельствующее о контаминации), или положительные серологические тесты, подтверждающие наличие активного инфекционного процесса, обусловленного микроорганизмами, способными вызвать ИЭ.
Таблица 1. Алгоритмы антимикробной терапии инфекционного эндокардита естественных клапанов
Диагноз ИЭ считается клинически достоверным при наличии 2 больших критериев, или 1 большого и 3 малых, либо 5 малых критериев.
Диагноз ИЭ остается предположительным, если он не укладывается в указанную выше совокупность критериев, а отвергнуть его окончательно недостаточно оснований.
Диагноз ИЭ может быть отвергнут, если имеются подтверждения другого заболевания, объясняющего наблюдаемую у больного симптоматику эндокардита, или происходит разрешение эндокардитического синдрома за 4 и менее дней после начала антимикробной терапии, или в материалах, взятых при операции или аутопсии, отсутствуют патологические изменения уже после 4-дневного курса антибиотикотерапии.
Антибиотикотерапия ИЭ в начале лечения чаще носит эмпирический характер, особенно при остром ИЭ, где промедление с назначением антибиотиков быстро приводит к развитию осложнении и в конечном итоге к летальному исходу. При подостром течении ИЭ без сердечной недостаточности можно дождаться результатов посевов крови, чтобы назначить оптимальную терапию. В таблицах 1 и 2 представлены варианты лечения ИЭ естественных и искусственных клапанов в ожидании результатов посевов крови и при установленной этиологии заболевания.
Таким образом, своевременная и правильная диагностика ИЭ способствует проведению адекватной антимикробнои терапии с учетом этиологии заболевания, а профилактическое применение антибиотиков по показаниям снижает риск развития ИЭ у пациентов группы риска.
Таблицa 2. Алгоритмы антимикробной терапии инфекционного эндокардита искусственных клапанов
| Дополнительные условия | Стандартная терапия | Альтернативная терапия |
| До выделения возбудителя | Ванкомицин 15 мг/кг каждые 12 ч в/в (не более 2 г/день) + рифампицин 600 мг внутрь | При нарастании сердечной недостаточности решать вопрос о хирургическом лечении |
| S.epidermidis | [Ванкомицин (дозы см. выше) + рифампицин 300 мг каждые 8 ч внутрь] 6 нед. + гентамицин 1 мг/кг каждые 8 ч в/в 2 нед. | Если in vitro стафилококк чувствителен к метициллину, ванкомицин заменяют на оксациллин (2 г каждые 4 ч в/в) |
| S.aureus (MS) | (Оксациллин 2 г каждые 4 ч в/в + рифампицин 300 мг каждые 8 ч внутрь) 6 нед. + гентамицин 1 мг/кг каждые 8 ч в/в 2 нед. | |
| S.aureus (MR) | [Ванкомицин в/в + рифампицин внутрь] 6 нед. + гентамицин в/в 2 нед. (дозы см. выше) | |
| S.viridans, Enferococcus | См. таблицу 1. | |
| Enterobacteriacea | В/в [аминогликозиды 1 + антисинегнойные пенициллины 2 (или цефтриаксон 2 г/сут., или ципрофлоксацин 400 мг каждые 12 ч], или тиенам (или меропенем) 0,5 г каждые 6 ч. Продолжительность лечения не менее 4-6 нед. | |
| P.aeruginosa | В/в [тобрамицин 2 мг/кг - ударная доза, затем 1,7 мг/кг каждые 8 ч (или до 7 мг/кг/день однократно) + цефтазидим (или цефепим) 2 г каждые 12 ч (или антисинегнойные пенициллины)] или тиенам (или меропенем) 0,5 г каждые 6 ч. Антибиотикотерапию необходимо сочетать с хирургическим лечением | Теоретически возможна замена тобрамицина на ципрофлоксацин (400 мг каждые 12 ч в/в), однако клинических наблюдений недостаточно. Добавление рифампицина (600 мг каждые 8 ч внутрь к комбинации тобрамицина с антисинегнойными пенициллинами усиливает синергический эффект (Antimicrob. Agents Chemother. 1992; 36: 620-5) |
| Candida, Aspergillus | Амфотерицин В (0,6 мг/кг/день в/в 7 дней, затем 0,8 мг/кг/день 2 раза в нед. 6-10 нед. после операции) + флюконазол 200 мг/день в/в не менее 2 нед. | В связи с высокой смертностью показано хирургическое лечение |
2 Тикарциллин/клавуланат 3,1 г каждые 6 ч; пиперциллин/тазобактам 3,375 г каждые 6 ч.
(MS) -метициллинчувствительные; (MR) - метициллинрезистентные.
После завершения курса антимикробной терапии и исчезновения симптомов ИЭ посев крови не проводят. Однако в случае рецидива заболевания, который чаще возникает на 2-4-й неделе после лечения и характеризуется появлением признаков инфекции, вновь требуется проведение многократных посевов крови.
Хирургическое лечение по восстановлению инфицированного клапана позволяет снизить смертность с 27 до 11% при ИЭ естественных клапанов и с 56 до 23% при ИЭ искусственных клапанов. Его проводят до завершения курса антибиотикотерапии при наличии следующих показаний: застойная сердечная недостаточность вследствие клапанной недостаточности; развитие множественных обширных системных эмболий; ИЭ, вызванный антибиотикоустойчивыми микроорганизмами (грибы, P.aeruginosa); трещина инфицированного искусственного клапана; рецидив ИЭ искусственного клапана; персистирующая бактериемия, не поддающаяся антибиотикотерапии.
Антибиотикопрофилактика ИЭ показана всем пациентам группы риска (наличие искусственного клапана, сопутствующих заболеваний сердца, предрасполагающих к развитию ИЭ, ранее перенесенный ИЭ) при проведении стоматологических процедур, лечебно-диагностических манипуляций с применением катетеров и эндоскопических инструментов, при операциях, затрагивающих слизистую оболочку дыхательных путей, желудочно-кишечного и урогенитального тракта.
При стоматологических процедурах (экстракция зуба, хирургические вмешательства на деснах), на пищеводе (склеротерапия варикозных вен, расширение стриктуры пищевода, эндоскопическая ретроградная холангиография), дыхательных путях (тонзилло- и аденэктомия, жесткая бронхоскопия, операции на слизистых) назначают амоксициллин внутрь (2 г взрослым и 50 мг/кг детям за 1 ч до процедуры) или ампициллин в/м или в/в (в тех же дозах за 30 мин до процедуры). При аллергии на пенициллины назначают внутрь клиндамицин (600 мг взрослым и 20 мг/кг детям) или азитромицин (500 мг взрослым и 15 мг/кг детям) за 1 ч до процедуры. При невозможности приема препарата внутрь назначают клиндамицин в/в (в тех же дозах) или цефазолин в/м, в/в (1 г взрослым и 25 мг/кг детям) за 30 мин до процедуры.
При вмешательствах на ЖКТ (операции на желчных путях, слизистых кишечника) и урогенитальном тракте (операции на простате, цистоскопия, расширение уретры) пациентам группы высокого риска назначают в/в или в/м ампициллин 2 г + гентамицин 1,5 мг/кг (разовая доза не более 120 мг) за 30 мин до вмешательства, затем через 6 ч повторно вводят ампициллин в дозе 1 г. При аллергии на пенициллины назначают ванкомицин 1 г в/в, капельно (продолжительность инфузии 1-2 ч) + гентамицин (дозы указаны выше) за 30 мин до вмешательства. Пациентам группы среднего риска назначают один антибиотик - либо ампициллин, либо ванкомицин (дозы указаны выше).
Читайте также:

