После кишечной инфекции ребенок вялый и слабый плохо ест и пьет
Обновлено: 23.04.2024
Острые кишечные инфекции (ОКИ) — это большая группа инфекционных заболеваний человека с энтеральным механизмом заражения, вызываемых патогенными и условно-патогенными бактериями, вирусами или простейшими
Острые кишечные инфекции (ОКИ) — это большая группа инфекционных заболеваний человека с энтеральным (фекально-оральным) механизмом заражения, вызываемых патогенными (шигеллы, сальмонеллы и др.) и условно-патогенными бактериями (протеи, клебсиеллы, клостридии и др.), вирусами (рота-, астро-, адено-, калицивирусы) или простейшими (амеба дизентерийная, криптоспоридии, балантидия коли и др.).
Ведущим компонентом терапии ОКИ является рациональное лечебное питание, адаптированное к возрасту ребенка, характеру предшествующего заболевания и вскармливания.
Цель диетотерапии — уменьшение воспалительных изменений в желудочно-кишечном тракте, нормализация функциональной активности и процессов пищеварения, максимальное щажение слизистой оболочки кишечника.
Основные требования к диете при ОКИ:
включение в диеты низко- и безлактозных продуктов и кисломолочных продуктов, обогащенных бифидо- и лактобактериями;
снижение объема пищи в первые дни болезни на 15–20% (при тяжелых формах до 50%) от физиологической потребности;
Из диеты исключаются стимуляторы перистальтики кишечника, продукты и блюда, усиливающие процессы брожения и гниения в кишечнике: сырые, кислые ягоды и фрукты, соки, сырые овощи, сливочное и растительные масла (в чистом виде), сладости, свежая выпечка. Не следует давать бобовые, свеклу, огурцы, квашеную капусту, редис, апельсины, груши, мандарины, сливы, виноград. Не рекомендуется овсяная крупа, так как она усиливает бродильные процессы. Должны быть исключены из питания жирные сорта мясных и рыбных продуктов (свинина, баранина, гусь, утка, лосось и др.).
Цельное молоко в остром периоде кишечных инфекций назначать не следует, так как оно усиливает перистальтику кишечника и бродильные процессы в результате нарушения расщепления молочного сахара (лактозы), что сопровождается усилением водянистой диареи и вздутием живота.
В первые дни заболевания исключается также черный хлеб, способствующий усилению перистальтики кишечника и учащению стула.
При уменьшении проявлений интоксикации, прекращении рвоты и улучшении аппетита вводится творог, мясо (говядина, телятина, индейка, кролик в виде котлет, фрикаделек, кнелей), рыба нежирных сортов, яичный желток и паровой омлет. Разрешаются тонко нарезанные сухари из белого хлеба, каши на воде (кроме пшенной и перловой), супы слизистые, крупяные с разваренной вермишелью на слабом мясном бульоне.
В остром периоде заболевания рекомендуется использовать молочнокислые продукты (кефир, ацидофильные смеси и др.). Молочнокислые продукты за счет активного действия содержащихся в них лактобактерий, бифидобактерий, конечных продуктов протеолиза казеина (аминокислот и пептидов, глутаминовой кислоты, треонина и др.), увеличенного количества витаминов В, С и др. способствуют улучшению процессов пищеварения и усвоению пищи, оказывают стимулирующее влияние на секреторную и моторную функции кишечника, улучшают усвоение азота, солей кальция и жира. Кроме того, кефир обладает антитоксическим и бактерицидным действием на патогенную и условно-патогенную флору за счет наличия молочной кислоты и лактобактерий. Однако длительное применение только кефира или других молочнокислых смесей нецелесообразно, поскольку эти продукты бедны белками и жирами. Лечебным кисломолочным продуктом является Лактофидус — низколактозный продукт, обогащенный бифидобактериями.
При лечении детей с ОКИ в периоде выздоровления необходимо широко использовать плодово-овощные продукты (яблоки, морковь, картофель и др.), так как они содержат большое количество пектина. Пектин — коллоид, обладающий способностью связывать воду и набухать, образуя пенистую массу, которая, проходя по кишечному тракту, адсорбирует остатки пищевых веществ, бактерий, токсических продуктов. В кислой среде от пектина легко отщепляется кальций, оказывая противовоспалительное действие на слизистую оболочку кишечника. Фрукты и овощи содержат органические кислоты, обладающие бактерицидным действием, а также большое количество витаминов, глюкозу, фруктозу, каротин и др. Применение вареных овощей и печеных фруктов уже в остром периоде кишечных инфекций способствует более быстрому исчезновению интоксикации, нормализации стула и выздоровлению.
Питание детей грудного возраста
В последнее время в клинике кишечных инфекций предпочтение отдается назначению детям, находящимся на искусственном вскармливании, низко- и безлактозных смесей (Низколактозный Нутрилон, Фрисопеп, Хумана ЛП+СЦТ, соевые смеси). При тяжелых формах ОКИ и развитии гипотрофии широко используются гидролизованные смеси (Нутрилон Пепти ТСЦ, Нутримиген, Алфаре, Прегестимил и др.), способствующие быстрому восстановлению процессов секреции и всасывания в кишечнике и усвоению белков, жиров и углеводов, что предупреждает развитие ферментопатии в исходе кишечной инфекции (табл).
По нашим данным, в результате клинико-лабораторной оценки влияния низколактозных смесей на клиническую картину и состояние микробиоценоза кишечника при вирусных диареях у детей раннего возраста был получен положительный эффект стимуляции функциональной активности нормальной и, в первую очередь, сахаролитической микрофлоры (по стабилизации показателей уксусной, масляной и пропионовой кислот), а также регулирующее влияние на процессы метаболизма углеводов и жиров в острый период заболевания. Клинический эффект заключался в быстром и стойком купировании основных проявлений болезни: рвоты, диареи, абдоминального синдрома и эксикоза, что наряду с хорошей переносимостью позволило рекомендовать низколактозные смеси для использования в качестве лечебного питания у детей раннего возраста в острый период кишечных инфекций вирусной этиологии.
При разгрузке в питании ежедневно объем пищи увеличивается на 20–30 мл на одно кормление и соответственно изменяется кратность кормлений, то есть увеличивается интервал между кормлениями. При положительной динамике заболеваний и улучшении аппетита необходимо довести суточный объем пищи до физиологической потребности не позднее 3–5 дня от начала лечения.
Детям 5–6 месяцев при улучшении состояния и положительной динамике со стороны желудочно-кишечного тракта назначается прикорм кашей, приготовленной из рисовой, манной, гречневой круп на половинном молоке (или воде при ротавирусной инфекции). Кашу назначают в количестве 50–100–150 г в зависимости от возраста ребенка и способа вскармливания до заболевания. Через несколько дней добавляют к этому прикорму 10–20 г творога, приготовленного из кипяченого молока, а затем — овощные пюре, ягодный или фруктовый кисель в количестве 50–100–150 мл, соки.
Питание детей 7–8 месяцев должно быть более разнообразным. При улучшении состояния им назначают не только каши, творог и кисели, но и овощные пюре, желток куриного яйца на 1/2 или 1/4 части, затем бульоны, овощной суп и мясной фарш. В каши и овощное пюре разрешается добавлять сливочное масло. Желток (яйцо должно быть сварено вкрутую) можно давать отдельно или добавлять его в кашу, овощное пюре, суп.
Питание детей старше года строится по такому же принципу, как и у детей грудного возраста. Увеличивается лишь разовый объем пищи и быстрее включаются в рацион продукты, рекомендуемые для питания здоровых детей этого возраста. В остром периоде болезни, особенно при наличии частой рвоты, следует провести разгрузку в питании. В первый день ребенку назначают кефир по 100–150–200 мл (в зависимости от возраста) через 3–3,5 часа. Затем переходят на питание, соответствующее возрасту, но с исключением запрещенных продуктов. В остром периоде заболевания всю пищу дают в протертом виде, применяется паровое приготовление вторых блюд. Крупу для приготовления каши и гарнира, овощи разваривают до мягкости. Набор продуктов должен быть разнообразным и содержать кисломолочные смеси, кефир, творог, сливки, сливочное масло, супы, мясо, рыбу, яйца, картофель, свежие овощи и фрукты. Можно пользоваться овощными и фруктовыми консервами для детского питания. Из рациона исключают продукты, богатые клетчаткой и вызывающие метеоризм (бобовые, свекла, репа, ржаной хлеб, огурцы и др.). Рекомендуются арбузы, черника, лимоны, кисели из различных ягод, желе, компоты, муссы, в которые желательно добавлять свежевыделенный сок из клюквы, лимона.
Правильно организованное питание ребенка с кишечной инфекцией с первых дней заболевания является одним из основных условий гладкого течения заболевания и быстрого выздоровления. Неадекватное питание и погрешности в диете могут ухудшить состояние ребенка, равно как и длительные ограничения в питании. Важно помнить, что на всех этапах лечения ОКИ необходимо стремиться к полноценному физиологическому питанию с учетом возраста и функционального состояния желудочно-кишечного тракта ребенка.
Значительные трудности в диетотерапии возникают у детей с развитием постинфекционной ферментопатии, которая развивается в разные сроки заболевания и характеризуется нарушением переваривания и всасывания пищи вследствие недостатка ферментов.
При ОКИ, особенно при сальмонеллезе, кампилобактериозе, протекающих с реактивным панкреатитом, наблюдается нарушение всасывания жира и появление стеатореи — стул обильный с блеском, светло-серый с неприятным запахом. Диетотерапия при стеаторее проводится с ограничением жира в рационе, но не более 3–4 мг/кг массы тела в сутки для детей первого года жизни. Это достигается путем замены части молочных продуктов специализированными низкожировыми продуктами (Ацидолакт) и смесями зарубежного производства, в состав которых в качестве жирового компонента входят среднецепочечные триглицериды, практически не нуждающиеся в панкреатической липазе для усвоения (Нутрилон Пепти ТСЦ, Хумана ЛП+СЦТ, Алфаре, Прегестимил, Фрисопеп и др.). При появлении признаков острого панкреатита из рациона исключают свежие фрукты, ягоды, овощи, концентрированные фруктовые соки на срок до 1 мес.
При лактазной недостаточности рекомендуется использование адаптированных низколактозных смесей (Низколактозный Нутрилон, Фрисопеп, Хумана ЛП+СЦТ и др.) или соевых смесей (Нутрилон Соя, Фрисосой, Хумана СЛ, Симилак Изомил, Энфамил Соя и др.). При их отсутствии — 3-суточный кефир; детям первых трех месяцев жизни можно давать смесь типа В-кефир, состоящую из 1/3 рисового отвара и 2/3 3-суточного кефира с добавлением 5% сахара (глюкозы, фруктозы), 10% каши на воде, овощных отварах.
В качестве прикорма этим больным дают безмолочные каши и овощные пюре на воде с растительным или сливочным маслом, отмытый от сыворотки творог, мясное пюре, печеное яблоко. Схемы введения прикормов могут быть индивидуализированы, следует обратить внимание на раннее назначение мясного (суточная доза в 3–4 приема). Избегают применения сладких фруктовых соков, продуктов, повышающих газообразование в кишечнике и усиливающих перистальтику (ржаной хлеб, белокочанная капуста, свекла и другие овощи с грубой клетчаткой, кожура фруктов, чернослив, сухофрукты). Длительность соблюдения низколактозной диеты индивидуальна — от 1,5–2 до 6 месяцев.
После тяжелых кишечных инфекций может возникнуть непереносимость не только лактозы, но и других дисахаридов, реже — полная углеводная интолерантность (глюкозо-галактозная мальабсорбция), при которой у больных отмечается выраженная диарея, усиливающаяся при применении смесей и продуктов, содержащих дисахариды, моносахариды и крахмал (молочные и соевые смеси, крупы и практически все фрукты и овощи). Это чрезвычайно тяжелое состояние, приводящее к обезвоживанию и прогрессирующей дистрофии, требует строгого безуглеводного питания и парентерального введения глюкозы или полного парентерального питания. В отдельных случаях возможно пероральное введение фруктозы. При индивидуальной переносимости в диете сохраняются белок и жиросодержащие продукты: нежирное мясо — индейка, конина, говядина, кролик, растительное масло, ограниченный ассортимент овощей с низким содержанием сахарозы и глюкозы — цветная и брюссельская капуста, шпинат, стручковая фасоль, салат.
Дефицит белка возникает за счет нарушения утилизации, всасывания либо за счет потери эндогенного белка, особенно у детей с исходной гипотрофией. Коррекция потерь белка проводится путем назначения гидролизованных смесей (Нутрилон Пепти ТСЦ, Нутримиген, Алфаре, Прегестимил, Фрисопеп и др.).
При длительных постинфекционных диареях, особенно у детей, получавших повторные курсы антибактериальных препаратов, возможно развитие вторичной пищевой аллергии, сопровождающейся сенсибилизацией к белкам коровьего молока, реже — к яичному протеину, белкам злаковых культур. Такие нарушения могут возникать не только у детей с аллергическим диатезом, но и у больных без отягощенного преморбидного фона. Клинически постинфекционная пищевая аллергия проявляется гиперчувствительностью к ранее хорошо переносимым продуктам — молочным смесям, молочным кашам, творогу и др. У детей отмечаются боли в животе, вздутие после кормления, срыгивания, жидкий стул с мутной стекловидной слизью, иногда с прожилками крови, при копрологическом исследовании в кале обнаруживаются эозинофилы. Характерна остановка прибавки массы тела, вплоть до развития гипотрофии.
При выявлении аллергии к белкам коровьего молока в питании детей первого года жизни используются смеси на соевой основе (Нутрилак Соя, Нутрилон Соя, Фрисосой, Хумана СЛ, Энфамил Соя и др.) и на основе гидролизатов белка (Нутрилон Пепти ТСЦ, Нутримиген, Прегестимил, Фрисопеп и др.).
Отсутствие специализированных продуктов не является непреодолимым препятствием в организации безмолочного рациона. Элиминационная диета в этом случае составляется на основе безмолочных протертых каш (рисовой, гречневой, кукурузной), фруктовых и овощных пюре, картофеля, кабачков, цветной капусты, тыквы, из печеного яблока, банана, растительного и сливочного масла, мясного пюре. При этом необходимо учитывать физиологические потребности ребенка в основных пищевых веществах и энергии. Мясное пюре, как основной источник белка, при отсутствии специализированных смесей можно назначать с 2–3-месячного возраста. Предпочтительно использовать конину, мясо кролика, птицы, постную свинину, а также диетические мясные консервы — Конек-Горбунок, Чебурашка, Петушок, Пюре из свинины и др.
У детей старше года принцип составления рациона тот же. При назначении безмолочной диеты необходимо полностью компенсировать недостающее количество животного белка протеинами мяса, соевых смесей, а также исключить из диеты продукты, обладающие повышенной сенсибилизирующей активностью (шоколад, рыба, цитрусовые, морковь, свекла, красные яблоки, абрикосы и другие плоды оранжевой или красной окраски, орехи, мед). При постинфекционной пищевой аллергии срок соблюдения указанной диеты составляет не менее 3 месяцев, а чаще — от 6 до 12 месяцев. Эффект от элиминационной диеты оценивается по исчезновению симптомов заболевания, прибавке массы тела, нормализации стула.
Л. Н. Мазанкова, доктор медицинских наук, профессор Н. О. Ильина, кандидат медицинских наук Л. В. Бегиашвили РМАПО, Москва
На сервисе СпросиВрача доступна консультация педиатра онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Здравствуйте, Олеся. Как правило, улучшение при вирусных кишечных инфекциях наступает к 3-5 дню заболевания. Но при ротавирусной инфекции возможно волнообразное течение (после улучшения снова ухудшение). Питьевой режим и диету следует соблюдать не менее 7 дней от начала заболевания. Давать Регидрон Био можно без ограничения, но если ребёнок его пьёт плохо, следует выпаивать обычной водой. За счёт того, что в первые дни заболевания пила мало слабость и вялость может сохраняться до 7 дней, так как потери жидкости были значительные (повышенная температура, рвота, понос). При ухудшении состояния необходим очный осмотр педиатра. Желаю скорейшего выздоровления.

Здравствуйте. Такое бывает после перенесенной кишечной инфекции. Можете взять полоски для определения ацетона в моче. Возможно, незначительно повышен ацетон. Когда падает в крови глюкоза, организм начинает расщеплять жиры., в результате образуются кетоны. Сейчас главная задача- отпаивать ребенка. В первую очередь необходимо предложить сладкий напиток. Ребенок в 3 года должен пить 1300 мл воды в сутки. В это число входят солевые растворы, сладкие напитки, питьевая вода. Солевые растворы-около 400-500 мл. Сладкие напитки- компоты или чай с сахаром. Пить небольшими порциями по 1-2 глотка, чтобы не вызвать рвоту.Каждые 10-15 мин. Можно поить с помощью шприца от Нурофена. Количество выпитой жидкости- записывайте. Выпил ребенок 10 мл- записали. Выздоравливайте.
Гульназ, Здравствуйте! Спасибо большое. Тест полоски делали, кетоновые тела фиолетовые, и ацетоном пахнет изо рта. Но раньше при рвоте или поносе так же было, беспокоит, что вялая и сонная такая сейчас. Но пьёт много. Только воду и регидрон био. Сейчас приготовлю компот. Как раз шприцем от нурофена отпаиваю. Подскажите пожалуйста, какие лучше фрукты брать для компота, в такой ситуации?

Любые сладкие можно брать. Яблоки, сухофрукты.Можно чай с сахаром. Главное, не заменяйте сахар во время болезни медом или просто фруктами.
Болезнь имеет несколько названий: ротавирусный гастроэнтерит, желудочный или кишечный грипп, ротавирусная инфекция. Носит бактериальный характер. Болит живот после ротавируса у ребенка именно из-за бактерий. Инкубационный период длится до 5 суток. Взрослый или ребенок, заразившийся этим заболеванием, считается разносчиком инфекции на протяжении всего периода начиная с момента заражения до полного выздоровления. Длительность протекания болезни зависит от возраста и возможностей организма. Взрослые переносят ее легче, выздоровление при должной терапии у них наступает уже на седьмые сутки.
Как протекает болезнь
Несмотря на то, что ротавирус считается кишечной инфекцией, он начинает поражать организм человека с верхних дыхательных путей. Наблюдается чаще у детей до 5 лет. Именно в этот период иммунная система легко подвергается воздействию вируса, поэтому дети болеют данным заболеванием чаще, чем взрослые. Ротавирус поражает слизистые оболочки кишечника, желудка и двенадцатиперстной кишки, вызывая расстройства и обезвоживание.
Вирус, попадая в организм ребенка, может на протяжении первых 5 суток (инкубационный период) никак себя не проявлять. После наступает стадия обострения и в этот период начинают проявляться первые признаки. Ребенок начинает беспокоиться, плакать безо всякой, на первый взгляд, причины. Особенно плохо бывает ему в первые сутки.
Вместе с каловыми массами выходят возбудители болезни, поэтому заболевший считается разносчиком инфекции для всех членов семьи и окружающих.

Длится это на протяжении недели и только по истечении этого срока он перестает быть заразным. Пройдя лечение, требуется восстановление после ротавирусной инфекции у детей. Только после этого ребенка можно отпускать в школу или садик, но при условии, что у него не наблюдается рецидив.
Симптомы кишечного гриппа у взрослых людей
Взрослый человек переносит это заболевание намного легче. У него симптоматика не так явно выражается. В некоторых случаях болезнь вообще не выражается никакими признаками. У взрослого болезнь можно распознать по следующим симптомам:
- отсутствие аппетита;
- болит желудок;
- диарея;
- светлый кал, пенистый и обильный с наличием непереваренной пищи, резким и кислым запахом.
Рвота у взрослого чаще всего отсутствует вообще. Как видно, симптомы кишечного гриппа можно легко спутать с традиционным отравлением. Поэтому очень важно понять причины появления этих симптомов и если диагноз подтверждает наличие рассматриваемой инфекции, то очень важно знать, как правильно лечить болезнь, еще важнее, как восстановиться после ротавирусной инфекции.
Обычное отравление длится не дольше трех суток, ротавирусная инфекция до пяти дней, а иногда и до восьми.
Ротавирус у детей
Признаки болезни у детей носят ярко выраженный характер, причем с первых дней развития болезни:

- ребенок ничего не ест;
- у него наблюдается рвота;
- ребенок вялый, сонливый, беспокойный, не хочет гулять
- наблюдается высыпание на кожном покрове;
- стул меняет консистенцию и цвет: в первые сутки желтый и жидкий, на вторые и последующие желто-серый .
Может наблюдаться покраснение горла, насморк, высокая температура и сбить ее очень сложно.
Очень маленькие дети, в отличие от взрослого, не могут пояснить, что именно их беспокоит, поэтому становятся излишне нервозными и плаксивыми. Явным признаком наличия ротавируса можно считать урчание в желудке и вялость. Дети до годика в этот момент прижимают к себе ноги и сильно плачут.
Особенности лечения пациента с ротавирусной инфекцией
Больные с ярко выраженной симптоматикой лечатся в стационаре. В случае когда заболевание носит не тяжелый характер, пациент может лечиться амбулаторно, но под строгим наблюдением врачей. Терапия не предусматривает прием антибактериальных препаратов, потому что ротавирус нечувствителен к антибиотикам. Их врач не назначает еще и потому, что антибиотики считаются препаратами широкого действия, кроме того, что убивают патогенные бактерии, уничтожают и полезную кишечную флору. Все это влечет нарушения в иммунной системе и быстрому распространению вируса.
Антибактериальные медпрепараты назначаются лишь в тех случаях, когда заражение вирусом произошло на фоне бактериального инфицирования, например, когда появляется у ребенка кашель после ротавируса.
Выведение токсинов
С этой целью пациентам, у которых диагностирован кишечный грипп, назначают:

- Смекту. Для детей – в первые 3 дня принимать по 4, затем по 2 пакетика в день. Терапевтический курс составляет 5-17 дней. Состав пакетика разводят в 0,5 стакана воды. Взрослому – до 6 пакетиков в день. Длительность лечения 5-7 суток.
- Энтеросгель. Детям по столовой ложке трижды в день. Принимать средство следует за 60 минут до еды, запив большим количеством жидкости. Взрослым 1,5 ч, л. тоже трижды в день перед едой.
Полезно принимать и активированный уголь. Препарат хорошо чистит организм от патогенных микробов и токсинов.
Восстановление микрофлоры кишечника после ротавирусной инфекции
Чтобы восстановить естественную микрофлору пациенту назначаются максилак, бифидумбактерин, линекс. Прием препаратов показан, когда острая стадия развития болезни уже миновала.
Восстанавливать кишечную микрофлору вовремя нужно для того, чтобы у переболевшего не развился дисбактериоз.
Максилак
Относится к группе комбинированных препаратов. В состав средства входят про- и пребиотики. Показан и детям, и взрослым. Помогает в случаях, когда наблюдается, например, запор у ребенка. Выпускается в пакетиках, содержимое легко растворяется в воде. Принимать дважды в день по пакетику на протяжении 14 суток.
Бифидумбактерин-форте
Выпускается в виде капсул или в порошке. Содержит полезные бифидобактерии. Детям показано принимать по пакетику или капсуле трижды в день, взрослым доза удваивается. Капсулы нужно проглатывать целыми, запив водой. Порошок разводить в жидкости и принимать вместе с едой.
Линекс
Состоит из кисломолочных бактерий, хорошо восстанавливает природную микрофлору в кишечнике, помогает в случаях, когда ребенок не какает или, наоборот, у него наблюдается диарея. Детям следует принимать по капсуле трижды в день, взрослым – две капсулы и также трижды в сутки.
Какой врач лечит кишечный грипп

Самостоятельно устанавливать схему лечения и выбирать препараты запрещено. Это должен делать педиатр для детей, участковый терапевт для взрослых (при легких формах течения). По сути, болезнь лечит инфекционист и гастроэнтеролог. После основной терапии нужно пройти курс восстановления. В этот период следует обращаться к диетологу.
Диета и ее роль в лечении ротавирусной инфекции
Диета после ротовируса помогает восстановить кишечник:
- Исключение из рациона молока и молочных блюд, кроме материнского, если ребенок слишком маленький. На время заменить его простой водой или травяными чаями. С мятой — для устранения тошноты, с имбирем — если болит живот после ротавируса у ребенка.
- Блюда должны быть легкими и полезными, например: супы, бульоны, пюре из картофеля, соки из овощей. Если ребенок пошел на поправку, можно в меню вводить йогурт для восстановления кишечной флоры.
- Взрослым следует придерживаться диеты №4. В нее входит потребление сухарей из белых сортов хлеба, рыба, бульоны, приготовленные на воде, манная и рисовая каши. Соль нужно вовсе исключить на время лечения.
- Из питья рекомендованы: простая вода, отвары и чаи из черной смородины или малины, какао не на молоке, а на воде.
- После уменьшения диареи, когда пройдет у ребенка сыпь после ротавируса, можно в рацион включать овощные блюда, супы, сезонные фрукты, овощи и ягоды.
- На период терапии нужно напрочь отказаться от ячневой и перловой каш, капусты (белокочанной), макарон, чеснока, копченостей, солений, лука, жирных блюд, газированных напитков, острых приправ, кофе.
Профилактические мероприятия
Прежде всего обработать квартиру дезинфицирующим средством, строго следить за личной гигиеной, мыть руки:
- до еды и после;
- перед визитом в туалет и после него;
- по возвращении домой с улицы.
Помимо гигиены, нужно следить за свежестью, чистотой и качеством продуктов питания – яблоки, например, не просто вытирать, а мыть. Обработать игрушки, если имеется несколько детей и один из них заболел.
Молочную продукцию покупать свежую и в магазинах, а не на стихийных точках.
Возможно ли повторное заражение вирусом

Заразиться можно после выздоровления и неоднократно. Чаще заражаются дети. Дальше, по мере взросления, у них ЖКТ становится более устойчивый к бактериям. Поэтому и болеют взрослые намного реже, чем дети. Правда, многое зависит от резервных сил организма, индивидуальных особенностей пищеварительной системы.
Прививка против ротавируса
Действенный и целесообразный метод профилактики против ротавируса – вакцинация. У детей с прививкой вырабатывается стойкий иммунитет к вирусу. Вакцинация осуществляется в два этапа с промежутком в 4 недели. Выпускается в капельной форме, принимается перорально под наблюдением медика.
Вакцину от ротавируса можно сочетать с иными прививками (ближайшими по плану). Она никоим образом не действует на результативность других медпрепаратов, поэтому не может быть причиной проявления побочных эффектов.
Есть ряд противопоказаний к вакцинации:
- Аллергическая реакция (высыпание) после первого приема препарата.
- Инвагинация кишечника.
- Дефекты в развитии кишечника.
Вакцина переносится детьми хорошо, не вызывает побочных эффектов, за исключением индивидуальной непереносимости препарата. Вакцинация не считается стопроцентной защитой, но эффективность ее длительное время остается высокой.
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых кли
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых клинических признаков болезни. В этот период происходит мобилизация защитных сил организма, направленных на компенсацию возможных нарушений, на уничтожение болезнетворных агентов и удаление их из организма. Продромальный период представляет собой временной интервал от первых симптомов заболевания до полного проявления. Период выраженных проявлений заболевания характеризуется полным развитием клинической картины. При различных инфекционных заболеваниях может страдать нервная система ребенка, что клинически проявляется синдромом нейротоксикоза. Нейротоксикоз — ответная неспецифическая реакция детского организма на воздействие вирусной, бактериальной или вирусно-бактериальной флоры, характеризующаяся преимущественным поражением центральной (ЦНС) и вегетативной нервной системы. С истощением функциональных возможностей органов и систем в результате перенесенного заболевания, особенно нервной системы при ее перенапряжении, а также вследствие аутоинтоксикации или экзогенного токсикоза связывают возникновение астенического синдрома. Это наиболее частое клиническое проявление периода реконвалесценции. Утомление в течение длительного времени, которое не компенсируется полным восстановлением, вызывает синдром перегрузки, следом за которым развивается состояние истощения. Субъективно ощущаемое чувство утомления — прежде всего сигнал о перегрузке центральных регуляторных систем, неудовлетворительном состоянии энергетических ресурсов организма и аутоинтоксикации продуктами метаболизма. Длительное утомление, приводящее к истощению, по сути своей является результатом стрессорного воздействия на организм, вызывающего нарушение функций регуляторных систем — вегетативной, эндокринной и иммунной. Если стрессорные факторы действуют в течение длительного времени, может развиться реакция организма, при которой возможны функциональные изменения в виде вегетативной дисфункции [1, 6]. Синдром вегетативной дисфункции (СВД) включает в себя проявление всех форм нарушения вегетативной регуляции. Наряду с соматическими проявлениями: головокружением, головными болями, сердцебиением, одышкой, жаждой, булимией, рвотой после еды, непереносимостью отдельных видов пищи, субфебрилитетом неясного происхождения, кожными высыпаниями и др., у пациентов с СВД выявляют эмоциональные расстройства разной степени выраженности в виде тревожности, нарушения сна, беспричинного плача, а также расстройства поведения, в частности, импульсивности, повышенной двигательной активности и возбудимости, дефицита внимания, что клинически определяется как астеновегетативный или психовегетативный синдром [Вейн А. М., 1981].
Интерес и сложность проблемы астеновегетативного синдрома заключается в том, что она является комплексной: медицинской, психологической и педагогической. Однако все специалисты сходятся в том, что такое состояние существует, его необходимо диагностировать и правильно корректировать.
Задачи исследования
Данное исследование посвящено изучению динамики состояния вегетативной нервной системы детей с астеновегетативным синдромом после перенесенных инфекционных заболеваний, а также оценке эффективности препарата Тенотен детский при названной патологии.
Тенотен детский содержит сверхмалые дозы антител к мозгоспецифическому белку S-100, создан по особой технологии специально для детского возраста, оказывает успокаивающее, нормализующее настроение и поведение действие, а также выраженное вегетостабилизирующий эффект [3, 5].
Критерии включения больных в исследование:
Критерии исключения больных из исследования:
Наличие декомпенсированных заболеваний или острых состояний, которые могут влиять на проведение исследования.
Применение вегетотропных и ноотропных препаратов в период исследования и в последние две недели перед исследованием.
Участие в других клинических исследованиях в течение четырех недель перед включением в данное исследование.
Материал исследования
Для исследования методом случайной выборки дети были распределены в две группы. В основной группе (30 человек) дети в периоде реконвалесценции наряду с симптоматической витаминотерапией получали Тенотен детский по 1 таблетке 3 раза в день в течение 4 недель в сочетании со стандартной терапией. В контрольную группу (20 человек) вошли дети, получавшие стандартную витаминотерапию и симптоматическую терапию за исключением препаратов, обладающих вегетотропной активностью.
Достоверных различий по половозрастным показателям между основной и контрольной группами детей не было.
По спектру перенесенных заболеваний, их тяжести, характеру осложнений выделенные группы детей также значительно не отличались. Спектр заболеваний включал вирусные и вирусно-бактериальные инфекции дыхательных путей (этиологически подтвержденные формы гриппа и другие респираторные вирусные инфекции, тяжелые формы бронхитов и пневмоний и др.), острые средние отиты, тяжелые и осложненные формы инфекционного мононуклеоза, висцеральные формы ветряной оспы, протекающие с нейротоксикозом и везикулезными высыпаниями на внутренних органах. Данные о заболеваниях приведены в таблице.
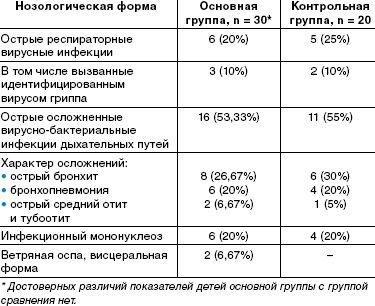
Диагностическое обследование включало в себя клиническую оценку проявлений вегетативной дисфункции, психологическое исследование, неврологическое обследование, электрокардиографию (ЭКГ).
Состояние вегетативной нервной системы определялось по исходному вегетативному тонусу, вегетативной реактивности и вегетативному обеспечению деятельности. Исходный вегетативный тонус, характеризующий направленность функционирования вегетативной нервной системы в состоянии покоя, оценивался по анализу субъективных жалоб и объективных параметров. Оценивалась степень выраженности психопатологических проявлений: утомляемость, тревожность, эмоциональная неустойчивость и др. (модифицированный опросник А. М. Вейна). Определялся внутрисистемный вегетативный тонус по индексу Кердо и межсистемный вегетативный тонус по коэффициенту Хильдебранта. Для оценки вегетативного обеспечения деятельности, отражающего в основном состояние автономной системы регуляции, проводилась клиноортостатическая проба (КОП). Функциональное состояние сердечно-сосудистой системы рассматривалось также на основании данных электрокардиографии.
Уровень внимания оценивался с использованием шкалы SNAP-IV, таблиц Шульте, по результатам модифицированного метода Пьерона–Рузерапо. Выявление расстройств кратковременной и долговременной памяти, косвенно отражающей выраженность астении, проводилось с помощью методики 10 слов и пиктограммы.
Для определения состояния эмоциональной сферы обследуемых (тревоги, депрессии) использовался ахроматический и цветовой тесты Люшера.
После окончания лечения всем детям было проведено повторное комплексное обследование для оценки эффективности терапии. Кроме того, родителям детей предлагалось оценить результаты лечения при помощи десятибалльной аналого-визуальной шкалы, где 0 — это очень плохая оценка, 10 — очень хорошая.
Результаты исследования
Перед началом исследования у всех обследуемых детей (без достоверных различий в обеих группах) с помощью опросника А. М. Вейна определялись умеренно выраженные психопатологические расстройства, в виде неустойчивости эмоционального фона (84%), повышенной тревожности (34%), утомляемости (38%), отвлекаемости (86%), нарушений сна (74%), снижения памяти, а также различные соматические проявления в виде периодических головных болей (52%), головокружения (24%), метеозависимости (12%), снижения аппетита (64%), диспептических нарушений в виде тошноты, рвоты, вздутия живота (44%).
Индекс Кердо позволил определить наличие внутрисистемной дистонии у детей, перенесших тяжелые инфекционные заболевания, он составил в среднем 32,89 ± 0,99 в обеих исследованных группах, что свидетельствовало о превалировании симпатических влияний на организм в покое.
Межсистемный вегетативный тонус, оцениваемый с помощью коэффициента Хильдебранта (средние значения составили 3,98 ± 0,03), имел, в основном, эйтонический характер.
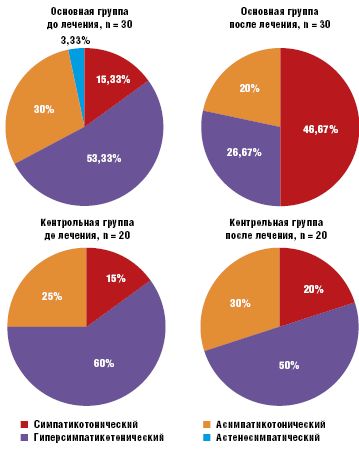
КОП, определяющая вегетативное обеспечение автономной системы регуляции, наряду с нормальным симпатикотоническим вариантом КОП, отражающим устойчивость гемодинамики в ортостазе (14% случаев), выявила и патологические варианты. Гиперсимпатикотонический вариант КОП, характеризующийся резким повышением систолического артериального давления (САД) и диастолического артериального давления (ДАД) и частоты сердечных сокращений (ЧСС) и обусловленный избыточным включением симпатико-адреналовой системы, встречался в преобладающем количестве случаев — у 58% детей. Асимпатикотонический вариант КОП, обусловленный недостаточным подключением симпатического отдела вегетативной нервной системы, при котором САД и ДАД не изменяются или падают, ЧСС остается нормальной или компенсаторно увеличивается, встречался у 28% детей с СВД. Астеносимпатический вариант КОП с падением САД и ДАД и резким увеличением ЧСС в первые минуты ортостаза, с последующей гиперсимпатикотонической реакцией был выявлен в 2% случаев.
Основными психопатологическими проявлениями СВД являлись невнимательность, гиперактивность, импульсивность. Их оценка производилась с помощью шкалы-опросника SNAP-IV (Swanson J., 1992). Показатель невнимательности в двух группах по этой шкале достоверно не отличался и составил в среднем 53,33% (норма (Swanson J., 1992) — 0,40–1,82), средний показатель гиперактивности — 1,96 ± 0,32 (норма (Swanson J., 1992) — 0,27–1,59) и импульсивности 2,13 ± 0,37 (норма (Swanson J., 1992) — 0,26–1,52) (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Выраженность астении косвенно отражается на интеллектуально-мнестических показателях, в частности на оперативной памяти: чем выше утомляемость ребенка в период после перенесенного инфекционного заболевания, тем больше страдает процесс запоминания. Оценка памяти у детей проводилась с помощью методики запоминания десяти слов. Регистрировались следующие показатели: 1) количество повторений, необходимых для воспроизведения 10 слов; 2) количество слов, воспроизведенных через 1 час.
В большинстве случаев обследуемым обеих групп (достоверных различий показателей детей основной группы с группой сравнения нет) для воспроизведения 10 слов требовалось 3 и более повторений, что свидетельствовало о снижении показателей механического запоминания. В то же время количество воспроизводимых слов через час после начала исследования значительно снизилось, что явилось признаком нарушения динамической памяти у детей с вегетативной дистонией.
В качестве методики для исследования опосредованного запоминания использовалась пиктограмма. Регистрировались следующие показатели: 1) количество воспроизведенных понятий; 2) динамика воспроизведенных понятий через 1 час.
Оценка результатов пиктограмм в целом показала, что у детей с СВД дистонией изображаемые образы часто не соответствовали реальным объектам, что впоследствии затрудняло их интерпретацию. Показатели по критерию адекватности (обоснованности связи между предложенным понятием и его пиктограммой) в среднем составили около 50%.
Проведенное по методике Люшера тестирование отразило статистически значимое отклонение преимущественно выбираемой обследуемыми цветовой гаммы от аутогенной нормы. В то же время величина вегетативного показателя не имела столь значимых различий по сравнению с возрастными нормами. Среднестатистические показатели тревожности и напряжения, определенные с помощью теста Люшера, также не имели значительных отклонений от стандартных показателей (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Таким образом, проведенное клиническое обследование детей, перенесших инфекционные заболевания, выявило наличие у них различной степени выраженности проявлений СВД. Безусловно, такие психовегетативные нарушения отражались на периоде реконвалесценции, ухудшали качество жизни и требовали их адекватной коррекции.
В качестве альтернативного препарата для коррекции проявлений СВД был использован Тенотен детский с успокаивающим и выраженным вегетостабилизирующим действием (Лобов М. А., 2008). Основная группа детей (30 человек) получала Тенотен в дозе 3 таблетки/сутки курсом 1 месяц в сочетании со стандартной витаминотерапией. Контрольная группа детей (20 человек) получала стандартную терапию с применением лекарственных средств, не обладающих психотропной и вегетотропной активностью. По окончании курса лечения были проведены повторные клинические исследования.
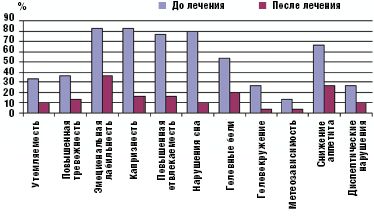
Прием препарата Тенотен детский в течение месяца обеспечил достоверное (в сравнении с контрольной группой) улучшение показателей психовегетативного статуса и снижение частоты соматоневрологических расстройств у детей, принимавших Тенотен детский, тогда как в контрольной группе детей эти показатели оставались практически на прежнем уровне (рис. 1, 2).
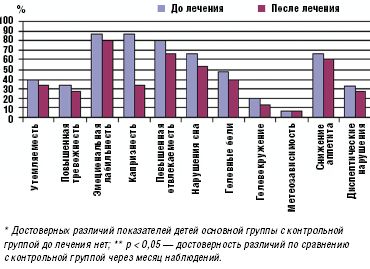
Улучшение показателей вегетативного тонуса отмечалось не только в его психоэмоциональной (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна), но и соматоневрологической (головные боли, головокружение, снижение аппетита, диспептические нарушения) составляющей. Полученные данные отражены на рис. 1.
Качественно изменились результаты КОП. У детей, принимавших Тенотен детский, отмечалась нормализация показателей вегетативного обеспечения (симпатикотонический вариант КОП) с 15,33% детей в начале терапии до 46,67% (p < 0,05), у остальных наметилась четкая тенденция к улучшению. В контрольной группе показатели КОП остались практически на прежнем уровне. Данные отражены на рис. 3.
Была выявлена положительная динамика в отношении патопсихологических проявлений. После курсового применения препарата уменьшение выраженности мнестических и поведенческих симптомов (невнимательность, гиперактивность, импульсивность) отмечалось в среднем у 85% детей. Все показатели шкалы SNAP-IV у детей основной группы после лечения Тенотеном достоверно снизились (p < 0,05). Показатели гиперактивности и невнимательности снизились до нормальных значений, абсолютные показатели импульсивности также значительно уменьшились в наблюдаемой группе.
По данным психометрического исследования у пациентов с СВД основной группы были выявлены достоверные положительные изменения при проведении тестов на память и внимание в сравнении с контрольной группой. Данные тестирования выявили отчетливое улучшение показателей механической и динамической памяти у 30% детей (p < 0,05), а также опосредованной памяти в тестах с пиктограммой — повышение показателя адекватности до 75% (p < 0,05).
Динамическая оценка результатов цветового теста Люшера выявила относительную стабилизацию психоэмоционального состояния у детей основной группы, что отразилось на предпочитаемой цветовой гамме и приближении ее к аутогенной норме (по коэффициенту суммарного отклонения от аутогенной нормы — p < 0,05). У детей контрольной группы определяемые показатели не имели статистически значимых изменений.
По окончании исследования родители оценили результаты лечения при помощи десятибалльной аналого-визуальной шкалы. В среднем успешность лечения в основной группе была оценена на 7–8 баллов, в контрольной — на 4–5 баллов.
Выводы
Проведенное исследование показало, что у детей, перенесших инфекционные заболевания, имеются в различной степени выраженные симптомы астеновегетативного синдрома (СВД) в виде психоэмоциональных (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна) и соматоневрологических (головные боли, головокружение, снижение аппетита, диспепсия) нарушений.
Астеновегетативные нарушения отрицательно влияют на процесс реконвалесценции у детей после перенесенных тяжелых инфекционных заболеваний, удлиняя этот период и ухудшая качество жизни пациентов.
Применение препарата Тенотен детский после перенесенных инфекционных заболеваний в дозе 1 таблетка 3 раза в день приводит к нормализации показателей вегетативного тонуса и обеспечения, уменьшает частоту соматоневрологических проявлений вегетативной дисфункции, что способствует более быстрому завершению периода восстановления.
Тенотен детский устраняет проявления астении, стабилизирует психоэмоциональное состояние детей: улучшает настроение, успокаивает, способствует снижению раздражительности и капризности, облегчает процессы обучения (запоминание, концентрацию внимания, усидчивость).
Препарат Тенотен детский безопасен у пациентов старшего дошкольного и младшего школьного возраста. Побочных эффектов во время применения препарата не было отмечено.
Доказанное успокаивающее, выраженное вегетотропное и антиастеническое действие препарата Тенотен детский позволяет рекомендовать его для применения у детей с различными проявлениями вегетососудистой дисфункции после перенесенных инфекционных заболеваний.
По вопросам литературы обращайтесь в редакцию.
Е. В. Михайлова, доктор медицинских наук, профессор
Т. Ильичева
Cаратовская областная детская инфекционная клиническая больница,
Саратовский государственный медицинский университет, Саратов
Читайте также:

