Послеоперационная интоксикация на кишечнике
Обновлено: 23.04.2024
Каловый перитонит — это воспаление брюшины, при котором в брюшную полость проникает кишечное содержимое. Заболевание проявляется интенсивными разлитыми болями в животе, тошнотой и рвотой, задержкой газов и стула. Наблюдается характерный внешний вид больных: землистый оттенок кожи, заостренность черт и страдальческое выражение лица, неподвижное положение. Для диагностики проводятся клинические анализы крови и мочи, рентгеноскопия, УЗИ, при необходимости — лапароскопия. Лечение калового перитонита хирургическое: санация с последующим дренированием полости брюшины, ликвидация источника (ушивание перфорации, наложение анастомоза).
МКБ-10
Общие сведения
Попадание калового содержимого в полость брюшины считается прогностически неблагоприятным фактором и значительно отягощает течение перитонита. Среди заболевших преобладают мужчины (60-70%). Хирургическая патология развивается в любом возрасте, но более 30% в структуре заболеваемости занимают люди пожилого и старческого возраста. Каловый перитонит является серьезной медицинской проблемой. Несмотря на современные оперативные методики и множество медикаментозных средств, смертность при перитоните остается высокой.
Причины
Каловый перитонит, как и другие формы воспаления брюшины, возникает при воздействии бактериальных факторов. Возбудителями заболевания становятся микробы, которые содержаться в просвете кишечника. Наиболее частые возбудители — кишечная палочка, клебсиеллы, энтерококки и стафилококки. В абдоминальной хирургии выделяют ряд патологических состояний, которые провоцируют инфицирование брюшины каловым содержимым:
- Перфорация кишечника. Является основной причиной калового перитонита и возможна при различных хирургических процессах. В 20-25% случаев болезнь обусловлена поражением толстой кишки (инвагинация, кишечная непроходимость, инфаркт кишечника), в 20% — гангренозным деструктивным аппендицитом, в 5-10% — ущемленными грыжами.
- Колоректальный рак. Вследствие частой встречаемости у больных старше 60 лет заболевание отнесено в отдельную группу этиологических факторов. Перфорация кишки происходит вследствие распада опухоли. При этом между листками брюшины проникает каловое содержимое и некротизированные ткани.
- Ятрогенные повреждения. После одноэтапных операций по формированию анастомозов кишечника возможно развитие несостоятельности швов, вследствие чего каловые массы инфицируют брюшную полость. Состояние встречается при тяжелых некрозах кишечника, опухолевых процессах, активном воспалении.
- Травмы. В редких случаях начало калового перитонита связано с проникающими ранениями (ножевыми, огнестрельными) брюшной полости, которые сопровождаются повреждением кишки.
- Воспалительные болезни кишечника. Причиной воспаления могут стать хронические поражения кишечника — болезнь Крона и неспецифический язвенный колит, которые осложняются перфорацией язв. Описаны случаи калового перитонита при дизентерии.
К группе риска принадлежат пациенты старческого возраста со сниженной реактивностью организма, больные с хроническими гастроэнтерологическими патологиями.
Патогенез
Согласно современным представлениям, в течении любого перитонита выделяют несколько этапов. Сначала возникает системная воспалительная реакция, которая под действием микробных факторов переходит в септическую фазу. Затем развивается синдром множественной дисфункции органов (MODS) и токсический шок (TSST). Несмотря на большое количество экспериментальных и клинических исследований, четких представлений о патогенезе перитонита нет.
При распространенном варианте калового воспаления решающее значение имеет интоксикация, которая нарушает все функции организма. Токсинами являются продукты распада микробных клеток, каловое содержимое, воспалительные цитокины. Эти вещества активно всасываются через брюшину, откуда попадают в лимфатическую и кровеносную систему. Первой при токсемии страдает печень, затем вовлекаются другие органы.
Классификация
Каловый перитонит систематизируют в зависимости от распространенности поражения. Выделяют местный процесс — самую легкую форму, когда воспаление локализовано в ограниченном участке брюшной полости. К неблагоприятным вариантам относят разлитой перитонит с поражением нескольких этажей брюшной полости и тотальный перитонит. По этиологии каловый перитонит можно разделить на 2 группы:
- Вторичный. Наиболее обширная категория, которая включает 95-97% всех случаев. Характеризуется развитием воспаления брюшины вследствие хирургических болезней или травм кишечника.
- Третичный. Относится к нозокомиальным заболеваниям. Формируется в результате повторного инфицирования после проведения операции по санации брюшной полости.
Симптомы калового перитонита
Чтобы облегчить свое состояние, человек находится в вынужденном положении: неподвижно лежит на спине, слегка согнув ноги в коленных и тазобедренных суставах. При попытке повернуться на бок боли усиливаются. Кратковременное беспокойное поведение в начале заболевания быстро сменяется заторможенностью, сонливостью. При перитоните отсутствует перистальтика кишечника, поэтому беспокоят задержка стула и метеоризм.
Одновременно с болевым синдромом наблюдаются тошнота и рвота, имеющие рефлекторный характер. Вначале рвотные массы содержат только желудочное содержимое, затем появляются примеси желчи. О тяжелом течении свидетельствует каловая рвота, которая представляет собой регургитацию содержимого тонкой кишки. При выраженной интоксикации рвота становится неукротимой.
Осложнения
Для калового перитонеального воспаления характерно неблагоприятное течение. При отсутствии медицинской помощи наблюдается 100% летальность. При успешно проведенном лечении калового перитонита риск смертельного исхода колеблется от 4,5% до 10%, а в тяжелых случаях достигает 30%. Если каловый перитонит осложняется сепсисом и септическим шоком, летальность возрастает до 70%.
Частым последствием перитонита является ДВС-синдром, который характеризуется тяжелыми нарушениями свертывающей системы крови. Из-за формирования тромбов и последующей коагулопатии потребления развивается полиорганная недостаточность. К поздним осложнениям патологии относят несостоятельность наложенных анастомозов, что сопровождается повторным выходом каловых масс в полость живота.
Диагностика
- Клинический анализ крови. В разгар заболевания обнаруживают высокий лейкоцитоз (более 15х10^9/л), сдвиг лейкоцитарной формулы влево вплоть до миелоцитов. При тяжелом каловом перитоните наблюдается лейкопения, которая является прогностически неблагоприятной. Для калового воспаления типично повышение СОЭ, умеренная анемия.
- Рентгенография. При обзорной рентгеноскопии органов брюшной полости удается выявить выпот в виде затемнения, наличие уровня жидкости и газа в кишечных петлях. При каловом перитоните зачастую визуализируется свободный газ в полости живота, что указывает на перфорацию полого органа. Типично высокое стояние диафрагмы.
- УЗИ брюшной полости. В ходе сонографии определяют наличие и примерное количество экссудата. Второй ультразвуковой признак калового перитонита — отсутствие перистальтики кишечных путей. УЗИ информативно не только для верификации диагноза, но и для обнаружения источника перитонита.
- Диагностическая лапароскопия. Исследование проводится в сомнительных случаях перитонита. С помощью лапароскопа определяются характер выпота в брюшной полости, визуализируются патологические изменения брюшины — серозный покров становится тусклым, отечным, гиперемированным.
Лечение калового перитонита
Консервативная терапия
Медикаментозное лечение рекомендовано на этапе предоперационной подготовки, а также в послеоперационном периоде для профилактики осложнений. Проводится активная инфузионная терапия с применением коллоидных препаратов, растворов глюкозы и электролитов. Для ликвидации бактериального инфицирования назначают парентеральные антибиотики. Для устранения болей используют комбинацию наркотических и ненаркотических анальгетиков.
Хирургическое лечение
Единственный метод радикальной терапии калового перитонита — выполнение оперативного вмешательства в максимально короткие сроки. Объем хирургического лечения подбирают с учетом состояния гемодинамики и функциональных возможностей организма. Целью операции является устранение или отграничение источника воспаления, рациональная санация и дренирование брюшной полости. Выделяют 2 разновидности хирургической тактики:
- Одноэтапная операция. Радикальное вмешательство по санации полости брюшины и ликвидации источника калового перитонита (ушивание или резекцию кишки, формирование анастомоза) чаще проводят у пациентов среднего возраста без тяжелых сопутствующих заболеваний. При этой методике есть риск расхождения кишечных швов.
- Многоэтапные оперативные вмешательства. Показаны преимущественно больным старческого возраста, которые не могут перенести травматичную одномоментную операцию. После резекции выполняется наложение стомы с отсроченным восстановлением целостности кишки. Многоэтапный метод показывает хорошие результаты при осложненном и крайне тяжелом течении калового воспаления брюшины.
Прогноз и профилактика
Вероятность полного выздоровления зависит от своевременности оказания хирургической помощи и тяжести основного заболевания, вызвавшего перитонит. При раннем проведении операции прогноз благоприятный. Осложненное течение калового воспаления брюшной полости наблюдается у онкологических пациентов, пожилых и ослабленных больных. Профилактика предполагает ликвидацию возможных причин калового перитонита.
1. Неотложная хирургия органов брюшной полости и забрюшинного пространства/ В.И. Лупальцов, В.Н. Лесовой. — 2014.
4. Абдоминальный сепсис/ Б.Р. Гельфанд, М.И. Филимонов, С.З. Бурневич// Русский медицинский журнал. — 1998.
Мидленко В.И. 1 Баринов Д.В. 1 Зайцев А.В. 1 Смолькина А.В. 1 Зайцева О.Б. 1 Дойко М.И. 1 Казыханов Р.И. 1
Рак толстого кишечника в последние годы привлекает особое внимание ученых и клиницистов в связи с неуклонным ростом заболеваемости данной патологией. Целью данного ретроспективного исследования явился анализ осложнений в периоперационном периоде хирургического лечения больных раком толстого кишечника. Представлены результаты обследования и оперативного лечения 196 пациентов с раком толстого кишечника, находившихся в клинике кафедры госпитальной хирургии Ульяновского государственного университета. По нашим данным, у большинства оперированных пациентов – 123 (62,7 %) – выявлена III стадия, у 54 (27,5 %) – IV стадия рака ободочной кишки и лишь у 19 (9,8 %) – II стадия. Острая обтурационная толстокишечная непроходимость являлась самой частой формой осложнений рака ободочной кишки: в 50 % случаев. Клинически у всех были отмечены анемия, интоксикация, гипопротеинемия и нарушение водно-электролитного баланса. При обследовании выявлены осложнения: перифокальное воспаление, перфорация опухоли в свободную брюшную полость с развитием разлитого перитонита, пенетрация опухоли в брыжейку тонкой кишки с развитием абсцесса и у 12,7 % пациентов выявлено кишечное кровотечение. Объем операции зависел от локализации опухоли, степени непроходимости, состояния толстой кишки, характера метастазирования, тяжести общего состояния и наличия сопутствующих заболеваний. У 166 (84,7 %) пациентов удалось выполнить радикальную операцию, и послеоперационная летальность составила 13,3 %. Наибольшее количество осложнений в послеоперационном периоде выявлено у больных с перфорацией опухоли и развитием перитонита.

1. Бочкарева Н.А., Напольских В.М., Камашев В.М. Анализ результатов лечения больных колоректальным раком по данным республиканского клинического онкологического диспансера г. Ижевска // Медицинский альманах. – 2009. – № 3(8). – С. 73–76.
2. Гатауллин И.Г., Аглуллин И.Р., Шакиров Р.К. Фундаментальные и прикладные аспекты первичной профилактики, ранней диагностики и совершенствования методов лечения колоректального рака // Онкология сегодня: пациент, государство, медицинское сообщество: материалы VII Росс. конф. – Ульяновск, 2011. – С. 69–73.
3. Городнов С.В., Набегаев А.И., Мальченко С.А. Анализ хирургического лечения больных колоректальным раком // Онкология сегодня: пациент, государство, медицинское сообщество: материалы VII Росс. конф. – Ульяновск, 2011. – С. 80–82.
4. Измайлов С.Г., Лукоянычев Е.Е., Орлинская Н.Ю. Алгоритм коррекции высокого внутрибрюшного давления при острой кишечной непроходимости // Медицинский альманах. – 2012. – № 2(21). – С. 171–174.
5. Чиссов В.И. Злокачественные новообразования в России в 2003 году // В.И. Чиссов, В.В. Старинский. – М., 2005. – 264 с.
6. Шойхен Я.Н. Рак толстой кишки в Алтайском крае // Я.Н. Шойхен, А.Ф. Лазарев, К.Г. Мамонтов. – Барнаул, 2006. – 211 с.
7. Malbrain M.L.N.G., I.E. De Laet, De Waeie J.J. IAH/ACS: the rationale for surveillance. // World J. Of Surg. – 2009. – Vol. 33, № 6. – P. 1110–1115.
В 2003 году в России от данной патологии умерло 36 036 человек [1, 5]. Прирост стандартизированных показателей смертности за последнее десятилетие наиболее выражен при раке ободочной кишки за счет осложнений в послеоперационном периоде – 13,3 % [5, 6]. Основной причиной летальности при данной патологии является отсутствие раннего выявления злокачественных заболеваний толстой кишки и развившихся осложнений [4, 7].
Цель исследования: анализ осложнений в периоперационном периоде хирургического лечения больных раком толстого кишечника.
Материал и методы исследования
С 2010 по 2012 годы в клинике кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова Ульяновского государственного университета г. Ульяновска пролечено 196 больных по поводу осложненных форм рака толстой кишки. Мужчин было 101 человек (51,5 %), женщин – 95 (48,5 %) в возрасте от 36 до 86 лет. Анализ возрастного состава больных показал, что 138 (70,4 %) пациентов были пожилого и старческого возраста, опухолевый процесс у которых был отягощен сопутствующими заболеваниями сердечно-сосудистой системы, органов дыхания и мочевыделительной системы, а также нарушениями обменных процессов. И 58 (29,6 %) пациентов были молодого и среднего возраста. Диагностика распространенности рака ободочной кишки, выявление осложнений опухолевого процесса, а также сопутствующих заболеваний основывались на комплексе клинико-инструментальных обследований, который включал лабораторные, рентгенологические, ультразвуковые, эндоскопические и морфологические методы диагностики.
В зависимости от осложнений злокачественных опухолей толстой кишки было выделено четыре группы пациентов, представленные в таблице, в клинической картине которых преобладали основные симптомы: первая группа – острая толстокишечная непроходимость – 98 (50,0 %), вторая группа – воспалительные параканкрозные осложенения с элементами абсцедирования – 45 (23,0 %), третья группа – перфорация опухоли с развитием перитонита различной распространенности – 28 (14,3 %), четвертая группа – профузное кишечное кровотечение – 25 (12,7 %).
Группы пациентов, распределённые по клиническим проявлениям
Симптомы рака толстого кишечника
Острая толстокишечная непроходимость
Воспалительные параканкрозные осложенения с элементами абсцедирования
Перфорация опухоли с развитием перитонита
Профузное кишечное кровотечение
Большая часть выявленных осложнений отмечена у пациентов с раком сигмовидной и слепой кишок – 78 %. Осложненные опухоли в 36 % случаев (n = 70) локализовались в правой половине ободочной кишки, в 59 % (n = 116) – в левой, в поперечной ободочной кишке у 5 % (n = 10) больных.
Наибольшее количество больных с вновь диагностированным колоректальным раком приходится на 3–4 стадию заболевания [1, 2]. По нашим данным, у большинства оперированных пациентов – 123 (62,7 %) – выявлена III стадия, у 54 (27,5 %) – IV стадия рака ободочной кишки и лишь у 19 (9,8 %) – II стадия.
При анализе данных обследования и клинической картины, изучении операционных находок и морфологического материала не было обнаружено зависимости распространения процесса от пола и возраста больных. Во всех группах больных по данным гистологического исследования основное место занимали аденокарциномы различной степени дифференциации – 80,8 %, гораздо реже встречались перстневидно-клеточные и недифференцированные формы рака (7,1 и 12,1 % соответственно).
В 45 % наблюдений во время оперативного вмешательства было обнаружено метастатическое поражение регионарных лимфатических узлов, отдаленные метастазы выявлены у 27 % обследованных с наиболее частой локализацией в печени (62 %), легких (12 %), канцероматоз брюшины выявлен в 18 % наблюдений.
Результаты исследования и их обсуждение
Острая обтурационная толстокишечная непроходимость (n = 98 (50 %)) являлась самой частой формой осложнений рака ободочной кишки. Причем в 75 % это были больные старше 60 лет. Преобладающее число пациентов с этим осложнением составили больные с опухолями сигмовидной (n = 54 (53,3 %)) и слепой (n = 29 (31 %)) кишок. В эту группу вошли больные с декомпенсированным нарушением проходимости ободочной кишки и при отсутствии эффекта от консервативных мероприятий, направленных на разрешение непроходимости кишечника. Клинически у всех были отмечены анемия, интоксикация, гипопротеинемия и нарушение водно-электролитного баланса. В 59 % наблюдений отмечены проявления токсико-анемичного синдрома преимущественно у пациентов с локализацией опухоли в правых отделах ободочной кишки. Неблагоприятным явился тот факт, что у 21 (22 %) больного обтурационная непроходимость сочеталась с опухолевым перифокальным воспалением, у 12 (11 %) – имела место перфорация опухоли в свободную брюшную полость с развитием разлитого перитонита, у 4 (4 %) – с пенетрацией опухоли в брыжейку тонкой кишки с развитием абсцесса. Предоперационная подготовка заключалась в проведении лечебных мероприятий, направленных на коррекцию водного и белково-электролитного баланса, кислотно-щелочного состояния, купирования интоксикации.
Объем операции при обтурационной непроходимости ободочной кишки зависел от локализации опухоли, степени непроходимости, состояния толстой кишки, характера метастазирования, тяжести общего состояния и наличия сопутствующих заболеваний. Из 70 оперированных пациентов с локализацией опухоли в правых отделах ободочной кишки в 21,2 % (n = 15) случаев выполнили правостороннюю гемиколэктомию с наложением илеотрансверзанастомоза и интраоперационную декомпрессию тонкой кишки. Восьми (11,4 %) пациентам с локализацией нерезектабельной опухоли в печеночном изгибе и восходящем отделе ободочной кишки были выполнены паллиативные симптоматические операции – наложение илеотрансверзанастомоза с обязательной зондовой назоинтестинальной декомпрессией, пятерым пациентам (7,1 %) этой группы при наличии тяжелой сопутствующей патологии наложена разгрузочная цекостома. При IV стадии онкологического процесса с наличием отдаленных метастазов, но при технически возможной резектабельности опухоли считали правомочным выполнение паллиативной санационной правосторонней гемиколэктомии с первичным наложением анастамоза.
При раке левой половины и поперечно-ободочной кишок, осложненных кишечной непроходимостью, у 71 (61,2 %) пациента выполнены резекции сегмента кишки со стенозирующей опухолью с последующим ушиванием дистального отрезка кишки и выведением проксимального конца в виде одноствольной колостомы на переднюю брюшную стенку по типу операции Гартмана. При неоперабильности опухоли 45 (38,7 %) пациентам были наложены разгрузочные трансверзо- и сигмостомы.
Умерли после операции 12 (12,2 %) пациентов от прогрессирующей раковой интоксикации и декомпенсации сопутствующей патологии.
Параканкрозные воспалительные процессы осложняют клиническое течение рака ободочной кишки. По нашим данным, воспалительные изменения в опухоли, выходящие за пределы кишечной стенки, составили 22,9 % (n = 45). У большинства пациентов (n = 38 (84 %)) опухоль с перифокальным воспалением локализовалась в правой половине ободочной кишки, что клинически проявлялось токсико-анемичным синдромом. И только у 7 (16 %) пациентов воспалительный процесс локализовался при опухолях селезеночного изгиба и сигмовидной кишки.
Клинические проявления в этой группе зависели от степени выраженности и характера воспалительной реакции тканей вокруг опухоли (стадии развития опухолевого процесса, локализации опухоли, реактивности организма больного). В 87 % случаев эти больные поступали по неотложным показаниям с симптоматикой острых хирургических заболеваний органов брюшной полости или забрюшинного пространства. Сложность дифференцировки перифокального воспаления, обусловленного опухолью или доброкачественной воспалительной инфильтрацией стенки ободочной кишки (при дивертикулите, болезни Крона, неспецифическом язвенном колите), позволяла разрешить эндоскопическое исследование. При ирригоскопии определялся суженный участок ободочной кишки, неровность рельефа слизистой, выход контрастного вещества за пределы кишечной стенки, что не позволяло отдифференцировать опухолевое поражение от доброкачественного воспалительного процесса. В сомнительных случаях при наличии положительных симптомов раздражения брюшины, а также в связи с дифференциальной диагностикой острой хирургической патологии органов брюшной полости у 8 (17,7 %) пациентов была выполнена диагностическая лапароскопия, которая позволила определить характер воспалительного процесса и его распространенность. У 22 больных (51,1 %) этой группы при отсутствии симптомов перитонита и прогрессирования воспалительного процесса предпринята выжидательная тактика, позволяющая выполнить операцию в плановом порядке после купирования воспалительного процесса путем проведения курса антибактериальной и детоксикационной терапии. Однако у 15 (33,3 %) из 45 больных с клиникой прогрессирования перитонита и кишечной непроходимости пришлось выполнить экстренные оперативные вмешательства.
При локализации опухоли в правых отделах, печеночном изгибе, правой трети поперечной ободочной кишки с распространением воспалительной инфильтрации на брыжейку у 25 (55,5 %) больных была выполнена расширенная правосторонняя гемиколэктомия с адекватным дренированием забрюшинной клетчатки и брюшной полости в зоне оперативного пособия. При левосторонней локализации (n = 8 (16 %)) выполняли операцию типа Гартмана, так как наличие даже умеренного перифокального воспаления тканей в зоне оперативного вмешательства не создают условия для безопасного наложения первичного толстокишечного анастомоза, тем более при наличии параканкрозных абсцессов.
Тяжелым осложнением при раке ободочной кишки является перфорация кишечной стенки. Перфорацию кишечной стенки в зоне опухоли и диастатическую перфорацию проксимальнее опухоли мы наблюдали у 28 (14,2 %) больных. Значительно чаще это осложнение развивалось при поражении левых отделов ободочной кишки (n = 26 (92,8 %)) с перфорацией опухоли вследствие ее распада. Перфорация вне зоны опухоли от пролежня каловым камнем или перерастяжения кишечной стенки при обтурационной непроходимости выявлена у 2 (7,2 %) больных. Обнаруженные осложнения позволяют предполагать, что ведущим этиологическим фактором при диастатической перфорации кишки являются сосудистые расстройства и дистрофические изменения стенки кишки, тогда как основной причиной перфорации самой опухоли явились нарушения кровоснабжения с последующей ишемией и некрозом. Во всех случаях перфорации обнаружены при III и IV стадии заболевания преимущественно у пациентов пожилого и старческого возраста.
Исходы лечения в этой группе пациентов характеризовались наибольшим количеством осложнений и летальных исходов (n = 12, что составило 42,8 %).
Кишечные кровотечения являются нередким осложнением рака ободочной кишки. Мы наблюдали 25 (12,7 %) больных с профузными (n = 7, то есть 28 %) и рецидивирующими (n = 18 соответственно 72 %) кровотечениями из опухолей толстой кишки. Локализация опухолей, явившихся источником профузного кровотечения, по нашим данным была преимущественно в левой половине ободочной кишки (92 %), тогда как для рецидивирующих кровотечений более характерна правосторонняя локализация опухоли (8 %). Как правило, возникновение обильных кровотечений связано с аррозией сосудов при распаде опухолевой ткани.
Клиническая картина кишечного кровотечения проявляется значительной слабостью пациентов, анемией и кровянистыми выделениями или кратковременными периодическими кровотечениями из прямой кишки. Длительность существования этих признаков у 20 пациентов (80 %) превышала несколько месяцев. Эти больные длительно лечились и обследовались по поводу анемии, которая в определенной степени была связана не только с кровотечением, но и с раковой интоксикацией. Половина пациентов этой группы (n = 13, что составило 52 %) поступила в стационар с анемией тяжелой степени и требовала заместительных гемотрансфузий.
В диагностический алгоритм этой группы пациентов нами включены эндоскопия и ультразвуковая диагностика, которые в 72 % случаев помогли поставить правильный диагноз. Проведение экстренной диагностической фиброколоноскопии у 5 (20 %) больных было затруднительным вследствие невозможности адекватной подготовки кишечника к исследованию из-за наличия сгустков крови и поступления её из проксимальных отделов кишки, затрудняющих визуализацию и идентификацию источника кровотечения.
В связи с отсутствием эффекта от гемостатической терапии и невозможностью выполнения эндоскопического гемостаза 2 пациента с профузным кишечным кровотечением опухолевого генеза были оперированы по жизненным показаниям в ургетном порядке, выполнена правосторонняя гемиколэктомия. Крайне тяжелое состояние двух пациентов старческого возраста с анемией тяжелой степени позволило выполнить только паллиативные резекции сигмовидной кишки с кровоточащей опухолью по типу операции Гартмана. Эта группа пациентов с геморрагическими осложнениями опухолей ободочной кишки характеризовалась наименьшим количеством послеоперационных осложнений и двумя летальными исходами.
У 166 (84,7 %) пациентов удалось выполнить радикальную операцию. Умерло 26 пациентов, следовательно, послеоперационная летальность составила 13,3 %. Наибольшее количество осложнений в послеоперационном периоде выявлено у больных с перфорацией опухоли и развитием перитонита.
Таким образом, непосредственные результаты хирургического лечения больных осложненным течением рака ободочной кишки находятся в прямой зависимости от своевременной диагностики основного заболевания и его осложнения, обоснованной хирургической тактики, выбора способа и техники выполнения оперативного вмешательства, а также от полноценной профилактики и терапии послеоперационных осложнений.
Несмотря на современный уровень организации и оснащенность медицинской помощи, ранняя диагностика рака толстого кишечника остается на низком уровне, и выявление данной патологии происходит на поздних стадиях, что способствует увеличению периоперационных осложнений.
Рецензенты:
В данной статье рассматриваются следующие осложнения противоопухолевого лечения со стороны желудочно-кишечного тракта:
- снижение массы тела (недостаточность питания)
- пострезекционные синдромы (осложнения после операционных вмешательств на желудке, поджелудочной железе)
- нарушение стула на фоне лечения (диарея/запор)
- лучевые поражения кишечника
Снижение массы тела (недостаточность питания)
Снижение массы тела у онкологического пациента возникает вследствие многих факторов: необходимо учитывать лечение пациента сейчас и в прошлом, состояние больного, объем операционных вмешательств и т.д.
Причины потери массы тела:
- Проведенное оперативное лечение (пострезекционные синдромы)
- Последствия проводимого лечения: ХТ/ЛТ; нарушение стула, тошнота, рвота, лучевые поражения слизистой, снижение аппетита/изменение вкуса.
- Нарушение проходимости/моторики желудочно-кишечного тракта
- Прогрессирование основного заболевания, хронический болевой синдром.
- Другие причины
Оценка недостаточности питания
В амбулаторной практике используются различные шкалы для оценки недостаточности питания.
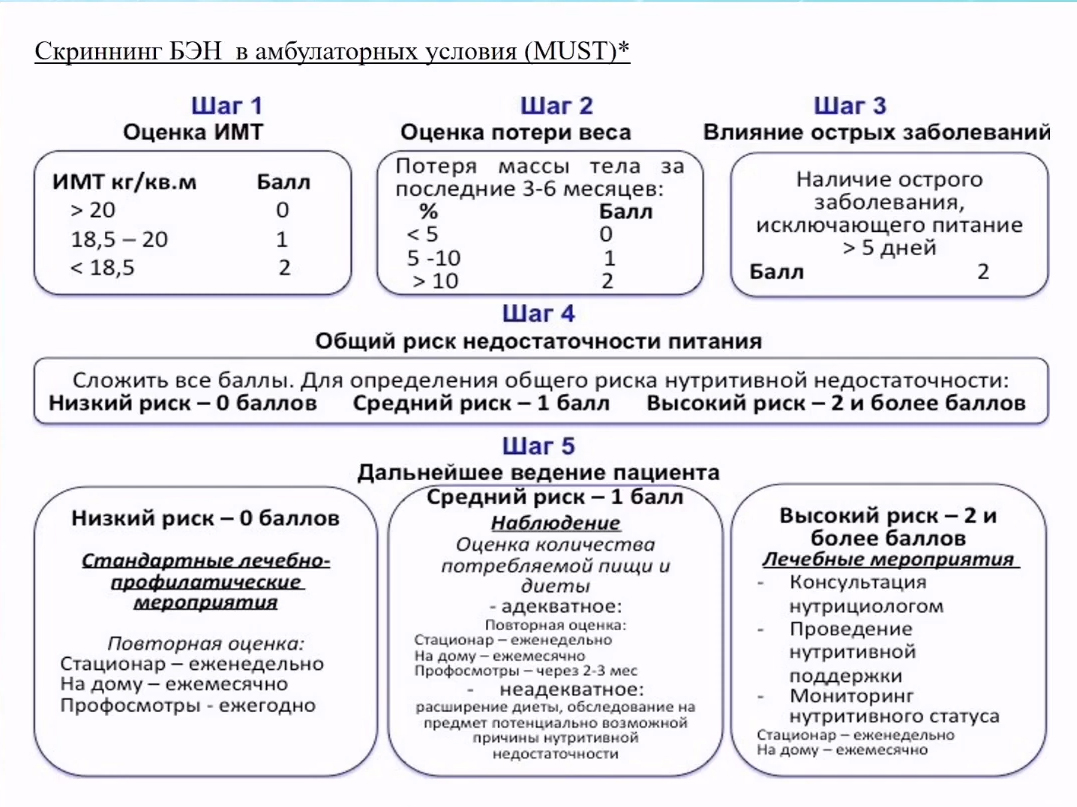
Оценка ситуации должна включать в себя как минимум следующие вопросы:
- Какой объем веса потерял пациент от момента начала заболевания до момента приема у гастроэнтеролога?
- Сколько из этого веса было потеряно за последние 1-3 месяца?
- Принимал ли пациент какие-то препараты лечебного питания?
- Какую дополнительную терапию получает пациент?
- Получает ли на сегодняшний день препараты лечебного питания? Если да, то в какой дозировке и что именно?
Алгоритм назначения нутриционной поддержки
Данный алгоритм должен разрабатываться совместно со специалистом, поскольку пациент не может самостоятельно подобрать для себя адекватную терапию, которая поспособствует улучшению самочувствия и облегчению симптоматики.
Для алгоритма назначения нутриционной поддержки необходимо ответить на следующие вопросы:
Для расчета энергетических потребностей пациента необходимо оценить имеющуюся недостаточность питания, риски прогрессирования недостаточности питания.
Осуществляется выбор оптимального пути введения лечебного питания. Возможны следующие варианты: сиппинг (лечебное питание, которое пациент может употреблять самостоятельно), зондовое питание, комбинированная нутриционовая поддержка (совмещение парентерального и энтерального питания). Отдельно стоит рассматривать ситуации, когда у пациента есть стома (гастростома, энтеростома, эзофагостома): в этом случае введение препаратов лечебного питания может осуществляться через нее.
Определяется режим кормления, режим введения препаратов лечебного питания.
Определяются сроки нутриционной поддержки пациента.
Осуществляется выбор препаратов для конкретной ситуации.
Методы оценки эффективности проводимой нутриционной поддержки
- Биоэлектрический импедансный анализ
- Двухэнергетическая рентгеновская абсорбциометрия
Эти методы часто используются в рутинной практике. Они позволяют оценить изменение состава тела на фоне нутриционной поддержки, оценить объем жировой массы, внеклеточной и внутриклеточной жидкости, косвенно оценить количество мышечной массы.
- лабораторно-инструментальная оценка показателей
- калориметрия
Эти методы редко используются в рутинной практике. Однако их достоинство в доступности – врач может осуществить оценку состояния тела прямо во время приема.
Пострезекционные синдромы
Синдромы оперированного желудка
К ним относятся – депминг-синдром, гипогликемический синдром, анемический синдром, синдром приводящей петли, рефлюкс-эзофагит, недостаточность питания, моторные нарушения культи желудка, анастомоза.
Чаще всего с этими синдромами сталкиваются пациенты, которые перенесли операции на желудке, пищеводе или поджелудочной железе. Данные симптомы могут развиваться, как в раннем, так и в более отсроченном периоде.
Демпинг-синдром. Как правило, проявляется слабостью, потливостью после приема пищи, головокружением, зачастую возникает при приеме углеводистой пищи. Развивается, как в раннем, так и в позднем послеоперационном периоде. Синдром обусловлен быстрой эвакуацией пищи из пищевода в тонкую кишку с последующим развитием гипергликемии, то есть пища быстро попадает из пищевода в тонкую кишку, что вызывает повышение уровня глюкозы (сахара) в крови.
Обычно регулируется подбором режима питания и рациона, а также медикаментозными препаратами.
Пациентам, страдающим демпинг-синдромом, необходимо вести пищевой дневник. Это поможет отследить причины синдрома (определенное время суток, определенная еда и т.д.).
Гипогликемический синдром. Проявляется недостаточным уровнем сахара в крови. Является разновидностью позднего демпинг-синдрома.
Анемия. Обусловлена дефицитом железа и витамина В-12 после удаления желудка. Данное состояние необходимо корректировать и компенсировать препаратами.
Рефлюкс-эзофагит. Это заброс пищи из тонкой кишки в пищевод. Самыми частыми проявлениями рефлюкс-эзофагита является изжога, горечь во рту, тяжесть после приема пищи, ощущение жжения по ходу пищевода. Реже симптом проявляется жжением в области языка, кислым привкусом во рту. Корректируется режимом питания, новыми жизненными привычками и назначением медикаментозной терапии.
Недостаточность питания или потеря массы тела. Данный синдром требует коррекции рациона и режима питания, а также назначения дополнительной нутриционной поддержки.
Важно знать, сколько массы пациент потерял до операции, после операции, во время химио/лучевой терапии. Исходя из этого подбираются препараты лечебного питания.
Нарушение культи желудка, анастомоза (т.е. места соединения органов). Осложнение, которое относится к моторно-эвакуаторным нарушениям. Корректируется медикаментозно.
Болевой синдром. Может быть обусловлен разными факторами. При обращении к врачу важно описать, когда возникают боли, связаны ли они с приемом пищи, через какое время и в каком месте после приема пищи возникают, проходят самостоятельно или требуют применения препаратов, сопровождаются ли тошнотой, рвотой, нарушением стула.
Астения. Состояние общей слабости и утомляемости.
Эти и другие симптомы, которые могут беспокоить пациента в послеоперационном периоде или на фоне проводимого лечения. Любые жалобы требуют обращения к врачу.
Диагностика синдромов оперированного желудка
- ФГДС (фиброгастродуоденоскопия)
- клинический анализ крови
- биохимический анализ крови (при снижении массы тела + общий белок и альбумин)
- КТ грудной и брюшной полости по назначению онколога
- при развитии железодефицитного состояния рекомендовано два раза в год сдавать анализ крови на железо, ферритин, коэффицент насыщения трансферрина железом, витамин В-12, фолиевую кислоту
- рентгеноскопия (при появлении рвоты, стойкого болевого синдрома в эпигастральной области после приема пищи)
Обследования позволяют подобрать терапию, дать точные рекомендации по образу жизни.
Как установить причину рефлюкса (заброса пищи обратно в пищевод)?
В сложных случаях для оценки характера рефлюктата и оценки того, что именно забрасывается в пищевод, используется суточная импеданс-pH-метрия. Данное исследование особенно актуально для пациентов, которые перенесли гастрэктомию (удаление желудка), резекцию пищевода.
Обследование выполняется в тех клинических ситуациях, когда пациент получает медикаментозное лечение, но улучшения не наблюдаются. Либо, когда жалобы не соответствуют характеру проведенного оперативного вмешательства.
Консервативная терапия после оперативного вмешательства на желудке
- Коррекция недостаточности питания (подключение препаратов лечебного питания)
- Коррекция анемического синдрома (т.е. анемии). Назначаются препараты железа В12, фолиевая кислота. При железодефицитном состоянии возможно парентеральное введение препаратов железа.
- Симптоматическая терапия (т.е. терапия, которая снимает симптомы): ферменты, прокинетики и т.д.
- Подбор рациона питания в зависимости от симптомов.
- Формирование новых привычек. Например, пациентам после операции на желудке или его удалении лучше спать с приподнятым изголовьем, не переедать, распределять приемы пищи в течение дня и не ложиться после еды. Это позволит минимизировать заброс пищи в обратно пищевод.
Последствия оперативного вмешательства на поджелудочной железе
Хирургические вмешательства на поджелудочной железе зачастую влекут за собой недостаточность выработки ряда ферментов и гормонов в организме. Нехватка данных веществ может привести к потере массы тела, вторичному диабету, диарее, синдрому избыточного бактериального роста. Вторичной проблемой становится боль в животе.
Чтобы оценить недостаточность ферментов проводится анализ кала на панкреатическую эластазу.
Основное лечение патологии заключается в заместительной ферментативной терапии, подбор питания.
Нарушение стула на фоне лечения (диарея/запор)

Диарея
Основные факторы, которые вызывают диарею (в зависимости от них подбирается терапия):
- проведение химиотерапии
- проведение лучевой терапии
- гастроэктомия (удаление желудка)
- ферментативная недостаточность
- нарушение всасывания макро и микроэлементов после обширных резекций тонкой кишки
- гипоальбуминемия (низкая выработка белка альбумина может приводить к отечности кишки)
- инфекционная диарея из-за снижения иммунитета на фоне противоопухолевой терапии
- синдром избыточного бактериального роста (особенно усугубляется после проведенного оперативного лечения и на фоне химиолучевой терапии)
- прием антибиотиков
- развитие псевдомембранозного колита
Любой из вышеперечисленных симптомов требует обращения к врачу для назначения терапии.
Если на фоне диареи, у пациента отмечается подъемы температуры, интоксикация, то необходимо дополнительное обследование на псевдомембранозный колит.
Диарея и недержание кала
После операций на органах, расположенных в малом тазу, у пациента может наблюдаться комбинация сразу двух синдромов – диареи и недержания кала. Чаще всего данное расстройство наблюдается у пациентов гинекологического профиля.
У больного может наблюдаться неоформленный или полуоформленный стул, а также фрагментная дефекация в течение дня, трудности с удержанием кала и газов после возникновения позывов на дефекацию. Иногда бывает ночное недержание кала.
Чтобы оценить состояние анального сфинктера специалисты назначают сфинктерометрию.
При лечении патологии применяется комбинация методов – лекарственная терапия, физиотерапия, физические упражнения.
Запор / задержка стула
Симптом может сопровождаться такими жалобами, как напряжение и/или боли в животе, натуживание, вздутие живота, твердый кал, ощущение неполного опорожнения кишечника, необходимость ручного пособия при опорожнении, отсутствие позывов на дефекацию или ложные позывы на дефекацию без опорожнения кишечника.
Причинами запора/задержки стула могут послужить:
- проведение химиотерапии
- проведение лучевой терапии
- хирургическое лечение
- спаечная болезнь
- канцероматоз
- усугубление заболеваний, уже имеющихся до установки онкологического диагноза
Если пациент наблюдает у себя запор или задержку стула, необходима консультация специалиста.
Методы диагностики, которые помогут установить причину запоров:
- фиброколоноскопия
- анасфинктерометрия (позволяет изучить тонус мышц тазового дна и тонус анального сфиктера)
- рентгеноскопия
- обзорная рентгенограмма брюшной полости
- лабораторные исследования (посевы кала и др.)
Если на фоне лечения задержка стула длится от 4 суток, а также отмечаются повышенное газообразование, тошнота и/или рвота, боли в кишечнике, то необходима срочная консультация специалиста!
Терапия запора/задержки стула
Традиционным методом лечения является медикаментозная терапия. В случае спаечного процесса может потребоваться хирургическое лечение.
Отметим, что противоболевая терапия может усугубить ситуацию.
Лучевые поражения кишечника
Лучевые поражения кишечника проявляются в виде колитов – воспалительного заболевания слизистой оболочки кишечника. Колиты преимущественно развиваются у пациентов, получающих терапию на область малого таза (матка, цервикальный канал, простата, прямая кишка, мочевой пузырь).
Колиты могут возникнуть на любом этапе лечения: во время начала лучевой терапии и в течении 3 месяцев после окончания лечения. Существуют и позднеотстроченные лучевые колиты, которые возникают в течение первого года после проведенной лучевой терапии.
Симптомы
К основным симптомам лучевого поражения кишечника относят: нарушение стула, диарея, ложные позывы к дефекации, боли по ходу кишечника и боли в заднем проходе, в зависимости от зоны, куда пациент получает лучевую терапию. При достаточно выраженном воспалении появляются следующие симптомы — недержание кала и газов, диспепсия, метеоризм, рвота, тошнота, снижение массы тела на фоне диареи.
Если в начале лучевой терапии, во время нее, после нее у пациента отмечается выделение крови с каловыми массами – стоит немедленно обратиться к врачу! Он назначит необходимые обследования и лечение.
Диагностика лучевых поражений кишечника
Исследования, которые позволяют определить степень поражения и назначить терапию:
- Сбор жалоб и анамнеза
- Лабораторные исследования
- ФКС — фиброколоноскопия (применяется при позднеотсроченном колите)
- Аноскопия (применяется при ранних поражениях, позволяет оценить степень воспалительной реакции прямой кишки)
- КТ/МРТ
- Ирригоскопия
- Фистулография (применяется только при наличии свища, на определение свищевого хода, это не рутинное исследование.
Терапия
При лучевых поражениях желудочно-кишечного тракта терапия зависит от локализации патологического процесса. В основном используются:
- препараты месалазина
- глококортикостероиды
- заместительная ферментативная терапия
- антидиарейные препараты
- коррекция микробиоценоза
Срок лечения определяется специалистом. Стоит отметить, что лучевой колит невозможно вылечить за 2-3 недели, терапия должна быть длительной и систематической.

Авторская статья:
Захарова П.А.
Гастроэнтеролог, гепатолог НМИЦ онкологии им. Н.Н. Петрова
Высокий риск развития постоперациооных тошноты и рвоты отмечается у лиц, перенесших лапароскопическую операцию и после продолжительной операции, согласно результатам мета-анализов. Во многих исследованиях говорится о высоким риске тошноты и рвоты после перенесены урологических и билиарных вмешательств. В одном из недавних исследований говорится о 35% частоте тошноты и рвоты после резекции кишки.
У пациентов с послеоперационной тошнотой и рвотой отмечается снижение аппетита в послеоперационном периоде, что может приводить к более длительному пребыванию в стационаре.
Целью исследования было определись снижает ли риск тошноты и рвоты предоперационное назначение дексаметазона у пациентов, у которых планируется вмешательство на кишечнике.
Дизайн исследования
Проведено рандомизированное исследование с двумя параллельными группами сравнения в 45 медицинских центрах Великобритании.
В анализ были включены 1350 пациентов в возрасте 18 лет и старше, которым проводилась плановая открытая или лапароскопическая операция на кишечнике по поводу доброкачественной или злокачественной патологии.
Пациентам вводили внутривенно 8 мг дексаметазона перед началом введения анестетиков или проводили стандартную терапию.
В качестве первичной конечной точки было выбрано развитие рвоты в течение 24 часов после операции. В качестве вторичных конечных точек были выбраны: рвота в течение 72 и 120 часов, репортируемые пациентом или врачом, частота послеоперационной тошноты и рвоты в течение 24, 72 и 120 часов, усталость и качество жизни через 120 часов и через 30 дней, время возвращения к приему пищи, длительность госпитализации и частота нежелательных явлений.
Результаты
Из 1350 пациентов 674 были включены в группу дексаметазона и 676 в группу стандартной терапии.
- Рвота в течение 24 часов после операционного вмешательства имела место у 172 участников, получавших дексаметазон (25.5%) по сравнению с 223 из контрольной группы (33.0%), P=0.003. Число пациентов, которое необходимо пролечить, чтобы предотвратить рвоту у одного больного (NNT) составило 13.
- Антиеметические препараты были назначены по требованию 285 лицам из группы дексаметазона (39.3%) и 351 пациенту из группы контроля (51.9%). Показатель NNT составил 8 (95% CI, 5-11; P <0.001). В течение 72 часов сниженная потребность в назначении препаратов сохранялась. Не было отмечено повышения частоты осложнений.
Заключение
Добавление внутривенно однократно дексаметазона в дозе 8 мг в начале анестететической терапии ассоциировано с достоверным снижением риска послеоперационной тошноты и рвоты в течение 24 часов и уменьшением потребности в введении антиеметических препаратов в течение 72 часов у больных, которым проводится операция на кишечнике.
Источник: DREAMS Trial Collaborators and West Midlands Research Collaborative. BMJ 2017;357:j1455.
4. Хирургические боезни : учебник /М.И. Кузин, О.С.Шкроб, Н.М.Кузин и др.М.:Медицина,2005.( ст.693-710)
6. Красильников Д.М Ранняя спаечная послеоперационная непроходимость кишечника // Вестн. хир. - 1994. - Т.152. - №1/2. - С. 17-21.
КИШЕЧНЫЕ СВИЩИ — изолированные от брюшной полости отверстия в кишечной стенке, через которые просвет кишки сообщается с окружающей средой или с другим полым органом.[2]
После оперативных вмешательств на кишечник происходит локальное нарушение циркуляции крови, что приводит к гипоксии, затем ишемии и в конечном итоге к некрозу данного участка.
На сегодняшний день наиболее часто свищевой ход возникает в послеоперационный период резекции кишечника. Не менее важную роль в развитии данной патологии играют такие послеоперационные осложнения как несостоятельность кишечных швов, скопление гноя между петлями тонкой кишки после операции по поводу перитонита, кишечная непроходимость после операции на кишечник.
Наихудший прогноз при высоких свищах в тонком кишечнике так как по ним происходит излитие значительного количества содержимого, что приводит к расстройствам в организме: со стороны системы пищеварения - нарушается всасывание нутриентов, возникает интоксикация организма; кровообращения – через свищевой ход теряется большое количество жидкости, пищеварительных соков, ферментов, электролитов и питательных веществ, отсюда снижается объем циркулирующей крови, возникает гемоконцентрация; мочевыделения – в результате обезвоживания через канальцы почек циркулирует меньше крови, отсюда олигурия.
На данный момент классификаций кишечных свищей несколько. Наиболее полной и востребованной является классификация П.Д. Колченогова (1957), приведенная ниже.
По этиологии кишечные свищи могут быть: врожденные и приобретенные.
По местоположению свищевого отверстия: наружные, внутренние и комбинированные.
По расположению свищевого хода: желудочные, тонкокишечные и толстокишечные.
По выделяемому содержимому из органов: каловые, слизистые, гнойно-каловые, гнойно-слизистые.
По наличию осложнений: осложненные и неосложненные.
Спаечная болезнь кишечника также чаще всего возникает в послеоперационный период. Эта проблема в хирургии не утратила актуальность по сей день. У этой патологии нет специфических симптомов, часто она может длительное время протекать и вовсе безсимптомно и впервые быть обнаруженной после колоноскопии.
Существует множество вариантов классификаций спаечной болезни. В классификации Симоняна К.С. (1966г), Женчевского Р.А. (1989г) описывается стадии развития спаечного процесса в кишечнике. Напалков П.Н.(1977г) спаечный процесс классифицирует по стадиям развития и морфологическим изменениям кишечника.Балаценко Д.Н. приводит классификацию по объему патологического процесса. Объединив все вышеуказанные классификации можно прийти к следующему выводу:
По причине возникновения: Врожденные и приобретенные;
По объему патологического процесса: ограниченные, распространенные и сплошные;
По уровню возникновения: высокая (тонкокишечные спайки), низкая( толстокишечные спайки);
1 стадия: Болевой синдром без задержки стула или с неустойчивым стулом и диареей;
2 стадия: Болевой синдром с задержкой стула;
3 стадия: Рубцово-спаечная обтурация и странгуляция кишечника.
Лечение в каждой стадии будет отличаться.В первой стадии можно применить консервативну терапию; во второй стации назначается стационарный режим, консервативную терапия и плановое оперативное вмешательство; в третей стадии экстренное хирургическое вмешательство.[3]
Причины возникновения спаечной болезни:
- Открытые и закрытые травмы живота.
- Хирургические вмешательства на органах брюшной полости.
- Воспалительные заболевания органов брюшной полости.
- Лучевая терапия ( при лечении онкологических заболеваний в брюшной полости)
- Генетическая предрасположенность.
В основе патогенеза лежит экссудативное восполение вследствие травмы бршины.На месте повредения брюшины возникает экссудат богатый фибрином, фибринозные образования выпадают на поврежденную область брюшины, и на вторые сутки покрывают ее. Поврежденные участки покрытые фибриновыми нитями при соприкосновении склеиваются меду собой, появляются коллагеновые волокна, образуется хорошо васкуляризованная юная соединительная ткань, в ней в результате формирования анастомозов между сосудами и нервными волокнами , формируются спайки.
Полученные результаты показали, что за 2016 год у 12 пациентов были выявлены кишечные свищи. Основными причинами, которые привели к таким осложнениям были острый аппендицит у 1(8%), дивертикулы тонкого кишечника у 4 (33,3%), на месте лигатуры у 3 (25%) ,несостоятельность швов после операции-4 случая (33,3%) в основном после хирургических вмешательств, связанных с резекцией кишечника . Из них тонкокишечные у 8 (68%), свищ на месте лигатуры у 3 (25%), толстокишечный у 1 (7%) больных. На долю больных с наружными свищами приходится 2 (20%), с внутренними 10 (80%) , сформированный свищ был выявлен у 2 (20%), несформированный у 10 (80%) пациентов. Данная патология в два раза чаще встречалась у женщин, чем у мужчин. У всех пациентов свищи являлись осложнением основного заболевания. Возраст пациентов как правило старше 50 лет 7 (67%).
Приводим клиническое наблюдение пациентки после левосторонней гемиколэктомии и экстирпации матки.
Больная Х,54 года, женского пола, была переведена в хирургическое отделение РКБ№1 с осложнением - вскрытие толстокишечного свища в области рубца с отделяемым кишечного содержимого.
Жалобы при поступлении: общая слабость, боли в ране в эпигастральной области, отделяемое из свищей кишечного содержимого, повышение температуры тела до 38 градусов.
Состояние тяжелое, пациентка в сознании. Кожные покровы бледно-серого цвета, сухая. Дыхание жесткое, ослаблено в нижних отделах, хрипов нет. ЧДД 18 в мин. АД 100/70 мм.рт.ст. ЧСС 96 ударов в мин.
Подкожно-жировая клетчатка умеренного питания. Живот мягкий, болезненный в местах эрозии околокишечного свища в области эпигастрия. Симптом раздражения брюшины отрицательный. Перистальтика выслушивается в правом подреберье и в области послеоперационной раны, определяется инфильтрат без четких границ. В левой подвздошной области сформировано свищевое отверстие. В эпигастрии по средней линии рана 3.5*1.5 см с геморрагическим кишечным обильным жидким отделяемым, зловонного запаха. Эвакуировано до 800 мл отсосом. Рана промыта водным хлоргексидином.
За время пребывания в стационаре проведены анализы крови, мочи, кала, мокроты, отделяемого из раны, ультразвуковое исследование органов брюшной полости, магнитно-резонансная томография, рентгенография органов грудной клетки, фистульная холангиограмма.
В общем анализе крови количество эритроцитов снижено (RBC-2.7*10^12\л), гемоглобин (HGB-60 г\л) снижен, в коагулограмме повышено содержание фибриногена(10 г\л), в биохимическом анализе крови высокое содержание мочевины(18,2 ммоль\л), количество общего белка понижено(40,0 г\л). В общем анализе мочи протеинурия (30 мг\л). В анализе мокроты обнаружены бактерии стафилококка. Заключение рентгенографии органов грудной клетки: Гиповентиляция базальных отделов легких.
Поставлен окончательный клинический диагноз –
Основное заболевание: Несформированный толстокишечный свищ, колостома.
Осложнения основного заболевания: -
Сопутствующие заболевания: анемия средней степени тяжести.
Проведено следующее консервативное лечение: режим стационарный, диета №1, глюкоза 5% по 500 мл. 1 раз в день внутривенно, раствор Рингера 1000 мл. 1 раз в день внутривенно, цифтриаксон 200,0 внутримышечно 2 раза в день, кеторол 1,0 внутримышечно 1 раз в день.
Хирургическое лечение: санация брюшной полости, дренирование. Катетеризация магистрального венозного сосуда. Проведена трансфузия.
Смертность после оперативного лечения кишечных свищей достигает 2-10% (в зависимости от вида свища и состояния пациента перед операцией). Самые частые причины смерти таких больных – сепсис и почечная недостаточность. При своевременном выявлении свищевого хода, возможно его самопроизвольное закрытие на фоне консервативной терапии в 40% случаев. Профилактика образования кишечных свищей заключается в своевременном выявлении и лечении фоновых заболеваний, приводящих к формированию свищевых ходов.
По полученным данным исследования, мы пришли к выводу, что кишечные свищи, как тяжелое осложнение, возникают чаще по поводу несостоятельности кишечных швов после операции. Поэтому большое значение имеет в клинической практике профилактика и качественное наблюдение за больными после абдоминальных операций.
Клинический случай по спаечной болезни.
Больной Х, 61 год, мужского пола, поступил в хирургическое отделение 1 РКБ с жалобами на общую слабость, тупые боли в эпигастральной области, иррадиирущие по всей поверхности живота, схваткообразные, стихающие на несколько минут, по интенсивности сильные. Беспокоят вздутие живота, тошнота и рвота, задержка стула в течение недели.
В 2016 году перенёс операцию - грыжесечение из-за пупочной грыжи, которая явилась фактором риска острой спаечной кишечной непроходимости, возникшей в данное время.
Состояние средней степени тяжести, сознание ясное, положение активное. Кожные покровы физиологической окраски. Дыхание везикулярное. Пульс= 80уд/мин. АД= 130/60 мм.рт.ст. Живот равномерно умеренно вздут, мягкий, умеренно болезненный в пупочной области и левой фланке. Проба Шварца: непроходимость в желудке и проксимальных отделах тощей кишки. При перкуссии живота над всей поверхностью брюшной полости определяется тимпанический перкуторный звук. Над растянутыми кишечными петлями определяется высокий тимпанит. Толчкообразные движения руки над растянутыми кишечными петлями вызывают шум плеска, что свидетельствует о скоплении в приводящей петле жидкости и газа. При аускультации выслушивается периодическая усиленная перистальтика кишечника.
За время пребывания в стационаре проведены лабораторно- инструментальные исследования: анализ крови, мочи, обзорная рентгенография и ультразвуковое исследование органов брюшной полости, электрокардиография.
В общем анализе крови количество эритроцитов снижено (RBC-3.4*10^12\л), гемоглобин (HGB-104 г\л) снижен, выявлена тромбоцитопения, в коагулограмме повышено содержание фибриногена(5,46 г\л), ПТИ (46000%), ПТВ (23,600сек), МНО(1,830), D-димер(1.510,400 мкг/л) в биохимическом анализе крови высокое содержание мочевины(11,2 ммоль\л), количество общего белка понижено(49,0 г\л). В общем анализе мочи лейкоцитоз (6-7 в поле зрения, моча мутная).
Заключение обзорной рентгенографии органов брюшной полости: выявлены рентгенологические признаки частичной тонкокишечной в непроходимости. Заключение ЭКГ-признаки гипертрофии левого желудочка. УЗИ органов брюшной полости - в левой половине брюшной полости определяется конгломерат петель кишечника 16х 8 см, с крайне вялой перистальтикой. Вокруг конгломерата и в брюшной полости свободная жидкость в небольшом количестве до 200мл. Заключение: признаки диффузных изменений печени, поджелудочной железы, свободная жидкость в брюшной полости, косвенные признаки тонкокишечной непроходимости.
Поставлен окончательный клинический диагноз –
Основное заболевание: Спаечная болезнь брюшной полости. Спаечная частичная тонкокишечная непроходимость
Осложнения основного заболевания: -
Сопутствующие заболевания: постгеморрагическая анемия 2 ст.,Генерализованный атеросклероз аорты и её ветвей. Облитерирующий атеросклероз сосудов нижних конечностей 3ст.Гипертоническа болезнь 2стадия 2 степени. ХСН-0.
Хирургическое лечение: лапаротомия, рассечение спаек, интубация кишечника.
Читайте также:

