Послеоперационные инфекционные осложнения антибиотики
Обновлено: 19.04.2024
Послеоперационные инфекции в гинекологии
Инфекции — главные причины послеоперационных осложнений. Факторами риска инфекционного заболевания у больных со злокачественными новообразованиями половых органов служат недостаточная профилактика антибиотиками до операции, контаминация операционного поля из инфицированных тканей или выход содержимого толстой кишки в брюшную полость, ослабление иммунитета, диабет, несбалансированное питание, хроническое и тяжелое заболевание, неквалифицированное выполнение операции и существование очаговой или системной инфекции.
Источниками послеоперационной инфекции могут быть легкие, мочевыводящий тракт, операционная рана, боковая стенка таза, культя влагалища и места введения в/в катетеров. Для эффективных результатов терапии любых инфекционных потенциально опасных осложнений необходимы ранняя диагностика и лечение.
Хотя инфекционное заболевание — неизбежное осложнение после операции, вероятность инфицирования может быть снижена за счет адекватных простых мер профилактики. Также неизбежен выход в брюшную полость содержимого толстой кишки при ее травматизации. Проведение до операции механической и антибактериальной подготовки кишечника в сочетании с системной профилактикой антибиотиками поможет снизить вероятность послеоперационного тазового и абдоминального инфицирования. Хирург может снизить риск инфекционных осложнений, используя хорошо отработанные хирургические методики.
Кровь и некротическая ткань служат превосходной средой для роста аэробных и анаэробных микроорганизмов. В случаях более высокой, чем обычно, вероятности скопления сыворотки и крови в местах, которые были контаминированы микроорганизмами, закрытый аспирационный дренаж может снизить риск инфекции. Плановые хирургические вмешательства у пациенток с инфекционным заболеванием должны быть отложены.
Исторически сложилось, что стандартом для определения лихорадки у оперированных больных было два последовательных повышения температуры тела до 38 °С как минимум с интервалом 4 ч, за исключением первых суток после операции. Однако в других работах лихорадочное состояние определялось как два последовательных повышения температуры тела более 38,3 °С. Предполагают, что лихорадочное состояние наблюдается у половины больных после операции; однако оно часто исчезает самостоятельно и, как правило, не есть следствие инфекции.

Для дифференциальной диагностики инфекционной этиологии лихорадочных состояний и других их причин чаще используют показатель температуры 38,3 °С, а не 38 °С.
Оценка лихорадочных состояний у оперированных больных должна включать анализ истории болезни, причем особое внимание следует уделять факторам риска. И при изучении истории болезни, и при физикальном исследовании необходимо рассматривать вероятные источники инфекции. Следует обследовать носоглотку, провести полное исследование легких, перкуссию почек, чтобы определить болезненность в реберно-позвоночном углу, пальпировать место разреза брюшной стенки, осмотреть места расположения в/в катетеров и конечности, чтобы выявить наличие тромбоза глубоких вен (ТГВ) или тромбофлебита.
У больных со злокачественными новообразованиями женских половых органов диагностика может также включать исследование и пальпацию культи влагалища (определить индурацию, болезненность или гнойные выделения). Необходимо провести гинекологическое исследование с целью диагностики тазовой гематомы, абсцесса или параметрита.
Больные с лихорадкой в ранний послеоперационный период нуждаются в активной санации дыхательных путей, включая стимулирующую спирометрию. Если лихорадка сохраняется более 72 ч после операции, необходимо получить результаты дополнительных лабораторных исследований, которые могут включать клинический анализ крови, определение лейкоцитарной формулы и анализ мочи.
Информативность общепринятого бактериологического исследования мочи составляет лишь 9 %, поэтому не следует проводить это исследование, пока не получены результаты анализа мочи или не выявлены симптомы. Рутинная рентгенография грудной клетки информативна в 12,5 % случаев и необходима больным с и без признаков локализации инфекции в легких. Также можно провести посев крови, но если у больной нет высокой температуры тела (38,9 °С), скорее всего, информативность этого исследования будет минимальной.
Больным, испытывающим боль в реберно-позвоночном углу, следует выполнить КТ, УЗИ почек или внутривенную пиелографию, чтобы исключить повреждение мочеточника или его обструкцию вследствие операции, особенно если отсутствуют лабораторные доказательства инфицирования мочевых путей. Больным, у которых лихорадка сохраняется и причина ее не определена, необходимо провести КТ органов брюшной полости и таза, чтобы исключить интраабдоминальный абсцесс. Наконец, после операции на ЖКТ в 1-ю неделю после хирургического вмешательства, если сохраняется высокая температура тела, требуется ирригоскопия или исследование верхних отделов ЖКТ вместе с тонкой кишкой, чтобы исключить нарушение целостности анастомоза или наличие свища.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
М.Н. ЗУБКОВ, доктор медицинских наук, профессор, вице-президент Межрегиональной ассоциации клинической микробиологии и антимикробной химиотерапии (МАКМАХ). ПРОФИЛАКТИКА И ТЕРАПИЯ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
Основная роль антибиотикопрофилактики в хирургии заключается в предупреждении инфекций, возникающих вследствие операции или других инвазивных вмешательств либо имеющих прямую связь с ними, а побочная цель - в уменьшении продолжительности и стоимости пребывания больного в стационаре.
Ее суть состоит в достижении эффективных концентраций антибиотика в операционной зоне во время ее микробного загрязнения и поддержании бактерицидного уровня препарата в течение всей операции и первых 3-4 часов после оперативного вмешательства, поскольку этот отрезок времени является решающим для размножения и адгезии на клетках хозяина попавших в рану микробов, что служит пусковым механизмом для начала инфекционно-воспалительного процесса в ране. Антибиотикопрофилактика, начатая по истечении этого периода, является запоздалой, а ее продолжение после окончания операции в большинстве случаев излишним, поскольку профилактическая роль антибиотика в основном заключается в уменьшении пороговой концентрации бактерий в ране и препятствии адгезии возбудителя.
Антибиотикопрофилактика показана там, где особенно высок риск развития послеоперационной инфекции (например, при "условно чистых" операциях на органах брюшной, грудной полости и малого таза, затрагивающих слизистые оболочки, населенные микрофлорой) или если ее последствия могут представлять угрозу здоровью и жизни больного (при некоторых "чистых" операциях, связанных с имплантацией сосудистых шунтов или искусственных протезов, когда немногочисленные и малопатогенные микроорганизмы с поверхности кожи могут проникнуть глубоко в рану и вызвать ее нагноение). Если хирург заранее уверен, что встретится с инфекцией в процессе операции (например, при "условно чистых" или "загрязненных" вмешательствах), в качестве антибактериальной защиты проводят превентивную антибиотикотерапию, которая должна быть ограничена самыми жесткими показаниями: патофизиологическими предпосылками (например, перфорация органов желудочно-кишечного тракта в результате проникающего ранения или имеющая эндогенное происхождение, сопровождающаяся загрязнением кишечной микрофлорой брюшной полости и прилегающих к ней структур); наличием входных ворот инфекции (например, открытые переломы); биологией потенциального возбудителя. Раннее назначение антибиотиков, обычно в течение 12 часов с момента перфорации или травмы, расценивается как профилактика, более позднее, когда развились признаки серьезной инфекции, - как лечение.
В большинстве случаев для профилактики послеоперационной инфекции достаточно одной дозы антибиотика (во время премедикации; вторая доза вводится при 3-часовых и более длительных операциях) либо проводят сверхкраткий курс антибиотикопрофилактики, ограниченный двумя-тремя дозами препарата. Такая тактика, основанная на многочисленных клинических и экспериментальных наблюдениях, вполне эффективна, снижает вероятность побочных действий антибиотика, ограничивает возможность развития устойчивости бактерий к химиопрепаратам, обеспечивает меньшую стоимость лечения. Профилактическое применение антибиотиков задолго до операции или более 48 часов в послеоперационном периоде ведет к нарушению биоценоза желудочно-кишечного тракта и колонизации верхних его отделов микрофлорой толстой кишки с возможным развитием эндогенной инфекции путем бактериальной транслокации условных патогенов через лимфатическую систему тонкого кишечника. Кроме того, возрастает опасность суперинфекции у оперированных больных за счет селекции антибиотикорезистентных штаммов. Поэтому антибиотик следует вводить больному в соответствующей дозе непосредственно перед операцией (за 10-15 мин. внутривенно во время наркоза либо за 40-60 мин. до операции внутримышечно) с последующими повторными инъекциями по показаниям, но не более 24-48 часов.
Для профилактики раневой инфекции чаще всего назначают цефалоспорины 1-го и 2-го поколения (препараты 3-го поколения существенно дороже и используются в основном для лечения), так как они имеют достаточный спектр бактерицидной активности против наиболее распространенных возбудителей послеоперационных осложнений, и прежде всего стафилококков; при парентеральном введении создают высокие концентрации в операционной зоне; отличаются малой токсичностью и частотой побочных действий. К числу недостатков всех цефалоспоринов следует отнести неэффективность при энтерококковой инфекции; плохое проникновение через гематоэнцефалический барьер (кроме цефтазидима и некоторых других препаратов 3-го поколения); возможное увеличение нефротоксичности в комбинации с аминогликозидами.
Помимо цефалоспоринов при высоком риске стафилококковой хирургической инфекции у ортопедических и некоторых других категорий больных применяют ванкомицин. При колоректальных операциях наряду с пероральным промыванием кишечника изотоническим раствором за сутки до операции больному назначают внутрь неомицин, 1 г + эритромицин, 1 г в 13, 14 и 22 ч., а в день операции - цефалоспорины 1-2-го поколения в/в дважды с интервалом 8 ч. При катаральном и флегмонозном аппендиците достаточно однократного применения в/в цефазолина (1 г) или цефуроксима (1,5 г) либо проведения короткого курса (2-3 дозы). При гангренозном аппендиците дополнительно вводят метронидазол, 0,5 г в/в. Если в послеоперационном периоде возникает подозрение на перитонит и/или абсцедирование, продолжают применение антибиотиков в течение 3-5 суток. Схемы профилактики при других видах операций приведены в таблице 1.
Таблица 1
ВАРИАНТЫ АНТИБИОТИКОПРОФИЛАКТИКИ (АП) РАНЕВОЙ ИНФЕКЦИИ ПРИ НЕКОТОРЫХ ВИДАХ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ*
1 Первую дозу цефалоспорина вводят в/в во время вводного наркоза (за 10-15 мин. до разреза); при операциях > 3 ч антибиотик вводят повторно; при реконструктивных операциях на сосудах и нервных окончаниях АП продлевают до 2-3 сут.
2 До 3 дней, по показаниям.
3 В/в капельно в течение 1 часа.
4 Профилактика газовой гангрены.
5 АП не показана при катетеризации сердца.
6 О преимуществах нетилмицино см. в тексте.
7 Цефалоспорины 2-го поколения, активные против анаэробов.
8 При брюшном доступе повторяют по 1 г в/в через 8 ч и 16 ч.
Антибиотикопрофилактику считают неэффективной, если в области первичного операционного разреза возникла послеоперационная инфекция; если появилась необходимость дренирования операционной зоны; если в течение 4-недельного периода после первичной операции понадобилось не находящее объяснений применение антимикробных препаратов.
При уже развившейся хирургической инфекции на начальном этапе лечения назначение антибиотиков носит эмпирический характер до получения результатов бактериологического исследования материалов из раны. При этом выбор тактики химиотерапии зависит от характера хирургической патологии и локализации гнойно-воспалительного процесса, определяющих специфику раневой инфекции. Вполне естественно, что при перитонитах, где превалирует анаэробная флора в ассоциации с энтеробактериями, и при инфекциях костей и мягких тканей, где ведущую роль играют стафилококки, алгоритмы эмпирической антибиотикотерапии будут различными.
При травматических ранах с признаками нагноения назначают комбинированную терапию, учитывая лидирующее положение стафилококков и высокий удельный вес микробных ассоциаций (до 70%) при посттравматических инфекциях. Обычно используют гентамицин (4,5 мг/кг/сут) в сочетании с оксациллином (4-6 г/сут), цефазолином (3 г/сут) или линкомицином (1200-1800 мг/сут) при высоком риске развития анаэробной инфекции.
Состав микрофлоры при перитонитах
Стрептококки - 11%
Энтеробактерии - 24%
Стафилококки - 5%
Псевдомонады - 12%
Анаэробы - 48%
Состав микрофлоры при инфекциях костей и мягких тканей
Стрептококки - 7%
Энтеробактерии - 15%
Стафилококки - 60%
Псевдомонады - 8%
Анаэробы - 10%
Но особенно следует выделить антисинегнойную активность пиперациллина и тазоцина, что позволяет использовать их для лечения внутрибольничных инфекций в виде монотерапии (4 г/0,5 г тазоцина) или в комбинации с нетилмицином (4,5 г/кг/сут).
При острых интраабдоминальных инфекциях (80% из них возникает вне стационара), когда точная локализация неизвестна, лечение направляют против смешанной флоры кишечника, включающей факультативные грамотрицательные бактерии и часто встречающиеся анаэробы (Clostridium spp. и Bacteroides spp.). Одна из применяемых в настоящее время схем противоинфекционной терапии предусматривает комбинацию аминогликозида с антианаэробным препаратом (метронидазол или клиндамицин). Многие хирурги предпочитают добавлять ампициллин для воздействия на энтерококки. Назначение тазоцина по эффективности не уступает комбинированному препарату имипенем-циластатин. Широко используются также комбинации цефалоспоринов 3-го поколения с клиндамицином или метронидазолом. Парентеральную терапию продолжают до исчезновения лихорадки, снижения числа лейкоцитов крови (< 1200 в 1 мкл), восстановления функции кишечника (обычно примерно после недельного курса лечения).
Инфицирование послеоперационных ран относится к разряду внутрибольничных инфекций, где возможны разные варианты эмпирической антибиотикотерапии в зависимости от тяжести течения раневой инфекции и особенностей формирования резистентности бактерий к антибиотикам. При неосложненных инфекциях мягких тканей, как правило, обходятся монотерапией, в то время как осложненные инфекции, требующие повторных оперативных вмешательств и нередко приобретающие системный характер, чаще нуждаются в назначении антибиотиков более широкого спектра действия или проведении комбинированной антибиотикотерапии.
При лечении тяжелых и жизнеугрожающих инфекций препаратами выбора становятся аминогликозиды, спектр действия которых охватывает подавляющее большинство аэробных грам(-) и грам(+) бактерий (за исключением стрептококков и пневмококков), а в комбинации с пенициллином они оказывают синергическое бактерицидное действие на энтерококки. Однако, несмотря на их активность против Staphylococcus spp., аминогликозиды не следует применять в качестве стартовой монотерапии при стафилококковой инфекции. Гентамицин наиболее широко применяется в практике, однако имеется много свидетельств о высоком удельном весе резистентных к нему микробных изолятов от стационарных больных, что снижает эффективность лечения хирургической инфекции. Наиболее активным среди аминогликозидов является нетилмицин (нетромицин), который, по нашим данным, превосходит другие антибиотики этой группы и некоторые цефалоспорины 3-го поколения и сопоставим по антимикробной эффективности лишь с фторхинолонами (см. табл. 2). У него наименее выражен ото- и нефротоксический эффект, что позволяет вводить суточную дозу препарата однократно без увеличения частоты побочных осложнений. Такой режим введения существенно увеличивает ударное антимикробное действие нетилмицина и имеет экономические преимущества. По стоимости он гораздо доступнее амикацина и, по нашему опыту, должен занять первостепенное положение среди аминогликозидов в лечении оппортунистических инфекций.
Таблица 2
АНТИБИОТИКОЧУВСТВИТЕЛЬНОСТЬ ГРАМ(-) БАКТЕРИЙ ПРИ ИНФЕКЦИЯХ КОСТЕЙ И МЯГКИХ ТКАНЕЙ (%)
| Антибиотики | E.col (n=28) | KES* (n=48) | Proteus spp. (n=22) | P.aeruginoza (n=37) | Acinetobacter (n=19) |
| Нетромицин | 100 | 90 | 73 | 74 | 88 |
| Амикацин | 75 | 40 | 57 | 67 | 75 |
| Тобрамицин | 58 | 34 | 22 | 63 | 43 |
| Гентамицин | 50 | 36 | 30 | 58 | 27 |
| Цефтазидим | 83 | 40 | 70 | 57 | 40 |
| Ципрофлоксацин | 100 | 88 | 79 | 83 | 80 |
Нельзя обойти вниманием и фторхинолоны, которые все чаще становятся препаратами выбора при системных инфекциях. Среди них ципрофлоксацин (ципробай, ципринол) занял прочное место в хирургической практике, в то время как другие препараты этой группы чаще используются для лечения больных терапевтического профиля. Наличие инфузионной формы препарата существенно повышает его конкурентоспособность при лечении больных в реанимационных отделениях, а возможность проведения так называемой ступенчатой терапии с переходом на пероральный прием антибиотика (без существенного снижения его концентрации в крови из-за высокой биоусвояемости при всасывании) значительно снижает стоимость курса лечения. Область применения ципрофлоксацина в хирургии с одинаковым успехом распространяется на инфекции костей и мягких тканей, интраабдоминальные инфекции, инфекции органов грудной полости и малого таза и, конечно, при лечении сепсиса.
Таким образом, применение антибиотиков в хирургии с профилактической и лечебной целью имеет свои особенности, а знание спектра возбудителей хирургических инфекций и антимикробного действия химиопрепаратов является основой правильного их применения в клинике.
Антибактериальная терапия в послеоперационном периоде ранений - принципы
Частота гнойно-септических осложнений после ранений груди и живота в течение многих лет остается на постоянном уровне. Официальные источники указывают, что в хирургических стационарах такие осложнения развиваются у 12-18,5% пострадавших. Спектр возбудителей представлен микроорганизмами, относящимися к различным группам бактерий (анаэробы, аэробы), вирусам, грибам, и включает как патогенные, так и условно-патогенные микроорганизмы. Однако, по данным некоторых авторов, в зависимости от характера и локализации повреждений количество осложнений может достигать 48% [Бисенков Л.Н., Ерюхин И. А. и др., Роостар Л., Розанов В.Е. и др., Tacyiliz I.H. et al., Degiannis E. et al., Bostrom L., Nilsson В., Nagy K.K. et al.].
Хирургическое лечение ранений шеи, груди и живота сопряжено с риском инфицирования тканей, частота которого, по некоторым данным, достигает 25% [Baric P. S. et al.].
Н. Wacha и соавт. приводят следующие факторы риска возникновения раневой инфекции:
— квалификация хирурга;
— продолжительность операции более 2 ч с увеличением риска с каждым часом;
— инфицирование зоны ранения;
— гемотрансфузия;
— продолжительность наркоза;
— одновременные операции в нескольких областях тела;
— гипоксия;
— переохлаждение;
— использование ранорасширителя.
P. Gastmeier и соавт. пришли к выводу, что плохая хирургическая техника может привести к нарушению асептики или непреднамеренному вскрытию полого органа с контаминацией зоны хирургического вмешательства.
Обращает на себя внимание тот факт, что авторы этих исследований на первое место ставят уровень квалификации хирурга, и с этим выводом приходится согласиться. Подчеркнем еще такие факторы, относящиеся непосредственно к нашим пациентам, как вмешательство сразу в нескольких областях тела, что и имеет место при сочетанных ранениях, а также использование реберного расширителя, без которого не обходится ни одна классическая торакотомия.
Что касается послеоперационного периода, то Н. Wacha и соавт. выделяют такие факторы риска:
— наличие дренажей серозных полостей на протяжении более 3 сут;
— острый респираторный дисстресс-синдром;
— переохлаждение;
— инвазивные методики лечения (катетеризация мочевого пузыря, дренирование плевральной полости, назогастральное дренирование, катетеризация центральных вен).
С нашей точки зрения, для возникновения гнойно-септических осложнений необходимо сочетание нескольких факторов — внешних (по отношению к организму пострадавшего) и внутренних.
К внешним факторам, не зависящим от организма, следует отнести в первую очередь степень контаминации нанесенных пациенту ран. При наличии более 100 тыс. микроорганизмов на 1 г ткани риск нагноения существенно возрастает даже при высоком уровне иммунитета. Бактериальное загрязнение из внешней среды обусловлено либо самим ранящим предметом, либо частицами земли, одежды и т.д. При нарушении целости органов пищеварительного тракта, мочеполовых и воздухоносных путей обширная контаминация стерильных тканей происходит как в момент ранения, так и в течение времени, пока рана остается открытой. Т. Krizek и соавт. показали, что при наличии инородных тел порог для возникновения раневой инфекции снижается в 1000 раз.

Не менее важными факторами являются вид ран (резаная, рвано-ушибленная, огнестрельная), ее глубина, локализация, наличие некротических тканей и степень кровоснабжения тканей в ее окружности. Последний упомянутый фактор хорошо известен — чем скуднее кровоснабжение тканей, тем легче возникает инфекционно-воспалительный процесс.
К внешним, не менее значимым факторам, следует отнести многие медицинские манипуляции, которые, нарушая естественные механические и биологические барьеры, также способствуют инвазии микробной флоры. Эндотрахеальные и трахеостомические трубки, желудочные и тонкокишечные зонды, сосудистые и мочевые катетеры являются инородными телами и представляют собой факторы риска, даже при строгом соблюдении асептики. Если же учесть, что реально при критическом состоянии пострадавшего с ранами шеи, груди и живота рутинными правилами асептики нередко пренебрегают, становится ясным значение этих факторов в генезе гнойно-септических осложнений.
Однако более существенную роль играют внутренние факторы, весь спектр которых в конечном итоге сводится к состоянию иммунитета (степень кровопотери, сопутствующая хроническая патология, возраст и т.д.). Еще в 1988 г. D. H. Livingston и М.А. Malungoni в экспериментах на животных доказали прямую зависимость тяжести течения гнойно-септических процессов от степени кровопотери. В последующем было уточнено, что одним из главных факторов, определяющих риск возникновения инфекции, является уровень напряжения кислорода в тканях, поскольку активность полиморфноядерных лейкоцитов зависит от содержания кислорода [Kinighton D.R. et al.].
Одним из важных, но по-прежнему дискуссионных вопросов является целесообразность назначения антибиотиков в целях профилактики гнойных осложнений. В связи с этим следует признать, что проведенные еще в середине XX века исследования показали неэффективность антибактериальной профилактики пневмонии у пациентов в группе риска. Гораздо действенней оказались такие меры, как полноценное обезболивание, коррекция гомеостаза, тщательная санация трахеобронхиального дерева, строгое соблюдение правил асептики при установке и смене эндотрахеальных трубок и возможно более раннее их удаление.
В ряде более поздних исследований — D. Demetriades и соавт., Р. J. Cant и соавт., R. P. Gonzalez и соавт. — доказывается эффективность профилактического назначения антибиотиков, в то время как в других — R. L. Nichols и соавт., А. К. Mandall и соавт. — не было выявлено заметной разницы в частоте развития осложнений в группах пациентов, которым антибиотики применяли и которым — не применяли. На основании 5474 наблюдений дренирования плевральной полости А. К. Mandall и соавт. доказали, что единственным фактором риска развития эмпиемы плевры при этом является остаточный (свернувшийся) гемоторакс.
Действительно, если считать, что частота развития эмпиемы плевры при проникающих ранениях груди составляет в среднем около 2 %, то для предотвращения двух случаев развития эмпиемы необходимо пролечить антибиотиками 100 пострадавших с проникающими ранениями и получить у них устойчивую к антибиотику микрофлору.
Однако на самом деле приведенные выше исследования не учитывают наиболее значимый, с нашей точки зрения, фактор — степень кровопотери. Любые, даже самые совершенные методы компенсации кровопотери, включая аппаратные методы реинфузии крови, не могут восполнить все компоненты циркулирующей крови и прекратить процесс, запущенный в организме самим фактом острой кровопотери.
Целесообразность введения антибиотиков в группах риска (массивная кровопотеря, повреждения полых органов, позднее поступление пациентов с проникающими ранениями) не вызывает сомнений. Многими исследователями — D. H. Livingston и соавт., C.D. Ericsson и соавт., R. L. Reed и соавт. — установлено, что в группах риска высокие дозы антибиотиков в тканях на начальных этапах лечения более важны, чем большая продолжительность курса лечения. При этом в работе С. D. Ericsson и соавт. доказана одинаковая эффективность профилактического введения антибиотиков в течение 24 ч и на протяжении 72 ч после ранения.
Профилактическое применение современных сильных антибиотиков резко уменьшило частоту гнойных осложнений, в том числе и при ранениях толстой кишки. Это позволило ряду хирургов пересмотреть хирургическую тактику и сократить показания к наложению колостом [Nichols R. L. et al., Demetriadcs D. et al.]. С точки зрения этих авторов, единственной причиной несостоятельности швов, наложенных на стенку толстой кишки, является недостаточная декомпрессия желудочно-кишечного тракта в послеоперационном периоде. Однако эту точку зрения поддерживают далеко не все хирурги, тем более что опыт последних лет свидетельствует о том, что вера в эффективность антибактериальной терапии себя не оправдала.

Мы считаем, что ведущим фактором, влияющим на развитие гнойно-септических осложнений послеоперационного периода, является объем кровопотери. Руководствуясь современной концепцией деэскалационной антибактериальной терапии, мы рекомендуем профилактическое применение антибиотиков у пострадавших с кровопотерей более 2 л и у пострадавших с повреждением полых органов. Первое введение антибиотиков должно быть на операционном столе либо в первый час после операции в условиях отделения интенсивной терапии. При ранениях шеи и груди (без повреждений полых органов) можно ограничиться применением цефалоспоринов 3-го поколения, при ранениях живота и повреждениях полых органов — сочетанием аминогликозидов с клиндамицином.
Эти же группы риска с первых суток послеоперационного периода нуждаются в проведении неспецифической иммунной терапии. Как известно, для реализации адекватного иммунного ответа на повреждающее действие необходимо определенное время, в течение которого происходит пролиферация иммунокомпетентных клеток и синтез специфических белков. Особенно уязвимой иммунная система становится при дефиците иммуноглобулинов и снижении фагоцитарной активности вследствие большой кровопотери.
В связи с этим большое значение приобретает профилактическая иммунокоррекция. Ее мы рассматриваем не только как средство заместительной терапии, восполняющей дефицит быстро потребляемых при тяжелых ранениях факторов иммунитета, но и как средство направленного изменения иммунного ответа для профилактики системных нарушений гомеостаза.
Наиболее известными препаратами являются тактивин (тимоген), который способствует дифференцировке Т-лимфоцитов и восстанавливает прямую и обратную связь между иммунной и эндокринной системой, и миелопид, который активирует окислительный метаболизм и фагоцитоз нейтрофилов, образование зрелых моноцитов и функциональную активность Т-хелперов. Эти препараты применяют в течение первых 3 сут после ранения и хирургической операции.
Однако не всегда их применение сопровождается заметным клиническим эффектом, так как при тяжелой травме иммунокомпетентные клетки не в состоянии отвечать на введение подобного рода препаратов.
Полноценные иммуноглобулины и специфические антибактериальные антитела, содержащиеся в высокой концентрации в плазме от иммунизированных доноров, восстанавливают комплексообразование и процессы опсонизации, в результате чего активируется фагоцитоз, уменьшается эндотоксикоз и снижается риск инфицирования.
Одним из необходимых компонентов, определяющих полноценное функционирование всех регулирующих систем организма, являются плазменные белки, дефицит или дисбаланс которых вследствие острой кровопотери поддерживает состояние иммунного дисбаланса. Донорская плазма содержит фибронектин в концентрации, необходимой для обеспечения репаративных и санирующих процессов, в том числе — фагоцитарной активности, выведения циркулирующих иммунных комплексов и белковых фрагментов, а также антиоксиданты, предупреждающие воспалительную деструкцию тканей.
Содержащиеся в плазме иммунизированных доноров медиаторы ускоряют дифференцировку клеток и их межклеточные взаимодействия, что способствует процессу иммунореабилиации после ранения и кровопотери.
Учитывая нарушение механизмов синтеза белков в раннем послеоперационном периоде у пострадавших с массивной кровопотерей, мы широко используем свежезамороженную антибактериальную плазму или плазму неиммунизированных доноров как средство заместительной терапии.
Опыт показывает, что тяжелые гнойные осложнения чаще всего развиваются у пострадавших с повреждениями, сопровождающимися массивной кровопотерей, с повреждениями нескольких анатомических областей и жизненно важных органов, а также с повреждениями, сопровождающимися массивным инфицированием. Поэтому проведение иммунопрофилактики у пострадавших с признаками развития вторичного иммунодефицитного состояния мы основываем на следующих положениях:
1) при множественных сочетанных ранениях шеи, груди и живота обоснованная иммунопрофилактика должна быть начата как можно ранее с момента получения ранения;
2) основанием к назначению иммуномодуляторов является несоответствие клинической картины и данных лабораторных методов исследования: если при наличии обширных повреждений с массивной кровопотерей в первые 2 сут отсутствует лейкоцитоз, имеется абсолютная лимфопения с преобладанием незрелых форм гранулоцитов, диспротеинемия;
3) основной задачей иммунопрофилактики является возмещение утраченных звеньев иммунорегуляции для обеспечения адекватной воспалительной реакции;
4) не менее важно обоснованное применение препаратов, способных снизить чрезмерную воспалительную активность моноцитов/макрофагов и полиморфноядерных нейтрофилов и ограничить поступление в кровоток избыточного количества медиаторов системной воспалительной реакции, эндо- и экзотоксинов (препараты антиоксидантного действия, ингибиторы протеаз, нестероидные противовоспалительные препараты).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В этой статье мы затронем одну из самых интересных тем антимикробной терапии, а именно периоперационную антибиотикопрофилактику. О нее за крайние годы сломано огромное количество копий и они, как ни странно, до сих пор продолжают ломаться.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
В этой статье мы затронем одну из самых интересных тем антимикробной терапии, а именно периоперационную антибиотикопрофилактику. О нее за крайние годы сломано огромное количество копий и они, как ни странно, до сих пор продолжают ломаться.
- особенностями преподавания принципов антибактериальной терапии в ВУЗах
- и достаточно легкого отношения к самим антимикробным препаратам бесконечно меняющиеся концепции антибактериальной терапии так же накладывают свой серьезный отпечаток.
Вы, наверное, помните, не так уж давно это было, как нас учили, что за неделю до операции пациент должен получить курс антибиотиков в качестве «подготовки к оперативном вмешательству. Потом передумали и стали проводить подобный курс уже после операции, причем абсолютно всем пациентам и вне зависимости от того, есть там инфекция или ее нет. Для профилактики. Чтобы было и не думалось. И этот подход так укоренился в сознании, что за 10 лет его никак не удается переломить.
Итак, чего бояться хирурги и почему они назначают антибактериальные препараты? А бояться они нагноения раны или говоря академическим языком – инфекции в области хирургического вмешательства (ИОХВ)
ИОХВ – это инфекция разреза, органа или полости, возникающая в течение 30 дней (без имплантата) или 1 года (с имплантатом) послеоперационного периода.
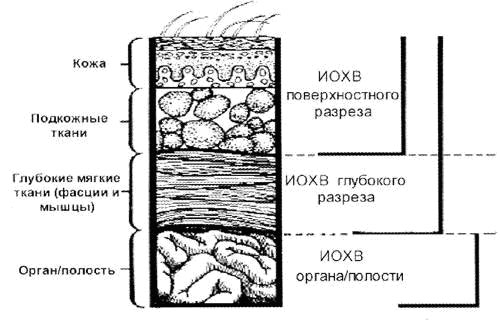
- Поверхностную ИОХВ разреза (кожа, подкожная клетчатка)
- Глубокую – ИОХВ разреза (фасция, мышцы)
- ИОХВ органа или полости
- Симптомов воспаления
- Гнойного отделяемого и лабораторное подтверждение наличия воспаления
- Достоверное микробиологическое подтверждение (окраска мазока по Граму, посев)
- необходимости вмешательство хирурга.
- Гнойное отделяемое из глубины разреза
- УЗИ и RG признаки поражения в сочетании с визуальной симптоматикой
- Спонтанное расхождение краев раны
- Присоединение глубокого поражения к поверхностному
- Необходимость хирургического вмешательства.
- Гнойного отделяемого по дренажам
- Достоверное микробиологическое подтверждение (окраска мазка по Граму, посев)
- Наличие абсцесса
Группу риска по развитию ИОХВ составляют:
- пациенты с пожилого возраста и новорожденные
- пациенты с недостатком массы тела
- больные СД
- ожирение
- сопутствующая инфекция другой локализации
- колонизация носоглотки S.aureus
- снижение местного и общего иммунитета, в т.ч. и в результате лечения.
- Особенности предоперационной подготовки – не надо брить операционное поле, это приводит к микротравматизации и увеличению риска ИОХВ
- Техника выполнения операции – при выполнении операции интернами, ординаторами и молодыми врачами, а так же в ситуациях, когда техника оперативного вмешательства еще не отточена, риски инфекции возрастают очень значительным образом.
- Несоблюдение правил асептики и антисептики
- Большая длительность операции.
- Большая кровопотеря в следствие оперативного вмешательства
- Отсутствие периоперационной антибиотикопрофилактики
- Дренирование раны
- Инфекции хирургического персонала (в том числе колонизация S.aureus)
- Степень микробной обсемененности раны
- Резистентность бактерий к антимикробной терапии.
- чистые,
- условно-чистые,
- контаминированные,
- грязные.
Чистая рана – характеризуется отсутствием признаков воспаления и вовлечения ЖКТ, МВП, дыхательных путей, а так же отсутствием технических нарушений при выполнении оперативного вмешательства.
Условно-чистая рана характеризуется вовлечением ЖКТ, мочеполовых и дыхательных путей; низкой вероятностью контаминации или незначительными техническими нарушениями при выполнении оперативного вмешательства
Контаминированная рана – имеет признаки острого негнойного воспаления; кроме того могут иметь место серьезные технические нарушения в ходе вмешательства (раны пациентов, оперированных начинающими врачами изначально должны считаться контаминированными из-за того, что техникой они еще не владеют в должном объеме)
Сюда же относится большой выброс содержимого полых органов, а также проникающие ранения со сроком менее 4 часов.
Грязные раны – характеризуются наличием гноя, предоперационной перфорацией органов и проникающими ранениями старше 4-х часов.
Итак, мы подошли к главному вопросу – когда же мы должны применить периоперационную антибиотикопрофилактику.
Периоперационную антибиотикопрофилактику мы применяем в первых трех видах ран, а в случае грязной мы с самого начала идем на антибиотикотерапию.
Почему именно тогда? В случае грязной раны возбудители могут быть какие угодно, а вот в случае первых трех, что доказано результатами многочисленных крупномасштабных исследований, ИОХВ вызовут в основном:
- Стафилококки
- Энтеробактер
- Коагулазонегативные стафилококки
- Энтерококки
- Стрептококки
- Кишечная палочка
А что же такое периоперационная антибиотикопрофилактика (ПАП) и какие цели мы перед ней ставим? Это предоперационное в/в введение антибиотика для уменьшения риска развития раневой инфекции, благодаря созданию в ране концентрации, достаточной для снижения уровня микробной контаминации тканей по ходу операционного разреза.
Давайте обратимся к очень известной картинке, которую всегда демонстрируют, когда речь идет о профилактике инфекций в хирургии:
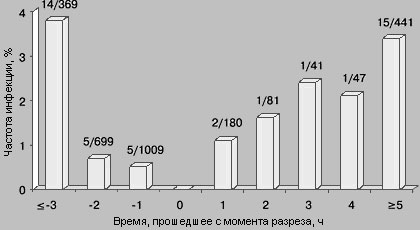
Обратите внимание, что с момента разреза контаминация тканей начинает расти в геометрической прогрессии. И введение антибиотика после операции выглядит как пальба из пушки по воробьям. При этом введение антибиотика не должно быть заблаговременным, ибо через 2-3 часа он уже будет выведен из организма, а значит и не подавит размножение микробов в ране. Таким образом, оптимальным интервалом введения, является введение антимикробного препарата за 30-40 минут до операционного разреза.
- В каких случаях следует проводить антибиотикопрофилактику?
- Какие препараты следует использовать?
- Когда необходимо начинать введение антибиотиков?
- Сколько препаратов необходимо назначить?
- Какова должна быть продолжительность антибиотикопрофилактики?
По первому пункту и третьему пунктам мы уже разобрались – профилактируем мы чистые, условно-чистые и контаминированные раны. Грязные мы начинаем сразу же лечить. А препарат вводим за 30-40 минут до разреза.
- Избирательность применения антимикробных препаратов. Т.е. препараты, применяющиеся с целью ПАП не должны больше использоваться ни в одной схеме антимикробной терапии в стационаре. Это делается для того, чтобы на максимально долгое время отсрочить развитие антибиотикорезистентности у микроорганизмов, вызывающих ИОХВ.
- Препарат должен вводится непосредственно перед операцией, за 30-40 минут до первого разреза.
- Пациентам с высокой массой тела необходимо пересчитывать дозу в сторону ее увеличения
- При длительных операциях препарат должен вводиться дважды, исходя из наиболее часто использующихся препаратов, повторная доза должна быть введена через 3-4 часа от начала оперативного вмешательства, так как это напрямую связано с фармакокинетикой антибиотика, конкретно с его периодом полувыведения (Т1/2)
- Применение ПАП более чем через 24 ч не приводит к увеличению ее эффективности. Исключением в данной ситуации являются оперативные вмешательства, проводимые молодыми врачами, осваивающими технику оперативных вмешательств. В этой ситуации антибиотикопрофилактика продляется до 72 часов.
- пациентов с трахеостомой или интубированных (для профилактики инфекций дыхательных путей);
- пациентов с постоянным мочевым катетером;
- пациентов с центральными венозными катетерами или дренажами плевральной полости;
- большинства пациентов с открытыми ранами, в том числе и ожоговыми.
Связано это с тем, что раны подвергаются постоянной контаминации и добиться там эрадикации не представляется возможным. За такими за пациентами необходим тщательный уход и контроль состояния, для того чтобы немедленно начать антибактериальную при первых же признаках инфекции
- По спектру активности – он должен включать всех наиболее часто встречающихся возбудителей
- Доза препарата должна быть обычной терапевтической (исключение – лица с ожирением)
- Время введения препарата 30-40 мин до разреза, строго!
- Кратность введения определяется Т1/2 и длительностью операции. Для основных препаратов для ПАП справедливо правило о повторном введении антибиотика через 3-4 часа от начала операции.
- легко доступен,
- дешев,
- не использоваться в схемах антибиотикотерапии в стационаре.
Почему только там? Цефазолин относится к препаратам с грам(+) активностью, он отлично воюет с грамположительными кокками, но совершенно непригоден в случае грамминус возбудителей.
Кроме того, применяя этот препарат следует помнить об общем класс-эффекте всех цефалоспоринов – лекарственные гипертермии. Примерно каждый сотый пациент выдает на цефазолин гипертермию, которая от истинной отличается тем, что проходит на фоне относительной брадикардии. Таким образом, если после АБП цефазолином у вашего пациента поднялась температура тела, а операция была чистой и в своей технике вы уверены, прежде чем паниковать и бросаться лечить его мощными антибиотиками – осмотрите рану, возьмите клинические анализы и посчитайте пульс!
Прекраснейший антибактериальный препарат, перекрывающий всех возбудителей ИОХВ и как следствие могущий использоваться при всех 3-х видах оперативных вмешательств в дозе 1,2 г в/в за 30-40 мин до разреза…
Во-вторых, его крайне сложно вывести из оборота в стационаре, так как он входит в схемы лечения многих инфекций, а что актуально конкретно для вас, так то, что он является препаратом первой линии в лечении сепсиса, тяжелых пневмоний и нейтропенических лихорадок, так же он является препаратом выбора в практике оториноларингологов. И если пациенты с подобными состояниями проходят лечение в ваших стационарах, использование амкоксициллин/клавуланата с целью ПАП принесет больше проблем, чем пользы, так как вызовет селекцию резистентных к нему штаммов. Если же подобные состояния у вас не встречаются – смело можете выводить данный препарат из общебольничной практики и использовать его в качестве периоперационной профилактики ИОХВ.
3) Ампициллин/сульбактам – перекрывает все тех же возбудителей, что и амоксициллин/клавуланат, но более дешев, легче выводится из общего оборота стационара.
Вводится по 3 г в/в за 30-40 мин до разреза. Повторная доза, если она потребуется, вводится через 3-4 часа от начала оперативного вмешательства
Отдельно следует упомянуть, что если пациент имеет в анамнезе данные об аллергических реакциях на препараты пенициллинового ряда, препаратом выбора в данной ситуации становится Клиндамицин в дозе 0,6 г.
Более подробно о методах и схемах периоперационной антибиотикопрофилактики вы можете познакомиться в следующих руководствах:
5) Антибактериальная профилактика инфекций в области хирургического вмешательства в колоректальной хирургии.
Сегодня поговорим еще об одной часто встречающейся (статистика говорит, что это каждый третий случай обращения) проблеме – инфекциях кожи и мягких тканей. Причем поговорим в том числе и через призму отделений гнойной хирургии
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Часть первая, касающаяся антибиотикотерапии органов дыхания, была здесь.
Во второй части мы обсуждали инфекции мочевыводящих путей тут и тут.
Сегодня поговорим еще об одной часто встречающейся (статистика говорит, что это каждый третий случай обращения) проблеме – инфекциях кожи и мягких тканей. Причем поговорим в том числе и через призму отделений гнойной хирургии. Наш рабочий план будет выглядеть следующим образом: сначала кратко упомянем основные нозологии в привязке к уже изученным возбудителям и таким образом разберемся, что приносит нам пациент, разберем, как эти патогены геноцидить, а затем поговорим о тех микробах и их ассоциациях, которые наиболее вероятны для хирургических отделений, и как с ними бороться.
Патогенные нейсерии (при наличии основного заболевания!)
При этом, как мы помним, почти все перечисленные микробы являются либо составной частью нормальной микрофлоры кожи, либо могут попасть туда транзитом (например, человек в огороде или в цветочном горшке поковырялся, и вот они – обожаемые автором неферментеры во всей красе). Автор позволит себе напомнить, что мы никогда не лечим анализ! Подробным образом мы разбирали этот вопрос вот тут. Если пришел пациент без клинической картины, но с неким анализом, а в нем зоопарк, то мы ничего не лечим и зоопарк не травим, иначе разрушим биоценоз кожи, и тогда уже точно пациент обретет проблемы – и хорошо, если быстро решаемые.
Итак, главное, что надо иметь перед собой, чтобы задуматься о начале антибактериальной терапии инфекции кожи и мягких тканей, – чтобы было наличие соответствующей клиники гнойно-воспалительного заболевания с лабораторным подтверждением оного.
Какие именно заболевания мы имеем в виду:
Абсцессы бывают как первичными, так и вторичными, как осложнение основного заболевания, либо медицинских манипуляций. Микробиологическая флора будет различаться кардинально и зависеть от основной причины, вызвавшей эту патологию. Так, при травматическом поражении кожи, почти всегда основной причиной будет метициллин-чувствительный Staphylococcus aureus, который, несмотря на всю свою агрессивность, довольно несложно уничтожается, главное – соблюсти длительность проведения терапии не менее 14 дней цефазолином (или оксациллином). При абсцедировании как результате медицинских манипуляций будем иметь дело уже с MRSA и, помимо первичной хирургической обработки, понадобится еще и ванкомицин. Помним, что первичная хирургическая обработка совершенно необходима, иначе антибиотики до возбудителей не доберутся. Скажем больше, иногда антибиотики вообще не нужны, например, это касается случаев поверхностного расположения и хорошей первичной обработки раны, а макрофаги доедят все, что попыталось спрятаться от рук хирурга.
Иное дело, когда вопрос касается абсцедирования внутренних органов как осложнения основного заболевания – здесь мы будем иметь дело с той же флорой, которая вызвала основное заболевание, но которую организм смог отграничить. Тут уже будет и семейство Enterobacteriaceae в случае абсцесса брюшной полости, и гемофилы при абсцессах легких, ну и куда без вездесущей синегнойки и брата ее ацинетобактера. Антибактериальная терапия в этом случае должна строго опираться на результаты микробиологии, но эмпирическую терапию подобрать уже несколько проще, так как мы довольно четко представляем, с кем имеем дело.
Когда сил организма, по каким-либо причинам, для ограничения распространения патогенных микробов не хватает, развиваются флегмоны. Статистика утверждает, что в гнойных хирургических отделениях таких пациентов до 40% госпитализированных. Пациентов, помимо локального поражения, начинают беспокоить симптомы общей интоксикации, соответственно реагирует кровь, а при не вовремя начатом лечении и большой распространенности поражения есть немалый риск перехода в сепсис. Для гнойных хирургов диагноз не представляет затруднений, к тому же современные методы визуализации при глубоко расположенных очагах доступны практически везде, начиная с УЗИ, заканчивая магнитно-резонансной томографией.
Надо помнить, что ведущей причиной снова будет S. aureus, причем наиболее агрессивна MSSA-форма (лейкоцидин Пантона–Валентайна мы давно уже запомнили, как и про то, что он присутствует и у внебольничных MRSA, наиболее характерных для внутривенных наркоманов). Второе почетное место занимают стрептококки и энтеробактерии, а уж незабываемая вонь синегнойки определяется даже через респиратор FFP3. Но надо также не забывать о клостридиальных поражениях, которые снова подняли голову и, в отличие от наших старших коллег, которые в лучшем случае несколько раз в жизни видели некротические фасцииты и другие варианты анаэробных хирургических инфекций, их более молодые коллеги оперируют подобное уже десятками в год и ни с чем их не перепутают.
Чем лечить? На первое место, конечно же, выходит хирургическое пособие и ежедневная санация раны, вторым обязательным пунктом идет антибактериальная терапия. Эмпирически должен быть назначен препарат, который перекрывает максимально возможный спектр возбудителей. Если речь идет о стафилококковом поражении и пациент не наркоман – то это однозначно цефазолин в вену в высоких дозах. Если имеем дело с флегмонами органов брюшной полости, то назначаем цефалоспорины третьего поколения в комбинации с фторхинолонами. Если речь о клостридиальной инфекции, то карбопенемы и антианаэробные препараты нам в помощь. А учитывая высокую вероятность развития сепсиса, лечение флегмон должно быть комплексным, с привлечением всех необходимых специалистов.
Раневые инфекции области оперативного вмешательства. И по названию все понятно, да и обсуждали мы этот вопрос уже не один раз, например, когда говорили об антибиотикопрофилактике. Но все равно необходимо выделить некоторые моменты. Первое и, наверное, главное – можно ли избежать? Можно, но, увы, не всегда, как бы ни старались, и руки ни намывали и носы за тремя масками ни прятали. Есть факторы, которые мы контролировать не можем:
Со стороны пациентов – это увеличение доли лиц пожилого возраста, доли лиц с ожирением и сахарным диабетом.
Со стороны медицины – большое количество инвазивных исследований, многочасовые оперативные вмешательства (тут хоть обпрофилактируйся, но обширные повреждения мягких тканей, каким бы ювелирным способом хирург ни работал, неизбежны), установка дренажей в рану само по себе является фактором риска, а многие раны вести без них вообще невозможно, и т. д., и т. п.
Конечно, в большинстве случаев антибиотикопрофилактика и умелые руки врача сводят все риски развития раневой инфекции к нулю, но все-таки мы не боги. И поэтому надо помнить, что основным возбудителем инфекции области оперативного вмешательства и здесь будет S. aureus (собственно именно с ориентиром на него мы, по большей части, и подбираем препараты для антибиотикопрофилактики), его наиболее неприятная MRSA форма (одно хорошо, рана не так быстро разваливается, как при MSSA), далее идут коагулазонегативные стафилококки, и замыкают тройку лидеров энтеробактерии. А совершенно незабываемую вонь синегнойки мы уже упоминали (хотя при правильном выполнении правил асептики и антисептики надо очень постараться, чтобы в послеоперационную рану ее запихнуть). И именно исходя из этого знания мы и будем подбирать антибактериальную терапию.
Так как наши статьи теперь не прячутся под замком, то автор остережется давать конкретные названия препаратов и конкретные дозировки, но многое из этого мы обсудили в соответствующих статьях по отдельным представителям возбудителей. Напомним основное в деле назначения антибактериальной терапии – она должна быть этиологической, то есть мы должны четко знать, кого должны убить, а для этого нужна микробиологическая лаборатория и правильная интерпретация ее данных.
Читайте также:

