Повышенная чувствительность замедленного типа при туберкулезе
Обновлено: 19.04.2024
Сведения об иммунной системе, межклеточных взаимодействиях в организме, накопленные за последние десятилетия, позволяют по-новому подойти к разработке патогенеза туберкулеза. Формирование полирезистентных штаммов микобактерий туберкулеза как один из итогов полувековой истории противотуберкулезной терапии и заметное увеличение числа больных с иммунодефицитами различной природы создают новые проблемы перед фтизиатрами всего мира. В настоящее время имеется насущная необходимость изучения патогенеза туберкулеза как в преморбидном периоде, так и при его прогрессирующем течении, а также изучения морфологических изменений в пораженных органах. Без продолжения таких исследований трудно понять причины современного патоморфоза туберкулеза, повышения уровня заболеваемости, терапевтических неудач и смертельных исходов.
The data on immunity and intercellular decades, allow one to have a further insight into the pathogenesis of tuberculosis. Formation of multiresistant strains of Mycobacterium tuberculosis as one of the results of semicentennial history of antituberculous therapy and a noticeable rise in the number of patients with immunodeficiencies of different etiology make phthisiologists in the world to be faced with new problems. There is now a vital need for studying the pathogenesis of tuberculosis both in its premorbidity and progression and for examining morphological changes in the affected organs. If these studies are not under way, it is difficult to understand the causes of the present-day pathomorphism of tuberculosis and higher rates of morbidity, mortality, and therapeutical failures.
А.Г. Хоменко — Центральный НИИ туберкулеза РАМН, Москва
A.H. Khomenko — Central Research Institute of Tuberculosis, Russian Academy of Medical Sciences, Moscow
Т уберкулез чаще всего развивается в результате заражения микобактериями человеческого вида, выделяемыми больным человеком. В ряде районов, неблагополучных по туберкулезу крупного рогатого скота, происходит заражение от животных, заболевание вызывается M. Bovis. Наиболее частый путь заражения – аэрогенный, но возможен алиментарный и весьма редко контактный, через поврежденную кожу или слизистые оболочки. Определенную защитную роль при аэрогенном заражении играет система мукоцилиарного клиренса, позволяющая частично вывести попавшие в бронхи частицы пыли, капельки слизи, слюны, мокроты, содержащие микроорганизмы. При энтеральном заражении может иметь значение всасывающая функция кишечника.
После проникновения микобактерий в организм человека, не зараженного ранее туберкулезом, в качестве первой защитной реакции развивается фагоцитоз. Эффективность этой защитной реакции зависит от многих факторов: возраста, пола, различных индивидуальных факторов риска, наследственной резистентности или предрасположенности к туберкулезу. Течение туберкулезной инфекции определяет в основном состояние иммунитета, как врожденного, так и приобретенного.
Процесс взаимодействия легочных макрофагов с микобактериями туберкулеза очень сложен и до конца не изучен. Результат этого взаимодействия определяется рядом механизмов, в том числе определяющих переваривающую способность макрофагов.
При недостаточной переваривающей способности макрофагов микобактерии туберкулеза могут сохраняться в них и даже размножаться, приводя к разрушению макрофагов и выходу из них микобактерий.
Макрофаги, фагоцитировавшие микобактерии, выделяют во внеклеточное пространство фрагменты разрушенных микобактерий, протеолитические ферменты, а также медиаторы (в том числе интерлейкин-1), которые взаимодействуют с Т-лимфоцитами, в частности Т-хелперами. Происходит активация Т-хелперов и выделение лимфокинов, в том числе интерлейкина-2, g-интерферона и других лимфокинов. Макрофаги устремляются к месту нахождения микобактерий, так как подавляется фактор угнетения миграции, выделяющийся b-лимфоцитами, под влиянием фактора активации макрофагов (этот фактор отождествляют с интерлейкином-2) возрастает ферментативная активность макрофагов. Активированные макрофаги выделяют также кожно-реактивный фактор, который обусловливает воспалительную реакцию, повышение сосудистой проницаемости. С этим фактором связывают появление повышенной чувствительности замедленного типа (ПЧЗТ) и положительной туберкулиновой реакции [1]. Кроме Т-хелперов значительное влияние на состояние иммунитета оказывают Т-супрессоры и супрессорные моноциты, которые угнетают иммунный ответ. Таким образом, процесс фагоцитоза и лизиса микобактерий регулируется Т-лимфоцитами. Их количественные изменения и функциональная активность в настоящее время хорошо изучены у больных туберкулезом, в том числе на субпопуляционном уровне [2, 3]. Кроме того, в инфекционном процессе активное участие принимают вещества, освобождающиеся при разрушении микобактерий. Удалось доказать, что корд-фактор (фактор вирулентности) микобактерий туберкулеза, обусловливающий их рост на плотной питательной среде в виде кос, провоцирует острый воспалительный процесс, а сульфатиды повышают токсичность корд-фактора и, главное, подавляют процесс образования фаголизосом в макрофагах, что предохраняет от разрушения расположенные внутриклеточно микобактерии. При интенсивном размножении микобактерий в организме человека вследствие малоэффективного фагоцитоза выделяется большое число токсичных веществ, индуцируется ПЧЗТ, которая способствует выраженному экссудативному компоненту воспаления с развитием казеозного некроза. В процессе разжижения казеозных масс микобактерии получают возможность для бурного внеклеточного размножения. Увеличивается число Т-супрессоров, происходит угнетение ПЧЗТ, снижение количества Т-хелперов, что приводит к анергии, обусловливающей прогрессирование туберкулезного процесса.
При сравнительно небольшой бактериальной популяции в условиях более эффективного фагоцитоза отмечается другая тканевая реакция – образование туберкулезной гранулемы и формирование туберкулезных очагов. Поскольку величина бактериальной популяции, а также характер течения иммунных реакций на разных этапах туберкулезной инфекции меняются, морфологические проявления у заболевших туберкулезом характеризуются чрезвычайно большим разнообразием.
Клинико-морфологические проявления первичного заражения микобактериями туберкулеза принято называть первичным туберкулезом. В настоящее время хорошо известно, что первичный туберкулез может проявляться не только в виде первичного туберкулезного комплекса, как это было принято считать ранее, возможно развитие туберкулеза внутригрудных лимфатических узлов, плеврита, различных изменений в легких – туберкулем, очагов и др. Первичный туберкулез в результате первичного заражения развивается лишь у 7 – 10% инфицированных, а остальные переносят первичную туберкулезную инфекцию без клинических проявлений, заражение проявляется лишь виражем туберкулиновых реакций. Отсутствие клинико-морфологических проявлений первичной туберкулезной инфекции может объясняться высоким уровнем естественной резистентности к туберкулезу, а также быть следствием иммунитета, приобретенного в результате противотуберкулезной вакцинации БЦЖ.
Первичный туберкулез может протекать с развитием распространенных или множественных изменений или ограниченных воспалительных. Прогрессирующее течение первичного туберкулеза проявляется преимущественно в виде милиарного туберкулеза и менингита, а также в виде первичной казеозной пневмонии с образованием каверны в легком. Такое течение первичной туберкулезной инфекции наблюдается редко и характерно для невакцинированных детей. В настоящее время реже, чем в прежние годы, отмечается хроническое течение первичной туберкулезной инфекции, протекающей у некоторых больных с наличием разнообразных параспецифических проявлений, так называемых масок туберкулеза [4, 5].
Заживление первичного туберкулеза может завершаться с выраженными или малыми остаточными изменениями. В настоящее время, как правило, первичный туберкулез излечивается с небольшими остаточными изменениями. У таких лиц развивается приобретенный иммунитет. Сохранение в остаточных очагах персистирующих микобактерий не только поддерживает приобретенный иммунитет, но и одновременно таит в себе риск эндогенной реактивации туберкулезного процесса вследствие реверсии измененных форм возбудителя туберкулеза в бактериальную форму и размножения бактериальной популяции.
В основе реактивации лежит прогрессирующее размножение микобактерий, находившихся в персистирующем состоянии. Установлено, что реактивация туберкулеза и развитие различных клинических форм вторичного туберкулеза чаще наблюдаются у лиц с остаточными изменениями при наличии факторов, ослабляющих иммунитет.
Возможен и другой путь развития вторичного туберкулеза – экзогенный, связанный с новым, повторным заражением микобактериями туберкулеза (суперинфекцией). Для развития вторичного туберкулеза помимо массивной повторной суперинфекции необходима совокупность ряда факторов, снижающих иммунитет. Вторичный туберкулез характеризуется большим разнообразием клинических форм.
Особо выделяют формы туберкулеза, возникшие вследствие бактериемии при проникновении микобактерий туберкулеза в кровяное русло и развития специфического васкулита. Заболевание может развиваться в виде острого или подострого диссеминированного туберкулеза с поражением многих органов – легких, плевры, печени, селезенки, гортани и др.
Различные сочетания морфологических реакций туберкулезного воспаления создают предпосылки для чрезвычайно большого разнообразия изменений в пораженных органах, особенно при хроническом течении болезни со сменой периодов обострения и затихания процесса. К этому следует добавить, что из сформировавшихся зон поражения микобактерии могут распространяться током лимфы или крови в непораженные участки и различные органы человеческого организма. Исход болезни зависит от течения болезни (прогрессирующего или регрессирующего), эффективности лечения и обратимости изменений, сформировавшихся в течение болезни. Доказано, что в условиях голодания и даже при недостаточном питании, особенно при недостаточном содержании в рационе белков и витаминов, нередко возникает реактивация туберкулеза. К факторам, способствующим реактивации, относятся также различные заболевания: сахарный диабет, лимфогранулематоз, силикоз, язвенная болезнь желудка и двенадцатиперстной кишки, состояние после резекции желудка, хронические воспалительные заболевания легких, психические заболевания, протекающие с депрессивным синдромом, алкоголизм, наркомания, стрессовые ситуации, синдром приобретенного иммунодефицита (СПИД), длительный прием глюкокортикоидов, цитостатиков. В настоящее время течение и исходы туберкулеза следует рассматривать только в условиях проводящейся противотуберкулезной химиотерапии. В процессе химиотерапии уменьшается микобактериальная популяция и создаются более благоприятные условия для репаративных процессов.
Отмечается разное течение инволютивного туберкулезного процесса: регрессия с последующим заживлением, стабилизация туберкулезного процесса без клинического излечения с сохранением каверны, туберкулемы или других изменений; временное затихание воспалительного процесса с последующим возникновением обострения. При неэффективном лечении могут иметь место хронизация или прогрессирование заболевания.
Заживление туберкулезного процесса и последующее излечение зависят не только от уменьшения бактериальной популяции, но и от способности микроорганизма обеспечить регрессию туберкулезного процесса.
При развитии хронического туберкулезного процесса с образованием каверн и появлением лекарственной резистентности микобактерий наступает прогрессирование заболевания, так как химиотерапия малоэффективна, подавления бактериальной популяции не происходит, наоборот, количество микобактерий увеличивается, поражаются все новые участки легких и другие органы. Такой прогрессирующий туберкулезный процесс может быть причиной смертельного исхода, особенно если у больного развивается казеозная пневмония или генерализованный туберкулез с поражением различных внутренних органов. Смертельные исходы заболевания туберкулезом обусловлены не только прогрессирующим течением хронических форм, но и нередким развитием в настоящее время изначально остро прогрессирующих форм туберкулеза, в прошлом названных скоротечной чахоткой. У взрослых это, как правило, казеозная пневмония с быстрым образованием множественных или гигантских каверн. Более чем у половины больных эта форма туберкулеза вызвана полирезистентными к противотуберкулезным препаратам микобактериями, а также осложнено неспецифической микрофлорой, повторяющимися легочными кровотечениями, дыхательной недостаточностью и выраженной интоксикацией.
Развитие остро прогрессирующих форм туберкулеза связывают с быстрым размножением микобактерий и образованием огромной бактериальной популяции, уничтожение или уменьшение которой с помощью противотуберкулезных препаратов невозможно вследствие имеющейся к ним полирезистентности микобактерий. Эта точка зрения подтверждается данными о внутригоспитальных эндемических вспышках туберкулеза со смертельными исходами в больницах Нью-Йорка в США. Следует также обратить внимание на подавление функционального состояния иммунокомпетентных систем организма, в частности моноцитарно-макрофагальной, которые в условиях иммунодефицитного состояния не могут осуществить защитную функцию. Роль иммунодефицита в развитии прогрессирующего туберкулеза и его смертельного исхода четко прослеживается у ВИЧ-инфицированных больных. Смертельные исходы наблюдаются также при сочетании прогрессирующего туберкулеза и рака, лейкоза, лимфогранулематоза.
Таким образом, если в недалеком прошлом изучение патогенеза туберкулеза проводилось в основном с точки зрения развития заболевания и его саногенеза, т.е. процессов заживления, в настоящее время имеется насущная необходимость изучения патогенеза туберкулеза как в преморбидном периоде, так и при его прогрессирующем течении, а также изучения морфологических изменений в пораженных органах. Без продолжения таких исследований трудно понять причины современного патоморфоза туберкулеза, повышения уровня заболеваемости, терапевтических неудач и смертельных исходов.
1. Медуницын Н.В., Литвинов В. И., Мороз А.М. Медиаторы клеточного иммунитета и межклеточного взаимодействия. – М., 1980.
2. Авербах М.М., Гергерт В.Я., Литвинов В.И. Повышенная чувствительность замедленного типа и инфекционный процесс. – М.,1974.
3. Туберкулез. Руководство для врачей // Под ред. А.Г.Хоменко. – М., 1996.
4. Иванова М.Г., Хмельницкий Б.Я. // Руководство по туберкулезу. – М., 1959. – Т. 2. – С. 241–77.
5. Струков А.И. Формы легочного туберкулеза в морфологическом освещении. – М., 1948.
Активность туберкулеза. Критерии активности туберкулеза.
Определение активности туберкулеза — весьма важная задача клиники, диагностики, эпидемиологии туберкулеза и организации борьбы с ним. От ее правильного решения зависят реализация ряда лечебно-профилактических мероприятй индивидуального и государственного значения, а также достоверность статистических данных об общей численности больных и ее динамике в стране. Однако на этом пути лежат значительные трудности, обусловленные особенностями патогенеза и клиники туберкулеза, протекающего весьма многообразно и часто скрыто или малосимптомно. Под влинянем туберкулиностатической терапии у больных сравнительно быстро устраняются функциональные расстройства, исчезают катаральные явления в легких, прекращается бацилловыделение, подвергаются инволюции рентгенологически определяемые изменения в легких.
Важно также и то, что до последнего времени нет единого и общепринятого критерия активности туберкулеза. По рекомендации экспертов ВОЗ ее показателем служит только обнаружение микобактерий в мокроте и других выделениях больного. В остальных случаях при соответствующих клинических данных можно лишь подозревать наличие активного процесса. Такого именно принципа, например, придерживаются в Дании. Однако как ни велико значение этого признака, его нельзя считать безупречным. Еще Г. Р. Рубинштейн и М. Д. Розанова (1950) указывали, что микобактерии туберкулеза удается найти в желудочном содержимом даже здорового человека. Их обнаруживают иногда при абсцессе, гангрене или раке легкого, если патологический процесс локализуется в зоне заглохших туберкулезных очагов.
Вместе с тем у части впервые выявленных больных с явно активным и даже деструктивным туберкулезом не всегда находят микобактерии, несмотря на использование современных методов лабораторной диагностики. Так, Kuntz (1964) при исследовании мокроты и промывных вод бронхов у 341 больного активным туберкулезом легких у 32% из них не обнаружил микобактерии, несмотря на применение всех способов, в том числе и биологического. Н. М. Рудой (1975) установил, что удельный вес бацилловыделителей при активном туберкулезе легких без распада составляет 44,7%. Вместе с тем у значительного числа больных туберкулезом легких сравнительно часто отмечается скудное бацилловыделение (Ф. А. Рашитова, 1974).

Существует последовательный переход от активного к затихающему, затем к возможно еще активному, а в дальнейшем к возможно неактивному и в конце концов к неактивному процессу, — утверждает Jarosczewicz. Но как разграничить такие фазы инволюции болезни — на этот вопрос автор не дает конкретного ответа. Вот почему в отдельных странах его решают различно. В ГДР, например, считают неактивным туберкулез, если он не проявляется какими-либо клиническими, рентгенологическими и лабораторными признаками активности в течение 1 года при ограниченных формах процесса и на протяжении 2 лет при большей его распространенности. Если состояние благополучия сохраняется 5—10 лет, то можно предполагать наступившее излечение от туберкулеза (Steinbruck, 1966).
В Дании, как указывалось выше, основным критерием неактивности процесса является отсутствие бацилловыделения в течение 3 лет. В Чехословакии туберкулез считают неактивным, если при систематическом наблюдении в течение не менее 2 лет отсутствуют клинические симптомы ранее бывшего заболевания. К таким лицам относят носителей фиброзных специфических изменений в легких, выявленных при флюорографии, которые ранее не болели активным туберкулезом. Все эти контингепты ввиду возможности рецидива процесса пожизненно наблюдаются в противотуберкулезных учреждениях.
В России, согласно принятому в 1973 г. положению, различают лиц: 1) с активным туберкулезом органов дыхания (I группа контингента взрослых, подлежащих учету в диспансере); 2) с затихающим процессом (II группа); 3) с неактивным туберкулезом (III группа). К последней группе относятся клинически излеченные от туберкулеза, что подтверждается дифференцированными сроками наблюдения (от 1 года до 5 лет), зависящими от исходной формы процесса, полноценности проведенного лечения, распространенности и характера остаточных специфических изменений в легких (больших или малых), а также от условий труда, быта и сопутствующих заболеваний. Кроме того, различают лиц с туберкулезными изменениями в легких, нуждающихся в уточнении активности процесса (группа 0).
Наконец, выделена группа лиц (VII) с повышенным риском заболевания туберкулезом или его рецидива. В нее включают лиц, ранее состоявших в III группе диспансерного наблюдения или впервые выявленных, но также с неактивными малыми или выраженными остаточными фиброзно-очаговыми, цирротическими изменениями, множественными кальцинатами, особенно при наличии отягощающих факторов. Эта категория может быть пополнена за счет тех, у которых при обследовании вначале выявлен туберкулез органов дыхания сомнительной активности (группа 0), но затем в результате динамического наблюдения, а нередко только после пробной химиотерапии специфические изменения в легких признаны неактивными.
Чувствительность к туберкулину при саркоидозе. Реакции Т-клеток in vitro при саркоидозе
В настоящее время, по-видимому, нет убедительных указаний на дефект самих Т-клеток. Этот вывод поддерживается тем, что у ряда больных при помощи местного или системного лечения кортикостероидами можно восстановить ПЧЗТ. Старые эксперименты показали, что внутримышечные или подкожные инъекции ацетата кортизона перед туберкулиновыми кожными пробами вызывают вираж примерно у 50% больных, имевших ранее отрицательную реакцию [Руке, Scandding, 1952].
Citron и Scandding (1957), обследовавшие ряд больных саркоидозом и легочным туберкулезом, установили, что подмешивание ацетата кортизона к туберкулину для внутрикожных проб дает эффект, обратно пропорциональный степени прежней повышенной чувствительности: в случаях с высокоположительными реакциями после введения кортизона реакция ослаблена, а в случаях с первоначально отрицательными реакциями наблюдается вираж. Среди больных туберкулезом повышенная реакция, подобная реакциям при саркоидозе, после кортизона наблюдалась только у лиц, десенсибилизированных к туберкулину.
(Настоящее исследование проводилось в то время, когда такая десенсибилизация обычно применялась в лечебных целях.) Позднее Cross (1973) повторил эти эксперименты и получил в основном такие же результаты. Cross и Valdimarsson (1972), стимулируя лимфоциты кокканавалином (вещество, которое неспецифически стимулирует образование лимфокина лимфоцитами), получили лимфокин и наблюдали положительные реакции ПЧЗТ на него более чем у 90% обследуемых из контрольной группы.
У 8 больных саркоидозом и отрицательными пробами Манту лимфокин также дал отрицательные результаты, по если он вводился после местного введения кортизона, то реакции становились положительными. Cross объяснил эти данные тем, что отрицательные реакции при саркоидозе вызываются не принципиальным нарушением функции Т-клеток, а их заторможенной способностью давать замедленную реакцию.
Ряд других исследований поддерживает предположение, что функция Т-клеток in vivo может быть нормальной. Так например, можно перенести пассивно-местную чувствительность к туберкулину больным, страдающим саркоидозом [Ursbach et al., 1952], что указывает на нормальную реактивность кожи. Кроме того, отторжение кожных гомотрансплантатов, видимо, происходит нормально [Snyder, 1964], и на основании клинических данных можно полагать, что защитный иммунитет против грибковых и вирусных инфекций, который зависит главным образом от функции Т-клеток, также нормален.
Атипичные (активированные) лимфоциты, возможно, являются признаком спонтанной трансформации. Если это так, то фоновое поглощение тимидииа в покое должно быть повышено pi увеличение поглощения после инкубации с ФГА должно быть относительно меньше. Однако даже в стандартизованных условиях ряд авторов отмечали нарушение трансформации под воздействием ФГА [Brand et al., 1964; Hirschhorn et al., 1964; Buckley et al., 1966; Siltzbach et al., 1971a; Horsmanheimo, Virolainen, 1974].
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Реакции гиперчувствительности четвертого типа ( IV типа ). Гиперчувствительность замедленного типа. Реакции гиперчувствительности замедленного типа.
Реакции гиперчувствительности IV типа также называют гиперчувствительность замедленного типа (ГЗТ). Они обусловлены клеточными иммунными реакциями. В отличие от реакций немедленного типа, они развиваются не ранее чем через 24-48 ч после повторного введения Аг. Развитие реакций гиперчувствительности замедленного типа (ГЗТ) индуцируют продукты микроорганизмов и гельминтов, природные и неприродные Аг и гаптены (лекарства, косметические красители).
Классические примеры гиперчувствительности замедленного типа (ГЗТ) — туберкулиновая проба и контактный дерматит. Распознавание Аг, связанного с белками организма, иммунокомпетентными клетками вызывает активацию Т-хелперов, что приводит к клональной пролиферации Т-эффекторов ГЗТ. Сенсибилизированные лимфоциты секретируют цитокины, привлекающие другие лимфоциты и макрофаги в очаг аллергической реакции. На более поздних этапах в реакцию включаются полиморфно-ядерные фагоциты, стимулирующие воспалительный ответ.
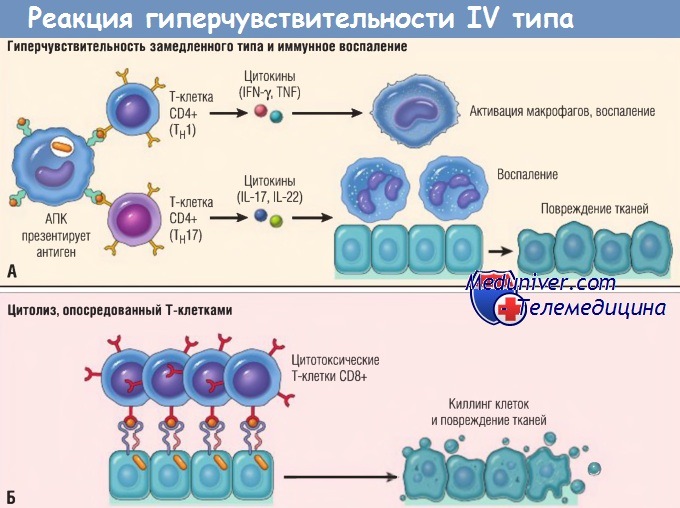
Механизмы реакций гиперчувствительности типа IV, опосредованных Т-клетками.
(А) В реакциях гиперчувствительности замедленного типа Тн1-клетки CD4+ (а иногда Т-клетки CD8+, не показаны) отвечают на тканевые антигены секрецией цитокинов,
которые стимулируют воспаление и активируют фагоцитоз, приводя к повреждениям тканей. Тн17-клетки CD4+ способствуют воспалению, мобилизуя нейтрофилы (в меньшей степени моноциты).
(Б) При некоторых заболеваниях цитотоксические Т-клетки CD8+ непосредственно убивают клетки тканей.
IFN — интерферон; IL — интерлейкин; TNF — фактор некроза опухоли; АПК — антигенпрезентирующая клетка.
• Гаптены приобретают способность инициировать реакции гиперчувствительности замедленного типа (ГЗТ) после взаимодействия с высокомолекулярными соединениями, в частности с белками. В свою очередь белки вызывают гиперчувствительность замедленного типа (ГЗТ) при длительной иммунизации малыми дозами в сочетании с адъювантами. Многие низкомолекулярные органические вещества или неорганические вещества (например, хром), связываясь с белками кожи, выполняют роль гаптенов и сенсибилизируют организм при длительном контакте. В результате развивается контактная аллергия, клинически проявляющаяся контактными дерматитами.
• Способность отвечать развитием гиперчувствительности замедленного типа (ГЗТ) на различные микробные продукты (например, Аг возбудителей туберкулёза, бруцеллёза) применяют при постановке кожных проб для диагностики инфекционного процесса или установления возможного контакта организма с возбудителем.
Иммунитет — специфическая реактивность, способ защиты организма от живых тел и веществ, несущих признаки генетической чужеродности; способность высших организмов распознавать, обезвреживать и элиминировать генетически чужеродные вещества; функция специализированной системы генетического наблюдения организма — иммунной системы (Р. В. Петров).
Иммунитет при туберкулезе существенно отличается от иммунитета при других инфекциях. Инфицирования микобактериями туберкулеза не всегда сопровождается развитием заболевания, свидетельствует о наличии естественной устойчивости к ним (естественный иммунитет). Она основывается на способности организма ликвидировать возбудителя заболевания и предотвратить болезни. Природный противотуберкулезный иммунитет неодинаково выражен у разных видов животных. Среди млекопитающих слабую резистентность имеют морские свинки, кролики, обезьяны; относительно устойчивые белые мыши, человек; всего устойчивые крысы и собаки.
Следствие инфицирования МБТ у животных с относительной естественной устойчивостью зависит от многих факторов: дозы и вирулентности МБТ, пути их проникновения, а главное — от степени резистентности. Доказательством наличия естественной резистентности у человека есть секционные данные, свидетельствующие о почти 100%-ную инфицированность МБТ взрослого населения, но известно, что заболевшие составляют всего доли процента. Это свидетельствует о том, что организм человека восприимчив к туберкулезной инфекции, но, в то же время, сравнительно устойчив. Существует естественная резистентность многих тканей организма человека к туберкулезной инфекции. Это подтверждается тем, что в ранний период инфицирования происходит генерализация МБТ по всему организму, однако первичное туберкулезное очаг развивается преимущественно в легких.

В основе естественной резистентности лежат неиммунологические феномены: защитное действие неповрежденной кожи и слизистых оболочек, физико-химические особенности тканей, антимикробные гуморальные факторы (лизоцим, плазмин, (3-лизин и др.). В механизме естественной резистентности особая роль отводится фагоцитирующим клеткам, особенно макрофагам. Для туберкулеза характерно внутриклеточное паразитирование возбудителя, но взаимодействие МБТ и макрофагов не всегда заканчивается разрушением микроба.
Роль макрофагов
Установлено, что в условиях макроорганизма только около 5% МБТ уничтожаются макрофагами, другие разрушаются частично или распространяются в организме макрофагами. Эта неспособность фагоцитоза способствует привлечению в процессе иммунизации большого количества лимфоидных клеток, но с другой стороны ведет к диссеминации МБТ. Следует отметить и тот факт, что МБТ могут разрушить макрофаги и затем подвергнуться повторному фагоцитированию. Макрофаги, сливаясь друг с другом, образуют гигантские клетки Пирогова-Лангханса, что является проявлением защиты организма против МБТ.
Итак, фагоцитоз является эффективным фактором противотуберкулезной защиты. Фагоцитарная активность неоднозначная у животных с разной природной устойчивостью: у резистентных лиц происходит более выраженное угнетение размножения МБТ, чем у чувствительных видов. Неспецифические по своей сути фагоцитарные клетки осуществляют и специфические функции: захватывают и переносят антиген к иммунокомпетентным клеткам и органам.
В ответ на вторжение МБТ в организме развиваются и специфические иммунологические изменения, определяющие приобретенный противотуберкулезный иммунитет. Доказательством развития иммунитета является эффективность применения вакцины БЦЖ, предложенной Кальмет и Гереном. Исследованиями многочисленных авторов доказано, что массовая вакцинация резко уменьшила заболеваемость туберкулезом. Приобретенный иммунитет возникает не только в результате вакцинации, но и в результате естественного инфицирования. Продолжается поствакцинальный иммунитет 5-6 лет. В механизме приобретенного иммунитета играют роль три основных феномена: повышенная чувствительность замедленного типа (ПЧСТ), антителообразования и фагоцитоз.
Повышенная чувствительность замедленного типа рассматривается большинством исследователей как основное звено в механизме противотуберкулезного иммунитета. ПЧСТ или туберкулиновая аллергия — классический пример инфекционной аллергии. Она заключается в повышенной чувствительности организма к повторному введению МБТ или продуктов их жизнедеятельности (туберкулин). ПЧСТ развивается не сразу после вакцинации или инфицирования, а через определенный период инкубации (аллергический период), продолжительность которого может колебаться от нескольких дней до нескольких месяцев и зависит от вида животных, способа заражения, дозы и вирулентности МБТ. У человека этот период составляет в среднем 2-3 месяца.
Аллергия при туберкулезе
Сущность аллергии при туберкулезе давно интересует исследователей. Еще в 1891 году Р. Кох описал отличие реакций организма на первичное и повторное проникновение микобактерий туберкулеза. Это различие стала основой классического феномена Коха. Сущность феномена: у здоровых морских свинок подкожное введение МБТ вызывает местную воспалительную реакцию, которая сопровождается генерализацией инфекции; у инфицированных животных повторное введение МБТ уже через несколько часов вызывает местное воспаление, быструю язву, заживает через несколько дней. Ткани инфицированного животного создают своеобразный барьер, который защищает организм. Эта барьерно-фиксирующая способность тканей инфицированного организма является проявлением аллергии, защищающий организм от повторного проникновения МБТ.
Следствие реакции зависит от степени повышенной чувствительности, которая определяется как дозой первичного инфекта, так и продолжительностью периода между первичным и повторным инфицированием. Имеет значение и количество МБТ при повторном инфицировании.
ПЧСТ при туберкулезе — тимус зависимый иммунологический феномен, который является специфическим. Главными клетками-эффекторами ПЧСТ являются Т-лимфоциты, кооперируются с В-клетками и макрофагами. Доказательством роли Т-лимфоцитов в реализации устойчивости к МБТ есть возможность пассивного переноса ПЧСТ от сенсибилизированных животных интактным. Считают, что развитие иммунитета при туберкулезе соединенный с функцией Т-хелперов 1-го типа и синтезом определенного профиля цитокинов — интерлейкин-2 (ИЛ), интерферон-у, ИЛ-12. Это определяет главную роль в иммунитете ПЧСТ. Однако нельзя отрицать и роли Т-хелперов 2-го типа, синтезирующих другие цитокины (ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13) и усиливают антителообразования (синтез специфических антител). Эти типы иммунного ответа находятся во взаимной конкуренции, но не исключено их совместное участие в реализации специфического ответа на МБТ.
Выявление ПЧСТ возможно при проведении внутрикожной туберкулиновой пробы Манту. Она и сейчас не утратила своего диагностического значения, особенно для выявления поствакцинальных аллергии и виража, однако в настоящее время появились новые методы выявления ПЧСТ, основанные на определении реакции имунокомпетентных клеток на туберкулин: реакция бластной трансформации лимфоцитов (РБТЛ), ингибирования миграции лейкоцитов (НМЛ), цитотоксический эффект сенсибилизированных лимфоцитов на клетки-мишени (ЦТЛ).
Реакции, отражающие интенсивность ПЧСТ, наиболее выраженные на высоте вакцинного иммунитета как в эксперименте, так и у вакцинированных БЦЖ людей. ПЧСТ может быть подавлена применением препаратов, действующих на Т-лимфоциты. Преднизолон, имуран и другие приводят к резкому угнетению ПЧСТ и в свою очередь к ослаблению противотуберкулезного иммунитета и прогрессирования туберкулезной инфекции.
Гуморальные реакции. Также развиваются в организме человека в результате инфицирования МБТ.
Широкий спектр противотуберкулезных антител обусловлен сложностью антигенной структуры МБТ. При этом следует отметить низкий уровень антител при туберкулезе, несмотря на выраженные антигенные свойства МБТ. Считают, что ПЧСТ индуцируется белковыми компонентами, а антителообразования — как белковыми, так и липополисахаридный фракциями. Это является причиной разнообразия специфических противотуберкулезных антител. До сих пор не определена сущность антителообразования в механизме противотуберкулезной устойчивости. Четко установлено, что антителам не свойственный защитный эффект, то есть предварительное введение их здоровому животному не предотвращает развития туберкулезной инфекции.
Установлено, что специфические противотуберкулезные антитела способны усиливать фагоцитоз. Таким образом, преимущественно клеточный характер противотуберкулезного иммунитета дополняется гуморальным звеном, которая определяет кооперацию Т-, В-лимфоцитов и фагоцитирующих клеток.
Высокий уровень антител, который имеет место при хронических формах туберкулеза, может неблагоприятно влиять на течение туберкулезного процесса. Кроме того, доказано, что антитела участвуют в комплексообразовании, высокий уровень которого нарушает трофику тканей и способствует их некротизуванию. Существует зависимость частоты выявления антител в продолжительности туберкулезного процесса. Антитела определяются чаще всего у больных с фиброзно-кавернозной формой процесса, и значительно реже — у лиц с "малыми" формами. На основании этих данных можно сделать вывод, что антитела при туберкулезе свидетельствуют о продолжительности антигенного воздействия.
Фагоцитоз
В противотуберкулезной защите очень велика роль фагоцитов, особенно макрофагов, тесно взаимодействуют с лимфоцитами. Сенсибилизированные лимфоциты осуществляют специфическое влияние на макрофаги с помощью синтезируемых ими цитокинов, благодаря чему макрофаги и другие фагоцитирные клетки привлекаются в очаг повторного вторжения МБТ, усиливается их способность к перевариванию гиоглиненю МБТ, подавляется рост МБТ в очаге воспаления. Этот эффект лимфоцитов специфический.
В свою очередь контакт фагоцитирующих клеток с МБТ сопровождается синтезом цитокинов (провоспалительного, противовоспалительного действия), которые обеспечивают клеточную взаимодействие при развитии реакций противотуберкулезного иммунитета. В макрофагах резко усиливаются метаболические процессы, ферментативная активность (гидролазы, протеазы, фосфолипазы и др.). Макрофаги неоднородны по своей значимости. Некоторые осуществляют активный фагоцитоз или выполняют синтетическую функцию, обеспечивающую межклеточное взаимодействие. Существенная роль уделяется их способности к выводу иммунных комплексов из организма.
Результат взаимодействия между МБТ и макрофагами зависит от функционального состояния последних, а именно от их способности синтезировать гидролитические ферменты, цитокины, метаболиты кислорода. Угнетение фагоцитарной и секреторной способности макрофагов, еще может иметь место при иммунодефицитных состояниях различного генеза (облучение, интоксикация, иммуносупрессивная терапия и т.д.), способствует персистенции МБТ.
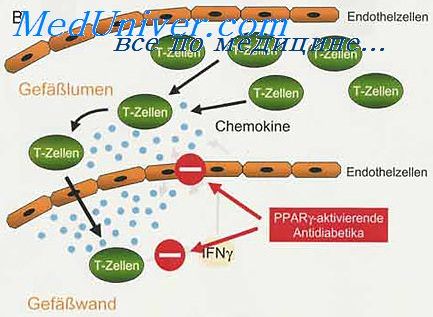
Клетки эндотелия кровеносных сосудов
В развитии иммунного ответа на МБ1 участвуют и клетки эндотелия кровеносных сосудов, выделяют биологически активные вещества: адгезивные молекулы, различные цитокины факторы роста. Они обеспечивают взаимодействие эндотелия с другими клеточными элементами (Т-лимфоциты, макрофаги, нейтрофилоциты, тромбоциты). В последние годы клеткам эндотелия отводится существенная роль как в реализации защитных реакций, так и в иммунопатологических процессах.
Состояние, возникающее после вакцинации БЦЖ или после первичного инфицирования, не определяет абсолютной устойчивости против МБТ. Интенсивность противотуберкулезной защиты зависит как от характера антигенного воздействия (вид возбудителя, вирулентность, массивность) так и от состояния макроорганизма, в первую очередь от состояния иммунной системы (наличия врожденного иммунодефицита), а также факторов, которые могут вызвать вторичную ее дефектность: облучение, употребление имуноденресантов, интоксикация. Играют роль другие факторы: состояние нервной, эндокринной систем, характер обменных процессов и др.
Долгое время считалось, что иммунитет при туберкулезе носит "нестерильный" характер. Это основывалось на том, что для поддержания иммунитета необходимо обязательные наличие в организме МБТ или их субстанций. Однако исследования многих авторов к вели, что для поддержания иммунитета наличие живых микроорганизмов не нужно.
Иммунологическая память
Это сохранение антигенных детерминант на клеточных элементах крови и в сыворотке крови (М. М. Авербах). В механизме поддержки иммунитета этот феномен играет большую роль.
Серьезной проблемой фтизиатрии является широкое инфицирование практически здорового населения; большинство лиц туберкулинпозитивные, что свидетельствует о наличии персистирующей туберкулезной инфекции. Очень важное значение имеет выявление среди них групп риска, в которых возможно развитие заболевания. Нужны критерии определения активации старых очагов, в которых могут храниться МБТ в той или иной форме.
Многие авторы связывают заболевания туберкулезом и реактивации туберкулезной инфекции со снижением естественной сопротивляемости и приобретенного противотуберкулезного иммунитета. В клинике нет возможности оценить состояние иммунной системы к заболеванию, поэтому нельзя с полной достоверностью совместить развитие патологии с начальными нарушениями иммунной системы.
Однако известно, что более высокая заболеваемость туберкулезом встречается у больных диабетом, у переболевших корью, у ВИЧ-инфицированных, то есть у лиц с нарушениями в иммунной системе. Проблема иммунодефицита актуальна также потому, что значительно увеличивается число больных туберкулезом среди лиц, злоупотребляющих наркотиками.
Различная степень естественной устойчивости к туберкулезной инфекции различных видов животных и человека связана с генетическими факторами, определяющими разную склонность к заболеваемости разных людей. Выполнено достаточно много исследований, доказавших ассоциации генов НLА-системы с устойчивостью к туберкулезу. Показано, что неблагоприятное течение туберкулезного процесса чаще встречается у лиц с БК-2 антигенами, благоприятный — с ОК.-3. Гены НLА-комплекса I и II классов являются важными факторами, определяющими патогенез туберкулеза, контролируя устойчивость и восприимчивость к туберкулезной инфекции.
Читайте также:

