Повышенное соэ при цитомегаловирусе
Обновлено: 19.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитомегаловирус: причины появления, симптомы, диагностика и способы лечения.
Определение
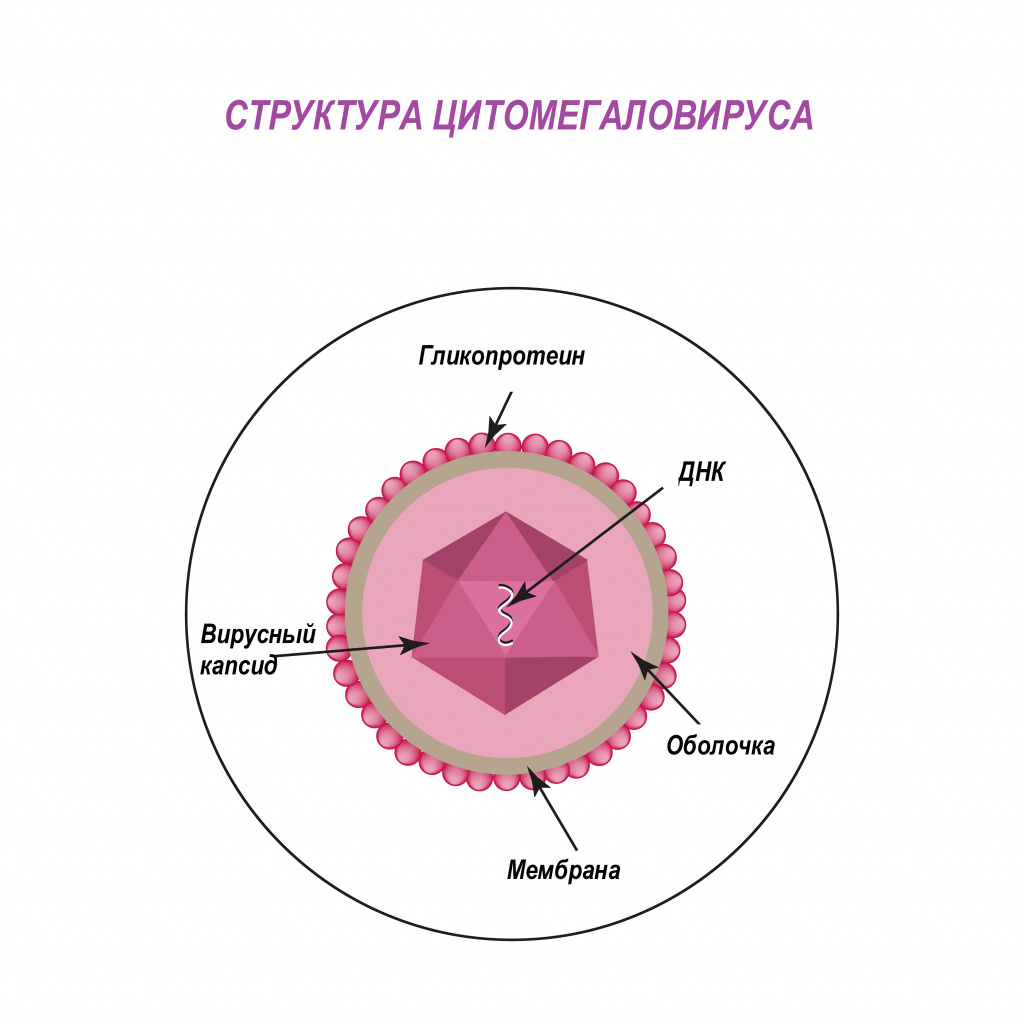
Цитомегаловирус (ЦМВ, или цитомегаловирусная болезнь) – хроническое инфекционное заболевание вирусной этиологии, характеризующееся многообразием клинических форм и проявлений - от бессимптомного течения до тяжелого поражения внутренних органов и центральной нервной системы. Возбудитель ЦМВ – представитель семейства герпесвирусов (вирус герпеса человека 5-го типа).
Попадая в клетки организма, цитомегаловирус способен оставаться в них пожизненно. У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. При угнетении иммунитета вирус активизируется, вызывая клинические симптомы болезни.
По различным данным доля носителей цитомегаловируса в России составляет порядка 73-90% - то есть именно у такого количества людей выявляются антитела к ЦМВ.
Причины появления цитомегаловирусной болезни
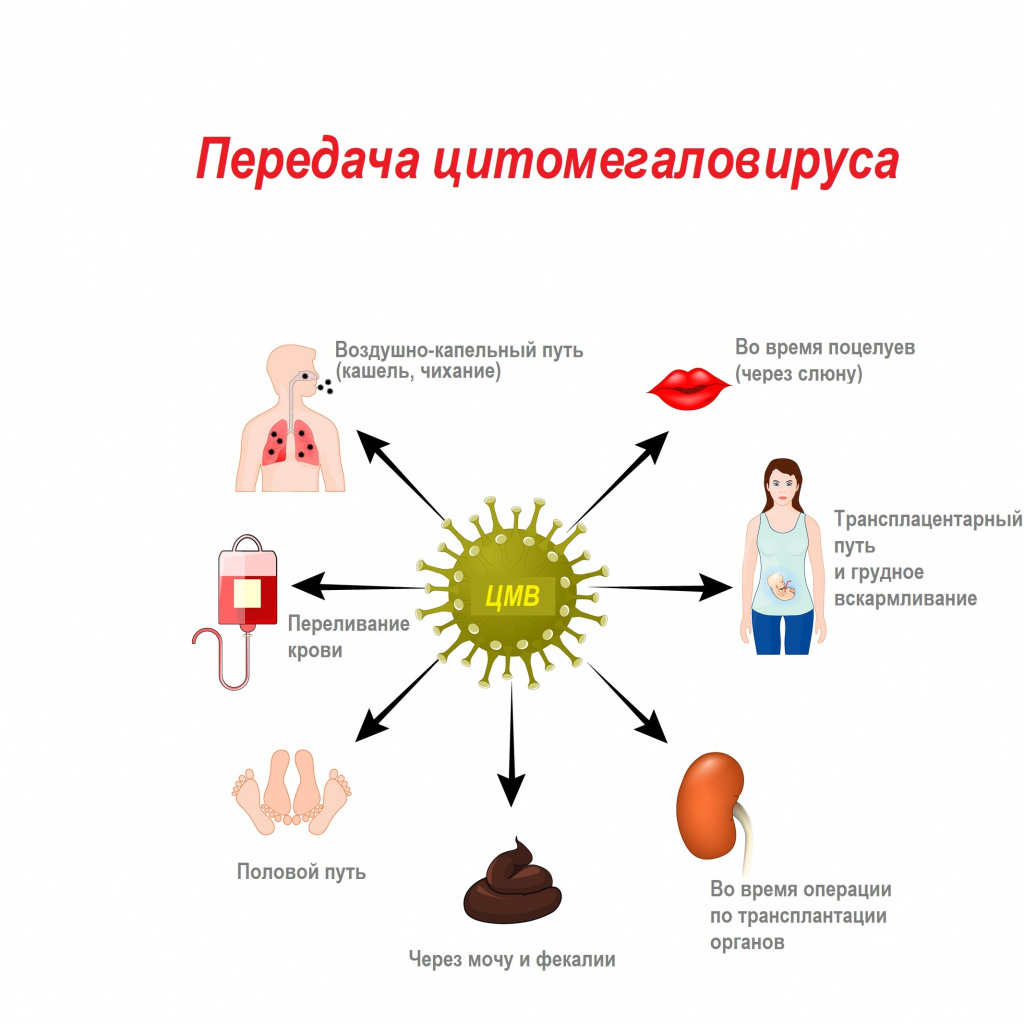
Цитомегаловирус передается через биологические жидкости: слюну, мочу, кровь, вагинальный секрет, слезы, сперму, фекалии, грудное молоко.
Из-за лабильности возбудителя и низкой концентрации вируса в выделениях для передачи инфекции необходим длительный, частый и тесный контакт с носителем.
Механизмы передачи вируса — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой), гемоконтактный (парентеральный, а также при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Заражение плода реализуется за счет трансплацентарной передачи от матери к плоду, которая возможна в течение всей беременности. Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности, поскольку часто вызывает формирование врожденных пороков развития.
Особое свойство ЦМВ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов, в первую очередь ИНФ-α. При острой инфекции вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Цитомегаловирус может инфицировать нервные клетки, клетки гладкой мускулатуры, костного мозга.
Классификация заболевания
По характеру инфицирования:
- врожденное (внутриутробное),
- постнатальное (приобретенное).
- латентная инфекция,
- персистирующая инфекция,
- активная (низкой, средней, высокой степени тяжести) инфекция.
- острая инфекция,
- реактивация вируса,
- реинфекция.
Инкубационный период цитомегаловирусной болезни составляет от 15 дней до трех месяцев (при манифестной, выраженной форме заболевания). Однако чаще первичное инфицирование протекает или бессимптомно, или по типу легкой формы ОРЗ – у пациента наблюдаются незначительная слабость, лихорадка (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение шейных лимфатических узлов, болезненность слюнных желез, головная боль, отсутствие аппетита.
У беременных острая первичная инфекция протекает, как правило, бессимптомно (25–50%) или с неспецифическими проявлениями (с лихорадкой, астенией и головной болью).
В редких случаях развиваются гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфоцитоз.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает тяжело - вирус быстро распространяется по организму и вызывает серьезные осложнения.
Диагностика цитомегаловируса
Диагностические мероприятия начинаются со сбора жалоб и анамнеза, в том числе акушерско-гинекологического анамнеза матери.
Затем врач проводит объективное обследование (физикальное, неврологическое и антропометрическое).
Лабораторные исследования - общие и специфические:
-
общий анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgG; Цитомегаловирусная инфекция; ЦМВ-инфекция; Специфические иммуноглобулины класса G к цитомегаловирусу. Cytomegalovirus; CMV Antibody, IgG; CMV infection; CMV-specific IgG. Краткое описание исследования Anti-CMV-IgG .
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирусная инфекция входит в группу репродуктивно значимых инфекций, обозначаемых как TORCH-комплекс (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes); первичное инфицирование данными возбудителями, либо обострение .
К каким врачам обращаться
С первичными жалобами пациенты обращаются к врачу-терапевту или врачу общей практики (семейному врачу), детей ведет врач-педиатр . Могут потребоваться консультации инфекциониста - для верификации диагноза, стоматолога - при поражениях слизистой оболочки рта, кардиолога - при наличии врожденного порока сердца, нейрохирурга - при пороках центральной нервной системы, невропатолога - для оценки неврологической патологии, гематолога - при выраженных гематологических изменениях и геморрагическом синдроме, окулиста - для исследования глазного дна, отоларинголога - для исследования слухового аппарата.
Лечение цитомегаловирусной болезни
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфической терапии даже при выявлении антител. Их лечение направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для терапии клинически активных форм инфекции применяют:
- комплекс патогенетической (противовирусной) терапии, который разрабатывается профильными специалистами и включает препараты прямого противовирусного действия для минимизации риска осложнений, сокращения времени течения заболевания, а также профилактики рецидивов;
- иммунотерапию – антицитомегаловирусный иммуноглобулин назначают преимущественно детям при манифестных формах заболевания и беременным;
- дезинтоксикационную терапию, которая направлена на купирование синдрома интоксикации;
- метаболическую терапию - для восстановления обмена веществ в организме;
- симптоматическую терапию - для купирования воспалительных и токсических проявлений заболевания.
Проблема клинически выраженной инфекции актуальна для лиц, имеющих иммуносупрессию иной природы, в частности, онкогематологических пациентов, больных лучевой болезнью, лиц, длительно принимающих кортикостероидную, туберкулостатическую терапию, а также перенесших ожоговую травму.
Острое течение ЦМВ может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом.
Ученые предполагают роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, кардиомиопатии, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма.
Первичное инфицирование цитомагаловирусом у беременных женщин существенно повышает риск преждевременных родов, самопроизвольного выкидыша, многоводия, замершей беременности, внутриутробного инфицирования и даже гибели плода. Врожденная ЦМВ-инфекция может стать триггерным фактором развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией.
Профилактика цитомегаловирусной болезни
Женщинам, планирующим беременность, необходимо пройти обследование на наличие ЦМВ. При обнаружении вируса важно получить консультацию врача-иммунолога.
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции после трансплантации органов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Наиболее распространенным методом обнаружения ЦМВИ (цитомегаловирусной инфекции) является анализ крови на цитомегаловирус. Существуют различные методики обнаружения возбудителя, которые позволяют надежно определить наличие возбудителя. Большинство тестов основано на обнаружении специфических антител, вырабатываемых организмом в ответ на возбудитель. Возможна и ПЦР диагностика, которая дает информацию о наличии ДНК возбудителя в крови, позволяет оценить активность протекания инфекционного процесса и степень распространения возбудителя в организме.
Наиболее распространенным методом обнаружения ЦМВИ (цитомегаловирусной инфекции) является анализ крови на цитомегаловирус. Существуют различные методики обнаружения возбудителя, которые позволяют надежно определить наличие возбудителя. Большинство тестов основано на обнаружении специфических антител, вырабатываемых организмом в ответ на возбудитель. Возможна и ПЦР диагностика, которая дает информацию о наличии ДНК возбудителя в крови, позволяет оценить активность протекания инфекционного процесса и степень распространения возбудителя в организме.
Цитомегаловирусная инфекция человека это вирусное антропонозное заболевание поражающее практически весь организм. Характеризуется большой вариабельностью форм и симптоматики – от бессимптомного носительства до тяжелейших поражений дыхательной, выделительной и других систем организма.
Возбудители инфекции, ее источники
Источником заражения является больной либо носитель. Возбудитель определяется в биологических жидкостях и выделениях. Пути проникновения вируса:
Большинство штаммов малоизученны, достоверно известно, что все они могут репродуцироваться, не уничтожая клетку-носитель. Вирус способен длительно сохранятся при комнатной температуре, но чувствителен к нагреву и действию дезинфицирующих средств.
- Воздушно-капельный.
- Контактный.
- Пищевой.
- Парентеральный и трансплацентарный.
По статистическим данным показатель инфицированности составляет до 95%, в зависимости от региона и страны.
Классификация
Общепринятой на мировом уровне системы классификации цитомегаловирусной инфекции (ЦМВИ) нет. На практике применяется классификация, разработанная в 1980 году. Согласно этой системе ЦМВИ делится на:
- Врожденную, может быть острой, хронической.
- Приобретенную, бывает острой, латентной, генерализованной.
По длительности течения выделяют ЦМВИ:
- Острую.
- Затяжную
- Хроническую
- Рецидивирующую.
В зависимости от тяжести течения бывает легкая, среднетяжелая, тяжелая формы протекания.
Механизм зарождения и развития болезни
Вирус попадает в организм через слизистый эпителий различных органов. Свободное нахождение вирусных частиц в кровеносном русле быстро заканчивается внедрением возбудителя в фагоциты мононуклеарного типа. В них происходит начальная репликация цитомегаловируса.
Зараженные клетки увеличиваются, в них можно обнаружить крупные внутриядерные включения, которые являются скоплениями вирусных тел. Увеличение количества пораженных клеток проявляется развитием множественных узелковых инфильтратов либо кальцификатов в тканях. Особенно активно размножение возбудителя в слюнных железах, в которых его проще всего обнаружить.
Возбудитель способен длительно сохранятся в клетках, единственным проявлением инфекции будет подавление клеточного иммунитета. У большинства болезнь протекает скрыто и переходит в бессимптомное носительство.
Обострение ЦМВИ возникает у больных с подавленным иммунитетом. Наиболее частые причины ослабления защитных сил организма:
- Прием иммуносупрессоров.
- ВИЧ-инфекция.
- Беременность.
В результате вирус активируется, начинается активное размножение возбудителя во всех органах и тканях, развивается клиника одной из форм заболевания. Тяжелые поражения ЦМВИ в большинстве случаев ассоциированы с ВИЧ-инфекцией.
Клиническая картина
Продолжительность инкубационного периода остается невыясненной так как начальные формы ЦМВИ протекают латентно. Характерные клинические симптомы развиваются в результате воздействия факторов, ослабляющих иммунитет.
Врожденная ЦМВИ-инфекция у детей в ранних периодах жизни также протекает как бессимптомное носительство. Затем проявляется в виде различных тяжелых осложнений, наиболее частые:
- Глухота.
- Хориоретинит.
- Цитомегаловирусный синдром.
В особо тяжелых случаях врожденная ЦМВ-инфекция приводит к возникновению вторичных патологий и летальному исходу в первые недели жизни. Избежать этих последствий можно сделав анализ крови на цитомегаловирус перед зачатием ребенка.
Острая врождённая ЦМВИ
Является следствием первичного заражения матери в процессе беременности. Развивается примерно у 5% детей заразившихся ЦМВ-инфекцией внутриутробно. В остальных случаях протекает скрыто, не приводит к серьезным последствиям. Летальность острой врожденной ЦМВ-инфекции высока, составляет до 30% от заболевших. Выжившие дети зачастую страдают от тяжелых последствий, в их перечень входят:
- Задержка в физическом и психическом развитии.
- Хроническая желтуха.
- Гидроцефалия.
- Поликистоз поджелудочной.
Если заражение ребенка произошло на ранних сроках эмбриогенеза, плод с высокой вероятностью погибнет. У выживших наблюдаются серьезные дефекты и аномалии развития:
- Микроцефалия.
- Гипоплазия легких.
- Дефекты строения почек сердца и аорты.
- Атрезия пищевода.
- Хроническая врождённая ЦМВИ
Летальность при развитии этой формы инфекции невысока, она характеризуется развитием тяжелых патологий органов и систем ребенка. В их число входят: гидро- и микроцефалия, помутнение хрусталика, глухота, микрогирия (недоразвитость извилин головного мозга).
Приобретённая ЦМВ-инфекция
У большинства зараженных протекает без выраженной клиники, в виде субклинической формы либо латентного вирусоносительства. Переход в клинически выраженное заболевание наблюдается при различных нарушениях в работе иммунитета возникающих под воздействием разнообразных факторов риска.
При этом развивается острая приобретенная ЦМВИ, симптомы которой схожи с вирусным гепатитом либо инфекционным мононуклеозом. Может протекать скрытно, выявляется случайно при скрининговом анализе крови на цитомегаловирус.
Еще одна часто встречающаяся форма приобретенной ЦМВ-инфекции – мононуклеозоподобный синдром. Клинические проявления этой формы практически идентичны другому заболеванию, вызванному герпесвирусом Эпштейна-Барра – инфекционному мононуклеозу.
Период инкубации может длиться до 60 дней. Активная фаза заболевания начинается с гриппоподобных симптомов: длительной лихорадки, озноба, выраженных болей в мышцах, суставах, сильной утомляемости. Больные часто жалуются на першение в горле, наблюдается увеличение региональных лимфоузлов, кожные высыпания.
Изредка возможно проявление симптомов гепатита, таких как желтуха. В анализе крови наблюдается увеличение ферментов печени (АлАТ, АсАТ). Возможно развитие пневмонии, вероятность поражения легких составляет 5-6%.
Длительность заболевания может составлять до 1-2 месяцев, после чего у большинства больных происходит полное выздоровление. Некоторые симптомы сохраняются дольше, например, увеличенные лимфоузлы могут сохраняться на срок до полугода.
Приобретенная Цитомегаловирусная инфекция у новорожденных
Развивается в результате инфицирования новорожденного при прохождении родовых путей либо на начальных этапах жизни – при вскармливании грудью, контактах с носителями вируса. У большинства детей бессимптомно преобразуется в форму носительства.
Клинические симптомы проявляются в случае тяжелой недоношенности либо маловесности ребенка. Инфекция протекает в виде длительной пневмонии, часто присоединяется бактериальное поражение дыхательной системы. Не исключено развитие гепатита, увеличение лимфоузлов, задержки в умственном, физическом развитии. При беременности необходимо сдавать массу анализов, которые помогают выявить наличие не только ЦМВ-инфекции, но и токсоплазмоза.
Генерализованная форма ЦМВ-инфекции
Развивается у зараженных с крайне ослабленным иммунитетом. Отличается серьезным повреждением печени, нервной системы, ЖКТ, легких. Степень тяжести патологии зависит от состояния иммунной системы, особенно тяжелые проявления наблюдаются у принимающих иммуносупрессоры и больных СПИДом.
Основные клинические проявления при генерализованной ЦМВ-инфекции:
- Подострое начало. Для него характерны: выраженный упадок сил, лихорадка, повышенное потоотделение в ночное время суток, больные жалуются на боль в суставах, мышцах.
- Язвы желудка, кишечника и пищевода, проявляются в виде болей в животе, диспепсических явлениях. Могут привести к внутренним кровотечениям и прободениям в стенках ЖКТ.
- Гепатит. Наблюдается желтуха, болезненность и увеличение печени.
- Пневмония. Появляется боль в груди, кашель, увеличивается ЧДД.
- Энцефалит. Основные проявления: нистагм (ритмичные подергивания глаз), сонливость, поражение одной либо нескольких пар черепных нервов, дезориентация. У ВИЧ-положительных может развиться СПИД-дементный синдром.
- Ретинит. Приводит к полной либо частичной слепоте.
- Полиорганная недостаточность. Самая часто встречающаяся причина смерти при генерализованном инфекционном процессе. Проявляется в виде дисфункции всех органов и систем пораженного вирусом организма.
Диагностика инфекции
В обычном анализе крови у страдающих ЦМВ-инфекцией наблюдается:
- Выраженный лимфоцитоз.
- Атипичные мононуклеары (до 10% и более).
- Общее количество лейкоцитов редко выходит за пределы нормы. У новорожденных возможно обнаружение тромбоцитопении и снижения количества эритроцитов. При биохимическом анализе крови наблюдается увеличение активности печеночных ферментов.
В пробах спинномозговой жидкости у пациентов с поражением ЦНС выявляют увеличение белковых компонентов, нейтрофильный плеоцитоз и значительное снижения уровня глюкозы.
Лечение
Профилактика
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфического лечения, даже при выявлении специфических антител. Лечения таких форм цитомегаловируса направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для лечения клинически активных форм ЦМВ-инфекции применяют 3 препарата, обладающих достаточной эффективностью:
- Ганцикловир. Вводится путем внутривенных вливаний дважды в сутки. Курс лечения длится 2-3 недели. Особенно эффективен в комбинации с Citotect – специфическим иммуноглобулином, который также вводится внутривенно.
- Фоскарнет. Применяется если лечение ганцикловиром было недостаточно эффективным. Вводится внутривенно трижды в день, путем медленного введения (длительность инфузии не менее 2 часов).
- Цидофовир. Еще один препарат выбора при ЦМВИ, который применяется при резистентности к ганцикловиру. Вводится внутривенно, 1 раз в неделю.
Эти препараты противопоказаны для применения беременным. В этом случае назначается патогенетическая терапия. В нее входят разнообразные препараты интерферона (виферон, роферон) а также индукторы выработки собственных интерферонов – циклоферон, неовир.
Введение интерферонов и других иммуномодулирующих препаратов происходит под контролем иммунологического статуса. При неэффективности иммуномодуляторов возможно назначение курса, человеческого иммуноглобулина который вводится путем внутримышечных инъекций в количестве от 3 до 5 с промежутком в 2-3 дня.
Различные формы ЦМВ-инфекции могут маскировать под схожие по симптомам заболевания. Поэтому требуется дифференциальная диагностика с:
- Сепсисом.
- Инфекционным мононуклеозом.
- Бактериальным менингитом.
Специфическая диагностика
Основное направление в профилактике ЦМВИ – соблюдение правил личной гигиены, индивидуальная защита при контакте с больными цитомегаловирусом. Особенно важно соблюдать профилактические рекомендации людям, входящим в группу риска:
- Пациенты, перенесшие трансплантацию.
- Беременные.
- ВИЧ-инфицированные.
- Больные страдающие иммунодефицитами.
Средства для специфической профилактики находятся в разработке. Единственный препарат, который позволяет проводить профилактику у пациентов после трансплантации – летермовир. Широкого применения он пока не нашел, рекомендован к использованию только в США.
Обследование на цитомегаловирусную инфекцию в Медарт
Лаборатория клиники Медарт оборудована современным высокоточным оборудованием, которое позволяет выполнить любые виды диагностики цитомегаловирусной инфекции и другие виды серологической диагностики инфекционных заболеваний (диагностика на ВИЧ, сифилис, гепатит, лямблиоз, Helicobacter pylory, токсоплазмоз).
Анализ крови на цитомегаловирус входит в комплекс анализов на ИППП (инфекции, передающиеся половым путем). Также есть возможность провести диагностику ЦМВИ по индивидуальным показателям, например, при планировании беременности.
При необходимости результаты теста можно получить в день сдачи материала. Это особенно важно при тяжелых формах ЦМВ-инфекции, когда решающую роль играет скорость постановки диагноза и назначения эффективного лечения. Преимущества клиники:
- Возможность выполнить полный спектр диагностических процедур.
- Оптимальная ценовая политика.
- Квалифицированные специалисты.
Пациенты клиники Медарт получают полный спектр медицинских услуг – от предварительного приема и лабораторной диагностики цитомегаловируса до назначения эффективной терапии и получения рекомендаций по профилактике и реабилитации после перенесенного заболевания.
В статье содержатся результаты собственных наблюдений за 140 детьми в возрасте от 1 до 15 лет с инфекционным мононуклеозом, сопровождавшимся лихорадкой, ангиной, увеличением лимфатических узлов, печени и селезенки. Проведена комплексная оценка изменений периферической крови при острой Эпштейн-Барр вирусной инфекции, цитомегаловирусной инфекции, инфекционном мононуклеозе неуточненной этиологии, микст-инфекции. Выполнен подсчет количества эритроцитов, лейкоцитов, тромбоцитов, лейкоцитарный индекс интоксикации, определение концентрации гемоглобина и гематокрита (Ht), скорости оседания эритроцитов. Верификацию возбудителя осуществляли с помощью молекулярно-генетического (ПЦР) метода исследования. На основании лабораторных данных были сформулированы дифференциально-диагностические особенности инфекционного мононуклеоза различной этиологии у детей. Доказано, что длительность и тяжесть течения инфекционного мононуклеоза напрямую зависят от типа возбудителя, возраста и состояния иммунитета больного.

1. Белан Ю.Б., Михайлова Т.А. Значение клинических и лабораторных данных в дифференциальной диагностике инфекционного мононуклеоза // Детские инфекции. - 2008. - № 1 (7). - С. 32-35.
2. Крамарь Л.В., Арова А.А., Карпухина О.А. Клинико-иммунологические характеристики мононуклеозоподобного синдрома у детей // Вестник Волгоградского государственного медицинского университета. - 2012. - № 1 (41). - С. 72-74.
3. Крамарь Л.В., Карпухина О.А., Арова А.А. Этиологическая структура и клинико-лабораторная характеристика мононуклеозоподобного синдрома у детей // Фундаментальные исследования. - 2012. - № 7 (1). - С. 92-95.
4. Рослый И.М., Абрамов С.В. Биохимические показатели в оценке цитолитических механизмов и метаболических процессов на примере инфекционного мононуклеоза // Эпидемиология и инфекционные болезни. - 2005. - № 5. - С. 33-41.
5. Симованьян Э.Н. Эпштейна-Барр вирусная инфекция у детей // Лечащий врач. - 2007. - № 7. - С. 36-41.
6. Уразова О.И., Новицкий В.В., Помогаева А.П. Клинико-гематологические и цитогенетические проявления инфекционного мононуклеоза у детей // Эпидемиология и инфекционные болезни. - 2004. - № 3. - С. 34-39.
7. Mossman K.L., Ashkar A.A. Herpesviruses and the innate immune response // Viral Immunol. - 2005. - Vol. 18. - № 2. - P. 267-281.
8. Randall R.E., Goodbourn S. Interferons and viruses: an interplay between induction, signalling, antiviral responses and virus countermeasures // J. Gen. Virol. - 2008. - Vol. 89. - P. 41-47.
Общий анализ крови (ОАК) - один из важнейших диагностических методов, тонко отражающих реакцию кроветворных органов на воздействие различных физиологических и патологических факторов. Данные, полученные при его выполнении, представляют собой интегральные показатели состояния гемопоэтической системы, зрелые элементы которой осуществляют основные защитные функции организма и принимают активное участие во всех видах обмена [7].
Количественные и качественные изменения форменных элементов крови характерны для многих инфекционных заболеваний как бактериальной, так и вирусной этиологии. Наиболее выраженные изменения в периферической крови наблюдаются при герпетических инфекциях, кори, краснухе, ВИЧ-инфекции, вирусных гепатитах и др. [1].
Инфекционный мононуклеоз - острое инфекционное заболевание, вызываемое герпетическими вирусами 4, 5, 6-го типов, характеризующееся лихорадочным состоянием, ангиной, увеличением лимфатических узлов, печени и селезенки [5].
В настоящее время инфекционный мононуклеоз следует считать полиэтиологическим заболеванием. Согласно МКБ -10 выделяют: инфекционный мононуклеоз, вызванный гамма-герпетическим вирусом Эпштейн-Барр (В27.01); цитомегаловирусный мононуклеоз (В27.1);
другой инфекционный мононуклеоз (В27.8); инфекционный мононуклеоз неуточненный (В27.9).
Основными проявлениями инфекционного мононуклеоза, определяющими его сущность и название, служат изменения в периферической крови, которые возникают в первые дни болезни и достигают максимума в ее разгар. Это умеренный лейкоцитоз, увеличение количества одноядерных элементов крови (лимфомоноцитоз), умеренное повышение СОЭ [8]. В начале болезни у большинства больных значительно снижается содержание сегментоядерных нейтрофилов и увеличивается количество палочкоядерных. Самым характерным признаком инфекционного мононуклеоза является наличие атипичных мононуклеаров, которые появляются в разгар болезни и сохраняются 2-3 недели. На ранних стадиях - это В-лимфоциты, содержащие специфические иммуноглобулины в цитоплазме. В последующие стадии большую часть атипичных мононуклеаров составляют Т-клетки [2].
Диагностическое значение имеет увеличение количества атипичных мононуклеаров с широкой цитоплазмой не менее чем до 10-12%, хотя число этих клеток может достигать 80-90%. Следует заметить, что отсутствие атипичных мононуклеаров при характерных клинических проявлениях заболевания не противоречит предполагаемому диагнозу, поскольку их появление в периферической крови может задерживаться до конца 2-3-й недели болезни [4].
При обследовании детей с инфекционным мононуклеозом анализ крови обычно включает определение количества эритроцитов, лейкоцитов, тромбоцитов, ретикулоцитов, подсчёт лейкоцитарной формулы, определение концентрации гемоглобина, СОЭ, вычисление цветового показателя и гематокрита (Ht).
Данные общего анализа крови позволяют получить комплексное представление о тяжести течения инфекционного мононуклеоза, наслоении бактериальной инфекции, эффективности проводимой терапии.
Цель исследования - выявление закономерностей изменения показателей периферической крови у детей при инфекционном мононуклеозе различной этиологии.
Материалы и методы исследования
Под нашим наблюдением находилось 140 детей с инфекционным мононуклеозом в возрасте от 1 до 15 лет, проходивших стационарное лечение в Волгоградской областной детской клинической инфекционной больнице. Верификацию возбудителя осуществляли с помощью молекулярно-генетического (ПЦР) метода исследования. Также всем больным проводилось комплексное обследование, которое включало в себя общеклинические (сбор анамнеза, осмотр, пальпацию, перкуссию, аускультацию) и лабораторно-инструментальные методы: общие анализы крови и мочи, биохимические тесты (АЛТ, АСТ, коэффициент де Ритиса, тимоловые пробы), УЗИ органов брюшной полости.
С целью определения степени интоксикации и выраженности гнойно-воспалительного процесса в ротоглотке при инфекционном мононуклеозе у детей производили расчёт лейкоцитарного индекса интоксикации (ЛИИ). Определение ЛИИ имело важное значение как для контроля за лечением, так и для прогноза заболевания.
Существует несколько способов расчета лейкоцитарного индекса интоксикации. Нами была выбрана формула В.К. Островского (1983), в которой в числителе находится сумма процентного содержания клеток миелоидного ряда, а в знаменателе - сумма остальных клеток белой крови [6].
Формула расчёта ЛИИ,
где: ПК - плазматические клетки, миел. - миелоциты, ю. - юные, п. - палочкоядерные, с. - сегментоядерные, Лимф. - лимфоциты, мон. - моноциты, э. - эозинофилы, б. - базофилы.
Результаты и их обсуждение
Данные, полученные при исследовании носоглоточной слизи и сыворотки крови у 140 детей методом ПЦР, показали, что на долю классического ИМ, вызванного Эпштейн-Барр вирусом (ЭБВ), приходилось 74,3% всех случаев. У 1/3 детей мононуклеоз был обусловлен другими возбудителями: в 9,2% - цитомегаловирусом (ЦМВ), в 8,6% - микст-инфицированием ЦМВ и ЭБВ, у 7,9% детей этиологию заболевания установить не удалось.
Далее нами был проведен анализ гемограмм наблюдаемых детей с учетом этиологии заболевания. Полученные данные представлены в табл. 1 и 2.
Таблица 1 - Частота встречаемости патологических изменений показателей ОАК при инфекционном мононуклеозе различной этиологии
Таблица 2 - Средние значения патологических показателей ОАК при инфекционном мононуклеозе различной этиологии
Сниж. гемоглобина (г/л)
Повыш. гемоглобина (г/л)
Сниж. гематокр. (г/л)
Ускорение СОЭ (мм/час)
Оценка данных таблиц показала, что при Эпштейн-Барр вирусном мононуклеозе лейкоцитоз отмечался у 43,3% больных, лейкопения - у 2,9%. Количество лейкоцитов колебалось в широких пределах - от 4,0х109 г/л до 32,7х109 г/ л и в среднем составляло 16,3±5,3х109 г/л. Характерным для ИМ-ЭБВ этиологии изменением в периферической крови было снижение сегментоядерных нейтрофилов (в среднем до 18,1±8,2%), что отмечалось у 39,4% детей. Нейтрофилез встречался редко и был зафиксирован только у 7,7% больных. В 16,3% случаев у детей с ИМ-ЭБВ этиологии в ОАК отмечался палочкоядерный сдвиг влево. Количество палочкоядерных нейтрофилов колебалось от 0 до 42%, составляя в среднем - 11,4±8,9%.
Процентное содержание лимфоцитов в периферической крови у детей было разнообразным и варьировало от 2,0 до 85,0%. Лимфоцитоз, при сравнении с нормальными возрастными показателями, был выявлен у 21,2% обследованных, лимфопения - у 15,4%. Нарастание моноцитов отмечалось у 23,0% детей, их среднее значение составило - 15,6±3,3%.
Наличие в периферической крови атипичных мононуклеаров при инфекционном мононуклеозе Эпштейн-Барр вирусной этиологии являлось кардинальным симптомом и встречалось в 74,0% случаев. Количество плазматических клеток было разнообразным и в большинстве случаев зависело от сроков заболевания. Так, у 39,4% больных их значение не превышало 10% и в среднем равнялось 5,5±2,8%. У 34,6% - количество атипичных мононуклеаров в крови было более 10% и имело среднее значение - 21,9±1,7%.
Тромбоцитопения была частым симптомом ЭБВ-инфекции и выявлялась у 52,9% больных. Значение показателей тромбоцитов колебалось в пределах от 81х109 до 173х109 г/л и в среднем составляло 131±14,5х109 г/л.
Ускорение СОЭ отмечалось у 34,6% детей при ЭБВ-инфекции. Значения данного показателя были разнообразными и колебались от 13 до 50 мм/час, в среднем составляя 24±10,9 мм/час.
Цитомегаловирусная инфекция была подтверждена у 13 детей, поступавших в стационар с диагнозом инфекционный мононуклеоз. Характерными особенностями ОАК крови при ЦМВ-инфекции были: значительный лейкоцитоз со сдвигом влево и повышением общего количества лейкоцитов до 17,5±6,6х109 г/л, который наблюдался у 1/3 больных, нейтропения (у 23,0%), лимфоцитоз (23,0%), эритроцитоз (30,8%), гипохромная анемия (30,8%), тромбоцитопения (53,8%), выраженное снижение гематокрита, в среднем до 25,7 ±1,2 г/л, что наблюдалось у 61,5% детей. Обращала на себя внимание высокая частота встречаемости атипичных мононуклеаров в периферической крови у больных цитомегаловирусной инфекцией (84,6%), причем их количество в подавляющем большинстве случаев превышало 10% и в среднем составляло 17,5±2,1%.
СОЭ при ЦМВ-инфекции чаще соответствовало возрастной норме, ее ускорение отмечалось лишь у 23,0% детей.
Инфекционный мононуклеоз, обусловленный одновременным инфицированием Эпштейн-Барр и цитомегаловирусом, был диагностирован у 12 детей. Изменение показателей ОАК при микст-инфекции также имело характерные особенности: лейкопения за счет снижения сегментоядерных нейтрофилов, что выявлялось в 33,3% случаев, выраженный лимфоцитоз (у 33,3%) с повышением количества лимфоцитов в среднем до 74,3±13,2%, нормальное содержание моноцитов. Атипичные мононуклеары при микст-инфекции обнаруживались в крови у 33,3% больных, что было вдвое реже, чем при изолированных Эпштейн-Барр и ЦМВ-инфекциях. Их количество в подавляющем большинстве случаев не превышало 10% и в среднем соответствовало 8,2±2,4%.
Характерной особенностью инфекционного мононуклеоза смешанной этиологии была высокая частота встречаемости ускоренной СОЭ, что было выявлено у 58,3% больных. Данный показатель колебался в пределах от 13 до 40 мм/час, в среднем составляя 21±9,9 мм/час.
СОЭ была ускоренной у 54,5% детей, колебалась в пределах от 15 до 36 мм/час, в среднем не превышала 21±7,9 мм/час.
Для оценки степени интоксикации и выраженности гнойно-воспалительного процесса в ротоглотке при инфекционном мононуклеозе у детей мы производили расчёт лейкоцитарного индекса интоксикации (табл. 3).
Таблица 3 - Значение лейкоцитарного индекса интоксикации при инфекционном мононуклеозе различной этиологии
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgG; Цитомегаловирусная инфекция; ЦМВ-инфекция; Специфические иммуноглобулины класса G к цитомегаловирусу.
Краткое описание исследования Anti-CMV-IgG
Цитомегаловирус – вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирусная инфекция в зависимости от условий может характеризоваться многообразными проявлениями от бессимптомного течения или легкого острого респираторного заболевания до тяжелого поражения внутренних органов и центральной нервной системы. ЦМВ-инфекция относится к оппортунистическим инфекциям: выраженные клинические проявления отмечаются чаще всего у пациентов с врожденными или приобретенными иммунодефицитными состояниями (в том числе вследствие ВИЧ-инфекции, применения иммунодепрессантов при трансплантации органов и пр.), а также на фоне физиологических иммунодефицитных состояний (дети первых 3-5 лет жизни, беременные женщины).
Тестирование крови на аnti-CMV IgG позволяет установить, был ли человек в прошлом инфицирован цитомегаловирусом. Содержание этих антител обычно быстро нарастает в первые недели острой инфекции и у отдельных лиц может сохраняться на высоком уровне долгое время. Иммунный ответ, развивающийся по отношению к цитомегаловирусу после инфицирования, не является стерильным: присутствие аnti-CMV IgG не обеспечивает полной защиты от повторного инфицирования. Наличие этих антител свидетельствует о текущей или прошлой инфекции и не исключает возможности ее реактивации в будущем. Серийные исследования уровня аnti-CMV IgG используют в случае необходимости подтверждения первичного или острого течения инфекции, параллельно определению аnti-CMV IgМ (для этих состояний характерно достоверное повышение уровня аnti-CMV IgG через две недели). Для установления инфицированности новорожденных определение аnti-CMV IgG неинформативно, поскольку специфические IgG, в отличие от IgM, могут передаваться плоду от матери через плаценту.
С какой целью определяют Anti-CMV-IgG
Исследование на обнаружение антител класса G к цитомегаловирусу позволяет определить наличие или отсутствие текущего, или прошлого инфекционного процесса. Определения потенциальной возможности первичного инфицирования и острой ЦМВ-инфекции в будущем, что важно для беременных женщин в период беременности, при трансплантации органов и проведении иммуносупрессивной терапии.
Важно! ЦМВ-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами латинских наименований – Toxoplasma, Rubella, Cytomegalovirus, Herpes). Первичное инфицирование данными возбудителями либо обострение уже имеющейся хронической инфекции из этой группы во время беременности является потенциально опасным для развития плода.
В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за три месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности. Обследование на TORCH-комплекс входит в план обследования женщин в период беременности.
Первичная инфекция или (в меньшей степени) реактивации инфекции в период беременности связаны с риском внутриутробной инфекции, опасной для развития плода. Проявления инфекции зависят от особенностей иммунитета матери, вирулентности и локализации вируса, стадии беременности, на которой произошло инфицирование.
Правила подготовки к исследованию на Anti-CMV-IgG
Специальной подготовки не требуется. Рекомендуется взятие крови не ранее чем через 4 часа после последнего приема пищи. С общими рекомендациями для подготовки к исследованиям можно ознакомиться здесь .
В каких случаях проводят анализ Anti-CMV-IgG:
- подготовка к беременности;
- признаки внутриутробной инфекции, фето-плацентарная недостаточность;
- состояние иммуносупрессии при ВИЧ-инфекции, неопластических заболеваниях, приеме цитостатических препаратов и т. д.;
- клиническая картина инфекционного мононуклеоза в отсутствие инфекции, вызванной вирусом Эпштейна-Барр;
- гепатоспленомегалия неясной этиологии;
- лихорадка неясной этиологии;
- повышение уровня печеночных трансаминаз, гамма-ГТ, ЩФ в отсутствие маркеров вирусных гепатитов;
- атипичное течение пневмонии у детей;
- невынашивание беременности (замершая беременность, привычные выкидыши).
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
- ЦМВ-инфекция.
- Внутриутробная инфекция возможна, вероятность ее возникновения неизвестна.
- ЦМВ-инфекция не обнаружена.
- Инфицирование произошло в течение предыдущих 3-4 недель.
- Внутриутробная инфекция невозможна (за исключением случаев присутствия IgM).
Следует учитывать, что такой результат возможен при очень низком уровне антител, который может иметь место, в частности, в начальный период заболевания. В зависимости от клинической ситуации может быть полезным повторное исследование уровня антител через 10-14 дней для оценки динамики.
Когда кровь циркулирует по организму, эритроциты равномерно распределяются в плазме и обеспечивают привычный красный цвет. В лабораторных условиях кровь в пробирке постепенно разделяется на плазму и форменные элементы, причем скорость этого процесса имеет важное значение для оценки уровня здоровья. Повышенный показатель СОЭ (скорости оседания эритроцитов) указывает на проблемы в организме, особенно если он сопровождается колебаниями других лабораторных показателей или клиническими симптомами.
Повышена СОЭ крови: что это означает
Скорость оседания эритроцитов измеряется в миллиметрах в час. Для ее определения достаточно наблюдения за капиллярной пипеткой с образцом крови. По истечении часа измеряется столбик плазмы над поверхностью эритроцитов, который и составляет показатель СОЭ.
Нормальные значения (по Вестергрену) для мужчин находятся в пределах 2-20 мм/час, для женщин – 2-30 мм/час. Результаты, превышающие указанный диапазон, трактуются как патологически повышенные и требуют проведения углубленной диагностики.
Физиологические причины повышения СОЭ крови
Значения анализа зависят от многих факторов: количества эритроцитов, соотношения разных фракций белков плазмы крови, правильности взятия биоматериала для исследования. Поэтому в ряде случаев возможно незначительное отклонение от нормальных показателей, вызванное естественными причинами.
Повышенное СОЭ в клиническом анализе крови наблюдается в таких ситуациях:
- беременность – у женщин возрастает уровень белка фибриногена, который ускоряет оседание и склеивание эритроцитов;
- менструация – изменение соотношения протеинов плазмы крови обуславливает более быстрое оседание красных клеток;
- забор крови вскоре после употребления пищи.
Еще одной причиной отклонений в результатах гемограммы является неправильное хранение, транспортировка и обработка образца крови. Чтобы избежать таких проблем, рекомендуется сдавать анализы только в проверенных лабораториях, где специалисты четко следят за соблюдением протоколов диагностики.
Патологические причины увеличения СОЭ
Если состояние вызвано физиологическими факторами, в большинстве случаев СОЭ будет повышено на фоне других нормальных показателей гемограммы. При отклонении сразу нескольких значений от нормы, с большой долей вероятности это указывает на наличие патологии.
Основным причинным фактором является воспалительный процесс. Он вызывает накопление в крови избыточного количества иммуноглобулинов (белков), которые способствуют прилипанию эритроцитов друг к другу, ускоряют разделение форменных элементов и плазмы. Если причиной возрастания СОЭ выше нормы стало воспаление, в анализе крови также определяется повышение числа лейкоцитов, изменение соотношения их отдельных форм. Кроме того, нарушения в лабораторных анализах наблюдаются при аутоиммунных процессах, заболеваниях системы крови, злокачественных новообразованиях.
Самые распространенные болезни, которые проявляются повышенной СОЭ:
- Инфекции. Любые острые и хронические инфекционные процессы вызывают иммунный ответ и накопление в крови иммуноглобулинов, поэтому они ускоряют оседание эритроцитов. Чем выше значение СОЭ, тем более активна инфекция в организме.
- Ревматические заболевания. СОЭ резко повышается при ревматоидном артрите, системной красной волчанке, дерматомиозите, разных формах васкулитов. При некоторых болезнях уровень этого показателя достигает высоких цифр 50-80 мм/час.
- Заболевания крови. Изменения в анализах могут быть вызваны железодефицитной анемией, серповидно-клеточной анемией, макроцитозом, лейкозами и лимфомами.
- Онкологические болезни. Длительное превышение нормального уровня СОЭ типично для миеломной болезни, рака легкого, желудка, предстательной железы и любых других органов.
- Кардиоваскулярные заболевания. Возрастание скорости оседания эритроцитов относится к маркерам стрессовой реакции, возникает при инфаркте миокарда и других острых состояниях.

Поскольку СОЭ выше нормы у женщин нередко бывает при физиологических изменениях в организме, врачей больше настораживает повышение показателя у мужчин. Изменение скорости оседания красных клеток крови у пациентов мужского пола практически всегда указывает на наличие заболевания.
Эритроциты более активно оседают на фоне длительной фармакотерапии. Спровоцировать нарушения физиологии системы крови могут оральные контрацептивы, салицилаты, гипотензивные средства и опиоидные анальгетики.
Что делать при возрастании СОЭ
Повышенное СОЭ в крови у мужчины или женщины – повод обратиться к терапевту для выяснения первопричины отклонений лабораторных показателей. Даже случайное обнаружение этого нарушения при плановом медицинском осмотре не должно оставаться незамеченным. На приме врач уточнит жалобы, соберет подробный анамнез жизни, проведет физикальный осмотр, назначит дообследование.
Определить, какие изменения в организме показывает повышенное СОЭ, можно только при расширенной диагностике. Для этого назначается биохимический анализ крови, анализ мочи, коагулограмма, исследование острофазовых показателей. При необходимости врач направляет пациента на инструментальное обследование с помощью УЗИ, рентгенографии, ЭКГ.
Чем опасна повышенная СОЭ

Само по себе ускоренное оседание эритроцитов не представляет угрозы для здоровья. Данный показатель интересует врачей, поскольку существует прямая зависимость между его возрастанием и развитием патологических процессов.
Если человек получил результаты клинического анализа крови и заметил увеличение СОЭ, это не повод расстраиваться и паниковать. Главное – вовремя обратиться к специалисту, который сможет определить причину изменения лабораторных показателей и подберет лечение. По мере улучшения состояния и купирования болезни уровень СОЭ постепенно нормализуется.
Читайте также:

