Препарат для лечения пиелонефрита вызванного кишечной палочкой
Обновлено: 24.04.2024
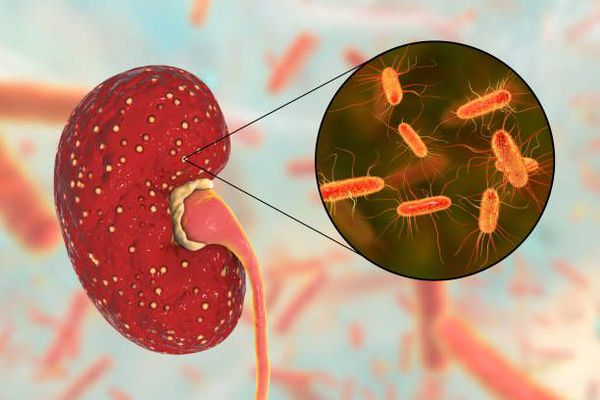
В настоящее время установлено, что при наличии предрасполагающих факторов развитие пиелонефритa у детей обусловлено кишечной палочкой, клебсиеллой, синегнойной палочкой, протеем, цитробактером и другими микробами. Значительно реже он вызывается стафилококком и стрептококком [4]. Исследования микробного пейзажа мочи у 106 детей в возрасте от одного месяца до 14 лет с острым пиелонефритом показывают, что Е.соli высевается у 86,6% больных, Proteus spp. - у 8%, Klebsiella pneumomae - менее чем у 2% пациентов [13]. Грамположительные кокки выявляются только у 3,6% больных острым пиелонефритом. При хроническом обструктивном пиелонефрите значительно чаще, чем при остром пиелонефрите встречаются Klebsiella pneumomae (у 18,7% больных), Str.faecalis (у 12,5% пациентов), Pseudomonas aeruginosa (у 6,2%) [12].
По материалам бактериологической лаборатории Тушинской детской больницы (зав. лабораторией М.В. Калинина) за 1995-1997 годы у больных с инфекцией мочевой системы в 88,4 % случаев высевалась грамотрицательная флора, и лишь в 11,4% случаев грамположительные бактерии. Наиболее часто встречалась кишечная палочка (39,3%). Высока частота выделения из мочи клебсиеллы (21,9%) и синегнойной палочки (10,3%) у "госпитальных" больных. Следует отметить, что нередко встречались микробные ассоциации (E.coli+Str.faecalis; E.coli+Staph.saprophyticus; Str.faecalis+Ent.cloacae; Str.faecalis+Staph.epidermitidis) и только в 40,8% случаев определялась монокультура. Положительные результаты бактериологического исследования мочи при пиелонефрите удается получить не всегда. В последние годы наметилась тенденция к снижению процента "высеваемости" микроорганизмов из мочи. Выявить "виновный" микроорганизм при посеве мочи удается у 42,0-75,7% больных пиелонефритом [5, 8, 11].
Быстрое развитие устойчивости микробной флоры к антибактериальным препаратам, изменение спектра микроорганизмов, вызывающих микробно-воспалительный процесс в мочевой системе, продукция многими из них бета-лактамаз, создают трудности при выборе антибактериального препарата и делают традиционную терапию неэффективной [14]. Это приводит к тому, что лечение инфекции мочевой системы становится более сложным и определяет необходимость создания все новых терапевтических средств и внедрения их в педиатрическую практику. Главным фактором, определяющим резистентность бактерий к антибиотикам, является продукция микроорганизмами бета-лактамаз, которые ингибируют активность антибиотиков.
При заболеваниях мочевой системы у детей вопрос о назначении антибиотика, его дозы определяется микрофлорой мочи, спектром действия антибиотика, чувствительностью к нему флоры, характером почечной патологии, функциональным состоянием почек. Известно, что многие антибактериальные препараты лучше действуют при определенных значениях рН мочи, что необходимо учитывать в процессе терапии.
В тяжелых случаях может применяться комбинированная антибактериальная терапия. При этом следует учитывать, что комбинировать необходимо антибактериальные препараты с синергическим действием.
Эффективность антибактериальной терапии зависит от:
- этиотропности воздействия;
- дозы препарата (оптимальная по способу введения, с учетом фармакокинетики препарата и течения заболевания; концентрация антибиотика в крови должна превышать минимальную подавляющую концентрацию для возбудителя минимум в 4 раза);
- своевременности терапии и рациональной продолжительности курсового лечения;
- применения комбинаций антибиотиков с целью расширения спектра действия и усиления антибактериального эффекта.
Рост устойчивости микрофлоры может быть связан с:
- нерациональной и необоснованной антибиотикотерапией с использованием двух и более антибиотиков;
- неправильным подбором дозы препарата и недостаточной длительностью терапии;
- длительным пребыванием пациента в условиях стационара;
- частым, бесконтрольным использованием антибактериальных препаратов, особенно в домашних условиях;
- нерациональным сочетанием различных антибиотиков между собой или с химиопрепаратами.
- мутации в обычных генах;
- обмен генетического материла;
- селективное давление внешней среды.
Эмпирическая (стартовая) антибактериальная терапия (в условиях стационара)
У большинства больных с острым течением пиелонефрита до выделения возбудителя "стартовая" антибактериальная терапия назначается эмпирически, то есть основывается на знаниях этиологической характеристики наиболее вероятных возбудителей и их потенциальной чувствительности к данному препарату, поскольку посев мочи и определение чувствительности требуют времени, а начало терапии откладывать недопустимо (табл. 1). При отсутствии клинического и лабораторного (анализ мочи) эффекта через три дня эмпирической терапии проводится ее коррекция со сменой антибиотика.
Таблица 1. Эмпирическая (стартовая) антибактериальная терапия при тяжелой форме
Возможна "ступенчатая терапия"
Цефалоспорины 2 поколения (цефуроксим, цефамандол)
Цефалоспорины 3 поколения (цефотаксим, цефоперазон, цефтазидим, цефтриаксон, цефепим)
Аминогликозиды (гентамицин, нетромицин, амикацин др.)
Цефалоспорины 2 поколения (цефуроксим аксетил, цефаклор)
Цефалоспорины 3 поколения (цефтибутен)
"Ступенчатая терапия" предусматривает использование при максимальной активности воспалительного процесса в течение 3-5 дней парентерального введения препаратов одной группы (внутривенно или внутримышечно) с последующей заменой на пероральный путь. При этом возможно применение препаратов одной группы, например, зинацеф в/в или в/м на зиннат per os; аугментин в/в на аугментин per os. Ступенчатая терапия имеет значительные клинические и экономические преимущества. Подобный метод терапии благоприятно сказывается на психоэмоциональном состоянии ребенка. Кроме того, значительно уменьшаются расходы материалов и нагрузка на медицинских работников. При переходе на пероральный прием препарата ребенок может быть выписан домой для амбулаторного долечивания.
При легком течении пиелонефрита может быть использован только пероральный путь введения антибиотика в виде специальных детских форм (сиропа, суспензии), которые отличаются хорошей всасываемостью из желудочно-кишечного тракта, приятными вкусовыми качествами.
Широкий спектр действия, включая большинство грамположительных и грамотрицательных микроорганизмов, позволяет рекомендовать "защищенные" пенициллины в качестве эмпирической терапии до получения результатов бактериологического исследования мочи.
Особенностью этих препаратов является и низкая токсичность. Возможны диспептические явления (рвота, диарея) при пероральном приеме препаратов этой группы за счет изменения кишечной микрофлоры и моторики желудочно-кишечного тракта. Этих симптомов можно избежать при приеме препаратов во время еды.
Таблица 2. Эмпирическая (стартовая) антибактериальная терапия при средне-тяжелой форме
Парентеральный или пероральный (у детей старшего возраста) путь введения антибиотика
Цефалоспорины 2 поколения (цефуроксим, цефамандол)
Цефалоспорины 3 поколения
Пероральноe применение препаратов
Цефалоспорины 2 поколения (цефуроксим аксетил, цефаклор)
Наиболее часто из препаратов этой группы используется амоксициллин с клавулановой кислотой (аугментин). Рядом клинических испытаний установлено, что аугментин эффективен при лечении 88% больных с инфекциями мочевой системы, в то время как при лечении амоксициллином положительные результаты достигнуты лишь у 40% больных. Достоинством аугментина является, помимо устойчивости к микробным бета-лактамазам, его малая токсичность.
Комбинированная антибактериальная терапия при пиелонефрите у детей используется по следующим показаниям:
- тяжелое септическое течение с целью повышения синергизма действия антибактериальных препаратов;
- тяжелое течение инфекции мочевой системы, обусловленное микробными ассоциациями;
- для преодоления полирезистентности микроорганизмов к антибиотикам (особенно при терапии "проблемных" инфекций, вызванных протеем, синегнойной палочкой, клебсиеллой и др.);
- для воздействия на внутриклеточно расположенные микроорганизмы (хламидии, микоплазмы, уреаплазмы).
Таблица 3. Этиотропная терапия пиелонефрита (после получения результатов бактериологического исследования мочи)
Цефалоспорины 2-3 поколения
Препараты налидиксовой кислоты
Препараты пипемидиновой кислоты
Цефалоспорины 2 поколения
Пероральные цефалоспорины 3 поколения
Препараты пипемидиновой кислоты
Препараты налидиксовой кислоты
Цефалоспорины 2 поколения
Пероральные цефалоспорины 3 поколения
Препараты пипемидиновой кислоты
Препараты налидиксовой кислоты
Цефалоспорины 3-4 поколения
Цефалоспорины 3 поколения (цефтазидим, цефтриаксон)
Препараты пипемидиновой кислоты
Аминогликозиды (амикацин, нетромицин)
Цефалоспорины 1-2 поколения
Цефалоспорины 1-2 поколения
Макролиды парентерально (клацид)
Макролиды парентерально (клацид)
Макролиды парентерально (клацид)
** Рифампицин назначается в исключительных случаях, ввиду того, что он нефротоксичен и относится к противотуберкулезным препаратам резерва с быстрым развитием резистентности микобактерий туберкулеза.
*** Тетрациклины используются у детей старше 8 лет.
Антибактериальная терапия пиелонефрита в амбулаторных условиях
В ряде случаев при обострении хронического пиелонефрита лечение ребенка может осуществляться амбулаторно с организацией "стационара на дому".
В поликлинике под наблюдением нефролога и участкового педиатра после курса непрерывной антибактериальной терапии проводится противорецидивное лечение в течение 4-6 недель в зависимости от характера пиелонефрита (обструктивный, необструктивный).
Рекомендуются следующие варианты противорецидивной терапии:
Парентеральный или пероральный путь введения антибиотика
"Защищенные" пенициллины (аугментин, амоксиклав, уназин)
Цефалоспорины 2 поколения (цефуроксим, цефамандол)
Цефалоспорины 3 поколения
Пероральное применение препаратов
"Защищенные" пенициллины (аугментин, амоксиклав, уназин)
Цефалоспорины 2 поколения (цефуроксим аксетил, цефаклор)
Детям раннего возраста принято рассчитывать препараты на кг массы. Им назначаются относительно более высокие дозы. Рассчитывая дозу антибиотика, следует учитывать, что дети раннего возраста имеют более низкий клиренс, эффективный почечный кровоток, "незрелый" тубулярный отдел нефрона; сниженную активность ряда ферментных систем печени, что может приводить к замедлению выведения некоторых лекарственных веществ и кумуляции в организме. У больных с незначительным снижением клубочковой фильтрации дозы природных и полусинтетических пенициллинов, цефуроксима, цефотаксима, цефокситина могут не подвергаться корректировке. При снижении клубочковой фильтрации > 50% по пробе Реберга дозы этих препаратов должны быть уменьшены на 25-75%. С особой осторожностью необходимо подходить к назначению аминогликозидов при нарушении функции почек, они могут быть использованы только в крайних случаях, с мониторингом концентрации вводимого препарата в крови и индивидуальным подбором дозы с учетом снижения клубочковой фильтрации. У больных с хронической почечной недостаточностью, находящихся на гемодиализе, часть антибиотика выводится и требуется его дополнительное введение. От 25 до 50 % пенициллинов, цефаклора, более 50 % сульфаниламидов, аминогликозидов, имипенема, большинство цефалоспоринов удаляется при гемодиализе. Практически не выводятся при гемодиализе макролиды, оксациллин, цефоперазон, цефиксим, цефотетан, амфотерицин В и хинолоны. При перитонеальном диализе не происходит "вымывания" большинства препаратов, за исключением аминогликозидов, цефуроксима (на 15-25%) [9].
Почки могут повреждаться при антибактериальной терапии, так как они являются органом выведения антибиотиков и их метаболитов. В связи с этим, все антибактериальные препараты можно разделить на три основные группы:
- Практически не обладающие нефротоксичностью (выделяются через желудочно-кишечный тракт)
- эритромицин
- бензилпенициллин;
- полусинтетические пенициллины;
- "защищенные" пенициллины;
- цефалоспорины 2 и 3 поколения
- аминогликозиды;
- цефалоспорины 1 поколения;
- карбапенемы;
- монобактамы
Таким образом, основной задачей при лечении детей, больных пиелонефритом, является ликвидация или уменьшение микробно-воспалительного процесса в почечной ткани и мочевыводящих путях [4]. Низкая эффективность антибактериальной терапии при лечении пиелонефрита обусловлена в ряде случаев наличием аномалий развития, нарушениями уродинамики, а также постоянно изменяющимися свойствами бактериальной флоры. Это и определяет необходимость постоянного поиска новых антибактериальных препаратов, высоко эффективных при лечении прежде всего грамотрицательных инфекций. В настоящее время фармацевтический рынок располагает большим количеством антибактериальных средств, позволяющим выбрать оптимальный из них. Несмотря на то, что антибиотики являются высокоэффективными препаратами, способными при рациональном их использовании спасти ребенку жизнь, терапия ими всегда является компромиссом между желаемым действием препарата и оценкой возможных побочных эффектов.
Для достижения хорошего эффекта при проведении антибактериальной терапии необходимо учитывать следующие рекомендации:
- как можно раньше провести идентификацию возбудителя и подобрать антибиотик с учетом чувствительности к нему микробной флоры;
- выбрать антибиотик для конкретного больного с учетом сопутствующей патологии;
- использовать оптимальные дозы и пути введения антибиотика;
- чаще использовать "ступенчатую" терапию, учитывая ее преимущества;
- в тяжелых случаях использовать комбинированную терапию;
- учитывать особенности взаимодействия антибиотиков с другими препаратами и пищевыми продуктами;
- при тяжелом течении инфекции мочевой системы предпочтительнее внутривенное струйное, "болюсное" введение, обеспечивающее "пиковую" концентрацию препарата в крови.
Литература
1. А.А. Баранов. Страна без детей не имеет будущего. Мед. курьер. 1997. N2(3), с. 10-12.
2. Н.В. Белобородова, Е.Н. Падейская, А.В. Бирюков. Дискуссия о ципрофлоксацине и других фторхинолонах в педиатрии. Москва, 1996.
3. И.П. Замотаев. Клиническая фармакология антибиотиков и тактика их применения. Москва, 1978.
4. М.С. Игнатова, Ю.Е. Вельтищев. Детская нефрология. Л., Медицина, 1989, с.306-308.
5. Г.В. Калугина, М.С. Клушанцева, Л.Ф. Шехаб. - Хронический пиелонефрит. М., Медицина, 1993, 240 с.
6. И.В. Маркова, М.В. Неженцев, А.В. Папаян. Лечение заболеваний почек у детей. Санкт-Петербург. 1994, с. 186-192.
7. И.Г. Мултых, Е.А. Молодова. Возбудители клинически значимых бактериурий. Клин. лаб. диагн. 1994, N5, с. 44-45
8. А.В. Терещенко, Д.А. Сеймивский, С.А. Ильин и др. Урол. и нефрол. 1991, N2, с.24-28.
9. В.К. Таточенко. Антибиотикo- и химиотерапия инфекций у детей (Справочник). Москва. 1996.
10. Р. Таушниц. Антибактериальная химиотерапия. Карманный справочник.
11. О.Л. Тиктинский, С.Н. Калинина. Пиелонефриты. СПбМАПО. Медиа пресс. 1996, с.240.
12. П.К. Яцык, Т.Б. Сенцова, P.Т. Габибли. Микробиологические особенности инфекционного процесса у детей с хроническим обструктивным пиелонефритом. Урол. и нефрол. 1988, N4, с. 17-20.
13. Begue P. et al. Proc 27 International Congress оn Antimicrobial Agents and Chemothrapy, Berlin 1991, 301.
14. F.C. Tenover. Глобальная проблема антимикробной резистентности. Русский медицинский журнал. Т.3, N4. 1996. 217-219.Что такое хронический пиелонефрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лычагин А. С., уролога со стажем в 17 лет.
Над статьей доктора Лычагин А. С. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
![Лычагин Андрей Сергеевич, андролог, врач узи, сексолог, уролог - Москва]()
Определение болезни. Причины заболевания
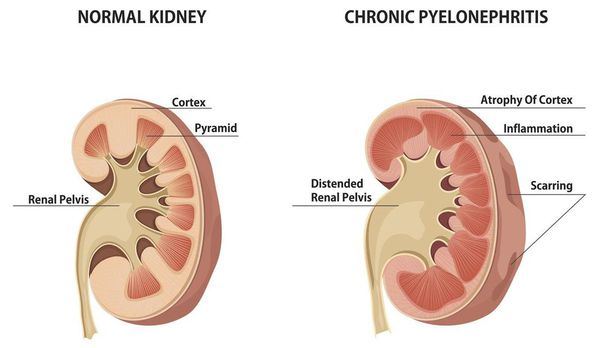
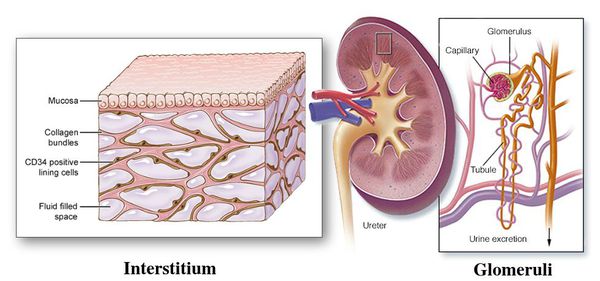
Хронический пиелонефрит — почечная патология, характеризующаяся длительно протекающим воспалительным процессом в почках. Вызывается воспаление разными видами бактерий, процесс затрагивает как чашечно-лоханочные структуры, так и интерстиций (соединительную ткань) почек. [1] [3]
![Хроническое воспаление почек]()
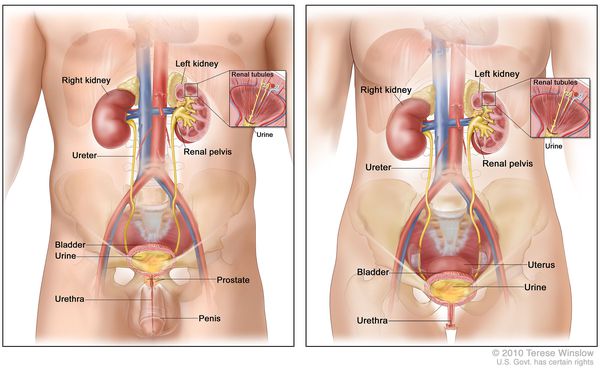
Эпидемиология хронического пиелонефрита такова, что на его долю приходится до 65% всех воспалительных заболеваний мочеполового тракта. Примерно в трети случаев описываемому заболеванию предшествует острый пиелонефрит. Отчетливо отмечено гендерное различие в частоте заболеваемости — преимущественно болеет женский пол (в 3-5 раз чаще). Объясняется этот факт особенностями анатомии женской мочевыделительной системы: короткая уретра, которая облегчает инвазию микроорганизмов в мочевыводящую систему.
![Анатомия женской и мужской мочевыделительной системы]()
Средняя заболеваемость составляет 18 случаев на 1000 населения. [2] [3]
Ведущий этиологический фактор, провоцирующий развитие хронического пиелонефрита — бактериальная флора. Хронический пиелонефрит вызывается как одним видом микроорганизмов, так и микробными ассоциациями, когда при бактериологическом исследовании выделяется сразу несколько видов микроорганизмов. [4] [7] Среди возбудителей выделяют:
- Escherichia coli (высевается у 75-95% пациентов);
- Staphylococcus saprophyticus (определяется в 5-10% случаев);
- Klebsiella pneumoniae
- прочие энтеробактерии (род Enterobacteriaceae);
- Proteus mirabilis;
- грибки;
- стафилококки;
- синегнойная палочка.
![Proteus mirabilis]()
Особую роль в патогенезе хронического пиелонефрита играют так называемые L-формы возбудителей. Они отличаются высокой резистентностью к химиопрепаратам и возникают под действием нерациональной антибиотикотерапии. Именно их активизация в определённых условиях вызывает очередное обострение пиелонефрита. [4] [7]
Хронизации процесса в большинстве случаев предшествует острая атака пиелонефрита. Этому способствуют разнообразные факторы (большинство из них вызывают значимые нарушения уродинамики):
-
;
- переохлаждение; (опущение почки); ;
- стриктуры мочеточников;
- уретрит;
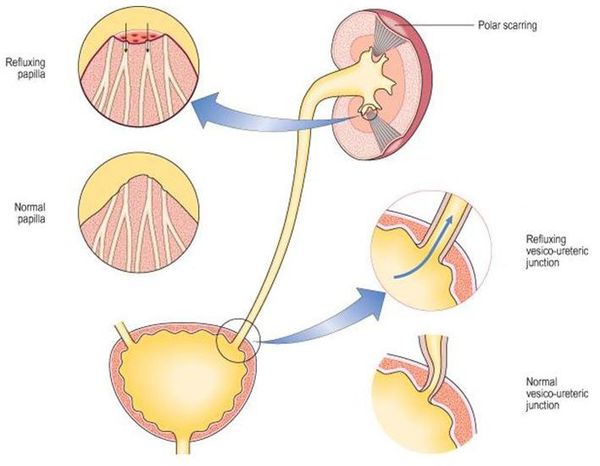
- пузырно-мочеточниковый рефлюкс (обратный заброс мочи из пузыря в мочеточники).
Вялотекущий воспалительный процесс любой другой локализации (тонзиллит, отит, абсцесс, стоматит, гастроэнтерит) способен длительное время поддерживать и провоцировать обострение хронического пиелонефрита. Хронические интоксикации (алкогольная, наркотическая и другие), иммунодефициты, соматические заболевания (сахарный диабет, метаболический синдром) также способствуют формированию хронического пиелонефрита.
У девушек в качестве провоцирующего фактора нередко выступает половая жизнь, а у женщин — беременность и роды.
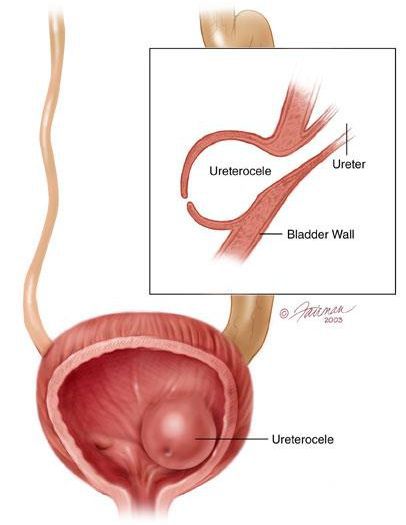
В детском возрасте развитие данной патологии связано с аномалиями развития мочеполовой системы, например, с уретероцеле.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы хронического пиелонефрита
Клинические проявления пиелонефрита зависят от активности воспалительного процесса.
Для латентной фазы характерна скудная симптоматика. Больных беспокоит незначительное повышение температуры, отмечается повышенная утомляемость, периодические головные боли. Патологические проявления со стороны почек и других органов отсутствуют либо выражены в минимальной форме. Часть пациентов жалуются на полиурию и повышение артериального давления. В анализе мочи выявляется незначительная протеинурия, бактериурия, периодически появляются лейкоциты. [1] [3] [7]
Фаза активного воспаления проявляется следующими симптомами:
- чувство тяжести и боли в пояснице (в области почек) ноющего характера;
- дизурические явления в виде учащённого мочеиспускания;
- анемический синдром;
- стойкая гипертония;
- в анализе мочи определяется большое количество белка, лейкоцитов и бактерий, в тяжёлых случаях возникает гематурия (попадание крови в мочу).
При выраженном повышении артериального давления говорят о гипертоническом варианте хронического пиелонефрита, при этом гипертония носит злокачественный характер и с трудом поддаётся коррекции.
Хроническое поражение почек зачастую сопровождается гипохромной анемией. Это свидетельствует о развитии анемического варианта патологии.
В стадии стойкой ремиссии какие-либо значимые симптомы отсутствуют.
Для более наглядного восприятия симптомы разных фаз хронического пиелонефрита отображены в табличном виде. [4]
Что такое пиелонефрит острый? Причины возникновения, диагностику и методы лечения разберем в статье доктора Закуцкий А. Н., уролога со стажем в 16 лет.
Над статьей доктора Закуцкий А. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
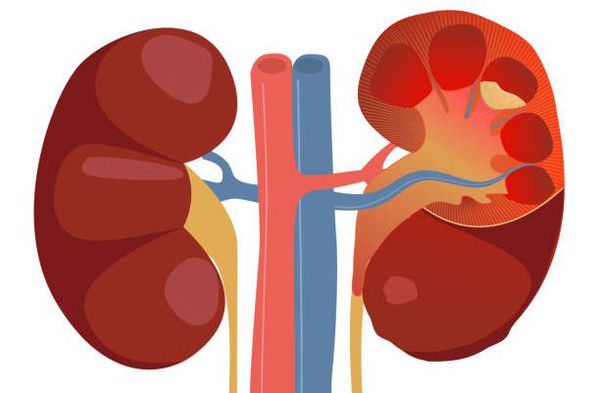
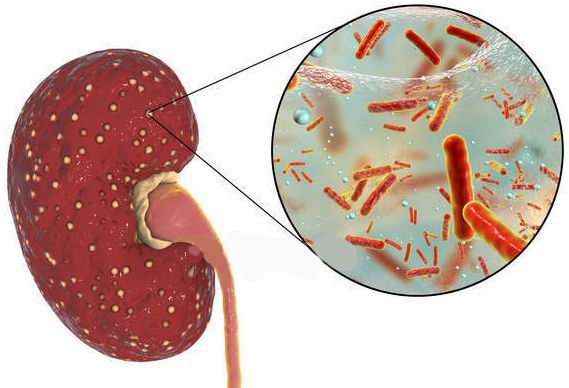
Причина пиелонефрита — бактериальная инфекция. Среди возбудителей заболевания лидирует кишечная палочка (Escherichia coli). Реже встречаются другие микробы, такие как протей, энтерококк, синегнойная палочка и стафилококк. [4]
Острый пиелонефрит может возникнуть в любом возрасте и у любого пола. Чаще всего заболевание возникает у женщин активного репродуктивного возраста, что объясняется особенностями строения женской мочеполовой системы. Однако нередко пиелонефрит выявляют у детей и половозрелых мужчин, поэтому возраст и пол заболевавшего не могут быть использованы в качестве дифференциального признака данного заболевания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острого пиелонефрита
Для острого пиелонефрита типично сочетание высокой температуры с болями в области воспалённой почки. Если почка располагается на своём месте, то боль беспокоит в проекции рёберно-позвоночного угла. При опущении почки боль возникает по фланкам живота. Пиелонефрит может затрагивать как одну почку, так и обе почки, соответственно боль может беспокоить как с одной стороны, так и с обеих сторон одновременно.
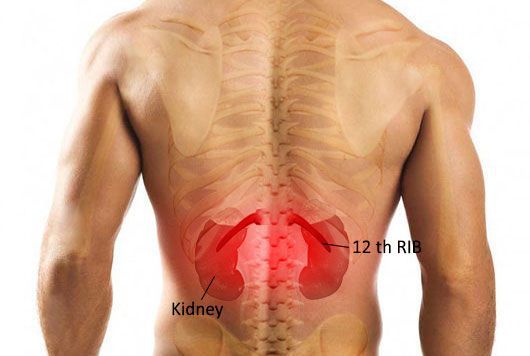
Выраженность боли может быть различной — от умеренной до интенсивной. Как правило, боль носит постоянный характер и не зависит от положения тела или движений. Иными словами, невозможно найти такое положение в кровати, когда боль будет беспокоить меньше или пройдет совсем. Также верно и то, что движения туловищем в виде сгибания, разгибания или поворотов не приводят к обострению болей.
В отдельных случаях боль носит приступообразный характер. Это характерно для пиелонефритов, которые возникают на фоне закупорки мочевых путей камнем. Если при классической почечной колике боль между приступами отступает совсем, то при сопутствующем пиелонефрите болевой синдром сохраняется и между приступами.
Развитие острого пиелонефрита может сопровождаться изменения со стороны мочеиспускания, хотя это не является обязательным условием. Можно отметить появление мути в моче и неприятного запаха. Кроме того, воспалённая моча потенциально способна спровоцировать учащённое мочеиспускание. В целом мочевые симптомы выходят на первый план только в том случае, если острый пиелонефрит осложняет уже имеющееся воспаление мочевого пузыря. [1] [4]
Патогенез острого пиелонефрита
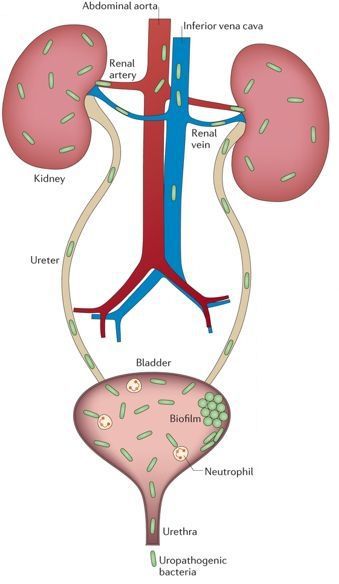
Уриногенный путь передачи особенно характерен для детей из-за широкого распространения пузырно-мочеточникового рефлюкса. Так называют заброс мочи из мочевого пузыря обратно в почку. Несмотря на широкое распространение рефлюкса именно в детском возрасте, многие взрослые страдают аналогичным заболеванием. Особенно часто рефлюкс, то есть обратный заброс мочи, наблюдается при переполнении мочевого пузыря. Поэтому очень важно своевременно опорожнять мочевой пузырь. [8]
Классификация и стадии развития острого пиелонефрита
Традиционно острый пиелонефрит подразделяют на серозный и гнойный, хотя гнойный пиелонефрит является скорее осложнением острого пиелонефрита.
Существует несколько форм гнойного пиелонефрита:
- апостематозный пиелонефрит;
- абсцесс почки;
- карбункул почки;
- некротический папиллит;
- эмфизематозный пиелонефрит.
Если гнойников много, и они небольшие по размеру, то говорят об апостематозном пиелонефрите. В том случае, если гнойник большой и одиночный, то мы имеем дело с абсцессом почки.
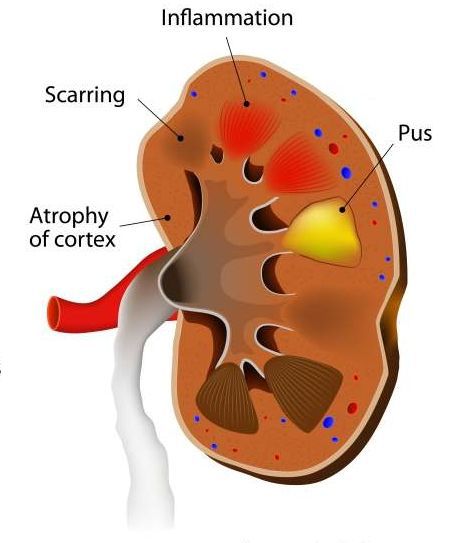
Почечный абсцесс нужно дифференцировать с карбункулом почки. Карбункул — это часть почечной паренхимы, погибшая вследствие закупорки крупного почечного сосуда микробным эмболом. Рано или поздно погибшие от эмболии ткани подвергаются гнойному расплавлению, что приводит к абсцедированию карбункула.
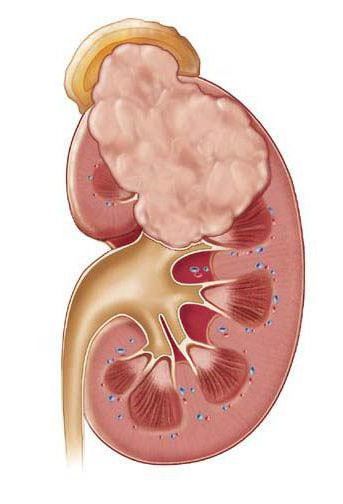
Особой формой острого пиелонефрита является некротический папиллит — это грозное и смертельно опасное заболевание. К счастью, эта болезнь встречается настолько редко, что даже опытные урологи со стажем работы в несколько десятков лет могут вспомнить лишь несколько случаев данной формы острого пиелонефрита. При некротической папиллите происходит некроз, то есть омертвление и гибель почечного сосочка. Это сопровождается почечной недостаточностью и появлением крови в моче. Причина некротического папиллита сходна с причиной карбункула: закупорка почечного сосуда микробным эмболом. Только при папиллите страдает сосуд, питающий почечный сосочек. [4]
Осложнения острого пиелонефрита
Местные осложнения острого пиелонефрита включают апостематоз, абсцесс почки, эмфизематозный пиелонефрит, а также тромбоз почечных сосудов либо в виде карбункула почки, либо в виде некротизирующего папиллита. [10]
Эмфизематозный пиелонефрит является исключительно редким заболеванием и отличается от прочих гнойных осложнений пиелонефрита появлением пузырьков газа. Воздушные скопления могут быть в почечной паренхиме, полостной системе почек или даже в паранефральной клетчатке. К счастью, эмфизематозный пиелонефрит встречаются существенно реже других гнойных осложнений почки. [7]
Среди системных осложнений нужно отметить острую почечную недостаточность и синдром системной воспалительной реакции (сепсис). Именно поэтому часть пациентов нуждается в госпитализации в урологические стационары. В условиях стационара проводится регулярный контроль анализов и УЗИ для своевременного выявления осложнений острого пиелонефрита. [4]
Некоторые осложнения пиелонефрита в большей степени ассоциированы с хронической формой этого заболевания, но так как острый пиелонефрит может перейти в хронический, то нельзя не упомянуть о таком важном осложнении как мочекаменная болезнь. В некоторых ситуациях воспаление почечной паренхимы вызывают уреаза-продуцирующие микробы. Уреаза — это фермент, который позволяет бактериям расщеплять мочевину из мочи. После срабатывания фермента мочевина расщепляется до углекислоты и аммиака. Именно эти два компонента запускают сложный биохимический каскад, который приводит к образованию инфекционных камней: струвита и гидроксиапатита. К счастью, самый частый возбудитель пиелонефрита — кишечная палочка — не умеет производить уреазу, этой способностью обладают другие более редкие возбудители пиелонефрита — протей, клебсиелла и синегнойная палочка.
Диагностика острого пиелонефрита
Минимальный объём обследований:
- общий анализ мочи;
- посев мочи на флору с определением чувствительности к антибиотикам;
- клинический анализ крови;
- анализ крови на креатинин;
- УЗИ почек и мочевого пузыря.
Общий анализ мочи
Типичным для пиелонефрита является повышение уровня лейкоцитов и обнаружение бактерий. Могут быть и другие неспецифичные для данного заболевания изменения, включая повышенный уровень белка или положительный тест на нитриты. Обнаружение большого количества эритроцитов требует проведения дифференциальной диагностики с мочекаменной болезнью и гломерулонефритом.
Посев мочи на флору и чувствительность к антибиотикам
Этот анализ имеет смысл сдавать до назначения антибиотиков. Посев мочи позволяет выявить возбудитель пиелонефрита и определить наиболее эффективные антибактериальные препараты.
Клинический анализ крови
Неспецифическим признаком пиелонефрита является повышенный уровень лейкоцитов со сдвигом лейкоцитарной формулы влево. Как правило, больной с острым пиелонефритом повторяет клинический анализ крови два или три раза во время лечения. Данный анализ позволяет оценить эффективность антибактериальной терапии и своевременно сигнализировать о развитии гнойных осложнений в воспаленной почке.
Анализ крови на креатинин
Этот анализ является обязательным для всех пациентов с пиелонефритом прежде всего потому, что в ряде случаев острый пиелонефрит может осложниться развитием острой почечной недостаточности. Кроме того, анализ крови на креатинин необходим для решения вопроса о рентгенологическом исследовании почек с применением контраста.
УЗИ почек и мочевого пузыря
Ультразвуковое исследование позволяет исключить обструктивный пиелонефрит, связанный с нарушением оттока мочи из почки. Кроме того, УЗИ почек необходимо для своевременного выявления апостематоза, абсцесса и карбункула в паренхиме почки. Все вышеперечисленные термины используются для описания осложнений острого пиелонефрита.
Важнейшим преимуществом ультразвукового исследования является возможность повторения этого исследования в динамике без нанесения какого-либо вреда или даже дискомфорта организму. Важно помнить, что нормальные результаты УЗИ не исключают наличие острого пиелонефрита.
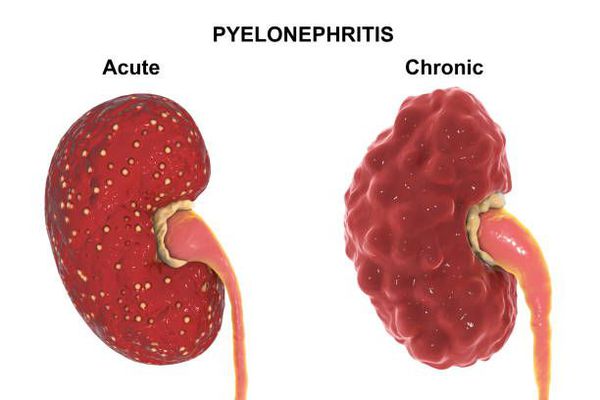
Рентгеновское обследование почек: внутривенная урография или компьютерная томография почек с внутривенным контрастированием.
Рентгеновское обследование почек является самым точным и достоверным методом диагностики. Традиционный рентген в виде внутривенной урографии подразумевает обязательное внутривенное введение йодсодержащего контраста. Это не всегда возможно из-за сопутствующих причин: аллергия на йод, приём гормонов щитовидной железы и повышенный уровень креатинина в крови. По сути, в настоящее время внутривенная урография необходима только для установления степени нефроптоза при опущении почек.
Значительно более широко применяется КТ почек (компьютерная томография). КТ относится к рентгеновским методам исследования, однако его информативность значительно выше, чем у обычного рентгена. Вопрос о введении йодсодержащего внутривенного контраста решается лечащим урологом индивидуально с каждым пациентом. [2] [4]
Лечение острого пиелонефрита
Стационарное лечение обычно требуется для беременных, детей, пожилых людей, пациентов с ослабленным иммунитетом, плохо контролируемым диабетом, после трансплантации почек и, конечно же, всех людей с обструкцией мочевых путей. Также желательно госпитализировать людей с острым пиелонефритом единственной существующей или единственно функционирующей почки. Здоровые, молодые, небеременные женщины, которые болеют неосложнённым пиелонефритом, могут лечиться амбулаторно.
Обычно острый пиелонефрит требует исключительно медикаментозного лечения. Показания к хирургическому лечению возникают крайне редко.
Первоначальный выбор антибиотика при остром пиелонефрите является эмпирическим. Через 4-7 дней антибактериальная терапия может быть скорректирована по результатам посева мочи. Эмпирический выбор антибиотика остаётся на усмотрение лечащего врача.
В национальных рекомендациях в качестве средства выбора при остром пиелонефрите указаны фторхинолоны второго и третьего поколения. [4] Тоже самое сказано и в рекомендациях Европейской ассоциации урологов. Между тем, ещё в 2016 году FDA (Управление по контролю качества пищевых продуктов и лекарственных препаратов) рекомендовала отказаться от использования данных антибиотиков из-за большого количества осложнений в отношении связок, суставов и периферических нервов. [6] Поэтому в качестве первой линии терапии рекомендуют использовать цефалоспорины третьего поколения.
Часто можно встретить комбинацию из двух антибиотиков для лечения острого пиелонефрита. Как правило, комбинируют цефалоспорины с фторхинолонами или аминогликозидами. Аминогликозиды в виде амикацина обладают явным нефротоксическим действием, поэтому их использование для эмпирической терапии оправдано только в тяжёлых случаях. В целом выбор антибиотика — на усмотрение лечащего врача. [9]
Показания к оперативному лечению возникают при гнойной форме воспаления и остром вторичном пиелонефрите. При вторичном пиелонефрите главная цель хирургического вмешательства состоит в дренировании мочи. Это можно сделать как путём установки почечного стента, так и благодаря чрезкожной пункционной нефростомии.
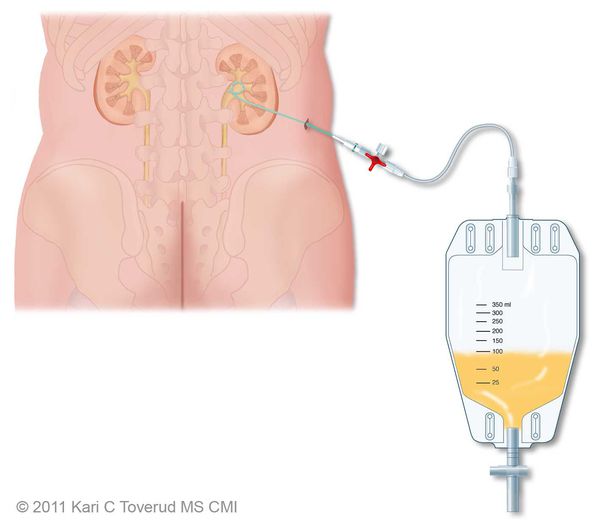
Гнойная форма острого пиелонефрита требует ревизии и декапсуляции почки, вскрытия гнойных очагов или даже нефрэктомии при гнойном разрушении большей части почки. [4]
Прогноз. Профилактика
Прогноз при пиелонефрите благоприятный. Большинство острых пиелонефритов успешно лечатся амбулаторно, и лишь небольшая доля случаев требует госпитализации. Тем не менее сохраняется определённый процент летальный исходов. Причиной неблагоприятного течения заболевания являются возраст старше 65 лет, присоединение острой почечной недостаточности, несвоевременно выявленные гнойные осложнения, требующие хирургического вмешательства, и тяжёлые сопутствующие заболевания наподобие декомпенсированного сахарного диабета. [5]
Составление плана индивидуальной профилактики начинается с изучения истории конкретного заболевания. В частности, необходимо ответить на вопрос, каким образом бактерии попали в почку: с кровью или с мочой? При гематогенном пути заражения необходимо санировать имеющиеся в организме очаги хронической инфекции, исключить переохлаждение и проводить профилактику сезонных простудных заболеваний. При уриногенном пути заражения необходимо заняться профилактикой воспалительных заболеваний мочевого пузыря.
В случае вторичной формы острого пиелонефрита целесообразно восстановить нормальный отток мочи из поражённой почки.
Вне зависимости от пути попадания микробов в почку всем пациентам рекомендуется потреблять достаточное количество жидкости и разнообразные урологические сборы растительного происхождения. [4]
Для цитирования: Могутов А.В. Особенности антибактериальной терапии пиелонефритов. РМЖ. 2003;24:1336.
Главный военный клинический госпиталь им. Н.Н. Бурденко, Москва
П иелонефрит – неспецифическое инфекционно–воспалительное заболевание почек, при котором в процесс вовлекаются почечная лоханка, чашечки и паренхима почки с поражением в первую очередь и в основном ее межуточной ткани. В конечной стадии заболевания в процесс вовлекаются кровеносные сосуды и клубочки. В итоге развивается так называемый бактериальный вариант интерстициального нефрита (Руководство по урологии под ред. Лопаткина Н. А., т.2 1998 г).
Существует много разнообразных классификаций пиелонефрита. Различают первичный и вторичный пиелонефрит. Вторичный пиелонефрит встречается в 5 раз чаще первичного. В его основе лежат органические или функциональные изменения в почках и мочевых путях. Пиелонефрит делят на острый и хронический, одно– или двусторонний и т.д.
Рис. 1. Классификация пиелонефрита
В приведенной ниже классификации, разработанной в урологической клинике Российского государственного медицинского университета им. Н.И. Пирогова, наиболее полно отражены стадии и формы инфекционно–воспалительного процесса в почке.
Пиелонефрит – заболевание бактериальной природы, однако специфического возбудителя не существует. Пиелонефрит вызывают различные микроорганизмы – бактерии, микоплазмы, вирусы, грибы.
Наиболее частым этиологическим фактором являются грамположительные и грамотрицательные условно патогенные бактерии, многие из которых принадлежат нормальной микрофлоре человека. Пиелонефрит вызывают кишечная палочка, протей, энтеробактер, клебсиелла, синегнойная палочка, стафилококки (золотистый, эпидермальный), энтерококки и др. Вид и характер бактериальной флоры имеют большое значение в возникновении пиелонефрита. Так, например, белый и золотистый плазмокоагулирующие стафилококки способны вызвать гнойно–воспалительный процесс в неизмененной почке, в то время как другие микроорганизмы, как правило, вызывают пиелонефрит при наличии предрасполагающих факторов. К ним относятся: бактериурия; рефлюксы на различных уровнях; инструментальное обследование мочевых путей; обструкция мочевых путей; заболевания простаты и парауретральных желез; возраст больных (особенно пожилой и старческий); беременность; сахарный диабет; гипертоническая болезнь с ангионефросклерозом; предшествующие болезни почек (интерстициальные нефриты различного генеза, врожденная патология и др.); подагра; миеломная болезнь; воздействие лекарств.
Необходимо отметить, что в настоящее время редко определяется один вид микроорганизмов, вызывающих пиелонефрит. Необходимо также помнить о роли протопластов и L–форм микроорганизмов. Установлена возможность развития L–форм практически у всех видов микроорганизмов, участвующих в развитии пиелонефрита. L–формы более устойчивы к внешним воздействиям, не растут на обычных питательных средах, поэтому их очень трудно идентифицировать.
Пиелонефрит, вызванный протопластными формами микроорганизмов, хуже поддается лечению, способствуя переходу острого пиелонефрита в хронический.
В последние годы особенно возросла роль госпитальных штаммов микроорганизмов в качестве возбудителей пиелонефрита.
При пиелонефрите, как при любом инфекционно–воспалительном заболевании, основными патогенетическими звеньями являются проникновение бактерий в пораженный орган и состояние противоинфекционной защиты макроорганизма.
Основные пути проникновения инфекции в почку – гематогенный и уриногенный. Гематогенный путь возможен на фоне острых заболеваний бактериальной природы как вне мочевых путей (тонзиллит, фурункулез, кариозные зубы, инфицированная рана и др.), так и в них (уретрит, цистит), в половых органах (эпидидимит, простатит, сальпингооворит и др.). Однако для возникновения пиелонефрита, кроме бактериурии, необходимо наличие предрасполагающих факторов, наиболее существенными из которых являются нарушения оттока мочи, крово– и лимфообращения. Основными причинами нарушения оттока мочи являются врожденное или приобретенное сужение мочеточника, нефроптоз, камни, опухоли; сдавление мочеточников снаружи опухолью, воспалительными инфильтратами или функциональными нарушениями при повреждении позвоночника.
Уриногенный (восходящий) путь имеет место при инфицировании нижних отделов мочевыделительного тракта или за счет активации сапрофитной флоры, обычно находящейся в дистальном отделе уретры.
Наряду с местными факторами в патогенезе пиелонефрита большое значение имеют и общие: снижение сопротивляемости организма к инфекции в результате гипо– и авитаминоза, переутомления, эндокринных, простудных заболеваний и т.д.
При любом пути проникновения инфекции микробы обычно задерживаются в венозных капиллярах почки, откуда распространяются на межуточную ее ткань, вызывая в ней развитие гнойно–воспалительного процесса.
Важным звеном патогенеза хронического пиелонефрита могут быть процессы, вызывающие повышение внутрилоханочного давления, что осложняется лоханочно–почечными рефлюксами с флебо– и лимфостазом в паренхиме почки. Кроме того, воспалительно–склеротические изменения клетчатки почечного синуса (педункулит), предшествуя пиелонефриту или осложняя его течение, могут привести к расстройству венозного и лимфатического оттока через магистральные сосуды почек. Флебостаз и лимфостаз, связанный с ними отек интерстиция способствуют фиксации в паренхиме патогенных микроорганизмов, а гипоксия паренхимы – их выживанию.
Раньше всего поражается мозговой слой почки. Это связывают с менее интенсивным его кровоснабжением по сравнению с кровоснабжением коркового слоя и высокой осмолярностью, способствующей выживанию в нем L–форм бактерий, а также с большим содержанием аммония, подавляющего один из компонентов комплемента, что может задерживать фагоцитоз и снижать бактерицидное действие антител. Важное значение придают также ранимости тонкостенных венозных сплетений, расположенных близко к эпителию чашечек, благодаря чему при резком повышении внутрилоханочного давления инфицированная моча поступает в интерстиций и венозную сеть, а возникающие отек и нарушение венозного и лимфатического оттока способствуют фиксации микрофлоры в мозговом слое.
Клиническая картина
Примерно в 80% случаев начало острого пиелонефрита характеризуется резким и значительным повышением температуры тела (до 39–40°C, иногда и выше), потрясающими ознобами, потами, артралгиями, быстрым нарастанием симптомов общей интоксикации – слабости, вялости, разбитости, тошноты, рвоты и т.д. Лихорадка обычно ремиттирующего характера, иногда – постоянная, может сопровождаться высыпаниями простого герпеса.
Типичным проявлением заболевания являются боли в области поясницы, иногда тупые, иногда достигающие значительной интенсивности. Весьма часто, как следствие и одновременно текущего цистита, появляются дискомфорт при мочеиспускании, поллакиурия или дизурия.
Начальной стадией заболевания является интерстициальный серозный нефрит, который не сопровождается деструкцией почечной ткани. Более поздняя – стадия гнойного воспаления, характеризующаяся разрушением почечной ткани в очаге воспаления. В зависимости от характера изменений в почечной паренхиме при остром пиелонефрите развивается апостематозный пиелонефрит, карбункул или абсцесс почки. Симптоматика острого пиелонефрита во многом зависит от наличия и степени нарушения пассажа мочи.
Клиническая картина хронического пиелонефрита имеет тенденцию к волнообразному течению: периоды обострения чередуются с периодами ремиссии. Клиника хронического пиелонефрита во многом зависит от активности проявлений и распространения воспалительного процесса в почке. В стадии активного воспалительного процесса клиническая картина идентична острому пиелонефриту. В стадии ремиссии проявления хронического пиелонефрита неспецифичны: головная боль, слабость, утомляемость, отсутствие аппетита, похудание, тянущие ощущения в реберно–позвоночном углу и т.д.
Для диагностики острого и хронического пиелонефрита большое значение имеют правильный сбор анамнеза, данные объективного осмотра (лихорадка, интоксикационный синдром, боли в пояснице с признаками поражения почки), лабораторные данные. В клиническом анализе крови выявляют лейкоцитоз, увеличение количества нейтрофилов, а через 3–5 дней и позже – увеличение СОЭ. При выраженной гнойной интоксикации – анемия с патологическими изменениями в морфологии эритроцитов (анизоцитоз, пойкилоцитоз и т.д.). Возможна гипергаммаглобулинемия, повышение уровня ЩФ, мочевины, креатинина и остаточного азота.
В общем анализе мочи выявляется лейкоцитурия (однако не у всех пациентов), могут быть обнаружены повышенное содержание белка, свежие и выщелоченные эритроциты (вследствие наличия конкремента, некротического папиллита или других причин). Лабораторная диагностика включает также посев мочи с последующей идентификацией возбудителя и определение чувствительности микроорганизмов к антибактериальным препаратам.
С целью уточнения диагноза и выработки терапевтической тактики приходится прибегать к методам дополнительного обследования, наиболее информативными из которых являются хромоцистоскопия, обзорная и экскреторная урография, ультразвуковая диагностика почек, радионуклидные методы. По специальным показаниям применяются абдоминальная аортография, селективная почечная артериография и компьютерная томография.
Лечение пиелонефрита должно быть комплексным, включающим следующие аспекты: устранение причины, вызывающей нарушение пассажа мочи, антибактериальную и симптоматическую терапию.
Несмотря на продолжительный период широкого применения антибактериальные препараты пенициллинового ряда и в настоящее время сохраняют высокую эффективность для лечения инфекции мочевыводящих путей. Группа пенициллинов включает целый ряд препаратов, которые в зависимости от происхождения, химической структуры и антимикробной активности подразделяются на несколько подгрупп. Однако в связи с широким распространением микроорганизмов, продуцирующих b -лактамазы, целесообразно применение представителей группы ингибиторзащищенных пенициллинов (например, амоксициллина/клавуланата, ампициллина/сульбактама и др.).
Цефалоспорины III–го поколения справедливо занимают одну из ключевых позиций в химиотерапии инфекционных заболеваний мочевыводящих путей. Цефалоспорины III–го поколения кардинально отличаются от пенициллинов и цефалоспоринов I–II поколений высокой эффективностью в отношении большинства энтеробактерий, стабильностью к действию b -лактамаз грамотрицательных бактерий. Кроме того, у цефалоспоринов III–го поколения отмечены лучшие фармакокинетические свойства. Поэтому данные препараты применяют при более тяжелом течении воспалительного процесса мочевыводящих путей – при осложненных инфекциях, обострении хронических инфекций мочевыводящих путей.
Цефтриаксон, например, обладает широким спектром антимикробного действия (особенно чувствительны: Proteus mirabilis, Haemophilus influenzae, Neisseria gonorrhoeae, Neisseria meningitidis.
Высокочувствительны: E. coli, Salmonella spp., Shigella spp., Klebsiella spp. (включая К. pneumoniae), Enterobacter spp., индолположительные Proteus spp. (Proteus vulgaris, morganii, rettgeri, inconstans), Streptococcus viridans, Streptococcus pneumoniae. Среди b -лактамов цефтриаксон оказывает самое мощное действие на Strep. pneumoniae.
Частично чувствительны: Pseudomonas aeruginosa, Staphilococcus aureus, Bacteroides fragilis, Clostridia spp. (включая Clostridia perfringens), Chlamydia trachomatis.
Слабочувствительны: Pseudomonas strains (за исключением Ps. aeruginosa), Streptococcus faecalis, Mycoplasma hominis, pathogenic fungi. и т.д.
Применяется как высокоэффективный препарат при лечении нозокомиальных инфекций, вызываемых чувствительными к нему микроорганизмами. Многие штаммы вышеуказанных микроорганизмов, полирезистентные к другим антибиотикам, таким, как аминопенициллины, цефалоспорины первого и второго поколения и аминогликозиды, чувствительны к цефтриаксону. В связи с длительным периодом полувыведения (около 8 часов у взрослых), для достижения терапевтического эффекта достаточно однократного введения этого препарата в сутки.
Однако если лечение нозокомиальной инфекции начинают эмпирически, то следует помнить о возможном участии в развитии инфекционного процесса резистентной к цефалоспоринам III–го поколения микрофлоры (некоторые штаммы синегнойной палочки, метициллинрезистентные стафилококки – MRSA, энтерококки). В связи с этим при проведении инициальной эмпирической терапии тяжелой нозокомиальной инфекции, как правило, предполагается сочетанное назначение цефалоспоринов и аминогликозидов.
Аминогликозиды имеют основное клиническое значение при лечении нозокомиальных инфекций, вызванных аэробными грамотрицательными возбудителями. Для аминогликозидов II (гентамицин) и III (амикацин) поколения характерна дозозависимая бактерицидная активность в отношении грамотрицательных микроорганизмов семейства Enterobacteriaceae (E.coli, Proteus spp., Klebsiella spp., Enterobacter spp., Serratia spp. и др.), а также неферментирующих грамотрицательных палочек (P.aeruginosa, Acinetobacter spp.). При совместном использовании с пенициллинами или цефалоспоринами наблюдается синергизм в отношении некоторых грамотрицательных и грамположительных аэробных микроорганизмов, что позволяет назначать меньшую дозу аминогликозидов и тем самым снижать риск развития побочных эффектов.
Особое место среди антибактериальных препаратов широкого спектра действия занимают фторхинолоны (левофлоксацин, офлоксацин, пефлоксацин, ципрофлоксацин). Они активны в отношении ряда грамположительных аэробных бактерий (Staphylococcus spp.), большинства штаммов грамотрицательных, в том числе Е.coli (включая энтеротоксигенные штаммы), Shigella spp., Salmonella spp., Enterobacter spp., Klebsiella spp., Proteus spp., Serratia spp., Providencia spp., Citrobacter spp., M.morganii, Vibrio spp., Haemophilus spp., Neisseria spp., Pasteurella spp., Pseudomonas spp., Legionella spp., Brucella spp., Listeria spp. Кроме того, одним из несомненных достоинств препаратов этого ряда является редкое развитие побочных эффектов.
Карбапенемы обладают сверхшироким спектром действия: активны в отношении большинства грамположительных, грамотрицательных и анаэробных микроорганизмов. Поэтому данные препараты являются препаратами второго ряда при лечении тяжелых форм воспалительных процессов мочевыводящих путей.
Тетрациклины высокоактивны в отношении большинства грамположительных и грамотрицательных микроорганизмов, а также микроорганизмов с преимущественно внутриклеточной локализацией – хламидий, микоплазм, листерий, уреаплазм и т.д. Несмотря на достаточно высокую активность в отношении представителей рода Enterobacteriaceae, тетрациклины не эффективны в отношении протея и синегнойной палочки.
Макролиды обладают хорошей чувствительностью по отношению грамположительной микрофлоре и атипичным микроорганизмам – микоплазмам, уреаплазмам, хламидиям и т.д. В настоящее время на основе эритромицина созданы новые макролиды – рокситромицин, азитромицин и т.д. У данных препаратов значительно улучшились фармакокинетические показатели: период полувыведения колеблется от 19 до 24 ч (у азитромицина), поэтому возможен двух– или одноразовый прием.
Наряду с антибиотиками используют и другие антибактериальные средства: нитрофураны, налидиксовую кислоту, триметоприм, сульфаметоксазол и др. Несмотря на широкое применение нитрофуранов и нитроксолина, микрофлора мочи больных хроническим пиелонефритом сохраняет чувствительность к ним практически на том же уровне, что и 10 лет назад.
Хорошие перспективы в антибактериальной терапии имеют препараты бактериофагов.
Пиелонефрит по своей частоте превосходит все почечные болезни вместе взятые [1]. Согласно сборной статистике (более чем 100 авторов), в среднем 1% людей на земле ежегодно заболевает пиелонефритом [2].
Пиелонефрит по своей частоте превосходит все почечные болезни вместе взятые [1]. Согласно сборной статистике (более чем 100 авторов), в среднем 1% людей на земле ежегодно заболевает пиелонефритом [2].
Острый пиелонефрит составляет 14% болезней почек, гнойные его формы развиваются у 1/3 больных [3]. В настоящее время инфекции мочевыводящих путей (ИМВП) разделяют на неосложненные и осложненные [4]. К осложненным ИМВП относят заболевания, объединенные наличием функциональных или анатомических аномалий верхних или нижних мочевых путей или протекающие на фоне заболеваний, снижающих резистентность организма (Falagas M.E.,1995). ИМВП в большинстве стран мира являются одной из наиболее актуальных медицинских проблем. Так, в США ИМВП служат причиной обращения к врачу 7 млн. пациентов в год, из которых 1 млн. требуют госпитализации. Группа осложненных ИМВП представлена крайне разнородными заболеваниями: от тяжелого пиелонефрита с явлениями обструкции и угрозой развития уросепсиса, до катетер–ассоциированных ИМВП, которые могут исчезнуть самостоятельно после извлечения катетера [5]. Некоторые авторы для практических целей придерживаются выделения двух форм пиелонефрита: неосложненный и осложненный [6,7]. Такое условное разделение ни в коей мере не объясняет степень воспалительного процесса в почке, его морфологическую форму (серозный, гнойный). Необходимость выделения осложненного и неосложненного пиелонефрита обусловлена различиями в их этиологии, патогенезе и соответственно – разными подходами к лечению. Наиболее полно отражает различные стадии и формы воспалительного процесса в почке классификация, предложенная в 1974 г. Н.А. Лопаткиным (рис. 1).
Рис. 1. Классификация пиелонефрита (Н.А. Лопаткин, 1974)
Несмотря на оптимистические предсказания, частота заболеваний пиелонефритом существенно не изменилась в эру антибиотиков и сульфаниламидов.
Острый пиелонефрит только у 17,6% больных является первичным, у 82,4% – он вторичен. Поэтому алгоритм диагностики должен ответить на следующие вопросы: функция почек и состояние уродинамики, стадия (серозная или гнойная), форма пиелонефрита (апостематозный, карбункул, абсцесс почки или их сочетание). В алгоритм экстренных исследований включают анализ жалоб больного и сбор анамнеза, клинико–лабораторное обследование, комплексное ультразвуковое исследование с применением допплерографии, рентгенологическое исследование [8].
Наибольшее количество диагностических ошибок допускается на амбулаторном этапе из-за подчас пренебрежительного отношения врачей к сбору анамнеза, недооценки жалоб и тяжести состояния больного, непонимания патогенеза развития острого пиелонефрита. В результате больные госпитализируются в непрофильные отделения в связи с неправильно установленным диагнозом или назначается амбулаторное лечение при обструктивном остром пиелонефрите, что недопустимо.
Улучшение качества диагностики острого пиелонефрита и уменьшение количества диагностических ошибок возможно только при использовании комплексного подхода, в основе которого лежат жалобы больного, анамнез заболевания и клинико–лабораторные данные. При установлении диагноза острый пиелонефрит на основании жалоб больного на повышение температуры, боли в поясничной области, наличии лейкоцитурии, бактериурии; необходимо исключить нарушение уродинамики с помощью ультразвукового исследования (УЗИ) с допплерографией, экскреторной урографии (ЭУ). Затем определить стадию пиелонефрита, т.е. провести дифференциальную диагностику между серозной и гнойной стадиями заболевания (табл. 1).
При выявлении гнойного пиелонефрита определяется форма заболевания – апостематозный, карбункул почки, абсцесс или их сочетание (табл. 2).
Пиелонефрит - заболевание бактериальной природы, однако специфического возбудителя не существует. Пиелонефрит вызывают различные микроорганизмы - бактерии, вирусы, грибы. Наиболее часто этиологическим агентом пиелонефрита являются бактерии – грамотрицательные и грамположительные условные патогены, многие из которых принадлежат нормальной микрофлоре человека. Наиболее значимыми возбудителями острого пиелонефрита являются: E. coli, Proteus spp., P. aeruginosa, Enterobacter spp., Staphylococcus spp., Enterococcus faecalis [10]. В настоящее время отмечено снижение частоты обнаружения E. coli, особенно у мужчин, пациентов с мочевыми катетерами. Возрастает частота выделения P. aeruginosa и Proteus spp. [11]. E. coli преобладает у пациентов при неосложненных ИМВП, т.е. при отсутствии обструктивной уропатии. Изменение этиологической структуры возбудителей острого пиелонефрита во многом связано с широким внедрением в клиническую практику эндоскопических методов диагностики и лечения, заканчивающихся оставлением дренажей в органах мочевой системы, которые становятся входными воротами инфекции (табл. 3).
Пиелонефрит - заболевание бактериальной природы, однако специфического возбудителя не существует. Пиелонефрит вызывают различные микроорганизмы - бактерии, вирусы, грибы. Наиболее часто этиологическим агентом пиелонефрита являются бактерии – грамотрицательные и грамположительные условные патогены, многие из которых принадлежат нормальной микрофлоре человека. Наиболее значимыми возбудителями острого пиелонефрита являются: [10]. В настоящее время отмечено снижение частоты обнаружения , особенно у мужчин, пациентов с мочевыми катетерами. Возрастает частота выделения и [11]. преобладает у пациентов при неосложненных ИМВП, т.е. при отсутствии обструктивной уропатии. Изменение этиологической структуры возбудителей острого пиелонефрита во многом связано с широким внедрением в клиническую практику эндоскопических методов диагностики и лечения, заканчивающихся оставлением дренажей в органах мочевой системы, которые становятся входными воротами инфекции (табл. 3).
При гнойном пиелонефрите – одной из самых тяжелых и опасных для жизни осложненных ИМВП, основными возбудителями являются грамотрицательные условно-патогенные микроорганизмы (76,9%). У пациентов, перенесших открытые оперативные вмешательства на органах мочевой системы или эндоскопические диагностические и лечебные манипуляции и операции, возрастает роль госпитальных штаммов микроорганизмов, в первую очередь это относится к P. aeruginosa.
Лечение острого пиелонефрита должно быть комплексным, включающим следующие аспекты: устранение причины, вызывающей нарушение уродинамики, антибактериальная, дезинтоксикационная, иммунокоррегирующая и симптоматическая терапия. Как диагностика, так и выбор метода лечения должны осуществляться в кратчайшие сроки. Лечение острого пиелонефрита преследует цель сохранения почки, профилактики уросепсиса и возникновения рецидивов заболевания. Исключение составляют катетер-ассоциированные инфекции, в большинстве случаев исчезающие после удаления катетера [12].
При любой форме острого обструктивного пиелонефрита в абсолютно неотложном порядке должен быть восстановлен отток мочи от пораженной почки, причем это должно предшествовать всем остальным лечебным мероприятиям. Восстановление или улучшение почечной функции при вторичном (обструктивном) остром пиелонефрите происходит лишь тогда, когда обтурация устранена не позднее, чем через 24 часа после начала острого пиелонефрита. Если же обтурация сохраняется на более длительный срок, это приводит к стойкому нарушению всех показателей функции почек, клинически наблюдается исход в хронический пиелонефрит [1]. Восстановление нормальной уродинамики является краеугольным камнем в лечении любой мочевой инфекции. В тех случаях, когда причина возникновения обструкции не может быть ликвидирована немедленно, следует прибегать к дренированию верхних мочевых путей нефростомическим дренажем, а в случае инфравезикальной обструкции – к дренированию мочевого пузыря цистостомическим дренажем [5]. Обе операции предпочтительнее выполнять под ультразвуковым наведением.
Антибактериальная терапия
Применяются различные схемы, программы, алгоритмы антибактериальной терапии острого пиелонефрита (табл. 4, 5).
Придерживаясь рациональной тактики антибиотикотерапии, можно избежать многих нежелательных последствий, возникающих при неправильном подходе к лечению: распространения антибиотикоустойчивых штаммов возбудителей, проявления токсичности лекарственных средств.
Длительное время занимаясь обследованием и лечением больных острым гнойным пиелонефритом, мы установили взаимосвязь возбудителя, пути проникновения инфекции и формы острого пиелонефрита (табл. 6).
Выявленная закономерность позволяет подбирать рациональную эмпирическую терапию с учетом наиболее вероятного возбудителя.
В лечении больных острым гнойным пиелонефритом нужно использовать препараты с расширенным спектром антибактериальной активности, резистентность к которым основных возбудителей пиелонефрита отсутствует или является достаточно низкой. Препаратами выбора для стартовой эмпирической терапии острого гнойного пиелонефрита являются карбапенемы, цефалоспорины III–IV поколений, фторхинолоны.
При отсутствии факторов риска, таких как инвазивные урологические вмешательства, сахарный диабет, возможно проведение комбинированной терапии: цефалоспорины I или II поколений и аминогликозиды.
При всех стадиях и формах острого пиелонефрита адекватным является только парентеральный способ введения антибиотиков, предпочтение следует отдавать внутривенному пути введения. Оценка эффективности проводимой терапии при остром пиелонефрите должна осуществляться через 48–72 часа, коррекция – после получения результатов бактериологического исследования.
Так как к моменту первичной оценки эффективности терапии (48–72 часа) результаты микробиологического исследования обычно отсутствуют, коррекция антибактериальной терапии при отсутствии эффекта или недо статочной эффективности терапии проводится также эмпирически. Если лечение начиналось с применения цефалоспорина I поколения в сочетании с аминогликозидом, проводится замена первого препарата на цефалоспорин II или III поколения. При отсутствии эффекта от применения цефалоспоринов III поколения в сочетании с аминогликозидами показано назначение фторхинолонов (ципрофлоксацин) или карбапенемов (имипенем). После получения данных микробиологического исследования – переход на этиотропную терапию.
При всех стадиях и формах острого пиелонефрита адекватным является только парентеральный способ введения антибиотиков, предпочтение следует отдавать внутривенному пути введения. Оценка эффективности проводимой терапии при остром пиелонефрите должна осуществляться через 48–72 часа, коррекция – после получения результатов бактериологического исследования. Если при остром серозном пиелонефрите антибактериальная терапия проводится в течение 10–14 дней, то при гнойном пиелонефрите длительность проведения антибактериальной терапии увеличивается. Критерием для решения вопроса о прекращении антибактериальной терапии являются нормализация клинической картины, анализов крови и мочи. У пациентов, оперированных по поводу острого гнойного пиелонефрита, антибактериальная терапия продолжается до закрытия нефростомического свища. В дальнейшем амбулаторно проводится назначение антибактериальных препаратов с учетом результатов антибиотикограммы.
Острый пиелонефрит – это хирургическая инфекция. В начале заболевания трудно прогнозировать, по какому пути будет развиваться заболевание, при котором в процесс всегда в той или иной степени вовлечены чашечно-лоханочная система и паренхима почки. Достоверно исключить нарушение уродинамики можно только проведя соответствующие исследования: ультразвуковое с применением допплерографии, экскреторную урографию. Поэтому было бы неправильно обсуждать вопросы, касающиеся антибактериальной терапии, в отрыве от алгоритма диагностики острого пиелонефрита, методов восстановления уродинамики.
- Кто должен лечить больного острым пиелонефритом: терапевт, нефролог, уролог?
- Где должно проводиться лечение: амбулаторно, в условиях нефрологического, урологического отделения?
- Где и как правильно и своевременно провести обследование пациента с острым пиелонефритом, чтобы своевременно исключить нарушение уродинамики и не допустить развития гнойного пиелонефрита или бактериемического шока?
- Как правильно подобрать стартовую эмпирическую антибактериальную терапию и провести ее своевременную и адекватную коррекцию при отсутствии возможности выполнения микробиологических исследований в амбулаторных условиях?
Только объединив усилия клиницистов, микробиологов и химиотерапевтов (создав в каждой крупной многопрофильной больнице соответствующее подразделение), ответив четко и однозначно на предложенные вопросы и поставив во главу угла конкретного больного, а не возбудителей и антибактериальные препараты (схема: Больной – возбудитель – антибиотик), мы сможем улучшить результаты лечения больных острым пиелонефритом.
1. Войно-Ясенецкий А.М. Острый пиелонефрит / клиника, диагностика, лечение: Дис. док. мед. наук. - 1969.
2. Болезни почек /Под редакцией Маждракова Г. и Попова Н. - София: Медицина и физкультура , 1980. - С. 311-388.
3. Пытель Ю.А., Золотарев И.И.. Неотложная урология. - М. Медицина, 1985
4. Лопаткин Н.А., Деревянко И.И. Неосложненные и осложненные инфекции мочеполовых путей. Принципы антибактериальной терапии // РМЖ. - 1997. - т.5. - N 24. - С.1579-1588.
5. Лоран О.Б., Пушкарь Д.Ю., Раснер П.И.// Клиническая антимикробная химиотерапия.- 1999. - т.1. - N 3. - С.91-94.
6. Деревянко И.И. Современная антибактериальная химиотерапия пиелонефрита: Дисс. . докт. мед. наук. - М.,1998.
7. Tolkoff-Rubin N., Rubin R. New approaches to the Treatment of Urinary Tract infections // Am. J.Med. - 1987.- Vol.82 (Suppl. 4A ). - P. 270-277
8. Синякова Л.А. Гнойный пиелонефрит (современная диагностика и лечение): Дисс. . докт. мед. наук. - М., 2002.
9. Степанов В.Н., Синякова Л.А., Денискова М.В., Габдурахманов И.И. Роль ультразвукового сканирования в диагностике и лечении гнойного пиелонефрита // Материалы III научной сессии РМАПО. М.,1999. - С. 373.
10. Лопаткин Н.А., Деревянко И.И., Нефедова Л.А. Этиологическая структура и лечение инфекционно-воспалительных осложнений в урологической практике // Российское общество урологов. Правление. Пленум: Материалы. - Киров, 2000. - С. 5-29.
11. Naber K.G. Optimal management of uncomplicated and complicated urinary tract infections. - Adv. Clin. Exp.Med. - 1998. - Vol. 7. - P. 41-46.
12. Перепанова Т.С. Комплексное лечение и профилактика госпитальной инфекции мочевых путей: Дис. . док. мед. наук. М., 1996.
13. Белобородова Н.В., Богданов М.Б., Черненькая Т.В. Алгоритмы антибиотикотерапии: руководство для врачей. - М., 1999.
14. Яковлев С.В. Антибактериальная терапия пиелонефрита // Consilium medicum. - 2000. - т. 2. - N 4. - С. 156-159.
15. Naber K. et al. Recommendation for antimicrobial therapy in urology// Chemother J.- Vol. 9. - P. 165-170.
16. Белобородов В.Б. Мировой опыт применения имипенема/циластатина и меропенема в клинической практике // Инфекции и антимикробная терапия. - 1999. - т. 1. - N 2. - С. 46-50.
17. Yoshida K., Kobayashi N., Tohsaka A. et al. Efficacy of sodium imipenem/cilastatin on patients with complicated urinary tract infections follow the failure of prior antimicrobial agents. Hinyokika. - 1992; Vol. 38. - P. 495-499.
Читайте также: