Препараты арвт первой линии для лечения вич
Обновлено: 24.04.2024
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
Приложение 1
к приказу МЗ КР № 424
от 16 апреля 2021 г.
Пока не имеется явных доказательств в пользу более высокого уровня заболеваемости COVID-19 или иного течения заболевания у ЛЖВ по сравнению с ВИЧ-отрицательными пациентами.
Вероятно, подавление иммунитета (CD4

Основной протокол - Коронавирусная инфекция COVID-19
Внедрение и организация системы единого подхода по диагностике, лечению и ведению коронавирусной инфекции (COVID-19), основанного на международных клинических руководствах высокого методологического качества и адаптированных к местным условиям.
Семейные врачи, врачи первичного уровня здравоохранения, инфекционисты, реаниматологи, пульмонологи, врачи других специальностей; организаторы здравоохранения; специалисты, контролирующие качество оказания медицинской помощи (ФОМС).
Клиническое руководство применимо к пациентам с коронавирусной инфекцией (COVID-19), находящихся на стационарном лечении
Дата создания: обновлено в августе 2020 г. Временное руководство, 1-я версия была утверждена приказом МЗ КР №173 от 20.03.2020, 2-я версия обновлена и утверждена приказом МЗ КР №219 от 05.04.2020, 3-я версия обновлена и утверждена приказом МЗ КР №387 от 08.06.2020, 4-я версия утверждена приказом МЗ КР №649 от 25.08.2020.
Данная 5-я версия клинического руководства разработана на основании новых обновленных данных по наилучшей клинической практике по COVID-19, в дальнейшем будет обновляться по мере появления новых доказательств.
КОРОНАВИРУСНАЯ ИНФЕКЦИЯ 2019 (COVID-19) – инфекционно-опосредованное заболевание, вызываемое коронавирусом SARS-CoV-2, протекающее в различных вариантах (от бессимптомного носительства вируса до терминальных состояний), характеризующееся развитием клинической картины не только острой респираторной инфекции, но и поражением легких, нервной системы, включая структуры головного мозга, желудочно-кишечного тракта, печени, почек, эндокринных органов, органов репродуктивной системы, кожи, интоксикацией, ДВС-синдромом подострого течения и полиорганной недостаточностью [26].
Этиология и патогенез
Одним из патогномоничным признаков, характеризующих тяжелое течение и плохой клинический прогноз при COVID-19, является лимфопения, которая часто встречается у пациентов. Исследования показали, что она может быть связана с повышенным уровнем смертности, особенно у людей с низким уровнем CD3+, CD4+ и CD8 - Т-лимфоцитов.
Вирус может непосредственно поражать лимфоциты и приводить к их гибели. Установлено, что лимфоциты экспрессируют ангиотензинпревращающий фермент - 2 (АПФ-2), и клетки могут стать прямой мишенью для вирусов;
Вирус может поражать лимфатические органы. Острое снижение лимфоцитов может быть связано с лимфоцитарной дисфункцией. Не может быть исключено и прямое повреждение новым коронавирусом таких органов, как тимус и селезенка;
Нарушение экспрессии воспалительных цитокинов, возможно, приводит к апоптозу лимфоцитов. Фундаментальные исследования подтвердили, что фактор некроза опухоли-α (ФНО-α), интерлейкин-6 (ИЛ-6) и другие провоспалительные цитокины могут индуцировать дефицит лимфоцитов;
Ингибирование лимфоцитов молекулами, которые продуцируются во время метаболических нарушений, таких как гиперлактическая ацидемия. У пациентов с тяжелыми вариантами клинического течения COVID-19 был отмечен повышенный уровень молочной кислоты в крови, что могло подавлять пролиферацию лимфоцитов.
Факторы и группы риска
По имеющейся информации лица в возрасте 60 лет и лица с диабетом, гипертонией, сердечно-сосудистыми заболеваниями или легочными заболеваниями подвергаются наибольшему риску возникновения опасного для жизни заболевания COVID-19, вызванного вирусом, известным как SARS-CoV-2.
Имеющиеся в настоящее время ограниченные данные не указывают на то, что течение болезни COVID-19 у людей с ВИЧ отличается от такового у людей без ВИЧ. До появления эффективной комбинированной антиретровирусной терапии (АРТ) прогрессирующая ВИЧ-инфекция (то есть количество клеток CD4 ниже 200/мм 3 ) была фактором риска осложнений других респираторных инфекций. Верно ли это и для COVID-19, пока неизвестно.
Некоторые люди с ВИЧ имеют другие сопутствующие заболевания (например, сердечно-сосудистые заболевания или заболевания легких), которые увеличивают риск более тяжелого течения заболевания COVID-19. Хронические курильщики также подвержены риску более серьезных заболеваний.
Таким образом, до тех пор, пока не станет известно больше, необходима дополнительная осторожность для всех людей, живущих с ВИЧ, особенно тех, у кого есть ВИЧ-инфекция в поздних стадиях или плохо контролируемый ВИЧ.
Необходимо приложить все усилия, чтобы помочь людям с ВИЧ поддерживать адекватный запас АРТ и всех других требуемых лекарств.
Люди с ВИЧ должны следовать всем рекомендациям - социальное дистанциирование и надлежащая гигиена рук. Эти рекомендации регулярно обновляются.
Лечение
Можно ли использовать антиретровирусные препараты для лечения COVID-19? 46
Несколько исследований показали, что у пациентов, инфицированных вирусом, вызывающим COVID-19, и связанными с ним коронавирусными инфекциями (SARS-CoV и MERS-CoV), были хорошие клинические результаты, причем почти во всех случаях выздоровление происходило полностью. В некоторых случаях пациентам давали антиретровирусный препарат: лопинавир, усиленный ритонавиром (ЛП/Р). Эти исследования в основном проводились на ВИЧ-отрицательных людях.
Важно отметить, что эти исследования с использованием ЛП/Р имели важные ограничения. Исследования были небольшими, сроки, длительность и дозировка для лечения были различными, и большинство пациентов получали совместные вмешательства / совместное лечение, которые, возможно, способствовали сообщенным результатам.
Хотя доказательства пользы от использования антиретровирусных препаратов для лечения коронавирусных инфекций очень низки, серьезные побочные эффекты встречаются редко. Среди людей, живущих с ВИЧ, обычное использование ЛП/Р в качестве лечения ВИЧ связано с несколькими побочными эффектами средней степени тяжести. Однако, поскольку продолжительность лечения пациентов с коронавирусными инфекциями, как правило, была ограничена несколькими неделями, можно ожидать, что эти случаи будут низкими или меньшими, чем при обычном использовании.

Схемы АРТ при COVID-19 не следует менять, если в этом нет медицинской необходимости (при хорошей приверженности и отсутствии побочных эффектов) Лопинавир / ритонавир не рекомендуется использовать в качестве средства для лечения COVID-19.


Обеспечение ухода за ВИЧ-инфицированными во время пандемии COVID-19 45 АРТ надлежит принимать неперерывно.
Снизить до минимума вероятность изменения схемы АРТ до окончания периода COVID-19, если это не является критически важным (при хорошей приверженности и отсутствии побочных эффектов).
Мониторинг CD4 и тесты на вирусную нагрузку следует отложить, за исключением тех случаев, когда это клинически необходимо (например, для начала АРТ или изменения схемы лечения).
Предоставление запаса антиретровирусных препаратов для ЛЖВ, получающих АРТ
Особая защита (изоляция) в период COVID-19 рекомендуется людям, живущим с ВИЧ, у которых количество CD4 < 200 клеток/мм 3 , есть иные серьезные сопутствующие заболевания или определяемая вирусная нагрузка.
Пациенты со стабильным течением ВИЧ-инфекции, т.е. люди со стабильным состоянием здоровья, принимающие АРВТ, имеющие нормальное количество CD4-лимфоцитов и подавленную вирусную нагрузку ВИЧ.
В данном случае можно рассматривать данную группу людей, аналогичную тем, кто имеет отрицательный статус по ВИЧ, и, возможно, не подвергается повышенному риску серьезных заболеваний.
Для таких пациентов, которые обычно обращаются в клинику каждые 3 месяца, можно рекомендовать отложить регулярные визиты в амбулаторное медицинское учреждение для плановых консультаций в рамках диспансерного наблюдения.
Если предусмотрена такая возможность, консультирование осуществлять на дистанционной основе, по телефону, с привлечением средств телемедицины, интернета и других видов связи.
Таким пациентам следует обеспечить необходимый запас лекарственных препаратов для АРВТ и сопутствующей терапии на 1-6 месяцев, что позволит предотвратить возможные перебои в лечении ВИЧ и поможет пациентам избежать ненужных посещений аптек.
На сегодняшний день нет убедительных свидетельств того, что у пациентов с тяжелой иммуносупрессией, связанной с ВИЧ, имеются риски тяжелого течения COVID-19.
Вместе с тем, предполагается, что низкое количество CD4-лимфоцитов или или отсутствие АРВТ связаны с повышенным риском инфицирования SARS-CoV-2, как и любой другой инфекцией (на примере гриппа), а пациенты с низким содержанием CD4-лимфоцитов потенциально подвержены более высокому риску тяжелого заболевания.
Как правило, эта группа ЛЖВ включает людей, которые не получают АРВТ либо потому, что у них не диагностирована ВИЧ-инфекция, либо потому, что они испытывают препятствия или затруднения для получения и/или соблюдения режима эффективной терапии (низкая приверженность к лечению и диспансерному наблюдению, употребление психоактивных веществ и др.).
Напротив, существует одна гипотеза, предполагающая, что люди с ослабленным иммунитетом могут быть защищены от некоторых иммунно-опосредованных аспектов болезни COVID-19. Однако это строго гипотеза, и большинство из нас склонны думать, что люди с ослабленным иммунитетом, вероятно, подвергаются более высокому риску
Вместе со своим лечащим врачом люди с ВИЧ должны взвесить все за и против посещения СПИД-центра. Факторы, которые следует учитывать, включают в себя степень локальной передачи COVID-19, объем требуемой медицинской помощи и ВИЧ-статус человека (например, количество клеток CD4, вирусная нагрузка ВИЧ) и общее состояние здоровья.
Телефонные или виртуальные визиты для повседневного или несрочной медицинской помощи и консультирования по вопросам приверженности могут заменить личные встречи.
Для лиц с подавленной вирусной нагрузкой ВИЧ и стабильным состоянием здоровья, обычные посещения клиники и лаборатории следует отложить, насколько это возможно.
Иммунологические и физиологические изменения во время беременности обычно усиливают восприимчивость беременной к вирусным респираторным инфекциям, возможно, включая COVID-19. Как отмечается при других коронавирусных инфекциях, риск развития тяжелой болезни, заболеваемости или смертности при COVID-19 может быть выше среди беременных, чем среди населения в целом.
Результаты, полученные от небольшой группы беременных женщин с COVID-19, не нашли доказательств вертикальной передачи COVID-19, хотя был описан как минимум один случай неонатального COVID-19
По имеющимся ограниченным данным, вероятность того, что дети заболеют тяжелой формой COVID-19, меньше, чем у пожилых людей. Однако могут быть субпопуляции детей с повышенным риском развития более тяжелой болезни COVID-19; в исследованиях инфицирования коронавирусами без COVID-19 у детей, более молодого возраста, патологии легких и иммунокомпрометирующих состояний были связаны с более тяжелыми исходами.
Младенцы и дети с ВИЧ должны быть вакцинированы согласно календарю прививок, включая вакцины против гриппа и пневмококка.

Тактика ведения людей с ВИЧ у которых развивается COVID-19 46
Если рассматривается вопрос об изменении схемы АРВТ, следует подумать об отсрочке принятия такого решения.
Если это возможно, следует подождать более безопасного времени для тщательного мониторинга состояния здоровья, переносимости препаратов, количества CD4-лимфоцитов, что может потребовать более частых визитов в медицинское учреждение и посещения врача, которые необходимы во время смены схемы АРВТ.
Для пациентов с низким уровнем виремии (РНК ВИЧ 50-200 копий/мл), основным практическим пособием следует считать консультирование по поддержанию приверженности, текущему приему препаратов, в таких случаях необходимо настоятельно воздерживаться от смены терапии.
Для пациентов с вирусологическим прогрессированием или неудачей (РНК ВИЧ ≥ 200 копий/мл), вероятно, следует рекомендовать быстрое и эпидемиологически безопасное обследование для определения уровня CD4-лимфоцитов, возможно, забор крови для 7 тестирования на устойчивость ВИЧ к АРВТ, с последующим очным или, еще лучше, удаленным / заочным обсуждением вариантов продолжения терапии, при условии, что по остальным медицинским вопросам пациент остается стабильным.
Р Е З Ю М Е
В статье представлены современные международные и отечественные рекомендации по выбору антиретровирусной терапии у больных ВИЧ-инфекцией, ранее не получавших лечения. Также приведены результаты наиболее крупных международных исследований, на основании которых препарат тенофовир включен в состав схем АРВТ первой линии. На основании высокой эффективности и безопасности схем АРВТ, содержащих препарат тенофовир, у больных ВИЧ-инфекцией, ранее не получавших антиретровирусных препаратов, эти режимы терапии включены в состав предпочтительных схем АРВТ первой линии практически во всех современных рекомендациях. Оптимальным сочетанием препаратов из группы НИОТ (в том числе и в рекомендациях ВОЗ) для большинства больных ВИЧ-инфекцией является сочетание TDF и 3TC или FTC. Применение тенофовира также показано и особым категориям больных ВИЧ-инфекцией, в первую очередь, больным хроническими вирусными гепатитами, туберкулезом и имеющим нарушения жирового обмена.
Ключевые слова: ВИЧ-инфекция, антиретровирусная терапия, тенофовир
В последние годы практически все современные рекомендации включили TDF в состав схем АРВТ первой линии: рекомендации Всемирной организации здравоохранения (март 2010 г.), стран Евросоюза (ноябрь 2009 г.), США (декабрь 2009 г.), международного общества по изучению СПИДа-США (IAS-USA, август 2008 г.) [3,5,6,14].
Под схемами АРВТ первой линии понимают схемы, назначаемые пациентам, которые ранее не получали антиретровирусных препаратов (АРВП). Предпочтительным или базовым режимом первой линии терапии называют режим, который назначают большинству пациентов. К альтернативным режимам относят схемы АРВТ, используемые у особых категорий пациентов (в первую очередь при невозможности назначить предпочтительный режим из-за наличия противопоказаний).
Таблица 1. Рекомендации по выбору препаратов в схеме АРВТ у взрослых и подростков с ВИЧ-инфекцией, ранее не получавших АРВП
| Руководство | Предпочтительный режим | Альтернативный режим | ||
| 2 НИОТ | 3-й компонент | 2 НИОТ | 3-й компонент | |
| EACS 2009 (Европ. клинич. общ-во по СПИДу) | ABC/3TC TDF/FTC | EFV, NVP или ИП/р: ATV/r, DRV/r (1 р/д), LPV/r (1 и 2 р/д), SQV/r (2 р/д) | ZDV/3TC ddI+3TC или FTC | FVP/r (1 и 2 р/д), SQV/r (1 р/д), RAL |
| IAS-USA 2008 (Межд. общ-во по СПИДу для США) | ABC/3TC TDF/FTC | EFV или ИП/р: ATV/r, DRV/r FVP/r, LPV/r, SQV/r | ZDV/3TC | NVP или ИП: ATV, FPV, NFV |
| DHHS 2009 (Департамент по здравоохр. и соц. развитию США) | TDF/FTC | EFV или ИП/р: ATV/r 1 р/д, DRV/r 1 р/д, LPV/r 1 или 2 р/д RAL | ABC/3TC ZDV/3TC, ddI+3TC или FTC* | NVP или ИП или ИП/р: ATV 1 р/д, FPV/r 1 р/д или FPV 2 р/д, SQV/r 2 р/д |
| ВОЗ, 2009 | ZDV/3TC TDF/FTC или 3ТС | EFV или NVP | d4T + 3TC | - |
| Россия, 2010 | ZDV/3TC | EFV | ФАЗТ+3TC d4T + 3TC ABC/3TC+ZDV | NVP или ИП или ИП/р: ATV; ATV/r; DRV/r LPV/r |
ABC- абакавир; d4T-ставудин; ddI-диданозин; FTC-эмтрицитабин; 3TC-ламивудин; TDF-тенофовир; ZDV-зидовудин; ФАЗТ – фосфазид; EFV-эфавиренз; NVP-невирапин; ATV-атазанавир; DRV-дарунавир; FPV-фосампренавир; LPV-лопинавир; NFV-нелфинавир; SQV-саквинавир: RAL-ралтегравир
При применении TDF в составе схемы АРВТ следует учитывать наличие лекарственных взаимодействий между препаратами:
- При сочетании TDF и ddI значительно увеличивается концентрация в крови последнего, что приводит к повышению риска развития панкреатита и периферической полинейропатии. Кроме того, данная комбинация препаратов приводит к слабому иммунологическому ответу на АРВТ (не следует сочетать TDF и ddI);
- Атазанавир (ATV/r) и лопинавир (LPV/r) повышают уровни тенофовира (нет необходимости изменять суточную дозировку препаратов);
- ТDF уменьшает уровни атазанавира в плазме крови (ATV необходимо назначать вместе со 100 мг ритонавира- ATV/r) [1].
В рекомендациях ВОЗ вместо комбинации ZDV/3TC в схемах АРВТ у беременных женщин с ВИЧ-инфекцией, которым показано назначение АРВТ, возможно использования сочетания TDF + 3TC или FTC + NVP или EFV. При этом в первом триместре беременности назначение EFV противопоказано [14].
По мнению большинства специалистов у пациентов старше 55 лет имеет место более быстрая прогрессия ВИЧ-инфекции, в связи, с чем пациентам старшего возраста рекомендуют начинать АРВТ раньше, при количестве CD4-лимфоцитов менее 500 клеток/мкл (а не менее 350 клеток/мкл). Кроме того, у людей старшего возраста существенно чаще выявляют заболевания сердечнососудистой системы, нарушения со стороны липидного и/или углеводного обмена (избыточная масса тела, сахарный диабет, метаболический синдром и др.). В наименьшей степени на метаболические процессы оказывают влияние препараты из группы ННИОТ (в первую очередь NVP, а также EFV) и НИОТ (TDF + FTC или 3TC). Поэтому оптимальной схемой АРВТ для данной категории больных будет комбинация TDF, FTC (или 3TC) и NVP (или EFV). В качестве альтернативы TDF можно использовать ZDV или ABC [3,5].
У больных ВИЧ-инфекцией и туберкулезом (ВИЧ/ТБ) необходимо учитывать наличие лекарственных взаимодействий между АРВП и препаратами из группы рифамицинов. В соответствии с рекомендациями ВОЗ при назначении лечения больным сочетанной патологией (ВИЧ/ТБ) следует учитывать, что при использовании рифампицина (RIF) в схемах противотуберкулезной терапии в качестве основной схемы АРВТ для лечения ВИЧ-инфекции у больных туберкулезом целесообразно применять - ZDV или TDF + 3TC или FTC + EFV [2,3,5,14].
Представленные в конце 2009 г. рекомендации специалистов США и Евросоюза по выбору схемы АРВТ первой линии основаны на результатах 96 недель терапии 3 наиболее крупных международных исследований эффективности и безопасности схем АРВТ у больных ВИЧ-инфекцией, ранее не получавших лечения. В этих исследованиях схемы АРВТ, включавшие TDF и FTC, получало 2135 больных ВИЧ-инфекцией (таблица 2) [8,10,11].
Таблица 2. Эффективность и безопасность применения TDF/FTC в течение 96 недель лечения в составе различных схем АРВТ у больных ВИЧ-инфекцией, ранее не получавших АРВТ
| Исследования | Схемы АРВТ TDF/FTC+ | РНК ВИЧ | CD4+лимфоциты, прирост клеток/мкл | Вирусологическая неэффективность (%) | Частота НЯ 2-4 степени (%) | Частота выбытия (%) |
| Castle | ATV/r N=440 | 74** | 268 | 6 | 30 | 16 |
| LPV/r N=443 | 68** | 290 | 7 | 32 | 21 | |
| Artemis | DRV/r N=343 | 79*** | 171 | 12** | 23 | 17 |
| LPV/r N=346 | 71*** | 188 | 17 | 34 | 23 | |
| Startmrk | RAL N=281 | 81*** | 240 | 13,9 | 47* | 13,1 |
| EFV N=282 | 79*** | 225 | 16 | 78* | 18,3 |
*-НЯ 1-4 степени, связанные с лечением; ** - p
Проведенный анализ результатов 15 клинических исследований эффективности и безопасности схем АРВТ 1 линии показал, что через 48 недель терапии нарушения лабораторных показателей липидного обмена были более выражены, если больные в составе схемы АРВТ не получали тенофовир (Рис.1) [7]. Среди больных, получавших TDF, уровни общего холестерина были выше в тех случаях, когда пациентам назначали лопинавир/ритонавир.
Рисунок 1. Изменение уровня общего холестерина через 48 недель терапии в зависимости от схемы АРВТ.
Помимо TDF/FTC второй рекомендуемой комбинацией препаратов из группы НИОТ является сочетание ABC/3TC [3,5,6].
Исследование HEAT – двойное слепое плацебо контролируемое исследование по сравнению эффективности схем АРВТ с приемом 1 раз в сутки [12]. 688 больных ВИЧ-инфекцией, ранее не получавших терапии были рандомизированы на 2 группы. Пациенты 1 группы получали ABC/3TC (600/300 мг – Кивекса), а 2 группы – TDF/FTC (300/200 мг – Трувада). В качестве 3-го препарата все пациенты получали LPV/r (800/200 мг 1 раз в сутки – Калетра).
Через 96 недель терапии у 60% и 58% больных уровень РНК ВИЧ был менее 50 копий/мл, а прирост количества CD4+лимфоцитов (по медиане) составил 250 и 247 клеток/мкл, соответственно. Обе схемы были одинаково эффективны у больных с исходно высоким уровнем РНК ВИЧ (>100000 копий/мл) или низким числом CD4+клеток (Среди НЯ, связанных с приемом TDF, выделяют головную боль, нарушение работы ЖКТ, поражение почек (довольно редкое НЯ). Повреждение проксимальных канальцев проявляется проксимальноканальцевым ацидозом, нормогликемической глюкозурией, гипофосфатемией, гипоурикемией, гипокалиемией, генерализованной аминоацидурией и протеинурией. Нефротоксичность развивается через несколько месяцев лечения, изредка в его начале. На ранних стадиях течение может быть бессимптомным, либо сопровождаться миалгиями; в большинстве случаев симптомы исчезают при прекращении приема препарата. К факторам риска относятся низкий вес тела и наличие заболевания почек на момент начала терапии. Частота развития нефротоксичных побочных эффектов крайне низкая у пациентов с исходно нормальной функцией почек. TDF не рекомендуется назначать больным с почечной недостаточностью, а также вместе с другими нефротоксичными препаратами (аминогликозидами, амфотерицином B, фоскарнетом, ганцикловиром, пентамидином, ванкомицином, цидофовиром, интерлейкином-2) или после недавнего применения этих препаратов [1].
При длительном приеме препарата возможно развитие деминерализации и снижение плотности костной ткани (большинство данных получено в экспериментах на животных).
В 2010 г. были опубликованы результаты 96 недель исследования ACTG 5202: сравнение эффективности и безопасности ATV/r или EFV в комбинации с ABC/3TC или TDF/FTC в составе схем АРВТ у пациентов, ранее не получавших лечение [4]. 1857 больных ВИЧ-инфекцией было рандомизировано в соотношении 1:1:1:1на 4 группы. В открытом режиме пациенты получали ATV/r или EFV, а в двойном слепом режиме TDF/FTC или ABC/3TC. Кратность приема всех препаратов составляла 1 раз в сутки.
Эффективность терапии оценивали по времени до развития вирусологической неудачи (РНК ВИЧ-1 ≥1000 копий/мл через 16 – до 24 недели или ≥200 копий/мл на/после 24 недели при повторных исследованиях). Безопасность лечения определяли по времени до возникновения НЯ. Учитывали впервые возникший симптом или лабораторное отклонение 3 или 4 степени, или, по крайней мере, на 1 степень выше, чем на исходном уровне (за исключением непрямого билирубина и КФК). Кроме того, отмечали время до появления признаков нарушения переносимости препарата.
Через 96 недель АРВТ у 83,4-85,3% больных, получавших АВС/3ТС, и у 89,0-89,8% больных, леченных TDF/FTC, не было выявлено вирусологической неудачи лечения. У пациентов с исходно высокой вирусной нагрузкой (> 100000 копий/мл) при терапии ABC/3TC, по сравнению с TDF/FTC, быстрее наступает вирусологическая неудача независимо от 3 компонента терапии (ATV/r или EFV). У когорты пациентов с низкой вирусной нагрузкой не обнаружено различий между группами (АВС/3ТС и TDF/FTC) во времени до развития вирусологической неудачи как на ATV/r, так и на EFV. При развитии вирусологической неудачи лечения в группе пациентов, получавших EFV, достоверно чаще регистрировали развитие мутаций резистентности (в т.ч. и к НИОТ), по сравнению с больными, леченными ATV/r, вне зависимости от комбинации НИОТ (ABC/3TC или TDF/FTC). У больных, получавших АВС/3ТС, прирост количества CD4-лимфоцитов через 96 недель терапии составил 250 и 251 клетку/мкл (ATV/r и EFV, соответственно). В тоже время, в группе больных, леченных TDF/FTC, прирост числа CD4-лимфоцитов был равен 252 и 221 клетке/мкл (соответственно, р=0,02).
При использовании в схемах АРВТ комбинации АВС/3ТС время до смены терапии было существенно короче, как на ATV/r (р=0,018), так и на EFV (р=0,005), что, вероятно, было связано с развитием РГЧ на абакавир. Если в составе схемы АРВТ больным был назначен EFV, то время до наступления побочного эффекта 3/4 степени было существенно короче при использовании ABC/3TC (р=0,03). При сравнении групп больных, получавших ABC/3TC или TDF/FTC, было обнаружено значительное увеличение уровней триглицеридов, липопротеидов низкой (ЛПНП) и высокой (ЛПВП) плотности у лиц, леченных АВС/3ТС, вне зависимости от третьего компонента схемы АРВТ (ATV/r или EFV). Менее чем у 5% больных, получавших TDF/FTC, регистрировали снижение индекса креатинина на 25% и более, причем у лиц, леченных ATV/r, эти изменения были более существенными [4].
Таблица 3. Исследование ACTG5202. Данные пациентов перед началом терапии.
| ABC/3TC | TDF/FTC | В целом (n=1857) | |||
| EFV (n=465) | ATV/r (n=463) | EFV (n=464) | ATV/r (n=465) | ||
| Возраст в годах, медиана | 37 | 38 | 39 | 39 | 38 |
| Мужчины (%) | 79 | 84 | 85 | 83 | 83 |
| Раса (%) | |||||
| Белые, не латиноамериканцы | 38 | 41 | 43 | 40 | 40 |
| Черные, не латиноамериканцы | 35 | 33 | 33 | 32 | 33 |
| Латиноамериканцы | 23 | 23 | 22 | 24 | 23 |
| ВИЧ РНК (log10 к/мл), Медиана | 4.7 | 4.6 | 4.7 | 4.7 | 4.7 |
| CD4 кл./мм3, медиана | 225 | 236 | 234 | 224 | 230 |
| СПИД (%) | 19 | 18 | 15 | 15 | 17 |
| Генотип на скрининге (%)* | 43 | 48 | 47 | 40 | 45 |
| HCV положительные пациенты (%) | 6 | 7 | 9 | 7 | 7 |
Исследование ACTG5224 было частью протокола 5202 и включало 269 пациентов [9]. В исследовании оценивали изменения жировой и костной ткани в зависимости от применяемой схемы АРВТ.
В начале терапии отмечали влияние всех исследуемых режимов на минеральную плотность костной ткани (МПКТ) с последующей стабилизацией после 48 недели АРВТ. Комбинация TDF/FTC приводила к большей, чем в группе пациентов, получавших комбинацию ABC/3TC, потере МПКТ бедренных костей и поясничного отдела позвоночника. Применение ATV/r приводило к большей потере МПКТ поясничного отдела позвоночника (но не бедренных костей) в сравнении с EFV. У 5,6% пациентов (из 269) наблюдали развитие 1 или более переломов, которые во всех случаях имели травматический характер. При оценке всей совокупности пациентов (исследование ACTG5202, n=1857) частоты возникновения переломов составила 4,3%, причем у 12,7% из них (10 человек) переломы были нетравматические. Не было обнаружено статистически достоверных различий между компонентами НИОТ или ННИОТ/ИП по частоте переломов (Точный тест Фишера) или времени до возникновения первого перелома (Монтель-Кокс тест) [9].
Сравнение влияния на состояние жировой ткани TDF/FTC и ABC/3TC не выявило существенных различий режимов АРВТ. При использовании обеих комбинаций НИОТ выявлено увеличение жировой ткани конечностей и туловища. Применение в составе схемы АРВТ ATV/r чаще приводило к увеличению жировой ткани в области туловища и конечностей, чем использование EFV. У 16% (95% CI 12-22 %) пациентов наблюдали развитие липоатрофии вне зависимости от используемой схемы АРВТ [9].
Таким образом, результаты международных исследований убедительно продемонстрировали высокую эффективность и безопасность схем АРВТ, содержащих препарат тенофовир, у больных ВИЧ-инфекцией, ранее не получавших антиретровирусных препаратов. Тенофовир включен в состав предпочтительных схем АРВТ первой линии практически во всех современных рекомендациях по назначению антиретровирусной терапии. Оптимальным сочетанием препаратов из группы НИОТ (в том числе и в рекомендациях ВОЗ) для большинства больных ВИЧ-инфекцией является сочетание TDF и 3TC или FTC. Применение тенофовира также показано и особым категориям больных ВИЧ-инфекцией, в первую очередь, больным хроническими вирусными гепатитами, туберкулезом и имеющим нарушения жирового обмена.
Выделяют схемы АРВТ первой, второй, третьей и т. д. линии и схемы резерва (спасения).
- Под схемами первой линии понимают схемы, назначаемые пациентам, которые ранее не получали высокоактивную антиретровирусную терапию или у которых ВААРТ возобновляется после перерыва, длительного пропуска (причем лечение осталось эффективным до момента прерывания).
Также к схемам первого ряда (линии) относятся схемы, измененные вследствие развития побочных эффектов, нежелательных явлений. Таким образом можно сделать вывод, что комбинация противовирусных препаратов первой линии – это схема, которые не менялась по причине неэффективности.
Схема первой линии включает, как правило, 2 препарата нуклеозидной основы (например Тенофовир или Абакавир) и третий препарат из другой группы, с другим механизмом действия.
- Под схемами второй, третьей и последующей линии подразумевают комбинации противовирусного лечения, применяемые в случае неэффективности терапевтических доз препаратов предыдущих линий.
Этим они отличаются от схем лечения вич-инфекции, которые назначают особым категориям больных. Например, людям с когнитивными нарушениями, получающим лечение ХВГС, беременным, пациентам имеющие нарушения липидного профиля, сахарный диабет и другие.
Соответственно препараты третьей линии назначают при неэффективности схем второй.
- Что такое схемы резерва (спасения) – это нестандартные (особые) схемы, которые применяются при неэффективности схем второй и последующих линий.
Обычно они включают в себя препараты разных групп, подбор которых осуществляется индивидуально для каждого пациента, исходя из анализа теста на резистентность (мутаций вируса конкретного пациента), истории ранее проводимой терапии, межлекарственных взаимодействий, сопутствующих заболеваний.
Для оценки эффективности АРВТ главными показателями являются:
1. Исследование вирусной нагрузки (вирусологические критерии).
Схема считается эффективной, если через 1 месяц приема препаратов количество РНК вируса снижается в 10 и более раз, через 3 месяца терапии - ниже 400 копий/мл, а через 6 месяцев - менее 50 копий/мл;
Поэтому своевременный лабораторный контроль поможет врачу правильно оценить эффективность.
2. Исследование уровня СД4 и других показателей иммунограммы (иммунологическая эффективность) – это критерии восстановления иммунной системы. Этот процесс происходит медленно и существенно зависит от степени иммунодефицита на момент начала лечения. У пациентов, начинающих лечение на фоне тяжелого иммунодефицита (CD4
Известно, что максимальное подавление вирусной нагрузки до неопределяемого уровня, и как следствие улучшение показателей иммунограммы, не только снижает риск передачи вируса окружающим, но и улучшает общее самочувствие пациента.
Для подбора правильной схемы АРВТ, с учетом таких параметров, как эффективность, безопасность, переносимость (частота развития побочных эффектов), удобство приема требуется наблюдение у опытных инфекционистов, работающих с вич-инфекцией и желание самого пациента получать качественное лечение.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, но специальные лекарства могут блокировать его на различных этапах.
В случае с ВИЧ это выглядит так.
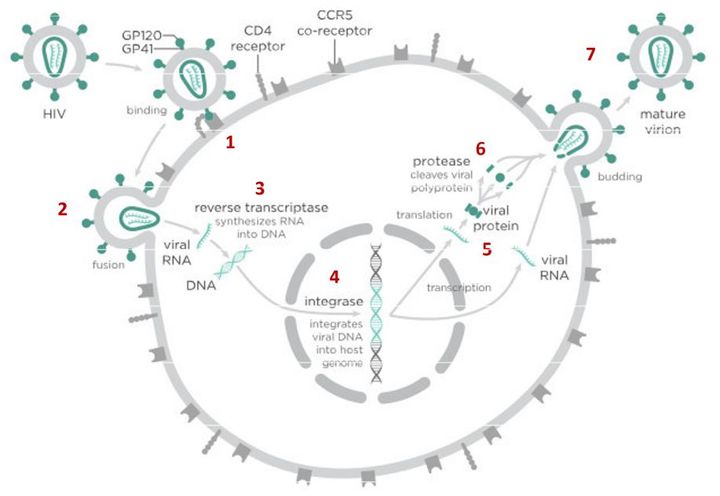
На первом этапе (цифра 1 на схеме) вирус проникает в клетку.
На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
(На этом видео можно увидеть как протекает этот и другие этапы репликации вируса в клетке)
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме).
На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина.
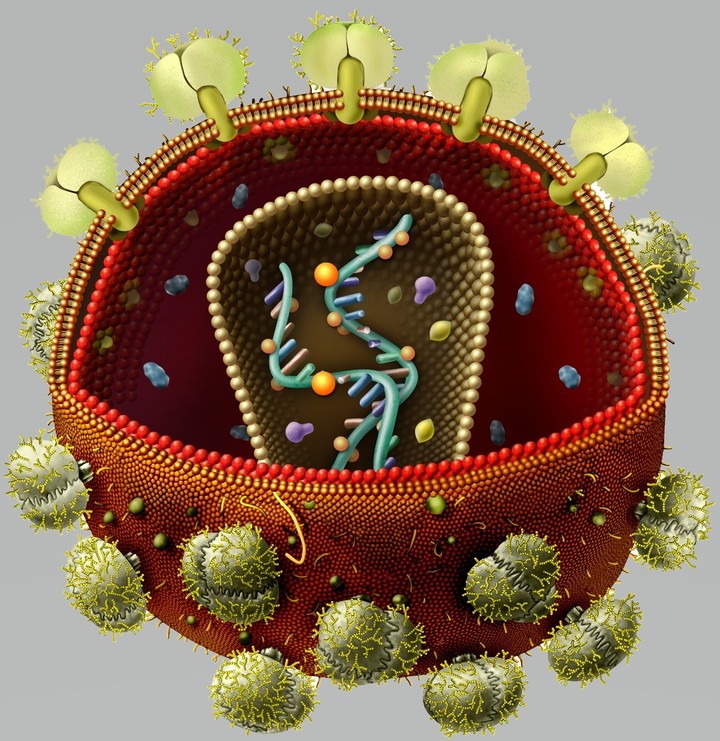
На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин).
Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы.
Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы (ингибиторы протеазы), включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Читайте также:

