Препараты для лечения лор инфекций
Обновлено: 24.04.2024
Противовирусные таблетки для лечения заболеваний уха, горла, носа
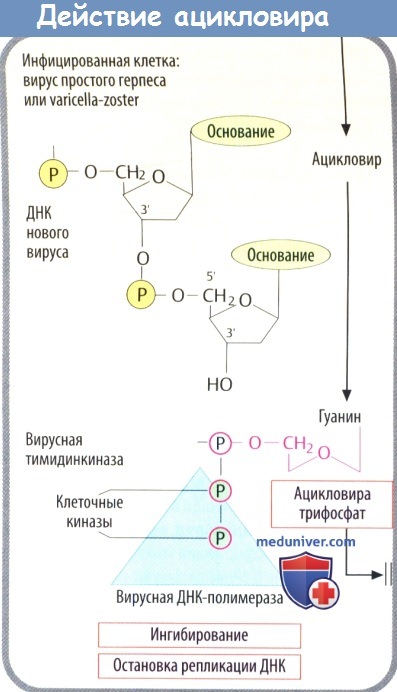
а) Противогерпетические препараты. К данной группе относятся ацикловир (зовиракс, GlaxoSmithKline), валацикловир (валтрекс, GlaxoSmithKline), фамцикловир (фамвир, Novartis), пенцикловир (денавир, New American Therapeutics). Они являются аналогами нуклеотидов, механизм действия основан на ингибировании синтеза ДНК.
Ацикловир эффективен в отношении Herpes simplex и Herpes zoster, доступен в формах для местного, перорального и внутривенного использования. Может использоваться для профилактики обострений вируса простого герпеса, однако эффективен лишь против вируса, находящегося в активной жизненной фазе, поэтому всегда есть вероятность развития рецидива.
Может вызывать нефропатию, особенно у лиц с изначально ослабленной функцией почек. Валацикловир принимается перорально, метаболизируется до ацикловира, достигающего высоких концентраций в плазме. Способен уменьшить выраженность лабиального герпеса при приеме в первые два часа после начала симптомов. Некоторые врачи используют противогерпетические препараты для лечения идиопатического паралича лицевого нерва (паралича Белла) из-за возможной вирусной этиологии заболевания.
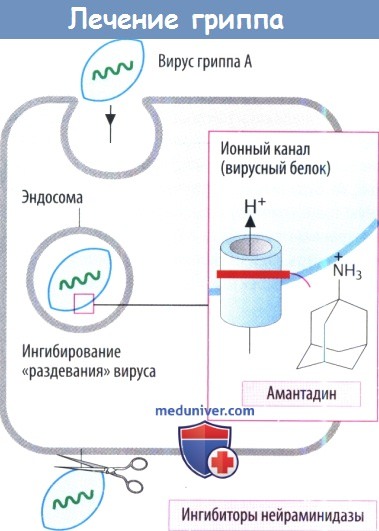
б) Противогриппозные препараты. Амантадин (симметрел, EndoHealth Solutions) и римантадин (флумадин, Forest Pharmaceuticals) предотвращают проникновение в клетки вируса гриппа А. Они неэффективны против вируса гриппа В. Начинать прием следует в течение первых 48 часов от начала симптомов и продолжать его до 7-10 дней. Они могут использоваться в качестве профилактики у пациентов, имевших контакт с носителем вируса, а также у пациентов домов престарелых и медицинского персонала во время эпидемий.
Побочные явления обычно выражаются нарушениями со стороны желудочно-кишечного тракта или центральной нервной системы (спутанность сознания, головокружения). Занамивир (реленза, Glaxo Smith Kline) и осельтамивир (тамифлю, Genentech) являются ингибиторами нейраминидазы, эффективными как против вируса гриппа А, так и вируса гриппа В. Могут уменьшать выраженность и продолжительность симптомов в случае начала лечения в течение 36 часов от начала заболевания.
Занамивир представляет собой порошок для ингаляций, который может вызывать раздражение слизистых полости носа, а у больных с бронхиальной астмой приводить к развитию бронхоспазма; возможно появление головных болей и дискомфорта со стороны желудочно-кишечного тракта. Осельтамивир может вызывать тошноту, диарею, рвоту, головные боли и головокружения.
в) Ключевые моменты:
• Сыпь возникает у 5% пациентов, получающих лечение пенициллинами. Только у половины из них сыпь возникнет вновь при повторном приеме. Пациентам с анафилактической реакцией на пенициллины в анамнезе должны выполняться кожные пробы и десенсибилизация при повторном приеме препаратов из этой группы.
• Так как этот препарат способен уничтожать высокорезистентные штаммы микроорганизмов, ванкомицин следует использовать только в случае тяжелых инфекций, не поддающихся лечению другими препаратами.
• Использование аминогликозидов ограничено их отои нефротоксичностью. Благодаря ототоксическому эффекту, гентамицин может использоваться для интратимпанального введения при лечении болезни Меньера.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Острые респираторные заболевания (ОРЗ) устойчиво занимают одно из ведущих мест среди инфекционно-воспалительных заболеваний детского возраста. Причем основная доля заболеваемости приходится на возраст от 1 до 6 лет. В этом возрастном периоде дети переносят в среднем от 3 до 6 ОРЗ в год. Затем частота заболеваемости постепенно снижается, составляя у взрослых в среднем 1-2 ОРЗ в год. Высокая заболеваемость ОРЗ наносит существенный экономический и социальный урон обществу, и это является одной из основных причин интенсивного поиска наиболее эффективных методов профилактики и терапии этих заболеваний /1, 2, 3/.
Особенностью острых респираторных заболеваний является то, что они представляют собой довольно обширную и разнородную группу заболеваний респираторного тракта, подавляющее большинство из которых имеет вирусную природу. Число вирусов и их сероваров, способных стать причиной ОРЗ огромно. В таблице приведены только основные виды респираторных вирусов, вызывающих заболевания у детей.
При этом следует отметить, что только риновирус имеет более 100 сероваров, вызывающих инфекционный процесс. Столь широкий спектр одних только вирусных возбудителей уже создает объективные трудности в разработке методов профилактики и терапии.
Около 10% всех ОРЗ обусловлены бактериальной микрофлорой — микоплазмами, хламидиями и бета-гемолитическим стрептококком группы А. Поэтому неудивительно, что в большинстве случаев при лечении ОРЗ не требуется проведения системной антибактериальной терапии. Это положение касается как большинства заболеваний верхних отделов респираторного тракта, так и острых бронхитов и трахеобронхитов. Многочисленные исследования, проведенные в основном на взрослом контингенте пациентов, показали, что назначение антибиотиков при респираторной вирусной инфекции не приводило к сокращению сроков лечения и числа осложнений.
Таким образом, алгоритм выбора терапии острой инфекции респираторного тракта у детей определяется не только нозологией и наиболее вероятной этиологией заболевания, но и возрастными и преморбидными характеристиками ребенка.
Следует отметить, что такие заболевания верхних отделов респираторного тракта, как фолликулярная и лакунарная ангина (тонзиллофарингит), острый средний гнойный отит, паратонзиллярный абсцесс, эпиглотит и острый ларингит со стенозом гортани 2–3 степени или осложненный нисходящим трахеитом, и пневмония являются основанием к назначению системных антибиотиков, выбор которых определяется наиболее вероятным возбудителем этих заболеваний.
Во всех остальных случаях терапию ОРЗ следует начинать с назначения противовоспалительной и противовирусной терапии. Препаратом выбора противовоспалительной терапии, который может быть использован в любом возрасте и не имеет противопоказаний за исключением индивидуальной непереносимости, является фенспирида гидрохлорид (Эреспал). Фенспирида гидрохлорид — оригинальный противовоспалительный препарат, отличный как от глюкокортикостероидов, так и от нестероидных препаратов. Его действие основано на подавлении транспорта ионов кальция в клетки и активности фосфолипазы А2. Это замедляет скорость каскада метаболизма арахидоновой кислоты. В результате тормозится образование простагландинов, лейкотриенов и тромбоксанов — основных факторов, инициирующих сосудистую фазу воспаления. Снижается степень воспалительного отека тканей и секреторной активности бокаловидных клеток слизистых оболочек. Кроме того, фенспирида гидрохлорид подавляет синтез гистамина и уровень экспрессии альфа1-адренорецепторов. Это способствует меньшей напряженности 2 фазы воспаления — фазы клеточной инфильтрации. Причем, фармакологической особенностью фенспирида гидрохлорида является преимущественное воздействие его на респираторный тракт при минимальном системном эффекте. Многоцентровые исследования, проведенные в 9 регионах РФ, показали, что эффективность терапии острой респираторной инфекции средней тяжести фенспиридом гидрохлоридом в качестве даже единственного препарата лечения достигает 88% /8/.
Противовирусная терапия в настоящее время представлена препаратами рекомбинантного интерферона и индукторами интерфероногенеза. В число противовирусных лекарственных средств входят /9/:
- вещества, избирательно подавляющие репродукцию вирусов на различных этапах их жизненного цикла;
- интерфероны, эндогенные низкомолекулярные белки, обладающие противовирусным, иммуномодулирующим и противоопухолевым эффектами;
- индукторы интерферонов — высоко- и низкомолекулярные соединения природного и синтетического происхождения, стимулирующие эндогенную выработку интерферонов в организме.
Известно более 10 групп препаратов, действие которых основано на подавлении репликации вирусов. Однако применение их в педиатрической практике ограничено из-за высокой токсичности, т.к. метаболизм размножающихся вирусов тесно связан с метаболизмом клеток организма-хозяина и воздействие на вирус почти неизбежно оказывает влияние на клетки растущего и развивающегося организма ребенка. В результате в детском возрасте из противовирусных химиопрепаратов разрешено использование лишь единичных и их назначение имеет довольно ограниченные показания.
При тяжелой рино-синтициальной инфекции, протекающей с явлениями бронхиолита или пневмонии, используется нуклеотидный аналог гуанозина — рибавирин. Рибавирин вводят ингаляционно (через небулайзер). При этом следует помнить, что рибавирин и римантадин, имеют достаточно большое число побочных эффектов, среди которых анемия, поражение печени и почек. Поэтому их назначение может быть оправдано только тяжелым течением вирусной инфекции и высоким риском неблагоприятного исхода болезни.
Из интерферонов у детей первого года, начиная с первых дней жизни, можно использовать рекомбинантный альфа-интерферон — Виферон. Препарат продемонстрировал высокую безопасность в детском возрасте. Показанием к его использованию являются рино-, корона-, РС- и аденовирусные инфекции, грипп и парагрипп.
Из группы индукторов интерферона у детей старше 6 месяцев может быть использован Анаферон детский, гомеопатический препарат, действие которого основано на введении сверхмалых доз антител к гамма-интерферону, что, как предполагается, стимулирует эндогенный синтез гамма-интерферона. С 2,5 лет используется индуктор синтеза эндогенного интерферона Арбидол. Арбидол эффективен главным образом по отношению к вирусам гриппа А и В, но показанием к его назначению являются и другие респираторные вирусные инфекции.
Этиологическими факторами развития бактериального инфекционно-воспалительного процесса в дыхательных путях — основного или осложнения острой респираторной вирусной инфекции — являются т.н. респираторные патогены: пневмококки (Str. pneumoniae), гемолитические стрептококки группы А (чаще Str. pyogenis и viridans), гемофильная палочка, микоплазма, хламидия, моракселла. Стафилококки и такие представители группы кишечных грамотрицательных бактерий, как кишечная палочка, клебсиелла и др. при заболеваниях, развившихся в домашних (амбулаторных) условиях встречаются крайне редко — не более чем в 2–5 % случаев. Причем, стафилококковые заболевания чаще осложняют тяжелые вирусные инфекции — грипп, ветряную оспу и др. Но стафилококки и грамотрицательные возбудители кишечной группы могут стать причиной бактериальных осложнений у часто болеющих и часто леченных антибиотиками детей с нарушенным микробиоценозом верхних дыхательных путей, а также детей, страдающих хроническими синуситами, хроническим тонзиллитом, аденоидитом. В таких случаях перед врачом встает вопрос о необходимости проведения антибактериальной терапии.
Показанием к назначению антибиотиков является развитие явно бактериального воспалительного процесса (гнойного среднего отита, гнойного синусита, ангины, ларингита с явлениями тяжелого стеноза гортани или бронхита, пневмонии). На бактериальную природу респираторной инфекции указывают:
- длительная, более 3 дней, фебрильная лихорадка;
- появление гнойных налетов и гнойного или слизисто-гнойного отделяемого;
- при отсутствии гипертермии и выраженной интоксикации - затяжной характер респираторной инфекции (более 2 недель).
Совокупность этих признаков может указывать на присоединение бактериального компонента инфекционного процесса.
Наряду с этим, как уже отмечалось, прямым показанием к назначению системных антибактериальных средств при респираторной патологии являются:
- предположение или установленный диагноз пневмонии;
- острый гнойный отит;
- клиническая картина эпиглотита,
- лакунарная и фолликулярная ангина стрептококковой этиологии (стрептококковый тонзиллофарингит);
Эти заболевания в подавляющем большинстве случаев имеют бактериальную или вирусно-бактериальную природу.
Современные антибактериальные препараты для лечения респираторной инфекции делят на препараты местного (Биопарокс, Гексорал) и системного действия.
Антибиотик местного действия Биопарокс в отличие от антисептиков местного действия (Гексорал, Фарингосепт и др.) используется в виде спрея для полости зева и носа. 4- кратное введение спрея создает достаточно высокую концентрацию растительного антибиотика местного действия фузафунгина в месте введения. Антимикробный спектр этого препарата соответствует спектру возбудителей респираторных заболеваний. Резистентность к нему респираторных патогенов незначительна. Многоцентровые исследования клинической эффективности препарата Биопарокс в лечении ОРЗ у 2609 часто болеющих детей, проведенные в 42 городах РФ, показали, что включение местной антибактериальной терапии в схему лечения ОРЗ достоверно повышало еe клиническую эффективность, позволяя достигнуть полного выздоровления без развития осложнений в течение 10 дней в 88,1% случаев вместо 68,8% — в контрольной группе. Причем, использование препарата с первых дней ОРЗ способствовало явному уменьшению выраженности симптомов острого воспаления со стороны слизистой носа, зева и гортани и степени выраженности температурной реакции, что сопровождалось достоверно значимым сокращением потребности больных в интраназальных деконгестантах и жаропонижающих препаратах. С третьего дня терапии отмечалась положительная динамика со стороны слизистой бронхов: быстрее исчезал кашель и аускультативные изменения в легких. Назначение Биопарокса сокращало потребность в использовании не только жаропонижающих средств и интраназальных деконгестантов, но и муколитиков и системных антибиотиков в лечении этой группы пациентов. Интересно, что повторное использование препарата в течение года не сопровождалось снижением его эффективности.
Ограничением для антибиотиков местного действия является возраст ребенка. Они назначаются детям только старше 2 лет. Кроме того, наиболее оптимально действие местных антибактериальных препаратов при раннем их назначении — не позже, чем на 2–3 сутки заболевания острой респираторной инфекцией, т.е. в период становления бактериального процесса. В то же время наши наблюдения и наблюдения других авторов показали, что антибиотики местного действия эффективны также при плановом лечении хронических процессов в носоглотке — тонзиллитов, аденоидитов, риносинуситов /10/. Оправдано назначение местных антибиотиков при ОРВИ у детей с хроническими воспалительными заболеваниями носоглотки. По сути, в данном случае местная антибактериальная терапия, играет роль превентивной терапии бактериальных осложнений острой вирусной инфекции.
При инфекции, вызванной стрептококком группы А, т.н. стрептококковом тонзиллофарингите (стрептококковой ангине), показан пенициллин, к которому сохраняется высокая чувствительность возбудителя.
Наиболее сложным остается вопрос о назначении системной антибактериальной терапии при остром бронхите. Большáя роль вирусов в этиологии заболевания, преобладание легких форм, самокупирующийся характер болезни подвергают сомнению целесообразность системной антибактериальной терапии в обычных, не осложненных, случаях заболевания. В то же время риск развития осложнений и неблагоприятное течение заболевания, особенно в раннем возрастном периоде, нередко является обоснованием назначения антибактериальной терапии при бронхите в детском возрасте. Таким образом, показаниями для назначения антибиотиков системного действия при остром бронхите у детей являются факторы, указывающие на возможность неблагоприятного течения заболевания. К ним можно отнести следующие:
- наличие выраженных симптомов интоксикации и длительной гипертермии (более 3 дней), особенно в группе детей раннего возраста;
- у детей всех возрастных групп — наличие неблагоприятного преморбидного фона, способного создать реальную угрозу развития пневмонии (наличие т.н. модифицирующих факторов);
- наличие клинических признаков, указывающих на бактериальную природу воспалительного процесса (слизисто-гнойный и гнойный характер мокроты) в совокупности с выраженной интоксикацией, лейкоцитозом и нейтрофилезом в анализе крови;
- затяжное течение заболевания (свыше 2 недель), особенно при подозрении на внутриклеточную природу возбудителя;
- клиническая и клинико-рентгенологическая картина бронхиолита, летальность от которого в раннем детском возрасте достигает 3 %, также рассматривается как показание к назначению антибиотиков;
- наличие выраженного, трудно поддающегося бронхолитической терапии, бронхообструктивного синдрома у детей раннего возраста.
К модифицирующим факторам бронхита, т.е. факторам, утяжеляющим его течение независимо от этиологии и создающим риск развития пневмонии, следует отнести:
- возраст до 3 месяцев;
- недоношенность, особенно среди детей первого полугодия жизни;
- гипотрофию 2 и 3 степеней;
- наличие врожденных аномалий развития, в первую очередь врожденных пороков сердца и сосудов, и других наследственных, врожденных и приобретенных заболеваний, создающих предпосылки для неблагоприятного течения болезни (например, спинальная амиотрофия Гофмана, бронхолегочная дисплазия и т.п.).
Антибиотики назначаются эмпирически, и при их выборе необходимо учитывать ряд факторов: возраст ребенка, наиболее вероятную этиологию, индивидуальную переносимость, особенности клинической картины болезни (типичная, атипичная), характер течения (затяжное, рецидивирующее), эффективность предшествующей терапии. Наиболее принятой практикой является назначение при типичной картине острого бронхита амоксициллина или амоксициллина клавуланата. Альтернативными препаратами (при неэффективности в течение 72 часов терапии или при непереносимости) являются цефалоспорины для приема внутрь 2–3 поколения и макролиды. При бронхитах с клинической картиной, позволяющей предположить микоплазменную или хламидийную этиологию, препаратами выбора у детей являются макролиды.
1. Инфекционная заболеваемость в Российской Федерации за январь-декабрь 2001 года -// Эпидемиол. инфекц. бол.- 2002.- 3–64.
2. Шаханина И.Л.// Здравоохранение.- М.- 1998.- №9.- 169–72.
3. Прудков А.И., Колпащикова Г.И., Савинова Т.Л., Фомин В.В. и др.// Пути снижения заболеваемости острыми респираторными инфекциями в крупном промышленном городе. Детские инфекции. 203.- 4.- С.56–59.
4. Альбицкий В.Ю., Баранов А.А.// Часто болеющие дети. Клинические и социальные аспекты. Пути оздоровления.- Саратов.- 1986.
5. Коровина Н.А., Заплатников А.Л., Чебуркин А.В., Захарова И.Н.// Часто и длительно болеющие дети; современные возможности иммунореабилитации (руководство для врачей). М.- 2001.
6. Запруднов А.М.// Клинико-патогенетические аспекты заболеваний органов дыхания у часто болеющих детей.- М.- 1996.
7. Самсыгина Г.А.// Часто болеющие дети: проблемы патогенеза, диагностики и терапии.- Педиатрия.- М.- 2005.- №1.- С.66–74.
8. Самсыгина Г.А., Фитилев С.Б., Левин А.М.// Педиатрия.- 2002.- №2.- С.81–86
9. Рациональная антимикробная химиотерапия.// Под общей редакцией В.П. Яковлева и С.В. Яковлева.- М.- Изд-во Литтера.-2003.- том 2. 1001 с.
Для цитирования: Страчунский Л.С., Каманин Е.И. АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ ИНФЕКЦИЙ В ОТОРИНОЛАРИНГОЛОГИИ. РМЖ. 1998;11:1.
L.S.Strachunsky, Ye.I.Kamanin — department of Clinical Pharmacology and Antimicrobial Chemotherapy, Smolensk State Medical Academy
L.S.Strachunsky, Ye.I.Kamanin — department of Clinical Pharmacology and Antimicrobial Chemotherapy, Smolensk State Medical Academy
Эпидемиология
В доступной литературе мы не нашли современных данных о распространенности инфекций ЛОР-органов в России. Для того чтобы получить представление об их распространенности, мы экстраполировали данные, полученные в США и Западной Европе [1]. Основываясь на данных зарубежных коллег, можно считать, что ежегодно в России 10 млн человек переносят острый синусит, развившийся во внебольничных условиях.
Согласно зарубежным источникам, острый средний отит (ОСО) является наиболее частой бактериальной инфекцией у детей. Для сравнения этих данных с отечественными мы изучили 400 случайно отобранных амбулаторных карт детей первых 5 лет жизни. Оказалось, что если, по зарубежным данным, на первом году жизни ОСО переносят 21-62% детей, то в России - 3%, в течение первых 5 лет жизни в США и Западной Европе более 70% детей переносят хотя бы 1 раз ОСО, а у нас только 20%. Все это указывает на низкую выявляемость ОСО у детей, поскольку маловероятно, чтобы существовали какие-либо объективные причины, объясняющие такие гигантские различия.
Инфекции ЛОР-органов являются одним из ведущих показаний к назначению антибиотиков. Во Франции ежегодно выписывается более 3 млн [2], а в США около 30 млн рецептов на антибиотики по поводу ОСО [3].
Возбудители
Первичная (природная) активность антибиотиков против основных возбудителей инфекций ЛОР-органов
Дозы антибиотиков при амбулаторных инфекциях ЛОР-органов
БГСА, или Streptococcus pyogenes является возбудителем преимущественно только при тонзиллофарингите. Как и в случае других возбудителей респираторных инфекций, выделение и определение чувствительности БГСА в отечественных лабораториях проводится очень редко и получаемые результаты часто вызывают сомнения. Например, нигде в мире пока не обнаружены штаммы БГСА, устойчивые к пенициллину или другим b- лактамным антибиотикам, хотя такие результаты попадают на стол лечащим врачам и публикуются в отечественной литературе. С помощью Е-тестов мы провели исследование чувствительности штаммов БГСА, выделенных в 1994-1996 гг. Все БГСА были чувствительны к пенициллину, амоксициллину, цефаклору и цефуроксиму. Вызывает тревогу 12,6% резистентность к эритромицину с перекрестной устойчивостью к другим макролидам (азитромицин, рокситромицин, диритромицин). Устойчивость к тетрациклину составила 60%, что еще раз подтверждает бесперспективность применения тетрациклинов при тонзиллофарингите.
Moraxella catarrhalis (старое название – Branchamella catarrhalis) часто описывается в литературе как один из основных возбудителей инфекций ЛОР-органов. Однако, как нам кажется, ее значение несколько преувеличено. По нашим данным, даже при проведении углубленных бактериологических исследований она встречается весьма редко и не может "конкурировать" с пневмококком и гемофильной палочкой. Так, в последней серии исследований у 80 пациентов с острым синуситом она была выделена только в одном случае. Моракселла почти в 100% случаев продуцирует b- лактамазу и поэтому устойчива к пенициллину, ампициллину, амоксициллину. В то же время она практически всегда чувствительна к амоксициллину/клавуланату, оральным цефалоспоринам II-III поколения. До последнего времени считали, что моракселла также всегда чувствительна к макролидам и ко-тримоксазолу. Однако недавние данные из Испании свидетельствуют о тревожном росте устойчивости к ним. Так, к ко-тримоксазолу были резистентны 42%, эритромицину 18%, азитромицину 3% штаммов моракселл, изолированных при респираторных инфекциях (E-102, J. Garcia e.a. A National, Multicenter, and Prospective Survey of Respiratory Bacteria Susceptibility to 12 Commonly Used Antimicrobials in Spain. ICAAC-96). К другим макролидам чувствительность не определялась. В целом выбор антибиотиков при лечении данной инфекции не представляет большой проблемы.
Резистентность к антибиотикам основных возбудителей инфекций ЛОР-органов
Экссудативный (выпотной) средний отит
Антибактериальная терапия ввиду ее низкой эффективности проводится очень избирательно, прежде всего в тех случаях, когда имеет место снижение слуха. Назначению антибиотика должен предшествовать период наблюдения – не менее 3 мес. Чаще всего назначают амоксициллин, продолжительность курса не менее 10 дней. При отсутствии эффекта возможно проведение повторного курса терапии амоксициллином/клавуланатом, эффективность которого недавно была доказана в контролированных клинических исследованиях [9].
При хроническом среднем отите антибактериальная терапия играет вторичную роль по сравнению с местной санацией и применением ототопических препаратов. Антибиотики целесообразно применять при неэффективности местной терапии, развитии яркой картины обострения и, что чрезвычайно важно, под контролем микробиологических данных, т.е. системная терапия должна быть этиотропной [10].
Наружный отит
При локализованных формах наружного отита основным возбудителем является золотистый стафилококк. В отдельных случаях может отмечаться рожистое воспаление с вовлечением ушной раковины и наружного слухового прохода, вызванное БГСА. От этих форм следует отличать острый диффузный наружный отит ("ухо пловца") и злокачественный наружный отит, которые почти всегда вызваны грамотрицательной микрофлорой и прежде всего синегнойной палочкой. При хроническом наружном отите обычно отмечается сопутствующий хронический средний отит. У таких пациентов необходимо исключить грибковую инфекцию (аспергиллы, кандида).
Системную антибактериальную терапию необходимо сочетать с местным лечением (гипертонические растворы, 2% раствор уксусной кислоты, 70-96% спирт, ототопические антибактериальные препараты). При стафилококковой природе отита назначают оксациллин, амоксициллин/клавуланат, пероральные цефалоспорины I – II поколения, ко-тримоксазол; при стрептококковой - феноксиметилпенициллин и макролиды.
При злокачественной форме назначают препарат с антисинегнойной активностью. Учитывая необходимость длительных курсов терапии (4-6 нед), обосновано назначение ступенчатой терапии ципрофлоксацином (первоначально внутривенно по 400 мг 2-3 раза в день с дальнейшим переходом на пероральный прием по 500-750 мг 2 раза в день).
Тонзиллофарингит
При выборе антибиотиков необходимо учитывать следующее: БГСА сохраняет чувствительность к пенициллину и к другим b- лактамным антибиотикам; в некоторых странах отмечается нарастание устойчивости к эритромицину и другим макролидам; отечественные данные о чувствительности БГСА, полученные международно признанными методами, очень ограничены.
Цели лечения фарингита, вызванного БГСА: уменьшение тяжести и длительности сохранения симптомов; профилактика гнойных осложнений, предотвращение распространения БГСА; снижение риска развития поздних осложнений - ревматизма и гломерулонефрита. Очевидно, что последняя цель является наиболее важной.
Ведущими препаратами для терапии тонзиллофарингита у детей и взрослых являются b- лактамные антибиотики, и прежде всего феноксиметилпенициллин, который применяется в обычной суточной дозе, однако не в 4 приема, как при других инфекциях, а в 2-3 приема. Несмотря на полную чувствительность пиогенного стрептококка к этому антибиотику, препарат нельзя признать идеальным для терапии, так как феноксиметилпенициллин необходимо принимать за 1 ч до или через 2 ч после еды, курс терапии составляет 10 дней, нередки случаи аллергических реакций. Кроме того, эрадикации возбудителя (самый важный показатель микробиологической эффективности) не удается достичь у 11-16% пациентов. Одним из факторов, объясняющих неполную эрадикацию, является наличие в глубинных слоях миндалин так называемых копатогенов - микроорганизмов, являющихся нормальными обитателями ротоглотки, – которые вырабатывают b- лактамазы, разрушающие пенициллин, ампициллин, амоксициллин. В связи этим возможны два дополнительных пути терапии: во-первых, применение антибиотиков других групп, прежде всего макролидов (эритромицин, спирамицин, рокситромицин, азитромицин, мидекамицин), причем при аллергии на пенициллины макролиды или линкосамиды являются препаратами первого ряда; во-вторых, использование b- лактамов, устойчивых к действию b- лактамаз. Это могут быть цефалоспорины II поколения (цефаклор, цефуроксим) или комбинации аминопенициллинов с ингибиторами b- лактамаз сульбактамом или клавуланатом (ампициллин/сульбактам или амоксициллин/клавуланат). Ингибитор-защищенные аминопенициллины чаще используются как препараты второго ряда при определенных ситуациях. Так, показаниями к применению амоксициллина/клавуланата являются рецидив тонзиллофарингита, возникновение тонзиллофарингита на фоне лечения пенициллином, макролидами.
Воспаление надгортанника и надглоточных структур – редкое, но тяжелое заболевание, которое чаще возникает у детей старше 2 лет. Наиболее частым возбудителем является гемофильная палочка типа Б, реже - БГСА. Учитывая опасность развития асфиксии, пациенты подлежат срочной госпитализации. Парентеральная антибактериальная терапия должна начинаться сразу же после постановки диагноза. Препаратами выбора являются ампициллин/сульбактам, цефалоспорины III поколения (цефотаксим, цефтриаксон).
Острый синусит
В данной статье мы коснемся только внебольничного острого синусита, другими словами, острого синусита, развившегося у амбулаторных больных, лечение которого может осуществляться как в поликлинических, так и в стационарных условиях. Важность отграничения этой формы синусита от хронического синусита и нозокомиального синусита у больных, находящихся на искусственной вентиляции легких, связана как с высокой частотой инфекции, так и с принципиальными различиями в этиологии, патогенезе и антибактериальной терапии.
Как показывают результаты компьютерной томографии, в большинстве случаев ОРВИ продолжительностью более 48 ч отмечается воспалительная реакция слизистой. Это связано с тем, что параназальные синусы выстланы слизистой, которая является продолжением слизистой полости носа. Окклюзия остиального отверстия вследствие гиперемии и отека ведет к нарушению дренажа синусов и вторичной инфекции. Таким образом, в большинстве случаев острый синусит развивается как осложнение острой респираторной вирусной инфекции, что отмечается у 2-5% пациентов с ОРВИ [11,12]. Другими предрасполагающими факторами являются механическая обструкция или аллергический ринит. Нередкая причина максиллярного синусита – одонтогенная инфекция.
Наиболее частые возбудители острого синусита – S.pneumoniae и H.influenzae, гораздо реже выделяются M.catarrhalis , стафилококки, неспорообразующие анаэробы. Такие результаты получают во всем мире при корректно проведенном микробиологическом исследовании, что подразумевает получение материала путем пункции синусов, посев материала на соответствующие среды (кровяной, шоколадный и анаэробный агары) и инкубацию при повышенном содержании CO 2 и в анаэробных условиях. Наши данные, полученные при исследовании пунктата максиллярных синусов у 85 пациентов, показывают, что бактериальные возбудители были выделены в 71% случаев. Ведущим возбудителем был S.pneumoniae, который был выделен у 53% пациентов, второе место занимали H.influenzae и неспорообразующие анаэробы [13].
Целью антибактериальной терапии острого синусита является подавление симптомов и сокращение продолжительности заболевания, уничтожение возбудителей, что уменьшает повреждение слизистой, ведущее к хронизации заболевания. Адекватная антибиотикотерапия также предупреждает развитие внутричерепных и орбитальных осложнений.
Традиционными препаратами для терапии острого синусита у взрослых были антибиотики для перорального приема: амоксициллин (в России - ампициллин), доксициклин, ко-тримоксазол. Однако, как отмечалось выше, такой выбор в современных условиях не всегда может привести к хорошим результатам. Это связано как с нарастанием устойчивости микрофлоры к этим препаратам, так и в случае ко-тримоксазола с недостаточной безопасностью. При этом следует помнить о таком очевидном преимуществе традиционных препаратов, как их низкая стоимость.
Оптимальными антибиотиками для лечения синуситов являются из пенициллинов - амоксициллин/клавуланат, из цефалоспоринов - цефуроксим аксетил, цефпрозил, цефтибутен, из макролидов - азитромицин, рокситромицин. Несмотря на имеющиеся в литературе рекомендации по применению фторхинолонов (офлоксацин, ципрофлоксацин), их следует рассматривать как препараты резерва. Это связано не только с их недостаточно высокой активностью против пневмококков, но и главным образом с тем, что эти препараты играют очень важную роль в лечении стационарных больных, в том числе находящихся в отделении интенсивной терапии. При подозрении на развитие внутричерепных или орбитальных осложнений следует немедленно назначить парентерально, лучше внутривенно, цефалоспорины III поколения (цефтриаксон - 2 г/сут однократно, цефотаксим - 6-8 г/сут в 3-4 введения).
Особенно активно следует проводить антибактериальную терапию у пожилых, у пациентов с нарушениями иммунитета и при развитии орбитальных или внутричерепных осложнений. Необходимо назначать один из антибиотиков, активных против пенициллинрезистентных пневмококков и b- лактамазаположительных штаммов гемофильной палочки: амоксициллин/клавула
Ключевые слова: инфекционно-воспалительные заболевания верхних дыхательных путей, осложнения, хронический риносинусит, хронический тонзиллофарингит, бактериальные лизаты, Исмиген®.
Для цитирования: Кривопалов А.А., Рязанцев С.В., Шаталов В.А., Шервашидзе С.В. Эффективность бактериальных иммуностимуляторов в терапии и профилактике инфекционно-воспалительных заболеваний ЛОР-органов. РМЖ. Медицинское обозрение. 2017;25(11):797-804.
Efficacy of bacterial immunostimulants in the therapy and prevention of infectious and inflammatory diseases of the ENT organs
Krivopalov A.A., Ryazantsev S.V., Shatalov V.A., Shervashidze S.V.
Saint-Petersburg Scientific and Research Institute of ear, throat, nose and speech
Key words: infectious-inflammatory diseases of the upper respiratory tract, complications, chronic rhinosinusitis, chronic tonsillopharyngitis, bacterial lysates, Ismigen®.
For citation: Krivopalov A.A., Ryazantsev S.V., Shatalov V.A., Shervashidze S.V. Efficacy of bacterial immunostimulants in the therapy and prevention of infectious and inflammatory diseases of the ENT organs // RMJ. 2017. № 11. P. 797–804.
Статья посвящена вопросам эффективности бактериальных иммуностимуляторов при инфекционно-воспалительных заболеваний ЛОР-органов
Введение
Цель исследования: оценка терапевтического и профилактического действия препарата Исмиген® на длительность и тяжесть обострения хронического риносинусита (ХРС) и хронического тонзиллофарингита (ХТФ) в эпидемиологический по ОРВИ сезон.
Материал и методы
Дизайн исследования
Статистический анализ. Первичными конечными точками исследования являлись частота, тяжесть и длительность обострений ХРС/ХТФ и ОРВИ за период наблюдения. Вторичными конечными точками служили необходимость и продолжительность дополнительной антибактериальной терапии у пациентов с ХРС/ХТФ (при его обострении) и ОРВИ.
Каждая из указанных конечных точек получала индивидуальную и комплексную статистическую оценку в аспекте наличия, степени и направления влияния на них предиктора – лечения препаратом Исмиген®. Оценена скорость лечебного эффекта в парных группах методом статистической оценки динамики жалоб и клинической картины заболевания при объективном осмотре пациентов. С целью повышения объективности и комплексности оценки жалоб пациентов, клинической картины заболевания баллы каждого из критериев визуально-аналоговой и клинической шкал (см. табл. 1–2) на всех визитах пациента к врачу суммировались и оценивались.
В качестве конечных точек и их предиктора рассматривались как категориальные (наличие или отсутствие изучаемого фактора/исхода), так и количественные (длительность обострений основного заболевания и ОРВИ, длительность дополнительной терапии лечения антибиотиками, сумма баллов визуально-аналоговой и клинической шкал) данные. Анализируемые параметры категориальных данных представлены в виде долей и частот от общего числа исследуемых (%), а количественных (непрерывных) данных – в виде групповых средних (M) и стандартного отклонения (SD).
Результаты множественного логистического регрессионного анализа представлены в виде отношения шансов (ОШ) реализации конечной точки в зависимости от факта приема препарата Исмиген®. ОШ выражает как степень, так и направление воздействия предиктора на вероятность реализации события. Так, если ОШ>1, это значит, что наличие предиктора повышает вероятность развития события в количество раз, равное самому ОШ. Если же ОШ Оценка скорости наступления лечебного эффекта в исследуемых группах пациентов выполнялась за счет сравнительной статистической оценки сумм баллов визуально-аналоговой и клинической шкал при последовательных 6 визитах пациентов к ЛОР-специалисту. Выявление различий между этапными наблюдениями в комплексе осуществлялось при помощи дисперсионного анализа для повторных измерений (One-way ANOVA) по типу простых плановых сравнений (Simple) относительно исходных показателей 1-го визита. Апостериорные попарные сравнения балльных показателей каждого из визитов (1–6-го) между собой (post hoc анализ) проводились по методу Bonferoni. Межгрупповое сравнение на уровне каждого из визитов проводилось с помощью U-критерия Mann – Whitney (рис. 2–5) [19]. При обработке данных использовался программный пакет SPSS 13,0 (SPSS Inc).
Результаты исследований
Все пациенты прошли обследование, лечение и наблюдение на протяжении 6 мес. в соответствии с протоколом, при удовлетворительной комплаентности.
Количество пациентов с легкими и среднетяжелыми формами обострения ХТФ в обеих группах сравнения было равным: статистические данные не различались в группе 1 (исследуемой) и группе 3 (контрольной) (р>0,05) (табл. 4). Результаты клинического анализа крови, выполненного пациентам, страдающим хроническим риносинуситом, до начала лечения и через 10/30 дней от начала лечения, демонстрировали выраженный клинический эффект в исследуемой группе (группа 1, получающая Исмиген®), проявляющийся снижением уровня лейкоцитов периферической крови (р>0,05) (см. табл. 4). Сравнительный анализ результатов рентгенологических исследований (рентгенография и компьютерная томография околоносовых пазух) демонстрировал более выраженный клинический эффект в исследуемой группе (группа 1, получающая Исмиген®), проявившийся восстановлением пневматизации околоносовых пазух у 15 (75%) обследуемых. В контрольной группе (группа 3 – стандартное лечение) констатировано отсутствие положительной динамики по данным рентгенологических исследований у 14 (70%) пациентов (р>0,05) (см. табл. 4).
При первичном обращении, после рандомизации, количество пациентов с легкими, среднетяжелыми и тяжелыми формами обострения ХТФ в обеих группах сравнения было равным: статистические данные не различались в исследуемой группе 2 и контрольной группе 4 (р>0,05) (табл. 5). Длительность и эффективность лечения ХТФ, диагностированного при первичном обращении, оценивалась на 10-е сутки (визит 2). На фоне проводимой терапии была зафиксирована положительная динамика жалоб и клинической картины заболевания у пациентов в обеих группах сравнения. На 10-е сутки от начала лечения, учитывая клинические данные, обострение ХТФ у всех обследуемых пациентов (n=60) было купировано. По течению заболевания (со слов пациента) была установлена длительность первичного обострения ХТФ в каждом конкретном клиническом случае. На основании этого были рассчитаны средние сроки длительности первичного обострения ХТФ в обеих группах: контрольная группа 4 (стандартное лечение) – 6,16±1,54 дня; исследуемая группа 2 (стандартное лечение + Исмиген®) – 4,77±1,25 дня.
Межгрупповые попарные сравнения балльных показателей на всех визитах выявили более быструю и равномерную положительную динамику в исследуемой группе 1 у пациентов, страдающих ХРС:
• согласно жалобам пациентов – начиная со 2-го визита;
• согласно клинической картине основного заболевания – начиная с 3-го визита (см. рис. 2, 3).
Межгрупповые попарные сравнения балльных показателей на всех визитах выявили более быструю и равномерную положительную динамику в исследуемой группе 2 у пациентов, страдающих ХТФ:
• согласно жалобам пациентов – начиная с 3-го визита;
• согласно клинической картине основного заболевания – начиная с 3-го визита (см. рис. 4, 5).
При оценке профилактического действия препарата Исмиген® были исследованы: среднее количество обострений ХРС/ХТФ и ОРВИ за период наблюдения, их средняя длительность и средняя продолжительность антибактериальной терапии, а также среднее количество дней, пропущенных на работе/учебе. Сравнительный анализ исследуемых параметров показал наиболее выраженный профилактический эффект в группах, получавших препарат Исмиген® (исследуемые группы 1 и 2). Разница значений всех исследуемых параметров, представленных в таблице 6, статистически достоверна.
Множественный логистический регрессионный анализ продемонстрировал следующее влияние лечения препаратом Исмиген® на конечные точки (табл. 7):
• снижение вероятности развития рецидивов ХРС/ХТФ и/или ОРВИ при назначении препарата ИСМИГЕН в 3,5 раза (Р=0,032);
• снижение вероятности развития среднетяжелых и тяжелых форм обострений ХРС/ХТФ и/или ОРВИ при назначении препарата ИСМИГЕН в 7,0 раз (Р=0,019);
• снижение вероятности потребности в дополнительной антибактериальной терапии рецидивов ХРС/ХТФ и/или ОРВИ при назначении препарата Исмиген® в 6,88 раз (Р=0,007).
Нежелательных реакций при использовании препарата Исмиген® в ходе проведенного исследования не зафиксировано.
Выводы
Препарат Исмиген®, включенный в стандартную терапию обострений ХРС и ХТФ, продемонстрировал высокую терапевтическую эффективность. В группе, получавшей Исмиген® (по сравнению с группой контроля, получавшей стандартное лечение), отмечалось снижение продолжительности обострений и более быстрая положительная динамика клинической картины заболевания в течение всего периода наблюдения.
Профилактический эффект в группах пациентов, получающих препарат Исмиген®, заключается в статистически достоверном (в сравнении с группой контроля, получающей стандартное лечение) снижении количества, средней продолжительности, тяжести обострений ХРС/ХТФ и ОРВИ, а также продолжительности антибактериальной терапии в течение 6 мес. наблюдения. Та же тенденция отмечается и в сроках временной нетрудоспособности и в количестве рабочих дней, пропущенных пациентами ввиду обострения ХРС/ХТФ и ОРВИ.
Результаты обработки клинического материала с использованием современных методов медицинской статистики позволили сделать вывод, что применение препарата Исмиген® достоверно понижает вероятность рецидивов обострения ХРС/ХТФ и ОРВИ, развития среднетяжелых и тяжелых форм заболевания, а также потребность в дополнительной антибактериальной терапии.
На основании проведенных исследований препарат Исмиген® может быть рекомендован для широкого клинического применения при острых и хронических воспалительных процессах ЛОР-органов на любой фазе развития заболевания, способствуя облегчению клинического течения респираторных инфекций, уменьшению частоты развития осложнений, обострений и хронизации патологического процесса. Препарат может применяться в сочетании со стандартным лечением. Для профилактики заболеваний показана монотерапия препаратом Исмиген®. Препарат характеризуется высокой степенью безопасности, удобством применения для пациента (1 раз в день) и низкой частотой нежелательных явлений.
Читайте также:

