Препараты при лечении туберкулеза у детей
Обновлено: 19.04.2024
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению? Какова роль фторхинолонов в лечении туберкулеза легких?
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению?
Какова роль фторхинолонов в лечении туберкулеза легких?
Таблица. Стандартные концентрации ПТП, используемые для выявления лекарственной устойчивости МБТ
Первый этап характеризуется проведением интенсивной насыщенной химиотерапии четырьмя-пятью ПТП в течение 2-3 месяцев, что ведет к подавлению размножающейся микобактериальной популяции, уменьшению ее количества и предотвращению развития лекарственной резистентности. На первом этапе используется комбинация препаратов, состоящая из изониазида, рифампицина, пиразинамида, стрептомицина и/или этамбутола.
Второй этап — менее интенсивной химиотерапии — проводится, как правило, двумя-тремя ПТП. Цель второго этапа — воздействие на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий. Здесь главной задачей является предупреждение размножения оставшихся микобактерий, а также стимуляция репаративных процессов в легких с помощью различных патогенетических средств и методов лечения.
Такой методический подход к лечению ЛЧТЛ позволяет к концу первого этапа комбинированной химиотерапии под непосредственным медицинским наблюдением абациллировать 100%, а к завершению всего курса лечения — закрыть каверны в легких у более чем 80% больных с впервые выявленным и рецидивным туберкулезом легких [5].
Намного сложнее вопрос о проведении этиотропного лечения второго варианта, к которому мы относим ЛУТЛ, вызванный лекарственно резистентными (ЛР) МБТ к одному и более ПТП и/или их сочетанию. Особенно тяжело протекает ЛУТЛ у больных с множественной ЛР МБТ к изониазиду и рифампицину, то есть к основным и самым эффективным ПТП. Поэтому поиск новых концептуальных путей повышения эффективности лечения ЛУТЛ и разработка современной методологии специфического воздействия на ЛР МБТ является одним из важнейших и приоритетных направлений современной фтизиатрии.
Развитие ЛР у МБТ к ПТП — одна из главных причин недостаточно эффективной этиотропной химиотерапии. Больные туберкулезом, выделяющие ЛР-штаммы МБТ, длительное время остаются бактериовыделителями и могут заражать окружающих ЛР-возбудителем. Чем больше число больных, выделяющих ЛР МБТ, тем выше риск распространения инфекции среди здоровых лиц и появления новых случаев заболевания туберкулезом с первичной резистентностью не только к основным, но и к резервным ПТП.
Феномен ЛР МБТ имеет важное клиническое значение. Существует тесная взаимосвязь количественных изменений микобактериальной популяции и изменения ряда биологических свойств МБТ, одним из которых является ЛР. В активно размножающейся бактериальной популяции всегда имеется небольшое количество ЛР-мутантов, которые практического значения не имеют, но по мере уменьшения бактериальной популяции под влиянием химиотерапии изменяется соотношение между количеством ЛР и устойчивых МБТ [5]. В этих условиях происходит размножение главным образом устойчивых МБТ, эта часть бактериальной популяции увеличивается. Следовательно, в клинической практике необходимо исследовать ЛР МБТ и результаты этого исследования сопоставлять с динамикой туберкулезного процесса в легких [5].
По определению экспертов ВОЗ [3], ЛУТЛ — это случай туберкулеза легких с выделением МБТ, резистентных к одному и более ПТП. По данным Центрального НИИ туберкулеза РАМН, у каждого второго впервые выявленного и ранее не леченного противотуберкулезными препаратами больного в мокроте выявлялись ЛР к ПТП МБТ, при этом у 27,7% из них наблюдалась устойчивость к двум основным противотуберкулезным препаратам — изониазиду и рифампицину. При хроническом фиброзно-кавернозном туберкулезе частота вторичной ЛР МБТ возрастает до 95,5%.
По нашему мнению, и это составляет основу нашей концепции, для повышения эффективности лечения туберкулеза, вызванного ЛР МБТ, необходимо в первую очередь использовать ускоренные методы выявления ЛР МБТ, что позволяет своевременно изменять режим химиотерапии.
Исследование лекарственной устойчивости МБТ в настоящее время возможно по прямому и непрямому методам.
Непрямой метод определения лекарственной чувствительности МБТ требует от 30 до 60, а иногда до 90 суток, ввиду того что вначале производится посев мокроты на твердые питательные среды и только после получения культуры МБТ производят ее пересев уже на среды с добавлением ПТП. При этом коррекция химиотерапии носит отсроченный характер, как правило, уже на конечном этапе интенсивной фазы химиотерапии.
В последнее время для ускоренного определения лекарственной устойчивости нами применялся радиометрический метод с использованием автоматической системы ВАСТЕС-460 ТВ (Becton Dickinson Diagnostic Systems, Sparks, MD), которая позволяет выявлять лекарственную резистентность МБТ на жидкой среде Middlebrook 7H10 через 6-8 дней.
Не менее важно правильное лечение впервые выявленных больных туберкулезом легких и применение современных режимов химиотерапии с использованием в начале лечения комбинации из четырех-пяти основных противотуберкулезных препаратов до получения результатов лекарственной устойчивости МБТ [2]. В этих случаях существенно повышается вероятность того, что даже при наличии первичной ЛР МБТ бактериостатическое действие окажут два или три химиопрепарата, к которым чувствительность сохранена. Именно несоблюдение фтизиатрами научно обоснованных комбинированных режимов химиотерапии при лечении впервые выявленных и рецидивных больных и назначение ими только трех ПТП является грубой врачебной ошибкой, что в конечном счете ведет к формированию наиболее трудно поддающейся лечению вторичной ЛР МБТ.
Наличие у больного туберкулезом легких ЛР МБТ существенно снижает эффективность лечения, приводит к появлению хронических и неизлечимых форм, а в ряде случаев и летальных исходов. Особенно тяжело протекают специфические поражения легких у больных с полирезистентными МБТ, которые обладают множественной ЛР, как минимум к изониазиду и рифампицину, т. е. к основным и самым активным противотуберкулезным препаратам. ЛР МБТ имеет не только чисто клиническое и эпидемиологическое, но и экономическое значение, так как лечение таких больных резервными ПТП обходится намного дороже, чем больных с чувствительными МБТ к основным химиопрепаратам.
В этих условиях расширение списка резервных ПТП, воздействующих на ЛР МБТ, является актуальным и крайне важным для повышения эффективности лечения больных с ЛУТЛ. Кроме того, присоединение к ЛУТЛ неспецифической бронхолегочной инфекции существенным образом утяжеляет течение специфического процесса в легких, требуя назначения дополнительных антибиотиков широкого спектра. В этом плане применение антибиотиков, воздействующих как на МБТ, так и на неспецифическую патогенную бронхолегочную микрофлору, является научнообоснованным и целесообразным.
В этом плане хорошо себя зарекомендовал в России такой препарат из группы фторхинолонов, как офлоксацин (таривид) [3]. Мы же свой выбор остановили на ломефлоксацине, как препарате, который еще не столь широко применяется при лечении туберкулеза и у которого, судя по имеющимся данным, практически не выявляются побочные эффекты и крайне редко формируется ЛР возбудителей инфекционных заболеваний [2].
Ломефлоксацин (максаквин) — антибактериальный препарат из группы фторхинолонов. Как и все представители производных оксихинолонкарбоновой кислоты, максаквин обладает высокой активностью против грамположительных (включая метициллин-устойчивые штаммы Staphylococcus aureus и Staphylococcus epidermidis) и грамотрицательных (включая Pseudomonas) микроорганизмов, в том числе по отношению к различным типам Micobacterium tuberculosis).
Механизм действия максаквина заключается в ингибировании хромосомной и плазмидной ДНК-гиразы, фермента, ответственного за стабильность пространственной структуры микробной ДНК. Вызывая деспирилизацию ДНК микробной клетки, максаквин ведет к гибели последней.
Максаквин обладает иным механизмом действия, нежели другие антибактериальные средства, поэтому к нему не существует перекрестной устойчивости с другими антибиотиками и химиотерапевтическими препаратами [2].
Основной целью настоящего исследования явилось изучение клинической и микробиологической эффективности максаквина при комплексном лечении больных деструктивным ЛУТЛ, выделяющих ЛР МБТ к изониазиду, рифампицину и другим ПТП, а также при сочетании туберкулеза с неспецифической бронхолегочной инфекцией.
Под наблюдением находилось 50 больных деструктивным ЛУТЛ, выделяющих с мокротой ЛР МБТ к изониазиду, рифампицину и ряду других ПТП. Эти люди в возрасте от 20 до 60 лет составили основную группу.
В контрольную группу вошли также 50 больных деструктивным ЛУТЛ легких в той же возрастной группе, выделяющие ЛР МБТ к изониазиду, рифампицину и другим ПТП. Эти пациенты лечились только протионамидом, амикацином, пиразинамидом и этамбутолом.
У 47 больных основной группы и 49 контрольной в мокроте микробиологическими методами были выявлены различные возбудители неспецифической бронхолегочной инфекции.
Среди больных основной группы диссеминированный туберкулез был установлен у 5 человек, инфильтративный — у 12, казеозная пневмония — у 7, кавернозный — у 7 и фиброзно-кавернозный туберкулез — у 17 человек. Большинство больных (45 пациентов) имели распространенный туберкулез легких с поражением более двух долей, у 34 больных был двусторонний процесс. У всех больных основной группы в мокроте были обнаружены МБТ, как методом микроскопии по Цилю — Нильсену, так и методом посева на питательные среды. При этом у них МБТ были устойчивы как минимум к изониазиду и рифампицину. Необходимо отметить, что все пациенты уже ранее неоднократно и неэффективно лечились основными ПТП, и специфический процесс у них приобрел рецидивирующий и хронический характер.
В клинической картине преобладали симптомы интоксикации с высокой температурой тела, потливостью, адинамией, изменениями в крови воспалительного характера, лимфопенией, увеличенной СОЭ до 40-50 мм в час. Следует отметить наличие грудных проявлений болезни — кашель с выделением мокроты, подчас значительного количества, слизисто-гнойной, а у половины больных — гнойной, с неприятным запахом. В легких выслушивались обильные катаральные явления по типу мелко-, средне-, а подчас и крупнопузырчатых влажных хрипов.
У большинства больных преобладали клинические проявления, которые скорее укладывались в картину неспецифического бронхолегочного поражения (бронхита, острой пневмонии, абсцедирования) с частыми и практически не стихающими обострениями.
Основным возбудителем неспецифической инфекции был Streptococcus hemoliticus — у 15,3% и Staphilococcus aureus — у 15% больных. Среди грамотрицательной микрофлоры преобладал Enterobacter cloacae в 7,6% случаев. Следует отметить высокую частоту ассоциации возбудителей неспецифической бронхолегочной инфекции.
МБТ были обнаружены у всех 50 больных. У 42 человек определялось обильное бактериовыделение. У всех пациентов выделенные штаммы МБТ были устойчивы к изониазиду и рифампицину. При этом у 31 больного лекарственная устойчивость МБТ к изониазиду и рифампицину сочеталась с другими ПТП.
Определение минимальной ингибирующей концентрации (МИК) максаквина проводили на лабораторных штаммах H37Rv и Academia, а также клинических штаммах (изолятах), выделенных от 30 больных, из которых 12 изолятов были чувствительны ко всем основным химиопрепаратам и 8 обладали резистентностью к изониазиду, рифампицину и стрептомицину. В опытах in vitro подавление роста лабораторных штаммов МБТ наблюдалось в зоне 57,6±0,04 до 61,8±0,02 мкн/мл, что почти в семь раз больше, чем показатели, характерные для остальных ПТП .
Таким образом, в ходе микробиологических исследований было установлено выраженное бактериологическое действие максаквина на МБТ, при этом более выраженный эффект наблюдался при его воздействии на лекарственно чувствительные штаммы и изоляты. Однако при повышенных концентрациях максаквина эффект также заметен при воздействии на полирезистентные МБТ, устойчивые к основным ППТ.
Лечение максаквином проводилось у всех 50 больных основной группы в разработанной нами комбинации с другими резервными препаратами: протионамидом, амикацином, пиразинамидом и этамбутолом.
Максаквин назначали в дозе 800 мг в сутки перорально однократно в утренние часы сразу вместе с другими противотуберкулезными препаратами для создания максимальной суммарной бактериостатической концентрации в крови и очагах поражения. Доза максаквина выбрана с учетом микробиологических исследований и соответствовала МИК, при которой отмечалось существенное подавление роста МБТ. Терапевтический эффект определяли через месяц — для оценки воздействия его на неспецифическую патогенную бронхолегочную микрофлору и через два месяца — для оценки воздействия на полирезистентные МБТ. Длительность курса лечения резервными химиопрепаратами в сочетании с максаквином составляла два месяца.
Через месяц комплексного лечения было отмечено значительное улучшение состояния больных основной группы, что проявлялось в уменьшении количества мокроты, кашля и катаральных явлений в легких, снижении температуры тела, при этом более чем у двух третей больных — до нормальных цифр.
У всех больных к этому сроку в мокроте перестал определяться рост вторичной патогенной бронхолегочной микрофлоры. К тому же у 34 больных значительно уменьшилась массивность выделения микобактерий туберкулеза. Практически у всех больных нормализовались анализы крови.
Следует отметить, что у 28 пациентов рентгенологически через месяц лечения максаквином в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом отмечалось частичное рассасывание специфических инфильтративных изменений в легких, а также существенное уменьшение перикавитарной воспалительной реакции. Это позволило применить на данном этапе искусственный пневмоторакс, который является обязательным методом в лечении ЛУТЛ и составляет вторую и не менее важную часть нашей концепции повышения эффективности лечения больных деструктивным туберкулезом легких, выделяющих полилекарственнорезистентные МБТ.
При анализе эффективности специфического действия комбинации резервных противотуберкулезных препаратов в сочетании с максаквином на полирезистентные МБТ при лечении 50 больных основной группы мы делали основной акцент на показатель прекращения бактериовыделения, как по микроскопии мокроты по Цилю — Нильсену, так и по посеву на питательные среды через два месяца после химиотерапии.
Анализ частоты прекращения бактериовыделения у больных основной и контрольной группы через два месяца лечения показал, что у пациентов, получавших максаквин в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом, прекращение бактериовыделения было достигнуто в 56% случаях. В контрольной группе больных, не получавших максаквина, — только в 30% случаев.
Следует отметить, что у остальных больных основной группы за этот период времени существенно уменьшилась массивность выделения МБТ.
Инволюция локальных изменений в легких у 50 больных контрольной группы также шла более замедленными темпами, и только у 25 больных к концу второго месяца удалось достичь частичного рассасывания перикавитарной инфильтрации и применить к ним искусственный пневмоторакс. К 39 из 50 пациентов основной группы был применен искусственный пневмоторакс в течение 1,5-2 месяцев, и 17 из них удалось достигнуть закрытия каверн в легких. 11 оставшихся больных, имеющих противопоказания к проведению искусственного пневмоторакса, в этот период были подготовлены к плановому оперативному вмешательству.
При определении лекарственной устойчивости МБТ к максаквину через два месяца лечения у больных основной группы только в 4% случаев была получена вторичная лекарственная устойчивость, сформировавшаяся в процессе двухмесячной химиотерапии, что в конечном итоге потребовало его отмены и замены на другой химиопрепарат, к которому МБТ сохранили свою чувствительность.
К концу второго месяца у 4% больных отмечались явления непереносимости максаквина — в виде диспепсических явлений и диареи, связанной с дисбактериозом, аллергических кожных проявлений и эозинофилии до 32%, что привело к полной отмене препарата. Во всех остальных случаях при двухмесячном ежедневном применении максаквина в суточной дозе 800 мг побочных явлений не отмечалось.
Проведенная после окончания курса лечения максаквином комбинированная химиотерапия резервными препаратами и динамическое наблюдение за этими же больными показали, что достигнутый ко второму месяцу положительный результат в абациллировании мокроты оказал положительное влияние и на конечный результат излечения больных с ЛУТЛ.
Таким образом, применение максаквина в дозе 800 мг в сутки в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом у больных деструктивным ЛУТЛ с сопутствующей неспецифической бронхолегочной инфекцией показало его достаточную эффективность как антибиотика широкого спектра, воздействующего на грамотрицательную и грамположительную микрофлору, и препарата, действующего на туберкулезное воспаление.
Максаквин с полной уверенностью может быть отнесен к группе резервных ПТП. Он эффективно действует не только на МБТ, чувствительные ко всем ПТП, но и на ЛУ МБТ к изониазиду и рифампицину, что и обусловливает целесообразность его назначения таким больным. Тем не менее максаквин не следует рассматривать как основной препарат в схемах лечения больных с впервые выявленным туберкулезом легких, он должен оставаться в резерве и применяться только при ЛУТЛ и сопутствующей неспецифической бронхолегочной инфекции.
Для изониазида это составляет 1 мкг/мл, для рифампицина — 40 мкг/мл, стрептомицина — 10 мкг/мл, этамбутола — 2 мкг/мл, канамицина — 30 мкг/мл, амикацина — 8 мкг/мл, протионамида (этионамида) — 30 мкг/мл, офлоксацина (таривида) — 5 мкг/мл, циклосерина — 30 мкг/мл и для пиразинамида — 100 мкг/мл.
Литература
1. Лечение туберкулеза. Рекомендации для национальных программ. ВОЗ. 1998. 77 с.
2. Мишин. В. Ю., Степанян И. Э. Фторхинолоны в лечении туберкулеза органов дыхания // Русский медицинский журнал. 1999. № 5. С. 234-236.
3. Рекомендации по лечению резистентных форм туберкулеза. ВОЗ. 1998. 47 с.
4. Хоменко А. Г., Мишин В. Ю., Чуканов В. И. и др. Эффективность применения офлоксацина в комплексном лечении больных туберкулезом легких, осложненным неспецифической бронхолегочной инфекцией // Новые лекарственные препараты. 1995. Вып. 11. С. 13-20.
5. Хоменко А. Г. Современная химиотерапия туберкулеза // Клиническая фармакология и терапия. 1998. № 4. С. 16-20.
Туберкулез легких – это инфекционная патология, вызываемая бациллой Коха, характеризующаяся различными в клинико-морфологическом отношении вариантами поражения легочной ткани. Многообразие форм туберкулеза легких обусловливает вариабельность симптоматики. Наиболее типичны для туберкулеза легких респираторные нарушения (кашель, кровохарканье, одышка) и симптомы интоксикации (длительный субфебрилитет, потливость, слабость). Для подтверждения диагноза используются лучевые, лабораторные исследования, туберкулинодиагностика. Химиотерапия туберкулеза легких проводится специальными туберкулостатическими препаратами; при деструктивных формах показано хирургическое лечение.
МКБ-10

Общие сведения
На сегодняшний день туберкулез легких представляет не только медико-биологическую, но и серьезную социально-экономическую проблему. По данным ВОЗ, туберкулезом инфицирован каждый третий житель планеты, смертность от инфекции превышает 3 млн. человек в год. Легочный туберкулез является самой частой формой туберкулезной инфекции. Удельный вес туберкулеза других локализаций (суставов, костей и позвоночника, гениталий, кишечника, серозных оболочек, ЦНС, глаз, кожи) в структуре заболеваемости значительно ниже.

Причины
Характеристика возбудителя
Отличительной чертой МБТ является их высокая устойчивость к внешним воздействиям (высоким и низким температурам, влажности, воздействию кислот, щелочей, дезинфектантов). Наименьшую стойкость возбудители туберкулеза легких демонстрируют к солнечному свету. Для человека опасность представляют туберкулезные бактерии человеческого и бычьего типа; случаи инфицирования птичьим типом микобактерий крайне редки.
Пути заражения
Основной путь заражения при первичном туберкулезе легких – аэрогенный: от больного открытой формой человека микобактерии распространяются с частичками слизи, выделяемыми в окружающую среду при разговоре, чихании, кашле; могут высыхать и разноситься с пылью на значительные расстояния. В дыхательные пути здорового человека инфекция чаще попадает воздушно-капельным или пылевым путем.
Меньшую роль в инфицировании играют алиментарный (при употреблении зараженных продуктов), контактный (при использовании общих предметов гигиены и посуды) и трансплацентарный (внутриутробный) пути. Причиной вторичного туберкулеза легких выступает повторная активация ранее перенесенной инфекции либо повторное заражение.
Факторы риска
Однако попадание МБТ в организм не всегда приводит к заболеванию. Факторами, на фоне которых туберкулез легких развивается особенно часто, считаются:
- неблагоприятные социально-бытовые условия
- курение и другие химические зависимости
- недостаточное питание
- иммуносупрессия (ВИЧ-инфекция, прием глюкокортикоидов, состояние после трансплантации органов)
- онкологические заболевания и др.
В группе риска по развитию туберкулеза легких находятся мигранты, заключенные, лица, страдающие наркотической и алкогольной зависимостью. Также имеет значение вирулентность инфекции и длительность контакта с больным человеком.
Патогенез
При снижении местных и общих факторов защиты микобактерии беспрепятственно проникают в бронхиолы, а затем в альвеолы, вызывая специфическое воспаление в виде отдельных или множественных туберкулезных бугорков или очагов творожистого некроза. В этот период появляется положительная реакция на туберкулин - вираж туберкулиновой пробы. Клинические проявления туберкулеза легких на этой стадии часто остаются нераспознанными. Небольшие очажки могут самостоятельно рассасываться, рубцеваться или обызвествляться, однако МБТ в них длительно сохраняются.
Классификация
Первичный туберкулез легких - это впервые развившаяся инфильтрация легочной ткани у лиц, не имеющих специфического иммунитета. Диагностируется преимущественно в детском и подростковом возрасте; реже возникает у лиц старшего и пожилого возраста, которые в прошлом перенесли первичную инфекцию, закончившуюся полным излечением. Первичный туберкулез легких может принимать форму:
- первичного туберкулезного комплекса (ПТК)
- туберкулеза внутригрудных лимфоузлов (ВГЛУ)
- хронически текущего туберкулеза.
Вторичный туберкулез легких развивается при повторном контакте с МБТ или в результате реактивации инфекции в первичном очаге. Основные вторичные клинические формы представлены:
Отдельно различают кониотуберкулез (туберкулез, развивающийся на фоне пневмокониозов), туберкулез верхних дыхательных путей, трахеи, бронхов; туберкулезный плеврит. При выделении больным МБТ в окружающую среду с мокротой говорят об открытой форме (ВК+) туберкулеза легких; при отсутствии бацилловыделения – о закрытой форме (ВК–). Также возможно периодическое бацилловыделение (ВК±).
Течение туберкулеза легких характеризуется последовательной сменной фаз развития:
- 1) инфильтративной
- 2) распада и обсеменения
- 3) рассасывания очага
- 4) уплотнения и обызвествления.
Симптомы туберкулеза легких
Первичный туберкулезный комплекс
Первичный туберкулезный комплекс сочетает в себе признаки специфического воспаления в легком и регионарный бронхоаденит. Может протекать бессимптомно или под маской простудных заболеваний, поэтому выявлению первичного туберкулеза легких способствуют массовые скрининги детей (проба Манту) и взрослых (профилактическая флюорография).
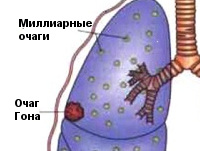
Чаще возникает подостро: больного беспокоит сухой кашель, субфебрилитет, утомляемость, потливость. При острой манифестации клиника напоминает неспецифическую пневмонию (высокая лихорадка, кашель, боль в груди, одышка). В результате лечения происходит рассасывание или обызвествление ПТК (очаг Гона). В неблагоприятных случаях может осложняться казеозной пневмонией, образованием каверн, туберкулезным плевритом, милиарным туберкулезом, диссеминацией микобактерий с поражением почек, костей, мозговых оболочек.
Туберкулез внутригрудных лимфоузлов
Признаки туберкулезной интоксикации включают отсутствие аппетита, снижение массы тела, утомляемость, бледность кожи, темные круги под глазами. На венозный застой в грудной полости может указывать расширение венозной сети на коже грудной клетки. Данная форма нередко осложняется туберкулезом бронхов, сегментарными или долевыми ателектазами легких, хронической пневмонией, экссудативным плевритом. При прорыве казеозных масс из лимфоузлов через стенку бронхов могут формироваться легочные очаги туберкулеза.
Очаговый туберкулез легких
Клиническая картина очагового туберкулеза малосимптомна. Кашель отсутствует или возникает редко, иногда сопровождается выделением скудной мокроты, болями в боку. В редких случаях отмечается кровохарканье. Чаще больные обращают внимание на симптомы интоксикации: непостоянный субфебрилитет, недомогание, апатию, пониженную работоспособность. В зависимости от давности туберкулезного процесса различают свежий и хронический очаговый туберкулез легких.
Течение очагового туберкулеза легких относительно доброкачественное. У больных с нарушенной иммунной реактивностью заболевание может прогрессировать в деструктивные формы туберкулеза легких.
Инфильтративный туберкулез легких
Клиническая картина инфильтративного туберкулеза легких зависит от величины инфильтрата и может варьировать от нерезко выраженных симптомов до острого лихорадочного состояния, напоминающего грипп или пневмонию. В последнем случае отмечается выраженная высокая температура тела, ознобы, ночная потливость, общая слабость. Со стороны органов дыхания беспокоит кашель с мокротой и прожилками крови.
В воспалительный процесс при инфильтративной форме туберкулеза легких часто вовлекается плевра, что обусловливает появление болей в боку, плеврального выпота, отставание пораженной половины грудной клетки при дыхании. Осложнениями инфильтративного туберкулеза легких могут стать казеозная пневмония, ателектаз легкого, легочное кровотечение и др.
Диссеминированный туберкулез легких
Может манифестировать в острой (милиарной), подострой и хронической форме. Тифоидная форма милиарного туберкулеза легких отличается преобладанием интоксикационного синдрома над бронхолегочной симптоматикой. Начинается остро, с нарастания температуры до 39-40 °С, головной боли, диспепсических расстройств, резкой слабости, тахикардии. При усилении токсикоза может возникать нарушение сознания, бред.
При легочной форме милиарного туберкулеза легких с самого начала более выражены дыхательные нарушения, включающие сухой кашель, одышку, цианоз. В тяжелых случаях развивается острая сердечно-легочная недостаточность. Менингеальной форме соответствуют симптомы поражения мозговых оболочек.
Подострое течение диссеминированного туберкулеза легких сопровождается умеренной слабостью, понижением работоспособности, ухудшением аппетита, похуданием. Эпизодически возникают подъемы температуры. Кашель продуктивный, не сильно беспокоит больного. Иногда первым признаком заболевания становится легочное кровотечение.
Хронический диссеминированный туберкулез легких при отсутствии обострения бессимптомен. Во время вспышки процесса клиническая картина близка к подострой форме. Диссеминированный туберкулеза легких опасен развитием внелегочного туберкулеза, спонтанного пневмоторакса, тяжелых легочных кровотечений, амилоидоза внутренних органов.
Кавернозный и фиброзно-кавернозный туберкулез легких
Характер течения кавернозного туберкулезного процесса волнообразный. В фазу распада нарастают интоксикационные симптомы, гипертермия, усиливается кашель и увеличивается количество мокроты, возникает кровохарканье. Часто присоединяется туберкулез бронхов и неспецифический бронхит.
Фиброзно-кавернозный туберкулез легких отличается формированием каверн с выраженным фиброзным слоем и фиброзными изменениями легочной ткани вокруг каверны. Протекает длительно, с периодическими обострениями общеинфекционной симптоматики. При частых вспышках развивается дыхательная недостаточность II-III степени.
Осложнениями, связанными с деструкцией легочной ткани, являются профузное легочное кровотечение, бронхоплевральный свищ, гнойный плеврит. Прогрессирование кавернозного туберкулеза легких сопровождается эндокринными расстройствами, кахексией, амилоидозом почек, туберкулезным менингитом, сердечно-легочной недостаточностью – в этом случае прогноз становится неблагоприятным.
Цирротический туберкулез легких
Является исходом различных форм туберкулеза легких при неполной инволюции специфического процесса и развитии на его месте фиброзно-склеротических изменений. При пневмоциррозе бронхи деформированы, легкое резко уменьшено в размерах, плевра утолщена и нередко обызвествлена.
Изменения, происходящие при цирротическом туберкулезе легких, обусловливают ведущие симптомы: выраженную одышку, тянущую боль в груди, кашель с гнойной мокротой, кровохарканье. При обострении присоединятся признаки туберкулезной интоксикации и бацилловыделение. Характерным внешним признаком пневмоцирроза служит уплощение грудной клетки на стороне поражения, сужение и втянутость межреберных промежутков. При прогрессирующем течении постепенно развивается легочное сердце. Цирротические изменения в легких необратимы.
Туберкулома легкого
Представляет собой инкапсулированный казеозный очаг, сформировавшийся в исходе инфильтративного, очагового или диссеминированного процесса. При стабильном течении симптомы не возникают, образование выявляется при рентгенографии легких случайно. В случае прогрессирующей туберкуломы легкого нарастает интоксикация, появляется субфебрилитет, боль в груди, кашель с отделением мокроты, возможно кровохарканье. При распаде очага туберкулома может трансформироваться в кавернозный или фиброзно-кавернозный туберкулез легких. Реже отмечается регрессирующее течение туберкуломы.
Диагностика
Диагноз той или иной формы туберкулеза легких выставляется врачом-фтизиатром на основании совокупности клинических, лучевых, лабораторных и иммунологических данных. Для распознавания вторичного туберкулеза большое значение имеет подробный сбор анамнеза. Для подтверждения диагноза проводится:
- Лучевая диагностика.Рентгенография легких является обязательным диагностической процедурой, позволяющей выявить характер изменений в легочной ткани (инфильтративный, очаговый, кавернозный, диссеминированный и т. д.), определить локализацию и распространенность патологического процесса. Выявление кальцинированных очагов указывает на ранее перенесенный туберкулезный процесс и требует уточнения данных с помощью КТ или МРТ легких.
- Анализы. Обнаружение МБТ достигается неоднократным исследованием мокроты (в т. ч. с помощью ПЦР), промывных вод бронхов, плеврального экссудата. Но сам по себе факт отсутствия бацилловыделения не является основанием для исключения туберкулеза легких. Современные иммунологические тесты позволяют выявить туберкулезную инфекцию почти со 100%-ной вероятностью. К ним относятся QuantiFERON и Т-спот. ТБ.
- Туберкулинодиагностика. К методам туберкулинодиагностики относятся диаскин-тест, пробы Пирке и Манту, однако сами по себе данные методы могут давать ложные результаты. Иногда для подтверждения туберкулеза легких приходится прибегать к пробному лечению противотуберкулезными препаратами с оценкой динамики рентгенологической картины.
По результатам проведенной диагностики туберкулез легких дифференцируют с пневмонией, саркоидозом легких, периферическим раком легкого, доброкачественными и метастатическими опухолями, пневмомикозами, кистами легких, абсцессом, силикозом, аномалиями развития легких и сосудов. Дополнительные методы диагностического поиска могут включать бронхоскопию, плевральную пункцию, биопсию легкого.

Лечение туберкулеза легких
Во фтизиатрической практике сформировался комплексный подход к лечению туберкулеза легких, включающий медикаментозную терапию, при необходимости - хирургическое вмешательство и реабилитационные мероприятия. Лечение проводится поэтапно: сначала в тубстационаре, затем в санаториях и, наконец, амбулаторно. Режимные моменты требуют организации лечебного питания, физического и эмоционального покоя.
- Противотуберкулезная терапия. Ведущая роль отводится специфической химиотерапии с помощью препаратов с противотуберкулезной активностью. Для терапии различных форм туберкулеза легких разработаны и применяются 3-х, 4-х и 5-тикомпонентные схемы (в зависимости от количества используемых препаратов). К туберкулостатикам первой линии (обязательным) относятся изониазид и его производные, пиразинамид, стрептомицин, рифампицин, этамбутол; средствами второго ряда (дополнительными) служат аминогликозиды, фторхинолоны, циклосерин, этионамид и др. Способы введения препаратов различны: перорально, внутримышечно, внутривенно, эндобронхиально, внутриплеврально, ингаляторно. Курсы противотуберкулезной терапии проводят длительно (в среднем 1 год и дольше).
- Патогенетическая терапия. При туберкулезе легких включает прием противовоспалительных средств, витаминов, гепатопротекторов, инфузионную терапию и пр. В случае лекарственной резистентности, непереносимости противотуберкулезных средств, при легочных кровотечениях используется коллапсотерапия.
- Хирургическое лечение. При соответствующих показаниях (деструктивных формах туберкулеза легких, эмпиеме, циррозе и ряде др.) применяются различные оперативные вмешательства: кавернотомию, торакопластику, плеврэктомию, резекцию легких.
Профилактика
Профилактика туберкулеза легких является важнейшей социальной проблемой и приоритетной государственной задачей. Первым шагом на этом пути является обязательная вакцинация новорожденных, детей и подростков. При массовых обследованиях в дошкольных и школьных учреждениях используется постановка внутрикожных туберкулиновых проб Манту. Скрининг взрослого населения осуществляется путем проведения профилактической флюорографии.
Эпидемическая ситуация, связанная с распространением туберкулеза в России, в настоящее время продолжает оставаться одной из важных социальных медицинских проблем, особенно в педиатрической практике.
Эпидемическая ситуация, связанная с распространением туберкулеза в России, в настоящее время продолжает оставаться одной из важных социальных медицинских проблем, особенно в педиатрической практике. Поэтому для детей, больных туберкулезом или входящих в группу риска, чрезвычайно важно проведение наряду с химиотерапией и химиопрофилактикой и комплексного этиопатогенетического лечения [2, 5, 7].
Среди многообразных нарушений физиологических процессов при туберкулезе — нарушение функции печени. При туберкулезе печень работает с большей перегрузкой, вследствие массового уничтожения микобактерий туберкулеза (МБТ) и нейтрализации продуктов их обмена. Под влиянием токсинов МБТ в большей или меньшей степени выявляются нарушения белкового, углеводного и ферментативного обмена.
Одним из грозных осложнений химиотерапии туберкулеза являются медикаментозные поражения печени. Известно, что основные противотуберкулезные препараты (ПТП) (изониазид, пиразинамид и рифампицин) обладают гепатотоксическим действием и приводят к развитию токсического гепатита, а при их комбинированном применении усиливается токсический эффект, который наиболее часто возникает при сочетании препаратов с рифампицином или его аналогами. Значительный рост остропрогрессирующих и распространенных форм туберкулеза у детей, а также увеличение числа случаев полирезистентных форм МБТ вынуждают использовать в химиотерапии комбинацию из 5–6 препаратов, что также ведет к развитию токсического гепатита [1, 2, 3].
Под воздействием этих препаратов часто развиваются токсические реакции, сопровождающиеся появлением желтухи, ухудшением общего самочувствия, снижением аппетита, тошнотой, рвотой, увеличением размеров печени, появлением болей в правом подреберье, нарушением пищеварения, ухудшением биохимических показателей крови.
Между тем по литературным и статистическим данным известно, что более 30% детей до начала терапии ПТП уже имеют сопутствующую патологию со стороны желудочно-кишечного тракта (ЖКТ), печени, желчевыводящих путей или имеют в анамнезе перенесенные вирусные гепатиты. В патогенезе острых и хронических вирусных гепатитов лежит синдром цитолиза, который приводит к повышению проницаемости печеночно-клеточных мембран, к потере биологически активных веществ, к потере ферментов и, как следствие, к нарушению всех видов обмена. Все это приводит к нарушению внешнесекреторной функции печени, изменению нормального процесса пищеварения, нарушению желчеобразующей и желчевыделяющей функции [2, 4, 6].
Вышеизложенные данные создают определенные трудности при назначении ПТП. В связи с этим весьма актуальным является поиск методов профилактики гепатотоксических реакций у детей, получающих ПТП. Одним из способов защиты печени от токсических реакций является включение гепатопротекторов (Эссенциале, Сирепар, Карсил, Урсосан, ЛИВ.52) и желчегонных средств.
ЛИВ.52 оказывает достаточно выраженный гепатопротективный эффект: снижает застойные явления и устраняет воспаление печени, стимулирует процесс регенерации гепатоцитов, усиливает внутриклеточный обмен, уменьшает дегенеративные, жировые и фиброзные изменения, стимулирует биосинтез белков и фосфолипидов. Оказывает защитное действие против перекисного окисления липидов, благодаря повышению уровня токоферолов (антиоксидантов) печеночной клетки. Защищает эндоплазматический ретикулюм клеток печени, активизирует активность печеночных микросомальных ферментативных систем, повышает уровень цитохрома Р-450, играющего важную роль в метаболизме лекарственных средств и детоксикации ядов [5].
Актуально использование данного препарата как в лечении сопутствующей патологии печени, такой как острый и хронический вирусный гепатит, дискинезии желчного пузыря, так и при медикаментозных поражениях печени. ЛИВ.52 — это комплексный лекарственный препарат, в состав которого входит тысячелистник обыкновенный, паслен черный, цикорий обыкновенный, дымянка лекарственная, кассия западная, терминалия арджуна, тамарикс гальский, тиноспора сердцелистная, оксид железа [1, 8].
Материалы и методы исследования
Целью данной работы была оценка эффективности препарата ЛИВ.52 в профилактике гепатотоксических реакций у детей, больных туберкулезом как с поражением, так и без патологии печени, получающих противотуберкулезную терапию.
Нами были поставлены следующие задачи:
Определить состояние печени в процессе лечения детей, получающих специфическую терапию в комплексе с ЛИВ.52.
Изучить переносимость и эффективность препарата ЛИВ.52 в профилактике гепатотоксических реакций у детей, больных туберкулезом.
Оценить эффективность применения ЛИВ.52 у детей с распространенными и осложненными туберкулезными процессами, с наличием лекарственно-устойчивых штаммов МБТ.
Под наблюдением находилось 150 детей, которые были разделены на 2 группы: 1 группа из 100 детей, получающих специфическую терапию и ЛИВ.52 (из них — 18 детей с поражением печени и 82 ребенка без патологии печени); контрольная группа из 50 детей без патологии печени, получающих специфические химиопрепараты, без назначения ЛИВ.52.
Все дети, больные туберкулезом, до назначения ЛИВ.52 подвергались тщательному клиническому обследованию, включающему в себя сбор жалоб, сбор данных анамнеза жизни, заболевания; объективному осмотру и общеклиническим и лабораторным методам исследования: общие анализы крови, мочи, биохимические исследования крови. У детей с сопутствующей патологией печени и желчевыводящих путей с особым вниманием наблюдали за аппетитом ребенка, режимом и характером питания, переносимостью тех или иных продуктов питания и аллергическими реакциями, болями в животе, частыми запорами или поносами.
Продолжительность курса лечения составила 3 месяца, все данные фиксировались в истории болезни. Для оценки эффективности препарата ЛИВ.52 в динамике лечения проводились комплексные наблюдения за объективным статусом ребенка среди детей обеих групп (оценка общего состояния, состояния кожных покровов, размеров печени), общеклинические исследования крови, мочи (стандартными методами), изучались состояния ЖКТ (тошнота, рвота, горечь во рту, тяжесть и боль в правом подреберье, анорексия). Также в динамике проводилось биохимическое исследование крови с определением содержания белка (альбумина и глобулиновых фракций) билирубина, холестерина, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), тимоловой пробы 1 раз в месяц. При возникновении гепатотоксической реакции контроль над сроком ее исчезновения проводили 1 раз в 10 дней.
Несомненно, основным методом обследования детей для изучения состояния печени в процессе лечения в настоящее время стал ультразвуковой метод исследования (УЗИ), который по сравнению с другими методиками имеет определенные преимущества — отсутствие лучевой нагрузки, высокая информативность, неинвазивный метод обследования. УЗИ отражает в основном анатомическую структуру органа (форму, контур, размер, эхогенность, посторонние включения, новообразования и т. д.). Поэтому всем детям, больным туберкулезом с поражением и без патологии печени, получающим лечение химиопрепаратами, проводилось УЗИ органов брюшной полости и печени 1 раз в 3 месяца, при выявлении патологии — по показаниям.
В 1 группе из 100 детей под наблюдением находилось 18 детей с патологией печени в анамнезе; у всех наблюдались выраженные симптомы интоксикации, как по основному процессу, так и в связи с сопутствующей патологией печени. У 6 детей в анамнезе был перенесенный вирусный гепатит (ВГ): ВГА — у 2 детей, ВГВ — у 3 детей, ВГС — у 1 ребенка; также у этих детей наблюдалось наличие в крови НВsAg антигена. У 12 детей (ранее получивших лечение до поступления в институт) отмечались явления токсического гепатита. Из всех 18 детей с активным туберкулезом легких в сочетании с патологией печени — у 11 детей (в 61,1% случаев) отмечалось увеличение размеров печени на 2–3 см, с умеренной или выраженной болезненностью при пальпации в области правого подреберья. Жалобы были на снижение аппетита, тошноту, иногда на рвоту после приема пищи и химиопрепаратов.
Несмотря на поражение печени, всем больным детям назначалось полноценное специфическое химиотерапевтическое лечение 4 антибактериальными препаратами в сочетании с гепатопротектором ЛИВ.52. Особое внимание нами было уделено диетотерапии с содержанием достаточного количества растительной клетчатки, растительных жиров с содержанием в них полиненасыщенных жирных кислот, необходимых для обменных процессов в печени, и продуктов, стимулирующих отток желчи.
На фоне комплексного лечения отмечалось улучшение общего состояния, уменьшение симптомов как туберкулезной, так и печеночной интоксикации, повышение аппетита. Нормализация размеров печени отмечена: через 1 мес в 16% случаев, через 2 мес — 41%, через 3 мес — у 100% детей.
Патологические изменения в биохимических показателях крови до начала лечения ЛИВ.52 (повышение общего билирубина, трансаминаз, тимоловой проб, повышение уровня щелочной и кислой фосфатаз) отмечались в 72,2% случаев.
Нормализация биохимических показателей крови отмечена через 1 мес — в 23% случаев, через 2 мес — в 67% случаев, к концу 3-го мес — достигнута в 100% случаев. Дополнительным подтверждением эффективности препарата ЛИВ.52 является и более быстрая нормализация аминотрансфераз на 3–4 неделе лечения, т. е. купирование синдрома цитолиза, характерного для токсического гепатита. Это обусловлено его стимулирующим действием на регенерацию гепатоцитов, мембраностабилизирующим действием, что особенно ценно при длительной противотуберкулезной терапии. Отмечалось снижение активности щелочной и кислой фосфатаз, что свидетельствует о нормализации функциональной активности печени и функции желчеобразования.
По данным УЗИ детей с патологией печени, особенно после перенесенных вирусных гепатитов, у 4 детей (22,2% случаев) — усиление эхогенности печени за счет внутриклеточного холестаза, а также густой осадок в желчном пузыре. Ликвидация этих явлений зафиксирована у всех детей, получивших ЛИВ.52, на 5–6 неделе лечения. Также у 11 детей с увеличением печени отмечались изменения ультразвуковой картины печени в виде повышения плотности, увеличения размеров и выраженности стенок желчных протоков. При контроле за исчезновением изменений в области печени УЗИ проводилось 1 раз в 10 дней, нормализация показателей отмечалась через 3–4 недели лечения.
Таким образом, у детей с туберкулезом в сочетании с патологией печени включение в комплексную химиотерапию и гепатопротектора ЛИВ.52 приводило к более быстрой и благоприятной динамике клинико-лабораторных показателей и позволяло проводить полноценное лечение туберкулезного процесса.
В 1 группе детей с туберкулезом легких, но без патологии печени (82 ребенка), дети также получали наряду с химиопрепаратами гепатопротектор ЛИВ.52 с целью профилактики токсических реакций со стороны печени. Более половины детей переносили специфическое лечение удовлетворительно, и никаких нарушений со стороны функционального состояния печени у них не отмечено. В процессе лечения только у 2 детей наблюдались жалобы на рвоту, тошноту, расстройство стула, связанные с погрешностью в диете.
Функциональные нарушения со стороны печени в процессе лечения отмечены у 18 (21,5%) детей. Эти нарушения характеризовались невыраженными симптомами печеночной интоксикации, жалобами на подташнивание после приема препаратов и незначительным снижением аппетита. Общее состояние ребенка при этом не страдало и оставалось удовлетворительным, увеличения печени не отмечалось. В биохимических показателях крови были выявлены незначительные повышения общего билирубина или трансаминаз. Одной из причин таких нарушений со стороны печени явился длительный прием рифампицина или одновременный прием изониазида, рифампицина и пиразинамида, при такой комбинации гепатотоксические реакции развивались достоверно чаще. Другой причиной был одновременный прием 5–6 ПТП с включением как основных (изониазид, пиразинамид и рифампицин), так и резервных препаратов (протионамид, аминосалициловая кислота, капреомицин и т. д.) у детей с лекарственно-устойчивым туберкулезом, особенно с высоким уровнем полирезистентности МБТ к ПТП (к 3–4-м и более препаратам).
В контрольной группе больных (50 детей), с активным туберкулезным процессом и не получающих ЛИВ.52 на фоне приема специфических антибактериальных препаратов, у детей в 30,0% случаев наблюдались расстройства со стороны ЖКТ в виде тошноты, рвоты, расстройства стула и снижения аппетита. В 26,0% случаев к окончанию лечения специфическими препаратами была выявлена патология со стороны желчевыводящих путей (дискинезия желчевыводящх путей, острый холецистит) и у 2 детей были выявлены признаки реактивного панкреатита.
Заключение
Вышеизложенное позволяет заключить, что своевременное выявление заболеваний печени и оптимальный подбор противотуберкулезных препаратов позволяют обеспечивать непрерывность терапии туберкулеза и достигать положительного эффекта в легких, а также стойкого восстановления функции печени при ее изменениях в анамнезе в течение от 1,5 до 2 месяцев. У детей с сопутствующей патологией печени гепатотоксические реакции развиваются чаще, чем у больных без таковых, однако проведение превентивной коррекции функции печени путем введения гепатопротектора ЛИВ.52 позволяет снизить частоту гепатотоксических реакций.
Гепатопротектор ЛИВ.52 способствует ускорению нормализации биохимических показателей крови (снижение показателей билирубина, трансаминаз и тимоловых проб до нормальных величин). Снижение активности щелочной и кислой фосфатаз приводит к нормализации функциональной активности печени и функции желчеобразования.
ЛИВ.52 хорошо переносится детьми, не вызывает неприятных ощущений. Его защитное (антиоксидантное) действие при применении ПТП является благоприятным фоном для проведения адекватной химиотерапии у детей как с патологией печени, так и без патологии.
Таким образом, химиотерапия туберкулеза в комплексе с гепатопротекторами позволяет добиться желаемого эффекта при лечении туберкулеза у детей без токсических проявлений со стороны желудочно-кишечного тракта. Препарат ЛИВ.52 не проявляет токсичности, не оказывает побочных эффектов и способствует как профилактике, так и лечению гепатотоксических реакций и дает возможность проводить полноценное (без перерыва) специфическое лечение туберкулезного процесса.
Литература
Аксенова В. А., Мадасова В. Г., Муравьева Н. Н., Васюкова Н. С. Применение ЛИВ.52 в профилактике нежелательных гепатотоксических реакций при химиотерапии туберкулеза у детей и подростков.
Аюшева Л. Б., Куничан А. Д., Макарова О. В., Соколова Г. Б. Гепатозащитное действие полифитохола при химиотерапии туберкулеза. Пособие для врачей. М., 2000.
Колмогорова Т. И. Туберкулез абдоминальных лимфатических узлов у детей. Брошюра. Якутск, 1980. С. 51–52.
Николаев С. М. Растительные лекарственные препараты при повреждениях гепатобилиарной системы. Новосибирск: Наука, 1982. С. 21.
Панова Л. В. Гепатотоксические реакции на химиотерапию и их коррекция у подростков, больных туберкулезом. Автореф. дисс. канд мед. наук. М., 2001.
Учайкин В. Ф., Чередниченко Т. В., Чаплыгина Г. В., Писарев А. Г. ЛИВ.52 — новый взгляд на эффективность при острых и хронических вирусных гепатитах у детей // Детские инфекции. Ассоциация педиатров-инфекционистов. М., 2003. № 3. С. 41–44.
В. А. Аксенова, доктор медицинских наук, профессор
В. Г. Мадасова
НИИ фтизиопульмонологии, ММА им И. М. Сеченова, Москва
Туберкулез — инфекционное заболевание, вызываемое различными микобактериями (МБТ) — M.humanus, M.bovis, M.avium. Однако и другие виды микобактерий могут вызывать заболевание, которое принято называть микобактериозами. Микобактериоз может разв
 |
Туберкулез — инфекционное заболевание, вызываемое различными микобактериями (МБТ) — M.humanus, M.bovis, M.avium. Однако и другие виды микобактерий могут вызывать заболевание, которое принято называть микобактериозами. Микобактериоз может развиваться при заражении M.xenopi, M.kasasii, M.ulcerans и др.
Сегодня можно констатировать, что туберкулез поражает все слои общества, все возрастные группы и особенно опасен для детей первых трех лет жизни. По нашему мнению, при инфицировании ребенка на первом году жизни практически в 100% случаев развивается заболевание.
Наряду с ростом заболеваемости значительно возросло число осложненных форм туберкулеза у детей (особенно раннего возраста), что является следствием его поздней выявляемости.
Дети чаще всего заражаются микобактериями человеческого типа от взрослых членов семьи, обычно от близких родственников. В сельской местности, неблагополучной по туберкулезу крупного рогатого скота, происходит заражение младенцев от животных (употребление парного молока) микобактерией бычьего типа.
Преимущественно МБТ проникает в организм человека аэрогенным путем при ингаляции мельчайших капелек мокроты больного, выделяемых при кашле, чихании, разговоре. Гораздо реже отмечается инфицирование через высохшую мокроту. Возможно заражение алиментарным или контактным путями (через поврежденную кожу или слизистые оболочки). Крайне редко наблюдается внутриутробное заражение с развитием так называемого врожденного туберкулеза.
Наряду с перечисленными путями проникновения туберкулезной палочки в организм существует “ятрогенное” заражение в результате вакцинации и ревакцинации БЦЖ. Наши наблюдения за 420 детьми раннего возраста позволяют считать, что дальнейшее течение туберкулезной инфекции у детей раннего возраста и особенно первого года жизни обусловлено рядом факторов:
- социальным фактором;
- анатомо-физиологическими особенностями, характерными для данной возрастной группы;
- трудностями выявления и диагностики заболевания.
Анатомо-физиологические особенности, предполагающие и определяющие развитие и течение туберкулеза, заключаются в незрелости бронхолегочного аппарата, недифференцированности лимфатической системы, незрелости иммунной системы для локализации и уничтожения МБТ и в первую очередь реакции гиперчувствительности замедленного типа, превалировании экссудативно-альтеративного компонента в воспалительных реакциях. Существенную роль в этой возрастной группе играет склонность к частым острым респираторным инфекциям, развитию рахита и дефицита железа, аллергическая настроенность организма. Все это способствует возникновению тотального казеозного поражения внутригрудных лимфатических узлов, ранней лимфогематогенной диссеминации, быстрому прогрессированию процесса с развитием осложнений. Самоизлечение туберкулеза в этой возрастной группе, в отличие от других возрастных групп, наблюдается крайне редко. Известны лишь единичные случаи частичной регрессии процесса и переход его в хронически текущий первичный туберкулез с развитием обширных кальцинированных очагов в легких и лимфоузлах.
Диагностика туберкулеза в этом возрасте весьма затруднена, особенно на первом году жизни. Клинические проявления туберкулеза не имеют специфических черт, могут протекать под масками различных заболеваний — ОРВИ, бронхита, пневмонии и т. д. — или бессимптомно.
Туберкулинодиагностика на первом году жизни в массовом порядке еще не проводится. При проведении туберкулинодиагностики среди вакцинированных детей в первые 6-8 месяцев жизни возникают трудности в дифференциальной диагностике инфекционной и поствакцинальной аллергии. При инфицировании ребенка в первые дни и недели жизни идет параллельное формирование специфической аллергии. Только к концу первого года жизни и старше туберкулинодиагностика позволяет более четко констатировать инфекционный характер аллергии (формирование высокого уровня чувствительности к туберкулину или гиперэргическая реакция).
При генерализации туберкулезного процесса (милиарный туберкулез, туберкулезный менингит) в 30-50% формируется анергия к туберкулину. Незнание этого феномена нередко приводит к диагностическим ошибкам.
При проведении рентгенодиагностики можно столкнуться с рядом трудностей, которые обусловлены особенностями рентгеносимеотики неосложненного и осложненного первичного туберкулеза и с анатомо-физиологическими особенностями рентгенограммы органов грудной клетки ребенка первых лет жизни.
Особенности рентгеносимеотики определяются патофизиологическими механизмами первичного туберкулеза. Высокая реактивность тканей к микробактериям туберкулеза проявляется в виде обширных перифокальных реакций в легочной ткани, сегментарных и лобарных легочных поражений. Склонность к генерализации и лимфотропность приводит к увеличению внутригрудных лимфатических узлов.
Анатомо-физиологические особенности заключаются в том, что в малой по размерам грудной клетке ребенка относительно большое место занимает срединная тень, образуемая сердцем и сосудами, за которыми скрываются корни легких, особенно на первом году жизни. Большая вилочковая железа прикрывает зону верхнего средостения, что также затрудняет визуализацию внутригрудных лимфатических узлов. К тому же во время исследования маленький ребенок ведет себя беспокойно, и заставить его сделать глубокий вздох невозможно. Все это очень затрудняет диагностику поражения внутригрудных лимфатических узлов. В итоге рентгенологически локальный внутригрудной туберкулез подтверждается иногда лишь при динамическом наблюдении и целенаправленном рентгенотомографическом исследовании.
Бактериологические методы лечения в педиатрии, в отличие от терапии для взрослых, менее информативны, так как дети редко выделяют МБТ, да и получение мокроты представляет большие трудности.
Поэтому диагноз устанавливается на основании многих показателей: подробно собранный анамнез — сведения о вакцинации БЦЖ, контактах с больным туберкулезом, факторами риска по развитию туберкулеза; динамическое наблюдение за течением заболевания, рентгенотомографической картины; туберкулинодиагностика.
При развитии первичного туберкулеза у детей раннего возраста в 90-92% случаев диагностируется внутригрудной процесс.
Внутригрудной туберкулез проявляется в виде бронхоаденита — 89,3% и первичного туберкулезного комплекса соответственно — 10,7%. По результатам рентгенотомографического исследования бронхоаденит протекает преимущественно в виде туморозной и инфильтративной форм. Редко встречается “малая” форма (3,2%). При этом нередко поражаются все группы внутригрудных лимфатических узлов.
 |
Первичный туберкулезный комплекс характеризуется развитием воспалительных изменений в легочной ткани, поражением регионарных внутригрудных лимфатических узлов и лимфангитом. Легочный компонент у 96,6% детей локализуется в верхних долях (сегменты 2, 3, 4, 5), реже в зоне 6-го сегмента и крайне редко в сегментах 8, 9, 10, чаще справа, как правило в пределах одного или двух сегментов. В отличие от других возрастных групп у детей раннего возраста поражение лимфоузлов редко бывает регионарным, а характеризуется вовлечением нескольких, а то и всех групп внутригрудных лимфоузлов и зачастую по туморозному типу.
Туберкулезная интоксикация выявляется крайне редко, и при отсутствии локальных туберкулезных поражений требуется поиск других причин интоксикации.
Характерным проявлением туберкулезной инфекции в раннем детском возрасте является высокий удельный вес осложнений — 55,4%, а у детей первого года жизни частота осложнений доходит до 80%. В структуре осложнений наиболее часто встречаются бронхолегочные поражения — 55,6% (ателектатически-инфильтративный процесс в пределах одного или нескольких сегментов, доли или всего легкого), милиарный туберкулез — 19,3%, генерализованные формы — 13,9%, туберкулезный менингит (менингоэнцефалит) — 11,2%.
| Причинами эпидемиологического неблагополучия по туберкулезу являются ухудшение социально-экономических, экологических условий, снижение жизненного уровня населения, рост преступности (среди пребывающих в ИТУ туберкулез диагностируется в 42 раза чаще, чем в среднем по стране); рост числа людей без определенного места жительства и занятий; миграционные процессы (распространенность туберкулеза среди беженцев и вынужденных переселенцев — от 459 до 700 случаев на 100 тыс.) |
Развитие осложнений дает нередко более яркую клиническую картину, в отличие от неосложненных форм первичного туберкулеза, что в 38,4% случаев является поводом для госпитализации ребенка в общесоматический стационар и требует проведения дифференциальной диагностики. При этом необходимо отметить, что среди детей с осложненным течением первичного туберкулеза 70-72% — дети из семей мигрантов. Этот факт имеет важное значение в диагностике туберкулеза для врачей-педиатров соматических и инфекционных больниц.
Клинические проявления туберкулеза не имеют специфических черт. В 81,8% случаев туберкулез начинается постепенно [5]. Первые признаки заболевания проявляются в виде умеренно выраженных симптомов интоксикации: снижении аппетита, изменении поведения ребенка. При осмотре обращает внимание бледность кожных покровов, понижение массы тела, тургора, эластичности тканей, увеличение периферических лимфатических узлов. На ранних этапах можно выявить увеличение печени и селезенки, эпизодические подъемы температуры до субфебрильных цифр. В гемограмме отмечается гипохромная анемия, не поддающаяся лечению препаратами железа и коррекции питанием. В формуле крови при нормальном уровне лейкоцитов — нейтрофильный сдвиг с развитием лимфопении. С присоединением осложнений (милиарный туберкулез, менингит, бронхолегочные поражения) нарастает интоксикация, значительно снижается масса тела, температура становится субфебрильной-фебрильной, нарастает одышка, появляется непродуктивный кашель, а при менингите развивается менингеальная симптоматика.
Учитывая эти факторы, врач-педиатр может своевремено провести обязательный диагностический минимум для подтверждения или исключения специфического процесса.
| Классификация постпрививочных осложнений, предложенная в 1984 году Международным союзом по борьбе с туберкулезом ВОЗ; категории осложнений: |
| I — локальные кожные поражения (холодные абсцессы, язвы) II — персистирующая и диссеминированная БЦЖ-инфекция без летального исхода (волчанка, оститы и др.) III — диссеминированная БЦЖ-инфекция по типу генерализованного поражения с летальным исходом, которое отмечается при врожденном иммунодефиците IV — пост-БЦЖ синдром (проявления заболевания, возникшие вскоре после вакцинации БЦЖ, главным образом аллергического характера, узловатая эритема и т. д.) |
Более чем 37-летние результаты использования для вакцинации и ревакцинации внутрикожного введения БЦЖ, а затем и БЦЖ-М свидетельствуют о ее благоприятном влиянии на течение первичной туберкулезной инфекции у привитых. Противотуберкулезная вакцинация уменьшает развитие таких тяжелых форм заболевания, как милиарный туберкулез, туберкулезный менингит. Отмечено, что первичное инфицирование и первичные формы туберкулеза у вакцинированных при рождении детей по сравнению с невакцинированными протекают более доброкачественно, без осложнений и приводят к сравнительно быстрому благоприятному исходу [5]. Наряду с этим необходимо отметить два важных положения.
Первое — в условиях раннего инфицирования (первые дни и недели жизни ребенка) противотуберкулезная вакцинация, проведенная на четвертый—шестой день жизни, не может предупредить развитие туберкулеза и его осложнений, так как еще не сформировался поствакцинальный иммунитет. Отсюда следует вывод о необходимости обязательного обследования всех членов семьи перед выпиской ребенка из родильного дома, независимо от того, была проведена вакцинация в родильном доме или нет.
Второе — БЦЖ-инфекция. Частота поствакцинальных осложнений на отечественную вакцину БЦЖ — 0,02% после вакцинации и 0,003% — после ревакцинации [3]. После внедрения в практику вакцины БЦЖ-М частота осложнений уменьшилась до 0,004% к числу привитых новорожденных.
Проявления БЦЖ-инфекции также многообразны, как и проявления первичного туберкулеза, но в отличие от последних протекают менее агрессивно.
В большинстве случаев осложнения после вакцинации БЦЖ носят местный характер. Это подкожные холодные абсцессы; язвы величиной 10 мм и более в диаметре на месте внутрикожного введения вакцины; лимфадениты регионарных лимфатических узлов (подмышечные, шейные, над- и подключичные) при увеличении узла до 1,5 см и более в фазе инфильтрации, абсцедирования и кальцинации. Редко, но встречаются БЦЖ-оститы и диссеминированная БЦЖ-инфекция как следствие врожденного иммунодефицита (хроническая гранулематозная болезнь).
В условиях массовой вакцинации БЦЖ высокая частота поствакцинальных осложнений привела к тому, что довольно большое количество детей, в основном первого, реже второго года жизни требует длительного консервативного, а нередко и хирургического лечения.
Таким образом, в настоящее время в окружающей среде накоплен значительный резервуар туберкулезной инфекции. Туберкулез ведет себя агрессивно, поражая все возрастные и социальные группы населения. Наиболее негативно во всех своих проявлениях он действует на детей раннего возраста и особенно первого года жизни, приводя нередко к летальному исходу.
Литература
1. Аксенова В. А., Олянишин В. Н. Сборник резюме. Екатеринбург, 1997. № 186. С. 57.
2. Митинская Л. А. Противотуберкулезная вакцинация БЦЖ. М., 1975.
3. Митинская Л. А., Юхименко Н. В., Камаева В. Ф. Вакцинация БЦЖ и укороченные курсы лечения поствакцинальных осложнений с применением раствора рифампицина с димексидом. Педиатрия, 1986. № 6. С. 94-95.
4. Хоменко А. Г. Сборник резюме. Екатеринбург, 1997. С. 5-7.
5. Чугаев Ю. П. Диагностика и лечение туберкулеза у детей раннего возраста. Автореф. дис. док. мед. наук. М., 1988.
Читайте также:

