При атопическом дерматите аллергены кишечной палочки
Обновлено: 24.04.2024
Для цитирования: Соболева Н.Г., Первишко О.В. Атопический дерматит у детей раннего возраста с проявлениями дисфункции ЖКТ и кожного синдрома. РМЖ. 2014;3:212.
В настоящее время аллергические заболевания у детей, в частности атопический дерматит (АД), занимают одно из ведущих мест в структуре детской заболеваемости, распространенность дерматита увеличивается. Данные литературы последних лет свидетельствуют о частом сочетании патологии со стороны пищеварительного тракта и АД [1, 8].
По мнению ряда авторов, у больных АД слизистая оболочка ЖКТ является входными воротами для аллергенов, и здесь развивается местная аллергическая реакция [1, 2, 4].
В настоящее время в распоряжении педиатров имеется ограниченное число препаратов для лечения заболеваний кожи у детей раннего возраста, в равной мере эффективных и безопасных, действующих местно и одновременно потенцирующих процессы регенерации на клеточном уровне.
Цель работы: изучение дебютных признаков поражения пищеварительной системы и кожных проявлений у детей раннего возраста, страдающих аллергическим дерматитом, при нарушениях вскармливания и питания.
Материалы и методы
Проведено эпидемиологическое исследование среди детей дошкольного возраста (с рождения до 5 лет включительно, проживающих в Краснодарском крае), поскольку они в силу особенностей развития наиболее чувствительны к воздействию неблагоприятных факторов, в т. ч. в допороговых концентрациях. Исследование проводилось по унифицированной методике выборочным методом наблюдения [4], включало 2 этапа.
На 2-м этапе проведено дополнительное целенаправленное интервьюирование и анкетирование 498 детей и их родителей для более детального выявления симптомов поражения ЖКТ, кожных проявлений и анализа организации вскармливания и питания ребенка.
Результаты исследования и их обсуждение
По данным целенаправленного 2-этапного исследования выявлены 173 из 498 детей (24,9%) с признаками аллергического поражения кожных покровов. Анализ факторов формирования гастроэнтерологической патологии у детей-аллергиков включал детальное изучение наследственности, течения анте-, интра- и постнатального периодов, характер вскармливания ребенка на первом году жизни, в т. ч. сроки введения прикормов, особенности питания в течение последующих лет жизни (до 7 лет).
Наследственная отягощенность по заболеваниям ЖКТ выявлена у 74,8% детей, в основном по материнской линии. Кислотозависимые заболевания встречались чаще по отцовской линии. Генетическая предрасположенность к аллергическим заболеваниям обнаружена у 65,7% пациентов.
Сочетанная отягощенность (по гастроэнтерологической и аллергической патологии) выявлена у половины детей исследуемой группы (50,4%). Беременность протекала часто с гестозами первой (42,9%) и второй (35,4%) половины. Предыдущие беременности у 12,1% матерей закончились выкидышами.
В 35,4% случаев женщины перенесли аборты (от 1 до 10 раз). Обострения хронических заболеваний, в т. ч. гастроэнтерологических и аллергических, наблюдались во время вынашивания плода у 77 из 373 матерей (20,6%). Патология родового периода выявлена в 43,7% случаев. Недоношенными родились 14 детей, врожденную гипотрофию имели 21,4% младенцев. В родовом зале и послеродовой палате в первые 6 ч после рождения приложены к груди всего 28,1% детей, в то же время начали получать искусственное вскармливание с рождения более трети детей (35,1%).
В качестве докорма родители чаще всего использовали молочные смеси (55,7%) или коровье молоко (3 8,7%). В исследуемой выборке первый прикорм был введен в возрасте 4,2±0,35 мес., причем раньше рекомендуемого возраста – более чем половине детей (59,2%).
Настораживает тот факт, что 13,1% детей были переведены на общий стол еще до годовалого возраста; именно у этих детей в 50,7% случаев в последующем обнаруживались первые симптомы поражения кожных покровов и гастроинтестинальной системы. Учитывая ведущую значимость клинической картины и характера течения для постановки диагноза гастроэнтерологического заболевания, особое внимание уделяли симптомам поражения ЖКТ, срокам и последовательности их появления. У 304 (81,5%) дошкольников с АД отмечены типичные симптомы поражения пищеварительной системы.
Подробный расспрос родителей дал возможность уточнить ранние симптомы нарушений деятельности органов пищеварения у детей с АД, которые начали формироваться в возрасте от 0 до 2 лет. Так, кишечные дисфункции в виде запоров уже в течение первых месяцев после рождения выявлялись у 29,2% детей.
Диарея в подавляющем большинстве случаев возникала при грудном или раннем смешанном вскармливании (37,7 и 47,2% соответственно). С годами частота этого синдрома снижалась до 2,1% случаев в исследуемой группе. Литературные данные подтверждают, что этот факт связан с энзимопатиями кишечника, когда нарушение стyла возникает в результате несовершенства ферментативной системы ЖКТ. В последующем подобный дефект компенсируется, и стул у ребенка нормализуется [3].
Критическим фактором раннего поражения пищеварительного тракта явилось то, что 52 из 373 детей с АД перенесли на первом году жизни острую кишечную инфекцию, подтвержденную бактериологически, в основном дизентерию. Неадекватная реабилитационная терапия после перенесенной инфекции, нерациональное вскармливание на фоне нарушений моторной активности толстой кишки, замедления пассажа пищевого химуса приводили к хронизации воспалительной реакции слизистой оболочки и дисбиоценозу кишечника. Стойкие изменения микрофлоры кишечника потенцировали хроническое воспаление кишечника, с одной стороны, а с другой стороны, практически во всех случаях дисбиоценоз сопутствовал аллергическому заболеванию кожи.
Для ликвидации кожных проявлений использовали препараты серии декспантенол, которые наносили тонким слоем регулярно на пораженные участки кожи ребенка (5–6 р./сут). Ощутимый клинический эффект наступал на 3–4 сут. Применение препаратов с терапевтической целью продолжалось до полного исчезновения симптомов и в среднем составило 4,2±0,3 сут при средней тяжести поражения.
При тяжелом течении АД с элементами присоединения бактериального компонента положительного результата удавалось достичь за 7,2±0,2 сут. При этом дополнительно применяли воздушные ванны, а также обработку кожи антисептиком (раствором фурацилина).
После проводимой терапии родители отмечали, что дети хорошо переносили назначенные препараты, не было выявлено ни одного случая побочного действия. Под влиянием наружной терапии проявлений АД отмечались уменьшение экссудации, исчезновение трещин, шелушения, гиперемии кожи, значительное уменьшение зуда, что благоприятно сказывалось на общем и психоэмоциональном состоянии больного [5].
Таким образом, углубленный анализ исследуемой популяционной группы позволил выявить ряд дебютных симптомов поражения ЖКТ, играющего важнейшую роль в формировании АД. Такими симптомами являются запоры в первые месяцы и годы жизни; секреторные поносы и энзимопатии после употребления в пищу продуктов, содержащих облигатные аллергены или не подходящих для вскармливания ребенка в данном возрасте. Все эти проявления носят функциональный характер и связаны с нарушением переваривающей, моторно-эвакуаторной функций пищеварительной системы и повреждением системы кишечной цитопротекции, местной иммунной защиты.
Определяющими биологическими и социальными факторами их формирования следует считать высокий удельный вес наследственной отягощенности как по гастроэнтерологической, так и по аллергической патологии; патологию беременности и родов (предшествующие аборты, гестозы и др.); нарушения физиологического графика вскармливания.
Положительный клинический эффект местной терапии кожных проявлений АД позволил использовать препараты серии декспантенол как с профилактической, так и с терапевтической целью. При доказанной высокой эффективности отмечены хорошая переносимость и отсутствие побочных эффектов у выбранной группы препаратов.
Своевременное выявление педиатрами ранних симптомов поражения ЖКТ и адекватная терапия кожных проявлений у детей раннего возраста позволяют облегчить течение заболевания и предотвратить развитие осложнений.
Д.м.н. Л.С. Круглова
Московский Научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения г. Москвы
Современная медицинская наука дает возможность практикующему врачу рассматривать заболевания не только в узких рамках симптомокомплекса, но и с точки зрения изменения функциональных резервов организма человека в результате нарушения его адаптационных возможностей. Неуклонный рост заболеваемости атопическим дерматитом (АтД), наличие рецидивирующих, хронических форм создают потребность в интеграции лечебно-реабилитационных технологий, направленных на восстановление и сохранение здоровья, нарушенного данной патологией.
По современным представлениям человеческий организм является определенной экологической нишей для множества разнообразных микроорганизмов, которые в норме формируют своего рода различные биотопы, являющиеся достаточно сложными системами, сформировавшимися в процессе эволюции и со временем приобретшие определенную устойчивость применительно к особенностям макроорганизма. Биотопы отличаются не только многокомпонентностью, но и количественным разнообразием входящих в них представителей микрофлоры [1].
Постоянство бактериальной аутомикрофлоры организма человека позволяет рассматривать бактерий, существующих преимущественно в четырех локализациях - на коже и слизистой полости рта, кишечника, половых органов - как своеобразный прокариотический орган. Причем изменения в одном из биотопов могут приводить к нарушениям в других. Формирование микрофлоры биотопов организма, и в первую очередь кожи и кишечника, происходит уже с самого рождения ребенка при прохождении по родовым путям. В дальнейшем на формирование влияет много факторов: состав микрофлоры биотопов матери, вид вскармливания, а затем и характер питания, состояние соматического здоровья ребенка и состояние окружающей среды [2,3].
Из всех биотопов организма наибольшая численность и видовое разнообразие бактерий отмечается в биотопе кишечника: так, на площади в 200 м 2 обитает 10 12 -10 14 бактерий, может встречаться до 450 видов различных микроорганизмов, общая масса которых доходит до 5% массы самого кишечника [4,5]. При этом в разных отделах кишечника количество и состав микроорганизмов биоценоза различен. В тонком кишечнике микробов меньше - это преимущественно лактобациллы, стрептококки и веилонеллы, в толстом кишечнике их больше, причем преобладают кишечные палочки и анаэробные бактерии.
Многочисленные микроорганизмы обеспечивают такие важные функции, как выработка ферментов, участвующих в метаболизме белков, липидов, жиров, нуклеиновых и желчных кислот, формирование механизмов иммунной защиты, поддержание гомеостаза организма, продукция биологически активных веществ и витаминов, детоксикация эндогенных и экзогенных субстратов и многие другие.
Микрофлора кишечника условно подразделяется на защитную, сапрофитную и оппортунистическую (условно-патогенную). Защитная микрофлора наиболее многочисленная (до 95%) и в основном представлена лактобактериями, бифидобактериями и кишечной палочкой с нормальными ферментативными свойствами. Именно они обеспечивают постоянство микрофлоры за счет колониальной резистентности. Так, бифидобактерии, лактобактерии выделяют молочную, уксусную кислоты, другие вещества, обладающие избирательным антимикробным действием. Кислая среда, обусловленная жизнедеятельностью этих микроорганизмов, препятствует проникновению и закреплению на слизистой патологических микробов, не свойственных данному биотопу. Помимо этого, бифидобактерии стимулируют клеточное звено иммунитета и участвуют в синтезе иммуноглобулинов. Данные бактерии являются естественными биосорбентами и способны накапливать значительное количество соединений тяжелых металлов, фенолов, формальдегидов и других токсичных веществ [6,7]. Однако в соответствии с современными воззрениями, скорее всего, недостаточное количество лактобактерии является основным отягчающим фактором при атопическом дерматите.
Именно лактобактерии в значительной степени снижают всасывание аллергенов в кишечнике и стимулируют синтез иммуноглобулинов класса А, которые, особенно в раннем детском возрасте, являются основными антителами против пищевых аллергенов [8,9].
Сапрофитная микрофлора кишечника представлена эпидермальным и сапрофитным стафилококками, энтерококками и другими микроорганизмами, основной функцией которых является утилизация конечных продуктов метаболизма макроорганизма [5].
Оппортунистическая микрофлора может быть представлена различными микроорганизмами (3-гемолитический стрептококк, золотистый стафилококк, спороносные анаэробы, грамотрицательные энтерококки, грибы рода Candida ), которые при определенных условиях вызывают патологический процесс [5].
Таким образом, в кишечном микробиоценозе, как в единой системе, существуют корреляционные связи между различными видами бактерий. Нарушение колонизационной резистентности кишечника, связанное с изменением состава постоянной микрофлоры, способствует колонизации патогенными и условно-патогенными бактериями, нарушению основных функций, что и приводит к формированию дисбиоза [Мельникова, 1997; Билимова, 2000; Белова с соавт., 2004; Cammaro-ta, Ogava, 1998].
Согласно существующему в России медицинскому стандарту оказания специализированной помощи при патологии желудочно-кишечного тракта (ЖКТ) дисбиоз кишечника рассматривается, как своеобразный клинико-лабораторный синдром, который характеризуется изменением качественного и/или количественного состава аутомикрофлоры, с возможной транслокацией микроорганизмов в несвойственные для них биотопы; при этом данные изменения могут сопровождаться клиническими симптомами поражения кишечника. В широком понимании дисбиоз является проявлением общего нарушения в различных микробиотах организма, которое приводит к нарушению функционирования микробиот и сопровождается определенными симптомами, ассоциированными с различными патологическими состояниями [5,10,11].
При развитии дисбиоза защитная микрофлора кишечника перестает выполнять свои функции в достаточной степени, что приводит к формированию патологических состояний либо усугублению течения имеющейся соматической патологии [12,13]. Ассоциированные с дисбиозом заболевания в зависимости от преобладания механизмов, отягчающих течение болезни, условно подразделяются на 4 группы:
- заболевания органов пищеварения,
- гнойно-воспалительные заболевания,
- аллергические заболевания,
- заболевания, связанные с нарушением обмена веществ (метаболизма).
Безусловно, рациональные схемы лечения атопического дерматита должны включать методы детоксикации (в частности, энтеросорбции) и использование препаратов, восстанавливающих и поддерживающих нормальную микрофлору кишечника. Энтеросорбция является неинвазивным методом детоксикации и направлена на выведение из организма различных эндогенных и экзогенных аллергенов, токсинов, патогенных микроорганизмов и продуктов их жизнедеятельности. Известно, что на фоне проведения энтеросорбционных мероприятий происходит повышение функциональной активности клеточного и гуморального иммунитета, ускоряется регресс объективных и субъективных симптомов АтД [17,18].
Существенным является и то, что сорбенты позволяют снизить медикаментозную нагрузку, а в ряде случаев и обходиться без них. Требования к современным энтеросорбентам следующие: высокие сорбционные свойства (емкость); отсутствие токсических свойств и системной фармакокинетики; атравматичность для слизистых оболочек ЖКТ; хорошая эвакуаторная способность; высокая комплаентность [19].
Механизм процесса энтеросорбции зависит от двух факторов - характеристик сорбента и структуры подлежащих сорбции веществ. Сорбенты могут отличаться по ряду признаков: лекарственная форма, физические свойства и химическая структура. Одними из самых эффективных сорбентов являются природные органические на основе пищевых волокон, такие как лигнин, который не усваивается в пищеварительной системе человека и полностью ферментируется кишечными бактериями. Важнейшее свойство лигнина - высокая сорбционная активность.
Вместе с тем большой интерес представляет развитие относительно нового направления в лечении атопического дерматита - включение в комплекс терапевтических мероприятий пребиотиков , выделенных из естественных источников и обладающих определенными регулирующими свойствами в отношении функционирования биотопа кишечника. В отличие от пробиотиков, которые поставляют необходимые бактерии извне, пребиотики выступают в качестве питательной среды для развития собственной нормальной микрофлоры организма, что способствует более быстрому и устойчивому восстановлению нормальной аутомикрофлоры кишечника [20,21]. Как правило, в качестве пребиотиков используют вещества, содержащие бифидогенные факторы, стимулирующие рост и развитие полезных бактерий. Таким веществом, в частности, является лактулоза - синтетический стереоизомер молочного сахара - лактозы.
Таким образом, на сегодняшний день идеальным сочетанием можно считать комбинированные лекарст венные средства, содержащие пребиотик и адсорбент. Таким средством является препарат Лактофильтрум ® , включаюший сорбент и пребиотик. В качестве сорбента препарат содержит растительный компонент - лигнин, который обладает неспецифическим дезинтоксикационным действием. За счет большой площади поверх ности и развитой системы пор обладает высокой сорбционной емкостью и таким образом способен выводить из организма токсины, аллергены и патогенные микро организмы. В качестве пребиотика выступает лактулоза, положительное влияние которой на микрофлору кишечника обусловлено целым рядом фармакологических свойств. Так, продукты бактериального метаболизма лактулозы сдвигают рН среды в толстой кишке в кислую сторону, что при водит к подавлению размножения патогенных микроорганизмов и угнетению процессов гниения. Помимо этого, являясь пищевым субстратом для бактерий, лактулоза стимулирует рост собственных бифидобактерий и лактобактерий в толстом кишечнике, а это, в свою очередь, восстанавливает, нарушенные функции биотопа кишечника.
Активные составляющие препарата не инактивируются в агрессивных средах желудка и двенадцатиперстной кишки, что обеспечивает 100%-ю доставку непосредственно к месту действия.
Лактофильтрум ® производится из компонентов природного происхождения в таблетированной форме и удобен в применении. Препарат зарекомендовал себя как высоко безопасный, который практически не имеет противопоказаний к применению и побочных эффектов [22,23].
В клинических условиях под нашим наблюдением находилось 40 пациентов (средний возраст 18,9±2,3 года, продолжительность заболевания 11,4±2,7лет) с диагностированным по основным критериям атопическим дерматитом в стадии обострения. У большинства пациентов АтД носил распространенный характер - ДИШС (Дерматологический индекс шкалы симптомов) составил 18,2±2,3 балла, что соответствует среднетяжелому течению АтД. В зависимости от проводимого лечения пациенты были разделены на 2 сопоставимые по всем параметрам группы. В основную группу вошли 20 больных, которые получали препарат
Лактофильтрум ® по 2 таблетки 3 раза в сутки на протяжении 21 дня и фармакотерапию, соответствующую стандартам при данной патологии. Пациенты 2 группы (20 человек) получали традиционную медикаментозную терапию.
До лечения у 97,5% пациентов был диагностирован дисбиоз кишечника, причем у 52,5% пациентов он протекал с клиническими симптомами (метеоризм, усиление перистальтики, нарушение стула, дискомфортные субъективные ощущения). После комплексного лечения в основной группе у 95% пациентов отмечалась нормализация содержания лактобактерий, бифидобактрий и Е. coli. Такая же тенденция наблюдалась и в отношении клинических симптомов дисбиоза. В группе сравнения достоверно значимых изменений количественного содержания лактобактерий, бифидобактрий и Е. coli не отмечалось (рис.1).

Рис. 1. Число пациентов с нарушением колониальной резистентности
до и после комплексного лечения, включающего применение Лактофильтрума ®
и традиционного медикаментозного лечения
Под влиянием комплексного лечения (1 группа) через 3 недели общие проявления всех объективных симптомов заболевания сохранялись в среднем лишь у 10% больных, в то время как в группе сравнения они были выражены в 54% случаев (рис. 2).

Рис. 2. Динамика регресса клинических симптомов у больных атопическим дерматитом под влиянием различных методов лечения
К концу лечения индекс ДИШС, отражающий тяжесть течения АтД, в основной группе снизился на 84%, в группе сравнения лишь на 53%. Анализ выраженности зуда с использованием опросника Behavioral rating scores (BRS) показал выраженное отрицательное влияние зуда на повседневную деятельность пациентов с АтД. Так, до лечения в 1-й группе значение BRS составило 7,1 ±0,4 баллов, во 2-й группе - 6,8±0,5 баллов. Уже через 1 неделю от начала лечения в 1-й группе отмечался более выраженный регресс субъективной симптоматики: снижение BRS на 55%, во 2-й группе - на 26%. К концу лечения в 1-й группе значение BRS составило 0,4±0,1 балла. В контрольной группе к концу лечения индекс снизился лишь на 58% (рис. 3). Эти данные находились в соответствии с показателями биохимических маркеров зуда (табл. 1).

Таблица 1.
Динамика показателей гистамина и серотонина в сыворотке крови у больных АтД под влиянием комплексного лечения, включающего прием Лактофильтрума ® и традиционной медикаментозной терапии
| Изучаемый показатель | Контроль(n=20) | До лечения (n=40) | После лечения | |
|---|---|---|---|---|
| 1 группа (n=20) | 2 группа (n=20) | |||
| Серотонин (мкмоль/л) | 0,6±0,03 | 2,35±0,24Р1** | 0,81±0,32Р2*** | 1,46±0,22РГ**,РЗ* |
| Гистамин (мкмоль/л) | 0,8±0,06 | 2,14±0,62Р1** | 0,87±0,13Р2*** | 1,35±0,25Р1***,Р2** |
| Примечание: Р1 - сравнение с нормой; Р2 - сравнение с показателями до лечения; РЗ - сравнение с основной группой; *- р | ||||
Как видно из приведенных в таблице данных, после комплексной терапии, включающей применение Лактофильтрума ® отмечалось восстановление повышенных в исходном состоянии показателей серотонина и гистамина до нормальных значений - 0,81 ±0,32 и 0,87±0,13 (рВ процессе лечения с улучшением клинической картины заболевания пропорционально улучшались и показатели качества жизни (рис. 4). В результате анализа полученных данных, более выраженная положительная динамика дерматологического индекса качества жизни (ДИКЖ), особенно в первые дни терапии, была отмечена у пациентов 1 группы. Так, в первую неделю параметры ДИКЖ улучшились на 30% в 1 группе и лишь на 8% во 2 группе (рис. 5). К концу курса лечения ДИКЖ улучшился на 87 и 54% соответственно.

Рис. 4. Динамика изменения показателей, отражающих субъективные и объективные симптомы заболевания
у пациентов с АтД под влиянием комплексного лечения, включающего прием Лактофильтрума ®

Рис. 5. Динамика изменения показателей, отражающих субъективные и объективные симптомы заболевания
у пациентов с АтД под влиянием традиционной медикаментозной терапии
Таким образом, по оценке самими пациентами эффективности и комфортности проводимого лечения, метод, включающий применение Лактофильтрума ® , является наиболее эффективным.
Выводы
Нарушение колониальной резистентости кишечника, приводящее к повышенной эндотоксинемии, аллергизации и нарушению гомеостаза, может отразиться на состоянии кожи и течении атопического дерматита.
Представители нормальной микрофлоры биоты кишечника выполняют физиологически важную функцию поддержания постоянства внутренней среды организма, принимают участие в формировании иммунобиологической реактивности макроорганизма. Нарушение нормоценозаспособствуетхронизации патологических процессов (в частности, атопического дерматита).
Включение препарата Лактофильтрум ® в комплекс терапии больных АтД приводит к более быстрому и выраженному регрессу кожных высыпаний и субъективных ощущений, нормализации функции биотопа кишечника, что в конечном итоге способствует значитель-номуулучшению качества жизни. Препарат не токсичен, не вызывает побочных эффектов, обладает высокой комплаентностью.
Литература
Проблема атопического дерматита (АД) приобретает в последние годы все большее медико-социальное значение, так как распространенность заболевания неуклонно растет. По современным представлениям АД — мультифакториальное заболевание, развитие которого тесно
Проблема атопического дерматита (АД) приобретает в последние годы все большее медико-социальное значение, так как распространенность заболевания неуклонно растет. По современным представлениям АД — мультифакториальное заболевание, развитие которого тесно связано с генетическими дефектами иммунного ответа и отрицательными влияниями неблагоприятных воздействий внешней среды. Установлено, что действие этих факторов определяет темпы развития АД, особенно у детей раннего возраста. Значимым фактором риска АД является патология органов желудочно-кишечного тракта, особенно дисбиоз кишечника, который выявляется у 89–94,1% детей, больных АД [2, 3, 11]. Несомненно, кишечная микрофлора, неся большую функциональную нагрузку, не может не участвовать в возникновении и поддержании патологических расстройств при АД.
В первую очередь необходимо в полной мере оценить ту значительную роль, которую играет нормофлора кишечника в организме человека. Масса всех микробов, живущих в кишечнике одного человека, составляет около двух килограммов. В состав флоры содержимого толстого кишечника входят анаэробные и аэробные бактерии. Нормальная микрофлора на 95% состоит из анаэробных видов бактерий, главными из которых являются бифидобактерии и лактобактерии. Аэробные бактерии, представленные кишечными палочками, энтерококками и др., составляют сопутствующую микрофлору. К остаточной микрофлоре относят стафилококки, клостридии, протей, грибы. Самые многочисленные и незаменимые представители полезной микрофлоры — это бифидобактерии.
Бифидобактерии стимулируют перистальтику, предупреждая нарушения стула, повышают иммунитет организма, разлагают некоторые канцерогены и вырабатывают витамины. Типичными продуктами жизнедеятельности бифидобактерий являются молочная, уксусная, муравьиная и янтарная кислоты, аминокислоты и белки, витамины В1, В2, К, никотиновая, пантотеновая и фолиевая кислоты, пиридоксин, цианокобаламин. Производя молочную и уксусную кислоту, они препятствуют размножению патогенных микроорганизмов. Бифидобактерии стимулируют лимфоидный аппарат человека и участвуют в синтезе иммуноглобулинов. В клеточной стенке данных бактерий содержится большое количество мурамил-дипептида, который активирует образование В- и Т-лимфоцитов и макрофагов. Данные бактерии являются естественными биосорбентами и способны накапливать значительное количество соединений тяжелых металлов, фенолы, формальдегиды и другие токсичные вещества, попадающие в организм хозяина из окружающей среды и влияющие на снижение иммунитета [1, 2].
Еще одна группа полезных микроорганизмов — это лактобактерии, без участия которых нельзя представить нормальную жизнедеятельность организма. Лактобациллы заселяют организм новорожденного ребенка в раннем постнатальном периоде. Средой обитания лактобацилл являются различные отделы желудочно-кишечного тракта, начиная с полости рта и кончая толстой кишкой. Например, лактобациллы (Lactobacillus acitophilus) обеспечивают своевременное опорожнение кишечника.
Кишечные палочки и энтерококки можно отнести к нейтральной микрофлоре, поскольку пока нет доказательств их благотворного влияния на организм. Вполне вероятно, что эти микроорганизмы отвечают за противовирусный иммунитет. По мнению некоторых авторов, благодаря феномену молекулярной мимикрии и наличию рецепторов, приобретенных от эпителия хозяина, микрофлора приобретает способность перехвата и выведения некоторых вирусов [1, 2]. Известен ряд бактерий, имеющих высокую активность нитратредуктазы (пропионибактерии, пептококки, вейлонеллы, грамотрицательные энтеробактерии и другие), которые предотвращают развитие метгемоглобинемии при высоком содержании нитратов. Особенно это важно у детей раннего детского возраста, имеющих высокую долю фетального гемоглобина [9].
Обильно развивается гнилостная или бродильная флора, грибы, преимущественно рода Candida, в кишечнике могут обнаруживаться микроорганизмы, в норме нехарактерные для него. Они не способны выполнять многие физиологические функции, присущие нормальной микрофлоре, и, в частности, утрачивается способность инактивировать токсические продукты кишечного содержимого, нарушается поглощающая способность кишечника [1, 2]. Таким образом, дисбактериоз кишечника у больных АД нарушает ферментный статус пищеварительного тракта, создавая условия для развития патологии полостного, пристеночного и мембранного пищеварения и всасывания. Происходит повышенное поступление бактериальных и инфекционных аллергенов в организм ребенка. Значительно повышенная антигенная стимуляция недорасщепленными макромолекулами пищевых веществ и бактериальными аллергенами, при слабости иммунного ответа и неспособности организма к элиминации комплексов антиген–антитело, приводит к отягощению АД.
До сих пор дискутируется вопрос: что первично — атопический дерматит или дисбактериоз кишечника? Многие исследователи в своих наблюдениях пытались ответить на этот вопрос, однако противоречия существуют до настоящего времени. Например, у младенцев с АД чаще, чем у здоровых детей, обнаруживается повышение содержания бактероидов и пониженный уровень бифидобактерий в фекалиях. Тот факт, что различия в микрофлоре у здорового ребенка и с аллергией определяются еще на доклинической стадии, свидетельствует о том, что изменения микрофлоры являются первичными, а не вторичными по отношению к аллергии [5].
Данное обстоятельство повлекло за собой предположение, что профилактическое назначение пробиотика беременным женщинам могло бы предотвратить развитие атопии в первые два года жизни ребенка. Подтверждение этой теории получили отечественные исследователи, которые установили, что у детей, рожденных от матерей, получивших пробиотики в виде первичной профилактики аллергических заболеваний, отмечается тенденция к более редкой встречаемости аллергических высыпаний на первом году жизни, реже диагностируется АД [5]. Тем не менее, диаметрально противоположное мнение существует у зарубежных авторов. Karla Gale (2010) провел обширное обследование 415 беременных женщин, получивших пробиотическое молоко или плацебо в срок с 36 недель беременности до трех месяцев постнатального периода кормления грудью. В возрасте двух лет дети, рожденные от таких матерей, были обследованы на наличие атопии (АД, бронхиальная астма и аллергический риноконъюктивит). Статистический анализ не выявил достоверной разницы между группами сравнения, следовательно, по мнению автора, употребление пробиотиков беременными и кормящими матерями не имеет никого смысла для предотвращения развития атопии у детей [19].
Большинство исследователей склоны считать, что в реализации дисбактериоза участвуют искусственное вскармливание, нарушение питания кормящей матери, а также раннее введение прикорма и продуктов, не соответствующих возрасту ребенка, которые впоследствии являются триггерными факторами в осуществлении генетического дефекта иммунного ответа при АД [6, 8, 10, 15, 21]. Становление микробного биоценоза ребенка начинается с первых этапов жизни. Во время родов при заглатывании происходит поступление микрофлоры родовых путей матери и колонизация вагинальной флоры в пищеварительной системе ребенка, что обеспечивает предупреждение развития дисбактериоза у новорожденного. Начиная с 4-го дня жизни в толстой кишке новорожденного определяются лактобактерии, эшерихии, стрептококки, стафилококки. Флора ребенка первого года жизни находится в прямой зависимости от характера вскармливания. У детей, получающих искусственное вскармливание, чаще и в более высоких титрах появляются бактероиды и вейлонеллы. При избыточном количестве последних может отмечаться повышенное газообразование, развитие диспепсических проявлений [7].
Резюмируя разнообразные и противоречивые данные литературы, до сих пор остается открытым вопрос о причинно-следственной связи развития дисбактериоза у детей с АД. Можно предположить несколько причин, которые могут быть прямыми или косвенными обстоятельствами гибели полезных бактерий у таких больных:
- искусственное вскармливание, нарушение питания кормящей матери, а также раннее введение прикорма и продуктов, не соответствующих возрасту ребенка;
- нехватка пищеварительных ферментов приводит к тому, что непереваренные остатки пищи подвергаются брожению и служат субстратом для роста болезнетворных микробов;
- снижение тонуса или спазмы гладких мышц кишечника (вегетовисцеральные нарушения, дискинезия, вегетососудистая дистония);
- недостаток веществ в рационе, служащих субстратом для роста полезных микробов или присутствие некоторых продуктов, способствующих их гибели. Дефицит в рационе человека кисломолочных продуктов и растительной клетчатки лишает полезную флору питательной среды;
- присутствие в кишечнике паразитов (глисты, простейшие), губительно влияющих на полезную микрофлору;
- прием современных лекарственных средств, снижающих желудочную секрецию (блокаторы Н2-гистаминовых рецепторов), которые также способны, хотя и косвенно, снизить резистентность естественной кишечной микрофлоры;
- применение цитостатиков, глюкокортикоидов, снижающих имму-норезистентность организма.
В первую очередь нельзя гиперболизировать данный синдром, а необходимо верифицировать патологию ЖКТ, приведшую к его нарушениям. Назначение адекватной диагностической программы позволит правильно оценить ситуацию и проводить как этиопатогенетическое лечение основной патологии, так и коррекцию микроэкологических нарушений. Это приведет не только к повышению эффективности лечения, но и позволит снизить стоимость лечения и избежать полипрагмазии [1]. Лабораторная диагностика дисбактериоза чаще всего базируется на микробиологическом анализе фекалий. Микробиологическими критериями служат снижение бифидолактобактерий, снижение или увеличение эшерихий, появление штаммов с измененными свойствами, повышение количества кокков, обнаружение условно-патогенных грамотрицательных палочек, а также грибов и клостридий более 10 3 КОЕ/л. В анализах возможны различные сочетания указанных сдвигов [7].
Современные принципы лечебной коррекции дисбиотических сдвигов и восстановления эубиоза включают более широкий арсенал мероприятий, чем только назначение фармакологических препаратов. Особое внимание следует уделять режиму питания и диете больного ребенка, так как с нормализацией среды обитания активизируется метаболизм и увеличивается численность облигатной микрофлоры. Доказательством этому служит неожиданный результат исследования, проведенного Усовой О. В. (2005). По данным автора, дети, проживающие в условиях строгого режимного и диетологического контроля (детский дом), несмотря на крайне неблагополучный преморбидный фон, значительно реже и в более легкой форме болеют кишечным дисбактериозом, чем социально благополучные дети [15].
Диета, как правило, позволяет восстановить нормальное пищеварение в течение двух месяцев. Учитывая, что АД у детей раннего возраста в 73% случаев развивается за счет сенсибилизации к белкам коровьего молока, перспективным является использование адаптированных диетологических продуктов со сменой источников и структуры белка: белок козьего молока, гидролизованный белок коровьего молока, белок сои и т. д. [10]. У детей постарше диета во время лечения должна содержать минимум углеводистой пищи. Функциональное питание с большим количеством балластных веществ (пищевые волокна, отруби), продукты, обогащенные живыми культурами бактерий (кефир, кисломолочные смеси, йогурты и др.). Для полного преодоления дисбактериоза нужно употреблять больше растительной пищи. Очень полезна диета, в состав которой входят продукты, подавляющие гнилостные процессы в кишечнике: абрикосы, черная смородина, рябина, клюква, тмин, при условии, что у ребенка с АД нет пищевой аллергии к этим продуктам.
При грибковых дисбактериозах необходимо отказаться от всего, что содержит дрожжевые культуры, — винограда, изюма, кваса, свежего хлеба, сыра, грибкового кефира. Неблагоприятно действует на кишечную флору систематическое употребление рафинированных, консервированных продуктов, дрожжей, копченостей. Наибольших успехов в этом направлении достигли японские исследователи, которые считают развитие индустрии функционального питания самым перспективным направлением в решении проблемы ликвидации дисбактериоза. Сейчас в Японии, вышедшей на первое место по средней продолжительности жизни, 30% продуктов питания ферментируется или обогащается живыми бифидобактериями.
Большой интерес представляет развитие нового направления в лечении дисбактериоза — терапия пребиотиками. Препараты этой группы выделены из естественных источников, обладают определенными регулирующими функциями и в скором времени будут конкурировать на рынке с многими лекарственными препаратами. В отличие от пробиотиков, которые вносят пробиотические бактерии извне, пребиотики выступают питательной средой для восстановления собственной полезной микрофлоры организма. Исследования на добровольцах показывают, что аутомикроорганизмы обеспечивают более быстрое восстановление нормального состояния микрофлоры кишечника, чем вводимые извне [20]. Основой пребиотиков явлются препараты, содержащие бифидогенные факторы, стимулирующие рост и развитие полезных бактерий (лактулоза, соевый олигосахарид, ксилобиоза и др.), с практической стороны хорошо зарекомендовали себя препараты, содержащие лактулозу. Идеальным сочетанием являются лекарственные средства, содержащие пребиотики и адсорбенты.
Адсорбенты выводят из организма токсичные вещества и уменьшают метеоризм, как правило, наблюдающийся при дисбактериозе. В частности, таким условиям удовлетворяет лекарственный препарат Лактофильтрум, содержащий пребиотик и сорбент. Лактулоза, входящая в состав препарата Лактофильтрум, является синтетическим стереоизомером молочного сахара — лактозы. Продукты бактериального метаболизма лактулозы сдвигают pH среды в толстой кишке в кислую сторону, угнетая тем самым размножение патогенных микроорганизмов и процессы гниения. Во-вторых, являясь пищевым субстратом для бактерий, лактулоза стимулирует рост бифидобактерий и лактобактерий. Вторая составляющая препарата Лактофильтрум — лигнин, который представляет собой сложное природное органическое соединение, продукт гидролизной переработки древесины. Лигнин за счет большой площади поверхности и развитой системы пор обладает высокой сорбционной емкостью и, таким образом, способен выводить из организма токсины, аллергены и патогенную микрофлору.
Для лечения дисбактериоза используются также препараты, улучшающие пищеварение (например, ферментный препарат Микразим и др.).
Для нормализации сократительной способности кишечной стенки применяется иглорефлексотерапия, специальные системы массажа и самомассажа живота [17]. Одновременно с лечением дисбактериоза лечатся нарушения пищеварения, глистные инвазии.
Несмотря на то, что до настоящего времени существует много нераскрытых вопросов этиологии и патогенеза развития дисбактериоза у больных АД, ясным является то, что кишечная микрофлора, неся большую функциональную нагрузку, участвует в возникновении и поддержании патологических расстройств при АД. Данный факт обязывает врачей корректировать эти нарушения с учетом режима и характера питания, используя современные комбинированные средства (Лактофильтрум), содержащие пребиотики и энтеросорбенты.
Литература
Ю. А. Галлямова, доктор медицинских наук, профессор
РМАПО, Москва
Атопический дерматит (АД) – хроническое рецидивирующее заболевание кожи, проявляющееся интенсивным зудом, высыпаниями в сочетании другими многочисленными признаками атопии (необычностью) – атопический ринит, бронхиальная астма, мигрень, гастродуоденит и др.
Атопический дерматит — симптомы
АД в мире страдают 5-15 % детей и 2-10 % взрослых, впервые выявленный в детстве АД продолжается у 45- 60 % взрослых пациентов. АД отличается хроническим рецидивирующим течением с возрастной динамикой клинических проявлений. По проявлениям заболевание возможно разделить на три периода.
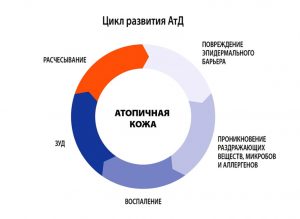
- В младенческом возрасте (до 1.5-2 лет) заболевание носит острый характер, преобладают явления покраснения, отечности, мокнутия и коркообразования.
- В период от 2 лет до полового созревания болезнь носит характер хронического воспаления, на коже на первый план выступают явления гиперемии (эритемы) и шелушения, признаки вегетососудистой дистонии. Кожа в очагах поражения гиперпигментирована, из-за сильного зуда появляются множественные расчесы.
- У детей старшего возраста и взрослых преобладают явления инфильтрации (уплотнения) на фоне гиперемии застойного характера. На коже могут появляться зудящие высыпания, имеющие цвет нормальной кожи, которые сливаются в очаги сплошной папулезной инфильтрации. Обычно к 50 годам заболевание самостоятельно регрессирует.
Атопический дерматит – многофакторное заболевание, характеризующееся аномальным иммунным ответом на аллергены природного происхождения, наследственной предрасположенностью к заболеванию, хроническим рецидивирующим течением. Большое внимание уделяется различным факторам, запускающим процесс в коже и длительно поддерживающим хроническое течение заболевания. К таким факторам относятся бактериальные, вирусные, грибковые, паразитарные и кишечные инфекции, продукты питания и химические вещества (добавки к пище, лекарства), клещи из домашней пыли.
Атопический дерматит и хеликобактер пилори
В последние годы доказана связь атопического дерматита с болезнями органов пищеварения. Установлено, что большинство больных, страдающих АД, имеют хронический гастрит, гастродуоденит, синдром раздраженного кишечника с запорами, заболевания печени и желчного пузыря, нарушение микрофлоры кишечника и др. Нередко существование этих сопутствующих болезней является пусковым фактором атопического дерматита, как у детей, так и у взрослых.
Так, в последние десятилетия в возникновении заболеваний желудка доказана роль специфического микроорганизма – Helicobacter pylori (НР), повреждающего слизистую оболочку желудка. Его наличие способствует активному поступлению токсинов и аллергенов в организм, развитию хронического воспаления слизистой желудка. У больных атопическим дерматитом в 90% случаев при проведении эндоскопического обследования желудка выявляется хронический гастрит и в 82.5% ассоциированный с НР. Отмечена связь между степенью обсеменения бактериями слизистой желудка, активностью хронического гастрита и степенью тяжести АД, что явилось обоснованием к включению в план обследования больных АД на хеликобактериоз и лечебных мероприятий антихеликобактерной терапии. Клинически гастриты у большей части больных АД протекают бессимптомно.
Эрадикация хеликобактера приводит к разрешению заболевания почти у трети больных АД, к улучшению течения АД у остальных пациентов, и самое главное, удлинению периода ремиссии заболевания АД и перехода непрерывного течения заболевания к рецидивирующему.
Обязательным условием профилактики АД у больных хроническим гастритом, ассоциированным с НР, учитывая оральный путь инфицирования, является обследование на хеликобактериоз контактных лиц в семье и вне ее!
Защитная роль кишечника
Здоровье невозможно без нормального функционирования кишечника, которому принадлежит большая роль в детоксикации и иммунологических процессах, которые протекают в организме человека. Слизистая кишечника представляет собой место контакта организма с окружающей средой. Для сравнения: поверхность кожи составляет около 2 квадратных метров, площадь же слизистой оболочки желудочно-кишечного тракта – около 400 квадратных метров. Поэтому слизистую кишечника считают самой большой частью защитной системы организма.
Для надежной защиты от внешнего вмешательства в пищеварительном тракте важнейшим оказался микробиологический барьер.
- Защитная микрофлора кишечника наиболее многочисленная (95%) и представлена в основном бифидобактериями, лактобактериями и кишечной палочкой. Эти микроорганизмы выделяют молочную и уксусную кислоты и другие вещества, которые обладают антимикробным действием и препятствуют проникновению и закреплению на слизистой кишечника вредных микроорганизмов, которые не свойственны человеку. Они стимулируют иммунную систему организма человека, являются сорбентами, которые способны накапливать значительное количество тяжелых металлов и других токсических веществ.
- Сапрофитная микрофлора кишечника представлена стафилококками, энтерококками и другими микроорганизмами, основная роль которых — утилизация конечных продуктов обмена организма человека.
- Оппортунистическая микрофлора представлена различными микроорганизмами (стрептококки, золотистый стафилококк, грамотрицательные энтерококки, грибы рода кандид и др.), которые при определенных условиях вызывают патологический процесс.
Для человеческого организма исключительно важно поддержание требуемого состава и количества кишечных бактерий. Оптимальные условия могут быть нарушены вследствие неправильного питания, возбудителями диареи (бактерии и паразиты), дополнительными отрицательными факторами могут быть токсические вещества, поступающие из окружающей среды, например, тяжелые вещества – кадмий, свинец, ртуть, а также путешествия в другие страны с иными микроорганизмами. Отрицательным действием на флору обладают многие лекарственные средства и методы лечения, непереносимость продуктов питания, вредно одностороннее и несбалансированное питание, недостаточность пищеварительных ферментов.
Атопический дерматит и дисбактериоз
Многие кожные болезни, и в том числе Атопический дерматит, сопровождаются дисбактериозом, и при этом считается, что отягощающим фактором при АД является недостаточное количество лактобактерий. Именно лактобактерии в значительной степени снижают всасывание аллергенов в кишечнике и стимулируют образование иммуноглобулинов класса А, которые, особенно в раннем возрасте, являются основными антителами против пищевых аллергенов.
В настоящее время считают, что возникновение кожных заболеваний в определенной мере связано с нарушением микроэкологического баланса кишечника. У 80-95% больных атопическим дерматитом отмечается дисбактериоз кишечника, при этом наряду с дефицитом лактобактерий и бифидобактерий наблюдается избыточный рост золотистого стафилококка, кишечной палочки с измененными свойствами, грибов роста кандид, выделяющих токсины.
Эти нарушения требуют санации кишечника от вредных бактерий, проведения детоксикационной терапии (энтеросорбции) и создания условий для развития собственной микрофлоры пациента, регуляции работы кишечника (борьба с запорами). Энтеросорбция – неинвазивный метод детоксикации и направлена она на выведение из организма различных эндогенных и экзогенных аллергенов, токсинов, условно-патогенных микроорганизмов и продуктов их жизнедеятельности. Одним из самых эффективных сорбентов являются природные органические на основе пищевых волокон, таких как лигнин, который не усваивается в пищеварительной системе и обладает высокой сорбционной активностью.
Новое направление лечения АД представляет собой применение пребиотиков (лактулоза), полученных из естественных источников и выступающих в качестве питательной среды для развития своей собственной нормальной флоры кишечника. Сочетание сорбента и пребиотика представлено в препарате Лактофильтрум, который производится из компонентов природного происхождения в таблетированной форме, прост в употреблении — по 2 таблетки 3 раза в день в течение 3-4 недель.
В клинической практике выявлена корреляция между степенью выраженности дисбактериоза и проявлений АД. Кроме прямого влияния дисбактериоза на сенсибилизацию организма при АД, в настоящее время доказано опосредованное влияние на состав аутомикрофлоры кожи у больного АД.
Образование токсических веществ в кишечнике в дальнейшем действует не только на иммунную систему, но и нарушает детоксикационную функцию печени, образование и выделение желчи из печени, желчевыводящих путей и желчного пузыря.
Атопический дерматит и желчный пузырь
При обследовании больных, страдающих атопическим дерматитом, в 60% случаев определяется дискинезия желчевыводящих путей, у взрослых по гипотоническому типу, т.е. желчный пузырь плохо сокращается, и не выводятся токсические вещества из организма.
У 31% пациентов в желчном пузыре определяется густая желчь, с хлопьями или мягкими конкрементами (сладж желчи), что свидетельствует о нарушении качественного состава желчи, продуцируемой печенью. Таким образом, нарушается еще одна функция органов пищеварения, осуществляющая детоксикационную функцию организма.
При этом в комплекс лечения больных АД добавляются желчегонные препараты (желчегонные сборы трав, Хофитол, Гепабене, настой шиповника или Холосас, Холит и др.), а также назначаются препараты, улучшающие функцию печени и качество желчи, продуцируемой печенью (Урсофальк, Урсосан, Уролесан), препараты расторопши, гептрал, гепатосан и др., проводятся гуманные тюбажи желчного пузыря (с растительными маслами, медом, минеральной водой).
Клинический опыт показывает, что улучшение состояния микрофлоры кишечника, регуляция работы кишечника без запоров и улучшение работы печени и желчевыводящей системы и желчного пузыря способствует более эффективному лечению больных с атопическим дерматитом.
Питание при атопическом дерматите
Несколько слов о питании у больных АД. Питание для больных АД во многих случаях не играет настолько большой роли, как часто полагают. Существует огромное количество продуктов питания, для которых выявлена взаимосвязь с АД, но в конечном счете реальным фактором является только индивидуальная чувствительность. Существует целый спектр потенциально опасных продуктов, и каждый пациент должен составить индивидуальный рацион питания. Пациентам с АД необходимо соблюдать полноценное питание, избегать строгих диет, особенно в детском возрасте.
Продукты питания, которые могут оказывать негативное воздействие на Атопический дерматит:
- Острые, копченые продукты,
- пряности,
- алкоголь,
- овощи (перец, редис, квашеная капуста, сельдерей, помидоры),
- орехи,
- сладости (мед, сахар, сушеные фрукты, шоколад),
- крепкие мясные бульоны,
- маринады,
- кофе, какао,
- яйца, молоко,
- рыба,
- пищевые добавки, консерванты, пищевые красители.
Пациент и сам должен активно участвовать в процессе оздоровления своего организма. Особенно следует обратить внимание на такие важные мероприятия как:
- полноценное питание,
- отказ от сахара,
- употребление в пищу пищевых волокон (отруби, пектины, сложные углеводы),
- употребление кисломолочных продуктов, заквашенных лактобактериями, или препараты с лактобактериями,
- отказ от свинины.
Атопический дерматит — фитотерапия
Важное место в лечении и профилактике обострений играет фитодиетология. Она включает использование соков из клюквы, черной смородины, красной и черноплодной рябины, свекольный, сливовый, яблочный, черничный, тыквенный, капустный соки.
Лечение Атопического дерматита травяными сборами
Несколько прописей травяных сборов, применяемых при АД.
- Сбор 1. Трава череды 10.0, листья подорожника 10.0, листья крапивы 10.0, трава полыни 5.0, трава тысячелистника 5.0, трава зверобоя 15.0, трава хвоща 10.0, листья толокнянки 20.0. Смешать, приготовить настой из 1 чайной/столовой ложки (в зависимости от возраста). Принимать по 1/3 стакана 3 раза в день до еды, прием 1-2 месяца.
- Сбор 2. Трава трехцветной фиалки 20.0, корень девясила 10.0, трава зверобоя 15.0, трава хвоща 10.0, шишки хмеля 10.0, трава душицы 10.0, цветки ромашки 15.0, трава мяты перечной 5.0. Смешать. Доза и способ приготовления настоя. Принимать по 1/3 стакана 3 раза в день после еды в течение 1-2 месяцев.
- Атопический дерматит с сопутствующими запорами. К 1и 2 настою добавить слабительный сбор, настой плодов фенхеля (5.0:200.0), настой листьев подорожника (10.0:200.0), настой плодов тмина (5.09:200.0) или препараты лактулозы (Дюфалак, Нормаза, лактусан)
- Атопический дерматит при длительном течении процесса, особенно в зимне-весеннем периоде. Используются растительные лекарственные препараты с витаминными свойствами. Это настой листьев крапивы (15.0:200.), плодов шиповника (10.0:200.0), листьев черной смородины и ее плодов.
- Атопический дерматит с выраженными мокнутиями, отечностью и инфильтраций кожных покровов. Полезны настои плодов можжевельника (5.0:200.0), листьев почечного чая (3.5:200.0), травы хвоща полевого (10.0:200.0), мочегонного сбора.
- В целях улучшения показателей неспецифического иммунитета применяют настой цветков черной бузины (5.0:200.0), настой корня солодки (10.0:200.0), экстракт элеутерококка или настойку аралии по 2-3 капли (в зависимости от возраста ребенка) утром и вечером в течение 2 недель.
- Сбор для нормализации углеводного обмена. Настой листьев крапивы (10.0:200.0), отвар корня одуванчика (10.0:200.), настой листьев черники (10.0:200.0), отвар корня лопуха (5.0:200.0). Эти настои обладают противовоспалительным, противозудным свойством, оказывают нормализующее действие на желчевыводящие пути и поджелудочную железу.
Местное лечение Атопического дерматита
Примеры повязок на мокнущие поверхности:
- Повязка с настоем коры дуба: 2 столовые ложки дубовой коры разводятся в 500 мл воды и кипятятся в течение 15 минут, после чего настой процеживают, остужают, в него опускают ткань для компресса и неплотно накладывают на больное место. Достаточно применять такие компрессы 3-4 дня, но ежедневно нужно готовить свежий отвар.
- С этой же целью можно использовать отвар лапчатки (15г:200.0), настой травы зверобоя или тысячелистника (15г:200.0).
- Компресс из трехцветных фиалок: 2 чайные ложки сухих фиалок настаивают в чашке кипятка, получившийся настой сливают, остужают и используют для компрессов на пораженные места.
- Очень широко используются растворы соли, например ванны с солями Мертвого моря. При правильном комплексном лечении мучительный зуд исчезает быстро, но если он сохраняется, то втирание разведенного яблочного уксуса может в значительной степени облегчить зуд.
- После прекращения мокнутий применяются мази, кремы. Пример мази следующего состава: сок подорожника 15 мл, настойка ландыша 5 мл, настойка валерианы 5 мл, настойка календулы 5 мл, димедрол 1 г, паста цинковая 79 г. Смешать. Наносить на пораженные участки 2-3 раза в день тонким слоем после удаления ранее нанесенной мази растительным маслом.
Для очистки кожи не использовать мыло! Можно использовать масляно-молочную ванну: 1 столовая ложка оливкового масла и 200 мл молока добавляются в ванну.
Следует придерживаться правила: каждые 3-4 дня препараты наружной терапии следует менять между собой для предупреждения развития побочных эффектов.
Читайте также:

