При гиперплазии может быть молочница
Обновлено: 24.04.2024
Что такое вагинальный кандидоз (молочница)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Соснина А. С., гинеколога со стажем в 15 лет.
Над статьей доктора Соснина А. С. работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Вагинальный кандидоз (кандидозный вагинит) — поражение слизистой оболочки влагалища дрожжеподобными грибами рода Candida. В быту эту болезнь называют молочницей .
Краткое содержание статьи — в видео:
Candida — это условно-патогенные микроорганизмы, факультативные анаэробы (организмы, способные жить как в присутствии кислорода, так и без него). Они обладают тропизмом — направлением роста на клетки богатые гликогеном, в частности клетки слизистой оболочки влагалища. Самый распространённый вид возбудителя, который встречается в 70—90 % случаев, — Candida albicans.
В последние годы растёт заболеваемость кандидозом, вызванным другими представителями рода Candida. Наиболее часто выявляются:
- С. glabrata (15 %);
- C. dubliniensis (6 %);
- C. tropicalis (3—5 %);
- C. parapsilosis (3 %);
- C. krucei (1—3 %).
Распространение новых видов микроорганизмов связано в первую очередь с бесконтрольным самолечением пациенток, приводящем к возрастающей устойчивости грибов к препаратам [3] [4] .
Частота кандидозного вагинита среди инфекционных заболеваний влагалища и вульвы составляет 30—45 %. Патология занимает второе место среди всех инфекционных заболеваний влагалища и является крайне распространённым поводом для обращения женщин за медицинской помощью. По данным J. S. Bingham (1999):
- к 25 годам около 50 % женщин репродуктивного возраста сталкивались с хотя бы одним диагностированным врачом эпизодом вагинального кандидоза;
- к началу периода менопаузы — около 75 % [17] .
Кандидозный вагинит редко наблюдается в постменопаузе, за исключением тех пациенток, которые получают гормональную заместительную терапию.
Предрасполагающими факторами заболевания являются:
- Механические — ношение синтетического белья, первый половой контакт, травматическое повреждение тканей влагалища, длительное применение внутриматочной спирали.
- Физиологические — беременность, менструация.
- Эндокринные — гипотиреоз, сахарный диабет.
- Иммунодефицитные состояния.
- Ятрогенные (приём антибиотиков, кортикостероидов, иммуносупрессоров, лучевая терапия, химиотерапия, онкологические заболевания, оральные контрацептивы).
- Прочие (авитаминоз, аллергические заболевания, хронические патологии гениталий и желудочно-кишечного тракта).
Заболевание, как правило, не передаётся половым путём, но установлено, что оно связано с характером половых контактов: анально-вагинальным и орогенитальным. Также не исключается вероятность развития кандидозного баланопостита у половых партнёров пациенток с вагинальным кандидозом.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы вагинального кандидоза
Основные симптомы при вагинальном кандидозе:
- жжение и зуд в области влагалища и вульвы;
- творожистые выделения из влагалища;
- расстройства мочеиспускания;
- боль при половом акте.
Зуд может усиливаться после водных процедур, полового акта, ночью во время сна и в период менструации [1] .
В целом симптомы вагинального кандидоза нарастают перед менструацией. При беременности проявление болезни также усугубляется, это связано со снижением иммунитета у беременных женщин.
Объективные признаки вагинального кандидоза:
- отёк и гипермия слизистой оболочки влагалища и наружных половых органов;
- белые или зеленовато-белые наложения на стенках влагалища;
- покраснение слизистой влагалища.
При осложнённом кандидозе на коже наружных половых органов появляются везикулы — пузырьки, возвышающиеся над уровнем кожи или слизистой и заполненные прозрачным или мутным содержимым, которые могут вскрываться и образовывать эрозии. При вагинальном кандидозе также могут наблюдаться трещины слизистой вульвы, задней спайки и перианальной области [2] .
Патогенез вагинального кандидоза
Грибы рода Candida относятся к условно-патогенной микрофлоре, которая присутствует как в окружающей среде, так и на поверхности кожных покровов и слизистых оболочках здорового человека (в полости рта, кишечнике, влагалище). При снижении защитных сил организма возможно повышение адгезивных свойств (способности прилипать) грибов с прикреплением их к клеткам эпителия влагалища, колонизацией слизистой оболочки и развитием воспалительной реакции [7] .
Вагинальный кандидоз зачастую затрагивает только поверхностные слои эпителия влагалища без проникновения возбудителя в более глубокие слои слизистой оболочки. Однако в редких случаях эпителиальный барьер преодолевается и происходит инвазия в подлежащую ткань с последующей гематогенной диссеминацией (распространением возбудителя инфекции из первичного очага заболевания по всему органу или организму посредством кровотока) [8] [9] .
Основные этапы патогенеза:
- Адгезия (прилипание) грибов на слизистой и колонизация.
- Инвазия (проникновение) в эпителий.
- Преодоление эпителиального барьера.
- Проникновение в соединительную ткань.
- Преодоление защитных механизмов ткани.
- Попадание в сосуды.
- Гематогенная диссеминация.
При вагинальном кандидозе воспаление происходит в верхних слоях эпителия влагалища. Причина состоит в том, что поддерживается динамическое равновесие между грибом, который не может проникнуть в более глубокие слои, и организмом, который сдерживает его распространение. Соответственно инфекция может долго развиваться в одном месте, проявляясь творожистыми выделениями из влагалища. Обострение заболевания происходит при сдвиге равновесия между развитием грибов и защитными силами организма.
Классификация и стадии развития вагинального кандидоза
Согласно национальным клиническим рекомендациям [18] , выделяют две формы вагинального кандидоза:
- острую — до трёх обострений в год;
- хроническую (рецидивирующую) — не менее четырёх обострений в год.
По классификации, предложенной D.A. Eschenbach, вагинальный кандидоз подразделяют на два типа:
У женщин различают три формы заболевания:
- вагинит (воспаление влагалища); (воспаление влагалища и вульвы); (воспаление шейки матки).
У мужчин выделяют:
- баланит (воспаление головки полового члена);
- баланопостит (воспаление крайней плоти и головки полового члена); (воспаление мочеиспускательного канала).
Для острой формы вагинального кандидоза характерны выраженные симптомы: обильные выделения из влагалища, жжение и зуд во влагалище и наружных половых органах. На фоне таких симптомов нередко снижается трудоспособность пациентки и развиваются неврозы. Острая форма вагинального кандидоза встречается наиболее часто и формируется в результате увеличения количества грибов рода Candida во влагалище на фоне снижения иммунитета пациентки.
Рецидивирующий вагинальный кандидоз — встречается у 10—15 % женщин репродуктивного возраста и проявляется четырьмя и более обострениями за год [11] .
Неосложнённая форма заболевания предполагает впервые выявленный или возникающий менее четырёх раз в год вагинальный кандидоз с умеренными проявлениями вагинита у пациенток без сопутствующих факторов риска (сахарный диабет, приём глюкокортикоидов, цитостатиков и др.).
При осложнённом вагинальном кандидозе наблюдаются яркие объективные симптомы: покраснение, отёк, образование язв, трещин слизистых оболочек и кожи перианальной области. Также характерны рецидивы четыре и более раз в год. Заболевание часто возникает на фоне сахарного диабета, ВИЧ-инфекции, терапии глюкокортикоидами и цитостатиками. Возбудителем заболевания в данном случае являются как C. albicans, так и другие грибы рода Candida.
Осложнения вагинального кандидоза
К осложнениям вагинального кандидоза у женщин относятся:
- стеноз влагалища;
- воспалительные патологии органов малого таза — сальпингит, оофорит и другие;
- заболевания мочевыделительной системы — цистит, уретрит[2] .
Стеноз влагалища развивается при воспалении стенок влагалища. При этом просвет влагалища сужается, а стенки влагалища становятся плохо растяжимы. Пациентки испытывают боль при половом акте.
Сальпингит — инфекционно-воспалительное заболевание фаллопиевой (маточной) трубы. Возникает при переходе инфекции восходящим путем из влагалища, не исключен также и гематогенный путь передачи. Сальпингит чаще всего протекает в сочетании с оофоритом — воспалением яичника. Поражение может быть как односторонним, так и двусторонним. Пациентки испытывают боль в области придатков, внизу живота слева или справа, повышается температура тела, возникает общее недомогание, слабость, а иногда и тошнота со рвотой. При несвоевременном лечении данного осложнения высок риск бесплодия, наступления внематочной беременности, возникновения спаечного процесса, приводящего к оперативному вмешательству, инфицированию органов брюшины и малого таза. Сальпингит особенно опасен в случаях, когда с кандидозом сочетаются другие инфекции [1] .
Уретрит — воспаление слизистой мочеиспускательного канала. Проявляется болезненным мочеиспусканием, чувством жжения в области уретры, выделением с мочой крови или гноя, дискомфортом при соприкосновении с бельём, слипанием краёв уретры, покраснением области вокруг мочеиспускательного канала.
Цистит — воспаление мочевого пузыря. Патология возникает при попадании возбудителя восходящим путём через уретру в мочевой пузырь. Симптомы цистита схожи с симптомами уретрита, однако есть некоторые отличия: частые позывы к мочеиспусканию при небольшом количестве мочи, чувство неполного опорожнения мочевого пузыря, боль, резь в конце мочеиспускания, помутнение мочи, повышение температуры тела, боли внизу живота.
На фоне вагинального кандидоза возрастает частота осложнений при беременности, а также увеличивается риск инфицирования плода.
Кандидоз плода может вызвать его внутриутробную гибель или приводить к преждевременным родам. После родов у женщин возможно развитие кандидозного эндометрита — воспалительного процесса в тканях, выстилающих внутреннюю полость матки.
Диагностика вагинального кандидоза
Диагностика вагинального кандидоза основывается на характерных жалобах пациентки, данных анамнеза, клинических проявлениях, выявленных при гинекологическом осмотре. В зеркалах видна гиперемия, отёк слизистой, белые налёты на стенках влагалища.
Независимо от этих признаков, подтверждение диагноза должно основываться на лабораторных данных:
- Микроскопия мазков вагинального отделяемого — позволяет выявить споры и мицелий гриба.
- Культуральный метод — посев влагалищного содержимого на искусственные питательные среды. Метод определяет количество, видовую принадлежность, чувствительность к противогрибковым препаратам, а также характер и степень заселения другими микроорганизмами. Культуральный метод дополняет микроскопию.
- Серологическая диагностика (РСК). Определяет антитела против антигенов грибов рода Candida. Такая диагностика имеет значение при генерализации процесса.
- Молекулярно-биологические методы. Направлены на обнаружение специфических фрагментов ДНК Candida spp. Применяют метод полимеразной цепной реакции (ПЦР).
- Иммунофлюоресцентная диагностика (Candida Sure Test) проводится в случае рецидивирующего течения вагинального кандидоза [15] .
К дополнительным методам диагностики относятся: изучение микробиоценоза кишечника, обследование на инфекции, передаваемые половым путём, внутривенный тест на толерантность к глюкозе [16] .
Дифференциальную диагностику проводят со следующими заболеваниями:
- генитальным герпесом; ;
- аэробным вагинитом;
- кожными заболеваниями (экземой, красным плоским лишаём, склеродермией, болезнью Бехчета и др.).
Лечение вагинального кандидоза
Показаниями к назначению терапии вагинального кандидоза являются жалобы пациентки, клинические проявления и лабораторное подтверждение наличия грибов рода Candida. Лечение не требуется при обнаружении грибов без каких-либо клинических проявлений (кандидозоносительство). Это правило обусловлено тем, что грибы рода Candida могут содержаться в небольшом количестве во влагалище и являются частью нормальной микрофлоры, если их количество не превышает пороговое значение 10 4 .
Механизм действия противогрибковых препаратов — нарушение синтеза эргостерола (вещества в составе клеточных мембран грибов), что приводит к образованию дефектов в мембране микроорганизма. В зависимости от дозы антимикотики проявляют фунгистатическое (замедление роста) или фунгицидное (полное уничтожение) действие [15] .
Существуют различные группы препаратов для лечения вагинального кандидоза:
- антибиотики (пимафуцин, амфотерицин В, нистатин, леворин);
- имидазолы (клотримазол, сертаконазол, кетоконазол, гино-певарил, миконазол);
- триазолы (итраконазол, флуконазол);
- комбинированные препараты ("Тержинан", "Полижинакс", "Пимафукорт", "Клион Д", "Макмирор комплекс");
- препараты разных групп (флуцитозин, гризеофульвин, дафнеджин, нитрофунгин, йодат поливинилпирролидон).
Лечение подбирается гинекологом индивидуально для каждой пациентки, учитывая клиническую картину, форму заболевания и степень выраженности симптомов. Но важно отметить, что при лечении молочницы при беременности флуконазол противопоказан, так как он может негативно повлиять на развитие плода [19] [20] .
При лечении острых форм вагинального кандидоза назначают местное лечение. Препарат не всасывается в системный кровоток, а действует в области влагалища и слизистой. Примеры схем лечения:
-
150 мг в виде вагинальных свечей один раз в сутки в течение трёх дней; один аппликатор крема на ночь вагинально в течение трёх дней; одна свеча на ночь один раз в сутки в течение восьми дней; одна таблетка на ночь в течение 10 дней.
При хроническом кандидозе наряду с местным лечением применяют системные антимикотики:
-
150 мг один раз внутрь; 200 мг внутрь два раза с интервалом 12 часов в течение одного дня или 200 мг в сутки в течение трёх дней.
При рецидивирующей форме заболевания (более четырёх эпизодов в год) применяют схему:
-
150 мг внутрь три раза с интервалом 72 часа в 1,4 и 7 день лечения.
Для купирования рецидивов препарат применяют в дозировке 150 мг один раз в неделю в течение шести месяцев.
В последние годы всё больше исследуется способность C. albicans формировать биоплёнки — вещества на поверхности колонии микроорганизмов, которые служат барьером для проникновения лекарственных средств и обеспечивают выживание. Основным полисахаридом, определяющим развитие резистентности к антибиотикам, является глюкан. Его рассматривают как одну из причин формирования резистентности к антимикотическим препаратам. Этим объясняется отсутствие эффекта при лечении у некоторых больных. Таким пациенткам можно порекомендовать препарат фентиконазол 600 мг в сутки с интервалом в три дня. Лекарство отличается от других способностью преодолевать биоплёнки, тем самым повышая эффективность лечения при резистентности к другим препаратам.
Прогноз. Профилактика
При своевременном обращении пациентки к врачу, лабораторном обследовании и отсутствии самолечения прогноз благоприятный. Самолечение опасно из-за риска рецидива заболевания, его хронизации и возникновения резистентности к препарату, неверно выбранному пациенткой или при неадекватной дозе.
Чтобы повысить эффективность терапии пациентки должны следовать схеме лечения, индивидуально назначенной гинекологом. Во время лечения и диспансерного наблюдения необходимо соблюдать половой покой или применять барьерные методы контрацепции. Повторно обратиться к врачу для контроля анализов следует через 7-10 дней [12] .
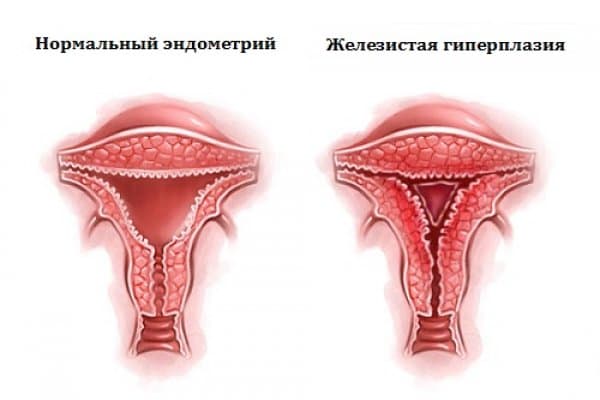
Железистая гиперплазия эндометрия – избыточное разрастание железистой ткани эндометрия, характеризующееся его утолщением и увеличением объема. Железистая гиперплазия эндометрия проявляется обильными менструациями, дисфункциональными ановуляторными кровотечениями, анемией, бесплодием. Для определения гиперпластической трансформации эндометрия проводится УЗИ, гистероскопия, Эхо-ГСГ, биопсия эндометрия, гормональные исследования. Лечение железистой гиперплазии эндометрия включает выскабливание полости матки, гормонотерапию, при необходимости – резекцию или абляцию эндометрия.
МКБ-10
Общие сведения
В основе железистой гиперплазии эндометрия лежат чрезмерно активные пролиферативные процессы в железистой ткани матки. Основной опасностью гиперпластических изменений эндометрия служит возможность их прогрессирования и злокачественной трансформации. Поэтому важность диагностики и лечения железистой гиперплазии эндометрия диктуется актуальностью сохранения репродуктивного потенциала женщины и профилактики рака эндометрия. Диагноз железистой гиперплазии может быть поставлен только по результатам гистологического исследования образцов эндометрия.
Причины развития железистой гиперплазии эндометрия
Гиперпластическая трансформация эндометрия может возникать у женщин любого возраста при наличии факторов риска, но чаще встречается в переходные периоды, связанные с гормональными изменениями в организме (у подростков и пациенток пременопаузального возраста).
Фоновыми генитальными процессами, сопутствующими развитию железистой гиперплазии эндометрия, являются миома матки, синдром поликистозных яичников, эндометриоз, эндометриты. Развитию железистой гиперплазии эндометрия нередко предшествуют гинекологические операции, диагностические выскабливания эндометрия, аборты. Факторами риска гиперпластических процессов матки служит отсутствие в анамнезе у женщины родов, отказ от использования гормональной контрацепции, искусственное прерывание беременности, поздняя менопауза.
К экстрагенитальным сопутствующим заболеваниям относятся сахарный диабет, мастопатия, гипертония, ожирение, заболевания щитовидной железы, печени и надпочечников. Ведущим моментом возникновения железистой гиперплазии эндометрия служит гиперэстрогения или длительное воздействие эстрогенов при снижении сдерживающего влияния прогестерона.
Классификация гиперплазии эндометрия
По гистологическому варианту выделяют несколько видов гиперплазии эндометрия: железистую, железисто-кистозную, атипическую (аденоматоз) и очаговую (полипы эндометрия). Железистая гиперплазия эндометрия характеризуется исчезновением разделения эндометрия на функциональный и базальный слои. Граница между миометрием и эндометрием выражена четко, отмечается увеличенное количество желез, но их расположение неравномерно, а форма неодинакова. При железисто-кистозной форме гиперплазии часть желез приобретает кистозно-измененный вид.
Для аденоматоза (атипической гиперплазии) свойственны структурная перестройка и более интенсивная пролиферация элементов по сравнению с железистой гиперплазией эндометрия, полиморфизм ядер, уменьшение числа стромальных элементов. При локальной гиперплазии отмечается разрастание железистого и покровного эпителия вместе с подлежащими тканями, ведущее к образованию эндометриальных полипов (железистых, фиброзных, железисто-фиброзных).
Наибольшую онконастороженность в гинекологии вызывают атипическая и полипозная гиперплазия, которые расцениваются как предраковое состояние. Угроза перехода аденоматоза в рак эндометрия составляет около 10%. Железистая и железисто-кистозная гиперплазия эндометрия менее склонны к озлокачествлению. Такая вероятность возрастает при их рецидивирующем течении после выскабливания эндометрия и неадекватности гормонотерапии.
Симптомы железистой гиперплазии эндометрия
Характерным симптомом железистой гиперплазии эндометрия является расстройство менструальной функции, выражающееся патологическими маточными кровотечениями. Среди форм менструальной дисфункции встречаются меноррагии (циклические кровотечения, превышающие обычные месячные по кровопотере и длительности) и метроррагии (ациклические кровотечения различной продолжительности и обильности).
Кровотечения при железистой гиперплазии эндометрия возникают после незначительной задержки менструации или в межменструальный период. Для ювенильных кровотечений, возникающих при железистой гиперплазии эндометрия у подростков, характерен прорывной характер с выделением сгустков. Длительные и обильные кровотечения со временем способствуют развитию анемии, слабости, недомогания, головокружения. Ановуляторный цикл, отмечающийся при железистой гиперплазии эндометрия, сопровождается бесплодием.
Диагностика железистой гиперплазии эндометрия
Поскольку проявления железистой гиперплазии эндометрия не являются специфичными только для данной патологии, вопросы полноценной и точной диагностики приобретают особую важность. При изучении анамнеза гинеколог расспрашивает о наследственности, особенностях течения менструального цикла, состоянии детородной функции, используемых методах контрацепции, перенесенных общих и гинекологических заболеваниях.
Кроме общего гинекологического осмотра, диагностика железистой гиперплазии эндометрия включает трансвагинальное УЗИ, в процессе которого определяется толщина эндометрия, наличие полипозных разрастаний. При помощи УЗИ-скрининга выявляется контингент женщин, нуждающихся в гистологическом подтверждении диагноза железистой гиперплазии эндометрия с помощью проведения аспирационной биопсии эндометрия либо раздельного диагностического выскабливания.
Диагностическое выскабливание выполняется накануне ожидаемой менструации или сразу после ее начала под контролем гистероскопии. Гистероскопия обеспечивает проведение адекватного кюретажа и полное удаление патологически измененного эндометрия. Соскобы эндометрия подвергаются гистологическому исследованию, позволяющему определить тип гиперплазии и установить морфологический диагноз. При железистой гиперплазии эндометрия информативность диагностической гистероскопии составляет 94,5%, тогда как трансвагинального УЗИ - 68,6%.
При железистой гиперплазии эндометрия у пациентки исследуются уровень прогестерона и эстрогенов, при необходимости – гормоны надпочечников и щитовидной железы. Вспомогательную диагностическую роль играют гистерография или радиоизотопное сканирование. Дифференциальную диагностику при кровотечениях, вызванных железистой гиперплазией эндометрия, проводят с внематочной беременностью, трофобластической болезнью, полипами или эрозией шейки матки, раком тела матки, миомой матки.
Лечение железистой гиперплазии эндометрия
Процедура раздельного диагностического выскабливания полости матки служит первым этапом лечения железистой гиперплазии эндометрия. В дальнейшем с учетом результатов гистологии подбирается схема гормонотерапии, направленная на подавление дальнейшей пролиферации эндометрия и устранение гормонального дисбаланса.
Параллельно с гормональным лечением проводится витаминотерапия, коррекция анемии, иглорефлексотерапия, физиотерапия (электрофорез). Контрольное УЗИ в процессе терапии выполняется через три и шесть месяцев лечения; повторная биопсия эндометрия – по окончании курса. В целях стимуляции овуляторного цикла в дальнейшем применяются стимуляторы овуляции.
В случае рецидива железистой гиперплазии эндометрия на фоне гормонотерапии у пациенток, заинтересованных в деторождении, могут выполняться абляция или резекция эндометрия с помощью лазерных и электрохирургических методики под гистероскопическим контролем. При железистой гиперплазии эндометрии, осложненной эндометриозом, миомой матки, а также в период климакса методом выбора может являться удаление матки: надвлагалищная ампутация, гистерэктомия или пангистерэктомия.
Профилактика железистой гиперплазии эндометрия
После завершения курса лечения железистой гиперплазии эндометрия особую значимость приобретает вопрос предупреждения ее рецидива и рака эндометрия. В этих целях рекомендуется регулярные осмотры гинеколога, консультация гинеколога-эндокринолога и подбор контрацепции, профессиональная подготовка и ведение беременности у пациенток. От самой женщины, своевременности ее обращения к специалисту и выполнения предписаний врача, в значительной мере зависит прогноз железистой гиперплазии эндометрия.
Гиперплазия эндометрия - это доброкачественное заболевание. Основной характерной чертой данного заболевания является разрастание внутреннего слоя матки - эндометрия, что приводит к утолщению и увеличению его объема.
Классификация гиперплазии эндометрия по локализации
- очаговая (наличие полипов на одной или нескольких стенках);
- тотальная ( поражает все стенки полости матки).
Классификация гиперплазии эндометрия (по гистологической картине)
- железистая (с разрастаниями железистой ткани);
- железисто- кистозная (железистая ткань в сочетании с кистами).
- атипическая (синоним “аденоматоз”) c атипическими клетками. Данный вид гиперплазии относят к предраковым заболеваниям. Риск перерождения аденоматоза в рак эндометрия составляет приблизительно 10%.
Причины гиперплазии эндометрия
В настоящее время основной причиной развития гиперплазии считается нарушение баланса женских половых гормонов, который чаще всего встречается в пубертатном периоде и перименопаузе.
Факторы риска развития гиперплазии эндометрия
- гормональные нарушения, а именно, избыток гормона эстрогена на фоне дефицита гормона прогестерона;
- сопутствующие заболевания, такие как: сахарный диабет, повышенное артериальное давление, ожирение, заболевания щитовидной железы, молочных желез и надпочечников;
- воспалительные заболевания половых органов;
- аборты и диагностические выскабливания;
- аденомиоз и миома матки;
- синдром поликистозных яичников;
- наследственная расположенность.
Симптомы, которые встречаются при гиперплазии эндометрия
Основные из них при гиперплазии эндометрия могут быть:
- обильные менструации более 3 -х прокладок в день;
- появление сгустков крови в менструальном отделяемом;
- кровянистые выделения из влагалища в любой день менструального цикла. Эти выделения женщина не связывает с менструацией. Они могут быть сразу после менструации, перед ней или в середине менструального цикла;
- в менопаузе у женщины любые кровянистые выделения, даже самые незначительные, из половых путей являются подозрением на наличие онкологического процесса.
Обследования, которые помогут выявить и поставить диагноз гиперплазии эндометрия
Лечение гиперплазии эндометрия
Практически в 100% случаев лечение гиперплазии эндометрия хирургическое.
Методами хирургического лечения гиперплазии эндометрия является гистероскопия и гистерорезектоскопия.
Гистероскопия - лечебно-диагностическая операция, которая проводится в условиях общей анестезии с использованием прибора гистероскопа. Гистероскоп имеет форму тубуса, с находящейся в ней видеокамерой. Форма гистероскопа позволяет свободно его ввести через влагалище, шейку матки в полость матки. С помощью видеокамеры хирургу в онлайн режиме доступна осмотру полость матки, можно легко выявить локализацию очагов гиперплазии, наличие или отсутствие полипов эндометрия. С помощью электрической петли, находящейся на гистероскопе под контролем видеокамеры, производится удаление очагов гиперплазии, полипов эндометрия при их наличии, возможно разъединение внутриматочных спаек (синехий). Во время операции в обязательном порядке берется биопсия тканей со всех четырех стенок матки и цервикального канала.
Данная операция проводится под общей анестезией. Продолжительность операции не превышает 30 минут, короткий период нахождения под общей анестезией позволяет врачам в тот же день отпустить пациентку домой.
В нашей Клинике данная операция проводится в условиях дневного стационара в течение 1 дня, с выпиской пациентка не позднее 16.00.
Повторная консультация врача - гинеколога проводится через несколько дней, где в зависимости от результатов гистологического исследования пациентке назначается профилактическая, противорецидивная терапия с учетом гистологической картины заболевания, возраста, сопутствующих заболевании и репродуктивных планов конкретной пациентки. Варианты послеоперационной терапии различны и назначаются в индивидуальном порядке для каждой отдельной пациентки.
При неблагоприятной ситуации ( выявлении онкологии или подозрения на онкологический процесс в результатах гистологического исследования) женщине рекомендуется консультация гинеколога- онколога с последующим хирургическим или медикаментозным лечением.
Осложнения гиперплазии
При отсутствии должного и адекватного лечения гиперплазия эндометрия приводит к тяжелой анемии с значительным снижением уровня гемоглобина, появлению слабости, повышенной усталости, сонливости, что связано с большими потерями крови во время менструации. У молодых женщин гиперплазия эндометрия может быть причиной бесплодия и невынашивания беременности. Отдельные формы гиперплазии эндометрия (железистая и кистозная гиперплазии эндометрия) являются предраковым состоянием и в случае длительного наблюдения, при отсутствии лечения, могут переродиться в рак матки.
Профилактические мероприятия при данном заболевании необходимы для того, чтобы снизить риск развития рака эндометрия и предотвратить рецидив гиперплазии.
- 1. Своевременное лечение воспалительных заболевании органов малого таза до перехода их в хроническую форму.
- 2. При наличии диагноза гиперплазия эндометрия диспансерное наблюдение врача-гинеколога 2 раза в год в течение 3 лет.
- 3. Ежегодный осмотр гинеколога, УЗИ малого таза всем женщинам вне зависимости от возраста.
- 4. Наблюдение у врача –терапевта. эндокринолога при наличии факторов риска развития гиперплазии эндометрия.
- 5. Регулярные физические нагрузки, соблюдение диеты с низким содержанием легкоусваиваемых углеводов.
Гиперплазия эндометрия. Часто задаваемые вопросы
1. Что это такое? Доброкачественный процесс, который характеризуется чрезмерным разрастанием внутреннего слоя матки.
2. Из-за чего она возникает? Из-за постоянного воздействия полового гормона эстрогена на эндометрий, который вызывает его чрезмерное разрастание. Гиперэстрогения возникает из-за нарушения центральной регулиции менструального цикла, гормонопродуцирующих опухолей яичников, неправильного использования гормональных препаратов, дефицита прогестерона (гормон II фазы менструального цикла), обладающего антипролиферативным действием, так же в результате ановуляторных циклов.
3. Это распространенное заболевание? Частота встречаемости в структуре гинекологической заболеваемости 15-50%. По данным обращаемости пациенток частота встречаемости ГПЭ- 30%. В позднем репродуктивном возрасте и в перименопаузе встречается с частотой- 50%
4. Это заболевание очень опасно? Пристального внимания врачей заслуживают:
- атипическая гиперплазия эндометрия в любом возрасте;
- атипические полипы эндометрия в любом возрасте;
- железистая гиперплазия эндометрия не поддающаяся гормонотерапии;
- рецидивирующая железистая гиперплазия эндометрия, особенно в пре- и постменопаузальном периоде.
При отсутствии должного лечения гиперплазия эндометрия может приводить к серьезным маточным кровотечениям, со снижением гемоглобина крови и вытекающими отсюда последствиями.
5. Возможно ли забеременеть на фоне гиперплазии эндометрия? Ответ – нет. Гиперплазия эндометрия не возникает спонтанно, это следствие нарушений в репродуктивной системе женщины. Нарушение баланса между звеньями регуляции менструального цикла вызывает избыток эстрогенов в организме женщины, нехватку прогестерона, вследствие этого отсутствие овуляции (выхода яйцеклетки из фолликула для оплодотворения). Так же сам эндометрий структурно изменен, поэтому является неблагоприятным для имплантации (прикрепление плодного яйца к стенке матки).
6. Часто ли гиперплазия озлокачествляется? У 3% женщин с гиперплазией эндометрия без атипии развивается рак эндометрия. У 25-33% женщин с атипической гиперплазией (по соскобу эндометрия) диагностируется рак эндометрия после гистерэктомии в течение последующего года. Поэтому обязательно комплексное лечение гиперплазии эндометрия - это проведение гистероскопии с последующим гормональным лечением. Гормональная терапия подбирается индивидуально, в зависимости от результатов гистологического исследования, периода жизни женщины (репродуктивный возраст, перименопауза, менопауза), репродуктивных планов пациентки. В некоторых клинических случаях требуется расширение объема оперативного вмешательства.
7. Как диагностировать атипическую гиперплазию эндометрия? Большую информацию врач получает при опросе пациентки во время общения (возраст менархе или время наступления менопаузы, все особенности менструального цикла- его длительность, характер выделений и т.д.).
УЗ-исследование в зависимости от периода жизни женщины, а также фазы менструального цикла может дать информацию о состоянии эндометрия. По этим данным можно заподозрить проблему, однако подтвердить или опровергнуть атипию в клетках эндометрия нельзя. Только проведение гистероскопии с последующим гистологическим исследованием материала является золотым стандартом для диагностики этого состояния. Информативность метода более 90%.
8. Обязательно ли проводить выскабливание эндометрия при гиперплазии? Раздельное выскабливание цервикального канала и полости матки несет за собой лечебный и диагностический характер. Механическое удаление измененной патогенной ткани из полости матки предотвращает маточное кровотечение, что составляет лечебный эффект. Полученный соскоб отправляется на гистологическое исследование, после которого будет дано заключение о характере ткани, наличии или отсутствии признаков злокачественного поражения.
9. Возможен ли рецидив гиперплазии эндометрия? Да, возможен. Так как причиной гиперплазии эндометрия является нарушение гормонального баланса в организме женщины, то требуется обследование её гормонального фона. Для профилактики рецидива необходимо соответствующее лечение и исключение факторов риска.
Оформите заявку на сайте, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы.
Изменение демографической структуры общества во второй половине XX в. привело к увеличению в популяции доли женщин старшей возрастной группы. С каждым годом возрастает число женщин, вступающих в период менопаузы. Если
Изменение демографической структуры общества во второй половине XX в. привело к увеличению в популяции доли женщин старшей возрастной группы. С каждым годом возрастает число женщин, вступающих в период менопаузы. Если 75 лет принять за 100%, то продолжительность препубертатного периода составляет 16%, репродуктивного — 44%, пременопаузального — 7%, а постменопаузального — 33% (H. Нaney, 1986). То есть более трети своей жизни женщина проводит в состоянии дефицита женских половых гормонов. Менопауза, не являясь собственно заболеванием, приводит к нарушению эндокринного равновесия в организме женщины, вызывая приливы, раздражительность, бессонницу, урогенитальные расстройства, а также повышая риск развития остеопороза и сердечно-сосудистых заболеваний. Все эти данные свидетельствуют о необходимости разработки целого ряда медицинских и социальных мер по защите здоровья, сохранению работоспособности и достойного качества жизни женщин пери- и постменопаузального периода.
В последние годы в симптоматологии климактерических нарушений стала лидировать проблема урогенитальных расстройств, что связано с их выраженным отрицательным влиянием на качество жизни женщины в постменопаузе. Частота развития возрастных урогенитальных расстройств достигает 30%. В перименопаузальном периоде урогенитальные нарушения встречаются у 10% женщин, тогда как в возрастной группе 55—60 лет — у 50%. К 75 годам уже 2/3 женщин испытывают урогенитальный дискомфорт, а после 75 лет трудно встретить женщину, у которой не наблюдалось отдельных симптомов урогенитальных расстройств.
Урогенитальные расстройства в климактерии — это симптомокомплекс вторичных изменений, связанных с развитием атрофических и дистрофических процессов в эстроген-зависимых тканях и структурах нижней трети мочеполового тракта, мочевом пузыре, уретре, влагалище, связочном аппарате малого таза и мышцах тазового дна.
Прогрессирующее увеличение с возрастом частоты развития урогенитальной атрофии связывают с развивающимися на фоне эстрогенного дефицита необратимыми возрастными метаболическими изменениями. Влагалище, уретра, мочевой пузырь и нижняя треть мочеточников имеют единое эмбриональное происхождение и развиваются из урогенитального синуса. Это объясняет наличие рецепторов к эстрогенам, прогестерону и андрогенам в мышцах, слизистой оболочке, сосудистых сплетениях влагалища, мочевого пузыря и уретры, а также в мышцах и связочном аппарате малого таза.
Процессы старения урогенитального тракта развиваются в двух направлениях:
- преимущественное развитие атрофического вагинита;
- преимущественное развитие атрофического цистоуретрита с явлениями нарушения контроля мочеиспускания или без такового.
Атрофический вагинит возникает в результате эстрогенного дефицита и характеризуется резким истончением слизистой оболочки влагалища, прекращением пролиферативных процессов во влагалищном эпителии, уменьшением продукции гликогена эпителиальными клетками, снижением или полным исчезновением лактобацилл, повышением влагалищного рН (см. таблицу 1).
Основные клинические проявлениями атрофического вагинита — это сухость и зуд во влагалище, рецидивирующие выделения, диспареуния, контактные кровянистые выделения.
Диагностика атрофического вагинита включает:
- жалобы больной - на сухость и зуд во влагалище; рецидивирующие выделения, часто расцениваемые как симптом рецидивирующего кольпита; контактные кровянистые выделения.
- объективные методы обследования: расширенная кольпоскопия: определяется истончение слизистой влагалища, кровоточивость, петехиальные кровоизлияния, многочисленные просвечивающиеся капилляры; кольпоцитологическое исследование — определение кариопиенотического индекса (КПИ), который при развитии атрофических процессов во влагалище снижается до 15–20, или определение индекса созревания (ИС). ИС оценивается по сдвигу формулы: сдвиг формулы влево свидетельствует об атрофии влагалищного эпителия; определение рН влагалища — рН влагалища у не получавших лечения женщин в постменопаузе составляет 5,5–7,0 в зависимости от возраста и сексуальной активности. У сексуально активных женщин рН несколько ниже. Чем выше рН, тем больше степень атрофии влагалищного эпителия.
- цисталгия - учащенное, болезненное мочеиспускание в течение дня, сопровождающееся чувством жжения, болями и резями в области мочевого пузыря и уретры;
- поллакиурия - учащение позывов к мочеиспусканию (более четырех-пяти эпизодов в день) с выделением при каждом мочеиспускании небольшого количества мочи;
- никтурия - учащение позывов к мочеиспусканию в ночное время (более одного эпизода мочеиспускания за ночь);
- стрессорное недержание мочи (при физической нагрузке, кашле, чихании, смехе, резких движениях, поднятии тяжестей);
- недержание мочи (моча вытекает без напряжения в связи с повелительными позывами).
Обследование женщин с расстройствами мочеиспускания:
- жалобы больной;
- проба Valsalva - женщине с полным мочевым пузырем в положении на гинекологическом кресле предлагают с силой потужиться. Проба считается положительной, если в области наружного отверстия уретры появляются капли мочи;
- кашлевой тест - женщине с полным мочевым пузырем в положении на гинекологическом кресле предлагают покашлять. Проба считается положительной при подтекании мочи при кашле;
- прокладочный тест - определяется вес прокладки после часа физических упражнений. Если вес прокладки увеличивается больше чем на 1 г, значит, имеет место недержание мочи;
- посев мочи на инфекцию и чувствительность к антибиотикам;
- уродинамическое обследование (проводится урологами) - урофлоуметрия, цистометрия, профилометрия уретры, электромиография.
Вычленение симптомов атрофического вагинита и цистоуретрита условно, так как в большинстве случаев они сочетаются. Различные сочетания симптомов атрофического вагинита и цистоуретрита позволили выделить три степени тяжести урогенитальных расстройств (В. Е. Балан, 1997).
К среднетяжелым урогенитальным расстройствам (80% женщин) относится сочетание симптомов атрофического вагинита, цистоуретрита и истинного недержания мочи при напряжении.
К тяжелым урогенитальным расстройствам (4% женщин) относится сочетание симптомов атрофического вагинита, цистоуретрита, истинного недержания мочи при напряжении и неудержание мочи.
Итак, установлено, что эстрогенный дефицит является причиной развития урогенитальных нарушений у женщин в климактерии. Проблема лечения урогенитальных расстройств неоднозначна. Акцент ставится на том, какой вид заместительной гормонотерапии (ЗГТ) считать оптимальным. ЗГТ урогенитальных нарушений может осуществляться препаратами, обладающими как системным, так и местным действием. К системной ЗГТ относятся все препараты, содержащие эстрадиол, эстрадиол валерат и конъюгированные эстрогены.
К местной ЗГТ — препараты, содержащие эстриол. Выбор типа ЗГТ для лечения урогенитальных расстройств является индивидуальным и зависит от возраста пациентки, длительности постменопаузы, ведущих жалоб, необходимости лечения климактерического синдрома либо профилактики поздних метаболических нарушений.
Назначение системной ЗГТ должно соответствовать общепринятым правилам с учетом абсолютных и относительных противопоказаний. При назначении ЗГТ пациенткам с урогенитальными нарушениями преследуется цель восстановления нормального состояния местных гормонозависимых структур нижних отделов мочеполовой системы и стимуляции механизмов биологической тканевой защиты.
При решении вопроса о выборе типа препарата для ЗГТ крайне важно определить:
- фазу климактерия - перименопауза или постменопауза;
- идет ли речь об интактной матке или матка отсутствует (если отсутствует, то по поводу чего произведена гистерэктомия).
При интактной матке применяется комбинированная терапия препаратами, содержащими эстрогены и гестагены:
- в перименопаузе - двухфазные препараты (климен, климонорм, дивина, цикло-прогинова, фемостон и др.) или трехфазные препараты (трисеквенс);
- в постменопаузе - комбинированные монофазные препараты в непрерывном режиме (клиогест, гинодиан-депо, ливиал, климодиен, паузогест, фемостон и др.).
У женщин после гистерэктомии системное воздействие обеспечивает монотерапия натуральными эстрогенами в циклическом или непрерывном режиме (эстрофем, прогинова, климара, дивигель, эстрадерм).
Приоритетная роль в выборе ЗГТ расстройств урогенитального тракта, обусловленных снижением функции гонад, принадлежит эстриол-содержащим препаратам, обладающим избирательной активностью в отношении мочеполовой системы. Специфичность действия эстриола определяется особенностями его метаболизма и сродством с соответствующими рецепторными системами. Местный эффект стероидных гормонов реализуется путем пассивной диффузии их в клетки организма. Задерживаясь лишь в клетках чувствительных тканей, они образуют комплексы с цитозольными рецепторами с последующей транслокацией в ядро клетки. Таким путем реализуется действие на уровне генетических структур клетки. Это и определяет специфичность эффекта, свойственного данной ткани.
Ответ тканей на воздействие эстрогенов определяется концентрацией рецепторов, их структурой и свойствами эстрогенов. Эстриол является конечным метаболитом в обмене эстрогенов. Он выводится из организма в конъюгированной форме с мочой и лишь в незначительном количестве экскретируется с калом, в основном в неконъюгированной форме.
При пероральном введении эстриола его максимальная концентрация в плазме крови достигается через 1-2 ч. Попавший в плазму крови эстриол не связывается с глобулином, связывающим половые стероиды, и довольно быстро элиминируется. Эстриол является наименее активным эстрогеном с кратковременным действием.
Установлено, что ткани, чувствительные к эстриолу, широко представлены в нижних отделах урогенитального тракта. Терапия эстриолом способствует развитию и восстановлению влагалищного эпителия, а также приводит к восстановлению основных элементов соединительной ткани — коллагена и эластина. При этом главным в назначении эстриол-содержащих препаратов является минимальное системное действие. Известно, что для стимуляции развития эндометрия связь его рецепторов с эстрогеном должна быть длительной, не менее 8—10 ч. Эстриол же связывается с чувствительными к нему структурами не более чем на 2—4 ч. Такого непродолжительного действия недостаточно для пролиферативной реакции эндометрия, но достаточно для эффективного воздействия на структуры нижних отделов урогенитального тракта. Таким образом, при однократном введении эстриол связывается с ядерным рецептором на непродолжительное время и не вызывает пролиферацию эндометрия, поэтому при его назначении не требуется добавления прогестагенов.
При урогенитальных расстройствах традиционно отдается предпочтение местному введению эстрогенов и именно эстриола (овестин) в мазях и свечах (см. таблицу 2).
В любой форме эстриол-содержащие препараты принимаются один раз в сутки. Не рекомендуется сочетание системных и местных форм препарата.
Выбор терапии зависит также от степени тяжести урогенитальных расстройств.
При легкой степени тяжести урогенитальных расстройств применяются препараты эстриола (свечи, крем) ежедневно или три раза в неделю, в зависимости от степени выраженности клинических симптомов. При сочетании явлений атрофического вагинита или атрофического цистоуретрита с климактерическим синдромом назначаются препараты для системной ЗГТ.
При средней степени тяжести урогенитальных расстройств проводится сочетанная терапия (системная и местная) не менее шести месяцев для нормализации уродинамических показателей.
При тяжелой степени урогенитальных расстройств в случае имеющихся показаний к системной ЗГТ проводится комбинированная терапия препаратами для системной ЗГТ в сочетании с местным введением препаратов эстриола и одного из препаратов аддитивного воздействия, обладающих избирательным действием на холинергические (парасимпатические) и адренергические (симпатические) или мускариновые рецепторы, расположенные в мышечной стенке мочевого пузыря и различных структурах урогенитального тракта: гладкомышечной мускулатуре уретры и мышцах тазового дна, участвующих в создании уретральной поддержки. Комбинированную терапию необходимо проводить в течение шести месяцев и более, после чего вопрос о типе терапии решается индивидуально в отношении каждой пациентки (см. таблицу 3).
Такая система дифференцированной ЗГТ позволяет повысить качество жизни больных с урогенитальными расстройствами на 60—70%.
Таким образом, представленные данные позволяют говорить о ЗГТ как об основной терапии урогенитальных нарушений в постменопаузе.
В связи с прогрессирующим характером урогенитальных расстройств преимущество отдается профилактическому назначению ЗГТ и ее долговременному применению. ЗГТ урогенитальных расстройств должна назначаться длительно, практически пожизненно, и в этой ситуации на помощь приходит именно местная терапия эстриолом.
А. Л. Тихомиров, доктор медицинских наук, профессор
Ч. Г. Олейник, кандидат медицинских наук
МГМСУ, Москва
Читайте также:

