При интоксикации дигоксином может наблюдаться увеличение уровня
Обновлено: 24.04.2024
Дигоксин — низкополярный сердечный гликозид, получаемый из шерстистой наперстянки, обладает кардиостимулирующим и антиаритмическим действием.
Положительное инотропное действие
Инотропный эффект связан с ингибирующим влиянием на Na + -K + -АТФ-азу мембраны кардиомиоцитов, что приводит к увеличению внутриклеточного содержания ионов натрия и снижению — ионов калия. Вследствие этого происходит повышение внутриклеточного содержания кальция, ответственного за сократимость кардиомиоцитов, что приводит к увеличению силы сокращений миокарда. Улучшает работу сердца, при этом удлиняет диастолу. Систола становится более короткой и энергетически экономичной. В результате увеличения сократимости миокарда увеличиваются ударный объём и минутный объём. Уменьшаются конечно-систолический объём и конечно-диастолический объём сердца, что наряду с повышением тонуса миокарда приводит к уменьшению его размеров и, таким образом, снижению потребности миокарда в кислороде. Уменьшает чрезмерную симпатическую активность путём повышения чувствительности кардиопульмональных барорецепторов.
Отрицательное хронотропное действие
Урежение частоты сердечных сокращений в значительной степени связано с кардио-кардиальным рефлексом и происходит в результате прямого и опосредованного действия на регуляцию сердечного ритма. Прямое действие заключается в снижении автоматизма синусового узла. Большое значение в формировании отрицательного хронотропного действия имеет изменение рефлекторной регуляции сердечного ритма: у больных с мерцательной тахиаритмией происходит блокада проведения наиболее слабых импульсов; повышение тонуса n. vagus в результате рефлекса с рецепторов дуги аорты и каротидного синуса при повышении минутного объёма крови; снижение давления в устье полых вен и правом предсердии (как следствие увеличения сократимости миокарда левого желудочка, более полного его опорожнения, снижения давления в легочной артерии и гемодинамической разгрузки правых отделов сердца), устранение рефлекса Бейнбриджа и рефлекторной активации симпатоадреналовой системы (в ответ на увеличение минутного объёма крови).
Уменьшает скорость проведения возбуждения через AV-узел и удлиняет эффективный рефрактерный период, благодаря увеличению активности блуждающего нерва или путём прямого действия на AV-узел, или за счёт симпатолитического эффекта. В средних дозах не влияет на скорость проведения и рефрактерность проводящей системы Гиса-Пуркинье.
Прямое вазоконстрикторное действие
Оказывает прямое вазоконстрикторное действие, которое наиболее чётко проявляется в случае, если не реализуется положительное инотропное действие. В то же время косвенный вазодилатирующий эффект (в ответ на повышение минутного объёма крови и снижение излишней симпатической стимуляции сосудистого тонуса), как правило, превалирует над прямым вазоконстрикторным действием, в результате чего снижается общее периферическое сосудистое сопротивление.
Повышает вентиляцию лёгких в ответ на вызываемую гипоксией стимуляцию хеморецепторов. Способствует нормализации функции почек и повышению диуреза.
Обладает выраженной способностью к кумуляции (материальной).
В высоких дозах повышает автоматизм синусового узла, что приводит к образованию эктопических очагов возбуждения и развитию аритмии.
В субтоксических или токсических дозах отмечается положительное батмотропное действие, проявляющееся в развитии различных (в том числе и опасных для жизни нарушений сердечного ритма) из-за электрической нестабильности кардиомиоцитов, в которых, вследствие блокады Na + -K + -насоса, снижается концентрация внутриклеточного K + и повышается концентрация внутриклеточного Na + и происходит сближение потенциала покоя с пороговым.
Фармакокинетика
Абсорбция
Дигоксин всасывается из желудочно-кишечного тракта вариабильно — на 70–80 %. Абсорбция зависит от моторики пищеварительного тракта, лекарственной формы, одновременного приёма пищи, взаимодействия с другими лекарственными препаратами. Биодоступность — 60–80 %.
При нормальной кислотности желудочного сока разрушается незначительное количество дигоксина, при гиперацидных состояниях может разрушиться большее его количество. Для полной абсорбции требуется достаточная экспозиция в кишечнике: при снижении моторики желудочно-кишечного тракта биодоступность препарата максимальная, при усиленной перистальтике минимальная.
Распределение
Максимальная плазменная концентрация (Cmax) достигается через 1–2 часа. Связь с белками плазмы — 20–25 %. Относительный объём распределения — 5 л/кг. Проникает через плацентарный барьер.
Метаболизм
Метаболизируется в печени.
Выведение
Дигоксин выводится преимущественно почками (60–80 % в неизменённом виде). Период полувыведения составляет около 40 часов. Выведение и период полувыведения определяется функцией почек. Интенсивность почечного выведения определяется величиной гломерулярной фильтрации.
Отдельные группы пациентов
При незначительной хронической почечной недостаточности снижение почечного выведения дигоксина компенсируется за счёт печёночного метаболизма дигоксина до неактивных метаболитов.
При печёночной недостаточности компенсация происходит за счёт усиления почечного выведения дигоксина.
Показания
- В составе комплексной терапии хронической сердечной недостаточности Ⅱ (при наличии клинических проявлений) и Ⅲ–Ⅳ функционального класса;
- тахисистолическая форма мерцания и трепетания предсердий пароксизмального и хронического течения (особенно в сочетании с хронической сердечной недостаточностью).
Противопоказания
- Повышенная чувствительность к дигоксину;
- гликозидная интоксикация;
- синдром Вольфа-Паркинсона-Уайта;
- AV-блокада Ⅱ степени;
- перемежающаяся полная блокада.
С осторожностью
Беременность и грудное вскармливание
Применение при беременности
Адекватных и строго контролируемых исследований по безопасности применения дигоксина при беременности не проведено.
Дигоксин проходит через плацентарный барьер.
Применение дигоксина во время беременности противопоказано, за исключением случаев крайней необходимости, по назначению врача и, если потенциальная польза для матери превышает возможный риск для плода.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения дигоксина в период грудного вскармливания не проведено.
Дигоксин проникает в грудное молоко.
При необходимости применения следует отказаться от кормления грудью.
Способ применения и дозы
Режим дозирования индивидуальный, в зависимости от показаний, клинической ситуации, схемы терапии и лекарственной формы.
Внутрь, внутривенно (капельно, струйно).
В процессе лечения дигоксина выделяют 2 периода: период начальной дигитализации (насыщения) и период поддерживающей терапии.
В период начальной дигитализации дигоксином происходит постепенное насыщение организма сердечным гликозидом до достижения оптимального терапевтического эффекта. Индивидуальной насыщающей дозой (ИНД) называется суммарная доза (с учётом биодоступности и суточной элиминации), приводящая к адекватному уровню дигитализации конкретного больного. Появление признаков насыщения гликозидами (прежде всего клинических) означает, что больной получил ИНД.
Терапевтический эффект гликозидов сохраняется, если в организме находится не менее 80 % от ИНД. Превышение её на 50 % обычно обусловливает развитие интоксикации. Усреднённое значение ИНД больных без сопутствующей патологии органов, ответственных за элиминацию и метаболизм, составляет среднюю насыщающую дозу (СНД). Это доза сердечного гликозида, при которой отмечается полный терапевтический эффект у большинства больных без появления токсических симптомов.
При умеренно быстрой дигитализации назначают внутрь, по 0,25 мг 4 раза в сутки или по 0,5 мг 2 раза в сутки. При внутривенном введении требуется суточная доза дигоксина 0,75 мг в 3 введения. Дигитализация достигается в среднем через 2–3 суток. Затем переводят пациента на поддерживающую дозу, которая обычно составляет 0,25–0,5 мг/сут при назначении внутрь и 0,125–0,25 мг — при внутривенном введении.
При медленной дигитализации лечение сразу начинают с поддерживающей дозы (по 0,25–0,5 мг/сут в 1 или 2 приёма). Дигитализация в этом случае наступает через неделю у большинства больных. Больным с повышенной чувствительностью к сердечным гликозидам назначают меньшие дозы и проводят дигитализацию в медленном темпе.
При переходе с одной лекарственной формы на другую могут потребоваться коррекция режима дозирования (различные лекарственные формы имеют различия в биодоступности). Доза 100 мкг в виде раствора для инъекций биоэквивалентна дозе 125 мкг в виде таблеток или эликсира.
При пароксизмальных наджелудочковых аритмиях вводят внутривенно струйно, 1–4 мл 0,025 % раствора (0,25–1 мг) в 10–20 мл 20 % раствора декстрозы. Для внутривенного капельного введения ту же дозу разводят в 100–200 мл 5 % раствора декстрозы или 0,9 % раствора натрия хлорида. Насыщающая доза для детей составляет 0,05–0,08 мг/кг; эту дозу вводят в течение 3–5 дней при умеренно быстрой дигитализации или в течение 6–7 дней при медленной дигитализации.
Поддерживающая доза для детей составляет 0,01–0,025 мг/кг/сут.
При нарушении выделительной функции почек необходимо уменьшить дозу дигоксина: при клиренсе креатинина 50–80 мл/мин СПД составляет 50 % от СПД для лиц с нормальной функцией почек; при клиренсе креатинина менее 10 мл/мин — 25 % от обычной дозы.
Побочные действия
Со стороны сердечно-сосудистой системы
Желудочковая пароксизмальная тахикардия, желудочковая экстрасистолия (часто бигеминия, политопная желудочковая экстрасистолия), узловая тахикардия, синусовая брадикардия, синоаурикулярная (SA) блокада, мерцание и трепетание предсердий, AV блокада; на электрокардиограмме — снижение сегмента ST с образованием двухфазного зубца T.
Со стороны пищеварительного тракта
Анорексия, тошнота, рвота, диарея, абдоминальные боли, некроз кишечника.
Со стороны центральной нервной системы
Нарушения сна, головная боль, головокружение, неврит, радикулит, маниакально-депрессивный синдром, парестезии и обморок, в редких случаях (преимущественно у пациентов пожилого возраста с атеросклерозом) — дезориентация, спутанность сознания, одноцветные зрительные галлюцинации.
Со стороны органов чувств
Аллергические реакции
Кожная сыпь, редко — крапивница.
Со стороны органов кроветворения и системы гемостаза
Тромбоцитопеническая пурпура, носовые кровотечения, петехии;
Прочие
Передозировка
Симптомы передозировки дигоксином
Лечение передозировки дигоксином
Отмена препарата, назначение активированного угля (для уменьшения всасывания), введение антидотов (димеркаптопропансульфоната натрия, натрия кальция эдетата, антител к дигоксину), симптоматическая терапия. Проводить постоянное мониторирование электрокардиограммы.
В случаях гипокалиемии широко применяются соли калия: 0,5–1 г калия хлорида растворяют в воде и принимают несколько раз в день до суммарной дозы 3–6 г (40–80 мЭкв ионов калия) для взрослых при условии адекватной функции почек. В экстренных случаях показано внутривенное капельное введение 2 % или 4 % раствора калия хлорида. Суточная доза составляет 40–80 мЭкв K + (разведённого до концентрации 40 мЭкв K + на 500 мл). Рекомендуемая скорость введения не должна превышать 20 мЭкв/ч (под контролем электрокардиограммы).
При гипомагниемии рекомендуется парентеральное применение солей магния.
В случаях желудочковой тахиаритмии показано медленное внутривенное введение лидокаина. У больных с нормальной функцией сердца и почек обычно бывает эффективно медленное внутривенное введение (в течение 2–4 минут) лидокаина в начальной дозе 1–2 мг/кг массы тела, с последующим переходом на капельное введение со скоростью 1–2 мг/мин. У больных с нарушением функции почек и/или сердца дозу необходимо соответствующим образом уменьшить.
При наличии AV блокады Ⅱ–Ⅲ степени не следует назначать лидокаин и соли калия до тех пор, пока не будет установлен искусственный водитель ритма.
Во время лечения необходимо следить за содержанием кальция и фосфора в крови и суточной моче.
Имеется опыт применения следующих препаратов с возможным положительным эффектом: β-адреноблокаторов, прокаинамида, бретилия тозилата и фенитоина. Кардиоверсия может спровоцировать фибрилляцию желудочков.
Для лечения брадиарипмий и AV блокады показано применение атропина. При AV блокаде Ⅱ–Ⅲ степени, асистолии и подавлении активности синусового узла показана установка искусственного водителя ритма.
Взаимодействие
При сочетании с препаратами, вызывающими нарушения электролитного баланса, в частности гипокалиемию (например, диуретиками, глюкокортикостероидами, инсулином, β-адреномиметиками, амфотерицином B), повышается риск возникновения аритмий и развития других токсических эффектов дигоксина.
Гиперкальциемия также может привести к развитию токсических эффектов дигоксина, поэтому следует избегать внутривенного введения солей кальция больным, принимающим дигоксин. В этих случаях дозу дигоксина необходимо уменьшить.
Абсорбция дигоксина в кишечнике может быть снижена под действием колестирамина, колестипола, алюминий-содержащих антацидов, неомицина, тетрациклинов.
Имеются данные, что одновременное применение спиронолактона не только изменяет концентрацию дигоксина в сыворотке крови, но также может влиять на результаты метода определения концентрации дигоксина, поэтому требуется особое внимание при оценке полученных результатов.
Снижение биодоступности: активированный уголь, вяжущие лекарственные средства, каолин, сульфасалазин (связывание в просвете ЖКТ); метоклопрамид, неостигмина метилсульфат (прозерин) (усиление моторики ЖКТ).
Увеличение биодоступности: антибиотики широкого спектра действия, подавляющие кишечную микрофлору (уменьшение разрушения в ЖКТ). Бета-адреноблокаторы и верапамил усиливают выраженность отрицательного хронотропного эффекта, снижают силу инотропного эффекта.
Индукторы микросомального окисления (барбитураты, фенилбутазон, фенитоин, рифампицин, противоэпилептические средства, пероральные контрацептивы) могут стимулировать метаболизм дигоксина (при их отмене возможна дигиталисная интоксикация).
При одновременном применении с дигоксином ниже указанных лекарственных средств возможно их взаимодействие, вследствие которого уменьшается терапевтическое действие или проявляется побочное или токсическое действие дигоксина: минерало-, глюкокортикостероиды; амфотерицин B для инъекции; ингибиторы карбоангидразы; адренокортикотропный гормон; диуретические препараты, способствующие выделению воды и ионов калия (буметанид, этакриновая кислота, фуросемид, индапамид, маннитол и производные тиазида); натрия фосфат.
Гипокалиемия, вызванная упомянутыми лекарственными средствами, повышает риск токсического действия дигоксина, поэтому при одновременном применении их с дигоксином требуется постоянное наблюдение за концентрацией калия в крови.
Особые указания
Во время лечения дигоксином пациент должен находиться под наблюдением врача для того, чтобы избежать развития побочных эффектов. Больным, получающим препараты наперстянки, нельзя назначать препараты кальция для парентерального введения.
При идиопатическом субаортальном стенозе (обструкция выходного тракта левого желудочка асимметрически гипертрофированной межжелудочковой перегородкой) назначение дигоксина приводит к нарастанию выраженности обструкции.
При выраженном митральном стенозе и нормо- или брадикардии сердечная недостаточность развивается вследствие снижения диастолического наполнения левого желудочка. Дигоксин, увеличивая сократимость миокарда правого желудочка, вызывает дальнейшее повышение давления в системе лёгочной артерии, что может спровоцировать отёк лёгких или усугубить левожелудочковую недостаточность. Больным с митральным стенозом сердечные гликозиды назначают при присоединении правожелудочковой недостаточности, либо при наличии мерцательной тахиаритмии.
У больных с AV блокадой II степени назначение сердечных гликозидов может её усугубить и привести к развитию приступа Морганьи-Адамса-Стокса. Назначение сердечных гликозидов при AV блокаде I степени требует осторожности, частого контроля ЭКГ, а в ряде случаев — фармакологической профилактики средствами, улучшающими AV проводимость.
Дигоксин при синдроме Вольфа-Паркинсона-Уайта, замедляя AV проводимость, способствует проведению импульсов через добавочные пути проведения в обход AV узла и, тем самым, провоцирует развитие пароксизмальной тахикардии.
Перекрёстная чувствительность
Аллергические реакции на дигоксин и другие препараты наперстянки развиваются редко. Если появляется повышенная чувствительность в отношении какого-нибудь одного препарата наперстянки, другие представители данной группы применять можно, так как перекрёстная чувствительность препаратам наперстянки не свойственна.
Перед прекращением применения препарата необходимо информировать об этом врача.
Отравление дигоксином (дигиталисом) и его побочные эффекты
Дигоксин — несомненно, наиболее широко применяемый препарат наперстянки в США. Дигитоксин более популярен в странах Латинской Америки, Европы и в Канаде. Его токсичность значительно варьирует из-за неполярной структуры и обусловленных этим токсико-кинетических свойств. К редко применяемым препаратам наперстянки относятся листья наперстянки, уабаин, ланатозид С, десланозид и гиталин. Следующие растения содержат сердечные гликозиды: олеандр обыкновенный (Nerium oleander), наперстянка пурпурная (Digitalis purpurea), ландыш майский (Convallaria majalis), желтый олеандр (Thevetia peruviana) и ургинея приморская (Urginea maritima).
Дигоксин выпускается в виде таблеток по 0,125; 0,25 и 0,5 мг, а также в виде эликсира — 0,05 мг/мл.
а) Токсичная доза. Если ребенок с массой тела 10 кг проглотит дигоксин в количестве 0,05 мг/кг (например, одну таблетку 0,5 мг), следует ожидать, что концентрация дигоксина у него в крови превысит верхний терапевтический предел на 2 нг/мл. Хотя дети переносят передозировки дигоксина лучше, чем взрослые, возможность серьезных последствий означает, что при любом потенциальном или предположительном проглатывании препарата в дозе, превышающей указанный предел, следует проводить деконта-минацию кишечника и вести наблюдение в отделении неотложной помощи.
Любой суицидальный прием препарата пациентом, регулярно принимающим дигоксин, следует рассматривать как серьезную передозировку. У таких пациентов трудно прогнозировать токсические эффекты из-за разнообразия факторов, предрасполагающих к отравлению наперстянкой.
б) Токсикокинетика. Существуют значительные различия между кинетикой дигоксина и дигитоксина.
- Всасывание. Дигоксин. Биодоступность зависит от степени растворения таблеток; этот фактор в настоящее время более стандартизован и варьирует в пределах от 50 до 80 %. В число индивидуальных факторов, обусловливающих снижение абсорбции, входят одновременный прием пищи, синдромы мальабсорбции, антациды и пониженная желудочно-кишечная моторика.
Дигитоксин. После перорального приема отмечается превосходная абсорбция. Латентный период после пероральных доз составляет 1—2 ч, максимальное воздействие наблюдается в период между 4 и 12 ч.
- Распределение:
Дигоксин. Для дигоксина характерен большой кажущийся объем распределения (у взрослых 7—8 л/кг; у новорожденных — 10 л/кг; у грудных детей — 16 л/кг). Объем распределения снижается при заболеваниях почек, гипотиреозе, при терапии хинидином, а также у пожилых людей (в связи со снижением мышечной массы). Первоначальный объем распределения невелик, что может привести к чрезмерно высоким концентрациям непосредственно после приема. Большая часть дигоксина распределяется в скелетных мышцах (приблизительно 65 % абсорбированной дозы). Соотношение миокард: плазма составляет примерно 30:1.
Дигитоксин. Для дигитоксина характерны высокая степень связывания с белками и относительно небольшой кажущийся объем распределения.
- Выведение:
Дигоксин. Через почки выделяется 60—80 % дигоксина в неизмененном виде. Терминальный период полужизни составляет в среднем около 36 ч. Экскреция желчи и энтерогепатическая циркуляция не имеют существенного значения при терапевтических дозах. Проводившиеся исследования показывают, что желчевыделение варьирует в зависимости от заболеваний печени и метода отбора проб. В зависимости от метода отбора проб экскреция желчи составляет от 8 до 30 % через 24 ч после перорального приема терапевтической дозы.
Дигитоксин. Печень метаболизирует дигитоксин, удаляя сахар (дигитоксозу) с образованием эпидигитоксигенина, который соединяется с неактивным метаболитом. Дигоксин — побочный продукт метаболизма дигитоксина (около 8 %). Энтерогепатическая циркуляция, вероятно, обусловливает длительный период полувыведения (около 100 ч). Верапамил и дилтиазем (но не нифедипин) снижают непочечный клиренс в среднем на 29 и 21 % соответственно.
- Беременность. После того как женщина на восьмом месяце беременности проглотила 8,9 мг дигитоксина, наблюдались клинические признаки интоксикации организма матери и плода наперстянкой. Новорожденный младенец умер через 3 дня после родов.

в) Взаимодействие лекарственных средств. В таблице ниже представлены типы взаимодействий, влияющих на токсикокинетику сердечных гликозидов наперстянки.
- Эритромицин. Эритромицин подавляет развитие Eubacterium lentum, под воздействием которых в кишечнике дигоксин превращается в продукты его восстановления. Это может привести к повышению концентраций дигоксина в сыворотке.
- Эритромицин + тетрациклин. У некоторых пациентов эритромицин и тетрациклин могут вызвать удвоение концентрации дигоксина, вероятно, вследствие уничтожения флоры кишечника, которая в норме снижает концентрацию дигоксина и уменьшает его абсорбцию.
г) Механизм действия. На рисунке ниже схематически изображено теоретически предполагаемое прямое воздействие наперстянки на сердце. Гипомагниемия, возможно, чаще, чем гипокалиемия, усиливает токсическое воздействие дигоксина.

д) Клиническая картина отравления дигоксином. Факторы, предрасполагающие к интоксикации наперстянкой, приведены в таблице ниже. Смертность выше у пациентов, имеющих 5 прогностических признаков: пожилой возраст, заболевание сердца, принадлежность к мужскому полу, предсердно-желудочковая блокада высокой степени и гиперкалиемия. Различия между острым и хроническим отравлением дигоксином представлены в таблице ниже.
- Регулярное применение. Хроническое токсическое действие наперстянки часто не сильное, и его бывает трудно диагностировать, поскольку побочные эффекты похожи на симптомы основного заболевания.
- Влияние на сердечно-сосудистую систему. Отравление наперстянкой может вызвать аритмию любого типа. Классический ритм при интоксикации дигоксином — это сочетание подавляющего и возбуждающего эффектов (например, непароксизмальная предсердная тахикардия с блокадой 2:1). Преждевременная желудочковая экстрасистолия — наиболее распространенное нарушение ритма при интоксикации наперстянкой, тогда как преждевременная предсердная и узловая экстрасистолы наблюдаются реже. Эти экстрасистолы бывают многофокусными или бигеминальными.
Наиболее распространенные устойчивые ритмы — узловые выскальзывающие ритмы, затем по степени распространенности следует эктопическая предсердная тахикардия с некоторой степенью предсердно-желудочковой блокады. Регуляризация ритма на фоне фибрилляции желудочков и приема дигоксина означает развитие узлового ритма в связи с интоксикацией наперстянкой. Дальнейшая интоксикация обусловливает повышенный неправильный ритм (усиленный автоматизм), узловую тахикардию и блокаду выхода Венкебаха.
При отравлениях наперстянкой могут наблюдаться все степени предсердно-желудочковой блокады и может потребоваться временная кардиостимуляция. Нарушениям ритма часто сопутствует гипокалиемия. Желудочковая тахикардия и фибрилляция желудочков относятся к числу наиболее тяжелых аритмий, индуцированных наперстянкой.
- Неспецифические эффекты и влияние на пищеварительный тракт. В число распространенных неспецифических и желудочно-кишечных симптомов интоксикации препаратами наперстянки входят недомогание, усталость, слабость, анорексия, тошнота, рвота и головная боль.
- Влияние на зрение. Наблюдаются следующие нарушения зрения: скотома, неясность зрения, фотофобия с цветовой аберрацией и транзиторная слепота.
- Влияние на психосенсорные механизмы. Регулярно отмечаются спутанность сознания, галлюцинации и делирий, но судороги наблюдаются редко.
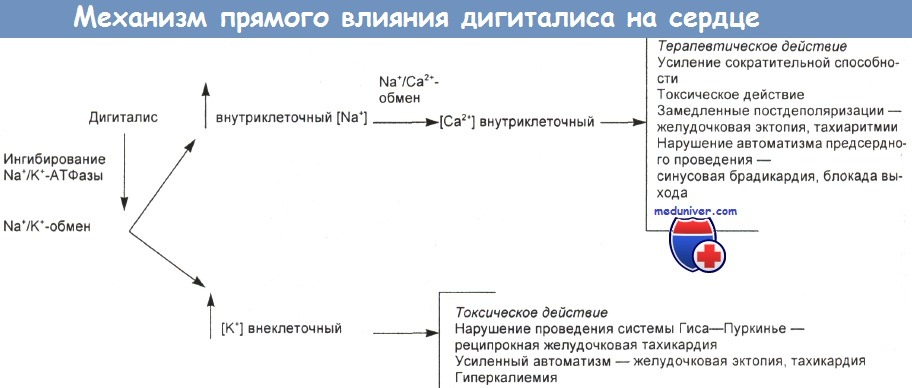
Теоретически допускаемый механизм прямого воздействия дигиталиса на сердце
Клиническая картина. Тошнота и рвота — наиболее типичные желудочно-кишечные проявления отравления наперстянкой. Могут отмечаться изменения психического состояния. Типичны признаки воздействия на сердечно-сосудистую систему, их проявление может задержаться на период до 6 ч. У детей отмечаются брадикардия и замедление проведения, но эндогенные водители ритма обычно обеспечивают адекватное распространение импульса и предотвращают гемодинамические нарушения. В число распространенных нарушений ритма входят брадикардия (21—75 %), блокада сердца (23—56 %) и тахиаритмии (30—42 %). У детей желудочковые аритмии наблюдаются реже.
- Смертные случаи. Летальный исход при массивных передозировках у взрослых является следствием обострения терапевтических эффектов:
• недостаточность нагнетательной функции сердца, обусловленная отрицательным инотропным эффектом (10 % смертных случаев);
• нарушение проведения с тяжелой предсердно-желудочковой блокадой (20 % смертных случаев);
• желудочковые аритмии из-за увеличенного автоматизма (70 % смертных случаев).

ж) Лабораторные данные отравления дигоксином:
- Аналитические методы. Концентрации свободного дигоксина наиболее точно измеряются в присутствии Fab-фрагмента (антигенсвязывающего домена) в многократных дозах с использованием ультрафильтрации с флюоресцентным поляризационным иммуноанализом. Радиоиммуноанализ не следует применять для измерения сывороточных концентраций свободного или суммарного дигоксина, так как при наличии в Fab незанятых участков связывания этот метод дает ложные результаты.
- Уровни дигоксина в сыворотке. Уменьшение количества ионов К+ в красных кровяных тельцах под воздействием сердечных гликозидов может быть с успехом использовано в качестве маркера воздействия наперстянки на Na+-, К+-АТФазу. Исчезновение ионов К+ из красных кровяных телец позволяет прогнозировать тяжесть отравления наперстянкой; оно, по-видимому, отражает исчезновение ионов К+ из миокардиоцитов, которое может происходить параллельно с тахиаритмией и нарушениями проведения. Клиническую пригодность этого маркера необходимо подтвердить дополнительными исследованиями.
- Уровни дигитоксина в сыворотке. Взрослого пациента, проглотившего 35 мг дигитоксина, лечили Fab-фрагментами антител (Digitalis antidote ВМ, 80 мг). Всего было введено 11 доз по 80 мг фрагментов Fab. Свободную фракцию сывороточного дигитоксина определяли с помощью иммунофлюоресцентного анализа Baxter-Status с усиленным разделением ферментов, а определение суммарного дигитоксина осуществлялось с помощью флюоресцентного поляризационного иммуноанализа. Пациент выздоровел.
Через 8 ч после приема молодым пациентом 250 мг дигитоксина уровень сывороточного дигитоксина поднялся до 360 ммоль/л. Пациенту ввели в 3 приема (всего 1440 мг) дигоксинспецифические Fab-фрагменты (Digitalis antidote ВМ, 480 мг). Синусовый ритм стабилизировался, и симптомы у пациента исчезли.
Показано, что дигитоксинспецифические Fab-фрагменты моноклональных антител могут быть использованы в случаях индуцированного отравления животных дигитоксином.
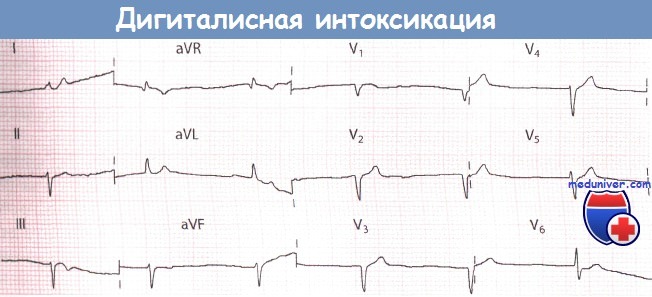
Ритм из АВ-соединения у пациента, получавшего дигоксин по поводу фибрилляции предсердий (ФП).
Содержание дигоксина в плазме крови 5,9 нмоль/л.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Отравление дигоксиноподобным иммунореактивным веществом (ДПИВ) и его побочные эффекты
Исследователи выявили вещество, присутствующее в жидкостях организма (в крови, слюне, моче, цереброспинальной жидкости, желчных кислотах, амниотической жидкости, фолликулярной жидкости), которое обусловливает ложноположительные результаты при проведении иммуноанализа дигоксина и может присутствовать в организме, даже если пациент не принимал дигоксин: это дигоксиноподобное иммунореактивное вещество (ДПИВ).
Дигоксиноподобное иммунореактивное вещество (ДПИВ) был также обнаружено в гипоталамусе, гипофизе, плаценте и надпочечниках.
Дигоксиноподобное иммунореактивное вещество известно также под названиями эндоксин, дигоксиноподобное вещество, кардиодигин, эндокардии, эндалин, уабаиноподобное вещество, дигоксиноподобный иммунореактивный фактор, эндогенная дигоксиноподобная реактивность и эндогенное дигиталисподобное вещество. Предложено также название дигоксиноподобное иммунореактивное вещество.
а) Механизм действия. Сердечные гликозиды действуют как специфические ингибиторы Na+, К+-АТФазы (натриевого насоса). Таким образом индуцируется их терапевтическое и токсическое действие. По этой концепции предполагается наличие рецепторного участка, для которого должен существовать эндогенный лиганд. Подавление транспорта Na+ может привести к повышению внутриклеточного уровня Са2+, сжатию сосудов и повышению кровяного давления.
Наличие дигоксиноподобных иммунореактивных веществ (ДПИВ) сочетается с повышенным объемом крови, увеличенным сердечным выбросом, застойной сердечной недостаточностью, физическими нагрузками и стрессом.
б) Природа дигоксиноподобных иммунореактивных веществ (ДПИВ). Предлагались различные варианты эндогенных дигиталисподобных веществ. Ни одно соединение не было выделено и химически охарактеризовано при клинических состояниях, сопровождающихся очевидным присутствием дигоксиноподобных иммунореактивных веществ (ДПИВ).

Теоретически допускаемый механизм прямого воздействия дигиталиса на сердце
в) Лабораторные данные отравления дигоксиноподобными иммунореактивными веществами (ДПИВ):
- Уровни в крови. Не существует единого стандарта, который позволил бы сравнивать результаты измерений, проводившихся в разных лабораториях, каждая из которых имеет собственные эталонные величины. Общие концентрации ДПИВ в период беременности при нормальном кровяном давлении в среднем составляют приблизительно 900 пг/мл, а у пациенток, беременных близнецами, уровень ДПИВ достигал 1143 пг/мл.
Терапевтические концентрации дигоксина могут налагаться на концентрации ДПИВ. В связи с этим для врачей-клиницистов очень важны значимость ДПИВ и его роль в дигоксиновой терапии и терапевтическом контроле. В отсутствие беременности уровень ДПИВ составляет 100 пг/мл и ниже.
У новорожденных уровень ДПИВ достигает 1500 пг/мл и затем снижается до 0 на 45-й день.
- Уровень свободного и общего дигоксиноподобного иммунореактивного вещества (ДПИВ). На протяжении периода беременности суммарные концентрации остаются стабильными, на уровне 700—800 пг/мл. Концентрация свободного ДПИВ в III триместре беременности возрастает с 30 до 240 пг/мл и снижается до нуля в течение 24 ч после родов.
- Методы анализа: перекрестная реактивность. Методы анализа дигоксина широко применяются для терапевтического мониторинга лекарственных средств. Применяются радиоиммуноанализ (РИА) и не-РИА методы. Изучение пяти РИА и пяти не-РИА методов показало, что Coat-a-Count RIA (Diagnostic products corporation) и колоночный метод иммуноанализа с ферментативным усилением (EMIT = enzyme multiplied immune technique) (Syva), проводимый на Cobas MIRA (Roche), обнаруживают наименьшее мешающее воздействие, а метод DELFIA (LKB/Wallace) продемонстрировал наибольшую перекрестную реактивность с ДПИВ.
Недавно был разработан метод радиоиммуноанализа дигоксина, в котором используется моноклональное антитело, распознающее дигоксин и не обнаруживающее никакой перекрестной реактивности с ДПИВ. Это быстрый, чувствительный, специфичный и воспроизводимый метод анализа дигоксина и его метаболитов.
- Искажающее результаты анализа воздействие лекарственных средств. Проглатывание лекарств тоже может мешать анализу дигоксина. Дигитоксин и, возможно, стероиды, такие как преднизон, прогестерон, тестостерон, спиронолактон и его метаболиты, а также дигоксиниммунные Fab-фрагменты (овечьи) могут дать ложноположительные результаты.
г) Клиническая картина. Дигоксикоподобное иммунореактивное вещество выявляли у пациентов с почечной недостаточностью, дисфункцией печени, застойной сердечной недостаточностью, гипертензией, аневризмальным субарахноидальным кровотечением, акромегалией, у беременных женщин, новорожденных и детей. Сывороточные концентрации ДПИВ возрастают во время беременности, затем быстро снижаются в организме матери после родов. У новорожденных высокие концентрации ДПИВ, но они быстро снижаются до нуля к концу II месяца жизни.
- Терапевтическое применение. У пациентки в возрасте 31 года с тяжелой токсемией на 25,5-й неделе беременности, не поддававшейся лечению нифедипином и гидралазином и не получавшей дигоксина, сывороточная концентрация дигоксина (ДПИВ) составляла 300 пг/мл. Внутривенно было введено 10 мг дигоксиниммунных Fab (овечьих) (Дигибинд). В течение 30 мин произошло значительное снижение кровяного давления. Требуются дальнейшие исследования, чтобы прояснить возможную роль дигоксина и иммунных Fab при этих состояниях.

- Яд жаб и ДПИВ. Уабаиноподобное соединение (резибуфогенин), обнаруженный в коже зеленой жабы (Bufo viridis), ингибирует Na+-, К+-АТФазную активность и обладает свойствами сердечного гликозида. В плазме жабы Bufo marinus присутствует и нормально циркулирует дигиталисподобное вещество. Мужчина в возрасте 31 года съел тарелку супа из жаб (Bufo melanosticus Schneider), и через 30 мин развились тошнота, рвота, головокружение, неясность зрения, пероральное онемение, потеря сознания и угнетение дыхания.
Были приняты реанимационные меры. Электрокардиограмма выявила пред-сердно-желудочковую блокаду высокой степени; QRS был нормальным. Сывороточная концентрация дигоксина (пациент не принимал дигоксин) составляла 2,1 нг/мл (вероятно, ДПИВ). Симптомы у пациента были похожи на симптомы тяжелой дигиталисной интоксикации.
Китайское лекарство, известное под названием Киушин, при проведении иммуноанализа перекрестно реагирует с дигоксином. В состав Киушина входит высушенный яд китайской жабы (Bufo bufo gargarizans Cantor) — чансу (chansu). Химическая структура основных компонентов чансу: буфалина и цинобуфагинала — подобна структуре дигоксина. Травяные чаи могут содержать дигоксиноподобные факторы.
д) Дигитоксиноподобное иммунореактивное вещество (ДТПИВ). Уровень дигитоксиноподобного иммунореактивного вещества не повышается у пациентов с почечной недостаточностью. Нормальный терапевтический уровень дигитоксина в сыворотке составляет 10—35 нг/мл.
Наивысшая концентрация ДТПИВ, выявляемая чувствительным методом анализа, равна 3,05 нг/мл. Поэтому происходит незначительное клиническое перекрывание, и это вещество, вероятно, не имеет значения для химических и лабораторных исследований.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ключевые слова: сердечные гликозиды, дигоксин, побочные эффекты, интоксикация, аритмия, Fab-фрагменты.
Для цитирования: Дядык А.И., Куглер Т.Е., Здиховская И.И., Ракитская И.В. Дигиталисная интоксикация: диагностика, лечебная тактика и профилактика. РМЖ. 2021;1:29-33.
Digitalis intoxication: diagnosis, management strategy, and prevention
A.I. Dyadyk , T.E. Kugler, I.I. Zdikhovskaya, I.V. Rakitskaya
M. Gorkiy Donetsk National Medical University, Donetsk, DPR
Current guidelines recommend prescribing cardiac glycosides with caution. However, considering their pharmacological properties and narrow therapeutic index, the rate of incorrect use of cardiac glycosides in clinical practice is still high. Digitalis toxicity develops at various serum concentrations of digoxin (generally, at concentrations > 2.0 ng/ml). Preventive strategies for digitalis toxicity should be based on both serum digoxin concentrations and its risk factors. Optimal doses of cardiac glycosides should be selected based on patient’s age, comorbidities, renal functions, and drug interactions. A wide spectrum of cardiac and non-cardiac manifestations of digitalis toxicity significantly hampers its diagnosis. The most common symptoms are irregular heartbeat and conduction abnormalities, nausea, vomiting, weakness, dizziness, headache, psychic disorders, and vision loss. The management strategy for digitalis toxicity is based on the severity of clinical signs. Severe life-threatening arrhythmias are a reason to prescribe anti-digoxin antibodies (Fab-fragments), which are, unfortunately, not readily available in Russian clinical practice.
Keywords: cardiac glycosides, digoxin, adverse effects, digitalis toxicity, arrhythmia, Fab-fragments.
For citation: Dyadyk A.I., Kugler T.E., Zdikhovskaya I.I., Rakitskaya I.V. et al. Digitalis intoxication: diagnosis, management strategy, and prevention. RMJ. 2021;1:29–33.

Памяти нашего Учителя
Введение
Сердечные гликозиды (СГ) продолжают широко применяться в клинической практике. В настоящее время в кардиологии в основном используется дигоксин, обладающий доказанной клинической эффективностью. В крупномасштабных рандомизированных контролируемых исследованиях последних лет (SENIORS [1], ROCKET-AF [2], ARISTOTLE AF NOAC [3]) приблизительно 30–40% пациентов с хронической сердечной недостаточностью (ХСН) и/или фибрилляцией предсердий (ФП) получали СГ в различных режимах терапии. Положительный эффект дигоксина может быть в большей степени связан с увеличением сократимости спиральных волокон миокарда, определяющих активную позднюю фазу опорожнения левого желудочка (ЛЖ) и активную раннюю фазу диастолического наполнения, чем со снижением ЧСС (особенно при синусовом ритме) [4].
Согласно рекомендациям Российского кардиологического общества (РКО) по диагностике и лечению острой декомпенсированной сердечной недостаточности и ХСН [1] дигоксин может применятьсяу больных ХСН с синусовым ритмом, несмотря на лечение ингибиторами ангионтензинпревращающего фермента,β-блокаторами и антагонистами альдостерона, для снижения риска госпитализации как по поводу как сердечной недостаточности, так и других причин (класс рекомендаций — IIb, уровень доказательности — B). Назначение дигоксина должно быть рассмотрено у больных ХСН II–IV функционального класса, с ФВ ЛЖ
Факторы риска развития дигиталисной интоксикации
Клиническая эффективность и безопасность дигоксина определяются рядом фармакокинетических параметров, включающих абсорбцию, распределение по органам и тканям и элиминацию путем биотрансформации и экскреции [23–25]. При одинаковых режимах дозирования дигоксина изменение сывороточной концентрации может наблюдаться у пожилых пациентов, при сниженной функции почек, сердечно-сосудистой патологии, электролитных нарушениях, одновременном приеме с некоторыми лекарственными препаратами. Отмечена повышенная чувствительность миокарда к токсическим эффектам СГ у больных с хроническим обструктивным заболеванием легких, особенно при развитии правожелудочковой сердечной недостаточности, гипоксемии и гиперкапнии. Сывороточные концентрации дигоксина снижаются при гипертиреозе и повышаются при гипотиреозе [16, 26–29].
Особенности фармакокинетики дигоксина
С целью профилактики ДтИ следует учитывать особенности фармакокинетики дигоксина при различных клинических ситуациях [28, 29]. Так, с возрастом наблюдается снижение скорости клубочковой фильтрации (СКФ), уменьшается скелетная мышечная масса, являющаяся основным депо СГ, что приводит к уменьшению объема распределения, а следовательно, к более высоким плазменным концентрациям [16]. Наличие коморбидности и полипрагмазии определяет необходимость снижения дозировок дигоксина у лиц пожилого возраста — обычно до 0,125 мг.
Фармакокинетика дигоксина существенно не меняется у больных гепатитами, циррозом печени и тучных больных в связи с низкой концентрацией в жировой ткани. Следовательно, при ожирении дозы дигоксина должны рассчитываться не на общую массу тела, а на мышечную [25, 30].
Взаимодействие с лекарственными препаратами
Представлены убедительные доказательства изменения плазменных концентраций дигоксина при комбинированном применении с другими лекарственными препаратами [26, 27, 29]. Снижение абсорбции дигоксина происходит при одновременном приеме с антацидами, холестирамином, сорбентами, метоклопрамидом, сульфасалазином, препаратами цитотоксического действия.
Повышение концентрации дигоксина в плазме происходит при назначении противоаритмических препаратов (хинидин, амиодарон, пропафенон, новокаинамид, верапамил), препаратов с холинергическими свойствами (атропин, метацин), ингибиторов ангиотензинпревращающего фермента. Применение нестероидных противовоспалительных препаратов сопряжено с риском снижения СКФ, что приводит к уменьшению почечной экскреции дигоксина на 20–30%, а следовательно, к повышению его плазменного уровня [26, 29, 31].
Комбинированное применение дигоксина с диуретиками повышает риск развития ДтИ вследствие присущих им побочных эффектов: гипокалиемии, гипомагниемии (петлевые и тиазидные диуретики), гиперкалиемии (калийсберегающие диуретики), гиперкальциемии (тиазидные диуретики), метаболического алкалоза (петлевые и тиазидные диуретики). В связи с этим у больных, получающих дигоксин и диуретическую терапию, необходимо контролировать плазменные уровни электролитов и электрокардиографические показатели [25–27].
Электролитные нарушения
С нарушениями баланса ионов К + , Na + , Mg 2+ и Са 2+ связано как изменение эффективности СГ, так и развитие ДтИ. Среди этих нарушений важное место занимают нарушения гомеостаза К + . В эксперименте и клинических исследованиях показано повышение риска развития ДтИ при гипокалиемии. Этот феномен обусловлен целым рядом факторов, включая снижение связывания CГ с Na + -К + -АТФазой сарколеммы, снижение содержания Na + -К + -АТФазных единиц в скелетной мускулатуре, непосредственное влияние гипокалиемии на формирование эктопических очагов в миокарде и нарушение проводимости. Электрофизиологические механизмы, обусловленные гипокалиемией, способствуют увеличению токсических эффектов СГ и существенно повышают риск развития аритмий [16].
В отличие от гипокалиемии, гиперкалиемия не ассоциируется с увеличением риска развития ДтИ. Повышение концентрации экстрацеллюлярного К + ведет к структурным изменениям Na + -К + -АТФазы, нарушающим связь с ней СГ. Кроме того, при гиперкалиемии наблюдается стимуляция активности Na + -К + -АТФазы. Повышение плазменных уровней К + (более 5,5 мэкв/л) стимулирует деполяризацию проводящей ткани сердца (особенно атриовентрикулярных соединений), результатом чего может быть снижение проводимости и развитие атриовентрикулярных блокад [26–28].
Ионам Са 2+ отводится важная роль в развитии ДтИ. Одним из факторов риска ДтИ является увеличение внутриклеточного Na + , что модифицирует Na + -Са 2+ обмен, в результате чего повышается внутриклеточное содержание Са 2+ , ведущее к замедлению процессов проведения [12]. Сказанное выше аргументирует необходимость определения плазменных уровней электролитов при использовании дигоксина [32].
Клинические проявления дигиталисной интоксикации
Широкий спектр проявлений ДтИ, как кардиальных, так и некардиальных, существенно затрудняет ее диагностику. По данным G. Ordog et al. (1987) [33], своевременная диагностика ДтИ осуществляется приблизительно в 20% случаев.
По результатам исследования М. Böhn et al. (1998) [34], при ДтИ кардиальные проявления имеют место в 67–80% случаев, желудочно-кишечные — в 20–25% случаев, неврологические — в 5–10% случаев. Нарушения сердечного ритма и проводимости нередко могут быть первыми (а иногда и единственными) проявлениями ДтИ.
I. See et al. (2014) [19] опубликовали детальный анализ данных 5165 больных, госпитализированных в отделения интенсивной терапии с 2005 по 2010 г. в США в связи с побочными эффектами лекарственных препаратов. Среди них был выявлен 441 случай ДтИ. Большинство составили женщины (67,8% [95% ДИ 62,9–72,6%]), лица ≥70 лет (79,1% [95% ДИ 73,5–84,7%]). Диагноз ДтИ был установлен в 5,9% случаев (95% ДИ 4,0–7,9%) госпитализаций пациентов ≥85 лет. Уровень сывороточной концентрации дигоксина ≥2,0 нг/мл имел место в 95,8% случаев. Эти данные дают реальное представление о частоте и тяжести ДтИ, ее структуре и факторах риска развития в клинической практике (табл. 1).
![Таблица 1. Частота клинических проявлений дигиталисной интоксикации [19]](https://www.rmj.ru/upload/medialibrary/69d/29-1.jpg)
Кардиальные симптомы
Токсическое влияние СГ на кардиальные электрофизиологические процессы — наиболее частое и серьезное проявление ДтИ. Практически все летальные случаи ДтИ обусловлены тяжелыми нарушениями ритма и проводимости, которые не носят специфический характер, в связи с чем установление их этиологии нередко представляет существенные трудности.
Аритмогенные эффекты СГ являются комплексными и недостаточно изученными. К механизмам их развития относят постдеполяризационные потенциалы, усиленную диастолическую реполяризацию и механизмы re-entry. Важное место также отводится внутриклеточной перегрузке Са 2+ [16, 18].
В зависимости от генеза выделяют две группы аритмий, развивающихся при ДтИ [25, 26]:
аритмии, обусловленные преимущественно повышением парасимпатической активности (синусовая брадикардия, синоатриальные и атриовентрикулярные блокады, узловой ритм, а также частота желудочковых комплексов менее 50 в минуту при ФП);
аритмии, обусловленные повышением эктопической активности (предсердная и желудочковая экстрасистолия, узловая тахикардия, желудочковая тахикардия и фибрилляция желудочков).
В ряде случаев усиленная эктопия сочетается с повышенным вагусным тонусом, что проявляется предсердной тахикардией с атриовентрикулярной блокадой или атриовентрикулярной тахикардией с атриовентрикулярной блокадой. Сочетание пароксизмальной предсердной тахикардии с атриовентрикулярной блокадой 2:1 считается классическим типом аритмии при ДтИ [19, 26, 35].
Наиболее частым проявлением ДтИ является развитие желудочковой эктопии, что проявляется полиморфной желудочковой экстрасистолией как с фиксированными, так и с разными интервалами сцепления. Желудочковая экстрасистолия часто носит характер бигеминии. Проявлениями ДтИ также могут быть пробежки желудочковой тахикардии (3 и более последовательных желудочковых комплекса). Характерной считается ее редкая форма — двунаправленная (или бифасцикулярная) желудочковая тахикардия. При ДтИ возможно также развитие фибрилляции желудочков [34, 35].
Некардиальные симптомы
Некардиальные симптомы ДтИ многообразны и неспецифичны, плохо коррелируют с сывороточными уровнями дигоксина и обычно не носят жизнеопасный характер. Среди них превалируют симптомы со стороны ЖКТ, ЦНС и зрительного аппарата [19, 26–28]. Аллергические реакции (кожная сыпь, эозинофилия, лихорадка) при приеме СГ наблюдаются редко.
Частыми и нередко ранними проявлениями ДтИ (до 80% случаев) являются анорексия, тошнота и рвота, имеющие центральное происхождение. Довольно часто наблюдается абдоминальная боль и диарея. Практически у всех больных с ДтИ развивается слабость, недомогание, снижение толерантности к физической нагрузке и головная боль. В 2/3 случаев наблюдаются различные психические нарушения, включающие раздражительность, нервозность, спутанность сознания, реже — дезориентацию, галлюцинации и психоз [17, 29, 31]. Нарушения зрения включают изменение цветовосприятия, ретробульбарный неврит и глазной паралич [37].
Лечебная тактика при дигиталисной интоксикации
Характер лечебных мероприятий при ДтИ и их эффективность определяются целым рядом факторов, включающих своевременную диагностику, установление тяжести состояния, суммарного количества принятого препарата и времени приема последней дозы, наличие нарушений электролитного баланса, функции почек, а также взаимодействия СГ с другими лекарственными препаратами [38–41]. Так, при ДтИ, проявляющейся синусовой брадикардией, атриовентрикулярной блокадой 1-й степени, редкими желудочковыми или предсердными экстрасистолами, достаточно временно отменить СГ, проводить мониторинг ЭКГ и АД. В последующем необходим подбор адекватных дозировок дигоксина для предотвращения повторных эпизодов ДтИ [41, 42].
В то же время серьезные жизнеопасные нарушения сердечного ритма и проводимости требуют немедленного проведения лечебных мероприятий. Так, при выраженной синусовой брадикардии, брадиаритмии при ФП или атриовентрикулярной блокаде 2-й степени применение атропина нередко обеспечивает хороший клинический эффект. При отсутствии эффекта от атропина, а также в случаях более тяжелой дисфункции синусового узла с атриовентрикулярной блокадой 3-й степени необходима установка кардио-стимулятора. Это может быть как временной мерой — в период острой борьбы с опасными для жизни нарушениями сердечного ритма, так и постоянной мерой — при сохраняющейся высокой степени блокады [16, 18, 29].
Развитие тяжелых жизнеопасных аритмий служит основанием для назначения специальных антидигоксиновых фрагментов антител (Fab-фрагментов). До назначения Fab-фрагментов или в ходе их применения необходимо срочное проведение других лечебных мероприятий, включающих коррекцию калиевого и/или магниевого гомеостаза и/или назначение противоаритмических препаратов (новокаинамид, пропафенон, лидокаин, амиодарон) [38, 39, 43].
Fab-фрагменты связываются с внутрисосудистым дигоксином, а также с дигоксином, находящимся в интерстициальном пространстве, куда он поступает путем диффузии. В результате этого происходит снижение концентрации свободного дигоксина во внеклеточном пространстве почти до нулевых уровней. Устанавливаемый при этом концентрационный градиент способствует выходу дигоксина из тканей и быстрому соединению с Fab-фрагментами. Благодаря этому наблюдается заметное повышение суммарной концентрации внеклеточного дигоксина, являющегося фармакологически неактивным, т. к. он находится в связанном состоянии с Fab-фрагментами. Связанный с Fab-фрагментами дигоксин элиминируется преимущественно почками. Таким образом, Fab-фрагменты антидигоксиновых антител быстро и эффективно устраняют проявления ДтИ [21, 39, 43]. По мнению E. Antman et al. (1990) [44], продолжение дигиталисной терапии возможно через 7 дней после устранения ДтИ и коррекции дозировок дигоксина. Гемодиализ и перитонеальный диализ не способны существенно элиминировать дигоксин из организма, т. к. он находится в связанном состоянии в различных (прежде всего в мышечных) тканях [45].
Заключение
Подходы к снижению частоты развития и тяжести клинических проявлений ДтИ должны базироваться на комплексе факторов, включающих знание фармакологических характеристик СГ, показаний и противопоказаний к их применению. Быстрая дигитализация должна применяться только в случаях развития жизнеопасных суправентрикулярных аритмий, когда использование других лекарственных средств противопоказано или неэффективно [46]. Кроме того, важное место в профилактике ДтИ отводится определению сывороточных концентраций дигоксина. Клиницистам следует рассматривать применение дигоксина с концентрацией в плазме не более 1,1 нг/мл (0,25 мг/сут и менее). Выбор дозы дигоксина должен осуществляться с учетом факторов риска развития ДтИ, т. е. особенностей кардиальной патологии, возраста, мышечной и жировой массы тела больного, сопутствующих заболеваний, состояния функции почек, а также возможного взаимодействия с другими лекарственными препаратами.
Читайте также:

