При каких цестодах возможны аутоинвазии и аутореинвазии
Обновлено: 18.04.2024
Цестодозы — общее название группыгельминтозов, которые вызваны ленточными червями. Чаще всего паразиты располагаются в кишечнике, однако болезнь может протекать с поражением других органов: легких, печени, головного мозга, глаз. Ленточные глисты распространены повсеместно, поэтому риск заражения присутствует у каждого человека. Более вероятно инфицирование среди путешественников, работников сельского хозяйства, любителей охоты и отдыха на природе. Лечением цестодозов занимаются паразитологи - узкоспециализированные инфекционисты ID-clinic.
Пути заражения цестодозами
Для большинства гельминтозов характерен фекально-оральный механизм инфицирования: в ЖКТ попадают инвазионные яйца или личинки, после чего они остаются паразитировать в кишечнике либо попадают в кровь и заносятся в другие органы. Заражение происходит при поедании термически необработанного мяса и рыбы, контакте с больными животными, питье некипяченой воды из неизвестных источников.


Виды цестодозов
Самые распространенные в России варианты паразитарной инвазии:
● тениоз — Taenia solium (свиной цепень)
● тениаринхоз — Taeniarhynchus saginatus (бычий цепень)
● дифиллоботриоз — Diphyllobothrium latum (широкий лентец)
● эхинококкоз — Echinococcus granulosus
● альвеококкоз — Alveococcus multilocularis
● гименолепидоз — Hymenolepis nana (карликовый цепень)
Типичные симптомы цестодозов
Чаще всего глистная инвазия проявляется кишечными симптомами. Спустя несколько недель после заражения у человека возникают боли в животе, тошнота и рвота, диарея. Общие симптомы болезни включают нарушения сна, ухудшение аппетита, головные боли, снижение работоспособности. При поражении печени ленточными червями наблюдаются боли и тяжесть в правом подреберье, горечь во рту.

Консультация врача
При нарушениях стула и болях в животе пациенту необходимо пройти обследование у инфекциониста или паразитолога ID-Clinic. На первичном приеме доктор выясняет жалобы и давность их появления, уточняет возможные факторы риска, собирает анамнез заболевания. Затем специалист проводит физикальный осмотр и назначает дальнейший план обследования для выяснения причины недомогания.


Диагностика цестодозов
● микроскопия кала и перианального соскоба на наличие яиц гельминтов
● серологические реакции (ИФА, иммунный блоттинг) при внекишечных формах паразитозов
● ПЦР-диагностика кала — информативный метод выявления генетического материала гельминтов
● клинический и биохимический анализы крови
● УЗИ органов брюшной полости
Лечение цестодозов
При всех формах гельминтозов назначается курс противопаразитарных препаратов. Вид, дозировка и длительность применения лекарств подбирается врачом индивидуально для каждого пациента. После дегельминтизации могут использоваться препараты пищеварительных ферментов и пробиотики, которые направлены на восстановление пищеварительной функции. В отдельных случаях при внекишечной локализации цестодозов проводится хирургическое лечение.

Записаться к врачу
Чтобы получить консультацию инфекциониста, оставьте заявку в форме обратной связи. Администратор ID-Clinic перезвонит вам и подберет удобное время врачебного приема.
Стоимость услуг клиники
УЗИ органов брюшной полости (без почек)
Online консультация врача-паразитолога
Прием (осмотр, консультация) врача инфекциониста-паразитолога, первичный
Диагностика паразитарных инвазий, распространённых в средней полосе
Серологическая диагностика паразитарных заболеваний
Кал на яйца гельминтов



















































Скидка по картам других клиник

Комплекс перед операцией

Комплекс УЗИ “Женское здоровье”
Вианвак от брюшного тифа со скидкой 40%

Флю-М Тетра со скидкой 50%

УЗИ всего организма для мужчин
УЗИ всего организма для женщин
ФЛЮ-М со скидкой 50%

Комплекс перед поездкой в санаторий
Комплексная вакцинация перед путешествием или командировкой за один день
Истории и отзывы наших пациентов

Все супер, мне понравилось. Грамотный, квалифицированный специалист.

У Баранова Алексея Васильевича я делала УЗИ щитовидной железы. Всё прошло как обычно - врач прокомментировал то, что увидел, всё объяснил и рассказал. В целом прием понравился.

Замечательная клиника! Отзывчивые администраторы, компетентные врачи - обратилась впервые и не пожалела! Долго выбирала клинику для вакцинации от COVID, остановилась на ID-Clinic. Позвонила в клинику, приятные девушки администраторы помогли с запросом, сориентировали, записали на приём. Привилась сегодня первым компонентом Спутник-V. Процедуре вакцинации предшествовали консультация врача и экспресс-тест на наличие вируса. По рекомендации врача после прививки оставалась в клинике ещё полчаса, чтобы понаблюдать за реакцией организма. Всё прошло хорошо, без каких-либо острых реакций) Всем рекомендую обращаться в ID-Clinic! :)

Была на приеме у врача-эндокринолога Дарьи Михайловны Сурженко. Очень внимательный, интеллигентный и чуткий врач! Были проблемы, связанные с деятельностью гормонов щитовидной железы. Прошло совсем немного времени, а уже улучшены показатели, самочувствие и настроение. Обязательно буду рекомендовать знакомым, так как знаю по себе, насколько сложно найти хорошего специалиста в данной сфере. Спасибо администрации "H-Clinic" за профессионализм и подбор врачей с таким колоссальным опытом! Отличная клиника.

Был у Виктории Валерьевны год назад. К сожалению, мой ноготок не поддался назначениям Виктории Валерьевны, я продолжаю битву. Мы договорились, что я приду еще раз, если улучшений не будет, а я так и не собрался. Теперь по делу: доктор объясняет всё, применительно к случаю, все-все нюансы поясняет. Смотреть на чужие страшные ногти, наверно, не всегда располагает к тактичному общению, но это не тот случай. Я считаю, к доктору можно и нужно обращаться.

Были в этой клинике с дочерью по совету подруги. Я была невероятно поражена внимательным отношением, профессионализмом, человечностью врачей. Отдельно хотим поблагодарить Базюк Евгению Михайловну. Она потрясающий доктор. Также благодарим Сурженко Дарью Михайловну!! Низкий поклон и Евгении Михайловне и Дарье Михайловне.

Буртулёва В.В. - грамотный врач-подолог, любит свою работу. Аккуратно, быстро, качественно работает, за что я очень благодарна, Виктории Валерьевне. После процедур сохраняется длительный эффект (делаю медицинский педикюр + установка пластин). Приятный человек в общении. На все вопросы доступно, подробно даёт разъяснения. Рекомендует только то, что необходимо без лишних навязываний доп.услуг и т.п. В кабинете просторно, чисто, всегда свежий воздух. Рекомендую всем, кому нужна помощь врача-подолога (по себе знаю, как трудно найти грамотного и добросовестного врача. Теперь только к Виктории Валерьевне).

Выбрала этого доктора, потому что была свободная запись в этот же день, что было важно. Врач объяснила все вопросы, которые меня интересовали и поставила хорошее лечение. Прием начался без задержек.

Прием прошел корректно. Вежливый персонал в клинике, чисто, аккуратно и приятно. Клинику выбирала по местоположению, рядом с домом и ценовой категории.

Внимательный, грамотный, объясняет простым языком без врачебных заумностей.
Внимательный врач, все расспросил, провел осмотр, объяснил, какие анализы надо сдать и зачем, когда они будут готовы, по результатам назначит лечение, заранее рассказал, какие могут быть варианты и как долго принимать. Консультация продолжалась целый час! Ответил на все вопросы, которые у меня были. Были сомнения, что доктор молодой, но оказалось, что уже очень опытный и грамотный. Понравилось, что не назначил лишних анализов, только то, что необходимо.
Кишечные цестодозы вызваны паразитированием половозрелых лентовных червей в тонких кишках человека. Инвазия происходит алиментарным путем при попадании финны червя в организм человека. В этом случае человек становится окончательным хозяином для паразита.
2.1. ДИФИЛЛОБОТРИОЗ. Возбудителем дифиллоботриоза человека является Diphillobothrium latum – лентец широкий. Родовое название составлено из трех греческих слов: di – два, phyllon – лист, bothrion – бороздка-щель и латинского latus – широкий. Жизненный цикл лентеца широкого связан с водной средой. Наряду с человеком он поражает также кошек, собак, свиней и диких хищных животных, питающихся костистой рыбой. Лентец широкий стал известен в начале XVII в. Впервые был описан К. Линнеем (1778). В 1883 г. М. Браун доказал, что заражение человека этим видом происходит через рыб, которые являются дополнительными хозяевами лентеца. К.Яницкий и Н.Розен в 1917 г. установили, что промежуточными хозяевами D. latum являются пресноводные рачки – циклопы и диаптомусы.
Морфология. Лентец широкий – один из самых крупных паразитов человека (анаконда среди гельминтов). Сколекс паразита вытянут в длину и снабжен присасывательными бороздами – ботриями (от греч. bothrion – щель), с помощью которых лентец прикрепляется к стенке тонкого кишечника окончательного хозяина. Стробила состоит из 4000 и более члеников и может достигать в длину 15–20 м, чаще от 2 до 10 м. Ширина члеников в средней части стробилы значительно превышает их длину, отсюда название – лентец широкий. Зрелые членики имеют матку розетковидной формы, наполненную яйцами. Созревшие яйца желтоватого цвета, широкоовальные, размером 70х45 мкм. На одном конце они имеют крышечку, а на другом – бугорок.
Жизненный цикл развития. Основными (дефинитивными) хозяевами служат плотоядные дикие и домашние животные: медведи, лисы, песцы, собаки, а также человек. Яйца (более 2 млн в сутки) выделяются с фекалиями основного хозяина и для дальнейшего развития должны попасть в воду. Там в яйцах созревает личинка округлой формы корацидий (от греч. korax – что-либо согнутое крюком), покрытая ресничками. Корацидии заглатываются пресноводными рачками — циклопами (Cyclops spp.), в теле которых развивается личинка процеркоид (от греч. pro – перед, kercos – хвост, eides – вид). Циклопы с процеркоидами заглатываются рыбами, в теле которых развиваются личинки плероцеркоиды (от греч. рleros – полный, kerkos – хвост). Плероцеркоиды накапливаются в мышцах и внутренних органах рыб, а также в икре.
Пути заражения человека. Люди и другие дефинитивные хозяева заражаются дифиллоботриозом при употреблении в пищу рыбы, содержащей плероцеркоиды лентеца.
Действие на организм человека. Органами фиксации (ботриями) и стробилой ленточная форма раздражает и травмирует слизистую оболочку кишечника. Паразит угнетает деятельность микрофлоры кишечника, которая вырабатывает фолиевую кислоту, участвующую в эритропоэзе. Кроме того, половозрелая особь потребляет витамин В12, что также является причиной развития анемии.
Обычно дифиллоботриоз протекает при слабовыраженных клинических явлениях. Больные жалуются на снижение аппетита, тошноту, рвоту, боли в эпигастрии или по всему животу, возникающие независимо от приема пищи. При развитии анемии появляются слабость, сонливость, головокружение, нередко чувство жжения и боль в языке, иногда ложные ощущения онемения, жжения, покалывания и другие парестезии. При тяжелой форме анемии кожные покровы бледны, лицо одутловато, иногда появляются отеки на ногах.
Лабораторная диагностика основана на обнаружении яиц широкого лентеца при микроскопии фекалий больного.
2.2. ТЕНИАРИНХОЗ. Возбудителем тениаринхоза является бычий или невооруженный, цепень – Taeniarhynchus saginatus (от лат. taenia – лента, rhynchus – хоботок, saginatus – жирный). В стадии половой зрелости, паразитируя в тонкой кишке человека (окончательного хозяина), достигает в длину 4–10 м. Антропоноз.
Морфология. Тело его состоит из сколекса и стробилы, разделенной на множество (более 1 тыс.) члеников. На головке гельминта находятся 4 мощные присоски. В конечных зрелых члениках бычьего цепня расположена матка, которая имеет срединный ствол и 18–35 боковых ответвлений.
Матка наполнена яйцами с тонкой прозрачной оболочкой. Внутри каждого яйца находится личинка онкосфера, заключенная в толстую двухконтурную желтовато-коричневую радиально исчерченную оболочку; размер онкосферы 0,03–0,04х0,02–0,03 мм.
Промежуточный хозяин – крупный рогатый скот, заражается через корм, загрязненный фекалиями больного тениаринхозом человека, содержащими членики цепня или яйца, из которых в мышцах развиваются личинки – финны-цистицерки.
Жизненный цикл. Бычий цепень имеет типичный для цестод цикл развития.
Инвазионная форма — финна типа цистицерк.
Действие на организм человека. Развитие тениаринхоза обусловлено механическим раздражением слизистой оболочки кишечника, вызванным присосками паразита, движениями его тела и перемещением зрелых члеников, а также токсическим воздействием его выделений.
Больные тениаринхозом жалуются на головокружение, общую слабость, тошноту, рвоту, боли в животе. В ряде случаев наблюдается потеря массы тела. У отдельных лиц возникают аппендикулярные колики, обусловленные проникновением члеников в аппендикс. Известны случаи гастродуоденита, печеночной колики, тениаринхозной непроходимости кишечника; возможно прободение стенки кишки, проникновение паразита в поджелудочную железу с развитием острого панкреатита.
Диагностика. Важным диагностическим признаком болезни является обнаружение активно выходящих из заднепроходного отверстия вне акта дефекации члеников бычьего цепня размером 20–30х12 мм, чего обычно при инвазии другими ленточными червями не бывает. Из лабораторных методов применяют микроскопию фекалий с помощью нативного мазка, толстого мазка по Като и методов обогащения. Этот метод имеет вспомогательное значение, т.к. онкосферы бычьего и свиного цепня неотличимы.
Профилактика тениаринхоза включает выявление и дегельминтизацию больных, тщательную экспертизу мяса на наличие финн на мясокомбинатах, мясо-молочных и пищевых контрольных станциях. Проведение мероприятий по защите окружающей среды от загрязнения фекалиями, улучшение санитарно-гигиенических условий содержания животных на фермах.
2.3. СВИНОЙ ЦЕПЕНЬ (Taenia solium) — возбудитель двух заболеваний: тениоза и цистицеркоза, антропонозов. Заболевание распространено в регионах, где традиционно разводят свиней и употребляют в пищу свиное мясо.
2.3.1. ТЕНИОЗ. Возбудителем тениоза является Taenia solium (от лат. taenia – лента, solium – цепочка) – свиной, или вооруженный, цепень. Взрослые гельминты паразитируют в тонкой кишке человека, который является единственным дефинитивным (окончательным) хозяином свиного цепня. Заболевание – антропоноз.
В задней (терминальной) части стробилы расположены зрелые членики прямоугольной формы размером 10–12х5–6 мм. В каждом зрелом членике имеется 7–12 ответвлений матки, в которых содержатся до 50 тыс. покрытых оболочкой яиц с зародышем (онкосферой). В окружающую среду яйца попадают при разрушении члеников, которые пассивно выделяются больными при дефекации (напомним, что онкосферы свиного цепня практически неотличимы от онкосфер бычьего).
Личинки – финны-цистицерки, свиного цепня паразитируют в организме промежуточных хозяев, которыми являются свиньи, собаки, кошки, иногда и человек, реже – дикие животные. В желудочно-кишечном тракте промежуточного хозяина онкосферы выходят из яйца, проникают в кровеносные сосуды и заносятся в мышечную ткань, мозг, подкожную клетчатку, внутренние органы. Через 2–2,5 мес. они преобразуются в цистицерки (финны).
Источником инвазии для человека служат свиньи. Человек заражается тениозом при употреблении в пищу их мяса. Продолжительность жизни свиного цепня в кишечнике человека достигает нескольких лет. Наиболее распространен тениоз в странах с развитым свиноводством.
Действие на организм человека. Патологические процессы, возникающие при тениозе, вызываются теми же механизмами, которые характерны для тениаринхоза. Больные обычно жалуются на потерю аппетита, тошноту, рвоту, ощущение кома в горле, иногда боли в животе, головную боль, головокружение, нарушение сна, потерю массы тела, зуд в области заднепроходного отверстия и понос с периодическим выделением члеников паразита при дефекации.
Диагнозтика. Распознавание тениоза затруднительно, так как яйца гельминта в кале обычно отсутствуют. Диагноз ставят на основании анамнеза, клинической картины и повторного микроскопического исследования фекалий с целью обнаружения яиц и зрелых члеников (подсчитывают число боковых ответвлений матки).
Профилактика. Профилактика тениоза включает благоустройство населенных пунктов с целью предупреждения загрязнения почвы фекалиями больных, содержащими членики свиного цепня; широкую санитарно-просветительскую работу среди населения; ветеринарно-санитарный надзор за убоем свиней; контроль свиного мяса на цистицеркоз и недопущение в продажу свиного мяса, зараженного личинками свиного цепня; выявление, лечение и диспансеризацию больных.
2.3.2. ЦИСТИЦЕРКОЗ. Цистицеркоз – гельминтоз, вызываемый цистицерком, протекает хронически с поражением кожи, подкожной клетчатки, мышц, головного и спинного мозга, глаз, реже внутренних органов и костей. Возбудитель цистицеркоза человека – Cysticercus cellulosae (от греч. kistis – пузырь, kerkos – хвост) – личиночная стадия цестоды Taenia solium.
Cysticercus cellulosae представляет собой пузырек с прозрачными стенками и ввернутой внутрь головкой (сколексом). Размеры и форма цистицерков зависят от их возраста и характера тканей, в которых они обитают, например в коже и подкожной клетчатке они имеют округлую или овальную форму, в мышцах – веретенообразную, а в желудочках мозга – шаровидную форму. Обычно диаметр цистицерков составляет 5–8 мм, однако в желудочках мозга описаны пузыри до 3–5 см в диаметре. Продолжительность жизни цистицерков от 3 до 20 лет с последующим полным обызвествлением.
Источник инвазии. Заражение человека онкосферами свиного цепня происходит при несоблюдении правил личной гигиены (перорально) или во время рвоты у больных тениозом (аутоинвазия). При этом в мышцах, глазах и головном мозге развиваются финны (цистицерки), вызывая тяжелое заболевание — цистицеркоз.
Действие на организм человека. Особенность этой инвазии состоит в том, что человек при заболевании цистицеркозом является неспецифическим хозяином. В патогенезе цистицеркоза ведущую роль играет его механическое воздействие на органы и ткани на фоне сенсибилизации организма метаболитами цистицерков. Клинические проявления цистицеркоза определяются локализацией паразитов:
при цистицеркозе головного мозга ведущими признаками являются головные боли, тошнота, рвота, эпилептиформные припадки, нарушения психики;
цистицеркоз глаза проявляется постепенным понижением остроты зрения вплоть до полной слепоты;
цистицеркоз кожи арактеризуется формированием в коже и подкожной клетчатке, особенно в области груди и спины, опухолевидных образований.
Диагнозтика. Диагноз устанавливают на основании клинической картины, данных эпидемиологического анамнеза (заболевание тениозом), рентгенологических и лабораторных исследований. Наличие цистицерка в глазу устанавливают с помощью офтальмоскопии.
Профилактика. Большое значение в профилактике цистицеркоза имеет санитарно-просветительная работа, в частности разъяснение больному тениозом, что промедление с лечением может привести к аутоинвазии и заболеванию цистицеркозом.
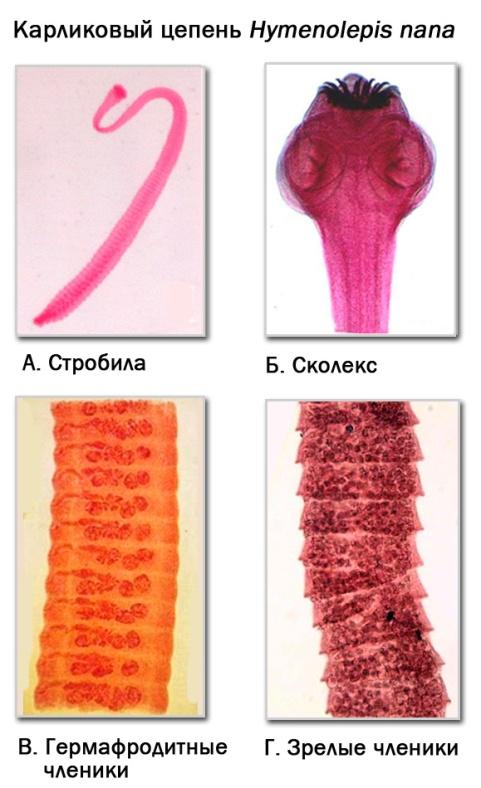
2.4. ГИМЕНОЛЕПИДОЗ. Возбудитель гименолепидоза Hymenolepis nana (от греч. hymen – мембрана, lepis – оболочка; лат. nana – карлик), или карликовый цепень.
Гименолепидоз поражает преимущественно городское население. Чаще болеют дети в возрасте от 4 до 14 лет, что объясняется отсутствием у них достаточных гигиенических навыков, а также особенностями возрастного иммунитета.
Морфологические особенности. Карликовый цепень имеет небольшие размеры тела (А) - 1,5–3 см. Ширина членика преобладает - 0,7–0,9 мм. Шаровидный сколекс (Б) вооружен четырьмя присосками и коротким втяжным хоботком с одним рядом хитиновых крючьев. Тонкая шейка переходит в лентовидное тело (стробилу), которое состоит из 200–300 члеников (проглоттид).
В незрелых члениках (В) содержатся три шаровидных семенника. Яичник располагается между семенниками в виде удлиненного образования, к которому прилегает лопастный желточник. Половые отверстия открываются на одну сторону стробилы в каждом членике.
В зрелых члениках (Г) сохраняется только матка, набитая яйцами. В кишечнике больного отделившиеся зрелые членики разрушаются, и поэтому яйца гельминта постоянно выделяются с фекалиями больного.
Яйца карликового цепня прозрачные и бесцветные. Внутри яйца располагается онкосфера с тремя парами зародышевых крючьев. От полюсов онкосферы отходят тонкие нити — филаменты, которые удерживают онкосферу в центре яйца.
Жизненный цикл. Человек для карликового цепня служит одновременно промежуточным и окончательным хозяином. Цикл развития в организме проходит в 2 фазы:
Внутритканевая стадия развития. Онкосфера освобождается от яйца и внедряется в ворсинку тонкого кишечника. Здесь она превращается в финну цистицеркоид (от греч. kystis – пузырь, kerkos – хвост, eidos – похожий). Через 4–7 сут в результате разрушения ворсинок цистицеркоиды попадают в просвет кишечника.
Кишечная фаза. Цистицеркоид имеет сколекс, с помощью которого он фиксируется к слизистой оболочке тонкого кишечника и в течение двух недель превращается во взрослую особь, наносит механические повреждения.
В очень редких случаях цикл развития карликового цепня может происходить со сменой хозяев. Промежуточным хозяином служат личинки или имаго различных насекомых: хрущака мучного, некоторых блох. В их теле личинки развиваются до стадии цистицеркоидов и могут сохраняться живыми свыше 260 дней. В этих случаях человек заражается при случайном проглатывании инвазированных насекомых с пищей, например с непропеченным тестом.
Таким образом, у карликового цепня существует три варианта развития:
1) развитие гельминта с выходом яиц во внешнюю среду, но без участия промежуточного хозяина;
2) развитие гельминта только в организме человека (без выхода яиц во внешнюю среду);
3) развитие гельминта с участием промежуточного хозяина.
Пути заражения человека. Человек заражается при заглатывании яиц Н. nаnа. Заражение возможно и при контакте с больным человеком.
При гименолепидозе возможно повторное заражение, как в результате повторного проглатывания яиц, так и за счет аутоинвазии. Аутоинвазия — процесс инвазии ворсинок кишечника онкосферами, освободившимися из яиц, которые выходят в просвет кишечника при разрушении зрелых члеников. Именно это служит причиной длительных и интенсивных инвазий.
Действие на организм человека. Гименолепидоз поражает преимущественно детей в возрасте от 4 до 9 лет. Наиболее частыми при гименолепидозе являются жалобы на боли в животе, снижение аппетита, неустойчивый стул, головную боль, общую слабость, повышенную утомляемость и раздражительность. В возрасте 10–14 лет обычно большинство детей избавляется от инвазии без лечения, что объясняется развитием возрастного иммунитета.
Диагнозтика. Диагноз ставят на основании обнаружения в фекалиях яиц или особей карликового цепня. В связи с закономерной периодичностью выделения яиц в очагах гименолепидоза рекомендуются трех кратные обследования проживающих там лиц с интервалами 15–20 дней по методике Калантарян.
Профилактика. Профилактика гименолепидоза основывается на раннем его выявлении и своевременном лечении, борьбе с грызунами, мухами, тараканами, блохами, мучным хрущаком.
Рассмотрены факторы риска паразитозов у детей, действие паразитов на организм ребенка, подходы к диагностике паразитарной инвазии и принципы комплексного лечения паразитозов с тем чтобы предотвратить дальнейшее развитие функциональных нарушений с формиров
Risk factors of parasitosis in children was considered, as well as the influence of parasites on a child's body, approaches to the diagnostics of parasitic invasions and principles of integrated treatment of parasitic diseases in order to prevent the further development of functional disorders of the formation of organic pathology.
.jpg)
Паразитарное заболевание — развитие болезненных симптомов в результате жизнедеятельности гельминта или простейших в организме человека [1]. Основной фактор выживания и распространения паразитов — их необычайно высокая репродуктивная способность, а также постоянно совершенствующиеся механизмы приспособления к обитанию в теле человека. К сожалению, настороженность медицинских работников в отношении паразитарных заболеваний у населения в настоящее время чрезвычайно низка, а профилактика гельминтозов сведена к лечению выявленных инвазированных пациентов [12, 13]. Вместе с тем многие исследователи отмечают связь широкой распространенности паразитозов у детского населения с развитием функциональной патологии органов пищеварения на фоне нарушений регуляции и высокий риск формирования хронических заболеваний даже при условии естественной санации ребенка с течением времени.
Самые распространенные и изученные заболевания — аскаридоз, энтеробиоз (рис. 1) и лямблиоз — регистрируются повсеместно. В России ежегодно выявляется более 2 млн больных нематодозами. При оценке территориального распределения лямблиоза по России установлено, что самый высокий средний уровень показателей заболеваемости в течение многих лет отмечен в Санкт-Петербурге, причем пораженность детей, посещающих детские учреждения, составляет 35% [2].
Каждый человек в течение жизни неоднократно переносит различные паразитарные заболевания [9]. В детском возрасте паразитозы встречаются чаще. У детей раннего возраста (до 5 лет) этому способствует широкая распространенность репродуктивного материала паразитов (цисты, яйца, личинки (рис. 2)) в окружающей среде и недостаточное развитие гигиенических навыков.
.jpg)
Значимость определенных факторов риска меняется в соответствии с возрастом ребенка. Доказано, что для детей младшего возраста более значимы санитарно-гигиенические условия проживания, а для подростков при сборе анамнеза необходимо уделить внимание социально-экономическим и географическим факторам (пребывание в лагере, туристическая поездка, наличие младшего брата или сестры) (рис. 3).
.jpg)
Транзиторное снижение противоинфекционного иммунитета как фактор риска возникновения паразитоза у детей регистрируется также в период реконвалесценции после вирусных заболеваний, вызываемых вирусами герпетической группы (цитомегаловирус, вирус простого герпеса I и II, вирус Эпштейна–Барр), может возникать в результате ятрогении (применение иммуносупрессивной терапии при аллергических и аутоиммунных заболеваниях). В настоящее время значимая доля детей находится в состоянии дезадаптации, которое также сопровождается снижением иммунной защиты.
Иммунную защиту желудочно-кишечного тракта (ЖКТ) ребенка можно условно разделить на специфическую и неспецифическую. К неспецифической защите относят комплекс условий нормального пищеварения: зрелость ферментативных систем, обеспечение кислотно-щелочного градиента в различных отделах ЖКТ, деятельность нормальной микрофлоры, адекватную моторику.
Отдельно необходимо отметить, что для такого заболевания, как лямблиоз, предрасполагающим фактором инвазии является нерегулярное и недостаточное отделение желчи в кишечник при аномалиях развития желчного пузыря (перетяжки, перегибы). Лямблиоз, выявленный у пациентов педиатрического отделения МОНИКИ, в 100% случаев сопровождался дисфункцией билиарного тракта.
.jpg)
У детей в восстановительном периоде после острых кишечных инфекций, после массивной антибиотикотерапии, а также у пациентов с хронической патологией органов пищеварения сопутствующие нарушения ферментного обеспечения, нормофлоры и моторики кишечника также делают ЖКТ более уязвимым для паразитов (рис. 4).
Специфическая защита слизистой оболочки органов пищеварения зависит от возраста ребенка и его зрелости. Механизм специфической иммунной защиты является одной из наиболее древних систем организма, так как гельминтозы сопровождают человечество в течение многих тысячелетий. Этот механизм представлен прежде всего эозинофилами крови и иммуноглобулином Е.
Классический развернутый антипаразитарный ответ может быть сформирован у ребенка не ранее достижения им 4 лет и тесно связан с качеством и количеством IgE, созревающего к этому возрасту. При контакте организма с паразитом в первую очередь выделяются медиаторы воспаления: интерлейкин, лейкотриен С4, D4, простагландины, тромбоксаны. Увеличивается количество лимфоцитов, продуцирующих IgM и IgG. В клиническом анализе крови отмечается рост уровня эозинофилов и базофилов, связанный с увеличением содержания этих клеток в тканях инвазированного органа. Встречаясь с личинками паразита, тканевые базофилы выделяют гепарин и гистамин, которые в сочетании с лейкотриенами и другими медиаторами воспаления вызывают общие проявления: зуд, реактивный отек, гиперемию, а также могут спровоцировать общие проявления: бронхоспазм, проявления крапивницы или диарею. Аллергическое воспаление при паразитозах развивается по классическому пути и призвано создать условия, приводящие к гибели и/или элиминации паразита [5].
Вместе с тем эозинофилы обладают выраженным цитотоксическим потенциалом, превышающим возможности других клеток крови, что объясняет первостепенное значение эозинофилов в антипаразитарных реакциях и их повреждающую роль при аллергии. Основное действие эозинофилы оказывают в барьерных тканях. В очаге инвазии они дегранулируют, оказывая гельминтотоксическое и цитотоксическое действие. Белки эозинофильных гранул (большой основной протеин, эозинофильная пероксидаза, эозинофильный катионный протеин, эозинофил-производный нейротоксин) токсичны не только для паразита, но и для клеток организма ребенка. Еще одной из важных причин системных и органных поражений, сопутствующих паразитозам, является образование иммунных комплексов [9, 10].
Действие паразитов на организм ребенка осуществляется с вовлечением многих систем. Практически все их виды могут вызывать сдвиг соотношения Th1/Th2 клеток в направлении, благоприятном для их выживания. Описаны случаи, когда продукты выделения паразита оказывали гормоноподобное действие на организм хозяина [5].
Местное влияние паразиты осуществляют, вызывая контактное воспаление слизистой оболочки и стимулируя вегетативные реакции. При этом нарушаются процессы кишечного всасывания, адекватная моторика ЖКТ и его микробиоценоз.
Системное влияние оказывается за счет использования паразитом энергетического и пластического потенциала пищи в ущерб организму ребенка, индукции аллергии и аутоиммунных процессов, целенаправленной иммуносупрессии и эндогенной интоксикации. Проведенными исследованиями показано, что аллергический синдром сопутствует аскаридозу и энтеробиозу в 71,3% случаев. Среди детей с атопическим дерматитом паразитозы выявляются у 69,1%, при этом лямблиоз из числа всех инвазий составляет 78,5% [4].
Особенно узнаваемую клиническую картину формирует токсокароз (рис. 5). Клиническими маркерами этой инвазии являются лейкемоидная реакция эозинофилов (от 20% и выше эозинофилов в формуле крови), сопровождающая ярко и упорно протекающий аллергический синдром в виде атопического дерматита с выраженным зудом и резистентностью к традиционной терапии или тяжелую бронхиальную астму с частыми приступами.
В 75,3% случаев паразитозы сопровождаются разнообразными функциональными нарушениями со стороны ЖКТ. Рядом работ доказано, что паразитарная инвазия способна вызывать нарушения углеводного обмена, а также дисахаридазную недостаточность за счет снижения уровня лактазы [7, 9].
У большинства детей нарушения адаптации являются одним из важных звеньев патогенетического процесса при паразитозе. Следует отметить, что состояние дезадаптации затрагивает в первую очередь лимфоцитарное звено иммуногенеза, что не может не сказываться на созревании и дифференцировке специфического иммунитета.
Диагностика паразитозов
До настоящего времени ведется поиск простого, доступного и надежного метода диагностики паразитозов. Разработанные методики прямого визуального обнаружения требуют минимальной экспозиции диагностического материала, многократных повторных исследований. Известные способы диагностики глистных инвазий и протозоозов, такие как метод толстого мазка фекалий по Като, метод формалин-эфирного осаждения, перианальный соскоб, микроскопия пузырной и печеночной желчи, имеют ряд недостатков, связанных как с особенностями развития паразита, так и с состоянием макроорганизма и его реактивностью.
Непрямые методы исследования (определение специфических антител) обладают недостаточной специфичностью и достоверностью. Известно, например, что, проходя сложный цикл развития от яйца до взрослого состояния, гельминты меняют свой антигенный состав. Антитела в организме хозяина вырабатываются в основном в ответ на поступление экскретов и секретов гельминта, тогда как в иммунодиагностических реакциях используются соматические антитела. Возникающая неспецифическая сенсибилизация организма, общность некоторых антигенов трематод, простейших и человека создают высокий удельный вес ложноположительных серологических реакций в титрах ниже достоверно диагностических. Таким образом, исследование методом иммуноферментного анализа (ИФА) на гельминты является высокочувствительным, но низкоспецифичным методом. Определение паразитов методом полимеразной цепной реакции (ПЦР) является высокоспецифичным и высокочувствительным методом, но из-за дороговизны и сложности не может быть скрининговым, когда, например, нужно обследовать группу детей из детского учреждения.
Не теряет своей актуальности клинический осмотр ребенка и внимательный учет косвенных признаков паразитоза. Важно отметить возможность течения паразитоза при аллергическом и астеническом синдроме, полилимфаденопатии неясного генеза, при нарушениях кишечного всасывания, углеводного обмена, при затяжном и хроническом течении болезней пищеварительного тракта, гепатоспленомегалии неясного генеза. Течение паразитарной инвазии имеет клинические особенности: обычно признаки поражения минимизированы, заболевание носит стертый характер, обострения полиморфны и неярки. Особенностью обострений заболеваний данной группы является их цикличность с периодом в 11–15 дней.
Косвенными лабораторными признаками паразитоза могут быть анемия, базофилия, эозинофилия, увеличение уровня аспартатаминотранферазы (АСТ).
Кроме того, признаки возможной паразитарной инвазии следует учитывать при оценке результатов инструментального исследования. При ультразвуковом исследовании органов брюшной полости у ребенка старше 3 лет косвенными признаками паразитоза являются гепатоспленомегалия, неравномерность паренхимы печени и селезенки за счет мелких гиперэхогенных сигналов, увеличенные лимфатические узлы в воротах селезенки.
Лечение гельминтозов
Лечение гельминтозов должно начинаться с применения специфических антигельминтных препаратов. Современный арсенал лекарственных средств, используемых для лечения кишечных паразитозов, включает значительное количество препаратов различных химических классов [11]. Они применяются как в клинической практике для лечения выявленных больных, так и с целью массовой профилактики.
Определяя препарат для специфической противопаразитарной терапии, следует понимать, что спектр действия этих препаратов не особенно широк. Практически все препараты этой группы применяются многие десятки лет и целесообразно предположить, что паразиты выработали системы приспособления и заболевание может быть резистентным к проводимой терапии. По данным Г. В. Кадочниковой (2004), эффективность такого традиционного препарата, как Декарис, в современных условиях не достигает 57%. Кроме того, эта группа противопаразитарных средств, к сожалению, имеет ряд побочных эффектов: тошноту, рвоту, абдоминальный синдром.
Таким образом, в современных условиях следует отдавать предпочтение более современным препаратам, которые, во-первых, являются универсальными для лечения как нематодозов, так и смешанных глистных инвазий и активны в отношении такого распространенного паразита, как лямблия. Во-вторых, использование одного противопаразитарного препарата, а не их комбинации, ощутимо снижает риск неприятных побочных эффектов. На сегодняшний день единственный представитель этой группы в нашей стране — альбендазол (Немозол).
Для лечения аскаридоза у детей старшего возраста или при рецидивировании заболевания в настоящее время под наблюдением врача может быть применен комбинированный прием антигельминтных средств (например, альбендазол в течение трех дней, затем — Вермокс в течение трех дней). Непременным условием успешной дегельминтизации больных энтеробиозом являются одновременное лечение всех членов семьи (коллектива) и строгое соблюдение гигиенического режима для исключения реинвазии. Следует отметить, что важное значение имеет ежедневная влажная уборка, так как были описаны казуистические случаи распространения репродуктивного материала остриц на частичках пыли на высоту до 1,5 метра.
В педиатрической клинике МОНИКИ разработаны принципы терапии паразитозов, учитывающие особенности патогенеза инвазии и позволяющие качественно и надежно вылечить данную группу заболеваний. Благодаря применению разработанной схемы терапии удается эффективно предотвратить реинвазию и развитие функциональных нарушений органов пищеварения у детей.
Принципы терапии больных паразитозами
1. Прием антипаразитарных препаратов проводится с учетом вида возбудителя инвазии.
Препараты, применяемые в лечениии аскаридоза:
- Вермокс (мебендазол) (для детей с 2 лет) — по 100 мг 2 раза в сутки в течение 3 дней;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении энтеробиоза:
- Вермокс (мебендазол) (для детей с 2 лет) — 100 мг однократно;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении лямблиоза:
- орнидазол 25–30 мг/кг (если масса тела больше 35 кг — 1000 мг) в два приема в течение 5 дней, 1 день — 1/2 дозы, повторный курс через 7 дней;
- Макмирор (нифурател) — по 15 мг/кг 2 раза в сутки в течение 7 дней;
- Немозол (альбендазол) — по 15 мг/кг однократно в течение 5–7 дней.
2. Лечение паразитоза предусматривает измененные в результате жизнедеятельности паразитов свойства пищеварительного тракта ребенка (функциональные нарушения органов пищеварения, ферментопатия, изменение микробиоценоза) и их коррекцию курсами ферментных препаратов и синбиотиков (табл. 1).
3. Обязательное применение энтеросорбентов и комплекса поливитаминов с микроэлементами (табл. 2 и 3).
Таким образом, разработанные в клинике педиатрии МОНИКИ принципы комплексной терапии паразитозов у детей предусматривают поэтапное восстановление функционального состояния ЖКТ, нарушенного в результате местного и системного влияния паразитов. Применение комплексной терапии позволяет предотвратить дальнейшее развитие функциональных нарушений с формированием органической патологии, а также избежать реинвазии.
Литература
Л. И. Васечкина 1 , кандидат медицинских наук
Т. К. Тюрина, кандидат медицинских наук
Л. П. Пелепец, кандидат биологических наук
А. В. Акинфиев, кандидат медицинских наук
В статье представлены современные данные о ларвальных гельминтозах у детей, самым распространенным и трудно диагностируемым из которых является токсокароз, имеющий тяжелое хроническое течение с выраженным иммуносупрессивным эффектом и полиорганными пораже
The article represents the modern data on larva migrans in children, toxocariasis being the most widespread and difficultly diagnosed among them, with severe clinical course, pronounced immunosuppressing effect and multiple affections of organs. Pathogenesis, therapy and prevention of the disease are discussed.
Распространенность гельминтозов среди жителей различных континентов Земли огромна: на каждого жителя Африки приходится более двух видов гельминтов, в Азии и Латинской Америке более одного вида, в Европе поражен каждый третий житель. В России практически каждый человек в течение жизни переносит паразитарное заболевание, причем чаще страдают дети [1]. По величине ущерба, наносимого здоровью людей, гельминтозы занимают 4-е место после диареи, туберкулеза и ишемической болезни сердца. Ежегодно в мире от гельминтозов погибают 135 тыс. человек, причем число это неуклонно растет [2].
- санитарно-гигиенические — высокий уровень контаминации окружающей среды яйцами гельминтов в результате сброса необезвреженных сточных вод и стоков животноводческих комплексов; недостаточные гигиенические навыки населения, привычка удобрять почву экскрементами;
- миграционными — усилением миграции населения и завозом паразитарных болезней из эндемических стран, вторжением городского населения в сельскую местность (работа на садовых участках, дачах, личных фермах), рост числа бродячих животных;
- информационными — малая информированность населения, а порой и врачей о гельминтозах и путях их заражения, профилактика гельминтозов ограничена лишь лечением вновь выявленных случаев заболевания;
- этническими — особенности питания населения, а именно употребление сырой или слабообработанной продукции;
- экономическими — обеднение населения, удорожание лекарственных препаратов;
- экологическими — снижение общей иммунной реактивности.
В настоящее время известно около 270 видов гельминтов, паразитирующих в организме человека, из которых 30 широко распространены на территории России. Гельминты, паразитирующие у человека, относятся к типу плоских червей, среди которых различают два класса: Cestoidea — ленточные черви и Trematoda — сосальщики, и типу круглых червей (класс Nematoda — собственно круглые черви). В зависимости от места паразитирования в организме человека, гельминты подразделяются на просветные, к которым относится большинство патогенных для человека гельминтов, и тканевые. В тканях в свою очередь могут обитать как взрослые особи, так и личинки.
Гельминтозы, при которых основным патогеном являются личинки, мигрирующие или покоящиеся, называют личиночными или ларвальными [3]. Особенностью ларвальных гельминтозов является то, что человек в данной ситуации является промежуточным или случайным хозяином, а жизненный цикл паразита не завершается, личинка не превращается в половозрелую особь и не может дать потомство [4]. Следовательно, такой вид паразитирования является биологическим тупиком. К числу таких гельминтозов относят многие филяриозы, трихинеллез, гнатостомоз, капилляриоз, спарганоз, эхинококкозы, токсокароз и др.
В отсутствие этиологического диагноза, который поставить удается не всегда, этот вид гельминтозов обозначают обобщенным термином Larva migrans, под которым понимают симптомокомплекс, обусловленный паразитированием личинок гельминтов, для которых человек не является естественным хозяином [5–7]. В зависимости от пути проникновения и места паразитирования условно выделяют перкутанные, или кожные, и висцеральные формы. Возбудителями кожной формы являются шистосомы, анкилостомы, некоторые виды филярий. При этом личинки гельминтов проникают в неповрежденную кожу при контакте с водой или почвой, паразитируют в эпидермисе, дерме или гиподерме, а после самопроизвольной гибели личинки, через 1–6 месяцев, наступает полное выздоровление [8]. Это условно доброкачественные гельминтозы. Висцеральная форма, возбудителями которой являются эхинококки, токсокары, цистицерки и др., возникает при проглатывании человеком яиц гельминтов с водой, продуктами питания, частичками почвы и протекает зачастую тяжело, длительно, порой годами и, как правило, не заканчивается спонтанным выздоровлением. Прогноз у данной группы гельминтозов серьезный, вплоть до летального исхода [9].
Наиболее тяжело протекают ларвальные (личиночные) гельминтозы вследствие множественного поражения печени, легких, сердца, почек, головного мозга, органа зрения и др. (токсокароз, однокамерный эхинококкоз, цистицеркоз) или агрессивного роста и метастазов зародышей или яиц паразита (многокамерный эхинококкоз, парагонимоз). Кроме этого, обладая значительной антигенной чужеродностью, мигрирующие личинки вызывают тяжелую общую и местную аллергическую реакцию, вплоть до формирования в тканях эозинофильных гранулем, оказывают механическое и токсическое повреждение [10].
Для гельминтозов характерен широкий диапазон клинических симптомов: от слабовыраженных до генерализованных реакций с множественными поражениями. Именно такая неспецифичность, малоинформативность стандартных методик гельминтологического исследования на яйца глистов, в совокупности с традиционным отсутствием настороженности у городских практических врачей, побудили нас еще раз обратить внимание на эту проблему. Часто правильный диагноз скрывается за самыми разнообразными масками и распознается поздно (рис. 1).
.jpg)
Токсокароз является самым распространенным из ларвальных гельминтозов у детей, пораженность токсокарозом в странах умеренного пояса составляет от 2% до 37%, достигая 92,8% в тропических странах [11–14]. Токсокароз — это зоогельминтоз, имеющий тяжелое хроническое течение с выраженным иммуносупрессирующим эффектом и полиорганными поражениями. Возбудителем токсокароза является нематода из рода Toksokara. Наиболее известны Toksokara catis, паразитирующая в организме кошек, и Toksokara canis, паразитирующая в организме собак, волков, лисиц, песцов и других представителей семейства псовых [15, 16]. Самка Toksokara canis имеет длину 9–18 см, самец — 5–10 см. Взрослые паразиты локализуются в желудке и тонкой кишке окончательных хозяев. Средняя продолжительность жизни половозрелых особей составляет 4–6 мес, и каждая самка Toksokara canis откладывает более 200 тыс. яиц в сутки. Яйца выделяются незрелыми и через 5–8 дней инкубации в почве становятся инвазионными, сохраняя жизнеспособность и инвазивность до 10 лет. Кроме этого, широкому распространению токсокароза среди животных способствует совершенный механизм передачи возбудителя, при котором сочетаются прямой (заражение яйцами из окружающей среды), внутриутробный (заражение плода личинками через плаценту), трансмаммарный (передача личинок с молоком) пути передачи и заражение через резервуарных (паратенических) хозяев.
Основной источник опасности для человека — это домашние и бродячие собаки разного возраста. В настоящее время в Москве численность собак превышает 1 млн особей, которые ежедневно оставляют на ее территории около 270 тонн экскрементов, содержащих более 40 тысяч яиц токсокар в каждом грамме! Поэтому каждая вторая проба почвы детских площадок, скверов, парков и территорий вокруг жилых домов содержит яйца этих паразитов [17–20]. У детей заражению может способствовать геофагия, именно поэтому токсокарозом чаще болеют дети дошкольного возраста. Прямой контакт с собакой также может привести к заражению через шерсть, загрязненную почвой, содержащей зрелые яйца токсокар. Ребенок может заражаться круглогодично через загрязненные яйцами почву, продукты питания, воду, руки. Установлена роль тараканов в распространении токсокароза: они поедают значительное количество яиц токсокар и до 25% их выделяют в жизнеспособном состоянии в окружающую среду [21]. Группу риска составляют люди, по роду деятельности контактирующие с животными и почвой.
Человек служит паратеническим (резервуарным) хозяином, являясь для паразита биологическим тупиком, так как токсокары паразитируют у него только в личиночной стадии, не выделяясь в окружающую среду. После проглатывания человеком зрелых яиц, в проксимальном отделе тонкого кишечника из них выходят личинки, которые через слизистую оболочку проникают в кровоток, затем заносятся в печень и правую половину сердца. Попав в легочную артерию, личинки продолжают миграцию и переходят из капилляров в легочную вену, достигают левой половины сердца и затем разносятся кровью по разным органам и тканям. Мигрируя, они достигают места, где диаметр сосуда меньше размера самой личинки, и покидают кровяное русло. Личинки токсокар могут оседать абсолютно во всех органах и тканях, сохраняя жизнеспособность в течение длительного времени, периодически активизируясь и возобновляя миграцию. С течением времени часть личинок инкапсулируется и постепенно разрушается внутри капсулы.
Токсокароз имеет длительное, рецидивирующее течение [22]. Клинические проявления определяются интенсивностью инвазии, распределением личинок в органах и тканях, частотой реинвазии и особенностями иммунного ответа человека [23, 24]. В зависимости от преимущественной локализации личинок выделяют висцеральную и глазную формы токсокароза.
Висцеральный токсокароз встречается чаще как у детей, так и у взрослых и возникает в результате заражения большим числом личинок [25]. Клинические проявления острого токсокароза разнообразны (рис. 2).
Для больных токсокарозом наиболее характерна субфебрильная, реже — фебрильная лихорадка с пиком во второй половине дня, сопровождающаяся недомоганием и ознобом. Как правило, одновременно с лихорадкой выявляется синдром поражения легких, варьирующий в широких пределах: от катаральных явлений до тяжелых астмоидных состояний. Могут наблюдаться рецидивирующие бронхиты, бронхопневмонии вплоть до летального исхода. При рентгенологическом исследовании в этот период выявляются множественные или единичные эозинофильные инфильтраты, так называемый синдром Леффлера. Наряду с синдромом поражения легких часто отмечается увеличение размеров печени, а иногда и селезенки, сопровождающееся болями в животе, тошнотой, рвотой и диарей. Практически у всех больных выявляется лимфаденопатия. В отдельных случаях токсокароз сопровождается развитием аллергического миокардита, панкреатита, поражением почек [26]. Поражение кожи при токсокарозе встречается реже и отличается полиморфностью высыпаний: от эритем до пятнисто-папулезных и уртикарных элементов. Все чаще стали выявлять и поражение центральной нервной системы, которое может протекать в виде эписиндрома, гиперактивности, аффективной неустойчивости, трудностей в учебе. В тяжелых случаях регистрируется менингоэнцефалит, парезы, параличи, нарушения психики. Увязать такие явления непосредственно с токсокарозом весьма проблематично, однако в одном из сероэпидемиологических исследований, проведенном в 1984 г., показана связь затруднений при чтении, невозможности сосредоточиться и низкого уровня интеллекта с заболеванием дошкольников токсокарозом.
Золотым стандартом диагностики любого гельминтоза является паразитологический метод. Однако прижизненный паразитологический диагноз токсокароза практически невозможен, поскольку обнаружить мигрирующие личинки трудно, а идентифицировать их по гистологическим срезам весьма непросто [29].
Клиническо-анамнестическая диагностика токсокароза также затруднительна ввиду полиморфизма и неопределенности клинических проявлений. В повседневной клинической практике своевременная постановка диагноза и назначение специфической терапии — скорее исключение, чем правило. Для облегчения задачи в 1978 г. был предложен диагностический алгоритм (табл.).
При сочетании симптомов и признаков на сумму более 12 баллов целесообразно назначение иммунологической диагностики. В диагностике глазного токсокароза может помочь офтальмологическое обследование с обнаружением личинки в области диска зрительного нерва или в макулярной части.
Диагностика токсокароза на сегодняшний день основывается на лабораторных методах исследования [30]. Одним из постоянных проявлений висцеральной формы токсокароза является лейкоцитоз и стойкая длительная эозинофилия до 30–90%. Наблюдается также умеренная анемия, гиперпротеинемия, гипергаммаглобулинемия, высокий уровень IgE. При поражении печени отмечаются нарушения ее функции.
Наиболее информативными в диагностике токсокароза являются иммунологические методы, а именно определение титра специфических IgG-антител к Toksokara canis методом иммуноферментного анализа (ИФА), обладающим высокой чувствительностью и достаточной специфичностью при висцеральной локализации гельминта — 93,7% и 89,3% соответственно [31]. Установлена корреляция между клиническими проявлениями, тяжестью процесса и титpами антител. Титp специфических антител 1:800 и выше с большой степенью вероятности свидетельствует о заболевании, а титpы 1:200–1:400 — о носительстве токсокаp при висцеральном токсокаpозе и патологическом процессе пpи токсокаpозе глаза. За лицами с низкими титрами противотоксокарозных антител устанавливается диспансерное наблюдение и пpи появлении клинических признаков болезни рекомендуется проведение специфической терапии. Однако необходимо помнить, что не всегда имеется прямая корреляция между титром антител и тяжестью заболевания, так как токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного. Кроме того, возможны и ложные результаты исследования: ложноположительные могут наблюдаться у больных эхинококкозами, описторхозом (в острой фазе заболевания), миграционной фазой аскаридоза; ложноотрицательные — при токсокарозе глаз, первичном иммунодефиците, длительном течении гельминтоза.
До настоящего времени нет единой схемы специфической терапии токсокароза, базирующейся на научных данных. Обычно применяют противонематодозные препараты, действующие на личиночную стадию гельминтов — альбендазол и мебендазол; ивермектин и диэтилкарбамазин [32]. Все препараты активны в отношении мигрирующих личинок и недостаточно активны в отношении тканевых форм, находящихся в гранулемах. Самым часто используемым является мебендазол, назначаемый в дозе 200–300 мг/сут в 2–3 приема, внутрь, в течение 10–14 дней. Повторный курс проводят через 2 недели. Диэтилкарбамазин назначают в дозе 3–4 мг/кг/сут в 2 приема, внутрь, в течение 21 дня. Однако наиболее широким спектром действия обладает альбендазол, эффективный в отношении большинства кишечных нематодозов и ларвальных цестодозов. Механизм действия альбендазола связан с избирательным подавлением полимеризации бета-тубулина, что ведет к деструкции цитоплазматических микроканальцев клеток кишечного тракта гельминтов. Назначается альбендазол в дозе 10 мг/кг/сут в два приема, внутрь, после еды в течение 10–14 дней. Необходимость повторного курса устанавливается после клинико-лабораторного обследования больного. Побочные явления, возникающие при применении вышеуказанных препаратов, могут быть связаны не только с токсическим действием антигельминтных препаратов, но и с реакцией организма на массовую гибель личинок токсокар. Поэтому в процессе лечения целесообразно назначать антигистаминные препараты, а в ряде случаев и кортикостероиды.
При глазном токсокарозе гранулемы удаляют микрохирургическими методами, для разрушения личинок в средах глаза применяют лазерокоагуляцию [33]. При бессимптомном течении с низкими титрами специфических антител лечение не проводится, а за больными устанавливается динамическое наблюдение.
Критериями эффективности лечения считают постепенное снижение и ликвидацию клинических проявлений токсокароза, уменьшение уровня эозинофилов и специфических антител. Вместе с тем исследования показывают, что в результате лечения процесс снижения уровня специфических антител идет медленно и не охватывает всех пациентов. Клинический эффект от лечения опережает гематологический и иммунологический. При рецидивах симптоматики, сохранении стойкой эозинофилии или повышении титра специфических антител проводят повторные курсы, иногда до 4–5.
Диспансерное наблюдение за переболевшими проводит врач-инфекционист или педиатр на протяжении не менее 6 месяцев. Больные подлежат осмотру 1 раз в 2 месяца и снимаются с учета после 2-кратного отрицательного результата на антитела методом ИФА с интервалом в 3–4 месяца. Прогноз в большинстве случаев благоприятный.
Основную роль в контроле заболеваемости токсокарозом играет традиционная профилактика, которая включает в себя соблюдение правил личной гигиены, обязательное обучение детей санитарным навыкам, своевременную дегельминтизацию собак, оборудование мест выгула собак, повышение культурного уровня владельцев собак [34].
Литература
А. С. Боткина 1 , кандидат медицинских наук
М. И. Дубровская, доктор медицинских наук, профессор
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Читайте также:

