При микроскопировании препаратов риккетсий не используют метод
Обновлено: 22.04.2024
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
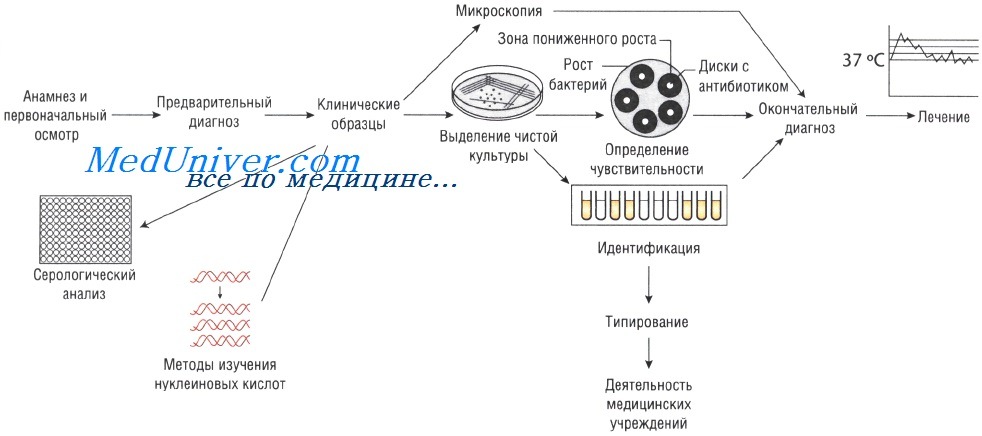
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Техника. Препарат обрабатывают I N раствором НС1 7 мин при подогревании до 60С. После промывания мазок окрашивают по Романовскому.
Микроскопическая картина. Ядерные элементы темно-красные, цитоплазма розовая.
Окраска риккетсий Метод Романовского-Гимза
Окраска по Романовскому-Гимза является одним из основных методов при изучении морфологии риккетсий, хламидий, спирохет, простейших, а также при исследовании форменных элементов крови.
Техника. Краситель Романовского-Гимза состоит из азура, эозина и метиленового синего. Непосредственно перед употреблением к 10 мл дистиллированной воды нейтральной реакции прибавляют 10 капель краски и тотчас же наливают на препарат, предварительно фиксированный жидким фиксатором, на один час. Затем краску сливают, препарат промывают водой, высушивают на воздухе и микроскопируют. Окрашивание происходит быстрее (30-40 минут), если препарат с краской поместить в термостат при 37С. К 10 мл дистиллированной воды нейтральной или слабо щелочной реакции непосредственно перед окраской препарата прибавляют 10 капель краски и тот час же наливают на фиксированный препарат (или погружают препарат в стаканчик с краской). Через 1 час краску сливают, препарат промывают водой, высушивают на воздухе и исследуют. Если поместить препарат с краской в термостат при 37º, то окрашивание происходит быстрее (30-40 минут).
Результаты окрашивания зависят от свойства воды, поэтому следует проверять ее реакцию.
Микроскопическая картина. Риккетсии окрашиваются в розово-красный цвет, ядра эукариотических клеток – в красно-фиолетовый, а цитоплазма – в голубой.
Метод Здродовского
Техника. Препарат тонким слоем наносят на стекло, фиксируют на пламени и окрашивают разведенным карболовым фуксином (10-15 капель фуксина на 10 мл дважды дистиллированной воды) в течение 5 минут; затем препарат слегка обесцвечивают погружением на 1-3 секунды в слабую (0,01%) соляную кислоту, промывают водой и докрашивают в течение 30 секунд 1% раствором водного метиленового синего. Тонкий мазок фиксируют на пламени горелки. Окраску производят разведенным карболовым фуксином (10-15 капель фуксина на 10 мл дистиллированной воды) в течение 5 минут. Окрашенный препарат промывают водой, а затем обесцвечивают в растворе органической или минеральной кислоты (0,5% лимонная кислота, 0,01% соляная кислота) в течение 2-3 секунд. Затем препарат промывают водой и докрашивают 0,5% раствором метиленовой синьки в течение 0,5 минуты.
Микроскопическая картина. Риккетсии окрашиваются в рубиново-красный цвет, в то время как клетки хозяина обесцвечиваются кислотой и дополнительно окрашиваются в голубой (протоплазма) или синий (ядра) цвет (рис.20).
Окраска хламидий
Метод Романовского-Гимза
Техника (см. выше).
Микроскопическая картина. На разных стадиях развития способность воспринимать окраску у хламидий меняется:
- “Элементарные тельца” (инфекционные частицы) окрашиваются краской Гимза в пурпурный цвет.
- “Первоначальные тельца” (неинфекционные частицы) окрашиваются по Гимза в синий цвет.
- Полностью сформировавшиеся зрелые внутриклеточные включения окрашиваются краской Гимза в пурпурный цвет (рис.21).
Метод Грама
Техника (см. выше).
Микроскопическая картина. Окраска по Граму дает вариабельные результаты. Поэтому не имеет диагностического значения.
Окраска водным разбавленным раствором Люголя
Придает внутриклеточным формам хламидий коричневый цвет из-за гликогеноподобной оболочки частиц.
Окраска микоплазм
Метод Романовского-Гимза
Техника (см. выше).
Микроскопическая картина. Исследование нативных препаратов не дает результата. Окрашивают препарат из культуры после агаровой фиксации: кусочек среды с колонией помещают на предметное стекло и накрывают покровным стеклом с каплей спиртового раствора метиленового синего и азура, затем препарат высушивают.
Окраска спирохет
Методы окраски спирохет делятся на две группы: методы позитивной окраски, когда окрашивается сама клетка, и методы негативной окраски, когда окрашивается фон препарата, а спирохета остается бесцветной.
Из методов позитивной окраски наиболее употребителен метод Романовского-Гимза.
Метод Романовского-Гимза
Техника. См. выше. Особенностью техники окрашивания препаратов спирохет является длительность окраски – в течение 12-15 часов.
Микроскопическая картина. Трепонемы окрашиваются в бледно-розовый, лептоспиры – розово-красный, а боррелии – сине-фиолетовый цвет.
Ускоренная модификация Шерешевского
Микроскопическая картина. См. метод Романовского-Гимза.
Окраска разведенным фуксином
Используется для окраски боррелий.
Реактив: фуксин Циля разводят 1:4 или 1:5. Краситель наносят на фиксированный мазок на 1-2 минуты.
Микроскопическая картина. В мазках крови боррелии окрашиваются в розово- красный цвет, эритроциты – в ярко-красный.
Серебрение по Морозову
Техника. См. выше.
Микроскопическая картина. Спирохеты окрашиваются в буро-черный цвет (рис.22).
Для негативной окраски спирохет используют несколько методов.
Негативный метод Бурри
Техника. См. выше.
Микроскопическая картина. На темно-сером тушевом фоне – бесцветные клетки.
Негативная окраска колларголом
Этот метод отличается простотой, доступностью и хорошей эффективностью.
Техника. На фиксированный мазок наливают на 3 минуты 2% раствор колларгола. После этого препарат ставят в наклонное положение (водой не смывают) и подсушивают.
Микроскопическая картина. На золотисто-оранжевом фоне отчетливо контурируется бесцветная спирохета.
Негативный метод Бурри
Техника. См. выше.
Микроскопическая картина. На темно-сером тушевом фоне – бесцветные клетки.
Окраска простейших
Метод Романовского-Гимза
Техника. См. выше.
Микроскопическая картина. Клеточная цитоплазма окрашивается в голубой цвет, а ядра клеток и жгутики – в красно-фиолетовый цвет (рис.23).
Метод Райта
Реактивы. Способ приготовления: 1% раствор щелочного метиленового синего на 0,5% растворе двууглекислого натрия наливают в сосуд таким образом, чтобы высота слоя жидкости не превышала 6 см, и нагревают при 100 С в течение часа. Затем жидкость охлаждают и фильтруют. Охлажденный фильтрат в тонком слое при искусственном освещении должен иметь пурпурно-красный оттенок. К 100 мл фильтрата добавляют 500 мл 0,1% водного раствора эозина. При смешивании обеих жидкостей образуется обильный осадок; последний отфильтровывают и высушивают. Полученный таким образом краситель растворяют в ступке в метиловом спирте в соотношении 0,1:60,0.
На сухой нефиксированный мазок наливают несколько капель красителя. Спустя 1 минуту прибавляют столько же капель дистиллированной воды. Через 2-3 минуты препарат промывают в воде около 0,5 минуты, пока он в тонком слое не приобретет розоватого оттенка.
Микроскопическая картина. Ядра простейших окрашиваются в вишнево-красный цвет, цитоплазма – в голубоватый, жгутики – в красный цвет.
ИФА. В настоящее время уже появились коммерческие наборы для выявления Аг некоторых возбудителей, позволяющие их идентифицировать в течение 5-10 мин. Для выявления Аг на твёрдой фазе сорбируют известные AT и добавляют сыворотку, содержащую Аг; после инкубирования несвязанный Аг декантируют, систему промывают и вносят меченые AT, специфичные к сорбированным AT. Повторяют процедуру инкубирования и отмывания, вносят хромогенный субстрат, положительный результат фиксируют при изменении окраски системы.
Гибридизация ДНК — высокоспецифичный метод, позволяющий идентифицировать геном вируса после его гибридизации комплементарными молекулами ДНК. В качестве маркёра применяют ферменты и изотопы. Метод определяет способность вирусной ДНК гибридизиро-ваться с меченой комплементарной ДНК; специфичность метода прямо пропорциональна длине комплементарной цепочки. Перспективен метод гибридизации нуклеиновых кислот in situ. Для постановки реакции меченую ДНК наносят на биоптаты тканей (в том числе на фиксированные формалином или заключённые в парафиновые блоки) и регистрируют взаимодействие с комплементарной ДНК. Метод используют для выявления вирусов простого герпеса, папилломы человека, Эпстайна-Барр и др.
ПЦР. Метод значительно увеличивает чувствительность метода гибридизации, повышая содержание вирусной ДНК в материале, полученном от больного, а также ускоряет время получения результата.
Методы диагностики микозов ( грибковых заболеваний )
Микроскопия — один из основных методов выявления возбудителей микозов. Позволяет проводить экспресс-диагностику микозов и получать результат в течение 1—2 ч, тогда как для выделении культуры возбудителя необходимы недели. Для экспресс-диагностики препараты часто необходимо окрашивать специальными красителями, так как простая окраска гематоксилином и эозином часто не позволяет выявить клетки грибов.
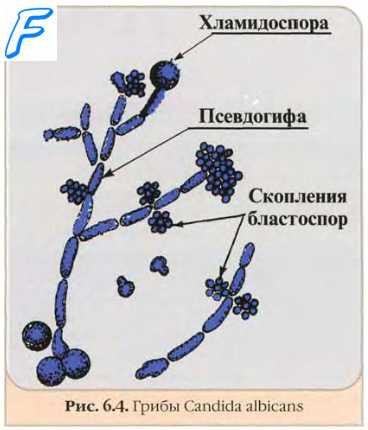
Неокрашенные препараты грибов
Микроскопия методом висячей или раздавленной капли. Метод позволяет выявить структуры грибов в клинических образцах без предварительного окрашивания.
Обработка 10% едким калием (КОН). Метод используют в первую очередь для визуализации структур возбудителей в фрагментах кожи и её придатках (ногти, волосы), отделяемом очагов поражения и влагалища. В указанных образцах содержится большое количество клеток, в которых КОН разрушает кератин, оставляя неизменёнными клетки грибов.
Окрашенные препараты грибов. Окраска мазка грибов.
• Окраска мазка грибов по Граму. В мазках из клинического материала грибы представлены грамположительными клетками. Клетки Cryptococcus neoformans плохо воспринимают красители, что можно использовать как дифференциально-диагностический признак при микроскопии окрашенных мазков СМЖ.
• Окраска мазка грибов нигрозином или тушью по Бурри мазков СМЖ позволяет выявить капсулированные клетки Cryptococcus neoformans. Для идентификации этого микроорганизма можно использовать муцикармин или конго красный.
• Окраска мазка грибов по Романовскому-Гимзе или Райту мазков крови и костного мозга позволяет выявить дрожжевую форму Histoplasma capsulatum в цитоплазме фагоцитов.
• Окраска мазка грибов метенаминовым серебряным по Гомори. Метод включает предварительную обработку гистологических препаратов хромовой кислотой с последующим нанесением красителя (клетки грибов тёмно-серые или чёрные).
• Окраска мазка грибов по Гридли. Метод включает предварительную обработку препаратов хроматом лейко-фуксина с последующим нанесением фуксинового альдегида и метанилового жёлтого (клетки грибов розово-пурпурные на жёлтом фоне).
• Окрашивание перйодной кислотой и реактивом Шиффа (по Мак-Манусу). 1,2-Гликольные группировки полисахаридов клеточных стенок грибов сначала окисляются перйодной кислотой до альдегидов, реагирующих с сульфитом лейкофуксина реактива Шйффа; клетки окрашиваются в насыщенно розовый или красный цвет.
Иммунофлюоресцентная микроскопия грибов
Наибольшее распространение нашла РИФ. Применяют AT, меченные флюоресцеинами; для выявления грибковых Аг реагент наносят на гистологический препарат, инкубируют и проводят люминесцентную микроскопию.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика туберкулеза. Принципы микробиологической диагностики туберкулеза. Выделение возбудителя туберкулеза.
Для диагностики туберкулёза применяют бактериоскопические, бактериологические, биологические, серологические и аллергологические методы, входящие в обязательный диагностический минимум. Материалом для исследований служат мокрота, отделяемое свищей, моча, СМЖ, испражнения.
Микроскопия возбудителя туберкулеза в патологическом материале. В мазках, окрашенных по Цилю-Нильсену, обнаруживают кислотоустойчивые палочки возбудителя туберкулеза.
Нередко материал содержит мало бактерий туберкулеза и для повышения вероятности их обнаружения используют методы обогащения: центрифугирование и флотацию. В первом случае исследуемый материал обрабатывают смесью растворов NaCl и NaOH, центрифугируют и микроскопируют осадок. Второй метод включает обработку материала смесью NaOH, дистиллированной воды и ксилола (или бензола). Образец энергично встряхивают; образующаяся пена всплывает и захватывает микобактерии. Пену отсасывают и готовят мазки.
Наиболее результативна люминесцентная микросколия возбудителя туберкулеза. Материал обрабатывают аурамин-родамином и бактерии окрашиваются в бело-жёлтый цвет. Для выявления L-форм применяют AT, меченные флюорохромами.
Выделение возбудителя туберкулеза
Достоинство метода — возможность получения чистой культуры туберкулеза, позволяющая её идентифицировать, оценить вирулентные свойства и определить чувствительность к ЛС. Материал засевают, тщательно втирая, на твёрдые питательные среды.
Для повышения эффективности выделения возбудителя туберкулеза и уничтожения контаминирующей микрофлоры применяют методы обогащения или обрабатывают материал 6-12% серной кислотой. Основной недостаток бактериологического метода — длительность получения результата (от 2 до 12 нед). В связи с этим разработаны ускоренные микрометоды выделения возбудителя туберкулеза.
Один из распространённых методов выделения возбудителя туберкулеза, метод Прайса, заключается в следующем. Материал помещают на предметное стекло, обрабатывают серной кислотой, отмывают физиологическим раствором и вносят в питательную среду, дополненную цитратной лизированной кровью.
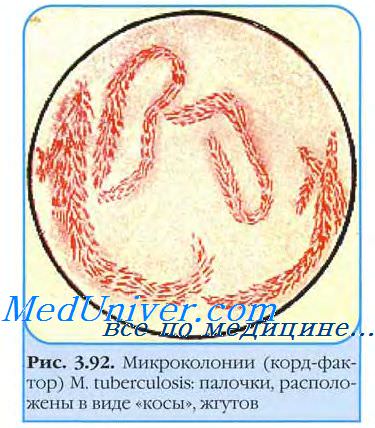
Стекло вынимают через 3-4 сут и окрашивают но Цилю-Нильсену. При микроскопии обнаруживают микроколонии микобактерии возбудителя туберкулеза. Вирулентные бактерии образуют змеевидные (рис. 22-2), а невирулентные — аморфные микроколонии. Культуры L-форм выделяют посевом в столбик полужидкой среды и инкубируют при 37 °С 1-2 мес.
Рост проявляется в виде облачка помутнения с мелкими вкраплениями. Вирулентность выделенной культуры возбудителя туберкулеза определяют заражением лабораторных животных и по наличию корд-фактора. Последний легко идентифицируют по способности микобактерии связывать нейтральный красный и нильский голубой и удерживать их после добавления щелочи. Вирулентные штаммы возбудителя туберкулеза удерживают красители, авирулентные — нет.
Читайте также:

