При переливании плазмы возможна передача инфекций
Обновлено: 24.04.2024
М.Н. Губанова, С.Р. Мадзаев, К.С. Аветисян, А.В. Бахметьев, М.В. Зарубин, А.В. Караваев, Е.А. Клюева, А.В. Коденев, К.В. Кузнецов, А.Р. Максимов, У.С. Султанбаев, Н.Г. Филина, К.В. Хальзов, Л.М. Яковлева, Е.Б. Жибурт
Российская ассоциация трансфузиологов
Трансфузиология №4, 2013
Резюме
Определили распространенность и встречаемость инфекций у доноров крови России в 2010-2012 гг. Расчетный остаточный риск трансфузионного инфицирования в 2012 году составил: для ВИЧ – 162; ВГС – 337; ВГВ – 971 на 1 млн донаций. В информационной системе службы крови АИСТ необходимо разделить учет положительных результатов скринингового и подтверждающего тестов на маркеры инфекций. Высокий риск трансфузионного инфицирования ВИЧ, вирусами гепатита В и С стимулирует активное внедрение мер повышения безопасности крови: отбор доноров, повышение чувствительности методов скрининга инфекций, инактивацию патогенов в компонентах крови и рациональное назначение гемотрансфузий в клинике.
Ключевые слова: кровь, донор, переливание, риск, инфекции, ВИЧ, гепатит, распространенность, встречаемость.
Введение
Общепризнано, что, несмотря на все меры безопасности, остаточный риск передачи инфекции с донорской кровью сохраняется из-за серонегативного окна и других особенностей течения инфекционного процесса [1–5].
Распространенность, превалентность – количество случаев определенной болезни в популяции в определенный момент. В трансфузиологии – количество заболеваний у первичных доноров (чаще – в год). Встречаемость, инцидентность –количество случаев заболевания, возникших в течение определенного времени в определенной популяции. В трансфузиологии – выявление заболеваний у регулярных доноров [6]. Остаточный риск передачи гемотрансмиссивных инфекций рассчитывают как произведение продолжительности серонегативного периода инфекции и встречаемости [7]. По со- стоянию на 10.11.2013 указанная статья Schreiber G.B. и соавт. процитирована в 815 публикациях. В соответствии с нормативами Евросоюза ежегодный отчет о деятельности учреждений службы крови должен включать показатели встречаемости и распространенности маркеров гемотрансмиссивных инфекций у доноров крови и ее компонентов [8].
В первой российской публикации о распространенности и встречаемости у доноров крови встречаемость определили как частное количества выявленных инфекций и количества кадровых доноров [9].
В Астане расчетный остаточный риск трансфузионного инфицирования составил: для ВИЧ – 12; ВГС – 1377; ВГВ – 1254 на 1 млн донаций [10].
Представляет интерес определить распространенность и встречаемость инфекций у российских доноров, а также остаточный риск трансфузионного инфицирования.
Материалы и методы
В службе крови России создана информационная система, основанная на программе АИСТ [11, 12]. Разработчик программы А.И. Болотов специально для настоящего исследования создал приложение к программе, позволяющее подсчитать количество выявленных случаев инфекций у первичных и повторных доноров. За что авторы статьи приносят Андрею Исааковичу глубокую благодарность.
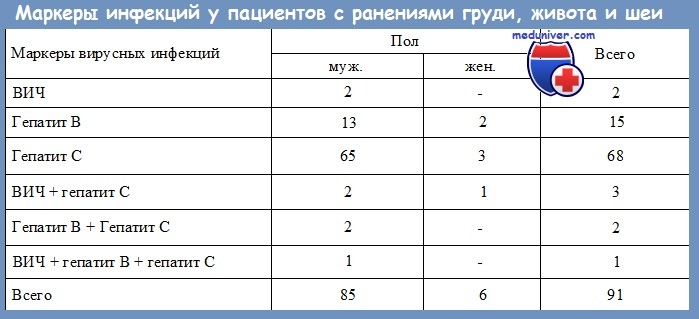
В исследовании приняли участие 48 организаций службы крови, представившие результаты обследования 773185 доноров крови и ее компонентов в 2010–2012 гг.
Образец крови от каждой донации обследовали на маркеры 4 гемотрансмиссивных инфекций: вирус иммунодефицита человека (ВИЧ) (антиген р24 ВИЧ-1 и антитела к ВИЧ- 1/2), вирус гепатита В (ВГВ) (поверхностный антиген ВГВ, HBsAg), вирус гепатита C (ВГC) (антитела к ВГС) и сифилис (антитела к бледной трепонеме). Доля доноров, включенных в исследование, составила 9–18% аналогичной категории доноров всей страны [13–15] (табл. 1).

Полученные данные анализировали с использованием дескриптивных статистик и корреляционного анализа при уровне значимости 0,05. При расчете встречаемости инфекций учли, что средняя частота донаций повторных доноров в России составляет 2,4 раза в год [15]. Распространенность рассчитывали на 100000 доноров. Встречаемость рассчитывали на 100000 человеко-лет с учетом средней частоты донаций.
Результаты и обсуждение
Инфекции у доноров
Известно, что АИСТ не формирует установленную [16] российскую отчетную форму организации, заготавливающей кровь, (№39) [17]. Также на результаты исследования могло повлиять разночтение роcсийских правил [18], в которых отсутствует алгоритм выбраковки крови и отвода донора. ВОЗ рекомендует кровь браковать после получения повторного положительного результата скрининга, а донора отводить по положительному результату подтверждающего теста [19].
Высокая частота регистрации ВИЧ-положительных результатов у доноров, включенных в исследование, может быть обусловлена учетом результатов скрининга, а не подтверждающего теста (табл.2).


Остаточные риски трансфузионного инфицирования (ОРТИ) вирусами гепатита В (ВГВ), гепатита С (ВГС) и ВИЧ являются основными объективными количественными показателями вирусной безопасности службы крови. Оценки остаточных рисков трансфузионного инфицирования ВГС, рассчитанные на основе анализа данных обследования (скрининга) доноров крови, мониторинга реципиентов множественных трансфузий и контрольного тестирования плазмы крови для производства ее препаратов, аналогичны полученным в настоящем исследовании, и составляют 940, 1600 и 630 на 1 млн кроводач, трансфузий и единиц плазмы соответственно [21].
Рассчитанные классическим способом ОРТИ в США составили: для ВИЧ – 2,03; ВГС – 9,70; ВГВ – 15,83 на 1 млн донаций [7]. По нашим данным, ОРТИ при переливании крови доноров России для ВИЧ, ВГВ и ВГС – соответственно, в 80, 35 и 61 раз выше, чем в США.
Следует подчеркнуть ограниченность нашего исследования: корректный расчет встречаемости может быть основан на учете интервала между предпоследней и последней донациями – в каждом конкретном случае выявления инфекции у регулярного донора. Очевидно, что автоматизация такого учета – важное направление развития информационной системы службы крови России. ОРТИ ВГВ в Казахстане в 3,7 раза, а ВГС – в 1,4 раза выше, чем в России. ОРТИ ВИЧ, напротив, в России в 13,4 раза выше, чем в Казахстане [10], что еще раз подтверждает возможность ошибочной автоматизированной регистрации российской информационной системой службы крови ВИЧ-ложноположительных результатов скрининга донорской крови.
Особо следует отметить необходимость программного определения встречаемости инфекций – с индивидуальной регистрацией периода между серонегативной и серопозитивной донациями.
Показатели донорства, встречаемость и распространенность инфекций в отдельных организациях
Представляет интерес анализ распространенности и встречаемости инфекций как по отдельным организациям, так и по нозологическим формам. Обращает на себя внимание широкий диапазон масштаба организаций, участвующих в исследовании. Так, соотношение верхнего и нижнего квартиля первичных доноров в 2012 году составило 12,8, а повторных доноров – 11,8. При этом 25% наименьших организаций принимали не более двух доноров в день и вероятность попадания инфицированного человека в их число ограничивалась объемом выборки, а возможно и обследованием донорской крови во внешней крупной лаборатории (табл. 7).


Расчет распространенности и встречаемости инфекций у доноров в отдельных организациях проводили без учета частоты донаций повторных доноров, поскольку в каждом отдельном случае этот показатель не регистрируется и неизвестен (табл.8 и 9). Недостоверность данных небольших организаций послужила основанием стратометрического отбора для последующего анализа 24 организаций, количество повторных доноров в которых было выше медианы исходной выборки [22].
Эта группа была более однородной (соотношение верхнего и нижнего квартиля первичных доноров в 2012 году составило 6,2, а повторных доноров – 3,6) и каждая организация в среднем принимала более 10 тысяч доноров ежегодно (табл. 10–12).

Интересно оценить соотношение показателей распространенности и встречаемости отдельных инфекций (табл. 13). Максимальная близость этих показателей ВИЧ-инфекции вряд ли свидетельствует об избирательно высоком риске инфицирования регулярных доноров. Скорее всего вновь учитываются ложнополо жительные результаты лабораторного скрининга.

Положительная корреляция показателей распространенности и встречаемости отдельных инфекций (табл. 14) свидетельствует о большом потенциале работы по формированию контингента регулярных доноров с минимальным риском инфицирования. Не следует также исключать и возможность систематических ошибок лабораторного скрининга крови первичных и повторных доноров.
Отсутствие корреляции распространенностей ВИЧ и ВГВ – признак различных механизмов передачи ВИЧ и ВГВ в общей популяции. Отсутствие корреляции распространенности ВИЧ и встречаемости ВГВ, ВГС и сифилиса – признак различных механизмов передачи ВИЧ в общей популяции и других гемотрансмиссивных инфекций среди доноров.
Положительные корреляционные связи всех показателей встречаемости инфекций можно расценивать как признак преимущественно единого механизма инфицирования повторных доноров – половым путем.

Выводы
1. Впервые определены распространенность и встречаемость гемотрансмиссивных инфекций у доноров крови России. Эти показатели целесообразно ввести в официальную отчетность организаций российской службы крови.
2. В российских нормативных документах нужно внедрить критерии выбраковки крови и отвода донора по результатам скрининга маркеров гемотрансмиссивных инфекций.
3. В информационной системе службы крови АИСТ необходимо разделить учет положительных результатов скринингового и подтверждающего тестов на маркеры инфекций.
4. Отсутствие корреляционных связей показателей распространенности и встречаемости гемотрансмиссивных инфекций – признак различных механизмов передачи инфекций. Выявленные в настоящем исследовании положительные корреляционные связи всех показателей встречаемости инфекций можно расценивать как признак преимущественно единого механизма инфицирования повторных доноров – половым путем.
5. Высокий остаточный риск трансфузионного инфицирования ВИЧ, вирусами гепатита В и С стимулирует активное внедрение мер повышения безопасности крови: отбор доноров, повышение чувствительности методов скрининга инфекций, инактивация патогенов в компонентах крови и рациональное назначение гемотрансфузий в клинике. Выражаем признательность А.И. Болотову.
Осложнения переливания крови и ее компонентов
б. Бактерии:
(1) Постоянная проблема, часто нераспознаваемая.
(2) Наиболее часто передаются с концентратом тромбоцитов и ЭМ.
(3) Микроорганизмы:эритроциты— Yersinia enterocolitica, Serratia и род Pseudomonas; тромбоциты — Staphylococcus epidermidis, Bacillus species.
(4) Treponema pallidum: не выживает при хранении препаратов крови в холодильнике; о случаях сифилиса сообщается после переливания цельной крови.
(5) Иногда можно идентифицировать пакет эритроцитарной массы со значительной бактериальной контаминацией по более темному цвету крови в сравнении с таковым в трубке.
г. Болезнь Крейтцфельда-Якоба:
(1) В настоящее время имеется несколько доказанных случаев передачи при переливании возбудителя (приона) нового варианта болезни Крейтцфельда-Якоба.
(2) Большинство центров по сбору крови пытаются минимизировать риск, исключая доноров, рассматриваемых как имеющих высокий риск носительства инфекций, согласно семейному анамнезу и специфическим особенностям анамнеза жизни (путешествия, перенесенные заболевания и вмешательства).
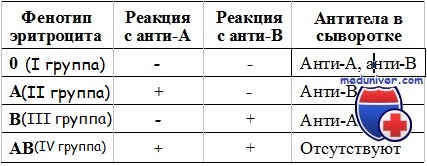
2. Гемолитические реакции:
а. Острые гемолитические иммунологические реакции. Редки, поскольку у новорожденных отсутствуют естественные анти-А- или анти-В-антитела, и посттрансфузионная аллоиммунизация эритроцитов отмечается редко, несмотря на многократные переливания.
б. Т-активация. Тяжелая форма гемолиза иммунного происхождения, сопровождающего переливание крови взрослых, содержащих анти-Т-антитела, у новорожденных с активацией нормального криптогенного Т-антигена на поверхности мембран эритроцитов:
(1) Часто у недоношенных новорожденных с некротизирующим энтероколитом и сепсисом.
(2) Подозревают Т-активацию у новорожденных с риском внутрисосудистого гемолиза, гемоглобинурии, гемоглобинемии после переливания препаратов крови или необъяснимого отсутствия прироста гемоглобина после переливания.
(3) При рутинной перекрестной пробе не обнаруживают Т-активацию при использовании моноклональной антисыворотки.
(4) Диагноз подтверждают с помощью малой перекрестной пробы по разнице в результатах прямого и обратного определения группы крови со специфической агглютинации и использованием арахисового лектина.
(5) Используют отмытые эритроциты, тромбоциты и анти-Т-плазму с низким титром только при подтвержденном гемолизе.
3. Неиммунологические причины гемолиза:
а. Механический, посредством чрезмерного давления при инфузии через маленькие иглы или фильтры 20-40 мкм.
б. Случайное перегревание или замораживание крови.
в. Одновременное введение несовместимых лекарственных средств и инфузионных растворов.
г. Переливание аномальных донорских клеток (недостаточность глюкозо-6-фосфатдегидро-геназы, наследственный сфероцитоз).
4. Другие иммунологические реакции:
а. Болезнь трансплантат против хозяина, вызванная трансфузией.
См. облучение крови для факторов риска и профилактики в этой статье.
б. Повреждение легких, вызванное трансфузией:
(1) Вторично к трансфузии донорской крови, содержащей антигранулоцитарные и анти-НLА-антитела, лейкоагглютинины против антигенов гранулоцитов реципиента или к трансфузии цитокинов/ медиаторов плазмы, которые поражают гранулоциты реципиента, вызывая дефекты адгезии эндотелия легких.
(2) Инициирует жизнеугрожающую гипоксе-мию вторично к активации комплемента и повреждению капилляров легких.
(3) О случаях у новорожденных сообщается редко; возможно, потому, что сложно отличить от дыхательной недостаточности, вызванной другими причинами у больных новорожденных.
5. Перегрузка большого круга кровообращения: изменения растяжимости легких и АД.
6.Побочное влияние на обмен веществ.
а. Гиперкалиемия:
(1) Облученная и хранившаяся в холодильнике кровь может иметь уровень ионов калия 30-50 ммоль/л или выше в плавающей на поверхности плазме.
(2) Переливания небольших объемов ЭМ не вызывают клинически значимого увеличения концентрации ионов калия в сыворотке.
(3) Жизнеугрожающая гиперкалиемия описана у больных новорожденных и у подвергшихся быстрому вливанию больших объемов хранившейся крови.
(4) Отмытые или свежие (хранившиеся
б. Гипо- или гипергликемия.
в. Гипокальциемия.
г. Изменение кислотно-щелочного баланса при переливании больших объемов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Советы хирургам по защите от инфекций передающихся через кровь
1. Какие заболевания, передающиеся с кровью, имеют наибольшее значение для хирурга?
Обычно среди возбудителей, передающихся при контакте с зараженной кровыо, основное внимание уделялось вирусу иммунодефицита человека (ВИЧ), однако рост заболеваемости гепатитом С в Северной Америке привел к тому, что именно гепатит сейчас является наиболее частым среди заболеваний, передающихся таким путем.
В настоящее время инфицирование вирусом гепатита В, который уже почти 50 лет считается профессиональной патологией хирургов, реже приводит к развитию заболевания, что связано с распространением прививок и разработкой сравнительно эффективной схемы лечения в случае контакта с вирусом.
2. Каков сравнительный риск заражения ВИЧ, HBV и HCV?
а) ВИЧ. На данный момент приблизительно 1 миллион жителей США инфицированы ВИЧ. Последние наблюдения показывают, что передача ВИЧ в больничных условиях происходит редко. Медработники составляют только 5% от всех больных СПИДом, и у большинства из них есть другие факторы, помимо профессиональных, вероятно, и вызвавшие заболевание. Наибольший профессиональный риск отмечен у медицинских сестер и работников лабораторий.
С 1 января 1998 года не отмечено ни одного документированного случая передачи ВИЧ от больного к врачу в результате профессионального контакта.
б) HBV. Нет сомнений, что все хирурги за время нормальной трудовой карьеры контактируют с HBV. Считается, что 1,25 миллиона жителей США болеют хроническим гепатитом В. Чрескожная инъекция инфицированной иглой приблизительно в 30% случаев приводит к развитию острого заболевания. В 75% гепатит В протекает клинически скрыто, а 10% инфицированных на всю жизнь остаются носителями вируса.
У многих носителей, потенциально заразных для окружающих, заболевание протекает бессимптомно, с минимальным прогрессированием или без прогрессирования. Примерно в 40% болезнь постоянно прогрессирует, приводя к циррозу, печеночной недостаточности или даже к генатоцеллюлярному раку.
в) HCV. Гепатит С стал для хирургов самой главной проблемой. Считается, что хроническим гепатитом С страдают приблизительно 4 миллиона жителей США. Риск сероконверсии при чрескожной инъекции инфицированной иглой составляет около 10%, однако в 50% острое заболевание приводит к хроническому носительству инфекции. О течении гепатита С до сих пор существуют различные мнения, однако почти у 40% больных хроническая HCV-инфекция приводит к развитию цирроза.
В последнем случае высок риск развития рака печени, вероятность которого достигает 50% в течение 15 лет.
3. Обеспечивает ли вакцинация против гепатита В полную защиту от заболевания?
В настоящее время для всех хирургов и лиц, работающих в операционной, доступна эффективная вакцинация против гепатита В. Вакцину против гепатита В получают с помощью рекомбинантной технологии; она не является разрушенными частицами вируса, полученными от инфицированных людей. Вводят три дозы вакцины, после чего следует определить титр поверхностных антител, чтобы убедиться в успешности вакцинации.
Приблизительно у 5% вакцинированных людей выработки антител не происходит и требуется повторная вакцинация. Некоторые люди остаются рефрактерными к вакцинации, для них сохраняется риск острого гепатита В. Вакцинация не гарантирует иммунизацию.
Согласно некоторым исследованиям, 50% практикующих хирургов не обладают достаточным иммунитетом к HBV из-за различных причин: отсутствия вакинации у старых хирургов, более чем 5-летнего срока после вакцинации, недостаточного количества рекомбинантной вакцины или неправильной вакцинации и, наконец, неспособности выработать соответствующий иммунный ответ.
4. Существует ли риск заражения больных от хирургов, инфицированных HBV?
Передача вируса гепатита В от хирурга к больному документирована. Анализ крови хирургов, которые могут заразить больных, как правило, положителен на е-антиген вируса гепатита В. Е-антиген является продуктом распада вирусного нуклеокапсида и говорит об активной репликации вируса в печени. Обнаружение е-антигена свидетельствует о высоких титрах вируса и сравнительно высокой заразности больного.
Большое количество документированных случаев передачи гепатита В больным от лиц, занятых в хирургии, может вызвать особенные проблемы и ограничение клинической деятельности для клиницистов, передавших эту инфекцию. В одном из последних отчетов из Англии сообщается о передаче вируса гепатита В больному даже от хирурга с отрицательным анализом па е-антиген HBV.
В последнее время одна национальная организация призывает ограничить деятельность е-антиген-положительных хирургов. Вопрос, можно ли хирургу с хроническим гепатитом В продолжать практику, будет обсуждаться в будущем.
5. Какова правильная тактика при чрескожном контакте с кровью больного, у которого есть гепатит В?
Тактика зависит от вакцинированности медработника. Если он вакцинирован и имеет положительный титр антител, то ничего предпринимать не надо. Если медработник не вакцинирован и не имеет антител к HBV, то ему или ей следует ввести дозу анти-HBV иммуноглобулина и начать серию вакцинации против гепатита В.
Медработникам, которые ранее были успешно вакцинированы от гепатита В, однако не имеют или имеют незначительный титр антител, следует ввести дозу анти-HBV иммуноглобулина и повторную дозу вакцины против гепатита В. Поскольку в большинстве случаев таких контактов с больным неизвестно, инфицирован он или нет, то, в общем, хирургам необходимо знать, есть ли у них антитела, и периодически повторять иммунизацию против гепатита В через каждые 7 лет.
6. Чем HCV отличается от HBV? Кто из них опаснее?
а) Заболеваемость в США:
- HBV: примерно 1,25 миллиона больных.
- HCV: примерно 4 миллиона больных.
б) Путь и последствия заражения:
- HBV: ДНК-вирус, передающийся с кровью; острая форма переходит в хроническую в 10% случаев.
- HCV: РНК-вирус, передающийся с кровью; острая форма переходит в хроническую в 50% случаев.
в) Профилактика:
- HBV: эффективная рекомбинантная вакцина.
- HCV: в настоящее время вакцины не существует.
г) Защита после контакта:
- HBV: людям, которые не были вакцинированы и не имеют антител к HBV, целесообразно введение анти-HBV иммуноглобулина.
- HCV: клиническая эффективность анти-HCV иммуноглобулина не доказана. Среди больных, с которыми имеют дело хирурги в США, больше лиц с хроническим гепатитом С, чем с хроническим гепатитом В, а вакцины против HCV-инфекции нет. Риск сероконверсии для гепатита С составляет 10% против 30% для гепатита В, однако HCV-инфекция гораздо чаще переходит в хроническую форму (50% против 10%). Поэтому HCV-инфекция представляет для хирургов гораздо большую угрозу.
7. Насколько высок риск для медработника заразиться ВИЧ?
Передача инфекции подтверждалось, если был зафиксирован контакт медработника с кровью или биологическими жидкостями инфицированного больного, после чего была отмечена сероконверсия ВИЧ. Профессиональный риск безусловно выше у медицинских сестер и работников лабораторий. Общее число заражений несравнимо с большим количеством контактов с вирусом, которые, по всей видимости, имели место с начала эпидемии (начало 1980-х годов).
8. Меньше ли риск заражения ВИЧ при выполнении операций лапароскопическим способом?
В последнее время лапароскопическую хирургию у ВИЧ-инфицированных больных считают хорошей заменой открытым вмешательствам. Данный метод уменьшает вероятность контакта с кровью и острыми инструментами, однако за счет некоторых его особенностей возможно заражение хирургов иными путями, чем при обычной операции. При десуфляции пневмонеритонеума во время лапароскопических вмешательств происходит разбрызгивание капелек ВИЧ-инфицированной крови в операционной. Риск заражения можно уменьшить, направляя воздух в закрытую систему и принимая соответствующие меры предосторожности при смене инструментов.
9. Является ли эффективным методом защиты использование двойных перчаток?
Вследствие возможности контакта поврежденной кожи с кровыо риск заражения людей, работающих в операционной, вирусом гепатита или ВИЧ повышен. Хотя двойные перчатки могут не предотвратить повреждения кожи, показано, что они явно уменьшают вероятность контакта с кровыо. Исследования, посвященные контакту с кровыо в операционной, показали, что в 90% такой контакт происходит па коже рук хирурга дистальнее локтя, включая область, защищенную перчатками. Согласно одному исследованию, если хирург надевает две пары перчаток, то вероятность контакта его кожи с кровыо уменьшается па 70%. Прокол наружной пары перчаток наблюдали в 25% случаев, в то время как прокол внутренней пары — только в 10% (в 8,7% у хирургов и в 3,7% у ассистентов). Прокол внутренней пары перчаток отмечался при операциях, длившихся более 3 часов; он всегда сопровождался проколом наружной пары. Наибольшее повреждение происходило па указательном пальце неведущей руки.
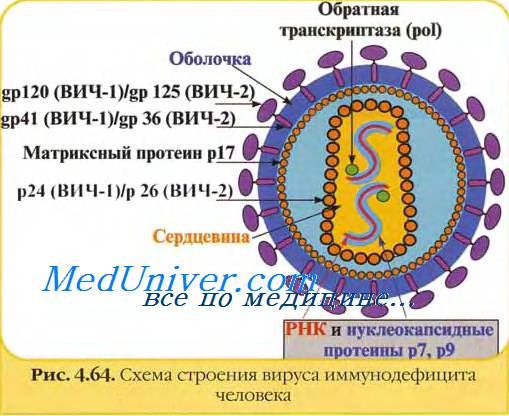
10. Представляет ли большую угрозу для хирургов попадание капелек в глаза?
Исследование эпидемиологических центров показало, что приблизительно в 13% случаев документированной передачи ВИЧ имел место контакт со слизистой и кожей. Попадание капелек в глаза часто недооценивают, хотя этот вид контакта легче всего предотвратить. В недавно проведенном исследовании изучали 160 пар защитных экранов для глаз, используемых хирургами и ассистентами. Все операции длились 30 минут и более. На экранах подсчитывали количество капелек, вначале макроскопических, потом микроскопических. Кровь была обнаружена на 44% из исследуемых экранов. Хирурги замечали брызги всего в 8% случаев. Лишь 16% капелек были видны макроскопически. Риск попадания капелек в глаза был выше для хирурга, чем для ассистента, и увеличивался с увеличением времени операции. Доказано, что важным является также тип вмешательства: риск выше при сосудистых и ортопедических операциях. Защита глаз должна быть обязательной для всех работающих в операционной, особенно для непосредственно оперирующих лиц.
11. Как часто кровь хирурга контактирует с кровью и биологическими жидкостями больного?
Контакт с кровью возможен при повреждениях кожи (уколы, порезы) и соприкосновении с кожей и слизистыми (прокол перчатки, царапины на коже, попадание капелек в глаза). Контакт вследствие повреждения кожи наблюдают в 1,2-5,6% хирургических процедур, а контакт вследствие соприкосновения с кожей и слизистыми — в 6,4-50,4%. Разница в приводимых цифрах обусловлена различиями в сборе данных, выполняемых процедурах, хирургической технике и мерах предосторожности. Например, хирурги в San Francisco General Hospital принимают крайние меры предосторожности, надевая водонепроницаемую форму и две пары перчаток. Случаев передачи инфекции какому-нибудь медработнику при контакте его неповрежденной кожи с инфицированными кровью и биологическими жидкостями не отмечено. Однако сообщалось о заражении ВИЧ медработников, не имеющие других факторов риска, вследствие контакта с их слизистыми и кожей ВИЧ-инфицированной крови. Вероятность передачи инфекции при таком контакте остается неизвестной, поскольку в проспективных исследованиях у медработников после контакта их слизистой и кожи с ВИЧ-инфицированной кровью сероконверсии отмечено не было.
Риск заражения существует для всех работающих в операционной, однако он намного выше для хирургов и первых ассистентов, поскольку 80% случаев загрязнения кожи и 65% случаев повреждений приходится именно на них.
12. Только ли хирургической техникой объясняется загрязнение кожи?
Кожа с царапинами может контактировать с кровью или биологическими жидкостями даже при соблюдении всех мер предосторожности. К сожалению, далеко не вся защитная одежда защищает в равной степени. В одном исследовании отмечены дефекты у 2% стерильных хирургических перчаток сразу после их распаковки.
13. Какова вероятность сероконверсии после контакта крови медработника с кровью больного для ВИЧ и HBV?
Вероятность сероконверсии после укола иглой составляет 0,3% для ВИЧ и 30% для HBV.
14. Какова вероятность для хирурга заразиться ВИЧ на рабочем месте за все время его карьеры?
Риск передачи ВИЧ хирургу можно вычислить, зная частоту обнаружения ВИЧ у хирургических больных (0,32-50%), вероятность повреждения кожи (1,2-6%) и вероятность сероконверсии (0,29-0,50%). Таким образом, риск заразиться ВИЧ от конкретного больного находится в интервале от 0,11 на миллион до 66 на миллион. Если хирург выполняет 350 операций в год в течение 30 лет, то риск заражения на протяжении всей карьеры для него составляет от 0,12% до 50,0%, в зависимости от переменных величии. В этом подсчете допущено несколько предположений:
а) Мы допустили, что заболеваемость ВИЧ является величиной постоянной, однако считается, что в Соединенных Штатах за год она увеличивается на 4,0-8,6%.
б) Учитывается только контакт с зараженной кровью при повреждении кожи; возможность контакта со слизистыми и кожей (без ее повреждения) не принимается во внимание.
в) Риск считается одинаковым для всех операций, однако известно, что он зависит от длительности и срочности операции, а также от объема кровопотери.
Очевидно, что эти предположения не способствуют точности вычислений, поэтому подсчитанная вероятность — всего лишь грубая оценка на основании имеющихся данных.
15. Знают ли хирурги о своем профессиональном риске?
16. Есть ли эффективные методы уменьшить риск заражения хирургов инфекциями, передающимися с кровью?
Профилактике заражения HBV, помимо общих мер предосторожности, способствует высокоэффективная вакцина, которая, однако, не используется так часто, как следовало бы. Большинство хирургов в возрасте 45 лет и старше не вакцинированы. Также отработан протокол лечения после контакта. Наиболее прагматичный подход для профилактики передачи HCV и ВИЧ — уменьшить вероятность повреждения кожи и контакта с кожей и слизистыми за счет применения оптимальных методик и мер предосторожнсти.
Наконец, при попадании крови необходимо быстро ее удалить. При загрязнении кистей или рук следует их немедленно обработать. Если это невыполнимо, то область контакта надо смочить раствором повидон-йода, а когда это будет возможно — обработать.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Посттрансфузионная иммуномодуляция. Влияние трансфузий на иммунитет
Гемокомпонентная терапия обладает мощным иммуномодифицирующим действием. Вопросы, связанные с влиянием гемотрансфузий на состояние иммунной системы, остаются до конца не изученными. Отдельного рассмотрения заслуживают вопросы постгрансфузионной иммуносупрессии. Не затрагивая возможности передачи с гемокомпонентами микроорганизмов и их способности оказывать влияние на иммунную систему, следует подчеркнуть, что такие изменения в иммунной системе реципиентов после гемотрансфузий, как анергия, иммунологическая толерантность, сниженный иммунный ответ, встречаются с чаще, чем клинически значимая аллосенсибилизация. Внутривенные гемотрансфузий значительно выраженнее предрасполагают реципиента к анергии, чем к аллоиммунизации.
Одни из первых доказательств о иммуносупрессивном действии гемотрансфузий были получены при анализе результатов трансплантации почек у больных, имевших в анамнезе различное количество переливаний компонентов крови. В настоящее время не вызывает сомнений, что гемотрансфузий существенным образом влияют на иммунную систему организма и в конечном итоге предопределяют течение различных заболеваний — инфекций, онкологических патологий, приживление трансплантата и др.
В этом плане большой интерес представляют данные об инфекционных осложнениях у больных с хирургическими методами лечения. Так, если послеоперационные инфекции у хирургических больных наблюдаются в 5 % случаев, то у реципиентов, получивших 2 и более дозы аллогенной крови, их частота возрастает до 20—30 %. При этом реципиенты аутологичной крови имеют такую же частоту инфекций, как и больные, не получавшие гемотрансфузий. При проведении гемотрансфузий компонентами крови, из которых удалены лейкоциты (лейкоцитарными фильтрами), частота послеоперационных инфекционных осложнений снижается до 2 % против 20 % у больных, получавших нефильтрованные компоненты крови.
При выполнении гемотрансфузий надо иметь в виду и возможность реактивации и генерализации латентных вирусных инфекций у реципиентов гемокомпонентов, что ведет к угнетению противоинфекционной резистентности.
О выраженном влиянии гемотрансфузий на иммунную системы указывают и результаты анализов лечения онкологических больных. Так, например, при ретроспективном анализе больных с колоректальным раком опухолями легких, у пациентов с аденокарциномой ободочной и прямой кишки обнаружено увеличение летальности в группе лиц, получавших гемотрансфузий в предперационном периоде. Смертность больных зависела не только от стадии опухолевого роста, размеров опухоли, но и от трансфузионного режима. Применение аутологичных гемокомпонентов оказывает более благоприятный эффект в послеоперационном периоде и даже способствует снижению частоты рецидивов колоректальных опухолей.
Следует отметить важное обстоятельство, что в клинических и экспериментальных исследования при проведении аллогенных гемотрансфузий выявлена значительная вариабельность опухолевого роста (от усиления до ингибиции).
Проведенные в последние годы клинические исследования показали, что трансфузионный эффект не может быть объяснен ни стадией опухолевого роста, ни другими клиническими параметрами. Иммуносупрессия выявлена даже при единичных трансфузиях отмытых эритроцитов или аллогенной плазмы, при этом установлена ее дозозависимость и связь с типом применяемого гемокомпонента.
У реципиентов аллогенной почки, получавших гемотрансфузий, в течение длительного времени снижена пролиферативная активность лимфоцитов на митогены и антигены, антигенпрезентирующая функция макрофагов, активность естественных киллеров, Т-клеточная пролиферация и секреция лимфокинов, число естественных киллеров и отмечается инверсия соотношения хелперов/супрессоров за счет снижения CD4+-лимфоцитов, увеличивается количество CD8+-клеток, В-лимфоцитов.
Проникновение в периферическую кровь большого количества антигенного материала, одновременно обладающего аллогенными, подобными и идентичными организму реципиента детерминантами, вызывает многообразные изменения в иммунной системе. Значительное повышение количества даже аутологичных антигенных детерминант приводит к снижению активности многих иммунных реакций, как это происходит при аутоиммунных процессах.
В процессах гемотрансфузионной имуномодуляции существенная роль принадлежит образующимся циркулирующим иммунным комплексам (ЦИК). Связываясь с различными субпопуляциями лимфоцитов, макрофагов, нейтрофилов, ЦИК ингибируют активность клеток.
Иммуносупрессия индуцируется и некоторыми факторами нормальной плазмы — растворимые HLA-антигены, фермент трансглютаминаза (так называемый фибринстабилизирующий фактор, или фактор XIII) имеют выраженное иммуносупрессивное действие на Т-лимфоциты и способствуют пролиферации В-лимфоцитов. Введение препаратов плазмы и концентратов факторов свертывания, содержащих значительное количество фибриногена, приводит к повышению уровня альфа2-макроглобулина, являющегося иммуносупрессорным агентом, ингибитором ИЛ-1, способным подавлять пролиферацию лимфоцитов, естественную цитотоксичность и антителозависимый киллинг.
Интерлейкин-1, интерлейкин-6 и TNF являются основной причиной постгрансфузионных фибрильных реакций. Физиологические эффекты цитокинов, накапливаюшихся в процессе хранения в контейнерах с гемокомпонентами и попадающих в организм реципиента, не учитываются при определении показании и не всегда сочетаются с задачами гемотрансфузии.
Посттрансфузионную иммуносупрессию следует рассматривать как результирующую всех 4 основных иммунопатологических синдромов:
— инфекционного;
— аллергического;
— аутоиммунного;
— лимфопролиферативного.
Целенаправленная профилактика и своевременная коррекция посттрансфузионной иммуносупресии позволят повысить эффективность лечения хирургических и терапевтических пациентов.
- Вернуться в оглавление раздела "Хирургия"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В этом ролике видно, как частицы вируса (они окрашены в зеленый цвет) распространяются из пораженной клетки на здоровые. Именно так вирус поражает одну клетку крови за другой.
Расследовать сложно, говорят в Федеральном Центре СПИД. Медицинские учреждения зачастую стараются информацию скрыть. А люди, у которых был риск заразиться в больнице, не всегда соглашаются пройти обследование. А ведь иногда приходится проверить до полутора тысяч человек, которые лежали в больнице в момент, когда там было зафиксировано заражение. Именно поэтому точной статистики нет. Расследования могут идти очень долго, между инфицированием и обнаружением могут проходить годы.
Как получают компенсацию за заражение
Первый и пока единственный случай при трансплантации был зафиксирован в 2000 году в Свердловской области — пациенту пересаживали почку. В дальнейшем случаи инфицирования, связанные с оказанием медицинской помощи, регистрировали в 40 регионах. Преимущественно это были дети, зараженные в детских больницах при медицинских манипуляциях.
Самая большая компенсация за инфицирование ВИЧ в больнице сегодня составляет 5 миллионов рублей. Ее получила каждая из трех жительниц Свердловской области. Они были инфицированы во время лечения бесплодия кровью санитарки, которая вызвалась стать донором.
Также в Екатеринбурге на днях закончился и суд по случаю 2014 года: мужчине в Свердловской областной больнице перелили кровь от пяти доноров, сразу двое из которых оказались инфицированными. Суд также закончился присуждением компенсации в 800 тысяч. В этом же лечебном учреждении произошло инфицирование в конце 2015 года. Пока известно только то, что пациент — девушка около 25 лет, она также инфицировалась при переливании.
«У нас в области эпидемия генерализовалась, — продолжает Светлана Смирнова. — Это значит, что пораженность ВИЧ превысила 1% от количества населения. Из-за этого у нас очень много скрытых источников, то есть людей, которые считают себя здоровыми. Настолько здоровыми, что они спокойно идут сдавать кровь, как та санитарка в клинике. И если они заразились, условно говоря, вчера, то в ближайшие три месяца — так называемый период "серонегативного окна" — у них нельзя обнаружить вирус стандартными методами. Это увеличивает риски в донорстве крови и органов, и несмотря на то, что сегодня вкладываются огромные средства в меры безопасности, полностью исключить риск невозможно. И чем больше скрытых источников, тем больше вероятность инфицирования.

Пациенты часто не подозревают о своем положительном ВИЧ-статусе, и поэтому спокойно сдают зараженную кровь.
Реальное количество носителей инфекции — неизвестно
О числе скрытых источников можно судить по тому, что в одной только Свердловской области ежегодно выявляется от 60 до 100 ВИЧ-инфицированных доноров. Если выясняется, что они сдают кровь не в первый раз, начинается поиск тех, кто получал кровь от них.
Группу риска сейчас не определить четко. К примеру, в Свердловской области было введено обследование мужей беременных. В результате, у здоровых женщин за 2014 и 2015 годы было обнаружено более 200 половых партнеров с ВИЧ, чудом не успевших инфицировать их до и во время беременности.
Кстати. Пять миллионов рублей — это, пожалуй, самая крупная компенсация, которую будет выплачивать больница за инфицирование пациента ВИЧ. Так, к примеру, пока не удается добиться приличной компенсации для ребенка, которого инфицировали в перинатальном центре Московской области сразу и ВИЧ, и гепатитом С.
Читайте также:

