При вич атипичные клетки
Обновлено: 24.04.2024
Коварство ВИЧ и последствий инфицирования им – это не более чем беспечность самих людей. Да, действительно, ВИЧ-инфекция является серьезным заболеванием. На сегодняшний день против нее нет вакцины и она неизлечима полностью. Но при своевременной диагностике и последующей ВААРТ (высокоактивная антиретровирусная терапия), продолжительность жизни ВИЧ-положительных пациентов ничем не отличается от среднестатистических показателей. Принимаемые на протяжении всей жизни препараты, тормозят развитие ВИЧ-инфекции и люди доживают до глубокой старости – 70 – 80 лет. Соблюдая рекомендации специалистов, они ведут обычный образ жизни – работают, вступают в брак, путешествуют и даже имеют здоровых детей. Главное – вовремя распознать первые признаки заболевания и обратиться за помощью.
Первые признаки ВИЧ-инфекции
Самолечение – плохая привычка. При недомогании мы сами себе ставим диагноз, назначаем лекарства, тем самым игнорируя симптомы на ранних сроках ВИЧ-инфекции. А в это время вирус уже активно атакует клетки нашей иммунной системы и разрушает ее. На прогрессирование процесса указывают следующие признаки.
- Увеличение лимфатических узлов – на шее, в паху, в области подмышек.
- Кандидоз (молочница), в том числе и в полости рта.
- Ночная потливость.
- Длительная диарея.
- Беспричинная тошнота и рвота.
- Резкое снижение массы тела.
- Лихорадка.
- Кожные высыпания.
Очень часто первые симптомы ВИЧ-инфекции напоминают ОРВИ и грипп. Пациента лихорадит, он испытывает мышечные и головные боли. У него ломит суставы, воспаляется слизистая рта и глотки. Но в скором времени все неприятные симптомы самостоятельно проходят и наступает следующая стадия ВИЧ-инфекции, когда заболевание ничем себя не выдает.
Стадии ВИЧ-инфекции
ВИЧ – это вирус иммунодефицита человека. Проникая в организм, он поражает клетки иммунной системы, что вызывает развитие ВИЧ-инфекции – медленно прогрессирующее заболевание. Без адекватного лечения оно переходит в СПИД – синдром приобретенного иммунного дефицита. Четкое разграничение этих понятий, помогает понять, что происходит с организмом человека на каждой из стадий заболевания.
Развитие заболевания: от инфицирования до СПИД
Вирус иммунодефицита человека относят к семейству ретровирусов. По своей сути это вирион – частица, состоящая из оболочки и белково-нуклеинового комплекса. Вне клетки-хозяина она не проявляет никаких признаков биологической активности. Но как только вирион ВИЧ присоединяется к живой клетке иммунитета (Т-лимфоциту), он сливается с ней и передает ей свою генетическую информацию. Инфицированная таким образом клетка иммунитета не способна выполнять свои функции и является благоприятной средой для репликации вирионов – ВИЧ начинает создавать собственные копии. Новые вирусные частицы отпочковываются, попадают в кровяное русло и находят для себя новую клетку-хозяина. Старая клетка-носитель вируса погибает, а под прицел попадают новые Т-лимфоциты. И так до бесконечности! Пока иммунная система не будет полностью разрушена. За это время организм человека проходит все стадии развития заболевания.
- ВИЧ попадает в организм – инфицирование вирусом.
- Вирионы начинают атаковать Т-лимфоциты – инкубационный период.
- Количество реплицируемых вирионов резко возрастает – острая фаза.
- Скорость размножения ВИЧ уравновешена иммунным ответом организма – латентная стадия, на которой симптомы отсутствуют.
- Количество репликаций растет, а количество здоровых Т-лимфоцитов неуклонно снижается – иммунная система не выполняет своих функций и развивается СПИД.
Таким образом, инфицирование и ВИЧ-инфекция не смертельны для человека. Проведение антиретровирусной терапии (ВААРТ) позволяет подавлять активность вируса, сдерживая прогрессирование заболевание. По сути, пациент постоянно пребывает в латентной стадии и ведет привычный образ жизни.
Сколько живут с ВИЧ?
В данном случае все зависит от трех важных факторов – сроки постановки диагноза, проводимое лечение и общее состояние здоровья пациента. В статистике ВИЧ-инфекции и СПИД приводятся следующие цифры.
- Своевременная постановка диагноза и последующая ВААРТ – продолжительность жизни составляет 20-50 лет.
- Выявление ВИЧ-инфекции на поздних стадиях и последующая ВААРТ – 10-40 лет.
- Не выявленная инфекция без лечения – 9-11 лет.
- СПИД без лечения – 6-9 месяцев.
Не менее важным фактором, влияющим на продолжительность жизни ВИЧ-инфицированных пациентов, является общее состояние здоровья и иммунитета. Естественно, люди с крепким иммунитетом, которые не имеют хронических заболеваний и врожденных патологий, будут жить дольше. В то время как, ослабленный организм хуже противостоит вирусу. Поэтому помимо ВААРТ, всем ВИЧ-положительным пациентам рекомендован здоровый образ жизни и правильное питание. Они должны беречь себя от инфекционных и простудных заболеваний. Укреплять иммунитет, заботиться о своем организме и проходить регулярное обследование.
Как проверить свой организм на наличие ВИЧ?
Для этого необходимо узнать свой ВИЧ-статус. Для его определения проводятся косвенные и прямые тесты, позволяющие обнаружить антитела к ВИЧ и собственно сам вирус. Для проведения тестов необходимо сдать кровь на анализ ВИЧ. Сделать это можно анонимно!
Через сколько можно проводить тест, если был риск заражения?
Сдать кровь на анализ можно спустя 2-3 недели после факта возможного заражения. Однако необходимо учесть, что в силу индивидуальных особенностей иммунной системы того или иного человека, результат теста может быть недостоверным, поскольку количество антител к ВИЧ еще будет слишком мало для точной диагностики заболевания.
Через сколько проявляется в крови точно ВИЧ-инфекция?
Для получения достоверного результата теста, необходимо чтобы прошло не менее 3 месяцев с момента инфицирования. В редких случаях появление характерных к ВИЧ антител занимает больше времени – 4-6 месяцев.
Если через 3 месяца результат отрицательный, обязательно ли делать повторный тест?
Если был получен отрицательный результат, но вы уверены в факте инфицирования, то тест лучше повторить через 6 месяцев.
Что делать, если тест на ВИЧ дал положительный результат?
- Во-первых, не паниковать.
- Во-вторых, обратиться за помощью к специалистам.
- В-третьих, проходить ВААРТ.
- В-четвертых, беречь иммунитет и соблюдать все рекомендации лечащего врача.
Важно понимать! Обнаружение ВИЧ-инфекции – это не конец жизни. Это ее принципиально новый этап, на котором необходимо пересмотреть свой привычный образ жизни и приложить все усилия к тому, чтобы сдерживать прогрессирование заболевания.

1. Корнилова З.Х., Луконина И.В., Алексеева Л.П. Туберкулез в сочетании с ВИЧ-инфекцией // Туб. 2010. №3. С.3-9.
2. Оттен Т.Ф. Микобактериоз у больных с ВИЧ-инфекцией / В кн.: Беляков Н.А., Рахманова А.Г.(ред.). Вирус иммунодефицита человека-медицина. Гл.10.2. СПб.: Балтийский медицинский образовательный центр, 2011. С.199-224.
4. Adjemian J., Prevots D. R., Gallagher J. et al. Lack of adherence to evidence based treatment guidelines for nontuberculous mycobacterial lung disease. Ann. Am. Thorac. Soc. 2014. V. 11, № 1. Р. 9-16.
5. Andréjak C., Nielsen R., Thomsen V. et al. Chronic respiratory disease, inhaled corticosteroids and risk of non-tuberculous mycobacteriosis. Thorax. 2013. V. 68, № 3. Р. 256-262.
6. Brode S.K., Daley C.L., Marras T.K. The epidemiologic relationship between tuberculosis and non-tuberculous mycobacterial disease: a systematic review. Int. J. Tuberc. lung Dis. 2014. V. 18, № 11. Р. 1370-1377.
7. Daley C. L., Griffith D. E. Pulmonary non-tuberculous mycobacterial infections. Int. J. Tuberc. Lung. Dis. 2010. V. 14, № 6. Р. 665-671.
8. Griffith D. E., Aksamit T., Brown-Elliott B. A. et al. An official ATS/ IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am. J. Respir. Crit. Care Med. 2007. V. 175, № 4. Р. 367-416.
К клиническим и рентгенологическим критериям для постановки диагноза микобактериоза согласно рекомендациям относятся: имеющиеся респираторные симптомы; обнаружение при рентгенографическом исследовании в легких очаговых или полостных изменений или наличие при компьютерной томографии множественных бронхоэктазов с мелкими очагами, при этом должна быть проведена дифференциальная диагностика в целях исключения других заболеваний, имеющих сходную рентгенологическую картину.
К микробиологическим критериям микобактериоза относятся:
– наличие в двух и более независимо взятых образцах мокроты нетуберкулезных микобактерий;
– не менее одного положительного результата культурального исследования материала, полученного при проведении бронхоскопии (бронхоальвеолярный лаваж [БАЛ] или промывные воды бронхов);
– морфологические изменения в тканях и органах (наличие гранулематозного воспаления или обнаружение кислотоустойчивых бактерий) и наличие роста культуры НТМБ этой ткани или не менее из одного образца БАЛ / промывных вод бронхов или мокроты,
или все вышеперечисленные критерии. В настоящее время этот вопрос является дискуссионным и широко обсуждается.
Цель исследования – изучить особенности клинических проявлений и диагностики микобактериозов у лиц, живущих с ВИЧ-инфекцией.
Результаты исследования и их обсуждение
Клиническое наблюдение 1
Пациентка Ш. (35 лет). Туберкулезом раньше не болела. Наблюдалась в Центре по борьбе со СПИД в течение 10 лет (4В стадия), получала антиретровирусную терапию. В июле 2018 г. перенесла пневмоцистную пневмонию, лечилась в стационаре, выписана с улучшением. В начале ноября состояние вновь ухудшилось, госпитализирована в стационар Центра по борьбе со СПИД. При обследовании на рентгенограмме легких выявлена патология, в мокроте обнаружены кислотоустойчивые микобактерии (КУМ), в связи с чем переведена в противотуберкулезный диспансер (ПТД) для исключения туберкулеза.
При поступлении в ПТД 22.11.2018 жалобы на кашель со слизистой мокротой до 50 мл в сутки, одышку при незначительной физической нагрузке, слабость, повышение температуры тела до 37оС, похудение на 4 кг за последний месяц. Общее состояние средней тяжести, пониженного питания, кожные покровы бледные. Дыхание жесткое с бронхиальным оттенком, гудящие хрипы в нижних отделах легких. ЧДД 24 в минуту. АД 90/55 мм рт. ст. Печень выступает на 7 см из-под подреберья.
Общий анализ крови: гемоглобин – 75 г/л; эритроциты – 2,9х1012/л; цветной показатель – 0,75; лейкоциты – 15,4х109/л; эозинофилы – 1; палочкоядерные – 16; сегментоядерные – 74; лимфоциты – 3; моноциты – 6; СОЭ – 57 мм/ч.
Общий анализ мочи: удельный вес – 1024; белок – 0,3; эритроциты – 1–2; лейкоциты – 5–6; цилиндры – 3–4.
Количество СD4+ лимфоцитов – 42 клетки/мкл.
В мокроте методом люминесцентной микроскопии выявлены кислотоустойчивые микобактерии КУМ (+) от 21.11.2018, 23.11.2018, 27.11.2018.
В мокроте методом ПЦР РВ от 26.11.2010 ДНК МБТ не выявлены; ПЦР Дженэксперт от 23.11.2018 ДНК МБТ не выявлены.
В мокроте посевом (BACTEC) от 23.11.2018, 26.11.2018 НТМБ(+). Иммунохроматографический тест на микобактерии туберкулеза TBAgMRT64 Rapid – отрицательный. Реакция на Диаскинтест отрицательная.
УЗИ органов брюшной полости: УЗ-признаки гепатоспленомегалии, диффузных изменений печени и поджелудочной железы.
Фибробронхоскопия: слева бронхи без особенностей. В просвете среднедолевого бронха (СДБ) справа густая слизисто-гнойная мокрота. По задней стенке СДБ с переходом на латеральную изъязвление, дно которого покрыто густыми массами белого цвета. Вокруг слизистая отечна, гиперемирована. Множество бугорков. За счет этих изменений БС4 сужено почти наполовину. Выше слизистая незначительно отечна. Шпора СДБ острая.
Гистологическое исследование биопсийного материала: в биоптате мелкие кусочки некротического детрита и фрагменты неспецифической грануляционной ткани с диффузной лимфоцитарной и нейтрофильной инфильтрацией, обилие мелких кровеносных сосудов.
При окраске по Цилю–Нильсену КУМ не определяются.
Заключение: морфологическая картина неспецифического воспаления.
На обзорной рентгенограмме органов грудной клетки в прямой и правой боковой проекции определяются массивное неоднородное инфильтративное затенение в средней доле правого легкого с четкой границей по междолевой борозде, неоднородное инфильтративное затенение в проекции 9-го сегмента левого легкого. Корни расширены. Тень средостения смещена влево (рис. 1, 2).
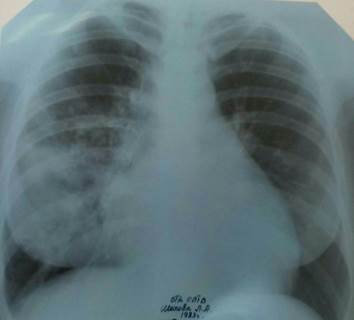
Рис. 1. Обзорная рентгенограмма органов грудной клетки в прямой проекции больной Ш.

Рис. 2. Обзорная рентгенограмма органов грудной клетки в правой боковой проекции больной Ш.
Мультиспиральная компьютерная томография органов грудной полости: в верхних и средних долях правого легкого массивная инфильтрация, участки консолидации в S8 нижней доли. Множественные полиморфные очаги по всем полям, больше справа. Часть из них с деструкцией. Лимфатические узлы гиперплазированы до 12–14 мм. Сердце обычных размеров, в перикарде жидкость, толщина слоя 12 мм. Дегенеративные изменения позвоночника. Костно-деструктивных изменений не выявлено.
Таким образом, у больной были типичные клинические проявления микобактериоза: кашель, одышка, лихорадка, потеря веса, анемия. Имелись рентгенологические изменения в легких в виде фокусов и очагов и поражение внутригрудных лимфатических узлов. Диагноз верифицирован бактериологическим методом исследования мокроты (рост НТМБ в двух анализах мокроты методом ВАСТЕК).
Клиническое наблюдение 2
Пациентка М., 32 года. Из анамнеза известно, что туберкулезом раньше не болела, наблюдается в Центре по борьбе со СПИД с 2008 г. (4В стадия), получает автиретровирусную терапию (АРВТ). В августе 2018 г. перенесла менингоэнцефалит. Состояние ухудшилось в октябре 2018 г., когда стали беспокоить кашель, общая слабость, плохой аппетит. Была госпитализирована в стационар. В легких при рентгенологическом исследовании выявлена патология. Больной была назначена антибактериальная терапия. При исследовании мокроты получили КУМ(+) методом люминесцентной микроскопии. Для исключения туберкулеза пациентка направлена в противотуберкулезный диспансер.
При поступлении в противотуберкулезный диспансер: состояние относительно удовлетворительное. Кожные покровы чистые, бледные. В легких дыхание аускультативно жесткое, хрипы не выслушиваются. ЧДД – 18 в минуту. Тоны сердца ритмичные ЧСС – 78 ударов в минуту, АД 100/65 мм рт. ст. Язык влажный, с белым налетом. Живот мягкий, безболезненный.
Общий анализ крови от 28.11.2018: гемоглобин – 130 г/л; эритроциты – 3,8х10/л; цветной показатель – 1,0; лейкоциты – 8,5х109/л; эозинофилы – 2%; палочкоядерные – 3%; сегментоядерные – 76%; лимфоциты – 8%; моноциты – 11%; СОЭ – 33 мм/ч.
Общий анализ мочи от 28.11.2018: уд. вес – 1020; белок – 0,19 г/л; лейкоциты – 1–3 в поле зрения.
Количество СD4+ лимфоцитов 101 клетка/мкл от 27.11.2018.
В мокроте КУМ (+) от 28.11.2018, 05.12.2018, 06.12.2018, 14.12.2018, 18.12.2018 методом люминесцентной микроскопии.
В мокроте методом ПЦР-РВ от 04.12.2018, 20.12.2018 ДНК МБТ не выявлены.
ПЦР Дженэксперт от 03.12.2018 ДНК МБТ не выявлены.
В мокроте посевом (BACTEC) от 05.12.2018, 06.12.2018 НТМБ(+). Иммунохроматографический тест на МБТ TBAgMRT64 Rapid – отрицательный.
Реакция на Диаскинтест – отрицательная.
Фибробронхоскопия № 1: слева устье нижнедолевого бронха сужено до почти щелевидного за счет бугристой опухоли с густым налетом некроза белого цвета.
Биопсия № 1: в собственном слое слизистой обилие мелких кровеносных сосудов и диффузная воспалительная инфильтрация лимфоидного и нейтрофильного характера, на фоне которого определяются мелкие нечеткие эпителиоидно-клеточные гранулемы. При окраске по Цилю–Нильсену КУМ не определяются.
Фибробронхоскопия № 2: устье верхнедолевого бронха справа полностью стенозировано бугристой опухолью с густым налетом фибрина белого цвета.
Биопсия № 2: в биоптате – мелкие фрагменты слизистой, местами покрытые многослойным плоским эпителием, местами – слоем некротического детрита. В слизистой – диффузная нейтрофильная и лимфоцитарная инфильтрация, на фоне которой местами определяются нечеткие мелкие эпителиоидно-клеточные гранулемы. В центре некоторых гранулем – скопление ядерного детрита. При окраске по Цилю–Нильсену КУМ не обнаружены.
МСКТ ОГК: в верхней доле S1, S2 справа и нижней доле S6 и базальной пирамиде левого легкого определяются очаговые изменения, деструкция четко не видна. Гиперплазированы бронхопульмональные лимфатические узлы. Средостение структурно не смещено.
В представленном случае клинические проявления микобактериоза (кашель, общая слабость, потеря веса) были мало выраженными. Это можно объяснить количеством СД4+ лимфоцитов (101 кл/мкл). Диагноз микобактериоза поставлен своевременно благодаря бактериоскопическому исследованию мокроты больной, консультации фтизиатра и комплексу обследований в противотуберкулезном диспансере.
1. В настоящее время наблюдается рост заболеваемости микобактериозами у лиц, живущих с ВИЧ-инфекцией. Для своевременного выявления микобактериозов у врачей различных специальностей должна быть настороженность.
2. Диагноз микобактериоза следует устанавливать на основании комплексного клинико-рентгенологического и микробиологического обследования. Главными критериями при постановке данного диагноза должны быть выделение культуры НТМБ и гистологическая верификация.
Актуальность. Рак шейки матки (РШМ) представляет собой одну из наиболее частых злокачественных опухолей̆ женской репродуктивной системы. Среди онкологических заболеваний у молодых женщин рак шейки матки имеет самые высокие показатели смертности. Источником раковой опухоли шейки матки служат нормальные клетки, покрывающие шейку матки. Ежегодно эту опухоль выявляют более чем у 600 тысяч пациенток [6]. Вирус иммунодефицита человека (ВИЧ) вызывает синдром приобретенного иммунодефицита (СПИД) и является одним из факторов риска развития плоскоклеточного интраэпителиального поражения или squamous intraepithelial lesion (SIL), возникающего в результате нарушения иммунного контроля. С течением времени SIL переходит в инвазивный рак шейки матки.
Цель работы. Изучить особенности возникновения, течения, диагностики, лечения рака шейки матки у ВИЧ- инфицированных женщин.
Задачи исследования. Установить взаимосвязь прогрессирования рака шейки матки у женщин с ВИЧ-положительным статусом.
Материалы и методы. По классификации выделяют LSIL, или Low grade SIL, или легкая степень и HSIL, или Hight grade SIL, или тяжелая степень. SIL должна своевременно лечиться (путем удаления или уничтожения внешних слоев клеток шейки
матки), чтобы не дать ей перерасти в инвазивный рак.
У ВИЧ инфицированных женщин переход SIL в рак шейки матки происходит намного быстрее, чем у здоровых женщин, вследствие поражения иммунной системы. ВИЧ поражает клетки крови человека, имеющие на своей поверхности CD4-рецепторы, а именно: Т-лимфоциты, макрофаги и дендритные клетки. Инфицированные Т-лимфоциты гибнут из-за разрушения вирусом, апоптоза и уничтожения цитотоксическими Т-лимфоцитами. Если число CD4+ T-лимфоцитов становится ниже 200 в одном микролитре крови, система клеточного иммунитета перестает защищать организм [3]. Исследования показали, что нелеченая неоплазия шейки матки с большей вероятностью переходит в инвазивный рак у ВИЧ-инфицированных женщин, чем у здоровых [4, 5].
При жидкостной цитологии забор материала проводится цитощетками, которые предназначены для взятия биологического материала с поверхности шейки матки и из цервикального канала для цитологических и бактериологических исследований, при этом образец не сразу переносится на стекло, а цитощетка с собранным материалом погружается в специальный раствор и затем с помощью прибора готовится образец для исследования. Цитощетка удобна в применении, атравматична для взятия материала. При необходимости рабочая часть может быть согнута под любым углом по отношению к рукоятке. Это позволяет адаптировать инструмент в зависимости от анатомических особенностей зоны, с которой выполняется забор материала.
Терапия требует чёткого соблюдения графика приёма. Недопустимо пропускать приемы препаратов, как и принимать уменьшенные или увеличенные дозы в случае пропуска.
Появление и развитие рака шейки матки — это многоступенчатый процесс. Этапы развития рака шейки матки представлены следующим образом: нормальный эпителий шейки матки => дисплазия эпителия (легкая, умеренная, тяжелая) => внутриэпителиальный рак (или рак 0 стадии, неинвазивный рак) => микроинвазивный рак => инвазивный рак. Самыми ранними проявлениями могут быть водянистые обильные выделения, кровянистые выделения, которые у женщин детородного возраста не связаны с менструациями, а у женщин в постменопаузе наблюдаются постоянно или периодически, выделения могут иметь неприятный запах. Выделение мочи и кала через влагалище свидетельство мочевлагалищных и прямокишечно-влагалищных свищей. При IV стадии появляются метастатические паховые и надключичные лимфоузлы.
Рак шейки матки делят на четыре стадии (I, II, III и IV), каждая из стадий делится на две подстадии (A и B), а каждая из подстадий IA и IB еще на две — IA1, IA2 и IB1, IB2. Выбор метода лечения рака шейки матки зависит от стадии заболевания. Хирургическое лечение используют при стадиях IA1, IA2, IB и реже IIA. Объем операции зависит от глубины инвазии, наличии метастазов в тазовых и парааортальных лимфоузлах. При стадии IA1 возможно выполнение конизации шейки матки (клиновидная биопсия, конусовидная эксцизия — ампутация конусовидного участка шейки матки, которая состоит в удалении части шейки матки в виде конуса) или простой экстирпации матки с придатками: трубами и яичниками. При стадиях IA2, IB1, IB2 и IIA показана радикальная экстирпация матки с удалением тазовых, а иногда и парааортальных лимфоузлов. Во время этой операции кроме матки с придатками и лимфоузлов удаляют еще и верхнюю треть влагалища, а также части связок матки и жировую клетчатку параметрия и клетчатку, окружающую шейку матки. При обнаружении метастазов в лимфоузлах, лечение после операции дополняют лучевой или одновременной химиолучевой терапией. Обычно комбинированное лечение (операция+лучевая терапия) проводят при стадиях IB и IIA. Иногда при инвазивном раке шейки матки (стадии IA2, IB1) выполняют сложную радикальную операцию, которая позволяет сохранить детородную функцию, под названием трахелэктомия. Во время операции удаляют только пораженную раком ткань шейки матки и окружающие лимфатические узлы [4]. Эффективность хирургического лечения и лучевой терапии при ранних стадиях инвазивного рака шейки матки практически одинаковая, лучевая терапия используется в виде дистанционной гамматерапии и брахитерапии. Длительность сочетанной лучевой терапии (дистанционной и брахитерапии) не должна превышать 55 дней. При стадиях IB2–IV стандартным лечением во всем мире признана одновременная химиолучевая терапия (раньше при этих стадиях проводили только лучевую терапию). При IVB стадии возможно применение только химиотерапию. Однако, женщины больные СПИДом и раком шейки матки одновременно, вылечиваются от рака не так успешно, как ВИЧ-отрицательные пациентки [5, 6].
Результаты исследования. Таким образом, в связи с большой вероятностью возникновения рака шейки матки у ВИЧ-инфицированных женщин и с целью раннего его выявления, им необходимо сделать ПАП-мазок, при отсутствии выявления атипичных клеток, необходимо повторить исследование через полгода, а затем, при отрицательных результатах, 1 раз в год. При обнаружении в ПАП-мазке всех видов SIL выполняется кольпоскопия с прицельной биопсией изменённых участков слизистой матки. Это позволяет не только выявить рак шейки матки на начальных стадиях, но также предупредить его развитие, путём диагностирования предопухолевых изменений эпителия шейки матки, лечение которых не позволяет развиться опухоли.
Выводы. СПИД-ассоциированный рак шейки матки развивается более стремительно, чем рак шейки матки ВИЧ-отрицательных женщин и приводит к многочисленным осложнениям. У женщин с положительным ВИЧ статусом предопухолевое состояние шейки матки с большей̆ вероятностью переходит в инвазивный рак, чем у ВИЧ-отрицательных женщин. Женщины, больные СПИД и ВИЧ-инфицированные женщины, должны находиться под постоянным наблюдением системой здравоохранения, так как имеют более высокий риск развития рака шейки матки.
Список литературы
1. У В.Н. Ошибки в лечении дисплазии шейки матки / В.Н. Беляковский // Иммунопатология, аллергология, инфектология. – 2008. – №1. – С. 83-87.
2. Биджиева Б.А. Генетическая нестабильность и аллельный полиморфизм у больных с дисплазиями и раком шейки матки, вызванными персистенцией ДНК вируса папилломы человека / Б.А. Биджиева. – М.: МИА, 2008. – 34 с.
3. Красногольский В.И. Патология влагалища и шейки матки / В.И. Красногольский. – М.: Медицина, 2007. – 172 с.
4. Прилепская В.Н., Роговская С.И., Межевитинова С.А. Кольпоскопия: практическое руководство / В.Н. Прилепская, С.И. Роговская, С.А. Межевитинова. – М.: МИА, 2001. – 100 с.
5. Садовникова В.Н., Вартапетова Н.В., Карпушкина A.B. Эпидемиологическая характеристика ВИЧ-инфекции у женщин / В.Н. Садовникова, Н.В. Вартапетова, А.В. Карпушкина // Эпидемиология и вакцинопрофилактика. – 2011. – №6. – С. 4-10.
6. Трушина О.И., Новикова Е.Г. Роль папилломавирусной инфекции в генезе рака шейки матки / О.И. Трушина, Е.Г. Новикова // Российский онкологический журнал. – 2009. – №1. – С. 45- 51.
Вирусная нагрузка – важный показатель состояния организма ВИЧ-положительного пациента. Она рассчитывается путем подсчета количества копий РНК ВИЧ (вирусных частиц) в 1 миллилитре плазмы крови. Полученные показатели указывают на степень тяжести вирусной инфекции. Благодаря им можно оценить эффективность проводимой ВААРТ, и прогнозировать дальнейшее развитие заболевания. Для создания более полной картины болезни, анализ на вирусную нагрузку проводится вместе с тестом на уровень CD4-лимфоцитов – антигены иммунной системы, отображающие ее состояние.
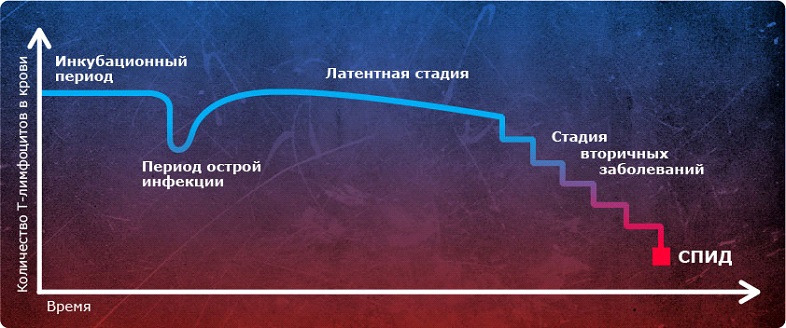
Без приёма терапии со временем снижается уровень СД4 клеток.
Как можно узнать уровень вирусной нагрузки на организм?
По сути, вирусная нагрузка отображает количество ВИЧ в крови. В то время как количество CD4 клеток демонстрирует состояние иммунной системы. Регулярный мониторинг этих двух показателей позволяет своевременно принимать решения – назначать ВААРТ и корректировать лечение, тем самым сдерживая прогрессирование ВИЧ-инфекции.
Анализ на вирусную нагрузку необходимо делать в следующих случаях.
- При подозрении на ВИЧ-инфекцию.
- При постановке диагноза ВИЧ.
- До начала антиретровирусной терапии – каждые 3-6-12 месяцев.
- Через 1 и 3 месяца после начала ВААРТ и далее каждые 3-4 месяца в ходе ее проведения.
Именно оценивая динамику вирусной нагрузки, лечащий инфекционист может сделать заключение об эффективности лечения и при необходимости корректировать ВААРТ.
Для определения вирусной нагрузки проводятся лабораторные исследования, с применением одного из нижеследующих методов.
- ПЦР (полимеразная цепная реакция) – обнаруживает вирус, начиная с 20 - 40 копий в 1 мл крови.
- Метод разветвленной ДНК – менее чувствительный и обнаруживает большое количество копий.
- NASBA (метод транскрипционной амплификации) – очень чувствительная методика, способная увеличивать белки вируса, для того чтобы определить его количество. Однако в России NASBA пока не получил широкое распространение.
Принципиальное различие методов и степень их чувствительности могут стать причиной недостоверного результата. Поэтому специалисты рекомендуют для определения вирусной нагрузки выбрать какой-нибудь один метод и использовать его на постоянной основе.
Расшифровка результатов исследований на ВИЧ
Полученные в ходе исследования вирусной нагрузки результаты расшифровываются следующим образом.
- До 10 000 копий вируса – низкая вирусная нагрузка.
- Свыше 100 000 копий – высокая вирусная нагрузка.
- 0 копий – вируса в организме нет, что считается нормой для здорового человека и указывает на необходимость повторного исследования для ВИЧ-инфицированных пациентов.
Неопределяемая вирусная нагрузка – минимальное количество копий, наличие которых невозможно зафиксировать с помощью выбранного метода исследования.
Таким образом, неопределяемая вирусная нагрузка – это показатель, к которому стремятся все ВИЧ-инфицированные пациенты. Такой результат указывает на то, что вирус в организме есть, но его количество ничтожно мало и на данный момент человеку ничего не угрожает. Одна при этом обязательно необходимо оценить общее состояние иммунной системы. Для этого нужно определить количество CD4+антигенов Т-лимфоцитов. Норма клеток и возможные отклонения приведены в нижеследующей таблице.
| Количество CD4 | Возможные действия пациента |
|---|---|
| 1500 – 500 кл/мл | норма |
| 500 - 350 кл/мл | необходимо начать ВААРТ |
| 200 кл/мл и ниже | проводят ВААРТ |
| Менее 100 кл/мл | проводят ВААРТ и симптоматическую терапию |
Оценивая показатели вирусной нагрузки и CD4 можно сделать достоверное заключение о состоянии здоровья пациента. Если зафиксирована низкая вирусная нагрузка, например, 4000 копий и показатели CD4 в норме, то ВААРТ эффективна. И наоборот – высокая вирусная нагрузка при снижении показателей CD4 свидетельствуют о низкой эффективности лечения.
Как уменьшить вирусную нагрузку?
Тест на вирусную нагрузку отражает степень тяжести ВИЧ-инфекции и состояние организма. Естественно, что столкнувшись с высокими показателями нагрузки, пациенты стремятся ее снизить. Нередко для этой цели они прибегают к альтернативным методам лечения. Но проблема в том, что единственный способ снизить вирусную нагрузку – это эффективная ВААРТ. Иммуностимуляторы, иммуномодуляторы, витаминные комплексы, отвары трав и прочие средства, не оказывают никакого влияния на развитие ВИЧ-инфекции. Снизить нагрузку можно только с помощью антиретровирусной терапии.
Преимущества неопределяемой низкой нагрузки
Низкая или неопределяемая вирусная нагрузка желательна по нескольким причинам.
- Минимальный риск прогрессирования инфекции.
- Минимальный риск развития резистентности к препаратам ВААРТ.
- Минимальный риск передачи инфекции во время незащищенного полового контакта.
- Максимальный шанс родить здорового ребенка (для женщин).
Категории МКБ: Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде других состояний (B23), Болезнь, вызванная вирусом иммунодефицита человека [вич], неуточненная (B24), Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде других уточненных болезней (B22), Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде злокачественных новообразований (B21), Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде инфекционных и паразитарных болезней (B20), Острый ВИЧ-инфекционный синдром (B23.0)
Общая информация
Краткое описание
ВИЧ-инфекция - инфекционная болезнь, развивающаяся в результате многолетнего персистирования в лимфоцитах, макрофагах и клетках нервной ткани вируса иммунодефицита человека (далее - ВИЧ), характеризующаяся медленно прогрессирующим дефектом иммунной системы, который приводит к гибели больного от вторичных поражений, описанных как синдром приобретенного иммунодефицита (далее - СПИД) [1].
B20 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде инфекционных и паразитарных болезней;
B21 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде злокачественных новообразований;
B22 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде других уточненных болезней;
Пользователи протокола: инфекционисты, терапевты, врачи общей практики, клинической лабораторной диагностики, фтизиатры.
Класс I - польза и эффективность диагностического метода или лечебного воздействия доказана и и/или общепризнаны
Класс III - имеющиеся данные или общее мнение свидетельствует о том, что лечение неполезно/ неэффективно и в некоторых случаях может быть вредным
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
Классификация
• нейтропения (
• хронический герпес (оролабиальный, генитальный или аноректальный длительностью более месяца или висцеральный любой локализации);
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• число лимфоцитов CD4 (абсолютное и процентное содержание) - двукратное измерение с интервалом не менее 7 дней;
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: не проводится.
Заболевание начинается постепенно.
• половые контакты (гетеро- или гомосексуальные; тип контактов: оральный, вагинальный, анальный) с ВИЧ-статус партнерами (если известно);
• патологическое увеличение лимфатических узлов, персистирующая генерализованная лимфоаденопатия.
Ротоглотка: стоматит, язвенно-некротические поражения, разрастание слизистой полости рта, преимущественно боковой поверхности языка.
Мочеполовая система и перианальная область: признаки следующих заболеваний: нефропатия, инфекция, вызванная вирусом папилломы человека (остроконечные кондиломы половых органов и заднего прохода, рак шейки матки).
Неврологический и психический статус: нарушение когнитивных функций (Приложение 1), парезы, симптомы нейропатии, нарушение сознания, менингеальные синдром.
Биохимический анализ крови: повышение уровня креатинина и мочевины в крови, гипонатриемия, гипокалиемия (при развитии ОПП).
• полимеразная цепная реакция РНК ВИЧ: определяемая вирусная нагрузка.
МРТ/КТ головного мозга: отек головного мозга, признаки менингоэнцефалита, дисциркуляторная энцефалопатия, объемные процессы;
• консультация невропатолога: при признаках/подозрении на криптококковый менингит, ВИЧ-энфефалопатию, токсоплазмоз ЦНС, ПМЛ, лимфомы головного мозга, периферической полинейропатии;
• консультация психиатра: при признаках/подозрении психического расстройства. ВИЧ-энцефалопатии/деменции;
Дифференциальный диагноз
Дифференциальный диагноз: проводится с оппортунистическими инфекциями и другими вторичными заболеваниями по результатам консультаций специалистов.
Лечение
Курс лечения АРТ – пожизненный, применяется тройная схема, кратность приема АРВ препаратов зависит от формы выпуска.
• эмтрицитабин (FTC) 200 мг, капсула; 200 мг 1 раз в сутки.
• рилпивирин* (RPV) 25 мг таблетка; 25 мг 1 раз в сутки.
• дарунавир (DRV) 400 мг, 600 мг, 800 мг таблетка; 600 мг 2 раза в сутки в комбинации с ритонавиром в дозе 100 мг 2 раза в сутки;
• типранавир* (TPV) 250 мг капсула; применяется усиленный ритонавиром, 2 раза в сутки 500 мг+200 мг ритонавира.
ИИ с целью: блокирования фермента ВИЧ, участвующий во встраивании провирусной ДНК в геном клетки-мишени.
• долутегравир (DTG) 50 мг таблетка; 50 мг 1 раз в сутки.
• элвитегравир 150 мг/кобицистат 150 мг /эмтрицитабин 200 мг /тенофовир 300 мг* 1 таблетка 1 раз в сутки;
* При регистрации в Республике Казахстан.
В приоритетном порядке АРТ назначается всем пациентам в 3-4 стадии ВИЧ-инфекции или пациентам с количеством CD4+ лимфоцитов ≤ 350 кл/мкл.
− ВИЧ-позитивным лицам в дискордантных парах (для снижения риска трансмиссии ВИЧ неинфицированным партнерам), при условии предварительного консультирования обоих партнеров;
− при подготовке ВИЧ-инфицированного пациента к применению вспомогательных репродуктивных технологий.
Схема АРТ состоит не менее, чем из трех антиретровирусных препаратов. Предпочтение отдается комбинированным препаратам в фиксированных дозировках.
b NVP использовать у лиц с низким числом лимфоцитов CD4 (у женщин с СД4 менее 250/мкл, у мужчин с СД4 менее 400/мкл)
с вместо AZT при умеренной анемии или гранулоцитопении (уровень гемоглобина> 90 г/л или количество нейтрофилов> 1000 клеток/мкл) рекомендуется назначать ABC, или TDF, а при более выраженной анемии или гранулоцитопении – АВС или TDF.
d использование комбинированного препарата фиксированной дозировки DRV/c (при регистрации)
При невозможности использования вышеперечисленных препаратов ddI может быть назначен в качестве НИОТ в комбинации 3TC/FTC +EFV.
• пациенты, получающие противотуберкулезные препараты.
− при количестве CD4+ лимфоцитов от 50 до 250 клеток/мкл и нормальном уровне АЛТ или АСТ – NVP в сочетании с АВС, или TDF, или AZT + 3ТС, или FTC;
− при любом количестве CD4+ лимфоцитов – LPV/r или DRV/r или ATV/r в сочетании с АВС, или TDF, или AZT + 3ТС, или FTC.
Рекомендуемые схемы АРТ: назначается схема из предпочтительных АРВП – 2 НИОТ + 1 ИП/r, или 2НИОТ + 1 ННИОТ, или 2 НИОТ + 1 ИИ.
LPV/r в сочетании с AZT/3TC. В качестве третьего компонента схемы АРТ являются LPV/r в таблетках (400/100 мг 2 раза в сутки).
При непереносимости LPV/r можно использовать (в порядке приоритетности) – DRV/r (600/100 мг 2 раза в сутки), NVP (при CD4 < 250 клеток/мкл и нормальном уровне АЛТ и АСТ). Частота назначения LPV/r и DRV/r – не реже 2 раз в сутки.
При непереносимости LPV/r и DRV/r, можно назначить ATV/r или другие ИП/р. В качестве нуклеозидной основы рекомендуется ZDV/3TC. Применение EFV не рекомендуется в I триместрe беременности.
Для лечения пациентов с низким уровнем CD4+-лимфоцитов рекомендуется применять схемы, включающие бустированный ИП.
В качестве нуклеозидной основы рекомендуется применять комбинацию ABC с 3TC или TDF с 3TC в стандартных дозах (или комбинированный препарат TDF/FTC). Однако у пациентов с ВН более 100 000 копий/мл препараты, содержащие ABC, применять не рекомендуется.
В качестве альтернативы третьим препаратом можно назначить FPV/r из-за минимального влияния на функцию почек либо LPV/r.
ТDF не рекомендуется больным с почечной недостаточностью.
более чем в 2,5 раза выше верхней границы нормы (ВГН) – EFV или RPV (при наличии противопоказаний к приему EFV и при уровне РНК ВИЧ < 100000 копий/мл) в сочетании с TDF+3TC или TDF/FTC;
• при уровне активности АЛТ или АСТ более чем в 2,5 раза выше ВГН – DTG, бустированный RTV ИП (DRV/r или LPV/r) в сочетании с TDF+3TC или TDF/FTC.
При снижении числа CD4+ лимфоцитов менее 500 клеток/мкл рекомендуют начать АРТ одновременно с терапией ХГС.
При количестве CD4+лимфоцитов менее 350 клеток/мкл начинают лечение ВИЧ-инфекции, а затем присоединяют терапию ХГС.
Не рекомендуется сочетание рибавирина с зидовудином (увеличивается частота развития анемии), диданозином (повышается вероятность декомпенсации заболевания печени).
Оптимальным сочетанием НИОТ является TDF + 3TC или FTC в стандартных дозировках. При невозможности применять TDF назначают АВС.
• при нормальном уровне активности АЛТ/АСТ или повышении его не более чем в 2,5 раза выше ВГН – EFV, RPV (при наличии противопоказаний к приему EFV и при уровне РНК ВИЧ < 100000 копий/мл) или DTG (при наличии противопоказаний к приему EFV и при уровне РНК ВИЧ >100000 копий/мл) в сочетании с АВС или TDF + 3TC или TDF/FTC.
• при уровне активности АЛТ/АСТ более чем в 2,5 раза выше ВГН – DTG или бустированный ИП (LPV/r или DRV/r) в сочетании с АВС или TDF + 3TC или TDF/FTC.
У больных при сочетании ВИЧ-инфекции и ХГС, не получающих лечения ХГС, в состав схемы АРТ может быть включено сочетание ZDV+3TC.
Все ЛЖВ с диагностированным туберкулезом нуждаются в лечении ТБ и ВИЧ-инфекции, независимо от числа лимфоцитов CD4.
Первым начинают противотуберкулезное лечение, а затем как можно быстрее (в первые 8 недель лечения) назначают АРТ.
Больным ВИЧ/ТБ, имеющим выраженный иммунодефицит (число лимфоцитов CD4 менее 50 клеток/мкл), необходимо начать АРТ немедленно – в течение первых 2 недель после начала лечения ТБ.
При наличии туберкулезного менингита начало АРТ следует отложить до завершения фазы интенсивной терапии ТБ.
В начале АРТ у больных, получающих противотуберкулезное лечение, предпочтительным ННИОТ является EFV, который назначают вместе с двумя НИОТ.
При отсутствии EFV рекомендована схема лечения - 3TC (или FTC) + ZDV + ABC (или TDF).
В таблице 3 представлены варианты замены антиретровирусных препаратов при развитии нежелательныхэффектов.
Неудача лечения определяется как постоянно выявляемая вирусная нагрузка более 1000 копий/мл по результатам двух последовательных измерений, проведенных с интервалом в 2-4 недели, но не ранее, чем через шесть месяцев после начала использования АРВ-препаратов.
Основные лекарственные средства, имеющие 100% вероятность применения: см пункт Медикаментозное лечение, оказываемое на амбулаторном уровне.
• эмтрицитабин (FTC) 200 мг, капсула;
• рилпивирин* (RPV) 25 мг таблетка;
• дарунавир (DRV) 400 мг, 600 мг, 800 мг таблетка; 600 мг в комбинации с ритонавиром в дозе 100 мг 2 раза в сутки;
• типранавир* (TPV) 250 мг капсула; применяется усиленный ритонавиром, 2 раза в сутки 500 мг+200 мг ритонавира.
• элвитегравир 150 мг/кобицистат 150 мг /эмтрицитабин 200 мг /тенофовир 300 мг* 1 таблетка 1 раз в сутки;
• элвитегравир 150 мг/кобицистат 150 мг* 1 таблетка 1 раз в сутки.
Хирургические вмешательства: нет.
• туберкулеза (при исключении у пациента активного туберкулеза) –однократно изониазид (5 мг/кг), но не более 0,3 г в сутки + пиридоксин (при наличии) в дозе 25 мг/сут не менее 6 месяцев;
• пневмоцистной пневмонии в случае CD4 < 200 клеток/мкл, токсоплазмоза, в случае CD4 < 100 клеток/мкл – котримоксазол (960 мг 3 раза/неделю). Отменить профилактику если у пациента более 3 месяцев количество CD4+ - лимфоцитов стабильно превышает 200 кл/мкл, возобновить при падении количества CD4+ - лимфоцитов
• Диспансерное наблюдение пациентов получающих АРТ осуществляется совместно ПМСП и территориальным центром СПИД с кратностью посещений не менее 1 раза в 3 месяца.
• Вирусная нагрузка определяется перед началом АРТ. В дальнейшем следует измерять ВН первый раз не позднее 3 месяцев, затем 1 раз в 6 месяцев, при достижении неопределяемого уровня ВН.
• В случае отсутствия снижения ВН через 6 месяцев от начала лечения на 1 lоg10 или последовательного двукратного повышения ВН после исходной супрессии, следует провести генотипический тест на определение резистентности ВИЧ к антиретровирусным препаратам.
• Число лимфоцитов CD4 нужно измерять через 3 месяца, затем каждые 6 месяцев, при необходимости чаще в течение 1-го года АРТ, далее не реже 1 раз в год (за исключением случаев неэффективности лечения).
• Лабораторные исследования необходимо проводить не менее одного раза в 6 месяцев.
Таблица 4. Сроки проведения лабораторных исследований
х - лабораторное исследование показано независимо от используемых АРВ-препаратов;
x (АРВ-препарат) - исследование показано пациентам, которые получают указанный в скобках препарат.
b Пациентам с хроническими гепатитами биохимические показатели определяют согласно клиническому протоколу диагностики и лечения хронического вирусного гепатита В и С у взрослых в РК.
Через 3 месяца после начала приема АРВ-препарата клинически проявляющиеся побочные эффекты должны отсутствовать (а также субклинические, которые со временем могут проявиться клинически )
b Вирусная нагрузка уменьшается постепенно: у большинства пациентов (за исключением имеющих изначально высокую вирусную нагрузку) через 24 недели АРТ она должна быть < 50 копий/мл либо демонстрировать выраженную тенденцию снижения до этого уровня.
При расхождении между вирусологическими и иммунологическими показателями, приоритет за вирусологическими.
Число лимфоцитов CD4 необходимо определять каждые 3 месяца, по стабилизации СД4 лимфоцитов на фоне АРТ - 1 раз в 6 месяцев.
Цель АРТ - снижение ВН до неопределяемого уровня (пороговый уровень
При показателях ВН от 200 до 400 коп/мл – развитие резистентности возможно, необходимо усилить работу по соблюдению приверженности к АРТ.
Госпитализация
III степень (тяжелая) - повседневная жизнь существенно нарушена, часто требуется дополнительная помощь близких, медицинская помощь и лечение, возможно в стационаре;
IV степень (крайне тяжелая, жизнеугрожающая) - нормальная повседневная жизнь невозможна, требуется постоянная помощь посторонних, серьезное лечение, чаще всего в стационаре.
Информация
Источники и литература
Информация
5) Трумова Жанна Зиапеденовна – доктор медицинских наук, профессор РГП на ПХВ «Казахский национальный медицинский университет имени С.Д.
Указание условий пересмотра протокола: пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Оценку нарушений познавательной деятельности (когнитивных функций) целесообразно проводить у всех ВИЧ-инфицированных пациентов без отягощающих факторов(тяжелые психиатрические заболевания, злоупотребление психоактивными веществами, в том числе алкоголем, текущие оппортунистические инфекции центральной нервной системы, другие неврологические заболевания) в течение 6 мес. со времени постановки диагноза. Данный подход позволяет точно определить исходные показатели и, соответственно, более точно оценить дальнейшие изменения. Для раннего скрининга когнитивных функций необходимо задать пациенту 3 вопроса (S.Simionietal. AIDS 2009, EACS 2012):
1. Часто ли у Вас бывают случаи потери памяти (например, Вы забываете значительные события, даже самые недавние, назначенные встречи и т.д.)?
Нейропсихологическое обследование должно включать в себя тесты для изучения следующих характеристик познавательной деятельности: слухоречевая и зрительная память, счет, скорость восприятия информации, внимание, , двигательные навыки. (Antinorietal.Neurology, 2007). В случае выявления патологии требуется обследование пациента у невролога, проведение МРТ головного мозга и исследовании спинномозговой жидкости (СМЖ) на вирусную нагрузку и, если есть к тому показания, провести исследование генотипической резистентности к препаратам в двойной пробе СМЖ и плазмы крови. Если у пациента выявлена патология нейрокогнитивных функций на этапе скрининга или при дальнейшем нейропсихологическом обследовании, необходимо рассмотреть возможность включения в схему препаратов, потенциально воздействующих на центральную нервную систему. К ним относятся либо те препараты, проникновение которых в СМЖ было продемонстрировано в исследованиях, проведенных у здоровых ВИЧ-инфицированных пациентов(концентрация выше IC90 у более чем 90% обследуемых пациентов), либо те, для которых доказана краткосрочная (3–6 мес.) эффективность воздействия на когнитивные функции или на снижение ВН на СМЖ, при условии, что оценка проводится в отсутствие каких-либо других совместно принимаемых препаратов или в рамках контролируемых исследований, результаты которых рецензируются экспертами (EACS 2012).
Читайте также:

