Принципы антибиотикотерапии в инфекции
Обновлено: 25.04.2024
Причины устойчивости к антибиотикам. Механизмы
Устойчивость к действию антибиотиков отмечают в случае, когда ранее восприимчивые микроорганизмы теряют свою чувствительность к антибактериальному препарату при использовании клинически безопасной дозы. Это происходит в результате генетических изменений, часто возникающих в быстро делящихся клетках с гаплоидным набором хромосом.
Факторы определяющие устойчивость бактерий к антибиотикам
Трансформация бактерий и утойчивость к антибиотикам. Трансформация — процесс захвата бактериями свободной цепи ДНК и встраивания её в собственный геном.
Например, Streptococcus pneumoniae способен захватывать у близкородственных видов часть генов, кодирующих пенициллинсвязывающие белки (обладают меньшим сродством к лекарственному препарату). При продукции изменёнными генами этих белков чувствительность к действию пенициллина заметно снижается, т.е. бактерии продолжают синтезировать пептидогликан, сохраняя структуру клеточной стенки, даже в присутствии препарата.
Устойчивость к действию бензилпенициллина у Neisseria gonorrhoeae развивается по такому же механизму.
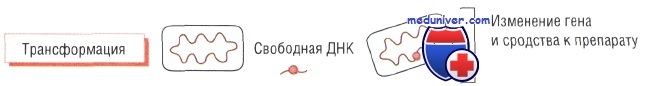
Конъюгация бактерий и утойчивость к антибиотику
Плазмиды — кольцевые структуры ДНК, расположенные в цитоплазме бактерий. Их может быть достаточно много. Именно поэтому при делении клеток одни и те же плазмиды обнаруживают у всех дочерних микроорганизмов. Плазмиды содержат информацию о различных генах бактерии, в том числе о генах, кодирующих метаболические ферменты, и факторах, определяющих вирулентность и устойчивость к действию антибиотиков.
Конъюгация — процесс передачи плазмид от одной бактерии к другой. В этом случае гены, кодирующие устойчивость, быстро распространяются среди бактерий, находящихся в одной среде обитания (например, в кишечнике). Комбинированное воздействие отдельных антибиотиков (например, в госпитальных условиях) приводит к появлению мультирезистентных штаммов.
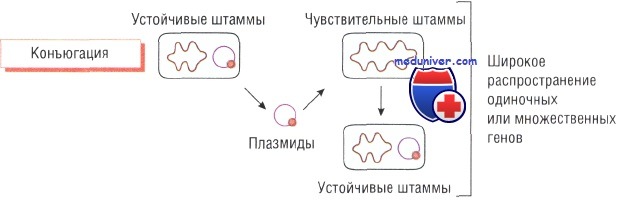
Транспозоны и интегроны бактерий и утойчивость к антибиотику
Транспозоны и интегроны — подвижные гены, способные кодировать транспозицию (внутрихромосомную транслокацию). Они могут перемещаться как между хромосомами и плазмидами, так и между бактериями и содержат большое количество генетической информации (например, антибиотикорезистентность).
Считают, что в основе развития устойчивости к метициллину у Staphylococcus aureus и к тетрациклину у Neisseria gonorrhoeae лежит передача именно этих генетических структур. Интегроны играют важную роль в передаче мультирезистентности у грамположительных микроорганизмов. Кроме того, передачу генов резистентности могут осуществлять бактериофаги.
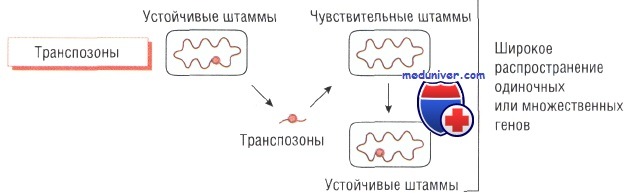
Механизмы возникновения утойчивости к антибиотикам
Изменение структуры антибактериального препарата. Ферментативная инактивация. Наиболее распространённый механизм развития устойчивости к действию антибиотика — спонтанное продуцирование фермента, разрушающего препарат.
Большинство штаммов Staphylococcus aureus продуцирует экстрацеллюлярный фермент бета-лактамазу, которая инактивирует пенициллины, разрушая бета-лактамное кольцо в их структуре. Ферменты, разрушающие пенициллины и цефало-спорины, синтезируют многие микроорганизмы, в том числе Escherichia coli, Haemophilus influenzae и некоторые представители рода Pseudomonas.
Гены, кодирующие эти ферменты, обычно расположены в подвижных генетических элементах (транспозонах) и могут передаваться как между бактериями одного вида, так и между видами. Распространение различных видов бета-лактамаз расширенного спектра (например, CTXm или АтрС) среди представителей семейства энтеробактерий приводит к возникновению устойчивости к эффектам пенициллинов и цефалоспоринов широкого спектра действия и возникновению внутрибольничных инфекций. Кроме того, эти микроорганизмы могут вызывать опасные внебольничные заболевания.
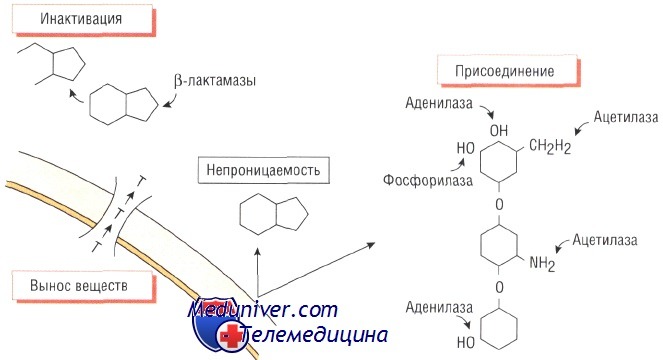
Ферментативное присоединение. Бактерии могут вырабатывать ферменты, способные угнетать активность антибиотиков путём присоединения к последним различных химических групп. Например, устойчивость к действию аминогликозидов возникает в результате присоединения ацетилового, аминового или аденозинового радикала к молекуле препарата.
Влияние такой модификации на эффективность лекарственных средств группы аминогликозидов различно. Так, амикацин наименее восприимчив к этому способу инактивации. Присутствие ферментов, обусловливающих устойчивость к действию аминогликозидов, характерно как для грамположительных (Staphylococcus aureus), так и для грамотрицательных (микроорганизмы рода Pseudomonas) возбудителей.
Непроницаемость клеточной стенки и утойчивость к антибиотику
Устойчивость некоторых бактерий к действию антимикробных средств связана с непроницаемостью их клеточной стенки для молекул препарата. Например, клеточная стенка грамо-трицательных микроорганизмов (особенно рода Pseudomonas) непроницаема для некоторых бета-лактамов.
В то же время аминогликозиды проникают внутрь бактерии посредством кислородозависимой транспортной системы (а потому анаэробы к ним невосприимчивы), в связи с этим анаэробы обладают небольшой чувствительностью к аминогликозидам.
Механизмы выведения веществ из бактериальной клетки и утойчивость к антибиотику
Некоторые бактерии, например Е. coli, становятся невосприимчивыми к действию тетрациклинов, когда приобретают внутримембранный белок, активно выводящий антибиотик из клетки. Устойчивость стрептококков к действию макролидов обусловлена подобным механизмом.
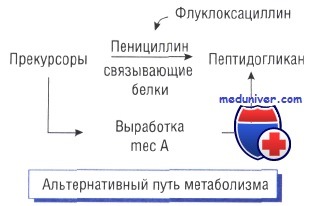
Альтернативные пути метаболизма и утойчивость к антибиотикам
Один из наиболее распространённых механизмов возникновения устойчивости к действию антибактериальных препаратов — развитие альтернативных путей метаболизма, помогающих обходить метаболический блок, вызываемый антибиотиком. Так, Staphylococcus aureus становится невосприимчивым к метициллину или флуклоксациллину, когда у него появляется ген тесА, кодирующий альтернативный пенициллинсвязывающий белок (РВР2), не чувствительный к метициллину.
Несмотря на то что состав бактериальной клеточной стенки изменяется, микроорганизм сохраняет способность к делению. Снижение восприимчивости к бензилпенициллину у Streptococcus pneumoniae также вызвано наличием пенициллинсвязывающих белков.
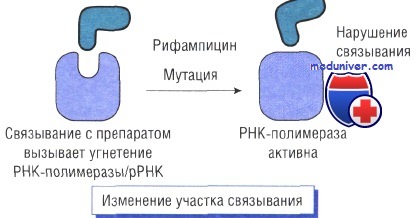
Изменение участка связывания антибиотика
В основе механизма действия рифампицина лежит угнетение бета-субъединицы РНК-полимеразы. Устойчивость возникает при изменении гена РНК-полимеразы в результате точечных мутаций, инсерции или делеции.
При этом новая РНК-полимераза невосприимчива к рифампицину.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В данной статье раскрыты современные представления об инфекции почек и мочевыводящих путей, освещены основные принципы антибактериальной терапии, представлены клинические рекомендации по ведению данной группы пациентов. Представлены альтернативные методы
In this article modern ideas of infection of kidneys and urinary tract are revealed, the basic principles of antibacterial therapy are covered, clinical guidelines on conducting this group of patients are presented. Alternative methods of treatment and prevention are presented.
Инфекционно-воспалительные заболевания почек и мочевыводящих путей в амбулаторной практике занимают второе место по обращаемости после острых респираторных вирусных инфекций, а нозокомиальные инфекции мочевыводящих путей (ИМП) — первое место среди всех видов данных инфекций, что делает эту проблему особенно актуальной [1].
Все ИМП в зависимости от уровня поражения можно классифицировать на следующие формы:
- пиелонефрит — инфекционно-воспалительное заболевание почек с преимущественным поражением слизистой лоханки и чашечек и/или интерстициальной ткани;
- уретрит — воспаление мочеточника;
- цистит — воспаление слизистой оболочки мочевого пузыря;
- простатит — воспаление предстательной железы;
- уретрит — воспаление мочеиспускательного канала;
- фуникулит — воспаление семенного канатика;
- эпидимит — воспаление придатка яичка;
- орхит — воспаление яичка.
В рекомендациях Европейской ассоциации урологов (European Association of Urology, EAU) 2015 [3] представлена новая классификация ИМП:
- неосложненная инфекция нижних мочевыводящих путей: цистит — острый, спорадический или рецидивирующий;
- неосложненная инфекция верхних мочевыводящих путей: пиелонефрит — острый, спорадический, факторы риска не идентифицированы;
- осложненная ИМП с и без пиелонефрита;
- уросепсис;
- уретрит;
- инфекции мужских половых органов: простатит, эпидимит, орхит.
Под неосложненной ИМП (НИМП) понимают эпизод острой ИМП у пациентов в отсутствие у них каких-либо нарушений оттока мочи из почек и мочевого пузыря, структурных изменений в органах мочевыводящей системы и серьезных сопутствующих заболеваний, которые могут утяжелить ее течение или привести к неэффективности проводимой терапии.
Бессимптомная бактериурия (ББ) — это наличие двух последовательных (с промежутком 24 часа) положительных результатов бактериологического исследования мочи (> 100000 КОЕ/мл) у женщин, при которых был выявлен один и тот же штамм возбудителя ИМП при отсутствии клинических проявлений заболевания [2]. ББ может защищать от суперинфекции вирулентными уропатогенами, поэтому ее лечение следует проводить только в случае доказанной пользы для пациента, чтобы избежать риска селекции резистентных микроорганизмов и эрадикации потенциально протективных при ББ штаммов микроорганизмов [4]. Определение и лечение ББ наиболее важно у беременных женщин, так как уменьшает риск развития пиелонефрита, а также перед эндоурологическим вмешательством, когда планируется разрез слизистой оболочки мочевыводящих путей.
Наиболее частым возбудителем НИМП является уропатогенная E. coli, которую выявляют у 75–90% пациентов. Реже возбудителя НИМП могут быть Staphylococcus saprophyticus, Proteus mirabilis, Enterococcus spp., Klebsiella spp. и другие представители семейства Enterobacteriaceae. Первичный уретрит часто вызывают возбудители, передаваемые половым путем: N. gonorrhoeae, C. trahomatis, Mycoplasma genitalium, T. vaginalis, Herpes simplex virus [5].
Вторичный уретрит вызывают госпитальные уропатогенные штаммы микроорганизмов, в связи с чем выбор антимикробных лекарственных средств при вторичном уретрите такой же, как при лечении госпитальной осложненной ИМП.
К преобладающим возбудителям простатита относятся микроорганизмы семейства Enterobacteriaceae, преимущественно E. coli, Enterococcus faecalis, Proteus mirabilis, а также P. aeruginosa. У пациентов с иммунодефицитом простатит может быть вызван Candida albicans, M. tuberculosis.
Осложненная ИМП характеризуется наличием широкого спектра полирезистентных возбудителей (особенно после длительного лечения антибиотиками. Наиболее частыми возбудителя осложненный ИМП являются E. coli, Klebsiella pneumoniae, Klebsiella oxytoca, Proteus mirabilis, Citrobacter spp., Enterobacter spp. и Morganella morganii. При осложенной ИМП часто наблюдается смешанная инфекция, а также смена одного возбудителя другим в процессе проведения антибактериальной терапии, что может быть следствием биопленочной инфекции, которая развивается на катетерах, дренажах, камнях и в слизистых оболочках нижних мочевыводящих путей [1].
Возбудителями катетер-ассоциированной ИМП в 40% случаях являются грамотрицательные микроорганизмы, реже энтерококки, стафилококки и грибы. Из госпитальных штаммов микроорганизмов следует выделить E. coli, P. aeruginosa, Enterobacter agglomerans, Klebsiella spp., Staphylococcus spp., Enterococcus faecalis, Proteus mirabilis.
Важнейшим фактором вирулентности уропатогенных штаммов E. coli и других микроорганизмов семейства Enterobacteriaceae следует считать их способность к адгезии к уротелию с помощью ворсинок 1-го типа (pili), S-ворсинок (pap).
В табл. 1 приведены критерии для диагностики ИМП, в зависимости от лабораторных данных [3].
Антибактериальная терапия (АБТ) — основной метод лечения НИМП. Эффективность данного вида лечения будет зависеть от чувствительности к нему патогенных микроорганизмов и от концентрации лекарственного препарата в очаге воспаления. При проведении АБТ следует учитывать тяжесть заболевания, возможные побочные влияния антибиотиков, а также функциональное состояние почек [1–6].
Терапия ИМП является эмпирической, у больных с НИМП начинается сразу же после постановки диагноза. У больных с наличием обструкции мочевыводящих путей начинается только после ее устранения, так как существует опасность развития бактериотоксического шока вследствие гибели патогенных микроорганизмов и выделения токсинов.
Выбор АБТ должен быть основан на результатах местного или регионального микробиологического наблюдения, в котором отражается перечень возбудителей ИМП и их степень чувствительности или резистентности к АБТ. Кроме того, должны учитываться последние российские рекомендации [1]. Перед началом АБТ необходимо произвести забор материала (мочи, крови) с целью проведения бактериологического исследования.
При тяжелом течении ИМП препаратами первой линии могут являться антибиотики широкого спектра действия, в дальнейшем АБТ должна быть скорригирована с учетом результатов бактериологического исследования мочи.
Оценка эффективности АБТ проводится через 48–72 часа после ее начала. При отсутствии положительной динамики необходимо пересмотреть режим АБТ.
При выборе стартового антибиотика для лечения осложненной ИМП препаратами выбора являются карбапенемы первой группы (эртапенем), в отношении синегнойной палочки — второй группы (имипенем + циластатин, меропенем, дорипенем).
В качестве АБТ при лечении псевдомонадной инфекции эффективны карбапенемы, фторхинолоны и аминогликозиды и их комбинации.
Для лечения ИМП, вызванных Enterobacter spp., Citrobacter freundii, Serratia marcescens, P. vulgaris, P. rettegeri, используется цефепим и карбапенемы.
Срок лечения острого пиелонефрита составляет 10–14 дней, с острым неосложненным пиелонефритом 7–10 дней. Короткий курс лечения АБТ используется для лечения НИМП у пожилых женщин.
В табл. 2 и 3 представлена АБТ при различных формах ИМП. Средствами выбора считаются те препараты, к которым имеется наименьшая резистентность микроорганизмов, вызывающих развитие ИМП. Альтернативная терапия назначается при невозможности использовать препарат выбора.
Для профилактики рецидивов бактериального цистита могут быть использованы эндовезикальные инстилляции гиалуроновой кислоты и хондроитин сульфата.
У женщин в постменопаузе вагинальное применение эстрагенов (эстриол) позволяет уменьшить частоту рецидивов ИМП.
В лечении ИМП используется бактериофаготерапия. Применяются следующие бактериофаги: стафилококковый, стрептококковый, протейный, синегнойный, пиобактериофаг комплексный, бактериофаг Klebsiella oxytoca. Лечение бактериофагами пациентов начинают после определения чувствительности возбудителя к препарату бактериофага: по 30 мл 3 раза в день 10–14 дней.
При лечении острого пиелонефрита у беременных при имеющемся расширении верхних мочевыводящих путей рекомендуется установка мочеточникового стента либо чрезкожная пункционная нефростомия.
Пациенты с тяжелым неосложненным пиелонефритом (табл. 3) подлежат госпитализации в стационар. Лечение начинают с внутривенного введения препаратов, при улучшении состояния пациента, после 72 часов от начала АБТ, возможно перевести больного на прием тех же препаратов внутрь.
Лечение рецидивирующей ИМП проводится так же, как и неосложненного бактериального цистита. Кроме того, используется иммуноактивная профилактика препаратом Уро-Ваксом, который назначают для профилактики рецидивов по 1 капсуле утром, натощак в течение 3 месяцев.
После улучшения состояния возможен перевод больного на прием препаратов per os: левофлоксацин 0,75 внутрь 1 раз в сутки или ципрофлоксацин 1 г внутрь 1 раз в сутки.
Из фитопрепаратов наиболее широкое применение получил препарат Канефрон Н, который назначают по 2 драже 3 раза в сутки, биодобавка Монурель — по 1 таблетке в день на протяжении 2 недель с повторным приемом на протяжении 3 месяцев.
Для лечения острого цистита у беременных используется фосфомицина трометамол, бета-лактамные антибиотики и нитрофураны, средняя длительность лечения — 7 дней начиная со II триместра беременности.
Фосфомицина трометамол внутрь 3,0 г однократно, или
- цефиксим внутрь 0,4 г 1 раз в сутки — 7 дней, или
- цефтибутен внутрь 0,4 г 1 раз в сутки — 7 дней, или
- нитрофурантоин внутрь 0,1 г 2 раза в сутки — 7 дней, или
- цефуроксим внутрь 0,25–0,5 г 2 раза в сутки — 7 дней, или
- амоксициллин/клавуланат внутрь 0,625 г 3 раза в сутки — 7 дней.
ББ у беременных подлежит лечению АБТ (табл. 4). При остром пиелонефрите беременных рекомендуемая длительность АБТ составляет 14 дней (табл. 5).
У женщин в постменопаузе лечение ИМП должно быть дополнено применением эстрогенсодержащих препаратов. Это необходимо с целью улучшения регенерации слизистой влагалища и мочевого пузыря и предотвращения рецидива ИМП.
При остром бактериальном простатите продолжительность лечения составляет 14–28 дней, в течение 7 дней препарат вводится внутривенно, а далее переходят на пероральный прием (табл. 6).
ИМП у молодых мужчин встречается крайне редко. Чаще всего она считается осложненной, так как она связана с аномалиями МВС, обструкцией, инструментальными вмешательствами, инфекциями, передающимися половым путем. При лечении ИМП у мужчин используют препараты группы фторхинолонов: левофлоксацин по 0,5 г внутрь 1 раз в сутки 7 дней, или офлоксацин 0,4 внутрь 2 раза в сутки, или ципрофлоксацин 0,5 внутрь 2 раза в сутки. При рецидиве ИМП требуется проведение урологического обследования.
Оценка эффективности лечения проводится по клиническим и лабораторным изменениям. Проведение бактериологических исследований мочи рекомендуется до и после лечения, через 5–9 дней после окончания АБТ и далее через 4–6 недель.
Прогноз лечения НИМП благоприятен, осложненной — индивидуален. Для вылечивания ИМП необходим комплексный подход к пациенту: коррекция всех анатомических и функциональных нарушений мочевыводящих путей, лечение сопутствующей патологии, удаление катетеров и дренажей. Ранняя диагностика ИМП, своевременно назначенное лечение позволят значительно улучшить отдаленные исходы заболевания.
Литература
- Перепанова Т. С., Козлов Р. С., Руднов В. А. Синяква Л. А. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации. М., 2015. 72 с.
- Stark R. P., Maki D. G. Bacteriuria in the catheterized patient // NEJM. 1984; 311: 560–564.
- Guidelines on urological, EUA, 2015, 88 s.
- Cai T., Mazzoli S., Mondaini N. et al. The role of asymptomatic bacteriuria in young women with recurrent urinary tract infections: to treat or not no treat? // Clin. Infect. Dis. 2012; 55 (6): 771–777.
- Нефрология: учебное пособие для послевузовского образования / Под ред. Е. М. Шилова. М.: ГЭОТАР-Медиа, 2007. 688 с.
- Лопаткин Н. А., Перепанова Т. С. Рациональная фармакотерапия в урологии: Compendium. М.: Литтера, 2015. 448 с.
О. Б. Поселюгина, доктор медицинских наук, профессор
Выбор антибиотика при инфекциях. Рекомендации, критерии
Основные принципы антибактериальной терапии — избирательная токсичность в отношении патогенного микроорганизма и относительная безопасность для организма человека. Для их выполнения большое значение имеет использование в качестве мишеней для лекарственных препаратов тех компонентов бактериальной клетки, которые отсутствуют у человека.
Примером такого компонента может быть клеточная стенка, воздействие на которую оказывает слабое влияние на макроорганизм и в то же время губительно для бактерии. Правильно подобранная антибиотикотерапия всегда эффективна и достаточно безопасна.
Несмотря на то, что почти все антибиотики обладают рядом побочных эффектов, серьёзные нарушения возникают достаточно редко. Кроме того, препараты этой группы имеют достаточно высокий терапевтический индекс, а потому побочные эффекты манифестируют только при назначении доз, намного превышающих терапевтическую. Важное исключение — аминогликозиды, наблюдение за концентрацией которых в сыворотке крови имеет первостепенное значение.
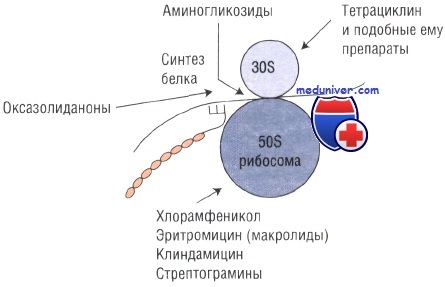
Выбор антибиотика
Выбор антибиотика зависит от локализации очага инфекции, чувствительности микроорганизмов, тяжести заболевания и аллергического анамнеза, вероятности возникновения побочных эффектов, стоимость препарата рассматривают в последнюю очередь. Рациональный выбор терапии зависит от знания локализации возбудителя и профиля его чувствительности к антибиотикам.
Локализация очага инфекции. Способность проникать в ткани (костную, суставную) или спинномозговую жидкость у всех антибактериальных препаратов различна. При абсцессах, а также в тканях с низким кровотоком достаточно трудно достичь высокого уровня антимикробной активности. Кроме того, эффект некоторых антибиотиков (например, аминогликозидов) снижается при низких значениях рН. В связи с этим абсцесс, возникающий внутри костной ткани или в спинномозговом канале, очень тяжело поддаётся лечению.
Чувствительность микроорганизмов. Streptococcus pyogenes высокочувствителен к действию бензилпенициллина, но другие бактерии, например, рода Acinetobacter и Pseudomonas. не восприимчивы к действию большинства антибиотиков, а потому подобрать эффективный препарат бывает достаточно сложно.
Вероятность возникновения аллергических реакций или побочных эффектов. Многие пациенты имеют в анамнезе наличие аллергических реакций к одному или более антибиотикам (наиболее чаще к пенициллину). В таких случаях обычно назначают альтернативное лечение. Возникновение аллергии — основное противопоказание не только к применению препарата, вызвавшего её, но и к назначению других родственных лекарств этой группы.
Противопоказание к использованию аминогликозидов — нарушение функции почек. Применение препаратов цефалоспоринового ряда ограничивается возрастом пациента, так как эти лекарственные средства повышают риск развития суперинфекции (например, в случае С. difficile).

Методы введения антибиотиков в организм при инфекциях
В настоящее время наиболее распространён приём препаратов внутрь (как при амбулаторном, так и при стационарном лечении). Кроме того, антибиотики можно применять местно (при кожных инфекциях), ректально (метронидазол для профилактики осложнений после хирургических операций) или вагинально (в виде пессариев). При тяжёлых инфекционных заболеваниях (септицемия и др.) для обеспечения терапевтического эффекта рекомендовано внутривенное введение антибактериальных препаратов.
Этот метод также показан пациентам, которые не могут принимать лекарства внутрь (например, при повторной рвоте). В педиатрии следует также учитывать вкусовые свойства антибиотиков. Кроме того, для многих пациентов большую роль играет кратность приёма и сложность режима лечения.
Многие пациенты имеют в анамнезе наличие аллергических реакций к одному или более антибиотикам (наиболее чаще к пенициллину).
Контроль антибактериальной терапии инфекции
Для контроля достижения и поддержания терапевтической дозы препарата, а также для снижения риска возникновения токсического эффекта при лечении антибиотиками необходимо наблюдение за состоянием пациентов. Это особенно важно в случаях, когда терапевтическая и токсическая дозы антибиотика отличаются незначительно. Перед внутривенным введением ванкомицина и аминогликозидов, а также по истечении часа после их введения необходимо измерять концентрацию препаратов в сыворотке крови.
Для обеспечения терапевтического эффекта и снижения риска интоксикации полученные результаты анализов должны соответствовать установленным нормам. Например, если концентрация высока, то дозу необходимо уменьшить. Кроме того, понизить уровень препарата в крови помогает снижение частоты его приёма. При приёме пролонгированных форм (когда для обеспечения терапевтического эффекта достаточно однократного приёма в сутки) анализы интерпретируют при помощи нормограммм и сравнивают результаты с общепринятыми нормами.
При лечении инфекций, вызванных частично устойчивыми микроорганизмами, также необходимо измерять концентрацию препаратов в сыворотке крови. Если рост бактерий ингибирует высокая концентрация антибиотика, то важно поддерживать её в сыворотке на постоянном уровне. Если инфекция возникает в труднодоступных местах (например, менингит, вызванный штаммами Pseudomonas), то содержание препарата можно измерить в спинномозговой жидкости.
Побочные эффекты антибиотиков
Наиболее распространённый побочный эффект при приёме антибиотиков — незначительные желудочно-кишечные расстройства. В исключительных случаях наблюдают тяжёлые аллергические реакции, приводящие к анафилактическому шоку или сывороточной болезни.
Желудочно-кишечный тракт при антибактериальной терапии. Антибактериальные препараты (особенно бета-лактамы) нарушают баланс нормальной микрофлоры кишечника, вызывая активный рост условно-патогенных микроорганизмов, таких, как род Candida. Таким образом, антибактериальная терапия может привести к острой диарее или более серьёзному осложнению — пневдомембранозному колиту.
Кожа при антибактериальной терапии. Кожные реакции могут быть различны: от лёгкой крапивницы или пятнисто-папулёзной эритематозной сыпи до мультиформной эритемы и крайне опасного синдрома Стивенса— Джонсона. В большинстве своём они не носят угрожающего характера и исчезают при отмене препарата.
Система кроветворения при антибактериальной терапии. У пациентов, принимающих хлорамфеникол или ингибиторы фолиевой кислоты, наблюдают дозозависимое угнетение функции костного мозга. При тяжёлых осложнениях вследствие лечения хлорамфениколом возникает апластическая анемия. Высокие дозы р-лактамных препаратов вызывают гранулоцитопению. Иногда при приёме антибиотиков развивается гемолитическая анемия. Большинство антибактериальных препаратов вызывают обратимую тромбоцитопению или угнетение функции костного мозга.
Мочевыводящая система при антибактериальной терапии. Нефротоксичность аминогликозидов обусловлена их способностью повреждать клетки проксимальных извитых канальцев почек. В группу риска входят пожилые пациенты, лица с заболеваниями почек, а также пациенты, принимающие помимо аминогликозидов другие нефротоксичные препараты (например, антибиотики тетрациклинового ряда).
Печень при антибактериальной терапии. Изониазид и рифампицин могут быть причиной развития гепатита, особенно если у пациентов ещё до приёма этих препаратов были заболевания печени. Другие препараты, связанные с развитием гепатита, — тетрациклины, эритромицин, пиразинамид, этионамид и реже ампициллин или фторхинолоны. Кроме того, при приёме тетрациклинов или высоких доз фузидовой кислоты возникает холестатическая желтуха.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Бактерицидные антибиотики ингибиторы синтеза клеточной стенки
У большинства бактерий клеточная стенка окружает клетку в виде плотной оболочки, защищающей от вредных внешних воздействий, и предотвращает разрыв плазматической мембраны под влиянием высокого внутреннего осмотического давления.
Транспептидаза сшивает пептидные цепи соседних цепей аминосахаров. Бактерии, которые окрашиваются грамотрицательно, имеют дополнительную мембрану поверх муреинового слоя. Она блокирует доступ многим антибиотикам к грамотрицательным бактериям. Эта мембрана состоит из фосфолипидного бислоя, содержащего белки (в т. ч. транспортные, которые позволяют антибиотикам преодолевать ее) вместе с липополисахаридами.
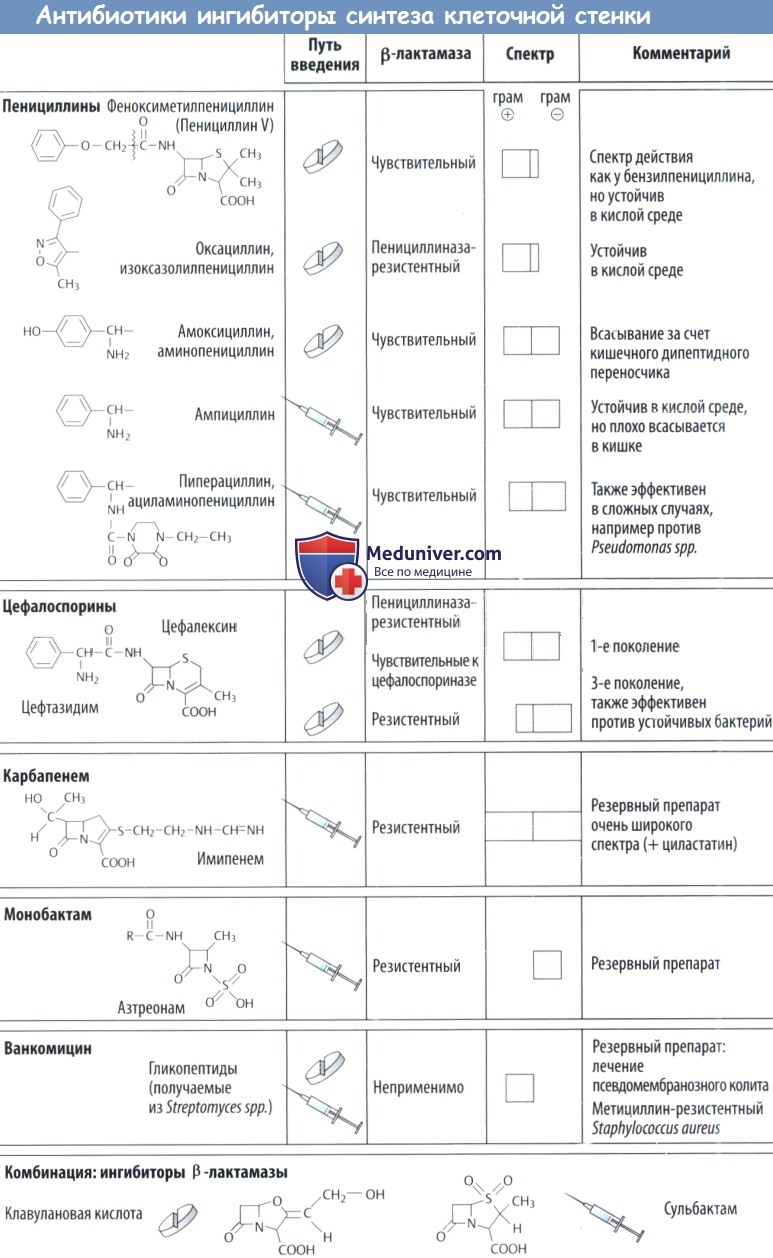
Ингибиторы синтеза клеточной стенки являются избирательными антибактериальными препаратами, т. к. у животных и у человека клеточная стенка отсутствует. Эти препараты оказывают бактерицидное действие на растущие и размножающиеся бактерии. К представителям данного класса относятся β-лактамные антибиотики, например пенициллины, цефалоспорины и атипичные β-лактамы, а также ванкомицин и бацитрацин.
а) Пенициллины. Исходным веществом данной группы является бензилпенициллин (пенициллин G). Он был впервые получен из культур плесневых грибов Penicillinum notatum. Бензилпенициллин имеет основную структуру, общую для всех пенициллинов, а именно 6-аминопенициллиновую кислоту, содержащую тиазолид и 4-членное β-лактамное кольцо. 6-аминопенициллиновая кислота сама по себе не обладает антибактериальной активностью.
Пенициллины нарушают синтез клеточной стенки за счет ингибирования транспептидазы. Бактерицидное действие пенициллинов проявляется при росте бактерий и в фазе репликации. В результате нарушения целостности клеточной стенки бактерии набухают и разрываются.
Пенициллины, как правило, хорошо переносятся. Суточная доза бензилпенициллина варьирует от 0,6 г в/м (10 6 ME, 1 мегаЕД) до 60 г в виде инфузии. В основе наиболее значимых побочных эффектов лежит гиперчувствительность (частота до 5%) с проявлениями от кожной сыпи до анафилактического шока (< 0,05% случаев). Аллергия к пенициллину в анамнезе служит противопоказанием к данным препаратам. Нейротоксическиеэффекты, в основном судороги вследствие антагонизма с ГАМК, встречаются при чрезвычайно высоких концентрациях в головном мозге, например, после быстрой в/в инъекции большой дозы или при субарахноидальной инъекции.
Бензилпенициллин быстро выводится почками в основном в неизмененном виде (t1/2 из плазмы около 0,5 ч) с помощью системы секреции органических ионов.
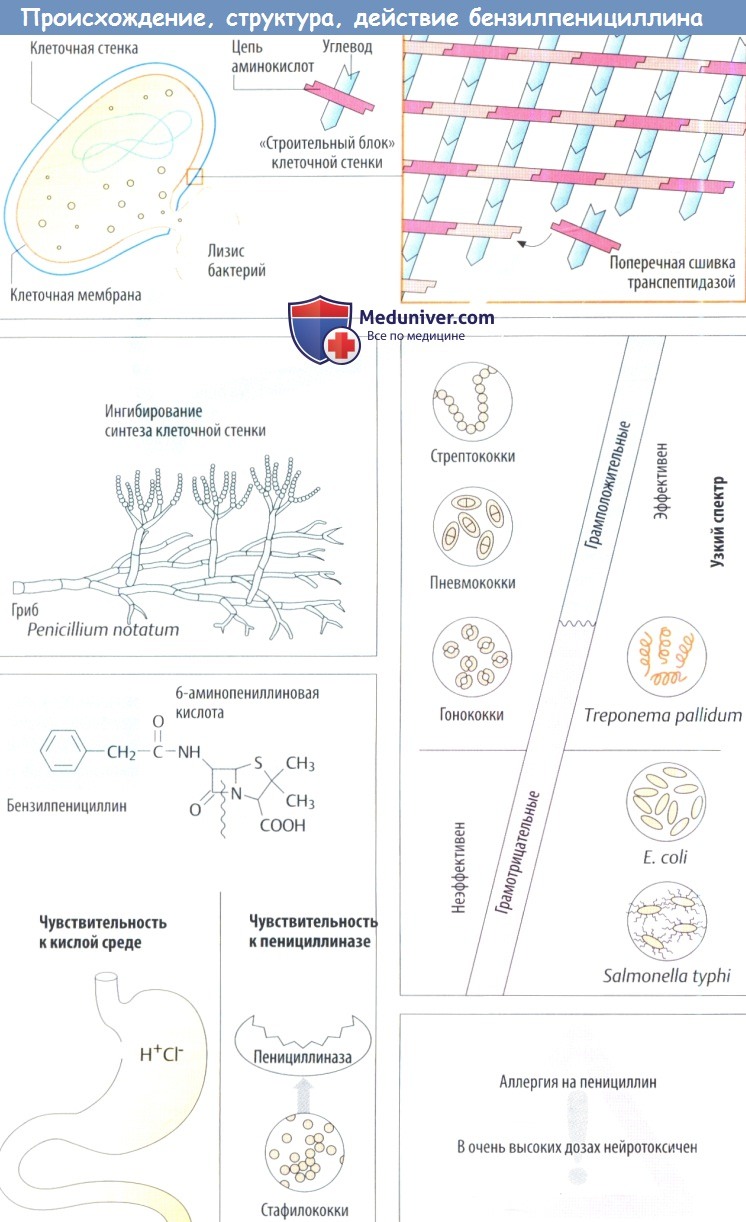
Для расширения диапазона дозы с сохранением необходимогоуровня антибактериального препарата пенициллины могут вводиться в высокой дозе в силу широкой терапевтической границы безопасности. Существуют пролонгированные препараты для в/м введения (продолжительность действия прокаин-бензилпенициллина составляет 1 день, а бензатин-бензилпенициллина — 7-28 дней). Одновременное введение пробенецида для ингибирования переносчика анионов в почках задерживает выделение пенициллина.
Несмотря на очень хорошую переносимость, у бензилпенициллина имеются недостатки, которые ограничивают его терапевтическую полезность:
1. Он инактивируется кислотой желудка, которая отщепляет р-лактамное кольцо, что делает необходимым в/в введение.
2. β-лактамное кольцо также разрушается бактериальными ферментами (р-лактамазами), в частности пенициллиназой, которая образуется штаммами стафилококка, обеспечивая их резистентность к бен-зилпенициллину.
3. Узкий антибактериальный спектр, и несмотря на то что он охватывает многие грамположительные бактерии, грамотрицательные кокки и спирохеты, вне поражения остаются многие грамотрицательные возбудители.
Производные пенициллина с различными заместителями 6-аминопенициллиновой кислоты обладают рядом преимуществ.
1. Резистентность в кислой среде позволяет вводить препарат внутрь при условии возможности кишечного всасывания. Многие производные, показанные на рисунке ниже, вводятся внутрь. Пенициллин V (феноксиметил пенициллин) обладает такими же антибактериальными свойствами, что и бензилпенициллин.
2. Благодаря резистентности к пенициллиназе изоксазолилпенициллины (оксациллин, диклоксациллин, флоксациллин) подходят для (перорального) лечения инфекций, вызванных продуцирующими пенициллиназу стафилококками.
3. Расширенный спектр активности: аминопенициллин амоксициллинактивен против многих грамотрицательных организмов, например бактерий группы кишечной палочки или Salmonella typhi.
Амоксициллин устойчив в кислой среде и хорошо всасывается в кишечнике, т. к. транспортируется ди-пептидным переносчиком. Ампициллин обладает аналогичным спектром активности, но из-за плохой всасываемости (< 50%) сильнее повреждает кишечную микробную флору (побочный эффект — диарея), поэтому его следует вводить только в виде инъекции.
Ациламинопенициллины (мезлоциллин, пиперациллин) характеризуются еще более широким спектром против грамотрицательных бактерий (в т. ч. синегнойных бактерий). Эти вещества неустойчивы к кислой среде и к пенициллиназе.
Чувствительные к пенициллиназе пенициллины эффективно действуют против продуцирующих пенициллиназу бактерий при комбинировании их с ингибитором β-лактамазы, который сам по себе не обладает антибактериальным свойством,но необратимо блокирует фермент. Это клавулановая кислота, сульбактам, тазобактам.
б) Цефалоспорины. Эти β-лактамные антибиотики тоже являются продуцентами грибов и обладают бактерицидной активностью из-за ингибирования транспептидазы. В основе их общей структуры лежит 7-аминоцефалоспориновая кислота, что можно видеть на примере цефалексина (серый прямоугольник). Цефалоспорины устойчивы в кислой среде, но многие из них плохо всасываются. Учитывая, что их нужно вводить парентерально, большинство из них, в т. ч. с высокой активностью, используется только в стационарах. Небольшое число препаратов, например цефалексин, подходит для приема внутрь.
Цефалоспорины резистентны к пенициллиназе, однако существуют микроорганизмы, образующие цефалоспориназу. Тем не менее некоторые производные устойчивы и к данной β-лактамазе. Цефалоспорины — антибиотики широкого спектра действия. Последние производные (цефотаксим, цефтриаксон, цефтазидим) тоже эффективны против возбудителей, резистентных к различным другим антибиотикам. Цефалоспорины в большинстве случаев хорошо переносятся. Все они вызывают аллергические реакции, а некоторые также приводят к повреждению почек, непереносимости алкоголя и кровотечению (антагонизм с витамином К).
в) Атипичные β-лактамы являются резервными антибиотиками в случае неэффективности или непереносимости пенициллинов и цефалоспоринов. После клубочковой фильтрации карбапенем имипенем инактивируется в полости проксимального канальца дегидропептидазой, расположенной на щеточной каемке. Их комбинация с ингибитором фермента циластатином защищает против инактивации и сохраняет эффективность в нижних мочевых путях. Меропенем нечувствителен к разрушению и менее токсичен в отношении ЦНС.
У монобактама азтреонама имеется только основная структура β-лактамов в β-лактамном кольце.
г) Другие ингибиторы синтеза клеточной стенки. Бацитрацин и ванкомицин нарушают транспорт пептидогликанов через цитоплазматическую мембрану и активны только против грамположительных бактерий. Ванкомицин — микробный гликопептид, содержащий необычные аминокислоты, поэтому он не расщепляется в ЖКТ. Его можно использовать для (перорального) лечения кишечных инфекций, возникающих как осложнение антибиотикотерапии (псевдомембранозный колит, возбудитель — Clostridium difficile). Он не всасывается.
Инфекции, вызванные грамположительными кокками, резистентные к лучше переносимым препаратам, тоже лечат ванкоми-цином при системном введении. Это приводит к повышенному риску ототоксичности (потеря слуха, шум в ушах) или вестибулярной токсичности (вертиго, атаксия, нистагм). Тейкопланин действует как ванкомицин.
Бацитрацин — смесь полипептидов с выраженной нефротоксичностью, поэтому используется только местно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

