Принципы и методы микробиологической диагностики инфекционных заболеваний
Обновлено: 12.05.2024
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
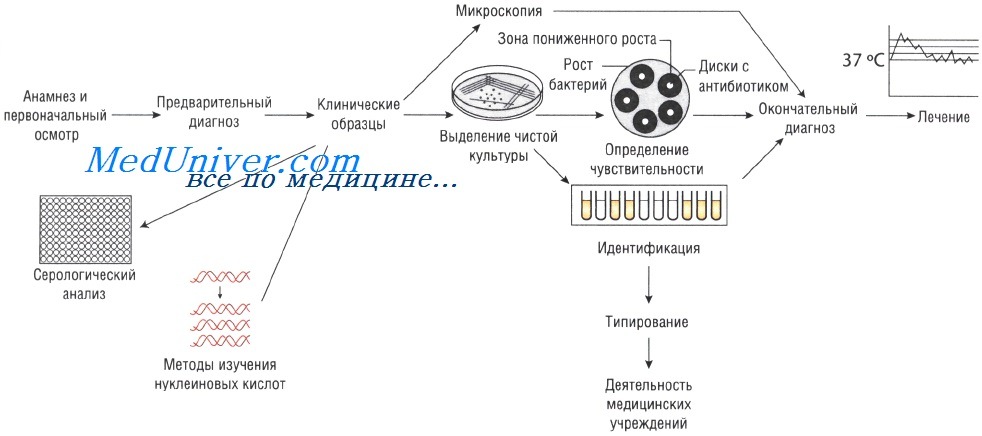
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лабораторная диагностика болезней человека основана на обнаружении в организме больного микроба, вызвавшего болезнь, его компонентов (антигенов) или продуктов его жизнедеятельности (токсинов и т. п.) или изменений в параметрах гомеостаза под действием этого микроба, например формулы крови, биохимического состава крови и т. д.
Наиболее важное место в лабораторной диагностике инфекционных болезней занимает специфическая микробиологическая диагностика, которую проводят в бактериологической, вирусологической, иммунологической и других лабораториях.
Забор материала для исследования. Первым этапом микробиологической диагностики является забор материала для исследования, выбор которого определяется патогенезом и клиникой инфекционного заболевания. Исследуемый материал берут, по возможности, в асептических условиях, помещают в стерильную посуду и как можно быстрее доставляют в лабораторию (желательно в течение часа).
В некоторых случаях посев материала проводят у постели больного. Иногда допускается непродолжительное хранение материала в регламентированных условиях. Исследуемый материал сопровождается документом, в котором обязательно указываются время взятия, характер материала, его источник и точно формулируется цель исследования.
Материалом для исследования в медицинской микробиологии служат различные биологические жидкости и другие материалы, взятые из организма (кровь, гной, моча, мокрота, ликвор, испражнения, рвотные массы, промывные воды и т. п.), и ткань — биопсия от живого или аутопсия от трупа. В некоторых случаях на исследование берут объекты окружающей среды: воздух, воду, пищевые продукты, смывы и т. п. При заборе материала для микробиологического исследования необходимо соблюдать следующие правила:
вид материала определяется клинической картиной заболевания, т. е. он должен соответствовать локализации предполагаемого возбудителя на данном этапе патогенеза болезни;
количество материала должно быть достаточным для проведения исследования и его повторения в случае необходимости;
материал берут, по возможности, в начальном периоде болезни, так как именно в этот период возбудители выделяются чаще, их больше, они имеют более типичную локализацию;
забор материала должен осуществляться до начала антимикробной химиотерапии или через определенный промежуток времени после приема антибактериального препарата, необходимый для выведения последнего из организма; материал берут непосредственно из очага инфекции или исследуют соответствующее отделяемое (гной, мочу, желчь и т. п.);
материал берут в момент наибольшего содержания в нем возбудителя;
необходимо исключить возможность контаминации материала нормофлорой больного и микробами окружающей среды, для чего материал берут в асептических условиях при адекватном доступе к источнику инфекции;
следует предупредить возможность попадания в материал антимикробных препаратов
(дезинфектантов, антисептиков, антибиотиков);
любой клинический материал должен рассматриваться как потенциально опасный для человека, поэтому при его заборе, хранении, транспортировке и обработке должны соблюдаться все правила биологической безопасности;
транспортировку материала в лабораторию следует проводить в максимально короткие сроки, чтобы исключить гибель неустойчивых видов микробов, или помещать его в специальные транспортные среды;
к материалу прилагают сопроводительный документ, содержащий основные сведения, необходимые для проведения микробиологического исследования (Ф.И.О. больного, номер истории болезни, клинический диагноз и т. д.).
в процессе транспортировки материал следует оберегать от действия света, тепла, холода, механических повреждений, чтобы исключить гибель микробов и контаминацию материала посторонней микрофлорой. Лучше всего доставлять материал в специальных металлических изотермических контейнерах, которые легко очищать и обеззараживать. Нельзя отправлять материал в лабораторию с больными или со случайными людьми.
Микробиологическая диагностика. Микробиологическая диагностика включает в себя 5 методов:
• аллергологический. Микроскопический метод заключается в
приготовлении препаратов (нативных или окрашенных простыми или сложными методами) из исследуемого материала и их микроскопии с применением различных видов микроскопической техники (световая, тем-нопольная, фазово-контрастная, люминесцентная, электронная и др.). В бактериологии микроскопический метод получил название бактериоскопического, в вирусологии — виру-соскопического.
Культуральный метод заключается в посеве исследуемого материала на искусствен-
ные питательные среды с целью выделения и идентификации чистой культуры возбудителя или возбудителей. В бактериологии культуральный метод получил название бактериологического, в микологии — микологического, в протозоологии — протозоологического, в вирусологии — вирусологического.
Биологический метод (экспериментальный или биопроба) заключается в заражении исследуемым материалом чувствительных лабораторных животных или других биологических объектов (куриные эмбрионы, культуры клеток). Его используют для выделения чистой культуры возбудителя, определения типа токсина, определения активности антимикробных химиотерапевтических препаратов и т. д.
Серологический метод заключается в определении титра специфических антител в сыворотке крови больного, реже — в обнаружении микробного антигена в исследуемом материале. С этой целью используются реакции иммунитета.
Аллергологический метод заключается в выявлении инфекционной аллергии (ГЗТ) на диагностический микробный препарат-аллерген. С этой целью ставят кожные аллергические пробы с соответствующими аллергенами.
Очевидно, что диагностическая ценность перечисленных методов неравнозначна. Ведущим методом микробиологической диагностики является культуральный метод, так как он позволяет выделять и идентифицировать микроб-возбудитель, т. е. первопричину болезни. Остальные методы менее информативны, так как они имеют дело с изменениями в организме, обусловленными наличием в нем микроба. Второе место по значимости занимает серологический метод, поскольку взаимодействие антигена и антитела характеризуется высокой степенью специфичности. Информативность трех остальных методов невысокая, и они обычно служат дополнением к культуральному и серологическому методам. Так, микроскопия исследуемого материала далеко не всегда позволяет увидеть и идентифицировать микробы под микроскопом. Их удается обнаружить только при высокой обсемененности ими материала. Даже обнаружив бактерии, под микроскопом их невозможно идентифицировать до вида морфологически. Как известно, все видовое многообразие бактерий сводится к четырем основным морфологическим
формам: кокки, палочки, извитые и ветвящиеся формы. Поэтому по микроскопической картине можно весьма ориентировочно отнести увиденные бактерии к крупному таксону, например, грамположительные кокки. Только в единичных случаях, когда бактерии имеют уникальную морфологию, на основании микроскопии можно определить их родовую принадлежность. При микроскопии грибов и простейших информативность микроскопического метода выше, так как грибы и простейшие, являясь эукариотами, имеют более крупные размеры и более характерную морфологию.
Диагностические возможности экспериментального метода ограничены тем, что к большинству возбудителей антропонозных инфекций человека лабораторные животные невосприимчивы, поэтому вызвать у них экспериментальную инфекцию не представляется возможным.
Возможности аллергологического метода ограничены тем, что большинство микробов, попадая в организм человека, не вызывают ГЗТ.
Поскольку микробиологические исследования являются одним из наиболее дорогих видов лабораторных исследований, перед микробиологом стоит задача постановки достоверного микробиологического диагноза с наименьшей затратой времени, сил и средств. Поэтому для постановки диагноза используют от одного до пяти методов диагностики, с тем чтобы выбранный набор методов гарантировал правильность ответа.
Особое значение приобретают методы экспресс-диагностики, которые позволяют поставить микробиологический диагноз в течение короткого промежутка времени (от нескольких минут до нескольких часов) с момента доставки исследуемого материала в лабораторию. К числу экспресс-методов относятся РИФ, ИФА, РИА, ПЦР, газовая хроматография и др.
Наряду с традиционными классическими методами микробиологической диагностики в последние годы все большее значение приобретают молекулярно-биологические методы диагностики (ДНК-зонды, ПЦР, газовая хроматография, электрофорез, иммуноблотидр.). Эти методы основаны на идентификации ДНК и РНК, специфических для данного вида микробов, и включают гибридизацию на основе ДНК-зондов и диагностику на основе ПЦР.
К числу экспресс-методов микробиологической диагностики анаэробной инфекции
следует отнести физико-химические методы исследования химического состава микробной клетки и продуктов ее метаболизма. Таким" методом, в первую очередь, является метод газожидкостной хроматографии (ГЖХ). Использование метода ГЖХ с целью экспресс-диагностики анаэробной инфекции основано на хроматографическом определении в исследуемом материале больных гнойно-септическими заболеваниями специфических продуктов метаболизма анаэробов — летучих жирных кислот, которые служат метаболическими маркерами наличия анаэробов в исследуемом материале. Хорошо известно, что конечными и высокоспецифичными продуктами метаболизма углеводов у анаэробов являются жирные кислоты. Различают корот-коцепочечные или летучие жирные кислоты С2-С7 и длинноцепочечные нелетучие кислоты. Определение в исследуемом материале наличия жирных кислот с помощью ГЖХ является убедительным доказательством анаэробной этиологии воспалительного процесса. Методом ГЖХ технически более просто определять летучие жирные кислоты. При этом метаболическими маркерами анаэробов являются изомасляная и масляная, изовале-риановая и валериановая, изокапроновая и капроновая, гексановая и каприловая кислоты. Аэробные бактерии летучие жирные кислоты не продуцируют. ГЖХ применяется также в диагностике заболеваний, вызванных микобактериями и, в первую очередь, при туберкулезе. Применение ГЖХ особенно целесообразно при тех заболеваниях, возбудители которых плохо или вообще не культивируются либо же слишком долго растут.
Цель микробиологических исследований — установить факт наличия или отсутствия возбудителя в организме больного и на объектах окружающей среды.
Задачи микробиологических исследований — идентифицировать микроорганизмы в исследуемом материале, определить их видовую принадлежность, морфологические, биохимические, токсигенные и антигенные свойства, а также установить чувствительность выделенных микроорганизмов к антимикробным препаратам. Несмотря на то, что проведение микробиологических исследований относится к компетенции микробиологов, каждый врач, имеющий дело с инфекционными заболеваниями, должен знать, как и когда необходимо отбирать материал для исследований, на какие исследования его направлять и как интерпретировать полученные результаты.
Отбор материала.
• Первый этап любого микробиологического исследования составляет правильный выбор материала для исследования. Его определяют свойства возбудителя и патогенез вызываемого им заболевания. При поражениях отдельных органов и систем целесообразно отбирать материал соответствующей локализации. При отсутствии поражений исследуют кровь, а затем отбирают образцы с учётом клинической картины заболевания и доступности материала для исследования. Так, при лихорадке неясного генеза первоначально проводят посев крови; затем, при появлении симптомов более конкретных проявлений, например, пневмонии, проводят забор мокроты.
Образцы следует забирать до назначения антимикробной терапии, с соблюдением правил асептики для предупреждения загрязнения материала. Каждый образец следует рассматривать как потенциально опасный. При заборе, транспортировке, хранении и работе с ним необходимо соблюдать правила биологической безопасности. Материал собирают в объёме достаточном для всего комплекса исследований. Микробиологические исследования следует начинать немедленно после поступления образца в лабораторию.
Выбор материала для исследования должен соответствовать характеру инфекционного процесса. Так, например, для установления этиологии пневмонии материалом должна быть мокрота, а не слюна, а при раневых инфекциях отделяемое следует забирать из глубины раны, а не с её поверхности.
Выбор лабораторных исследований
Основу микробиологической диагностики инфекционных заболеваний составляют микроскопические, микробиологические, биологические, молекулярно-генетический, серологические и кожно-аллергологические методы.
Микроскопический метод основан на микроскопии исследуемого материала, с целью определения формы, взаиморасположения клеток и тинкториальных свойств (тинкториальные свойства – способность воспринимать и удерживать краситель).
Бактериологический метод основан на выделение чистой культуры возбудителя с целью ее идентификации по определенным свойствам (морфологическим, культуральным, биохимическим и др.).
Серологический – основан на выделении в биологических жидкостях (чаще крови) человека специфических антител к соответствующим возбудителям, реже АГ с помощью различных реакций: агглютинации, преципитации, связывания комплимента, иммунной флюоресценции и т.д.
Биологический метод основан на заражение лабораторных животных исследуемым материалом с целью воспроизведения у них инфекционного процесса, постановки реакции нейтрализации и (или) последующего выделения накопленного возбудителя.
Кожно-аллергический метод обнаруживает повышенную чувствительность макроорганизма к определенным возбудителям или продуктам их жизнедеятельности (аллергены), применяются для выявления инфицированности организма (но не заболевания) соответствующим микрорганизмом.
Молекулярно-генетический – позволяет обнаружить возбудитель по нескольким молекулам ДНК, содержащимся в крови или поражённых клетках хозяина. Его целесообразно проводить в случаях, когда:
трудно выделить чистую культуру возбудителя из-за сложности культивирования;
возбудитель характеризуется высокой антигенной изменчивостью;
в исследуемом материале имеется крайне низкая концентрация возбудителя или наблюдается длительная его персистенция в организме человека.
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.
- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.
Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

