Природный антибиотик от кишечной палочки
Обновлено: 24.04.2024
Рассмотрены подходы к комплексной терапии инфекции мочевых путей с применением современных комбинированных фитопрепаратов, которые позволяют повышать эффективность антибактериальной терапии за счет преодоления резистентности возбудителя к антибиотикам, со
The article considers approaches to complex therapy of urinary tract infections, using modern combined phyto-preparations, which allow to enhance efficiency of antibacterial therapy due to overcoming the agent’s resistance to antibiotics, and reduce the course of antibiotic therapy.
Инфекция мочевых путей (ИМП; синонимы: инфекция мочевой системы, инфекция мочевыводящих путей) — собирательный термин, обозначающий инфекционно-воспалительный процесс в мочевыделительной системе без указания его локализации и характера течения. По локализации выделяют инфекцию нижних мочевых путей (цистит, уретрит) и верхних мочевых путей (пиелонефрит, абсцесс и карбункул почки, апостематозный пиелонефрит).
По характеру течения ИМП делятся на неосложненную и осложненную. Неосложненная ИМП развивается, как правило, у людей без обструктивных уропатий и структурных изменений в почках и мочевыводящих путях, в отсутствие фоновых заболеваний. Осложненные инфекции возникают у больных с обструктивными уропатиями, мочекаменной болезнью, поликистозом почек, доброкачественной гиперплазией предстательной железы (ДГПЖ), на фоне катетеризации мочевого пузыря и/или при инструментальных (инвазивных) методах исследования, а также у больных с сопутствующими заболеваниями, такими как сахарный диабет, подагра, другими метаболическими нарушениями.
По возникновению выделяют внебольничные (возникающие в амбулаторных условиях) и нозокомиальные (развивающиеся после 48 ч пребывания пациента в стационаре) ИМП. Не менее 40% всех нозокомиальных инфекций обусловлены ИМП, вызванной в большинстве случаев катетеризацией мочевого пузыря [1–3].
В зависимости от выраженности клинических проявлений ИМП часто подразделяют на афебрильную (преимущественно инфекция нижних мочевых путей), фебрильную (преимущественно инфекция верхних мочевых путей) и бессимптомную бактериурию (ББ). ББ — бактериологический диагноз, который устанавливается при исследовании мочи, собранной с максимальным соблюдением стерильности и доставленной в лабораторию в предельно короткие сроки. По определению Американского общества инфекционных болезней (Infectious Diseases Society of America, IDSA), ББ — это изолированная бактериурия в образце мочи, полученном в условиях, исключающих контаминацию, и при отсутствии симптомов мочевой инфекции [4]. Диагноз ББ может быть установлен:
- если в двух последовательных анализах мочи у женщин без клинических признаков ИМП выделен один и тот же штамм микроорганизмов в количестве ≥ 10 5 КОЕ/мл;
- если в анализе мочи у мужчин без симптомов ИМП однократно выделен бактериальный штамм в количестве ≥ 10 5 КОЕ/мл;
- если в анализе мочи, полученном при катетеризации, как у мужчин, так и женщин, выделен бактериальный штамм в количестве ≥ 10 2 КОЕ/мл.
В структуре инфекционной заболеваемости ИМП занимает второе место, уступая лишь респираторным инфекциям. Среди взрослой популяции женщины в 30–50 раз чаще, чем мужчины, страдают от ИМП, а в течение жизни до 60% женщин сталкиваются с эпизодом ИМП. У каждой четвертой пациентки этой возрастной группы в течение года ИМП рецидивирует [5]. В пожилом и старческом возрасте частота ИМП у женщин и мужчин постепенно сравнивается, что обусловлено развивающейся практически в 100% ДГПЖ, нарушающей уродинамику. В целом ИМП, включая пиелонефрит, регистрируется существенно чаще у женщин, чем у мужчин. Распространенность ИМП в детской популяции составляет 20–22 случая на 1000 детей и в возрасте старше одного года жизни у девочек встречается в десятки раз чаще, чем у мальчиков.
В структуре внутрибольничных инфекций доля ИМП может достигать 40%.
Этиология
Основными возбудителями ИМП являются грамотрицательные бактерии из семейства Enterobacteriacеae, а из них преимущественно Escherichia coli (E. сoli). При неосложненных ИМП на долю E. сoli и других представителей семейства Enterobacteriacеae приходится до 90–95% всех случаев, тогда как при осложненных ИМП доля кишечной палочки в этиологической структуре снижается до 30–50% и значительно чаще встречаются Proteus spp., Pseudomonas spp., Klebsiella spp., грибы (преимущественно Candida albicans). Особенностью осложненных ИМП является большая доля микробных ассоциаций в этиологической структуре (табл. 1).
Лечение ИМП
Основой терапии ИМП является антибиотикотерапия. Как и при других бактериальных инфекциях, чувствительность возбудителей к антибиотикам имеет решающее значение при выборе препарата для эмпирической терапии ИМП. Лучше всего поддается лечению неосложненная ИМП.
Одними из наиболее часто используемых препаратов для лечения ИМП являются фторхинолоны (левофлоксацин, норфлоксацин, офлоксацин, пефлоксацин и др.), которые во многих международных руководствах указываются как препараты выбора в терапии ИМП. Однако в настоящее время отмечается быстрый рост резистентности уропатогенной E. coli к препаратам этой группы. Считается, что при уровне резистентности в популяции более 10% на применение препаратов вводятся ограничения. В России уровень устойчивости уропатогенной E. coli к фторхинолонам, по данным различных исследований, колеблется от 4,3% до 12,9%, составляя в среднем около 7–8% [1, 2, 6, 7].
Для лечения ИМП у беременных женщин и детей, а также у других категорий пациентов при непереносимости фторхинолонов препаратами выбора являются амоксициллин/клавуланат, цефалоспорины II–III поколений, фосфомицина трометамол, нитрофурантоин [8]. Преимуществом применения амоксициллина/клавуланата является не только его высокая активность в отношении E. coli (уровень резистентности ниже, чем к фторхинолонам), но и отсутствие тератогенного воздействия, что делает возможным его применение в I триместре беременности [9, 10].
Доказана эффективность и безопасность применения цефалоспоринов III поколения у детей и беременных женщин при лечении неосложненной и осложненной ИМП [7]. Отличительной чертой цефалоспоринов III поколения является высокая активность в отношении микроорганизмов семейства Enterobacteriaceae, устойчивость к действию бета-лактамаз, длительный период полувыведения [11].
Использование налидиксовой кислоты и нитрофурантоинов имеет определенные недостатки в связи с необходимостью применения этих препаратов 3–4 раза в сутки, а также слабой активностью нитрофурантоина в отношении Proteus spp., а налидиксовой кислоты — в отношении S. saprophyticus [12].
Длительность антибактериальной терапии зависит от особенностей ИМП. Как правило, при отсутствии факторов риска антибактериальная терапия назначается на 3–5 дней при острой инфекции нижних мочевых путей, на 10–14 дней — при инфекции верхних мочевых путей. При острой осложненной ИМП или при наличии факторов риска применяются те же антимикробные препараты, что и при неосложненной ИМП, однако длительность терапии увеличивается до 7–14 или более дней [13].
Особенностью лечения ИМП в детском возрасте является более длительная, по сравнению со взрослыми, антибактериальная терапия с обязательным курсом противорецидивного лечения.
Поэтому, несмотря на успехи в создании новых антибактериальных препаратов, лечение ИМП, особенно осложненной и рецидивирующей, остается актуальной задачей, часто требующей в своем решении назначения комбинации препаратов или их последовательной смены, длительных противорецидивных курсов. Это неизбежно приводит к повышению частоты развития нежелательных лекарственных реакций терапии, а также формирует порочный круг, т. к. частое и длительное применение антибиотиков приводит к росту популяции резистентной к ним микрофлоры.
В последние десятилетия возрождается значительный интерес к фитотерапии как компоненту комплексной терапии ИМП. Лечебные свойства растений были хорошо известны врачам древности, народная медицина практически всех народов и стран использует их для лечения различных заболеваний. Действие фитопрепаратов в рамках современных исследований представляется нам в новом свете, прежде всего, с точки зрения преодоления антибиотикорезистентности и способности разрушать микробную биопленку на слизистой оболочке мочевых путей.
В комплексной терапии ИМП применяются фитопрепараты, обладающие противовоспалительным, мочегонным, а также кровоостанавливающим действием, что важно при развитии гематурии.
Растительные препараты можно применять в качестве отдельных настоев или травяных сборов. Компоненты различных растений входят также в состав фабричных лекарственных препаратов.
Наиболее широко применяемые при ИМП лекарственные растения представлены в табл. 2, а также описаны ниже [16, 17].
Золотарник (живительная трава, сердечник) — широко применяется в народной медицине различных стран. В Германии настой золотарника рекомендуют, прежде всего, при хронических воспалительных заболеваниях почек и мочевых путей, кристаллурии и мочекаменной болезни, как мочегонное средство. Препараты травы золотарника обладают гипоазотемическим действием. Трава золотарника содержит флавоноиды, сапонины, органические кислоты и эфирное масло, способствующие разрушению мембран бактериальной клетки, каротин, аскорбиновую и никотиновую кислоты.
Хвощ полевой — обладает противовоспалительным, мочегонным и кровоостанавливающим действием. Применяется при ИМП, кристаллуриях и мочекаменной болезни. Благодаря большому содержанию соединений кремния отвары, настои и экстракты хвоща полевого обладают выраженным заживляющим и сосудоукрепляющим действием, способствуют растворению кристаллов солей в моче, ускоряют выведение свинца из организма.
Листья брусники — обладают антимикробным и мочегонным действием. Последнее связано с наличием в листьях брусники гидрохинона. Применяется в виде отвара (2 столовые ложки на 1,5 стакана воды). Назначается по 2 столовые ложки 5–6 раз в день. Также, как и толокнянка, лучше действует в щелочной среде.
Горец птичий (спорыш) — содержит гликозид авикулярин, дубильные вещества, эфирное масло, каротин, аскорбиновую кислоту. Используется как мочегонное, кровоостанавливающее и вяжущее средство. Обладает спазмолитическим действием на мочевые пути. Широко применяется в народной медицине и входит в состав различных сборов.
Петрушка огородная — богата флавоноидами и эфирными маслами. Оказывает непосредственное действие на почечные канальцы, благодаря чему достигается диуретический эффект. Обладает спазмолитическим действием на гладкую мускулатуру мочевых путей и сосудов.
Любисток лекарственный (приворотное зелье) — с медицинской целью используются в основном корни растения. Содержит эфирные масла, органические кислоты, кумарин, дубильные вещества. Обладает выраженным мочегонным и антибактериальным действием. Используется при воспалениях мочевых путей, нарушениях желудочно-кишечного тракта. Как правило, входит в состав комбинированных препаратов и сборов.
Пырей ползучий — содержит эфирные масла, сапонины, инулин, аскорбиновую кислоту, каротин. Обладает диуретическим эффектом благодаря инулину, эфирное масло обеспечивает антисептическое и противовоспалительное действие.
Клюквенный сок, морс (содержит натрия бензоат) — обладает антисептическим действием (увеличивается синтез в печени из бензоата гиппуровой кислоты, которая, выделяясь с мочой, вызывает бактериостатический эффект). Принимают по 2–4 стакана в день.
Сосна лесная — эфирное (скипидарное) масло сосны обладает выраженным бактерицидным, противовоспалительным и мочегонным действием.
При хронических и рецидивирующих инфекциях мочевых путей применяются различные сборы лекарственных трав. Они назначаются, как правило, на долгий период, с чередованием преимущественно бактерицидных и мочегонных сборов. Однако самостоятельное лечение лекарственными растениями таит в себе некоторые опасности. Компоненты многих лекарственных растений в больших дозировках могут быть потенциально ядовиты, оказывать патологическое воздействие на функционирование отдельных органов. Поэтому с точки зрения безопасности в комплексном лечении ИМП предпочтение отдается лекарственным препаратам фабричного производства, правильная дозировка которых обеспечивает высокую эффективность при соблюдении полной безопасности.
Одним из наиболее широко применяемых фитопрепаратов для лечения ИМП является Фитолизин. Фитолизин содержит экстракт смеси растений (золотарника, хвоща полевого, пырея, горца птичьего, листьев березы, любистока, пырея, петрушки, масла шалфея, мяты, сосны и апельсина, семена пажитника), благодаря чему оказывает мочегонное, противовоспалительное, спазмолитическое действие, уменьшает кристаллообразование, способствует растворению кристаллов и конкрементов и выведению их с мочой.
Препарат имеет форму пасты для приготовления суспензии, что обеспечивает легкость его дозировки и применения. Взрослым назначают внутрь по 1 чайной ложке пасты, растворенной в 1/2 стакана теплой сладкой воды, 3–4 раза в день после еды. Фитолизин может применяться в комплексном лечении ИМП вместе с антибиотиками или после их применения на этапе противорецидивной терапии. Препарат широко применяется в качестве профилактического средства при хронических воспалениях мочевых путей. Курс терапии Фитолизином составляет 2–6 недель и при необходимости может быть продлен.
Эффективность лекарственных растений в терапии ИМП доказана многовековым опытом народов мира. Современные комбинированные фитопрепараты, такие как Фитолизин, занимают важное место в комплексной терапии ИМП и позволяют повышать эффективность антибактериальной терапии за счет преодоления резистентности возбудителя к антибиотикам, сокращают курсы антибиотикотерапии, снижают частоту нежелательных лекарственных реакций их применения.
Литература
А. В. Малкоч 1 , кандидат медицинских наук
Н. Н. Филатова, кандидат медицинских наук

Первый антибиотик, пенициллин, появился еще в начале прошлого века. Он стал настоящим спасением для огромного количества людей, особенно во вторую мировую войну – ведь в те времена практически не существовало эффективных лекарств. Но уже тогда было очевидно, что открытое Александром Флемингом вещество действует не только на патогенные микроорганизмы – оно потенциально опасно и для организма пациента. Впоследствии появились новые формы пенициллина (более чистые и безопасные в сравнении с начальной версией), а также другие антибиотики – цефалоспорины, макролиды, тетрациклины, аминогликозиды, левомицетины, линкозамиды и т.д. Только рисков меньше не стало. Да, антибиотики не убивают нас в прямом смысле этого слова, но их длительный и бесконтрольный прием способен нанести немалый урон здоровью. Начинается же всё с того, что страдает полезная микрофлора кишечника, она попросту гибнет.
Воздействие антибиотиков на микрофлору
Антибиотики незаменимы при терапии большого количества серьезных заболеваний дыхательных путей, ЛОР-органов, мочеполовой системы, инфекционных заболеваний кишечника. Поэтому вряд ли стоит ожидать, что в медицинской практике откажутся от их использования – да это и не нужно! Но, поскольку эти вещества не обладают избирательным действием, уничтожая как возбудителей болезней, так и полезные бактерии, их побочное действие зачастую не менее выражено, чем лечебный эффект. К большому нашему сожалению.
Наиболее частым побочным эффектом считается нарушение пищеварения. Возникает расстройство стула и так называемая антибиотик-ассоциированная диарея (ААД). Частота ее появления напрямую зависит от класса принимаемых препаратов и варьирует в пределах 30%. Развитие ААД напрямую проистекает из дисбактериоза, возникающего по причине уничтожения полезной кишечной микрофлоры. Вследствие этого организм человека остается без своих природных помощников, которые способствуют усвоению нами полезных веществ, принимают участие в синтезе витаминов, регулируют стул и улучшают перистальтику кишечника. Одной из основных мишеней антибиотиков становятся лакто— и бифидобактерии, которые в больших количествах гибнут от таких препаратов. Вместо них начинают разрастаться колонии условно-патогенных микроорганизмов, выделяющих продукты своей жизнедеятельности – токсины. При этом, кроме проявлений ААД, возникают боли в животе и ряд других неприятных симптомов. Нередки в таких случаях и колиты.
Серьезно начинает страдать метаболическая функция кишечника, точнее населяющей ее микрофлоры. Плохо перевариваются углеводы, что приводит к плохой их усвояемости организмом. Нарушается процесс расщепления клетчатки до КЦЖК – короткоцепочечных жирных кислот. В результате клетки кишечника начинают испытывать недостаток питания, ухудшается трофика ее слизистой оболочки. Также нарушается всасываемость воды и метаболизм желчных кислот. Поскольку последние активно стимулируют выработку секреции кишечника, возникает секреторная диарея.
Есть ли альтернатива антибиотикам?
Во многих из них – например, девясиле, солодке и толокнянке – содержатся гликозиды. Многие из этих органических соединений (их еще называют теоловыми гликозидами или фитонцидами) по своему действию подобны антибиотикам. Их использование доказало свою эффективность в борьбе с вредными микроорганизмами, однако при этом отсутствуют побочные явления, не говоря уже о привыкании и осложнениях. Специалисты рекомендуют: если лечение вашего заболевания в острой форме невозможно без синтетических антибиотиков, то при хроническом его течении применяйте природные антибиотики. Согласовав, конечно, этот вопрос с лечащим врачом, потому что лекарственные препараты тоже не следует принимать бесконтрольно. Кроме названных растений настоящим кладезем фитонцидов являются лук и чеснок, хрен и клюква, яблоки, цитрусовые и кизил. В чесноке еще имеется вещество аллин. Взаимодействуя с пищевыми ферментами, оно превращается в аллицин, которое известно своими выраженными бактерицидными свойствами.
Пробиотики – лучшая защита микрофлоры
Нормофлорины Л, Б, Д
Как можно нормализовать микрофлору кишечника, ставшую жертвой традиционной антибиотикотерапии? Этот вопрос более чем актуален сегодня для большого количества людей, однако ответ на него один – здесь могут помочь только пробиотики. Так называются специальные средства, способные не только поддержать и восстановить нормальную кишечную микрофлору, но и заселить кишечник такой микрофлорой. Уникальность и преимущество пробиотиков в том, что в своем составе они содержат живые штаммы полезных бактерий. При заселении ими кишечника условно-патогенная флора вынуждена сдавать свои позиции. В результате система пищеварения восстанавливается до своего здорового состояния, предшествовавшего курсу приема антибиотиков.
Помимо восстановления нормальной работы кишечника и улучшения пищеварения пробиотики участвуют в укреплении местного и общего иммунитета, синтезируют столь необходимые нам витамины как группы В и К. Все эти жизненно важные процессы происходят благодаря активной работе лакто- и бифидобактерий, которые находятся в составе пробиотических комплексов. Упреждая ваши возможные сомнения, отметим: применение пробиотиков в качестве восстановительного средства после антибиотикотерапии абсолютно безопасно. Что же касается эффективности, то судить о ней можно на примере биокомплексов, известных как Нормофлорины. Это специальные натуральные препараты, выпускаемые в жидкой форме, представляющие собой смесь лактобактерий и бифидобактерий с продуктами их жизнедеятельности – витаминами и минеральными веществами, антимикробными нутриентами и органическими кислотами. Помимо всего Нормофлорины содержат очень ценный ингредиент – дисахарид лактитол, служащий превосходным питанием для собственной микрофлоры человека, тем самым стимулируя ее рост и развитие.
Первым из отечественных ученых, кто серьезно исследовал влияние пробиотиков на восстановление микрофлоры, был И.И. Мечников. Свою работу он строил на основе наблюдений за молочнокислой палочкой, придя к отличным результатам. Впрочем, пробиотиками не обязательно являются только бактерии. К ним могут относиться и другие простейшие. Скажем, дрожжевые грибки.
Когда пробиотики особенно эффективны?

Некоторые натуральные вещества обладают антибактериальными свойствами, но какие из них безопасны в использовании, и когда следует их использовать? Рецептурные антибиотики, такие, как пенициллин, помогают людям вылечиваться от смертельных заболеваний с 1940г.
Тем не менее, люди нередко используют для лечения природные антибиотики.
Согласно данным статистики, 1 из 10 человек испытывает побочные эффекты, которые вредят пищеварительной системе после приема антибиотиков. 1 из 15 человек приобретает аллергию к этому этому типу лекарства.
В этой статье мы рассмотрим свойства семи лучших натуральных антибиотиков, а также веществ, приема которых следует избегать и когда обращаться к врачу.
Семь лучших натуральных антибиотиков

Подпись к картине: Чеснок может быть эффективным средством против бактерий.
Научное сообщество по-прежнему изучают природные антибиотики. Люди использовали их сотни лет, но большинство до сих пор не исследованы со всей тщательностью.
Тем не менее, некоторые из них показывают многообещающие результаты в медицинских обзорах, и дальнейшие исследования продолжаются.
С увеличивающимся ростом числа лекарственно-устойчивых бактерий, при разработке новых лекарств ученые ищут ответа у природы.
Лучшие природные антибиотики.
1.Чеснок
Чеснок уже давно признан во всем природным антибиотиком за его профилактические и лечебные свойства.
Исследования показали, что чеснок может быть эффективным методом лечения в отношении многих видов бактерий, включая Сальмонеллы и кишечную палочку (E. сoli). Чеснок даже используется в лечении мульти-резистентного к антибиотикам туберкулеза.

Со времен Аристотеля мед использовался как мазь которая помогает излечивать раны и предотвращает или развитие инфекции.
Специалисты здравоохранения сегодня нашли его полезным в лечении хронических ран, ожогов, язв, пролежней и кожных трансплантатов. Например, результаты исследования от 2016 демонстрируют что тканевые повязки с медом могут помочь заживлению ран.
Антибактериальное действие меда обычно приписывают содержанию в нем перекиси водорода. Однако мед манука также борется с бактериями, хотя и имеет более низкое содержание перекиси водорода.
Исследование 2011 года сообщило, что самый известный тип меда блокирует приблизительно 60 видов бактерий. Оно также предлагает, что мед успешно лечит раны, зараженные метициллин-устойчивым золотистым стафилококком (MRSA).
Другое антибактериальное свойство, меда — он может помочь ранам заживать путем создания защитного покрытия, которое обеспечивает наличие влажной окружающей среды.
3.Имбирь
Научное сообщество также признает имбирь как природный антибиотик. Несколько исследований, включая одно, опубликованное в 2017 году, продемонстрировали способность имбиря успешно сражаться со многими штаммами бактерий.
Исследователи также изучают имбирь в борьбе с морской болезнью и тошнотой и его способность понижать уровень сахара в крови.
4.Эхинацея

Эхинацея используется для лечения инфекций в течение многих лет.
Коренные американцы и другие знахари использовали эхинацею в сотни лет для лечения инфекций и ран. Исследователи начинают понимать почему.
В исследовании, опубликованном в журнале Биомедицина и биотехнологии сообщается, что экстракт эхинацеи пурпурной может убивать много различных видов бактерий, включая Стрептококк пиогенный (С. pyogenes).
Эхинацея может также снимать воспаление, связанное с бактериальной инфекцией.
5.Желтокорень (гидрастис)
Гидрастис обычно употребляют в чай или в виде капсул для лечения респираторных и желудочно-кишечных заболеваний. Однако, он может также вылечить диарею бактериального генеза и инфекции мочевыводящих путей.
Кроме того, результаты недавнего исследования подтверждают эффективность использование желтокорня для лечения кожных инфекций. В лаборатории вытяжка гидрастиса была использована для того чтобы предотвратить заражение тканей mrsa (Метициллинрезистентный золотистый стафилококк).
Человек, принимающий лекарства, должен проконсультироваться с врачом, прежде чем принимать гидрастис, так как эта добавка может вызвать побочные действия.
Желтокорень содержит берберин- важный компонент природных антибиотиков. Этот алкалоид не безопасен для младенцев и женщин во вhемя беременности и кормления грудью.
6.Гвоздика

Гвоздика традиционно используется в стоматологических процедурах. Новое исследование показало, что вытяжка из гвоздики может быть эффективна против многих видов бактерий, включая E. coli.
7.Орегано
Некоторые считают, что орегано повышает иммунитет и действует как антиоксидант. Он также может иметь противовоспалительные свойства.
Пока ученые должны проверить эти заявления, некоторые исследования показывают что орегано входит в число наиболее эффективных природных антибиотиков, особенно в форме масла.
Риски природных антибиотиков
Просто потому, что что-то называется природным, это не обязательно безопасно.
Количество и концентрации активных ингредиентов различаются у разных производителей биодобавок. Внимательно читайте состав. Желательно также сообщить своему лечащему врачу, если вы планируете прием каких-то добавок.
Термически обработанный чеснок обычно безопасен для употребления, но исследование предлагает что приём концентрированного чеснока может увеличить риск кровотечения. Это может быть опасно для людей перед хирургическими вмешательствами или для тех, кто принимает разжижающие кровь препараты.
Концентраты чеснока могут также уменьшить пользу лекарств от ВИЧ.
Следует избегать приема некоторых препаратов, содержащих определенные вещества, в том числе коллоидное серебро. Это вещество состоит из микроскопических кусочков серебра, взвешенных в воде.
Коллоидное серебро рекомендовано в качестве лечения различных заболеваний, включая бубонную чуму и ВИЧ. Однако, согласно национальному центру для Комплементарного и Интегративного здоровья, может быть опасно, и никакие заслуживающие доверия исследования не подтверждают его пользу.
Добавки, содержащие коллоидное серебро могут влиять на эффективность антибиотиков и лекарств, используемых для лечения заболеваний щитовидной железы.
Серебро также может накапливаться в организме и изменять цвет кожи на сизо-серый. Это состояние называется аргирией и является постоянным у большинства людей.
Рецептурные антибиотики

Антибиотики могут быть назначены для ускорения выздоровления или предотвращения распространения инфекционных заболеваний.
В связи с нынешним увеличением числа заболеваний, устойчивых к лекарственным препаратам, большинство врачей не назначают антибиотики, если они не являются эффективными и необходимыми.
Антибиотики чаще всего назначают:
- Для предотвращение распространения инфекционных заболеваний
- Для предотвращения развития более серьезного заболевания или осложнения
- Быстрого восстановления после болезни или травмы
Если человеку назначают антибиотики, он должен принимать всю дозировку по назначению. Это особенно важно для людей с более высоким риском бактериальной инфекции:
- запланированная операция
- прием химиотерапии
- ВИЧ-позитивный
- прием инсулина при сахарном диабете
- пациентам с ердечнаой недостаточностью
- восстановление после серьезных ран
- старше 75 лет
- младше 3 дней
Когда есть индивидуальноя аллергическая реакция к антибиотикам или появляются побочные эффекты, можно обсудить другие варианты с доктором.
Выводы
По данным центров по контролю и профилактике заболеваний (CDC), ежегодно более 2 миллионов американцев заболевают лекарственно-устойчивыми инфекциями, в результате чего ежегодно умирает 23 000 человек.
Эти бактерии представляют собой растущую угрозу, и ключ к разработке новых и эффективных лекарств может лежать в народной медицине — лечении природными антибиотиками.
В то время, как природные антибиотики могут представлять возможности, они также несут риски. Тем не менее, исследования в области этих методов лечения растут, и все большее число веществ проходит испытания.
Природные антибиотики, традиционно используемые на протяжении веков, могут способствовать спасению будущего.
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
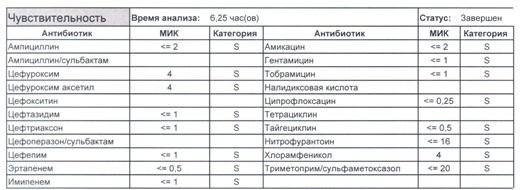
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
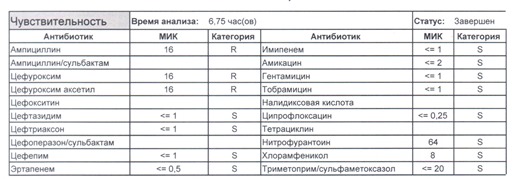
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
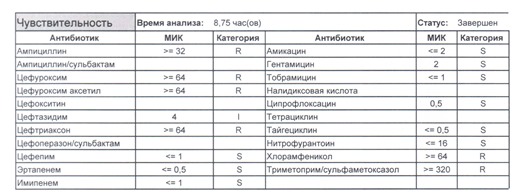
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
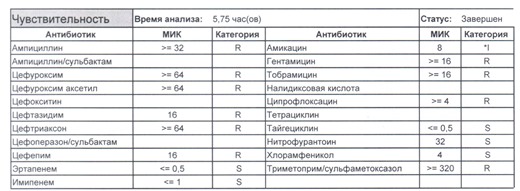
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения
Читайте также:

