Проба минора при лепре
Обновлено: 19.04.2024
Прогноз лепры. Диагностика лепры
Лепра редко является непосредственной причиной гибели больных, однако смертность среди лепроматозных пациентов вчетверо выше, чем в популяции в целом. Основными причинами смерти у нелеченных больных лепрой служат интеркуррентные Выявление больных лепрой производится на основании анализа комплекса клинико-эпидемиологических и лабораторных данных. В эндемических районах лепру необходимо предполагать у пациентов с наличием одного из следующих кардинальных признаков: 1) соответствующие лепре кожные поражения с четкой утратой чувствительности и с утолщением или без утолщения нервов; 2) положительный результат биопсии кожи.
Дифференциальный диагноз проводят с туберкулезом кожи, язвой Бурули, кожным лейшманиозом, дерматомикозами, сифилитическими поражениями, остеомиелитом, злокачественными новообразованиями кожи. Часто дифференцируют лепру и сирингомиелию, при которой, в отличие от лепры, нарушения чувствительности носят сегментарный характер, моторные расстройства превалируют над сенсорными.
Специфическая диагностика лепры заключается в обнаружении микобактерий в соскобе со слизистой оболочки носа и из очагов поражения кожи, в пунктате из лимфатических узлов при микроскопии препаратов, окрашенных по Ziehl-Neelsen. Соскоб из кожных элементов получают путем неглубокого (бескровного) надреза кожи в предварительно обескровленном при сжатии участке. Результаты исследования выражают в виде бактериологического индекса
Важное диагностическое значение, особенно в случаях РБ-лепры, имеет гистологическое изучение кожных биоптатов с определением морфологического индекса (morphological index — MI), позволяющее выявить характерные для различных типов лепры изменения.
Лепроминовый тест (реакция Mitsuda), выявляющий реакцию гиперчувствительности клеточного типа, применяется для более точного разграничения форм лепры, выбора терапии и контроля ее эффективности. Стандартный лепромин Mitsuda является ав-токлавированной суспензией М. leprae из гомогенизированной ткани лепром и содержит около 160 млн микобактерий в 1 мл. Лепромин вводится внутрикожно по 0,1 мл.
В случае положительной реакции через 48 ч в месте инъекции возникают эритема или папула (ранняя реакция Fernandez), а спустя 2-4 нед — бугорок или узел, в ряде случаев с последующим некрозом и рубцеванием (реакция Mitsuda), результаты оцениваются в баллах (1+, 2+ и 3+).
У больных ТТ-лепрой и 80-98% здоровых людей реакция Mitsuda положительна, но может на короткое время становиться отрицательной в период лепрозной реакции. При BB-лепре реакция Mitsuda может быть как положительной, так и отрицательной и изменяется в зависимости от направленности процесса по нисходящему (становится отрицательной) или по реверсивному (становится положительной) типам. У больных ZZ-лепрой лепроминовый тест стойко отрицателен.
При гистаминовой и морфинной пробах на поверхность исследуемого пятна наносят каплю раствора гистамина (1:1000) или 1% раствора морфина, затем производят укол иглой, не проникающий в дерму. На коже здоровых людей и в непораженных участках кожи у больных лепрой, а также у пациентов с нелепрозными высыпаниями возникает первичная и вскоре вторичная эритема диаметром несколько сантиметров, в центре которой через несколько минут появляются волдыри или папулы, иногда с некрозом (триада Lewis); в очагах лепрозных поражений вторичная эритема не выражена или отсутствует.
При пробе на потоотделение кожу смазывают реактивом Minor (2 г йода, 15 г крахмала и 98% спирта до 100 мл) или спиртовым раствором йода с последующим припудриванием крахмалом. После сухожаровой ванны участки кожи с нормальным потоотделением принимают синий цвет, пораженные участки с ангидрозом сохраняют цвет йода При применении горчичников в области лепрозного поражения кожи характерная эритема не развивается.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Лепра диагностируется только при наличии клинических признаков болезни. Как указывалось выше, клиническая симптоматика поражения органа зрения у больных лепрой обнаруживается лишь спустя много лет после начала заболевания. Следовательно, основой для установления лепрозной этиологии заболевания глаз служат прежде всего клинические проявления болезни, выражающиеся главным образом в многообразных дерматологических и неврологических симптомах и характеризующиеся хроническим течением с периодическими обострениями.
Установлению диагноза способствуют данные эпидемиологического, рентгенологического, функционального и лабораторных исследований.
Основными рентгенологическими признаками являются очаговая специфическая воспалительная деструкция костной ткани (лепромы), наблюдающаяся при лепроматозном типе лепры, и периоститы, гиперостозы и трофические изменения (оетеопороз и остеолиз), встречающиеся при всех типах лепры.
Как известно, лепрозные моно- и полиневриты сопровождаются не только сенсорными и двигательными, но и вазомоторными, секреторными и трофическими нарушениями. С целью диагностики последних применяют функциональные и фармакодинамические пробы: с гистамином (или морфином, дионином), никотиновой кислотой, горчичником, а также пробу Минора.
Проба с гистамином выявляет поражение периферической нервной системы. На пораженный участок и на внешне не измененную кожу наносят по одной капле 0,1% раствора гистамина (или 1% раствора морфина, 2% раствора дионина) и производят поверхностный надрез кожи. В норме наблюдаются три фазы реакции (триада Льюиса): на месте надреза кожи появляется небольших размеров эритема, через 1-2 мин развивается значительно больших размеров рефлекторная эритема (диаметром в несколько сантиметров), возникающая по типу аксон-рефлекса, спустя еще несколько минут в центре ее образуется папула или везикула. На высыпаниях лепрозной этиологии (иногда и на внешне неизмененной коже) вследствие поражения нервных окончаний в коже рефлекторная эритема не развивается.
Проба с горчичником применяется у больных с гипопигментными пятнами кожи, в области которых эритема не появляется вследствие вазомоторных нарушений.
Проба на потоотделение (Минора) заключается в следующем. Исследуемый участок кожи смазывают содержащим йод реактивом Минора или 2-5% спиртовым раствором йода и припудривают крахмалом. Затем стимулируют потоотделение. На участках здоровой кожи с нормальным потоотделением появляется синее окрашивание. На лепрозных поражениях кожи вследствие ангидроза синяя окраска не возникает.
Обследование органа зрения у больных лепрой должно включать наружный осмотр глаза и его вспомогательных органов, определение подвижности глазных яблок, изучение зрачковых реакций на свет, аккомодацию и конвергенцию, исследование преломляющих сред в проходящем свете, офтальмоскопию, биомикроскопию, гониоскопию, биомикроофтальмоскопию, исследование чувствительности бульбарной конъюнктивы и роговицы, определение остроты зрения, периметрию, кампиметрию, адаптометрию и тонометрию.
Для раннего выявления утомляемости круговой мышцы век Ю. И. Гарус (1959) предложил мигательную пробу. Больному предлагают в течение 5 мин производить непрерывные мигательные движения век. В норме эти движения прекращаются через 5 мин. При поражении круговой мышцы век ее утомление, выражающееся в неполном смыкании век, наступает через 2-3 мин.
При обследовании больных с подозрением на лепру применяют бактериоскопические, гистологические и иммунологические методы исследования.
Бактериоскопическому исследованию подвергают соскобы со слизистой оболочки перегородки носа, скарификаты из пораженных участков кожи и пунктат лимфатических узлов. При поражениях органа зрения исследуют отделяемое из конъюнктивального мешка, соскоб с конъюнктивы глазного яблока и век, с роговицы, влагу передней камеры глаза. Мазки окрашивают по Цилю-Нильсену. Результаты бактериоскопических исследований зависят от типа и стадии лепры, обострений и эффективности лечения лепрозной инфекции.
Материалом для гистологических исследований обычно служат биопсированные кусочки кожи. В случае энуклеации глазного яблока исследуют его оболочки. Гистологические срезы окрашивают по Романовскому-Гимзе и Цилю-Нильсену. Результаты гистологических исследований (чаще всего биопсированных кусочков кожи) имеют значение для классификации типа лепры, изучения динамики лепрозного процесса, оценки эффективности лечения, определения сроков стационарного лечения и диспансерного наблюдения.
Серологическая диагностика лепры с использованием реакции РСК, РИГА, РНИФ и др. находится в стадии изучения.
С целью определения резистентности организма к микобактериям лепры ставят лепроминовую пробу, предложенную К. Mitsuda в 1919 г. В реакции используют лепромин-антигеп Мицуды (получаемая из лепромы автоклавирокаипая суспензии микобактерий лепры). Это так называемый интегральный антиген, применяемый чаще всего. Предложены и другие антигены. В кожу плеча или предплечья больного вводят 0,1 мл лепромина. При положительном результате па месте введения антигена через 48 ч определяются гиперемия и папула. Это ранняя реакция на лепромин (реакция Фернандеса). Через 2-4 нед развивается бугорок, иногда изъязвляющийся узелок. Это поздняя реакция на лепромин (реакция Мицуды). В течение 3-4 мес формируется рубец, обычно гипопигментированный, сохраняющийся много лет.
Положительный результат реакции Мицуды свидетельствует о выраженной способности организма к развитию ответной реакции на введение микобактерий лепры, что и наблюдается у большинства здоровых людей.
Отрицательный результат реакции Мицуды свидетельствует об угнетении клеточных реакций иммунитета.
У больных с лепроматозным типом лепры проба с лепромином отрицательная, при туберкулоидном типе - положительная, при недифференцированном - положительная примерно в 50 % случаев, при пограничном - обычно отрицательная. У детей до 3 лет реакция Мицуды отрицательная.
Таким образом, лепроминовая проба имеет значение для определения типа лепры, прогноза заболевания и состояния резистентности организма. Клеточный иммунитет при лепре изучается также в реакциях in vitro (реакция бласттрансформации лимфоцитов. ж др.).
Клинические проявления лепры многообразны и требуют тщательной дифференциации от многих заболеваний кожи, слизистой оболочки верхних дыхательных путей, периферической нервной системы, лимфатических узлов и органа зрения, имеющих ряд входных черт с проявлениями лепры (узловатая эритема, бугорковый сифилид, сифилитические гуммы, туберкулезная волчанка, саркоидоз, сирингомиелия, миелодисплазии, рассеянный и боковой амиотрофический склероз, воспалительные заболевания слизистой оболочки носа и гортани, лимфатических узлов, органа зрения туберкулезной и сифилитической этиологии и др.).

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Рассмотрены подходы к диагностике истинного (вестибулярного, системного) головокружения. Предложен ряд простых диагностических тестов, не требующих применения дополнительного оборудования, которые помогают достаточно точно определить уровень поражения вес
Approaches to the diagnostics of genuine (vestibular, systemic) giddiness were presented. A number of easy diagnostic tests was suggested which doesn’t require the application of additional equipment. These tests help to identify the level of the vestibular system affection quite precisely.
Головокружение — ощущение неуверенности в определении своего положения в пространстве, кажущееся вращение окружающих предметов или собственного тела, ощущение неустойчивости, потеря равновесия, уход почвы из-под ног.
Истинное (вестибулярное, системное) головокружение связано с раздражением определенных участков вестибулярного анализатора и в зависимости от уровня поражения бывает периферическим и центральным. Периферическое вестибулярное головокружение (vertigo) возникает при поражении сенсорных элементов ампулярного аппарата и преддверия, вестибулярного ганглия и нервных проводников ствола мозга. Центральное вестибулярное головокружение возникает при повреждении связи с вестибулярными ядрами в стволе мозга, нарушении связей с мозжечком, медиальным продольным пучком, с глазодвигательными ядрами и их собственными связями, нарушении вестибулоспинальных и вестибулоретикулярных связей (тракта), а также связей с корой головного мозга [1].
Наиболее часто встречающиеся случаи системного головокружения можно разделить на три группы:
1) головокружение, сопровождающееся тугоухостью;
2) головокружение, не сопровождающееся тугоухостью;
3) головокружение с центральными неврологическими симптомами [2].
Периферическое вестибулярное головокружение — это головокружение приступообразного характера различной интенсивности (от слабых до бурных атак). При остром начале пациенты ощущают движение предметов в сторону больного уха, в эту же сторону направлен и нистагм, в стадии угнетения — в противоположную сторону. Продолжительность приступов может колебаться от минут до нескольких часов, недель, месяцев. Периферическое головокружение всегда сопровождается спонтанным нистагмом — клоническим, горизонтальным или горизонтально-ротаторным, разной интенсивности, степени, ассоциированным с гармоничным отклонением туловища и рук в сторону медленного компонента. Отмечается положительное влияние поворота головы (в сторону медленного компонента нистагма). Как правило, периферическое вестибулярное головокружение — процесс односторонний и сопровождается нарушением слуховой функции на пораженной стороне [1].
Периферическое вестибулярное головокружение обычно интенсивнее, чем центральное, и сопровождается вегетативными проявлениями (тошнотой, рвотой, побледнением, потливостью и др.). При центральном головокружении тошнота и рвота обычно отсутствуют; при изменении позиции глаз вправо или влево — изменяется и направление нистагма, а также отсутствует гармоничное отклонение рук.
Врачу следует акцентировать внимание на описании вращательного головокружения, уточнить направление движения неподвижных предметов видимой обстановки или собственного тела (свидетельствует об истинности головокружения).
Ощущение продолжения движения при торможении или ощущение избыточного заноса при повороте транспортного средства характерны для отолитового синдрома.
Ощущения толчка вперед, назад, в стороны (пропульсия, ретропульсия, латеропульсия) с высокой долей вероятности указывают на поражение ствола мозга.
Диплопия, дизартрия, потеря чувствительности, парезы, сопутствующие головокружению, характерны для повреждения задней черепной ямки (включая ишемию), базилярной мигрени.
Сведения о продолжительности головокружения важны для установки предположительного диагноза и сужения рамок дифференциально диагностического поиска.
На природу головокружения указывают и провоцирующие вестибулярную атаку факторы.
Ряд простых диагностических тестов, не требующих применения дополнительного оборудования, помогают достаточно точно определить уровень поражения вестибулярной системы.
1. Исследование спонтанного нистагма (n. Spontaneus — SpNy) проводят при взоре прямо, вправо, влево. Расстояние от глаз испытуемого равно до предмета, на котором фиксируется взор, 30–50 см, отведение — 30°, направление Ny определяют по его быстрой фазе (качество исследования повышается при использовании очков Френцеля (Френзеля) (Frenzel glasses) (+ 20D), электронистагмогафии/видеонистагмографии). Нистагм оценивают по направлению; по интенсивности: I ст. — при взоре в сторону быстрого компонента, II ст. — при взоре прямо, III ст. — при взоре в сторону медленного компонента, по амплитуде (мелкоразмашистый, среднеразмашистый и крупноразмашистый) и частоте.
При периферическом головокружении спонтанный нистагм горизонтальный или горизонтально-ротаторный, клонический, однонаправленный и соответствующий раздражению или угнетению лабиринта. При центральном — спонтанный нистагм является ассоциированным с гармоничным отклонением туловища и рук в сторону его медленного компонента. Спонтанный нистагм отсутствует либо является множественным — разнонаправленным, меняющимся, клонотоничным, не соответствующим выраженности головокружения.
4. Оптокинетический нистагм исследуют с помощью вращающегося барабана с нанесенными на него черными и белыми полосами. Барабан вращается рукой исследователя или приводится в движение мотором с определенной скоростью. Больной располагается на расстоянии 1 метра от цилиндра. Частота оптокинетического нистагма увеличивается по мере возрастания скорости вращения цилиндра с 1 до 6 об./мин. Для ретролабиринтных нарушенияй характерны дизритмия, полное выпадение реакций или изменение формы нистагменных циклов.
5. Проба Ромберга проводится для выявления статической атаксии. Больной стоит, плотно сдвинув ступни и закрыв глаза, руки у обследуемого подняты вперед, пальцы разведены. При вестибулярной атаксии (при поражении вестибулярного аппарата от рецепторного аппарата до ядер в стволе) покачивание или падение происходит в сторону менее активного лабиринта. При слабо выраженных проявлениях дистаксии, а также с экспертной оценкой пробы Ромберга усложняется (например, пациента просят оторвать одну из ступней от пола).
6. Проба Бабинского–Вейля. Пациента просят с закрытыми глазами повторить несколько раз пять шагов вперед и пять шагов назад по прямой линии. При заболеваниях преддверно-улиткового органа отмечается значительное отклонение от первоначального направления, иногда на 90° и более, в сторону патологического очага. Проба также положительна при некоторых заболеваниях мозжечка. Пациент отклоняется от намеченного направления в сторону поражения, траектория его передвижений образует фигуру звезды.
7. Шаговый тест Унтерберга/Фукуды. На полу рисуют три концентрические окружности с диаметрами 0,5 м, 1 м и 1,5 м. В этих окружностях чертят четыре перпендикулярные линии. Больному предлагают стать в центре и подравняться по одной из линий. Далее ему предлагают сделать 100 шагов на месте с закрытыми глазами [5]. При выполнении пробы учитывают три важнейших параметра: 1) расстояние смещения; 2) угол смещения; 3) вращение (угол поворота). Нормальным является линейное смещение вперед на расстояние в пределах 0,2–1,0 м, на угол до 30° и поворот до 30°. Отсутствие смещения или смещение назад, особенно сочетанное с широким раскачиванием, рассматривают как грубое нарушение. Направление смещения может указывать латерализацию периферического поражения. Примечание: иногда стоит корректировать нормативные данные с учетом роста и длины шага пациента.
8. Проба Циммермана. Больного устанавливают в позу Ромберга с открытыми глазами и предлагают максимально отклониться назад. Применяется для дифференциальной диагностики причины нарушения статического равновесия: обусловлены ли они поражением вестибулярного анализатора или связаны с заболеванием мозжечка. В норме и при поражении вестибулярного аппарата вместе с отклонением туловища назад одновременно наблюдается сгибание ног в коленных суставах. У больных с поражением мозжечка ноги при этом не сгибаются, остаются прямыми. Аналогичная картина отмечается и при выполнении данной пробы с закрытыми глазами (проба должна производиться с помощником, который подстраховывает больного в случае потери им равновесия).
10. Head-thrust test (HTT)/Head-impulse test (HIT). Пациент фиксирует взгляд на переносице врача, шея пациента расслаблена. Врач резко поворачивает голову пациента в сторону и наблюдает за движением глаз во время поворота. В норме при резком повороте головы глаза смещаются в противоположную повороту сторону, что позволяет сохранить фокус на цели. При угнетении лабиринта глаза пациента сначала следуют вместе с головой, а после остановки возникает саккада рефиксации взора на цели (переносице врача).
11. Head-shake test (HST). Пациент опускает голову вперед на 30° (горизонтальный полукружный канал в горизонтальной плоскости). Врач поворачивает (встряхивает) голову пациента из стороны в сторону с амплитудой 30° и частотой 2 Гц в течение 20 секунд. Возникающий после встряхивания головы нистагм — симптом нарушения баланса между горизонтальными полукружными каналами (находившимися в плоскости вращения). При поражении периферического отдела вестибулярного анализатора нистагм направлен в сторону более активно работающего лабиринта. При центральном вестибулярном синдроме нистагм длительный, вертикальный (после встряхивания головы в горизонтальной плоскости), движение глаз во время нистагма несопряженное.
12. Тест субъективной вертикали. Попросите пациента закрыть глаза и дайте карандаш, попросив держать его вертикально. Нарушение восприятия вертикали свидетельствует о поражении мешочков преддверия лабиринта. В норме отклонение субъективной вертикали пациента от эталона составляет не более 5°.
Антихолинэстеразные средства в неврологической практике применяются для активации процессов регенерации и реиннервации при заболеваниях периферической и центральной нервной системы.
Фармакологические эффекты антихолинэстеразных препаратов приводят к усилению действия ацетилхолина. Выбор препарата из группы антихолинэстеразных средств определяется его фармакологическими свойствами, длительностью действия, активностью, способностью проникать через тканевые барьеры, а также побочными эффектами.
Прозерин — N-(мета-диметилкарбамоилоксифенил)-триметиламмонийметил-сульфат обладает сильной обратимой антихолинэстеразной активностью. Основой механизма его действия является ингибирование ацетилхолинэстеразы — фермента, гидролизующего медиатор ацетилхолин, которое сопровождается замедлением скорости его разрушения, накоплением и усилением действия в области холинергических синапсов с восстановлением нервно-мышечной проводимости.
В связи с наличием в молекуле Прозерина четвертичной аммониевой группы, препарат плохо проникает через гематоэнцефалический барьер и оказывает в основном влияние на периферические холинергические структуры.
Существенным отличием Нейромидина (ипидакрина) от Прозерина является способность Нейромидина блокировать калиевую проницаемость мембраны, что приводит к продлению реполяризационной фазы потенциала ее действия и повышению активности пресинаптического аксона. Этот процесс сопровождается увеличением входа ионов кальция в пресинаптическую терминаль и, как следствие, усилением выброса медиатора ацетилхолина в синаптическую щель во всех синапсах, способствуя усилению стимуляции постсинаптической клетки.
Кроме того, Нейромидин обладает эффектом обратимого ингибирования холинэстеразы в холинергических синапсах, что дополнительно увеличивает накопление нейромедиатора в синаптической щели и соответственно усиливает функциональную активность постсинаптической клетки. Однако торможение действия ацетилхолинэстеразы у Нейромидина менее выражено по сравнению с Прозерином.
Таким образом, Нейромидин стимулирует пресинаптическое нервное волокно, увеличивает выброс нейромедиатора в синаптическую щель, уменьшает разрушение медиатора ацетилхолина ферментом, повышает активность постсинаптической клетки прямым мембранным и опосредованным медиаторным воздействием, то есть действует на все звенья проведения возбуждения, в отличие от Прозерина, который уменьшает метаболизм медиатора только в холинергических синапсах.
М-холиномиметические эффекты Прозерина и Нейромидина схожи, однако активность воздействия на М-холинорецепторы у Прозерина выше.
Нейромидин обладает следующими фармакологическими эффектами: восстанавливает и стимулирует нервно-мышечную передачу, проводит импульс в периферической нервной системе, нарушенный вследствие воздействия различных факторов. Нейромидин увеличивает сократительную активность мышц под влиянием ацетилхолина и других медиаторов: адреналина, серотонина, гистамина и окситоцина, оказывая прямое воздействие на миофибриллы, в то время как Прозерин таким свойством не обладает.
Нейромидин, в отличие от Прозерина, стимулирует проведение нервного импульса не только в нервно-мышечном синапсе, но и в ЦНС, что объясняет положительное влияние этого препарата на мнестические процессы.
Следует обратить внимание на чрезвычайно важное, хотя и умеренно выраженное свойство Нейромидина — способность блокировать натриевую проницаемость мембраны. С этим эффектом связаны его седативные и анальгетические свойства. Кроме того, препарат обладает антиаритмическим эффектом.
Прозерин и Нейромидин метаболизируются в печени, а выводятся в основном за счет почечных механизмов. В неизмененном виде выделяется 50% Прозерина и 3,7% Нейромидина, что свидетельствует об ускоренном метаболизме Нейромидина. Начальный эффект от введения Прозерина отмечается, в среднем, через 10–15 минут, а от введения Нейромидина — через 15–20 минут. Продолжительность действия Нейромидина — 3–5 часов, что связано с длительной блокадой калиевой проницаемости мембраны, а Прозерин заканчивает свое действие через 2–3 часа после его введения.
Прозерин в результате воздействия на Н-холинорецепторы приводит к значительному повышению силы сокращения скелетных мышц и благодаря этому показан к применению в первую очередь у больных с миастенией и миастеническим кризом. Также препарат используется в неврологической практике при параличах, парезах, возникающих после механических травм, остаточных явлениях перенесенного менингита, полиомиелита, энцефалита и при невропатиях.
Благодаря мускариноподобным эффектам Прозерин используется для устранения послеоперационной атонии кишечника и мочевого пузыря, изредка при слабости родовой деятельности, иногда в офтальмологической практике при открытоугольной форме глаукомы.
В связи с тем что Прозерин облегчает передачу возбуждения в вегетативных ганглиях, он показан при отравлениях ганглиоблокаторами. Кроме того, Прозерин эффективен при передозировке миорелаксантов антидеполяризующего действия (мышечная слабость, угнетение дыхания).
Показания к применению Нейромидина шире, так как в его основе лежит биологически выгодная комбинация двух молекулярных эффектов (блокада калиевой проницаемости мембраны и ингибирование холинэстеразы) и он стимулирует структурные образования ЦНС. Это не только поражения периферической нервной системы: нейропатии, полинейропатии, миелополирадикулоневриты, миастения и миастенический синдром, рассеянный склероз и другие формы демиелинизирующих заболеваний нервной системы (в комплексной терапии), но и бульбарные параличи и парезы при органических поражениях ЦНС в восстановительном периоде, а также нарушения памяти, внимания, мотивации и инициативы различного генеза, дезориентация, эмоциональная лабильность при сенильной деменции, болезнь Альцгеймера и другие формы слабоумия позднего возраста, энцефалопатии травматического, сосудистого и другого генеза, сопровождающиеся не только нарушением памяти, но и двигательных функций.
Нейромидин, также как и Прозерин, используется при атонии кишечника и интоксикации антихолинергическими средствами.
Сопоставление клинического эффекта Нейромидина и Прозерина при миастении показало, что Прозерин по своему антихолинэстеразному действию значительно превосходит Нейромидин. Добиться полной компенсации двигательных расстройств у пациентов с миастенией можно, только используя Прозерин. Однако его применение ограничивает большое число побочных эффектов.
Вместе с тем отмечена эффективность Нейромидина в комплексном лечении больных миастенией и миастеническими синдромами, так как он дополняет действие Прозерина. Оба препарата улучшают передачу возбуждения в нервно-мышечном синапсе, и хотя Нейромидин слабее по антихолестеразной активности, но выигрывает в длительности действия.
Нейромидин приводит к урежению миастенических кризов, более быстрому наступлению и увеличению длительности ремиссий, повышению сократительной активности мышц, улучшению общего состояния больных.
По данным Российского миастенического центра Нейромидин продемонстрировал максимальную эффективность у пациентов с миастеническим синдромом Ламберта–Итона в отличие от Прозерина, при этом отмечено относительное снижение выраженности вегетативно-трофических нарушений.
И все же достоверным дифференциально-диагностическим тестом в диагностике острых состояний при миастении, а именно миастенических и холинергических кризах, является введение Прозерина. Проба с Прозерином при миастеническом кризе позитивная и проявляется в увеличении силы мышцы или ее полном восстановлении, а при холинергическом кризе — негативная.
Нейромидин в лечении больных демиелинизирующими заболеваниями нервной системы (рассеянный склероз, боковой амиотрофический склероз) продемонстрировал положительный эффект на ранних стадиях заболевания у 40% больных. Конечно, лечебный эффект Нейромидина менее выражен, но он более длительный, чем у Прозерина. Под влиянием Нейромидина происходит восстановление проведения возбуждения в спинном мозге и периферической нервной системе, что проявляется уменьшением выраженности парезов и параличей, расстройств чувствительности, повышением силы в пораженных группах мышц.
Эффективное лечение сенсорных симптомов не зависимо от патогенеза поражения периферических нервов, обусловлено блокированием ионных каналов аксолеммы и нейрональных мембран, в основном калиевых и частично натриевых, что выгодно отличает Нейромидин от Прозерина.
Анальгетическое действие Нейромидина, блокирующего ионные каналы, достигается торможением эктопических разрядов и эфаптической передачи возбуждения в поврежденном нерве, в регенерирующих аксональных ветвлениях в результате коллатерального спраутинга, а также снижением возбудимости центральных нейронов.
Нейромидин в отличие от Прозерина, который фактически не проникает через гематоэнцефалический барьер, имеет способность стимулировать структурные образования ЦНС, в частности когнитивные процессы.
Когнитивные расстройства являются ведущими клиническими проявлениями хронической недостаточности мозгового кровообращения. Существует мнение, что мнестические расстройства связаны с центральным холинергическим дефицитом, а глютаматная экзайтотоксичность, возникающая при этом, является вторичной.
У пожилых людей нарушаются как пресинаптический, так и постсинаптический компоненты центральных холинергических синапсов, расположенных в коре больших полушарий и в гиппокампе, в результате чего уменьшается высвобождение ацетилхолина и снижается чувствительность к нему в пожилом возрасте.
После курса Нейромидина у пациентов с прогрессирующей сосудистой лейкоэнцефалопатией улучшалась кратковременная память, уменьшались проявления астенического синдрома, улучшались показатели когнитивных функций.
У больных сенильной деменцией альцгеймеровского типа и мультиинфарктной деменции, получавших Нейромидин, было выявлено уменьшение поведенческих нарушений, улучшение когнитивных функций, речи и социальной адаптации.
Независимым фактором нарушения когнитивных функций и развития деменций является сахарный диабет. Проведенные клинические исследования позволяют рассматривать Нейромидин как препарат первой линии лечения больных сахарным диабетом с умеренными когнитивными нарушениями и деменцией.
У больных с последствиями умеренного или легкого мозгового инсульта на фоне лечения Нейромидином возрастала физическая активность, интеллектуальные функции, увеличивался объем памяти. В восстановительном периоде ишемического инсульта средней тяжести у пациентов наблюдалось значительное уменьшение степени пареза конечностей без нарастания мышечного тонуса, бульбарных параличей и парезов, регресс расстройств чувствительности, вегетативно-трофических нарушений. У 70–80% больных с сосудистыми и другими органическими поражениями головного мозга в остром и отдаленном периодах отмечался быстрый регресс нарушений памяти, внимания, праксиса, шаткости при ходьбе, уменьшение астенических явлений, улучшение сна, повышение интеллектуальных возможностей больного и его работоспособности. Почти у всех больных с афазией отмечено улучшение речевых функций.
Оба препарата производятся в таблетированной (Прозерин по 15 мг, Нейромидин по 20 мг) и ампулированной форме по 1 мл (Прозерин 0,05%, в глазной практике используется 0,5% раствор, Нейромидин 1,5% и 0,5% раствор). Прозерин выпускается также в форме порошка, гранулах (для детей). Его применяют внутрь и подкожно. Взрослым Прозерин назначают внутрь за 30 мин до еды в порошках или таблетках по 10–15 мг 2–3 раза в день, подкожно вводят по 0,5 мг (1 мл 0,05% раствора) 1–2 раза в день, в глаза по 1–2 капли 0,5 % раствора 1–4 раза в сутки.
При развитии миастенического криза у взрослых Прозерин вводят внутривенно — 0,5–1 мл 0,05% раствора, затем подкожно в дозе 1,5–2,5 мл в зависимости от веса больного. Лечение миастении Прозерином проводят длительно. При других заболеваниях курс лечения продолжается 25–30 дней; при необходимости его повторяют после 3–4-недельного перерыва.
Нейромидин используют внутрь независимо от приема пищи, подкожно и внутримышечно. При поражениях периферической нервной системы — по 20 мг 2–3 раза в день в течение 30–40 дней. Курсы лечения повторяют с перерывом 1–2 месяца. При острых невритах используют по 10–20 мг в день в течение 10–15 дней, при хронических невропатиях длительность лечения увеличивают до 20–30 дней. При необходимости курсы повторяют 2–3 раза с интервалом 2–4 недели до достижения максимального эффекта.
При миастении, миастенических синдромах, демиелинизирующих поражениях нервной системы дозу Нейромидина можно увеличить до 20–40 мг 5–6 раз в сутки. Максимальная суточная доза — 180–200 мг. Купирование миастенического криза — по 5–15 мг 1–2 раза в сутки подкожно или внутримышечно.
Наибольший эффект для стимулирования когнитивных процессов получен при использовании средних (50–60 мг/сут) и высоких доз (80–120 мг/сут) Нейромидина.
При болезни Альцгеймера и других формах слабоумия требуется индивидуальный подбор режима дозирования Нейромидина. Максимальная суточная доза может достигать 200 мг; длительность курса терапии — от 4 месяцев до 1 года. При необходимости применения высоких доз целесообразно применение 4–5 раз в сутки с интервалом 2–3 ч.
В восстановительном периоде ишемического инсульта легкой и средней тяжести используют 1,5% раствор Нейромидина внутримышечно в течение 14 дней по 1 мл в день.
При черепно-мозговой травме Нейромидин назначают от 40 мг до 120–160 мг в сутки. Курс лечения составляет 30–40 дней, 4 раза в год с интервалом месяц.
Для лечения и профилактики атонии кишечника — по 15–20 мг 2–3 раза в сутки в течение 1–2 нед.
Противопоказаниями к применению Прозерина и Нейромидина являются: гиперчувствительность, эпилепсия, экстрапирамидные нарушения с гиперкинезами, бронхиальная астма, стенокардия, выраженная брадикардия, беременность и период лактации.
Число противопоказаний и побочных эффектов у Прозерина больше по сравнению с Нейромидином, что связано с его сильной антихолинэстеразной активностью. Прозерин нельзя использовать при выраженном атеросклерозе, органических заболеваниях сердца и сосудов, тиреотоксикозе, язвенной болезни желудка и двенадцатиперстной кишки, перитоните, воспалительных процессах в брюшной полости, механической обструкции желудочно-кишечного тракта и мочевыводящих путей, аденоме предстательной железы, периоде острого заболевания, интоксикации.
Следует соблюдать осторожность при использовании нейромидина у пациентов с заболеваниями сердечно-сосудистой системы, тиреотоксикозом, язвенной болезнью желудка, однако эти состояния не являются противопоказаниями к его применению.
При применении Прозерина возможно появление гиперсаливации, обильного потоотделения, спастического сокращения и усиления перистальтики кишечника, тошноты, рвоты, метеоризма, диареи, учащенного мочеиспускания. Кроме того, могут развиться головная боль, головокружение, слабость, потеря сознания, сонливость, миоз, нарушения зрения, артралгии, аллергические реакции вплоть до анафилаксии. Со стороны сердечно-сосудистой системы: замедление сердечного ритма, аритмии, AV-блокада, неспецифические изменения на ЭКГ, снижение артериального давления, остановка сердца. Со стороны дыхательной системы: одышка, бронхоспазм, угнетение дыхания до остановки. Благодаря никотиноподобным эффектам Прозерин может вызвать тремор, спазмы и подергивание скелетной мускулатуры, включая фасцикуляции мышц языка, дизартрию, судороги.
Для снятия побочных явлений уменьшают дозу Прозерина или прекращают его прием, при необходимости вводят холинолитические препараты.
При парентеральном введении больших доз Прозерина необходимо предварительное или одновременное назначение атропина для нивелирования побочных мускариновых эффектов. При развившихся судорогах используют Сибазон.
Нейромидин, в сравнении с Прозерином, хорошо переносим, побочные эффекты возникают редко, слабо выражены и, как правило, не требуют отмены препарата, в связи со слабой антихолестеразной активностью и быстрым выведением, что препятствует кумуляции и возникновению побочных эффектов.
Кроме того, при приеме Нейромидина, в отличие от Прозерина, не наблюдается побочных эффектов, обусловленных действием на Н-холинергические синапсы, — фасцикуляции, крампи. Побочные эффекты Нейромидина связаны с активацией М-холинергических синапсов. В основном это диспептические явления (тошнота, усиление перистальтики, учащение частоты стула без диареи), которые самостоятельно регрессируют и не требуют прекращения лечения.
Появление других побочных явлений, таких как головокружение, гиперсаливация и брадикардия, кожно-аллергические реакции, требует коррекции дозы или короткого 1–2-дневного перерыва в лечении.
Для предотвращения побочных нежелательных явлений необходимо титровать препарат до лечебной дозы, чтобы организм адаптировался к усилению холинергической активности.
В связи с тем что Нейромидин может оказывать седативное действие, во время лечения необходимо воздерживаться от занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания, в том числе и вождения автотранспорта. На время лечения следует исключить прием этанола, так как возможно усиление неблагоприятных побочных действий.
Нейромидин и прозерин, несмотря на общее антихолинэстеразное действие, являются препаратами, обладающими неоднородными фармакологическими свойствами, что обуславливает их круг применения. В связи с высокой антихолинэстеразной активностью, Прозерин обладает рядом выраженных побочных эффектов и остается препаратом выбора при миастении, миастенических кризах и демиелинизирующих заболеваниях. Нейромидин обладает более широким спектром фармакологической активности, в том числе и стимулирующим действием на структурные образования ЦНС, поэтому с успехом применяется как при лечении заболеваний периферической нервной системы, так и при органических поражениях ЦНС. Несомненным достоинством является хорошая переносимость и отсутствие выраженных побочных эффектов, что позволяет его длительно применять у пожилого контингента пациентов, страдающих многочисленными сопутствующими заболеваниями.
По вопросам литературы обращайтесь в редакцию.
З. А. Суслина, доктор медицинских наук, профессор, академик РАМН
М. Н. Шаров, доктор медицинских наук, профессор
О. А. Степанченко, кандидат медицинских наук
МГМСУ, Москва
В статье отражены современные представления о лепре, представлены современные данные литературы, посвященные вопросам эпидемиологии заболевания, особенностям клинической картины, диагностики, дифференциальной диагностики и лечения дерматоза.
The article summarizes information about the disease leprosy. Data of the literature on epidemiology of the disease, the features of the clinical picture, diagnosis, differential diagnosis and treatment of the dermatosis are presented.
Лепра (проказа, болезнь Хансена) — хроническое инфекционное заболевание из группы микобактериозов, характеризующееся продолжительным инкубационным периодом и рецидивирующим течением. Заболевание носит системный характер и поражает производные эктодермы — кожные покровы, слизистые оболочки и периферическую нервную систему. В настоящее время, несмотря на применение эффективной схемы антибиотикотерапии и устранение угрозы эпидемии лепры, по всему миру продолжают ежегодно выявляться новые случаи заболевания, поэтому перспектива полной ликвидации болезни ставится под сомнение [1–3].
Распространенность лепры в мире стабильно снижается из года в год. Согласно данным ВОЗ, количество новых случаев, каждый год выявляемых во всем мире, уменьшилось с 763 000 в 2001 г. до 249 000 в 2008 г. [1]. В 2013 г. было выявлено 215 656 новых случаев заболевания, в 2014 г. — 213 899, в 2015 г. — 211 973 [2, 3].
Глобальная статистика свидетельствует о том, что 96% (203 600 человек) новых случаев заражения лепрой были выявлены в 22 государствах (таких как Индия, Бразилия, Ангола, Конго, Судан, Эфиопия и др.). На долю других стран приходятся оставшиеся 4% [3].
Одной из шести стран мира с наиболее высокой распространенностью лепры является Бразилия, где ежегодно диагностируется более 30 000 новых случаев заболевания. В 2014 г. распространенность лепры в Бразилии составила 1,27 случая на 10 000 жителей. Уровень распространенности дерматоза по стране неравномерен: помимо эндемичных по лепре регионов существуют и такие, в которых отмечается низкий уровень распространенности лепры [4].
В России эндемичным регионом по лепре является Астраханская область. За последние десятилетия больные лепрой были выявлены и в других субъектах Российской Федерации: в Сибири, на Северном Кавказе и Дальнем Востоке [9, 10]. Однако стоит отметить, что, благодаря внедрению в практику целого комплекса противолепрозных мероприятий, заболеваемость лепрой в России носит устойчивый спорадический характер. В 2015 г. на учете состояло 240 больных, из них в Астраханской области — 135 [10].
Возбудителями лепры являются Mycobacterium leprae (M. leprae) и Mycobacterium lepromatosis (M. lepromatosis). M. leprae была впервые открыта норвежским врачом Герхардом Хансеном в 1873 г. [11]. Данный микроорганизм относится к семейству Mycobacteriaceae и является кислото- и спиртоустойчивой бактерией, которая представляет из себя грамположительную прямую или изогнутую палочку длиной 1–7 мкм и диаметром 0,2–0,5 мкм [12]. M. leprae может длительное время сохранять жизнеспособность при низких температурах и высушивании. Данному микроорганизму свойственен крайне медленный рост, который зачастую не характерен для бактерий (одно деление продолжается приблизительно 12 суток) [12]. Возбудитель заболевания является облигатным внутриклеточным паразитом. M. leprae способна продолжительно персистировать в макрофагах человека, что обеспечивается взаимодействием различных механизмов (антигенная изменчивость и пр.). Именно поэтому пациенты, выписанные из лепрозориев на амбулаторное лечение с персистирующими формами лепры, могут быть источником заражения [9].
В 2008 г. был открыт второй возбудитель лепры — M. lepromatosis, который, в отличие от M. leprae, является некислотоустойчивой бактерией и вызывает преимущественно тяжелый диффузный лепроматозный тип лепры [13, 14].
От других инфекционных заболеваний лепру отличает длительный инкубационный период, который варьирует от 2–3 месяцев до 50 лет (в среднем составляя 4–6 лет) [11].
Общепризнан воздушно-капельный путь передачи инфекционных агентов, однако не исключаются другие пути заражения — через укусы кровососущих насекомых и поврежденные кожные покровы. Лепра является малоконтагиозным заболеванием. Заражение микобактериями лепры происходит в результате длительного тесного общения с больным, не получающим лечения, вследствие сенсибилизации, нарастающей при повторяющихся контактах, снижения сопротивляемости организма (в результате неполноценного питания, тяжелых физических нагрузок, частых простудных заболеваний, алкоголизма и других интоксикаций) и иммуногенетической восприимчивости [11].
На восприимчивость к лепре оказывают влияние различные наборы генов, в том числе системы антигена лейкоцитов человека (HLA). В настоящее время изучаются изменения в генах-кандидатах, участвующих в ответной реакции организма хозяина на инфекционный агент. Исследования геномного сканирования выявили связывающие пики для лепры в областях хромосом 6p21, 17q22, 20p13 и 10p13 [15, 17].
Устойчивость к заражению M. leprae обеспечивается, с одной стороны, низкой вирулентностью M. leprae, с другой — индивидуальными особенностями врожденного иммунитета. Важную роль в поддержании врожденного иммунитета играет целостность эпителия, секрет желез и поверхностный иммуноглобулин A (IgA). Кроме того, уничтожать микобактерии, независимо от активации адаптивного иммунитета, могут NK-клетки, цитотоксические Т-лимфоциты и активированные макрофаги. При заражении регулирование воспалительных цитокинов и хемокинов приводит к пролиферации либо Т-хелперов 1-го типа (Th1), либо Т-хелперов 2-го (Th2) типа, что способствует активации клеточного или гуморального звена иммунитета, что определяет клиническую форму заболевания [16, 17].
Клеточный иммунитет неэффективен в отношении предотвращения развития заболевания у лиц с туберкулоидной формой лепры. Гуморальный иммунитет у лиц с лепроматозной формой заболевания, ответственный за продуцирование IgM против PGL-1 (фенольный гликолипид-1), не обеспечивает защиту и не предотвращает диссеминацию бактерий [17].
Высокий уровень ФНО-α в сыворотке крови у пациентов с туберкулоидной формой лепры свидетельствует об участии данного цитокина в деструкции M. leprae и образовании гранулемы. ФНО-α участвует в иммунной защите посредством активации макрофагов, однако гиперпродукция ФНО-α и его взаимодействие с ИФН-γ способствуют повреждению тканей и формированию узловатой лепрозной эритемы (ENL) [17].
При лепроматозной форме лепры наблюдается повышенный уровень трансформирующего фактора роста бета (ТФР-β), отсутствующего при туберкулоидной форме и проявляющегося в небольшом количестве при пограничной форме лепры. ТФР-β подавляет активацию макрофагов, что ингибирует продуцирование ФНО-α и ИФН-γ, способствуя персистенции инфекции [17].
О механизмах трансмиссии лепры известно, что микобактерии проникают в клетки эндотелия и оседают в Шванновских клетках нервов кожи, к которым имеют тропизм, где в дальнейшем происходит долговременный период их адаптации и размножения. Остается неизвестным, как колонизация Шванновских клеток микобактериями лепры приводит к распространению инфекции в другие ткани [18]. Нейронный тропизм M. leprae обусловлен его связыванием с областью G на мостике молекулы ламинина альфа-2, а альфа-дистрогликан служит рецептором для M. leprae на Шванновских клетках [18].
В работе Masaki и соавт. (2013), в исследовании in vitro и in vivo с использованием мышей, определялось взаимодействие M. leprae со Шванновскими клетками. Исследование показало, что M. leprae изменяют дифференцировку Шванновских клеток до клеток-предшественников [19]. Клеточная перестройка приводит к снижению регуляции Шванновской клеточной линии Sox10 [19]. Таким образом, M. leprae способствуют распространению инфекционного процесса через два механизма: прямая дифференцировка Шванновских клеток в мезенхимальные ткани и образование гранулемаподобных структур, которые выделяют бактерионесущие макрофаги [19]. Исследование расширяет понимание о пластичности зрелых клеток и демонстрирует свойства M. leprae, приводящих к перестройке взрослых клеток в стволовые [18]. Распространение инфекции путем дифференцировки Шванновских клеток возможно при их инфицировании большим количеством M. leprae. Методология, используемая на мышах, у которых нет Т-клеток, упрощает воспалительное микроокружение в преимущественно макрофаги [19]. Данная работа описывает перспективную in vitro модель для объяснения патогенеза M. leprae, но необходимы подробные исследования, прежде чем экстраполировать выводы на течение инфекционного процесса в организме человека [18].
Существует две классификации лепры: мадридская классификация, принятая в 1953 г., а также ее последующая модификация, предложенная Д. С. Ридли и В. Джоплингом в 1973 г. [11].
Согласно мадридской классификации выделяют два полярных типа лепры: туберкулоидный и лепроматозный и два промежуточных типа: недифференцированный и пограничный (диморфный) [11].
В классификации Ридли–Джоплинга выделяют три типа лепры — недифференцированный (I — Indeterminate), туберкулоидный (Tuberculoidtype — TT) и лепроматозный (Lepromatoustype — LL). Лепроматозный и туберкулоидный типы являются полярными. Кроме того, различают субполярные и пограничные группы заболевания. Классификация Ридли–Джоплинга не нашла широкого применения ввиду сложности, поэтому в практической деятельности различают лепроматозный и туберкулоидный тип лепры, а также пограничный тип, который в дальнейшем может трансформироваться в одну из первых двух форм [20].
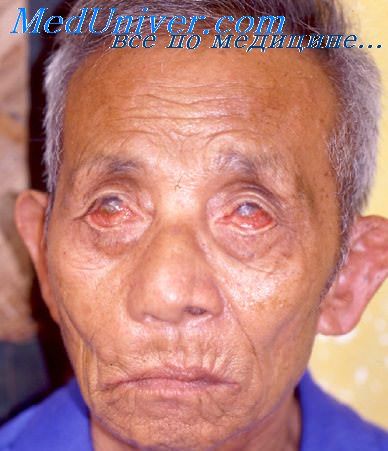
При лепроматозном типе лепры поражается как периферическая, так и центральная нервная система с развитием невротических расстройств, реже — психозов и поражений по типу невритов и полиневритов. В большинстве случаев поражаются лучевые, малоберцовые и большие ушные нервы: они утолщаются и становятся доступными для пальпации. В последующем развиваются двигательные и трофические расстройства, а также нарушения чувствительности. Больным свойственны невралгии, гиперестезии, парестезии, неадекватное или замедленное реагирование на раздражение, аналгезия. На фоне трофических нарушений развивается процесс мутиляции кистей и стоп. Поражение внутренних органов характеризуется неспецифическими изменениями в печени, легких, селезенке и нарушением функции некоторых желез внутренней секреции [11].
При недифференцированной форме лепры специфические высыпания отсутствуют. Для данной формы характерно появление небольшого количества бледных пятен различной величины с нечеткими границами, а также поражение периферической нервной системы по типу полиневрита. Как правило, выявить возбудителя у этой категории лиц удается крайне редко [11].
При развитии обострений лепрозного процесса форма заболевания может меняться. Несмотря на множество клинических проявлений лепры, окончательная постановка диагноза не всегда является простой задачей, так как отсутствуют патогномоничные клинические признаки заболевания [25].
При диагностике лепры учитывают данные эпидемиологического анамнеза (пребывание в эндемичном регионе, контакты с больными лепрой), объективного осмотра (обращают внимание на характер и длительность существования высыпаний, наличие признаков нарушений периферической иннервации).
Общепринятым лабораторным методом диагностики лепры считается бактериоскопическое исследование. Соскобы для исследования берут с очагов поражения на коже и слизистой оболочке носа путем легкого поскабливания. Мазок помещают на предметное стекло и окрашивают по Цилю–Нильсену. Также исследуют пунктат из бедренных или паховых лимфатических узлов. Однако бактериоскопическое исследование имеет очень низкую чувствительность, особенно у больных с промежуточной или туберкулоидной формой поражения [26].
Лепроминовая реакция (проба Митсуды) является показателем способности хозяина поддерживать в своем организме клеточный иммунитет к M. leprae. Проба Митсуды не всегда является достоверной, так как у 10% здоровых по лепре людей может наблюдаться отрицательная реакция. Ограничивают применение лепроминового теста и технические трудности, связанные с получением лепромина и его внутрикожным введением [11].
Наиболее чувствительным методом диагностики, позволяющим определять M. leprae, является полимеразная цепная реакция (ПЦР). ПЦР на данный момент считается наиболее перспективной из прямых диагностических методик и применяется для диагностики любого типа лепры [10, 18]. Преимуществом ПЦР являются неинвазивность и простота получения клинического материала, что предоставляет возможность проведения скрининга большого количества образцов при обследовании пациентов в высокоэндемичных по этому заболеванию регионах. Применение ПЦР позволяет усовершенствовать диагностику лепры и выявлять заболевание на ранней стадии [26].
Используемые в настоящее время традиционные методы диагностики, такие как лепроминовая проба и бактериоскопическое исследование, не всегда позволяют подтвердить диагноз лепры на ранних стадиях заболевания. При этом эффективность лечебных и профилактических мероприятий определяется возможностью ранней диагностики заболевания. В мире постоянно регистрируются новые случаи лепры, поэтому актуальным вопросом остается разработка и внедрение новых, более точных, методов диагностики, которые стали бы доступными для широкого использования и позволили с высокой степенью достоверности диагностировать лепру на ранних стадиях развития заболевания.
Лечение заболевания стандартизовано ВОЗ в 1981 г. [28]. Комбинированная лекарственная терапия включает в себя использование трех основных препаратов: дапсон, рифампицин и клофазимин [28].
Дапсон — бактериостатический препарат, действующий как конкурентный ингибитор ферментов дигидрофолатсинтетазы и дигидрофолатредуктазы, которые являются ключевыми ферментами путей биосинтеза фолатов в микобактериях лепры [28].
Рифампицин — оказывает в отношении M. leprae бактерицидное действие. Является селективным ингибитором ДНК-зависимой РНК-полимеразы и блокирует синтез РНК [29].
Клофазимин — жирорастворимый кристаллический краситель красноватого цвета с бактериостатическим и противовоспалительным свойствами. Механизм антибактериального действия клофазимина изучен недостаточно. Вероятно, он связан с блокировкой матричной функции ДНК, повышением фагоцитарной активности макрофагов и синтеза лизосомальных ферментов [28]. Клофазимин и рифампицин обладают эффективностью в отношении дапсонрезистентных микроорганизмов.
В 1997 г. ВОЗ была установлена продолжительность курса лечения: 6 месяцев для мультибациллярных форм лепры и 12 месяцев для олигобациллярных. Дапсон назначается в дозировке 100 мг для взрослых один раз в день, рифампицин в дозировке 600 мг один раз в месяц, клофазимин в дозировке 300 мг один раз в месяц. Для лечения детей применяются более низкие дозы препаратов [28]. В случае невозможности применения одного или двух препаратов из вышеперечисленных существуют схемы лечения с применением фторхинолонов, которые также показали свою эффективность в отношении M. leprae [30].
Своевременная диагностика лепры, профилактика распространения лепры беженцами и вынужденными переселенцами, особенно из высокоэндемичных государств (Бангладеш, Филиппинские острова, Индия, Ангола, Бразилия, Шри-Ланка и др.), являются серьезной и актуальной проблемой для мирового здравоохранения, одной из приоритетных задач при осуществлении контроля над здоровьем иностранных граждан и лиц без гражданства, въезжающих на территорию страны. В Российской Федерации, в соответствии с существующим порядком, установленным на законодательном уровне, для контроля над распространением заболеваний среди населения, нерезидентам Российской Федерации необходимо пройти медицинское освидетельствование в медицинских организациях. Однако данная процедура освидетельствования осложнена отсутствием комплексной методологической платформы.
Таким образом, несмотря на снижение распространенности лепры, представляется актуальным усиление контроля за обязательным обследованием на лепру прибывающих в страну иностранных граждан, разработка отечественных аналогов лекарственных препаратов и поиск новых схем лечения больных лепрой.
Литература
А. А. Кубанов*, доктор медицинских наук, профессор, член-корреспондент РАН
Т. В. Абрамова**, кандидат медицинских наук
Е. К. Мураховская* , 1 , кандидат медицинских наук
В. А. Ласачко*
* ФГБОУ ДПО РМАНПО МЗ РФ, Москва
** ФГБУ ГНЦДК МЗ РФ, Москва
Читайте также:

