Пробирки для забора крови на сифилис
Обновлено: 24.04.2024
Технологический протокол по регламенту забора проб капиллярной крови в клинико-диагностических лабораториях подготовлены для унификации работы лаборантов в целях обеспечения инфекционной безопасности медицинских технологий, как для пациента, так и для персонала.
Подлежат ежегодному пересмотру.
Рецензенты: д.м.н., проф. Е.В.Лишов, к.м.н. Л.С. Глазовская
© И.П. Рычагов, Е.Б. Брусина, О.М.Дроздова,Н.Б. Карпушкина, Л.И. Копытова.
© ГОУ ВПО КемГМА МЗ РФ
© ГУЗ Кемеровская областная клиническая больница
Раздел 1. Требования, предъявляемые к размещению кабинета для забора проб капиллярной крови в клинико-диагностической лаборатории
Раздел 2. Защитная одежда
Раздел 3. Подготовка кабинета к работе
Раздел 4. Обработка рук
Раздел 5. Подготовка рабочего места
Раздел 6. Технология забора капиллярной крови
Раздел 7. Технология забора капиллярной крови с помощью одноразовых стерильных пробирок на примере систем MiniCollect® или Microvette®
Раздел 8. Требования к организации забора крови в отделениях стационара
Раздел 9. Требования к обработке и стерилизации лабораторного инструментария, посуды, мягкого материала
Раздел 10. Уборка кабинета в конце рабочего дня
Раздел 11. Генеральная уборка по типу заключительной дезинфекции
Раздел 12. Защита персонала от инфицирования
Нормативные документы:
Требования,
предъявляемые к размещению кабинета для забора проб капиллярной крови в клинико-диагностической лаборатории
Расположение кабинета для забора проб капиллярной крови в лаборатории должно обеспечивать поточность поступающего на исследование материала и условий для выполнения правил санитарно-противоэпидемического режима.
Стены кабинета должны быть облицованы плиткой до потолка или покрыты влагостойкой краской. Потолок должен быть также покрыт влагостойкой краской. Допускается применение подвесных потолков при условии, что будут использованы конструкции и материалы, обеспечивающие герметичность, гладкость поверхности и возможность проведения их влажной очистки и дезинфекции.
Для покрытия полов должны быть использованы влагонепроницаемые материалы (линолеум, плитка и др. материалы). При использовании линолеумных покрытий края линолеума у стен должны быть плотно закреплены между стеной и полом, подведены под плинтуса. Швы примыкающих друг к другу листов линолеума должны быть тщательно пропаяны.
Кабинет для забора капиллярной крови должен быть оборудован:
секционной мойкой с подводкой горячей и холодной воды;
краном с локтевым или кистевым управлением;
дозаторами (локтевыми) с жидким (антисептическим) мылом и раствором антисептика;
устройством для салфеток;
емкостями для утилизации отходов в соответствии с требования биологической безопасности;
приточно-вытяжной вентиляцией с механическим побуждением и естественной вентиляцией через форточки, фрамуги и т.д., оборудованными системой фиксации;
системой кондиционирования воздуха.
Поверхности отопительных приборов должны иметь гладкую поверхность, устойчивую к ежедневному воздействию моющих и дезинфицирующих растворов, допускающую легкую очистку, исключающую адсорбирование пыли и скопление микроорганизмов. Отопительные приборы следует размещать у наружных стен под окнами, без ограждений.
Помещение кабинета должно иметь естественное, общее и локальное искусственное освещение. Искусственное освещение может осуществляться как люминесцентными, так и лампами накаливания. Светильники общего освещения кабинета должны быть со сплошными (закрытыми) рассеивателями. Рабочее место должно иметь дополнительное искусственное освещение.
Кабинет должен иметь:
стол с выдвижным ящиком для дезинфицирующих средств.
Мебель должна иметь влагостойкие поверхности, подлежащие дезинфекции.
В асептической зоне располагают медицинский шкаф со стерильными материалами, химическими препаратами. Стерильные материалы в упаковке должны храниться на отдельной полке. Укладки со стерильным материалом и подготовленные для стерилизации укладки хранят в разных отделениях шкафа.
В рабочей зоне выполняются все манипуляции пациенту и заполняется медицинская документация. В этой зоне располагаются рабочий и манипуляционный столы. На манипуляционном столе размещаются штативы с пробирками для крови. Все медицинские документы располагаются на рабочем столе.
Раздел 2.
Защитная одежда
* Хлопчатобумажная сорочка или костюм: рубашка и брюки;
* шапочка или косынка;
* обувь, подлежащая мытью и дезинфекции;
Порядок снятия перчаток.
* сделать отворот на левой перчатке пальцами правой руки, касаясь только наружной стороны;
* снять перчатку с левой руки, выворачивая ее на изнанку и держа за отворот. Держите ее в правой руке;
* взять правую перчатку левой рукой за отворот с внутренней стороны;
* снять перчатку с правой руки, выворачивая ее на изнанку: левая перчатка оказалась внутри правой;
* поместить перчатки в дезинфицирующий раствор (раствор для обеззараживания по режиму вирусных гепатитов);
Порядок снятия халата.
* снять халат вначале с одной руки, касаясь только нижней части рукавов4
* снять халат со второй руки, прикасаясь к нему изнутри и выворачивая его наизнанку;
* смена халата производится ежедневно или чаще, если это необходимо.
Порядок снятия маски.
* снять маску, прикасаясь только к завязкам;
* поместить маску в емкость с крышкой для последующей дезинфекции кипячением;
* маску меняют каждые 4 часа.
Защитные очки и лицевую маску тщательно моют теплой водой с мылом в конце рабочего дня и протирают насухо стерильной салфеткой. Хранят в шкафу на полке вместе с аптечкой первой помощи.
Раздел 3.
Подготовка кабинета к работе
* антисептиков и жидкого мыла для рук в дозаторах;
* бумажных салфеток для рук;
* необходимого количества упаковок стерильных, одноразовых скарификаторов, шариков, капилляров, предметных часовых стекол или одноразовых пробирок;
* комплектности аптечки для аварийных ситуаций;
* пробирок, капилляров, предметных стекол, штативов для подготовки проб крови для исследования;
пополнить все недостающее;
взять большую марлевую салфетку;
протереть рабочие горизонтальные поверхности;
если кабинет оборудован бактерицидным облучателем рециркуляционного типа – включить облучатель.
Раздел 4.
Обработка рук
* Снять кольца, перстни и другие украшения, так как они затрудняют эффективное удаление микроорганизмов; открыть кран;
* с помощью дозатора налить в ладонь жидкое мыло;
* под умеренной струей комфортно теплой воды энергично намылить руки жидким мылом из разового дозатора;
* тереть ладонью о ладонь;
* тереть правой ладонью по тыльной стороне левой руки;
* тереть левой ладонью по тыльной стороне правой руки;
* сложив ладони, тереть внутренние поверхности пальцев движениями вверх и вниз;
* тереть тыльной стороной пальцев по ладони другой руки;
* тереть пальцы круговыми движениями;
* поочередно круговыми движениями тереть ладони сжатыми пальцами;
Каждое движение следует повторять 5 раз!
* высушить руки двумя бумажными салфетками;
* закрыть кран локтем или запястьем
Внимание!
Запрещается закрывать кран руками!
Раздел 5.
Подготовка рабочего места
Вымыть руки (раздел 4);
Раздел 6.
Технология забора капиллярной крови
Подготовить на манипуляционном столе набор для забора крови из пальца, проверив целостность упаковок и дату стерилизации: индивидуальное стерильное предметное часовое стекло или пробирку одноразового использования, чистое предметное стекло для приготовления мазка крови, грушу, перчатки.
на рабочем столе оформить сопроводительные документы;
помочь пациенту найти удобное положение;
разъяснить пациенту суть предстоящей процедуры, создавая атмосферу доверия, предоставляя возможность задать вопросы;
вымыть руки (раздел 4);
обработать руки спиртовым антисептиком;
надеть чистые перчатки;
обработать подушечку пальца стерильным ватным шариком, смоченным спиртовым антисептиком;
вскрыть одноразовый скарификатор и сделать прокол на подушечке безымянного пальца. Укол лучше производить
сбоку, где более густая капиллярная сеть, на глубину 2-3 мм в
зависимости от толщины кожи;
произвести забор крови из пальца с использованием стерильных капилляров или одноразовых пробирок;
Внимание! Кровь забирается только самотеком!
Кровь из ранки должна вытекать
свободно, т.к. при сильном надавливании на палец возможно примешивание тканевой жидкости, что приводит к искажению результата.
закрыть место прокола стерильным ватным шариком, смоченным спиртовым антисептиком и отпустить пациента;
- произвести необходимые манипуляции по подготовке крови для клинического исследования;
Внимание! Груша используется только для подготовки пробы крови к клинико-диагностическому исследованию!
- провести обработку рабочей поверхности манипуляционного стола с использованием дезинфицирующего препарата в концентрации, предусмотренной для инактивации вирусов гемоконтактных гепатитов;
Внимание! Перчатки используются однократно!
Внимание! Перед забором крови следующему пациенту мытьё рук водопроводной водой с мылом не обязательно!
Обязательна обработка рук спиртовым антисептиком перед надеванием перчаток!
Раздел 7.
Технология забора капиллярной крови с помощью одноразовых стерильных пробирок на примере систем MiniCollect® или Microvette®
Системы состоят из двух основных компонентов:
пробирки объемом от 0,25мл до 1,0 мл с герметичной клапанной крышкой. В зависимости от назначения пробирка содержит реагент в необходимом количестве;
капилляры из пластика с различными наполнителями или универсальная воронка из полипропилена.
Процедура взятия капиллярной крови:
обработать руки спиртовым антисептиком;
надеть чистые перчатки;
вставить в крышку пробирки воронку или капилляр;
обработать подушечку пальца стерильным ватным шариком, смоченным спиртовым антисептиком;
собрать кровь в пробирку воронкой или через капилляр под действием капиллярного эффекта;
Взятие крови
Внимание! Крышку с пробирки не снимать!
пробирку аккуратно перевернуть вокруг своей оси для лучшего смешивания с реагентом;
поместить пробирку с кровью в штатив;
Раздел 8.
Требования к организации забора крови в отделениях стационара
Для забора крови в отделении лаборант должен подготовить контейнер для транспортирования, в котором выделяются 3 отделения – чистое, рабочее и грязное:
в чистом отделении размещается необходимое количество стерильных укладок с ватными шариками, капиллярами, предметными часовыми стеклами или одноразовыми пробирками, чистыми перчатками.
в рабочем отделении располагают чистые предметные стекла; груши; штативы с пробирками для определения СОЭ, содержания гемоглобина; мазки крови и т.д.
Забор крови в отделении должно проводиться на специально отведенном манипуляционном столе. Поверхность манипуляционного стола должна иметь влагостойкое покрытие. Около рабочего места лаборанта должна размещаться раковина для мытья рук с локтевым или кистевым управлением.
- Технология забора капиллярной крови проводится в соответствии с разделом 6.
При заборе капиллярной крови у постели больного рабочее место лаборанта должно быть оснащено передвижным манипуляционным столом:
на верхней полке передвижного манипуляционного стола разместить необходимое количество стерильных укладок с капиллярами, микропипетками, ватными шариками, стерильными предметными часовыми стеклами или одноразовыми пробирками, емкость с антисептиком, чистые перчатки и груши, одноразовые влагонепроницаемые салфетки;
Технология забора капиллярной крови проводится в соответствии с разделом 6.
Рука больного перед процедурой укладывается на влагонепроницаемую одноразовую салфетку.
Раздел 9.
Требования к обработке и стерилизации лабораторного инструментария, посуды, мягкого материала
Лабораторные инструменты, капилляры, скарификаторы, предметные стекла, меланжеры, счетные камеры, резиновые груши, баллоны, лабораторная посуда и др. после каждого исследования должны подвергаться дезинфекции в соответствии с режимом для инактивации вирусов гемоконтактных гепатитов дезинфицирующими средствами, разрешенными в установленном порядке в Российской Федерации;
Емкости с растворами дезинфицирующих, моющих и стерилизующих средств должны быть снабжены крышками, иметь четкие надписи с указанием средства, его концентрации, назначения, даты приготовления.
Одноразовый лабораторный инструментарий после использования подвергается дезинфекции с последующей утилизацией в установленном порядке. Повторное использование одноразовых изделий категорически запрещено;
Контроль качества предстерилизационной очистки проводится ежедневно лаборантом. Старший лаборант клинико-диагностической лаборатории проводит самоконтроль 1 раз в неделю с записью результатов в журнале согласно установленной формы. Для контроля качества предстерилизационной очистки используются азопирамовая (на скрытую кровь) и фенолфталеиновая (на наличие остатков моющего средства) пробы.
После дезинфекции и предстерилизационной очистки предметные часовые стекла, капилляры:
упаковываются по 1 шт. в крепированную бумагу или по 5 шт. в пластиковые (полиамидные) или бумажные пакеты для воздушных стерилизаторов;
наклеиваются индикаторные полоски;
упаковки стерилизуются в воздушных стерилизаторах при 180 0 С 60 минут или при 160 0 С 150 минут.
Приготовленные ватные шарики нужных размеров:
упаковываются в необходимом количестве в упаковочные пакеты или бязь;
приготовленные пакеты упаковываются в упаковочную бумагу;
наклеиваются или вкладываются индикаторные полоски;
пакеты стерилизуются в паровых стерилизаторах при 132 0 С 20 минут.
Бактериологический контроль качества стерилизации мягкого материала и предметных часовых стекол проводится не реже 1 раза в месяц.
Раздел 10.
Уборка кабинета в конце рабочего дня
взять большую салфетку;
применению формой дезинфектанта;
- протереть рабочие горизонтальные поверхности
вылить использованный дезинфицирующий раствор;
утилизировать дезинфицированные скарификаторы по принятой в учреждении схеме;
в ведро для мытья полов набрать воды, добавить небольшое количество моющего средства;
прополоскать и отжать ветошь, вылить раствор в канализацию;
убрать ведро и ветошь в помещение, предназначенное для ее хранения;
снять халат и сбросить его в корзину с грязным бельем;
включить бактерицидный облучатель (время экспозиции зависит от типа облучателя).
после окончания экспозиции бактерицидного облучения выключить облучатель;
Раздел 11.
Генеральная уборка по типу заключительной дезинфекции.
* Заключительная дезинфекция кабинета проводится 1 раз в неделю;
* надеть рабочий халат;
* освободить поверхности рабочего и манипуляционного столов;
* освободить шкаф и ящики столов, оставив их открытыми или выдвинутыми;
* надеть защитные очки, перчатки, респиратор;
* приготовить в емкости гидропульта дезинфицирующий раствор;
* с помощью гидропульта нанести на стены, окна, двери, внутренние поверхности шкафа, тумбочек, столов и другие поверхности дезинфицирующий раствор в концентрации, предусмотренной для инактивации вирусов гемоконтатных гепатитов из расчета 0.2л на 1 м2. Если не используется гидропульт, то стены и потолок моют с помощью телескопической швабры;
* покинув помещение, плотно закрыть дверь;
* выдержать время экспозиции дезинфектанта;
* вымыть стены на полную высоту и поверхности подоконника, шкафа, столов, холодильника, кушетки, тумбочки, стульев, пригласить электрика и протереть плафоны;
* прополоскать тщательно отжать ветошь;
* вылить остатки моющего раствора в канализацию;
* убрать ведро и ветошь в помещение, предназначенное для ее хранения;
* включить бактерицидный облучатель (время экспозиции зависит от типа облучателя).
* после окончания экспозиции бактерицидного облучения проветрить помещение;
* после окончания экспозиции бактерицидного облучения выключить облучатель.
Раздел 12.
Защита персонала от инфицирования.
Состав аптечки первой помощи при аварийной ситуации:
* 5% спиртовая настойка йода;
* 20 % раствор сульфацила-натрия;
* навески марганцевокислого калия для приготовления 0,05% раствора (50 мг на 100 мл воды);
* бинт, лейкопластырь, напальчники, перчатки.
При повреждении емкости, разливе биологических субстратов:
* использовать защитную одежду: перчатки, фартук, маску или щиток;
* ограничить место аварии ветошью и залить его дезинфицирующим раствором (0,1% раствором Жавелиона; 6% перекисью водорода и т.д.) на 1 час;
* через час собрать разбитую емкость с помощью совка, выбросить, поверхности вымыть водой;
* перчатки повторному использованию не подлежат.
При повреждении кожных покровов инструментами, загрязненными биологическими жидкостями пациента:
* выдавить кровь из ранки,
* обработать 700 спиртом,
* вымыть руки под проточной водой с двукратным намыливанием,
* обработать ранку 5% настойкой йода.
При попадании биологических жидкостей пациентов на слизистую глаз:
* промыть под проточной водой,
* закапать 20 % раствор сульфацила-натрия или промыть 0,05% раствором марганцевокислого калия (разведение 1 : 10000);
Внимание! Категорически запрещается тереть слизистые оболочки, загрязненные кровью или другими биологическими жидкостями.
При попадании биологических жидкостей пациентов на слизистую носа:
* промыть под проточной водой,
* промыть 0,05% раствором марганцевокислого калия;
* При попадании биологических жидкостей пациентов на неповрежденную кожу:
* обработать кожу 700 спиртом,
* вымыть руки под проточной водой с двукратным намыливанием,
* повторно обработать 700 спиртом,
При попадании биологических жидкостей пациентов на слизистую рта:
* прополоскать 0,05% раствором марганцевокислого калия или 700 спиртом;
В случае повреждения пробирки с кровью во время работы центрифуги:
* крышку открывать медленно, только через 40 минут после полной остановки,
* все центрифужные стаканы и разбитое стекло поместить в дезинфицирующий раствор на 1 час (3% раствором хлорамина, 0,1% раствором Жавелиона, 6% перекисью водорода и т.д.),
* внутреннюю и наружную поверхность центрифуги и крышки обработать дезинфицирующим раствором двукратным протиранием с интервалом в 15 минут.
Нормативные документы:

Анализ на сифилис, экспресс-методы определения заболевания
Если у вас есть малейшее подозрение на заражение сифилисом, вам надо срочно сдать анализы крови на сифилис. Одним из методов обследования пациента на сифилис является экспресс-диагностика на венерические заболевания (инфекции, передающиеся половым путем). Такой анализ можно сделать у нас в клинике в течении 20 минут.
Главное — необходимо понимать, чем скорее будет поставлен диагноз, тем больший процент вероятности вылечиться без серьезных осложнений на внутренние органы и системы.
Подготовка к сдаче анализа на сифилис
Для того, чтобы анализы на сифилис были более точными, к ним следует подготовиться. Для получения точных результатов анализов крайне важно строгое соблюдение пациентами правил подготовки к лабораторным исследованиям.
Требования для сдачи анализа на сифилис.
Требования для сдачи анализа совсем несложные. Кровь для исследования на сифилис берут натощак. Натощак — это через 12 часов после последнего приема пищи, лучше утром. В крайнем случае – не ранее, чем через четыре часа после еды. Можно пить воду. Накануне забора крови пациенту не следует употреблять алкоголь, наркотические и медикаментозные препараты, принимать жирную пищу. При взятии крови в более ранние сроки после приема пищи, в особенности жирной, а также после употребления алкоголя, могут выпадать неспецифические ложноположительные результаты.
Чтобы не получить ложноположительные результаты (ЛПР), не рекомендуется сдавать анализ во время лихорадочных состояний или непосредственно после перенесенных инфекционных заболеваний.
По тем же причинам не следует брать кровь у женщин — во время менструации, у беременных — в последние две недели перед родами и в ближайшие 10 дней после родов, у новорожденных — в первые 10 дней жизни. Нельзя брать кровь у больных с повышенной температурой, у пациентов ранее 24 часов с момента употребления ими спиртных напитков. Кровь не следует сдавать после рентгенографии, ректального исследования или физиотерапевтических процедур.
Венозная кровь – лучший материал для лабораторных исследований. Кровь для анализа берется из вены, в количестве 5-10 мл. Техника получения венозной крови из локтевой вены не отличается от стандарта взятия крови для других исследований в клинико-диагностической лаборатории.
Методы исследования сыворотки и плазмы крови на сифилис
Один из методов определения заболевания – серологические исследования. Они основаны на выявлении в сыворотке (плазме) крови антител, образующихся в организме больного при заражении сифилитической инфекцией. Такие исследования делят на нетрепонемные и трепонемные. При подозрении на наличие сифилиса серологические реакции являются обязательным компонентом обследования пациентов.
Привычный всем анализ на RW (реакция Вассермана) относится к нетрепонемным тестам. Современные интерпретации этого метода - RPR (быстрый плазмореагиновый тест) и VDRL (определение антител к кардиолипиновому антигену).
Экспресс-анализ на сифилис (это нетрепонемный анализ) не дает точного ответа на вопрос о наличии заболевания сифилиса у пациента. Суть метода состоит в следующем: проводится тест на преципитацию или осаждение с кардиолипиновым агентом. Результат экспресс-анализа на сифилис будет готов спустя 20 минут после забора крови. Если тест показывает положительный результат, то это следует рассматривать как причину для проведения более углубленных исследований (ИФА, РПГА,РИФ,антитела IgM и IgG).
Трепонемный анализ на сифилис представляет собой специфический тест, который выявляет только антитела к возбудителю сифилиса. Один существенный недостаток этого метода – антитела остаются в крови человека и после благополучного лечения, в течение всей оставшейся жизни.
Ложноположительные анализы крови возможны при ревматоидном артрите, ревматизме, туберкулезе, мононуклеозе, у беременных, у пожилых старше 60 лет, у людей с онкологическими, эндокринными, язвой желудка и т.д
Результаты диагностики оценивает врач-венеролог. Окончательный диагноз ставиться только врачом при положительных углубленных анализах .
Экспресс анализ на сифилис – доступная стоимость и быстрый результат.

Стоимость анализа на сифилис зависит от того, какой именно анализ вы хотите провести. Экспресс-анализ, проводимый в нашей клинике, имеет стоимость 1000р. Эта процедура является быстрой и эффективной, поэтому при малейшем подозрении (незащищенный секс, случайная половая связь, изнасилование, наличие подозрительных высыпаний) такой анализ сдать необходимо.
Прямые методы диагностики служат для выявления бледной трепонемы (Т. pallidum) или генетического материала этого возбудителя в образцах, взятых из очагов поражения. Прямое выявление возбудителя сифилиса является абсолютным доказательством наличия заболевания. Найденный генетический материал (ДНК/РНК) может свидетельствовать как об активном, так и о ранее леченном сифилисе.
На ранней стадии болезни, возбудитель сифилиса активно размножается в очаге инфицирования, при этом антитела к антигенам бледной трепонемы (Treponema pallidum) начинают появляться только со второй недели после инфицирования. Бледная трепонема располагается в тканевых щелях, между волокнами соединительной ткани, вокруг лимфатических и кровеносных сосудов, в стенках и даже просветах лимфатических капилляров.
При медицинском обследовании, у пациентов с подозрением на сифилис, все высыпания на коже или слизистых оболочках следует считать сифилитическими. Исследованию на бледную трепонему подлежат все эрозивные и язвенные шанкры, мокнущие и эрозивные папулы, широкие кондиломы на коже и слизистых оболочках рта, половых органов и анальной области.
Материалом, который необходим для бактериологического исследования на бледную трепонему, является тканевая жидкость (серум). Если нет возможности исследовать высыпания (например, в случаях раннего сифилиса), то рекомендуется проводить пункцию увеличенного регионарного лимфатического узла с соблюдением всех правил асептики, то есть стерильными инструментами и соблюдая правила, направленные на предотвращение распространения микроорганизмов. Кроме того, образцы могут быть получены путем взятия спинномозговой жидкости (ликвора) или плодной жидкости.
Важным условием для обнаружения бледной трепонемы в пат. материалах является правильное взятие проб из сифилитических элементов. Затем содержимое полученных проб изучают в лаборатории.
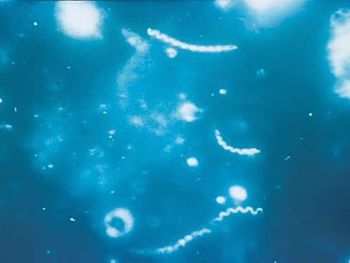
Обнаружение бледной трепонемы методом темнопольной микроскопии (ТПМ).
В России в качестве рутинного метода прямой визуализации T. pallidum традиционно используется метод темнопольной микроскопии (ТПМ, dark field microscopy, DFM).
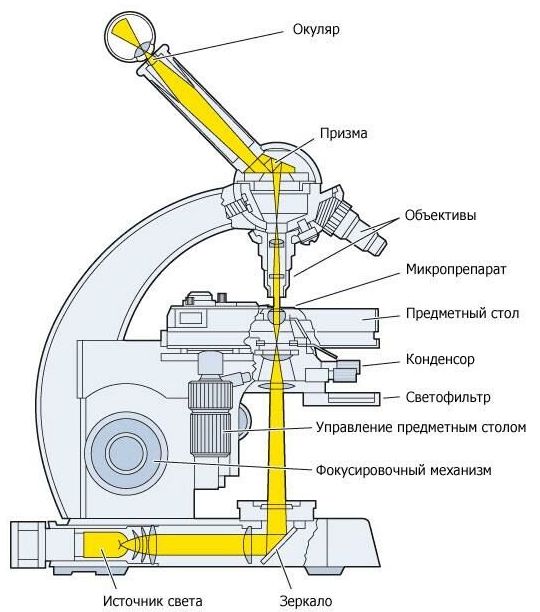
1. Конденсор темного поля
Исследование на бледную трепонему в темном поле зрения проводится с помощью стандартного микроскопа, снабженного конденсором темного поля.
Конденсор представляет собой двояковыпуклую линзу, прикрепляемую снизу предметного столика с таким расчетом, чтобы линза конденсора располагалась под отверстием предметного столика. Конденсор служит для собирания (конденсации) пучка световых лучей, что обеспечивает наибольшее освещение исследуемого предмета.
Неокрашенные живые бледные трепонемы не видны в световой микроскоп при обычном освещении препарата. Необходимые условия создаются путем замены обычного конденсора микроскопа особым конденсором, в котором центральная часть затемнена и проникновение лучей света происходит через узкую щель.
Вследствие получающегося при этом бокового освещения достигается отраженное свечение всех твердых частиц на темном поле (это называется "эффектом Тиндаля"), в том числе бледной трепонемы. Для получения темного поля необходим сильный источник света.
2. Бледная трепонема, характерные особенности при темнопольной микроскопии
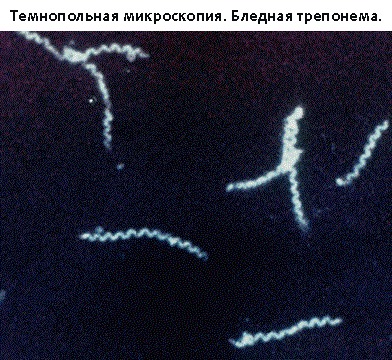
Исследование в темном поле микроскопа позволяет изучать бледную трепонему (БТ) в живом виде, а также достоверно отличать её от других трепонем как по морфологическим признакам, так и по характерным особенностям движения.
Чтобы отличать бледную трепонему от морфологически сходных типов сапрофитных трепонем, бледные трепонемы при исследовании должны быть живыми. Темнопольное исследование взятого материала должно быть проведено немедленно, сразу после получения образца, поэтому оборудование должно быть подготовлено заранее.
В затемненном поле зрения бледная трепонема выглядит, как движущаяся тонкая спираль или тонкий нежный пунктир с серебристым оттенком, слабо преломляющие свет. Помимо этих бактерий, в препарате все поле зрения усеяно массой мельчайших светящихся точек, находящихся в хаотичном броуновском движении.
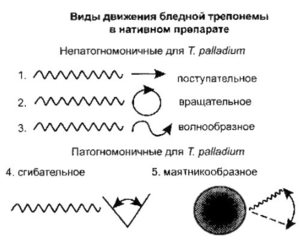
Бледные трепонемы движутся характерным образом: вращаются вокруг своей продольной оси, перемещаются в одном направлении, качаются наподобие маятника или совершают волнообразные, сократительные или сгибательные движения ("шагающая трепонема"). Бледная трепонема движется плавно, что является важной особенностью этого микроогранизма.

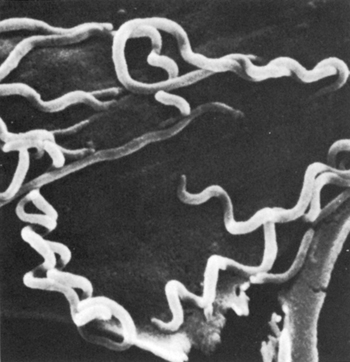
T. phagedenis, электронная микроскопия
В полости рта и на половых органах встречаются сапрофитные трепонемы: T . refringens и T. phagedenis (reiteri) в урогенитальном тракте и T. denticola в полости рта.
Непатогенные трепонемы морфологически сходны с T. pallidum. От них бледную трепонему отличает толщина, характер движения и форма завитков.
T.refringens колонизирует наружные половые органы. Эта бактерия движется быстро и неравномерно, отличается большей толщиной, отсутствием сгибательных движений, и более пологими и широкими завитками. T.denticola является представителем нормальной микрофлоры полости рта, ее завитки короче и направлены под более острым углом. В нормальной флоре наружных половых органов человека встречается также T. phagedenis.
Наличие непатогенных трепонем затрудняет исследования материала, взятого из поражений в полости рта или прямой кишке. При дифференциации трепонем может ошибиться даже опытный исследователь, поэтому присутствие этих микроорганизмов делает малодостоверным проведение исследования с данным материалом. Если необходимо провести тестирование материала, полученного из одного из указанных выше мест, то предпочтительнее выполнить DFA или NAAT (лучше отдать предпочтение методу ПИФ или молекулярно-биологическим методам).
Методом темнопольной микроскопии невозможно отличить бледную трепонему от патогенных возбудителей других трепонематозов — T. pallidum carateum (пинта), T. pallidum pertenue (фрамбезия), T. pallidum endemicum (беджель).
3. Применение темнопольной микроскопии для диагностики сифилиса
Микроскопию в темном поле можно применять для диагностики первичных и вторичных поражений кожи при сифилисе в результате заражения половым путем. В редких случаях этот метод можно использовать при третичном сифилисе (в последнем случае — если материал взят из глубины инфильтрата или со дна язвы).
Также с помощью этого метода исследуют поражения при раннем врожденном сифилисе, когда заражение плода бледной трепонемой произошло в утробе матери. Чтобы подтвердить диагноз "врожденный сифилис", для приготовления препарата для микроскопии можно использовать ткань пуповины, органы плода, выжатый сок плаценты, амниотическую (плодную) жидкость, отделяемое слизистой оболочки носа, содержимое пузырей (при ладонно-подошвенной сифилитической пузырчатке), тканевой жидкости (серума) с раздраженных папул.
Метод темнопольной микроскопии, используемый для диагностики сифилиса, отличается простотой, дешевизной, быстротой и достаточно высокой чувствительностью. Однако у него есть известные недостатки – невозможность диагностики скрытых и поздних форм сифилиса и непригодность для контроля излеченности. Даже многократный отрицательный результат микроскопического исследования на бледную трепонему не может исключить сифилис.
Кроме того, для проведения исследования методом ТПМ микроорганизмы T. pallidum должны быть подвижными. В условиях применения пациентами различных антибактериальных препаратов, в том числе для лечения других заболеваний, диагностическая чувствительность ТПМ снижается. В подобных случаях необходимо исследование методом прямой иммунофлюоресценции (ПИФ) или проведение серологического обследования на сифилис.
Для повышения информативности лабораторной диагностики разрабатываются более чувствительные и специфичные прямые тесты на основе молекулярно-биологических технологий, например различные модификации метода ПЦР.
Метод прямой иммунофлюоресценции (ПИФ)
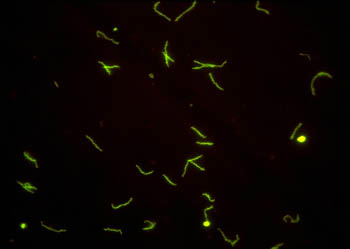
При необходимости микроскопия возбудителя в темном поле может быть дополнена прямой реакцией иммунофлюоресценции (ПИФ, direct fluorescent antibody test, DFA).
Прямой метод иммунофлюоресценции (по Кунсу) основан на взаимодействии антител, меченых флюорохромом, с антигеном, который находится на клетке, в клетке или в тканях. В качестве флюорохрома используют флюоресцеинизотиоционат (ФИТЦ).
Метод прямой иммунофлюоресценции предусматривает прямое выявление T. pallidum в образце при обработке материала специфическими моноклональными антителами. При этом на запарафинированные мазки или биопсийный материал накладываются противотрепонемные антитела, меченные флюоресцирующим красителем. Затем, образующиеся комплексы антиген—антитело исследуют под люминесцентным микроскопом.
В результате взаимодействия анти- T.pallidum антител, меченных ФИТЦ, и бледной трепонемы при люминесцентной микроскопии наблюдается специфическое ярко-зеленое свечение: бледная трепонема флюоресцирует ярко-зеленым цветом, сохраняя все морфологические признаки спирохеты.
Забор образцов производится таким же образом, как и для темнопольной микроскопии, при этом сам метод ПИФ является более точным, чувствительным и специфичным, чем ТПМ.
Метод ПИФ имеет преимущества перед темнопольной микроскопией для выявления бледной трепонемы. Флюоресцирующие микроорганизмы проще детектировать, вероятность спутать их с другими видами трепонем снижена. При этом возможна дифференцировка патогенных трепонем от непатогенных при исследовании материала со слизистых полости рта и прямой кишки, фиксация препаратов перед транспортировкой в лабораторию. Для исследования может быть использован материал, полученный при биопсии или аутопсии.
Кроме того, применение ПИФ ограничено из-за отсутствия промышленного производства и сертификации соответствующих ингредиентов в ряде стран, в частности, ФИТЦ-меченых моноклональных антител к патогенной бледной трепонеме.
Метод полимеразной цепной реакции (ПЦР)

Для диагностики сифилиса применяется прямой метод определения ДНК бледной трепонемы — метод ПЦР; это один из методов амплификации нуклеиновых кислот (МАНК, nucleic acid amplification test, NAAT).
Метод полимеразной цепной реакции (ПЦР) позволяет исследовать различные образцы (отделяемое сифилидов, биопсийный материал, биологические жидкости) в свежем, замороженном, фиксированном и парафинированном виде. В качестве объекта исследования методом ПЦР могут быть использованы соскобы шанкров и других высыпаний (папул, широких кондилом и т.д.), спинномозговая, амниотическая жидкость, сыворотка крови.
ПЦР–тесты для выявления ДНК бледной трепонемы были разработаны в 1991 году одновременно в нескольких лабораториях. Этот метод позволяет выявить и идентифицировать единственную молекулу ДНК бледной трепонемы среди сотен тысяч других молекул, что делает потенциально возможной диагностику нейросифилиса, третичного, врожденного сифилиса при наличии единичных трепонем в исследуемом материале.
Метод ПЦР высокоспецифичен, чувствителен и воспроизводим при правильном проведении и подготовке образцов. Однако, применительно к диагностике сифилиса, методы МАНК пока используется в исследовательских целях.
- PCR в режиме реального времени (PCR-RT). Учет полученных результатов происходит автоматически в режиме реального времени по уровню свечения флюорохромных меток;
- методика PCR-анализа с помощью обратной транскриптазы (PCR-ОТ);
- мультиплексная PCR (PCR-М, М-ПЦР), которая позволяет в биологической пробе одновременно определять наличие возбудителей нескольких заболеваний.
Основными достоинствами метода ПЦР и его модификаций является универсальность (возможность обнаружить любые нуклеиновые кислоты), весьма высокая чувствительность (80 – 94,7 %) и высокая специфичность (до 100 %). Результат получается быстро, для анализа необходима проба малого объема (несколько микролитров). Современные методы ПЦР позволяют одновременно исследовать нескольких возбудителей заболеваний, а также получать документальный ответ в виде фотографий и вносить результаты диагностики на компьютерные информационные носители. К недостаткам метода ПЦР-анализа следует отнести высочайшие требования к оснащению лаборатории, качеству тест–наборов и регламенту исследования.
Метод ПЦР является дополнительным и может быть рекомендован, главным образом, для исследования отделяемого эрозивных и язвенных высыпаний при подозрении на первичный сифилис, особенно при их локализации на слизистой оболочке рта; при применении пациентами местных и системных антибактериальных средств накануне обращения к врачу; при отрицательных результатах серологических тестов в начале первичного периода, когда ошибка метода ТПМ особенно значима.
Развитие высокочувствительного метода ПЦР и разработка его модификаций, оценивается как весьма перспективное. Особую важность этот метод приобретает при диагностике первичного серонегативного сифилиса (при котором серологические исследования дают отрицательный результат), раннего скрытого, врожденного сифилиса и нейросифилиса.
Препятствием к широкому внедрению метода ПЦР для диагностики сифилиса является отсутствие в массовой доступности тест-систем, разрешенных к медицинскому применению. В США применение ПЦР рекомендовано лабораториям, располагающим соответствующими тест-системами (в том числе созданными в самих лабораториях, in house). В России и странах Восточной Европы широкое использование метода лимитируется небольшим количеством наборов реагентов, прошедших валидацию и разрешенных к медицинскому применению на территории соответствующих государст
NASBA
NASBA - Nucleic Acid Sequence-Based Amplification, амплификация, основанная на последовательности нуклеиновых кислот (другие переводы - реакция амплификации на основе нуклеотидной последовательности нуклеиновых кислот, реакция транскрипционной амплификации). Методика NASBA основана на выделении РНК микроорганизма (в отличие от полимеразной цепной реакции, где используется ДНК). Этот метод тестирования считается одним из самых перспективных и многообещающих направлений молекулярной диагностики.
Использование в качестве мишени для NASBA видоспецифических участков рибосомальной РНК обеспечивает методу высокую специфичность. Так как РНК — менее стабильный по сравнению с ДНК тип генетического материала, который быстрее деградирует при разрушении клеток, то на основании результатов выявления РНК можно судить о наличии в образце жизнеспособных микроорганизмов, например, после проведенного лечения. С практической точки зрения важно, что для проведения NASBA в лабораторных условиях используется то же оборудование, что и для проведения ПЦР в реальном времени (PCR-RT). Кроме того, исходный биоматериал после ПЦР может исследоваться методом NASBA. В результате этого существует возможность интегрирования указанного метода в протокол лабораторного обследования, что позволит верифицировать возбудителя
Отдельные исследовательские коллективы уже получают достаточно перспективные результаты при изучении сифилитической инфекции методом NASBA и NASBA-RT, используя в качестве качестве мишени фрагмент гена 16s рРНК бледной трепонемы. Полученные данные позволяют отнести метод NASBA к диагностически перспективным в изучении сифилитической инфекции наряду с имеющимися методами диагностики.
Заражение сифилисом лабораторных животных
Задолго до открытия бледной трепонемы многие ученые стали проводить эксперименты по заражению сифилисом разнообразных животных. В естественных условиях животные сифилисом не болеют, но возможно искусственное заражение некоторых их видов. Первые успешные опыты были проведены на шимпанзе в начале 20-го века. Дальнейшие опыты на обезьянах привели к ряду блестящих научных открытий, но ввиду трудностей содержания и дороговизны обезьян, основными лабораторными животными стали кролики. Опыты с другими животными (холоднокровными, птицами, различными млекопитающими) давали отрицательный или недостаточный для практического применения результат. Некоторое значение имели только данные, полученные на морских свинках и мышах.
Заражение сифилисом кроликов является старейшим методом прямого выявления бледной трепонемы, т.к. кролик является наиболее чувствительным и удобным лабораторным животным для привития сифилиса. Заражение кроликов производят инокуляцией (введением микроорганизмов в ткани, от латинского inoculatio - "прививка") инфекционного материала в яичко. Чувствительность кроликов к инфекции Treponema pallidum практически 100%, если во взятом для прививки материале содержится достаточное количество бледных трепонем.
Е.Б. Лукоянычева–заведующая иммунологической лабораторией ГУЗ КОКБ.
Правила забора биологического материала для иммунологических исследований: Методические рекомендации / Авт.-составитель О.М.Луппова.- Кемерово: ГУЗ КОКБ ,2008.-25 стр.
Введение 4
Раздел 1. Общие правила забора биологического материала и оформления сопроводительных документов
Раздел 2.Технология забора крови из периферической вены для лабораторного исследования
Раздел 3.Правила взятия венозной крови с помощью закрытой системы (вакуумного шприца-контейнера)
Раздел 4.
Транспортировка образцов крови
Раздел 5.
Требование к маркировке пробирок
Раздел 6
Образец оформления пробирок и заполнения сопроводительных документов
Приложение № 1
Забор крови на иммунограмму
Приложение №2.
Забор крови на циркулирующий иммунный комплекс
Приложение №.3
Забор крови на криоглобулины
Приложение №.4
Забор крови на группу крови и резус принадлежность
Приложение №5.
Забор крови на реакцию Кумбса
Приложение №6
Забор крови на гемоконтактные гепатиты В и С (HBsAg, анти – HCV)
Приложение №7.
Забор крови на развернутый комплекс маркеров гепатитов
Приложение №8.
Забор крови на клещевой энцефалит, боррелиоз
Приложение №9.
Забор крови на антитела к антигенам описторхисов, лямблий, хеликобактеру
Приложение №10.
Забор крови на цитомегаловирус, токсоплазмоз, герпес
Приложение №.11
Забор крови на а/т к тироидной пероксидазе
Приложение №12
Забор крови на ВИЧ 23
Приложение № 4(образец заполнения)
Список литературы
Данное методическое пособие предназначено для медицинских сестер Кемеровской областной клинической больницы.
Методическое пособие поможет правильно произвести забор биологического материала и оформить сопроводительные документы.
Правильно произведенный забор биологического материала и правильно оформленные направления исключат ошибку на преаналитическом этапе исследования.
Формы сопроводительных документов составлены так, чтобы сократить время медицинской сестры, затрачиваемое на оформление направлений.
Необходимо, чтобы образцы крови были правильно взяты и вовремя доставлены в лабораторию. Нарушения, допущенные на преаналитическом этапе, могут повлиять на результат исследования и его дальнейшую интерпретацию.
Раздел 1.
Общие правила забора биологического материала и оформления сопроводительных документов
Перед забором крови пациенту следует сообщить:
1. На какой вид исследования будет проводиться забор крови.
2. Требования необходимые для данного исследования.
Порядок забора венозной крови
1. Исследование проводится утром натощак, последний прием пищи за 12 часов до взятия крови.
2. Исключение приема алкоголя не менее чем за 24 часа до взятия крови.
3. Утренний прием лекарственных препаратов, лечебно-диагностических процедур (массаж, ЭКГ, физиотерапевческое лечение и др.) проводится после взятия крови.
5. Пациент перед процедурой должен находиться в покое, сидеть или лежать не менее 5 минут.
6. Продолжительность пережатия сосудов жгутом должна составлять не более 1 минуты.
7. Нельзя просить работать пациента кулаком и массировать предплечье по ходу вен.
Раздел 2
Технология забора крови из периферической вены для лабораторного исследования
подготовить на манипуляционном столе стандартный набор для забора крови из периферической вены, проверив целостность упаковок и сроки годности:
1. лоток для использованных материалов;
2. пробирки для крови;
3. упаковка с 2-мя стерильными салфетками (5х5см) или 4-5 шариками;
5. кожный спиртовой антисептик во флаконе с дозатором;
сделать необходимые надписи на пробирках;
оформить сопроводительные документы в лабораторию;
обеспечить удобное освещение;
помочь пациенту найти удобное положение;
разъяснить пациенту суть предстоящей процедуры, создавая атмосферу доверия, предоставляя возможность задать вопросы;
обработать руки спиртовым антисептиком;
вскрыть упаковки со стерильными материалами;
руку больного уложить в положении максимального разгибания, для чего под руку следует положить валик, имеющий влагостойкое покрытие.
наложить жгут на 10 - 15 см выше выбранной зоны, не нарушая ток крови;
выбрать вену для венепункции;
обработать место венепункции кожным антисептиком и дать высохнуть самостоятельно;
Не пальпируйте вену повторно!
надеть на стерильный шприц иглу;
снять с иглы защитный колпачок;
пальцами левой руки фиксировать кожу над веной;
ввести под кожу иглу срезом вверх под углом 30-40 0 ;
установить иглу параллельно вене и быстрым движением проколоть ее стенку;
иглу продвинуть немного вверх по длине вены;
набрать необходимое количество крови в шприц
- запрещается забор крови свободным кровотоком из иглы в пробирку, а также присоединение к игле нового шприца;
- для безопасного забора крови предпочтительно использовать вакуумный шприц-контейнер.
иглу извлечь из вены;
прижать место венепункции стерильной салфеткой на 2-3 минуты;
осторожно, предупреждая разбрызгивание крови, вылить содержимое шприца через иглу в одну или несколько пробирок.
Раздел 3
Правила взятия венозной крови с помощью закрытой системы (вакуумного шприца-контейнера)
Закрытые системы взятия венозной крови представляют собой новое поколение вакуумных шприцев - контейнеров с реактивами. Их использование имеет следующие преимущества перед традиционными способами:
полностью исключается контакт медперсонала с кровью на всех этапах взятия крови и ее транспортировки;
особо прочный пластик закрытых систем позволяет осуществить безопасную доставку крови на любые расстояния;
благодаря наличию широкого спектра пробирок с заранее добавленными реагентами для различных видов анализов (ЭДТА для гематологии, цитрат натрия для коагулогии, активатор свертывания для получения сыворотки), значительно облегчается работа медсестер и лаборатории. Международная цветовая маркировка предотвращает их не правильное применение;
уменьшается количество ошибочных анализов, связанных с неправильным взятием проб крови и неверным соотношением реагентов.
закручивающаяся крышка предотвращает "аэрозольный эффект" при открывании;
1. Надеть иглу на контейнер и закрепить легким поворотом по часовой стрелке. Провести пункцию вены.
1. Провести пункцию вены иглой. Благодаря защитной мембране кровь из иглы не вытекает.
2. Медленно оттягивая поршень, наполнить контейнер кровью. После заполнения кровью контейнер вместе с иглой вынуть из вены. Поршень зафиксировать в конечном положении до характерного щелчка. В случае взятия нескольких образцов крови, контейнер отсоединить. Иглу оставить в вене и на нее надеть следующий контейнер.
2. Создать вакуум в контейнере.
Для этого отвести поршень в конечное положение (до характерного щелчка) и отломить его
3. По окончании взятия крови, шток поршня обломить. Вы получаете транспортный контейнер с кровью и антикоагулянтом или готовую пробирку для сепарации сыворотки.
3. Насадить контейнер на иглу. Взятие крови осуществляется под действием вакуума. В этом случае вы также получаете транспортный контейнер с кровью и антикоагулянтом или готовую пробирку для сепарации сыворотки.
Транспортировка образцов крови
При транспортировке образца внутри лечебно-диагностического учреждения, пробирки с кровью должны находиться в контейнере, который в случае повреждения пробирки будет предотвращать разлитие крови.
Порядок доставки крови в лаборатории
- Штативы с кровью поместить в герметичный контейнер;
наружные части контейнера двукратно с интервалом в 15 минут протереть дезинфицирующим средством (концентрация по режиму для вирусных гепатитов);
доставить контейнер в лабораторию;
вынимать образцы крови из контейнера только в перчатках!
после возвращения из лаборатории контейнер вновь двукратно с интервалом в 15 минут протереть дезинфицирующим средством (концентрация по режиму, предусмотренному для гемоконтактных вирусных гепатитов).
Требование к маркировке пробирок.
Маркировку пробирок и заполнение сопроводительных документов следует проводить аккуратно и четко.
Фамилию, имя, отчество пациента писать четко и разборчиво.
В направлении заполнять все графы.
Не допускается, чтобы этикетка на пробирке была размыта, порвана или плохо приклеена.
Взятие крови из вены с помощью вакуумной системы является наиболее безопасным и эффективным способом забора. Использование вакуумных пробирок, так называемых вакутейнеров, обеспечивает правильную процедуру сбора образца, транспортировки и качественный анализ.
Особенности и преимущества вакутейнеров
Трехкомпонентная система для забора венозной крови состоит из:
- стерильной вакуумной пробирки с консервантом;
- двусторонней автоматической иглы для внутривенной инъекции;
- автоматического иглодержателя.

Преимущества систем с отрицательным давлением связаны с их конструктивными особенностями:
- безопасность, стерильность и гарантия целостности образца;
- минимизация микросгустков и гемолиза;
- соблюдение постоянного времени между забором и соединением с добавкой;
- точное соотношение образца и добавки;
- минимизация эффекта жгута.
Алгоритм взятия крови с помощью вакуумной системы
Методика забора венозной крови вакуумными пробирками аналогичен использованию шприца, при этом обеспечивает большую безопасность, оперативность и удобство. Взятие осуществляется быстро, что важно для гарантии точного результата исследования.
При заборе крови из периферической вены с помощью вакуумной системы потребуются:
- вакуумные пробирки;
- жгут;
- вата (ватные тампоны) или салфетки;
- антисептическое средство (медицинский спирт);
- бактерицидный пластырь;
- стерильный медицинский лоток;
- медицинская спецодежда (халат, очки, маска и перчатки).
Перед проведением процедуры необходимо оформить направление пациента, обработать руки специальным раствором, надеть защитную медицинскую одежду.
Техника забора крови из вены
Возможные ошибки при использовании вакуумных пробирок
| Проблема | Возможные причины | Решение |
| Кровь не поступает в пробирку после соединения с держателем | Игла не попала в вену | Во всех перечисленных случаях необходимо осторожно скорректировать положение иглы. Отсоединять пробирку от держателя не нужно, если нет необходимости вынуть иглу и-под кожи. |
| Кончик иглы уперся в венозную стенку | ||
| Вена проткнута насквозь | ||
| Кровь в пробирку поступила в меньшем количестве, чем необходимо для проведения анализа | Венозный сосуд спался из-за низкого давления | Необходимо отсоединить пробирку от держателя и подождать некоторое время, пока вена снова наполнится |
| Систему нужно заменить и выполнить процедуру заново | В пробирку попал воздух |
Читайте также:

