Профессор громова ольга алексеевна вит д3 и туберкулез у детей
Обновлено: 22.04.2024
Данные современных фундаментальных и клинических исследований демонстрируют, что повсеместно используемые нормы рекомендованного суточного потребления витамина D для детей (400–500 МЕ/сут) существенно занижены. В статье представлены результаты обзорных и клинических исследований (n =21), в которых зафиксирована положительная динамика концентрации 25(OH)D в плазме крови на фоне применения витамина D у детей и подростков в возрасте от 0 до 18 лет. Продолжительность приема витамина D в проанализированных исследованиях составила от 1 до 12 мес, доза — от 800 до 4000 МЕ/сут. По результатам повозрастного анализа предложена ступенчатая схема назначения витамина D: для детей в возрасте до 4 мес рекомендуется ежедневный прием 500 МЕ/сут (для недоношенных — 800–1000 МЕ/сут), в возрасте от 4 мес до 4 лет — 1000 МЕ/сут, 4–10 лет — 1500 МЕ/сут, 10–16 лет — 2000 МЕ/сут витамина в течение года. При этом достигается эффективная компенсация дефицита витамина D (концентрация 25(OH)D >20 нг/мл), а также, по некоторым данным, снижение риска развития инфекционных и аллергических заболеваний. Показана безопасность рекомендуемого режима приема витамина D.
Ключевые слова
Об авторах
Научный центр здоровья детей, Москва, Российская Федерация Первый Московский государственный медицинский университет им. И.М. Сеченова, Российская Федерация
Россия
Список литературы
1. Normy fiziologicheskikh potrebnostei v energii i pishchevykh veshchestvakh dlya razlichnykh grupp naseleniya Rossiiskoi Federatsii. Metodicheskie rekomendatsii MR 2.3.1.2432 ot 18 dekabrya 2008 [Standard of Physiological Needs for Energy and Nutrients for Different Groups of Population in the Russian Federation. Guidelines MR 2.3.1.2432 dated December 18, 2008]. Moscow, 76 p.
2. Zakharova I.N., Dmitrieva Yu.A., Yablochkova S.V., Evseeva E.A. Insufficiency and deficiency of Vitamin D - What's new? Voprosy sovremennoi pediatrii = Current pediatrics. 2014; 13 (1): 134–140.
3. Holick M.F., Binkley N.C., Bischoff-Ferrari H.A. Endocrine Society. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011; 96 (7): 1911–1930.
4. Gromova O.A., Torshin I.Yu. Vitaminy i mineraly mezhdu Stsilloi i Kharibdoi. Pod red. E.I. Guseva, V.B. Spiricheva [Vitamins and Minerals Between Scylla and Charybdis. Ed. E.I. Gusev, V.B. Spirichev]. Moscow, MTsNMO, 2013. 693 p.
5. Torshin I.Yu., Gromova O.A. Ekspertnyi analiz dannykh v molekulyarnoi farmakologii [Expert Analysis of Data in Molecular Pharmacology]. Moscow, MTsNMO, 2013. 684 p.
6. Shmakin A.B. Development of climatological research at the Institute of Geography of the Russian Academy of Sciences. Izvestiya RAN = Proceedings of the Academy of sciences. 2008; 5: 95–105.
7. Holick MF. Vitamin D: extraskeletal health. Rheum. Dis. Clin. North Am. 2012; 38 (1): 141–160.
8. Halm B.M., Lai J.F., Pagano I., Cooney W., Soon R.A., Franke A.A. Vitamin D deficiency in cord plasma from multiethnic subjects living in the tropics. J. Am. Coll. Nutr. 2013; 32 (4): 215–223.
9. Ng K., Scott J.B., Drake B.F., Chan A.T., Hollis B.W., Chandler P.D., Bennett G.G., Giovannucci E.L. Dose response to vitamin D supplementation in African Americans: results of a 4-arm, randomized, placebo-controlled trial. Am. J. Clin. Nutr. 2014; 99 (3): 587–598.
10. Desai N.S., Tukvadze N., Frediani J.K., Kipiani M., Sanikidze E., Nichols M.M., Hebbar G., Kempker R.R., Mirtskhulava V., Kalandadze I., Seydafkan S., Sutaria N., Chen T.C., Blumberg H.M., Ziegler T.R., Tangpricha V. Effects of sunlight and diet on vitamin D status of pulmonary tuberculosis patients in Tbilisi, Georgia. Nutrition. 2012; 28 (4): 362–366.
11. Gromova O.A., Torshin I.Yu., Uchaikin V.F., Limanova O.A. The role of vitamin D in maintaining anti-TB, anti-virus and anti-infectious general immunity. Infektsionnye bolezni = Infectious diseases. 2014; 12: 65–74.
13. Makarov G.A. The mechanism of disorders of synthetic processes in tissues against the backdrop of prolonged inactivity. Patologicheskaya fiziologiya i eksperimental'naya terapiya = Pathological physiology and experimental therapy. 1974; 4: 41–45.
14. Zakharova I.N., Mal'tsev S.V., Borovik, G.V. Yatsyk T.E., Malyavskaya S.I., Vakhlova I.V., Shumatova T.A., Romantsova E.B., Romanyuk F.P., Klimov L.Ya., T.N. Elkina, Pirozhkova N.I., Kolesnikova S.M., Kur'yaninova V.A., Vasil'eva S.V., Mozzhukhina M.V., Evseeva E.A. Results of a multicenter study "fontanelle" for the study of vitamin D deficiency in young children in Russia. Pediatriya. Zhurnal im. G.N. Speranskogo = PEDIATRIYA-MOSCOW. 2015; 1: 62–70.
15. Torshin I.Yu. Bioinformatics in the post-genomic era: physiology and medicine. NY, USA: Nova Biomedical Books. 2007.
16. Tits N.U. Klinicheskaya otsenka laboratornykh testov [Clinical Evaluation of Laboratory Tests]. Moscow, 2012. 452 p.
17. Heaney R.P. Assessing vitamin D status. Curr. Opin. Clin. Nutr. Metab. Care. 2011; 14 (5): 440–444.
18. Holick M.F. Vitamin D deficiency. N. Engl. J. Med. 2007; 357: 266–281.
19. El-Hajj Fuleihan G., Nabulsi M., Tamim H., Maalouf J., Salamoun M., Khalife H., Choucair M., Arabi A., Vieth R. Effect of vitamin D replacement on musculoskeletal parameters in school children: a randomized controlled trial. J. Clin. Endocrinol. Metab. 2006; 91: 405–412.
20. Ziegler E.E., Nelson S.E., Jeter J.M. Vitamin D supplementation of breastfed infants: a randomized dose-response trial. Pediatr. Res. 2014; 76 (2): 177–183.
21. Natarajan C.K., Sankar M.J., Agarwal R., Pratap O.T., Jain V., Gupta N., Gupta A.K., Deorari A.K., Paul V.K., Sreenivas V. Trial of daily vitamin D supplementation in preterm infants. Pediatrics. 2014; 133 (3): 628–634.
22. Wagner C.L., McNeil R., Hamilton S.A., Winkler J., Rodriguez Cook C., Warner G. A randomized trial of vitamin D supplementation in 2 community health center networks in South Carolina. Am. J. Obstet. Gynecol. 2013; 208 (2): 137e1–13.
23. Grant C.C., Stewart A.W., Scragg R., Milne T., Rowden J., Ekeroma A., Wall C., Mitchell E.A., Crengle S., Trenholme A., Crane J., Camargo C.A., Jr. Vitamin D during pregnancy and infancy and infant serum 25-hydroxyvitamin D concentration. Pediatrics. 2014; 133 (1): 143–153.
24. Oberhelman S.S., Meekins M.E., Fischer P.R., Lee B.R. Maternal vitamin D supplementation to improve the vitamin D status of breast-fed infants: a randomized controlled trial. Mayo Clin. Proc. 2013; 88 (12): 1378–1387.
25. Ala-Houhala M., Koskinen T., Terho A., Koivula T., Visakorpi J. Maternal compared with infant vitamin D supplementation. Arch. Dis. Child. 1986; 61 (12): 1159–1163.
26. Camargo C.A., Jr, Rifas-Shiman S.L., Litonjua A.A., Rich-Edwards J.W., Weiss S.T., Gold D.R., Kleinman K., Gillman M.W. Maternal intake of vitamin D during pregnancy and risk of recurrent wheeze in children at 3 y of age. Am. J. Clin. Nutr. 2007; 85 (3): 788–795.
27. Grant C.C., Kaur S., Waymouth E., Mitchell E.A., Scragg R., Ekeroma A., Stewart A., Crane J., Trenholme A., Camargo C.A., Jr. Reduced primary care respiratory infection visits following pregnancy and infancy vitamin D supplementation: a randomised controlled trial. Acta Paediatr. 2014; 11–19.
28. Al-Shaar L., Mneimneh R., Nabulsi M., Maalouf J., Fuleihan Gel-H. Vitamin D3 dose requirement to raise 25-hydroxyvitamin D to desirable levels in adolescents: results from a randomized controlled trial. J. Bone Miner. Res. 2014; 29 (4): 944–951.
29. Nader N.S., Aguirre Castaneda R., Wallace J., Singh R., Weaver A., Kumar S. Effect of vitamin D3 supplementation on serum 25(OH)D, lipids and markers of insulin resistance in obese adolescents: a prospective, randomized, placebo-controlled pilot trial. Horm. Res. Paediatr. 2014; 82 (2): 107–112.
30. Radhakishun N.N., van Vliet M., Poland D.C., Weijer O., Beijnen J.H., Brandjes D.P., Diamant M., von Rosenstiel I.A. Efficacy and tolerability of a high loading dose (25,000 IU weekly) vitamin D3 supplementation in obese children with vitamin D insufficiency/deficiency. Horm. Res. Paediatr. 2014; 82 (2): 103–106.
31. Walker G.E., Ricotti R., Roccio M., Moia S., Bellone S., Prodam F., Bona G. Pediatric obesity and vitamin D deficiency: a proteomic approach identifies multimericadiponectin as a key link between these conditions. PLoS One. 2014; 9 (1): 83685.
32. Wingate K.E., Jacobson K., Issenman R., Carroll M., Barker C., Israel D., Brill H., Weiler H., Barr S.I., Li W., Lyon M.R., Green T.J. 25-Hydroxyvitamin D concentrations in children with Crohn'sdisease supplemented with either 2000 or 400 IU daily for 6 months: a randomized controlled study. J. Pediatr. 2014; 164 (4): 860–865.
33. Khadgawat R., Marwaha R.K., Garg M.K., Ramot R., Oberoi A.K., Sreenivas V., Gahlot M., Mehan N., Mathur P., Gupta N. Impact of vitamin D fortified milk supplementation on vitamin D status of healthy school children aged 10–14 years. Osteoporos Int. 2013; 24 (8): 2335–2343.
35. Maalouf J., Nabulsi M., Vieth R., Kimball S., El-Rassi R., Mahfoud Z., El-Hajj Fuleihan G. Short- and long-term safety of weekly high-dose vitamin D3 supplementation in school children. J. Clin. Endocrinol. Metab. 2008; 93 (7): 2693–2701.
36. McNally J.D., Iliriani K., Pojsupap S., Sampson M., O'Hearn K., McIntyre L., Fergusson D., Menon K. Rapid Normalization of Vitamin D Levels: A Meta-Analysis. Pediatrics. 2015; 135 (1): 152–166.
37. Pojsupap S., Iliriani K., Sampaio T.Z., O'Hearn K., Kovesi T., Menon K., McNally J.D. Efficacy of high-dose vitamin D in pediatric asthma: a systematic review and meta-analysis. J. Asthma. 2014; 21: P. 1–9.
38. Ganmaa D., Giovannucci E., Bloom B.R., Fawzi W., Burr W., Batbaatar D., Sumberzul N., Holick M.F., Willett W.C. Vitamin D, tuberculin skin test conversion, and latent tuberculosis in Mongolian school-age children: a randomized, double-blind, placebo-controlled feasibility trial. Am. J. Clin. Nutr. 2012; 96 (2): 391–396.
39. Marchisio P., Consonni D., Baggi E., Zampiero A., Bianchini S., Terranova L., Tirelli S., Esposito S., Principi N. Vitamin D supplementation reduces the risk of acute otitis media in otitis-prone children. Pediatr. Infect. Dis. J. 2013; 32 (10): 1055–1060.
40. Camargo C.A., Jr, Ganmaa D., Sidbury R., Erdenedelger Kh., Radnaakhand N., Khandsuren B. Randomized trial of vitamin D supplementation for winter-related atopic dermatitis in children. J. Allergy Clin. Immunol. 2014; 134 (4): 831–835.
41. Urashima M., Segawa T., Okazaki M., Kurihara M., Wada Y., Ida H. Randomized trial of vitamin D supplementation to prevent seasonal influenza A in schoolchildren. Am. J. Clin. Nutr. 2010; 91 (5): 1255–1260.
42. Mikati M.A., Dib L., Yamout B., Sawaya R., Rahi A.C., Fuleihan Gel-H. Two randomized vitamin D trials in ambulatory patients on anticonvulsants: impact on bone. Neurology. 2006; 67 (11): 2005–2014.
43. Gromova O.A., Torshin I.Yu., Pronin A.V. Pharmacology of water-soluble form of vitamin D on the basis of the micelles. Farmateka = Pharmateca. 2015; 1: 46–49.
44. Spirichev V.B., Gromova O.A. Vitamin D and its synergists. Zemskii vrach = Country doctor. 2012; 2: 16–19.
Для цитирования: Роль витамина D в формировании здоровья ребенка. Национальная программа по обеспеченности витамином D. Обзор симпозиума. Эксперты: Громова О.А., Мальцев С.В., Захарова И.Н., Намазова-Баранова Л.С. Consilium Medicum. Pediatrics (Suppl.). 2015; 1: 5–13.
The role of vitamin D in the formation of child health. The National Program of vitamin D provision. Symposium overview
Experts: Gromova O.A., Maltsev S.V., Zakharova I.N., Namazova-Baranova L.S.
The symposium discussed the recent data on the role of vitamin D in the framework of the vitamin D-hormone system, the prevalence of deficiency among children and adults, as well as the results of studies on the various effects of this vitamin. In recent years, there have been discussions about the concentration levels of 25(OH)D, and the norms. The data of studies which supports the normal limit of vitamin D, is presented as well. At the present time the Russian study called RODNICHOK with the aims of clarifying the prevalence of vitamin D, as well as the necessary measures to prevent and overcome the varying degrees of deficiency of this vitamin, is coming to its conclusion. Based on international experience and domestic data the Russian program “Vitamin D deficiency in children and adolescents of the Russian Federation: modern approaches to correction” is being developed.
Key words: vitamin D, vitamin D concentrations in blood, dosing of vitamin D, Akvadetrim.
For citation: The role of vitamin D in the formation of child health. The National Program of vitamin D provision. Experts: Gromova O.A., Maltsev S.V.,
Zakharova I.N., Namazova-Baranova L.S. Symposium overview. Consilium Medicum. Pediatrics (Suppl.). 2015; 1: 5–13.
Актуальные аспекты клинической и молекулярной фармакологии витамина D
Поиск оптимальной концентрации витамина D в сыворотке и дозы для перорального применения
В настоящее время активно обсуждаются вопросы диапазона содержания витамина D в сыворотке, который можно считать нормой, и подбора дозы витамина D для его дотации.
Нормы концентрации витамина D в крови, принятые в настоящее время, приведены в таблице.
Следует отметить, что как верхняя, так и нижняя границы нормы – предмет постоянных дискуссий среди ученых. Диапазон между верхней и нижней границами нормы подразумевает достаточность содержания витамина D и отсутствие токсичности. Этот диапазон – это то, к чему мы должны стремиться. В настоящее время полный диапазон референсных значений для витамина D не может быть представлен. Это связано с отсутствием надежных биомаркеров для определения достаточных уровней витамина D для реализации его внекостных, неклассических эффектов (по данным разных источников, они должны быть выше костных); кроме того, терапевтический диапазон витамина D достаточно широк, а уровень, сопровождаемый токсическими эффектами, в высокой степени индивидуален.
В настоящее время физиологически обоснованными представляются сывороточные уровни 25(ОН)D между 30 и 100 нг/мл (75–250 нмоль/л).
По результатам обсуждений недавно нижняя граница нормы была повышена с 20 до 30 нг/мл. Однако, возможно, эти цифры не окончательные. Так, эндокринологи предлагают с 15 лет жизни нижней границей нормы считать 38–40 нг/мл, что имеет ряд научных обоснований, сделанных на основе исследования костных эффектов витамина D.
Верхняя граница нормы зависит от возможных токсических эффектов витамина D (развитие гиперкальциемии), достижения гарантированного подавления избыточной секреции паратгормона у большинства индивидуумов и трудности превышения уровня витамина D более 100 нг/мл [3, 4]. В любом случае принятие за верхнюю границу нормы концентрации 80 нг/мл можно считать устаревшим мнением. Имеющиеся данные клинических исследований показывают, что гиперкальциемия отмечается у единичных пациентов только при приближении уровня 25(ОН)D к значениям 180–200 нг/мл [5, 6]. Опубликован метаанализ, показавший, что неблагоприятные последствия приема витамина D наблюдаются только при однократном приеме мегадоз витамина D – более 400 000 МЕ [7].
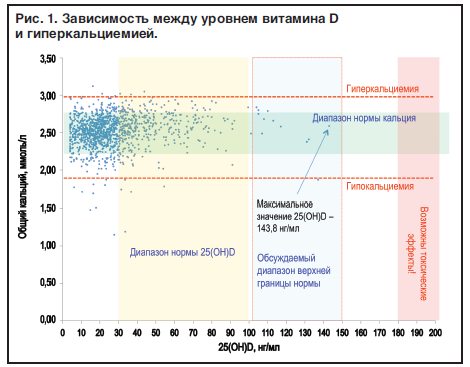
Российские исследователи также обсуждают оптимальную верхнюю границу нормы. Так, по результатам, полученным в ходе исследования РОDНИЧОК, анализировалась зависимость между высоким уровнем витамина D (100–150 нг/мл) и гиперкальциемией (рис. 1).
Из рис. 1 видно, что гиперкальциемия никак не связана с этим диапазоном.
Оптимальные дозировки
Наша собственная аналитическая работа показала, что достижение высокого уровня витамина D в сыворотке возможно только при условии применения высоких доз витамина D курсами не менее 4 мес при сохранении высокого комплаенса. По результатам другой работы даже при условии назначения врачом витамина D, применение до 80% доз пропускается, поэтому ожидать, что у таких пациентов будет нормальная концентрация витамина D, не стоит. Выполнение рекомендаций нужно отслеживать, не уставая вырабатывать дисциплину у больных и их родителей.
Витамин D должен применяться длительными курсами и достаточно высокими дозами. Так, результаты одного из сравнительных исследований показали, что в течение 12 мес применения витамина D в дозировке 200 МЕ/сут норма практически не достигается; при применении витамина D в дозе 2000 МЕ/сут преодолевается порог концентраций 20 нг/мл у более 90% подростков, а порог 30 нг/мл – у более 60% [8].
Оптимальная форма для перорального применения витамина D
Новое о витамине D
Дефицит витамина D
Недостаточность витамина D – одна из причин развития большинства болезней цивилизации. Роль педиатров в обеспечении детей витамином D и профилактике последствий его недостаточности очень велика.
Причины дефицита витамина D:
1. Нарушение поступления, недостаточная инсоляция и снижение синтеза витамина D в коже.
2. Недостаток в питании продуктов, содержащих витамин D.
3. Ряд причин, которые вызывают нарушение обмена витамина D, когда при достаточном поступлении нарушается его метаболизм в органах и тканях, и в итоге мы имеем его эндогенную недостаточность (снижение синтеза 25(ОН)D при заболеваниях печени, уменьшение синтеза 1,25(ОН)2D в почках, синдром мальабсорбции, резистентность органов-мишеней и т.д.).
Последствия дефицита витамина D
В настоящее время доказано негативное воздействие, которое оказывает на функционирование систем организма недостаточность витамина D. В настоящее время это влияние рассматривается с точки зрения эпигенетики. Эпигенетическая регуляция экспрессии генов определяет развитие в будущем сердечно-сосудистых (артериальная гипертензия, ишемическая болезнь сердца), аллергических заболеваний, сахарного диабета, психических заболеваний у детей и взрослых, онкологическую и другую патологию.
Анализ показывает, что снижение пребывания на солнце в течение последних 40 лет приводит к большинству болезней во всем мире. Достоверно доказано, что увеличение концентрации витамина D в крови снижает уровень частоты:
• рака молочной железы;
• сахарного диабета;
• рахита, остеопении, остеопороза;
• проблем беременности, заболеваний репродуктивной системы;
• гриппа;
• переломов в результате падений;
• когнитивных нарушений;
• болей в спине;
• ревматоидного артрита;
• паркинсонизма.
Связаны с низким уровнем витамина D:
• аллергия, астма, анемия;
• аутизм;
• болезнь Альцгеймера;
• целиакия;
• хроническая усталость;
• хроническая обструктивная болезнь легких;
• депрессия;
• болезни сердца;
• метаболический синдром;
• туберкулез;
• псориаз;
• ожирение.
При перечисленных патологических состояниях не только констатируется факт сниженного уровня витамина D, но выявлены и изучены патогенетические механизмы, приводящие к изменениям здоровья вследствие недостаточности витамина D.
В 2014 г. опубликована работа, показавшая, что снижение 25(ОН)D в крови лишь на 10 нг/мл увеличивает риск смерти от всех причин на 16%*.
Следует сказать, что результаты изучения последствий дефицита витамина D неоднозначны, а среди исследователей в разных научных центрах мира нет полного единодушия. Число проводимых работ огромное, и они показывают иногда достаточно противоречивые результаты. Возможно, это связано с тем, что витамин D-зависимая гормональная система работает у различных людей при разнообразных заболеваниях совершенно по-разному. Так, на сегодня известно, что имеет место полиморфизм генов как витамин D-связывающего белка, так и генов VDR. Варианты витамин D-связывающего белка характеризуются разным сродством к 25(ОН)D, а с полиморфизмом генов VDR связана разная чувствительность к витамину D. Распространенность тех или иных вариантов различается у разных рас, этносов, популяций, имеются и гендерные особенности. На одну и ту же дозу солнечного облучения возможен индивидуальный подъем уровня витамина D в крови. Вариативность ответа на одну и ту же дозу витамина D у разных людей следует учитывать в своей работе.
Подбор нижней границы нормы диапазона витамина D в крови
Какой уровень витамина D считать достаточным – 20 или 30 нг/мл – это также тема для обсуждения. Если принять за нижнюю границу нормы 25(ОН)D 20 нг/мл, то статистически 25−30% населения попадает в группу с низкой обеспеченностью витамином D. Если за норму принять 30 нг/мл, то 90% населения должны считаться дефицитными и получать дотацию витамина D. Необходимо взвешенно подойти к принятию решения о нормативах уровня обеспеченности, учитывая социальные, экономические, фармакоэкономические данные и последствия этой оценки. Окончательное решение должно быть принято на основании дальнейших исследований и обсуждений этого вопроса.
Кальций и витамин D
Все серьезные научные исследования увязывают дозу рекомендуемого витамина D и приема кальция с пищей. Именно поэтому в таблицах, которые приводят дозы витамина D для разных возрастных групп, обязательно указываются и рекомендуемые дозы кальция.
Приведенная таблица должна быть настольной для каждого врача, назначающего витамин D.
Баланс уровня витамина D и кальция обязательно должен быть идеальным, поскольку всякий дисбаланс вызывает нарушения. Кальций крови − это очень строгая константа, которая практически мало меняется, и диапазон нормы очень узок. Именно поэтому, когда доза витамина D существенно увеличивается, должна быть уменьшена доза кальция. Повышение и кальция, и витамина D может привести к гиперкальциурии и гиперкальциемии со всеми выходящими последствиями.
Обеспеченность витамином D детей раннего возраста в Российской Федерации. Результаты фармакоэпидемиологического исследования РОDНИЧОК
Фармакоэпидемиологическое исследование РОDНИЧОК
Анкетирование врачей
Анкетирование матерей
Лабораторное обследование детей: уровень обеспеченности витамином D
О.А. Громова 1,2 , И.Ю. Торшин 1 , Н.К. Тетруашвили 3 , О.А. Лиманова 2
1 ФИЦ Информатики и Управления РАН, г. Москва
2 ФГБОУ ВО Ивановская государственная медицинская академия Минздрава России, г. Иваново
3 ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России
New trends in nutritional support of pregnancy
O.A. Gromova 1,2 , I.Yu. Torshin 1 , N.K. Tetruashvili 3 , O.A. Limanova 2
1 Federal Research Center of Informatics and Management, Russian Academy of Sciences, Moscow
2 Ivanovo State Medical Academy, Ministry of Health of the Russian Federation, Ivanovo
3 National Medical Research Center of Obstetrics, Gynecology, and Perinatology named after Acad. V.I. Kulakov, Ministry of Health of Russia, Moscow 117997, Ac. Oparina str. 4, Russia
Дефициты макро- и микронутриентов во время беременности, особенно в ранние сроки, связаны с развитием плацентита, гипотрофии плода, увеличением риска врожденных аномалий ЦНС и органов зрения. Помимо общеизвестных нутриентов (витамины А, группа В, С, D, Е, селен, цинк, йод, железо и др.), входящих в большинство ВМК для беременных, не менее важное значение для нормального развития беременности имеет обеспеченность активными фолатами и омега-3 полиненасыщенными жирными кислотами (ПНЖК) [1].
Потребность организма в фолатах во время беременности увеличивается, поскольку фолаты в комплексе с другими витаминами и цинком принципиально важны для роста и развития плода. Недостаток фолатов приводит к тяжелым последствиям, в том числе дефектам нервной трубки (ДНТ), которые встречаются в 0,5% случаев беременности и составляют 2% в структуре неудачной беременности [2].
Эссенциальные омега-3 ПНЖК способствуют оптимальному развитию мозга не только внутриутробно, но на многие годы вперед (в период детства и отрочества), а также способствуют профилактике послеродовой депрессии [3]. Между активными фолатами, витаминами группы В и омега-3 ПНЖК существует определенный фармакодинамический синергизм: дефицит активных фолатов негативно влияет на метаболизм ПНЖК, а недостаточность омега-3 ПНЖК приводит к нарушениям метаболизма фолатов [4]. В настоящей работе рассмотрены упомянутые выше перспективные микронутриенты, которые целесообразно включать в современные ВМК для беременных.
Дефицит фолатов, особенно в преконцепцию и на ранних стадиях беременности, существенно повышает риск возникновения врожденных пороков (в том числе ДНТ), гипотрофии и недоношенности, а также увеличивает риск выкидыша и таких осложнений беременности, как эклампсия. На более поздних сроках беременности дефицит фолатов повышает риск синдрома Дауна и врожденных пороков сердца [5]. Нехватка фолатов в организме беременной ассоциирована с нарушениями развития речи в последующей жизни ребенка [6].
Для компенсации дефицита фолатов используют такие витамеры В9, как фолиевая кислота и 5-метилтетрагидрофолиевая кислота (L-метилфолат). Неметилированная форма витамина B9, фолиевая кислота, должна подвергаться ферментативному восстановлению метилентетрагидрофолатредуктазой (MTHFR), чтобы стать биологически активным витамером [7].
Метилтетрагидрофолиевая кислота (5-МТГФ, левомефолиевая кислота, L-метилфолат, (6S)-5-метилтетрагидрофолат, метафолин, экстрафолат S) является первичной биологически активной формой фолата, используемой на клеточном уровне для метилирования ДНК и регуляции уровней гомоцистеина. L-метилфолат синтезируется в абсорбирующих клетках тонкой кишки из полиглутамилированного диетического фолата.
Необходимость использования 5-МГТФ обусловлена тем, что от 5 до 25% людей в различных популяциях характеризуются пониженной активностью фермента метилтетрагидрофолат редуктазы (МТГФР), который является центральным ферментом метаболизма фолатов. Поэтому беременным предпочтительнее принимать именно метилтетрагидрофолат, который, в отличие от фолиевой кислоты, уже не требует биотрансформации и является биологически активной формой фолатов. Пик концентрации активного метаболита в плазме при аналогичной дозировке в несколько раз выше, чем при приеме просто фолиевой кислоты, что указывает на фармакокинетическое преимущество приема метилтетрагидрофолата [8].
При развитии мозга и органов зрения плода большую роль играют эссенциальные липиды – полиненасыщенные жирные кислоты (ПНЖК). Омега-3 ПНЖК не синтезируются в организме человека и крайне важно ежедневно получать их в достаточном количестве и в сбалансированном составе. У большинства россиянок репродуктивного возраста отмечается недостаточное потребление омега-3 ПНЖК [9]. По результатам независимого опроса в России препараты омега-3 ПНЖК принимают не более 1% беременных. В то же время каждый год возрастает число детей с нарушениями функции зрения и с перинатальной энцефалопатией – заболеваниями, во многом обусловленными дефицитом омега-3 [10]. Дети, рожденные от женщин, у которых содержание омега-3 ПНЖК в молоке было выше, обладают лучшими когнитивными способностями.

Рисунок. Синтез химических медиаторов разрешения воспаления из ЭПК и ДГК
Важно отметить, что между фолатами и омега-3 ПНЖК существуют неразрывные синергичные взаимодействия. С одной стороны, биологические эффекты активных фолатов осуществляются посредством синтезируемого из фолатов S-аденозилметионина, участвующего в реакциях метилирования ДНК при участии рибофлавина (витамин В2), никотинамида (витамин РР), пиридоксина (витамин В6) и цианокобаламина (витамин В12). Фолаты непосредственно воздействуют на экспрессию генов метаболизма углеводов, регуляции клеточного цикла и апоптоза. Развивающиеся на фоне дефицита активных фолатов нарушения метилирования ДНК будут нарушать экспрессию генов, кодирующих ферменты метаболизма омега-3 ПНЖК. С другой стороны, противовоспалительные, антиапоптотические и нейропротективные эффекты омега-3 ПНЖК обусловлены их производными – резолвинами и нейропротектинами. Омега-3 ПНЖК и их производные включаются в состав фосфолипидов, которые действуют как промежуточные сигнальные молекулы и также взаимодействуют с разными факторами транскрипции. Эти взаимодействия оказывают непосредственное влияние на экспрессию генов, вовлеченных в метаболизм фолатов и гомоцистеина [4].
Помимо омега-3 ПНЖК, синергистами фолатов является и ряд других микронутриентов (в частности, другие витамины группы В и цинк). Синергичность действия проявляется, прежде всего, в профилактике пороков развития и поддержании энергетического метаболизма постоянно растущих тканей плода. Дефицит многих витаминов группы В типичен для беременных (особенно при наличии гестационного диабета и рвоте беременных), что делает обязательной коррекцию дефицита витаминов посредством специальных ВМК для беременных [22].
Витамин В1 повышает секрецию молока у лактирующих женщин, в связи с чем используется в комплексе мер по лечению ранней гипогалактии (чаще в сочетании с витаминами С, В2, В6).
В составе кофакторов флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН) витамин В2 (рибофлавин) входит более чем в 180 ферментов, многие из которых участвуют в биосинтезе АТФ. Рибофлавин необходим для развития нервной системы, кожи, слизистых оболочек, печени плода, также стимулирует кроветворение. При нутрициальном дефиците рибофлавина в 3 раза возрастает риск развития дефектов конечностей [23], расщелин неба у плода и риск преэклампсии у беременной [24].
В3 (РР, никотинамид) необходим для активности ферментов биосинтеза АТФ. Низкие уровни диетарного потребления рибофлавина (менее 1,2 мг/сут) и никотинамида (менее 13,5 мг/сут) соответствовали более чем двукратному повышению риска рождения ребенка с врожденными пороками сердца [25]. Гиповитаминоз витамина РР может длительное время протекать латентно, без характерных клинических проявлений. В дальнейшем появляются вялость, депрессия, повышенная утомляемость, эпизодические головокружения и головная боль, раздражительность, нарушение сна, тахикардия с ощущениями сердцебиения, цианоз губ, лица, кистей, бледность и сухость кожи [22].
Пантотеновая кислота (витамин В5) входит в состав ацетил-кофермента А (ацетил-КоА), который является одним из важнейших кофакторов для ферментов, вовлеченных в катаболизм жирных кислот, аминокислот и сахаров. Поэтому витамин В5 синергичен прежде всего с другими витаминами группы В, вовлеченными в синтез АТФ (витамины В1, В2, В3). Следовательно, дефицит пантотеновой кислоты во время беременности будет стимулировать гипотрофию тканей плода.
Витамин Н (биотин) принимает участие в процессах катаболизма жиров и углеводов, синтеза АТФ, способствует улучшению состояния кожи, ногтей и волос. Недостаток биотина у беременных сопровождается шелушением кожи головы и лица, усталостью, депрессией, тошнотой, диффузным выпадением волос. Дефицит биотина может привести к развитию врожденных пороков [28].
Витамин В12 (цианкобаламин) является кофактором ферментов, участвующих в метаболизме гомоцистеина и фолатов. Тяжелый дефицит витамина В12 ведет к серьезным аномалиям развития плода и прерыванию беременности [29]. Гиповитаминоз В12 возникает у беременных с дисбиозом кишечной флоры, может приводить к врожденным порокам развития скелета вследствие нарушения кальций-фосфорного обмена [30]. Установлена взаимосвязь между низким уровнем В12 во время беременности у матери и ожирением и резистентностью к инсулину у детей в возрасте 6 лет [31].
Недостаток железа – самый распространенный дефицит микронутриентов среди беременных. Он ведет к развитию анемии (ЖДА) и нарушениям в развитии плода (низкий вес). Распространенность ЖДА в мире составляет 42% [34], в России также порядка 40% [35].
Компенсация железодефицита с помощью ВМК длится достаточно долго. Поэтому профилактический прием железосодержащих препаратов целесообразно начинать за несколько недель до планируемого зачатия. ЖДА возникает у большинства беременных. Поэтому препараты железа обязательно назначают при беременности, а также при подготовке к беременности.
Недостаток йода во время беременности является фактором риска развития кретинизма у ребенка и зоба у роженицы. Компенсирование этого дефицита является обязательным условием для нормальных родов, так как большинство россиянок репродуктивного возраста проживают в йододефицитных регионах. Потребление беременными 200 мкг/сут йода дополнительно к рациону питания нормализует уровень йода в организме и ликвидирует опасность йододефицита как для матери, так и для плода [38, 39].
Витамин Е является эндогенным антиоксидантом и участвует в процессах тканевого дыхания, метаболизме белков, жиров и углеводов. Дефицит витамина Е распространен среди беременных (15–20%). Дефицит витамина Е у недоношенных новорожденных сопровождается повышенным риском гемолитической анемии и в нарушений зрения. Прием витамина Е снижает риск отслойки плаценты [40].
Данные многочисленных фундаментальных и клинических исследований указывают на взаимосвязь между сниженной обеспеченностью витамином D и риском возникновения гестационного диабета. Дефицит витамина D3 встречается достаточно часто даже в относительно обеспеченных европейских странах (до 30% женщин репродуктивного возраста). Прием витамина D3 у беременных снижает риск преэклампсии, преждевременных родов и недостатка веса новорожденных [41]. В состав прегнотона мама витамин D3 входит в количестве 200 МЕ (при суточной норме для беременных 600 МЕ/сут), что позволяет при необходимости проводить дополнительную коррекцию недостаточности витамина D3 соответствующими монопрепаратами.
Недостаток витамина С часто встречается среди беременных. Есть данные, что прием витамина С снижает риск преждевременного отслоения плаценты и преждевременного отхождения вод при родах [42]. Показано, что прием аскорбиновой кислоты беременными снижал риск инфекций мочеполовой системы более чем в 2 раза (12% против 29%) [43].
Недостаточность селена у беременных значительно чаще встречается при повторных родах, особенно при коротких интервалах между родами. Отмечена взаимосвязь между дефицитом селена во время беременности и повышенным риском внезапной смерти у детей в раннем возрасте, развитием селен-дефицитной кардиомиопатии у роженицы. Дефицит селена может приводить к преждевременному прерыванию беременности, задержке развития плода, преэклампсии [44], послеродовой депрессии [45], повышенной материнской смертности [10, 22].
Заключение
В настоящее время среди производителей ВМК для беременных наблюдается положительная тенденция отхода от менее усвояемых и, в ряде случаев, более токсических неорганических форм микронутриентов (например, сульфат железа) к формам с более высокой биодоступностью (органическое соли, комбинированные формы, липосомное железо). Не менее важными тенденциями являются использование биологически активных форм микронутриентов (например, активных фолатов) и все более широкое применение омега-3 полиненасыщенных жирных кислот в составе ВМК для беременных.
Литература/References
Сведения об авторах:
Громова Ольга Алексеевна, д.м.н., профессор кафедры фармакологии и клинической фармакологии ГБОУ ВПО ИвГМА Минздрава России.
Адрес: 153000, Россия, Иваново, Шереметевский пр., д. 8.
Торшин Иван Юрьевич, к.ф-м.н., доцент кафедры интеллектуальные системы ГБОУ ВПО Московский физико-технический институт.
Адрес: 141700, Россия, Московская область, г. Долгопрудный, Институтский переулок, д. 9.
Тетруашвили Нана Картлосовна, д.м.н., профессор, зав. 2-м отделением акушерским патологии беременности ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Лиманова Ольга Адольфовна, к.м.н., доцент кафедры фармакологии и клинической фармакологии ГБОУ ВПО ИвГМА Минздрава России.
Адрес: 153000, Иваново, Шереметевский проспект, д. 8
About the authors:
Gromova Olga Alekseevna, MD, professor of Ivanovo State Medical Academy.
153000, Russia, Ivanovo, Sheremetiev pr. 8.
Torshin Ivan Yurievich, candidate of physic-mathematical sciences, associate professor, Moscow Institute of Physics and Technology.
141700, Russia, Moscow Region, Dolgoprudny, Institutsky pereulok, 9.
Tetruashvili Nana Kartlosovna, Doctor of Medicine, Head of the Department of Pregnancy Loss Prevention and Therapy, Research Center for Obstetrics, Gynecology and Perinatology, Ministry of Health of Russia.
117997, Russia, Moscow, Ac. Oparina str. 4.
Limanova Olga Adolfovna, PhD, associate professor, Department of Pharmacology and Clinical Pharmacology, Ivanovo State Medical Academy, Ministry of Health of Russia.
153000, Russia, Ivanovo, Sheremetiev pr. 8
В рамках рубрики "Школа по витаминам и минералам" начинаем публиковать серию лекций для врачей и студентов по наиболее актуальным и малоизученным вопросам клинической биоэлементологии - быстроразвивающейся ветви клинической фармакологии и нутрициологии. Первым в этой серии публикаций мы рассмотрим микроэлемент литий.
Литий (в переводе с греч. камень) был открыт в 1817 году шведским химиком Иоганом Августом Арфведсоном в минерале петалит. Элемент широко распространен в природе. В почвах содержится от 1,4 до 9,9 ммоль/кг лития (Li). Растения, накапливающие литий, относятся к пасленовым (табак, дереза, паслен сладко-горький), лютиковым (василистник), астровым (бодяк полевой, чертополох полевой). При этом пасленовые и лютиковые обладают снотворным и нормотимическим эффектом. Хорошим донором пищевого лития является варенье из лепестков крымской или болгарской розы (растение максимально концентрирует элемент в лепестках, особенно при условии произрастания на почвах вулканических и горных пород). Литий может незначительно всасываться кожей при купании в морской и минеральной воде. Уменьшают содержание лития в организме пересоленная (поваренная соль) и пережаренная (трансжиры) пища, избыточное употребление кофе, курение.
Литий содержится во всех органах и тканях организма человека. Его наибольшая концентрация отмечается в почках и в головном мозге. Концентрация лития в слюне значительно выше его концентрации в плазме, a содержание элемента в спинно-мозговой жидкости составляется 40% от концентрации в плазме [Авцын А.П. и соавт., 1991].
ТЕРАПЕВТИЧЕСКИЕ ЭФФЕКТЫ ЛИТИЯ
В 1949 году австралийский врач Джон Кейд продемонстрировал, что назначение лития вызвало снотворный эффект у больных с маниакальным синдромом. В настоящее время установлено, что действие лития опосредовано очень сложным и многообразным влиянием на различные внутриклеточные процессы, включая генную транскрипцию. В целом можно выделить два основных механизма терапевтического действия лития.
1. Ингибирование глутаматной эксайтотоксичности [Chen G., 1999]. Литий ингибирует NMDA-рецепторы за счет значительного ослабления фосфорилирования их субъединиц -NR2A и NR2B, что предотвращает активацию проапоптотических белков, запускающих каскад глютаматной эксайтотоксичности [Kopnisky К., 2003; Ma J., 2003]. При этом действие лития на молекулярные мишени связано с вытеснением ионов магния, необходимых для активации ряда ферментов [Mora A., 2001].
2. Активация сигнальных путей клеточного выживания [Nonaka S., 1998], представляющих собой каскады ферментативных реакций, запускающихся продуктами метаболизма (3, 4, 5 инозитол-3 фосфат), нейротрофическими факторами, факторами роста, которые приводят к делению, росту и дифференцировке клеток, с одной стороны, и к ингибированию апоптоза, с другой [Wada А., 2005]. Конечной точкой активации путей клеточного выживания является усиление активности белка CREB (c-amp responsive element binding protein). CREB является основным регулятором активности сотен факторов транскрипции, в том числе для генов, кодирующих про- и антиапоптотические белки и нейротрофические факторы: bcl-2, BDNF, c-Fos, Grp 78, HSP70 [Wada А., 2005]. Таким образом, в значительной степени повышается устойчивость клетки к различным неблагоприятным воздействиям.
С точки зрения доказательной медицины литий является эффективным средством для лечения моно- и биполярных аффективных расстройств [Cipriani А., et al., 2007]. Как показано в систематическом обзоре из библиотеки Кокрейна, даже для лечения монополярного расстройства литий имеет некоторое преимущество по сравнению с антидепрессантами [Burgess S., et al., 2007]. Кроме того, в настоящее время многочисленными исследованиями установлено нейропротекторное действие лития на моделях многих заболеваний [Wada А., 2005]:
Противодействие инфекционным заболеваниям весьма важно в акушерско-гинекологической практике. Витамин D – комплексный регулятор врожденного и приобретенного иммунитета. Известно, что недостаточная обеспеченность витамином D снижает антибактериальный и противовирусный иммунитет, стимулирует развитие патологий, ассоциированных с хроническим системным воспалением. Данные доказательной медицины указывают на важность использования препаратов витамина D для поддержки иммунитета. Результаты фундаментальных и клинических исследований показали, что возникающие на фоне недостаточности витамина D хроническое воспаление и нарушения врожденного иммунитета существенно снижают резистентность организма не только к туберкулезу, но и к вирусному гепатиту, ОРЗ, вирусам папилломы и герпеса. Помимо ярко выраженного антибактериального эффекта, витамин D также характеризуется противовирусным действием. Увеличивая экспрессию интерферона-альфа, кателецидина, дефенсина и противовирусных микроРНК, витамин D активирует различные механизмы врожденного противовирусного иммунитета. Результаты исследований показывают необходимость компенсации дефицита витамина D для успешной терапии вирусного гепатита, респираторных инфекций, вируса папилломы человека (ВПЧ) и герпесвируса. В настоящей статье последовательно рассмотрены молекулярные основы противовирусного действия витамина D, результаты фундаментальных и клинических исследований, указывающие на действие витамина D против вирусов гепатита, герпеса, RSV, Эпштейна – Барра, вируса папилломы человека, рассмотрена возможность применения витамина D в составе терапии этих и других вирусных патологий. Авторы проанализировали данные о влиянии витамина D на функции иммунитета и противовирусную защиту организма человека.
Ключевые слова
Об авторах
Информатика и управление; Центр хранения и анализа больших данных Московского государственного университета им. М.В. Ломоносова
Россия
119333, Москва, ул. Вавилова, д. 42,
119192, Москва, Ломоносовский проспект, д. 27
Scopus ID: 7003589812;
Author ID: 94901;
WOS ID: J-4946-2017
Торшин Иван Юрьевич, кандидат физико – мматематических наук, кандидат химических наук, старший научный сотрудник Института фармакоинформатики
119333, Москва, ул. Вавилова, д. 42
Scopus ID: 7003300274;
Author ID: 54104;
WOS ID: C-7683-2018
Фролова Дарья Евгеньевна, ассистент кафедры онкологии, акушерства и гинекологии
153012, Иваново, Шереметевский проспект, д. 8
Лапочкина Нина Павловна, доктор медицинских наук, заведующая кафедрой онкологии, акушерства и гинекологии
153012, Иваново, Шереметевский проспект, д. 8
Лиманова Ольга Адольфовна, кандидат медицинских наук, доцент кафедры фармакологии
153012, Иваново, Шереметевский проспект, д. 8
Список литературы
2. Sundaram M.E., Coleman L.A. Vitamin D and influenza. Adv Nutr. 2012;3(4):517–525. doi: 10.3945/an.112.002162.
3. Khoo A.L., Chai L.Y., Koenen H.J.P.M., Oosting M., Steinmeyer A., Zuegel U. et al. Vitamin D(3) down-regulates proinflammatory cytokine response to Mycobacterium tuberculosis through pattern recognition receptors while inducing protective cathelicidin production. Cytokine. 2011;55(2):294–300. doi: 10.1016/j.cyto.2011.04.016.
4. Lin Y.T., Wang L.K., Hung K.C., Wu Z.F., Chang C.Y., Chen J.Y. Patient characteristics and analgesic efficacy of antiviral therapy in postherpetic neuralgia. Med Hypotheses. 2019;131:109323. doi: 10.1016/j.mehy.2019.109323.
5. El-Taweel A.E., Salem R.M., Allam A.H. Cigarette smoking reduces the efficacy of intralesional vitamin D in the treatment of warts. Dermatol Ther. 2019;32(2):e12816. doi: 10.1111/dth.12816.
6. Oztekin A., Oztekin C. Vitamin D Levels in Patients with Recurrent Herpes Labialis. Viral Immunol. 2019;32(6):258–262. doi: 10.1089/vim.2019.0013.
8. Gutierrez J.A., Jones K.A., Flores R., Singhania A., Woelk C.H., Schooley R.T., Wyles D.L. Vitamin D Metabolites Inhibit Hepatitis C Virus and Modulate Cellular Gene Expression. J Virol Antivir Res. 2014;3(3). doi: 10.4172/23248955.1000129.
9. Beard J.A., Bearden A., Striker R. Vitamin D and the anti-viral state. J Clin Virol. 2011;50(3):194–200. doi: 10.1016/j.jcv.2010.12.006.
12. Jeng L., Yamshchikov A.V., Judd S.E., Blumberg H.M., Martin G.S., Ziegler T.R., Tangpricha V. Alterations in vitamin D status and anti-microbial peptide levels in patients in the intensive care unit with sepsis. J Transl Med. 2009;7:28. doi: 10.1186/1479-5876-7-28.
14. Arboleda J.F., Urcuqui-Inchima S. Vitamin D-Regulated MicroRNAs: Are They Protective Factors against Dengue Virus Infection? Adv Virol. 2016;2016:1016840. doi: 10.1155/2016/1016840.
15. Duan X., Guan Y., Li Y., Chen S., Li S., Chen L. Vitamin D Potentiates the Inhibitory Effect of MicroRNA-130a in Hepatitis C Virus Replication Independent of Type I Interferon Signaling Pathway. Mediators Inflamm. 2015;2015:508989. doi: 10.1155/2015/508989.
17. Matsumura T., Kato T., Sugiyama N., Tasaka-Fujita M., Murayama A., Masaki T. et al. 25-Hydroxyvitamin D3 suppresses hepatitis C virus production. Hepatology. 2012;56(4):1231–1239. doi: 10.1002/hep.25763.
18. Huang J.F., Ko Y.M., Huang C.F., Yeh M.L., Dai C.Y., Hsieh M.H. et al. 25-Hydroxy vitamin D suppresses hepatitis C virus replication and contributes to rapid virological response of treatment efficacy. Hepatol Res. 2017;47(13):1383–1389. doi: 10.1111/hepr.12878.
19. Petta S., Camma C., Scazzone C., Tripodo C., Di Marco V., Bono A. Low vitamin D serum level is related to severe fibrosis and low responsiveness to interferon-based therapy in genotype 1 chronic hepatitis C. Hepatology. 2010;51(4):1158–1167. doi: 10.1002/hep.23489.
20. Lange C.M., Bojunga J., Ramos-Lopez E., von Wagner M., Hassler A., Vermehren J. et al. Vitamin D deficiency and a CYP27B1-1260 promoter polymorphism are associated with chronic hepatitis C and poor response to interferon-alfa based therapy. J Hepatol. 2011;54(5):887–889. doi: 10.1016/j.jhep.2010.08.036.
21. Villar L.M., Del Campo J.A., Ranchal I., Lampe E., Romero-Gomez M. Association between vitamin D and hepatitis C virus infection: a metaanalysis. World J Gastroenterol. 2013;19(35):5917–5924. doi: 10.3748/wjg.v19.i35.5917.
22. Garcia-Alvarez M., Pineda-Tenor D., Jimenez-Sousa M.A., FernandezRodriguez A., Guzman-Fulgencio M., Resino S. Relationship of vitamin D status with advanced liver fibrosis and response to hepatitis C virus therapy: a meta-analysis. Hepatology. 2014;60(5):1541–1550. doi: 10.1002/hep.27281.
23. Kim H.B., Myung S.K., Lee Y.J., Park B.J. Efficacy of vitamin D supplementation in combination with conventional antiviral therapy in patients with chronic hepatitis C infection: a meta-analysis of randomised controlled trials. Journal of Human Nutrition and Dietetics. 2018;31(2):168–177. doi: 10.1111/jhn.12503.
24. Zdrenghea M.T., Makrinioti H., Bagacean C., Bush A., Johnston S.L., Stanciu L.A. Vitamin D modulation of innate immune responses to respiratory viral infections. Rev Med Virol. 2017;27(1):e1909. doi: 10.1002/rmv.1909.
25. Telcian A.G., Zdrenghea M.T., Edwards M.R., Laza-Stanca V., Mallia P., Johnston S.L., Stanciu L.A. Vitamin D increases the antiviral activity of bronchial epithelial cells in vitro. Antiviral Res. 2017;137:93–101. doi: 10.1016/j.antiviral.2016.11.004.
26. Hurwitz J.L., Jones B.G., Penkert R.R., Gansebom S., Sun Y., Tang L. et al. Low Retinol-Binding Protein and Vitamin D Levels Are Associated with Severe Outcomes in Children Hospitalized with Lower Respiratory Tract Infection and Respiratory Syncytial Virus or Human Metapneumovirus Detection. J Pediatr. 2017;187:323–327. doi: 10.1016/j.jpeds.2017.04.061.
27. Hansdottir S., Monick M.M., Lovan N., Powers L., Gerke A., Hunninghake G.W. Vitamin D decreases respiratory syncytial virus induction of NF-kappaBlinked chemokines and cytokines in airway epithelium while maintaining the antiviral state. J Immunol. 2010;184(2):965–974. doi: 10.4049/jimmunol.0902840.
28. Martineau A.R., Jolliffe D.A., Hooper R.L., Greenberg L., Aloia J.F., Bergman P. et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. 2017;356:i6583. doi: 10.1136/bmj.i6583.
29. Zhu M., Wang T., Wang C., Ji Y. The association between vitamin D and COPD risk, severity, and exacerbation: an updated systematic review and meta-analysis. Int J Chron Obstruct Pulmon Dis. 2016;11(1):2597–2607. doi: 10.2147/COPD.S101382.
30. Thappa D.M., Chiramel M.J. Evolving role of immunotherapy in the treatment of refractory warts. Indian Dermatol Online J. 2016;7(5):364–370. doi: 10.4103/2229-5178.190487.
31. Zimmerman R.K., Lin C.J., Raviotta J.M., Nowalk M.P. Do vitamin D levels affect antibody titers produced in response to HPV vaccine? Hum Vaccin Immunother. 2015;11(10):2345–2349. doi: 10.1080/21645515.2015.1062955.
32. Shim J., Perez A., Symanski E., Nyitray A.G. Association Between Serum 25-Hydroxyvitamin D Level and Human Papillomavirus Cervicovaginal Infection in Women in the United States. J Infect Dis. 2016;213(12):1886– 1892. doi: 10.1093/infdis/jiw065.
34. Hosono S., Matsuo K., Kajiyama H., Hirose K., Suzuki T., Kawase T. et al. Association between dietary calcium and vitamin D intake and cervical carcinogenesis among Japanese women. Eur J Clin Nutr. 2010;64(4):400– 409. doi: 10.1038/ejcn.2010.28.
35. Kumar A., Singh M.P., Kumar R.S., Ratho R.K. 25-Hydroxyvitamin D3 and 1,25 Dihydroxyvitamin D3 as an Antiviral and Immunomodulator Against Herpes Simplex Virus-1 Infection in HeLa Cells. Viral Immunol. 2018;31(8):589–593. doi: 10.1089/vim.2018.0026.
36. Suares A., Tapia C., Gonzalez-Pardo V. VDR agonists down regulate PI3K/ Akt/mTOR axis and trigger autophagy in Kaposi’s sarcoma cells. Heliyon. 2019;5(8):e02367. doi: 10.1016/j.heliyon.2019.e02367.
37. Suares A., Tapia C., Gonzalez-Pardo V. Antineoplastic effect of 1alpha, 25(OH)2D3 in spheroids from endothelial cells transformed by Kaposi’s sarcomaassociated herpesvirus G protein coupled receptor. J Steroid Biochem Mol Biol. 2019;186:122–129. doi: 10.1016/j.jsbmb.2018.10.004.
38. Mostafa A., Jalilvand S., Shoja Z., Nejati A., Shahmahmoodi S., Sahraian M.A., Marashi S.M. Multiple sclerosis-associated retrovirus, Epstein-Barr virus, and vitamin D status in patients with relapsing remitting multiple sclerosis. J Med Virol. 2017;89(7):1309–1313. doi: 10.1002/jmv.24774.
39. Perez-Perez S., Dominguez-Mozo M.I., Garcia-Martinez M.A., Aladro Y., Martinez-Gines M., Garcia-Dominguez J.M. et al. Study of the possible link of 25-hydroxyvitamin D with Epstein-Barr virus and human herpesvirus 6 in patients with multiple sclerosis. Eur J Neurol. 2018;25(12):1446–1453. doi: 10.1111/ene.13749.
40. Teymoori-Rad M., Mozhgani S.H., Zarei-Ghobadi M., Sahraian M.A., Nejati A., Amiri M.M. et al. Integrational analysis of miRNAs data sets as a plausible missing linker between Epstein-Barr virus and vitamin D in relapsing remitting MS patients. Gene. 2019;689:1–10. doi: 10.1016/j.gene.2018.12.004.
41. Abdel-Wahab N., Talathi S., Lopez-Olivo M.A., Suarez-Almazor M.E. Risk of developing antiphospholipid antibodies following viral infection: a systematic review and meta-analysis. Lupus. 2018;27(4):572–583. doi: 10.1177/0961203317731532.
42. Kim Y., Kim H.S., Park J.S., Kim C.J., Kim W.H. Identification of Epstein-Barr Virus in the Human Placenta and Its Pathologic Characteristics. J Korean Med Sci. 2017;32(12):1959–1966. doi: 10.3346/jkms.2017.32.12.1959.
43. Elliott S.E., Parchim N.F., Kellems R.E., Xia Y., Soffici A.R., Daugherty P.S. A pre-eclampsia-associated Epstein-Barr virus antibody cross-reacts with placental GPR50. Clin Immunol. 2016;168:64–71. doi: 10.1016/j.clim.2016.05.002.
Читайте также:

