Прогестерон при красной волчанке
Обновлено: 15.04.2024
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Чтобы исследовать состояние у пациентов с СКВ, которые принимали или недавно прекратили принимать противомалярийные препараты, исследователи выявили 1573 потенциальных участника из долгосрочного наблюдательного когортного исследования в университетской клинике.
Из этой многочисленной группы было выделено 88 клинических случаев - пациентов, которые достигли клинической ремиссии в течение как минимум года и прекратили прием противомалярийной терапии.
Первая контрольная группа была представлена пациентами, которые достигли ремиссии и продолжали принимать лекарства. Также был произведен второй контроль, в результате чего общее количество участников исследования составило 173.
Все пациенты наблюдались не менее 2 лет.
Обострение СКВ было определено как любое увеличение показателей по шкале SLEDAI-2K, при значительном обострении – превышение нормы на 4 или более баллов.
Средний возраст исследуемых составил 44 года, средний возраст в контрольной группе - 46 лет.
Представителями обеих групп были преимущественно белокожие женщины.
Причины отмены препаратов включали собственную инициативу, ремиссию, а также токсическое повреждение сетчатки, кожи, слизистых оболочек и органов сердечно-сосудистой системы.
20 участников экспериментальной группы сообщили о неблагоприятных побочных эффектах противомалярийных препаратов, связанных с их высоким профилем токсичности.
Врачи также сравнили результаты 26 пожилых пациентов с волчанкой, которые принимали гидроксихлорохин в течение как минимум 5 лет до момента прекращения приема препарата, с 32 пациентами контрольной группы, которые продолжали принимать гидроксихлорохин на момент исследования.
Обострение СКВ произошло в 61,4% случаев по сравнению с 45,1% в контрольной группе (P = 0,002), причем наиболее распространенными вариантами обострений были обострения со стороны кожи и скелетно-мышечной системы.
После многомерного анализа риск обострения более чем в два раза возрастал у тех, кто прекратил лечение (отношение шансов, 2,26; 95% доверительный интервал, 1,24–4,11; P = 0,008).
Более чем в половине случаев (n = 46) противомалярийные препараты возобновляли после отмены, что в основном было связано с обострением заболевания.
Из группы пациентов, возобновивших лечение в связи с обострением СКВ: у 88% вновь был достигнут контроль над заболеванием \ произошло улучшение состояния, у оставшихся 12% случились новые обострения.
Из 88 пациентов 51 пациент резко прекратили прием терапии тогда, как 37 пациентов отмену препаратов производили постепенно.
У пациентов, придерживающихся постепенной отмены, было меньше обострений (45,9%) по сравнению с пациентами, прекратившими лечение внезапно (72,6%).
После многофакторного анализа риск обострения более чем в три раза увеличился для группы внезапной отмены лекарств (OR 3,42; 95% ДИ 1,26-9,26; P = 0,016).
Пациенты, снизившие дозу противомалярийных препаратов, позднее возобновили полноценную терапию по сравнению с группой резкой отмены лекарств (37,8% против 62,7%; P = 0,02).
Только у 5 пожилых пациентов из каждой группы - 19,2% в группе отмены и 15,6% в группе пролонгирования терапии произошел эпизод обострения СКВ (OR 1,28; 95% ДИ 0,31-5,30; P = 0,73). Большинство обострений были кожными и скелетно-мышечными по своей природе; ни в одной из групп не было развития серьезных патологических состояний.
Медленное снижение дозы или продолжение приема противомалярийных препаратов может помочь предотвратить обострение болезни у пациентов с СКВ, достигших клинической ремиссии в течение как минимум года.
У пожилых пациентов с СКВ, которые постепенно прекращают прием гидроксихлорохина, также отсутствует повышенный риск обострения болезни.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
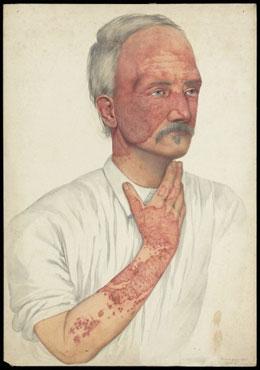
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди

По статистике, 9 из 10 людей с волчанкой – женщины. Болезнь обычно поражает в возрасте между 15 и 45 годами, хотя может начаться и в пожилом возрасте.
Есть два вида волчанки:
- Дискоидная красная волчанка;
- Системная красная волчанка.
Дискоидная красная волчанка, в основном, поражает кожу, не защищенную от воздействия солнечных лучей, и обычно не влияет на жизненно важные внутренние органы. При дискоидной красной волчанке образуются дискообразные (круглые участки) повреждения кожи, и после их заживления могут оставаться шрамы.
Системная красная волчанка – более серьезная проблема. Эта болезнь влияет и на кожу, и на жизненно важные органы. Помимо сильной сыпи на щеках и переносице, оставляющей шрамы если ее не лечить, при системной красной волчанке может появляться сыпь и на других участках тела. Но это не самое опасное. Помимо видимой сыпи системная красная волчанка может привести к воспалению и/или повреждению соединительной ткани в суставах, мышцах и коже, а также в мембранных тканях, окружающих легкие, сердце, почки и мозг. Мозг поражается крайне редко, но все же системная красная волчанка может стать причиной спутанности сознания, депрессии, судорог инсульта.
Системная красная волчанка способна влиять и на кровеносные сосуды. Такое воздействие приводит к появлению язв на коже, особенно на пальцах. У некоторых людей может развиться синдром Рейно, когда мелкие кровеносные сосуды в коже блокируются и мешают крови поступать к рукам и ногам. Чаще такое происходит на холоде. Такая ситуация обычно длится несколько минут, при этом в руки и ноги могут быть болезненными, побелеть или стать слегка голубоватыми. Людям с системной волчанкой и синдромом Рейно нужно обязательно носить перчатки и теплую одежду и обувь в холодное время года.
2. Причины заболевания
На сегодняшний день не установлен ни один фактор, с достоверностью являющийся причиной волчанки. Исследования показывают, что сочетание генетических, гормональных, экологических и иммунных факторов играет свою роль. Экологические факторы –от бактериальных или вирусных инфекций до тяжелого эмоционального стресса или переизбытка солнечного света – могут спровоцировать развитие волчанки. Некоторые лекарства (например, сильнодействующие наркотические препараты для лечения проблем с артериальным давлением и сердечными ритмами), могут вызвать появление волчанкоподобных симптомов. Высокий уровень эстрогена в начале беременности тоже может усилить волчанку.
Спровоцировать появление волчанки могут и другие факторы. Среди них курение, воздействие некоторых химических веществ (токсинов) и ряд инфекций. Так, с волчанкой может быть связан цитомегаловирус, парвовирус, инфекция гепатита С.
3. Диагностика волчанки
Волчанка, в том числе, системная красная волчанка – сложная для диагностики болезнь, потому что ее симптомы могут быть очень неопределенными. И в отличие от многих других заболеваний, волчанка не может быть диагностирована при помощи одного лабораторного теста. Тем не менее, лабораторные анализы могут помочь подтвердить диагноз волчанка (системная красная волчанка) и проконтролировать ход лечения.
Анализы крови для диагностики волчанки:
- Антинуклеарные антитела - ANA. Это оlин из видов антител, действующих против ядер клеток. ANA есть почти у всех людей с активной волчанкой. Но особенность и в том, что положительный результат теста не всегда указывает на волчанку. Поэтому такой анализ не может быть единственным критерием диагностики волчанки.
- Антифосфолипидные антитела- APL. Такие антитела направленно действуют против фосфолипидов. APL присутствуют примерно у 60% людей с волчанкой, и их присутствие может помочь подтвердить диагноз. Этот анализ крови обычно делают женщинам с подозрением на волчанку, когда требуется профилактика и мониторинг риска тромбоза, выкидыша или преждевременных родов. Но как и в предыдущем случае, APL могут оказаться в крови у людей и без волчанки.
- Анти-Sm- еще одна группа антител, действующих на определенный белок в ядре клеток. Такие антитела очень редко встречаются у людей, не болеющих волчанкой. Но с другой стороны, они есть лишь у 30% заболевших.
- Тест на анти-двухцепочечную ДНК бывает положительным у 75-90% людей с волчанкой. И в целом это очень специфическое исследование. Часто титр (или уровень антител) у пациентов возрастает с усилением болезни, поэтому данное исследование можно использовать для оценки активности заболевания. Кроме того, наличие таких антител указывает на большой риск воспаления почек из-за волчанки. Как и в предыдущих случаях, этот анализ крови не является абсолютным критерием диагностики волчанки – у 25% людей с волчанкой тест оказывается отрицательным.
Помимо этих и других анализов крови на антитела в комплексной диагностике волчанки используются анализы крови на наличие воспалительного процесса в организме, определение скорости оседания эритроцитов, общие анализы крови для определения содержания в ней различных типов клеток, биохимический анализ крови, анализы мочи для оценки влияния волчанки на почки. Каждое в отдельности такое исследование не может служить основанием для постановки диагноза волчанка, системная красная волчанка. Но в комплексе результат диагностики может быть довольно точным.
В любом случае, во время диагностики волчанки врачи будут исключать другие заболевания, которые могут давать схожие симптомы – ревматоидный артрит, инфекции, рак и другие.
4. Лечение болезни
Для пациентов с волчанкой, особенно с системной красной волчанкой, очень важно правильное питание. Диета должна включать много фруктов, овощей и здоровых жиров. Количество обработанных продуктов должно быть сведено к минимуму. Жирная морская рыба, капсулы рыбьего жира могут уменьшить боль в суставах.
При системной красной волчанке нужно внимательно соблюдать баланс между отдыхом и физическими нагрузками. С одной стороны, отдых важен для снятия усталости из-за волчанки. Но и важно давать организму адекватные нагрузки. Упражнения увеличивают мышечную силу, облегчают подвижность суставов, помогают контролировать вес и предотвращают потерю костной массы. Оптимальными считаются занятия ходьбой и плавание.
В целом же при волчанке нельзя перенапрягаться (морально и физически). Нужно больше спать (иногда до 12 часов в сутки). На солнце лучше не находиться, а если это необходимо – пользоваться защитными кремами.
Все эти меры в сочетании с регулярными обследованиями у врача помогают держать системную красную волчанку или дискоидную красную волчанку в ремиссии и в целом неплохо себя чувствовать.
Заболевания ![частые заболевания]()
Жалобы и симптомы ![Жалобы и симптомы]()
Если вы обнаружили у себя подобные симптомы, возможно, это сигнал заболевания, поэтому рекомендуем проконсультироваться с нашим специалистом.
Диагностика ![Диагностика]()
- Ревмапробы (С-реактивный белок, АСЛ-О, ревматоидный фактор)
- Рентгенография суставов
- Биохимический анализ крови
Наши цены ![Типичные жалобы]()
- Консультация врача ревматолога от 5000 рублей
- Ревматоидный фактор - 500 р.
- С-реактивный белок - 500 р.
- Антистрептолизин-О (АСЛ-О) - 500 р.
- Биохимический анализ крови (стандартная, 10 показателей) - 2470 р.
- Биохимический анализ крови (расширенаяая, 14 показателей) - 3565 р.
- Общий анализ крови - 675 р.
- Рентгенография суставов - от 2000 р.
Мы стараемся оперативно обновлять данные по ценам, но, во избежание недоразумений, просьба уточнять цены в клинике.
Данный прайс-лист не является офертой. Медицинские услуги предоставляются на основании договора.
Читайте также:




