Промотирование и отравление катализаторов
Обновлено: 24.04.2024
1)окислительно-восстановительный – это процессы, обусловленные переносом электрона: окисление, восстановление, гидрирование и де-. Катализаторы этих процессов: переходные металлы (d, f-элементы) и их соединения; простые оксиды (оксиды ванадия V2O5, MnO2, MgO3, Cr2O3); более сложные оксиды (Fe3O4, FeO, Fe2O3); сульфиды (MoS2, WS2); комплексные соединения и соли.
Высокая каталитическая активность этих веществ объясняется тем, что эти элементы могут существовать в различных степенях окисления и переходы электронов не требуют больших затрат энергии.
2)кислотно-основной катализ – процессы каталитического крекинга, гидратация, полимеризация. Катализаторы – вещества, которые способны передать или принять протон от реагентов или способные к гетеролитическому взаимодействию с реагентами. Среди этих веществ наиболее часто применяются: кислоты Бренстеда H2SO4, H3PO4, HF, H2CO3; кислоты Льюиса AlCl3, FeCl3, BF3; вещества основного характера NaO, CaO, MgO.
3)ферментативный катализ. Биологические катализаторы, ускоряющие скорость реакции, называются ферментами. Принципиальное отличие ферментов от катализаторов других типов связано с высокой специфичностью, выходом целевого продукта 100%.
Эффективность использования катализаторов в промышленности зависит от их технологических характеристик: активности, температуры зажигания, селективности, механической прочности, теплопроводности, пористости, устойчивости к ядам, доступностью и дешевизной.
1)Активностью катализатора называется мера ускоряющего воздействия по отношению к данной реакции (отношение констант скоростей каталитической и некаталитической реакций).
Снижая энергию активации, катализатор ускоряет ее на много порядков.
Продолжительность работы катализатора можно условно разделить на три периода:
1)активация или разработка катализатора (Оτ1), на которой происходит окончательное формирование физико-химических свойств, а иногда и химического состава продукта. Обычно активация проводится путем постепенного разогрева катализатора до температуры реакции в потоке воздуха, газа или воды без реагирующих веществ или в их присутствии. Режим активации подбирается эмпирически.
2)постоянная активность – рабочий, стационарный период работы;
3)прогрессирующая дезактивация, связанная с изменением структуры поверхности катализатора.
Старение – естественный процесс, при котором активность уменьшается равномерно по всему слою катализатора. Утомление – неравномерное падение активности в слое катализатора – опасный процесс, проявляется задолго до истечения срока жизни катализатора в результате неправильной эксплуатации.
2)Температура зажигания катализатора – это та температура, при которой процесс начинает идти с достаточной для промышленных процессов скоростью, обеспечивая заданную производительность. Чем выше активность катализатора, тем ниже температура его зажигания.
С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания, что позволяет снизить энергетические затраты на предварительный нагрев реакционной смеси.
3)Селективностью или избирательностью катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных. На селективность влияют многие факторы. Прежде всего, - число координационных мест у активного атома поверхности, минимальное количество атомов поверхности, необходимых для образования связей с молекулой реагента, прочность этих связей, т.е. структура поверхности. Следующей группой факторов могут стать природа и структура носителей, а также происхождение сырья. Промышленный катализатор должен отличаться достаточной гибкостью и перерабатывать широкий ассортимент сырья без потери селективности.
4)Пористая и кристаллическая структура катализатора.
Важным свойством катализатора является его пористая структура, которая характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему), удельной поверхностью катализатора (т.е. приходящейся на единицу массы или объема).

При выборе твердого вещества, которое должно служить активным катализатором для гетерогенных газовых реакций, важную роль играет доступность поверхности катализатора для реагирующих газов. Чем больше для каждого данного катализатора поверхность, доступная для реагирующего газа, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора.
Промышленные катализаторы всегда имеют развитую внутреннюю поверхность, иначе внешняя поверхность, весьма небольшая, быстро подвергалась бы отравлению, и катализатор вскоре утрачивал бы активность. Чем выше пористость катализатора и чем меньше диаметр пор, тем больше внутренняя поверхность. Современные катализаторы характеризуются большими значениями удельной поверхности (до 10- 100 м 2 /г).
В качестве катализаторов стараются применять природные или искусственные высокопористые адсорбенты (алюмосиликаты, цеолиты, силикагель, активированный уголь и т.д.). Эти вещества употребляют как носители, на поверхность которых наносят активные компоненты.
Наряду с пористой структурой большое значение имеет кристаллическая структура катализатора. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью.
5)Промотирование и отравление катализаторов.
Отравлением катализатора каталитическими ядами называют частичную или полную потерю его активности под воздействием контактных ядов. Введение небольшого количества посторонней добавки к основному катализатору приводит к резкому повышению его активности или снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором – об отравлении катализатора.
Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора постепенно восстанавливается, если в реакционной смеси больше не содержится каталитического яда. При необратимом отравлении действием свежей реакционной смеси активность восстановить не удается. Одно и то же вещество может вызвать и обратимое и необратимое отравление, в зависимости от продолжительности его действия, концентрации в реакционной смеси, температуры процесса.
Для удлинения срока службы катализатора в промышленных условиях предусматривают тщательную очистку реагирующих веществ от примесей, являющихся каталитическими ядами. Катализатор отравляется иногда побочными продуктами реакции. В реакциях органических соединений (крекинга, дегидрирования, изомеризации) отравление катализаторов часто происходит в результате образования высокоуглеродистой полимерной пленки (кокса), покрывающей поверхность катализатора. Для ее удаления цикл катализа сменяют циклом регенерации – катализатор продувают при высокой температуре воздухом для перевода кокса в СО2.
Современные процессы основного неорганического синтеза, нефтепереработки, нефтехимии и органического синтеза в настоящее время без применения катализаторов невозможно представить. Около 90 % промышленных химико-технологических процессов ведут с применением катализаторов. Примерами неорганического синтеза являются: производства аммиака, азотной и серной кислот; нефтехимии и органического синтеза – процессы производства метанола, стирола, бутадиена, фенола и ацетона, ацетальдегида и др. В нефтепереработке – это процессы каталитическиого крекинга и риформинга, гидроочистки и гидрокрекинга, алкилирования изобутана и изомеризации парафиновых углеводородов и т.д.
Каталитические процессы имеют ряд важных преимуществ по сравнению с некаталитическими. Кроме того, что применение катализаторов резко ускоряет скорости химических реакций, процессы с их использованием могут быть организованы как непрерывные, безотходные и менее энергоемкие, отличающиеся высокими технико-экономическими показателями и обеспечивающие более высокий выход целевых продуктов.
Катализаторы – это вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость. При этом они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий.
Влияние катализатора на механизм химической реакции можно пояснить на примере реакции А+В ® D, имеющей без катализатора энергию активации Ео
(рис. 1). Рассмотрим энергетическую диаграмму этой реакции:

Рисунок 1 - Энергетические диаграммы каталитической и некаталитической
I и II - энергетические уровни исходных реагентов и продуктов реакции; 1 - путь реакции без катализатора; 2 - путь каталитической реакции
Ход реакции без катализатора на энергетической диаграмме изображен кривой 1. В присутствии катализатора механизм реакции изменяется, и она протекает через несколько последовательных стадий в соответствии с кривой 2. Например, первой стадией может быть образование промежуточного активированного комплекса АКт:
А + Кт ® АКт, где Кт - катализатор.
Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта:
Последней стадией является разложение комплекса DКт с образованием продукта D и высвобождением катализатора для нового каталитического цикла:
Каждая из этих последовательных стадий характеризуется своими значениями энергии активации E1, E2, E3, но, как правило, высота каждого из этих потенциальных барьеров ниже энергии активации Eо. Таким образом, в присутствии катализатора реакция протекает по энергетически более выгодному пути, что позволяет проводить процесс с большей скоростью.
Исходное (I) и конечное (II) энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми. Следовательно, катализатор не может изменить состояние химического равновесия, которое не зависит от пути реакции. Роль катализатора состоит лишь в изменении скорости достижения состояния равновесия. Катализатор может увеличивать скорость только тех процессов, которые разрешены термодинамически, но не может инициировать термодинамически невозможные реакции.
Некоторые химические реакции без катализаторов практически неосуществимы из-за слишком большой энергии активации. Казалось бы, что для преодоления высокого энергетического барьера можно повысить кинетическую энергию молекул, т.е. увеличить температуру. Но для многих обратимых экзотермических реакций повышение температуры приводит к смещению равновесия в обратную сторону и делает реакцию неразрешенной термодинамически. В таких случаях применение катализатора не только оправдано, но и необходимо. Катализатор снижает энергию активации реакции и позволяет тем самым проводить ее при существенно более низких температурах. Очень важна роль катализаторов в осуществлении сложных реакций, так как катализаторы обладают способностью избирательно влиять на скорость только какой-то одной нужной реакции.
В качестве примера рассмотрим реакцию синтеза аммиака, характеризующуюся очень большим значением энергии активации (примерно 280 кДж/моль). Для преодоления такого высокого энергетического барьера реагенты необходимо было бы нагреть до температур выше 1000°С, при которых равновесная степень превращения даже при очень высоких значениях давления ничтожно мала.
В присутствии катализатора на основе железа энергия активации синтеза аммиака снижается примерно до 160 кДж/моль, что позволяет проводить реально процесс с достаточно высокой скоростью при температурах 400-500°С и высоких давлениях, достигая 20-35%-ной степени превращения исходного сырья.
Каталитические процессы подразделяют на две большие группы – гомогенные и гетерогенные. Наибольшее распространение в промышленности получили гетерогенно-каталитические процессы. В свою очередь, подавляющее большинство гетерогенно-каталитических процессов такие, в которых границей раздела фаз служит поверхность твердого катализатора, находящегося в газообразной или жидкой реакционной среде. Существенным преимуществом таких процессов является простота разделения продуктов реакции и частиц катализатора для повторного использования катализатора.
Технологические характеристики твердых катализаторов
Подбор катализаторов для проведения промышленных процессов – задача чрезвычайно сложная. Катализаторы очень специфичны по отношению к различным химическим реакциям. Твердые катализаторы – это, как правило, высокопористые вещества с развитой внутренней поверхностью, характеризующиеся определенной пористой и кристаллической структурой, активностью, селективностью и рядом других технологических характеристик. Наиболее важные характеристики твердых катализаторов:
1) Активность – это мера ускоряющего воздействия катализатора по отношению к данной реакции. При сравнении разных катализаторов обычно выбирают более активный, если он удовлетворяет основным технологическим требованиям. В связи с большим разнообразием каталитических процессов не существует единого количественного критерия активности. Это связано с тем, что применение различных катализаторов даже для одной и той же химической реакции может по-разному изменить ее механизм. Как правило, применение катализатора приводит к изменению и порядка реакции, и энергии активации, и предэкспоненциального множителя. Количественным критерием активности катализатора для данной реакции может служить, например, константа скорости, измеренная для разных катализаторов в сопоставимых условиях. Такой подход применим, если для всех сравниваемых катализаторов данной группы остается одинаковым порядок реакции. Иногда сравнивают катализаторы по скорости реакции или по степени превращения реагентов в стандартных условиях, по количеству реагентов, вступающих во взаимодействие в единицу времени на единице поверхности катализатора (производительности или напряженности катализатора) и т.п.
2) Селективность – это способность катализатора избирательно ускорять целевую реакцию при наличии нескольких побочных. Сложные каталитические реакции могут протекать по нескольким термодинамически возможным направлениям с образованием большого числа различных продуктов. Преобладающее направление зависит от используемого катализатора, причем не всегда ускоряется процесс, термодинамически самый выгодный из нескольких возможных. Количественно селективность катализатора можно оценить как селективность процесса – интегральную или дифференциальную. Селективность зависит не только от выбранного катализатора, но и от условий проведения процесса, от области протекания гетерогенно-каталитического процесса и т.д.
Если одновременно протекает несколько параллельных реакций, можно подобрать разные селективные катализаторы для каждой из этих реакций. Например, в присутствии оксида алюминия или оксида тория этанол разлагается преимущественно на этилен и воду:
В присутствии серебра, меди и других металлов практически имеет место только реакция дегидрирования спирта с образованием уксусного альдегида:
В присутствии смешанного катализатора (А12О3 + ZnO) с достаточно высокой селективностью идут реакции дегидратации и дегидрирования с образованием бутадиена:
3) Температура зажигания – это минимальная температура, при которой технологический процесс начинает идти с достаточной для практических целей скоростью. Понятие "зажигание", означает, что при увеличении температуры выше предела, равного Тзаж, происходит резкое, скачкообразное увеличение скорости реакции. Так как каждый катализатор характеризуется своими кинетическими параметрами, то и температуры зажигания будут различными для разных катализаторов. С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания, что позволяет снизить энергетические затраты на предварительный нагрев реакционной смеси. Особенно важно иметь невысокую температуру зажигания катализатора при проведении обратимых экзотермических реакций, тогда невысокие температуры проведения процесса позволяют сместить равновесие реакции в сторону образования продуктов.
4) Пористая структура катализатора – характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему), удельной поверхностью (поверхностью, приходящейся на единицу массы или объема). При выборе твердого вещества, которое должно служить активным катализатором гетерогенных газовых реакций, важную роль играет доступность поверхности. Чем больше для данного катализатора поверхность, доступная для реагирующих молекул, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора. Промышленные катализаторы всегда имеют развитую внутреннюю поверхность, иначе весьма небольшая внешняя поверхность быстро подвергалась бы отравлению, и катализатор вскоре утрачивал бы активность. Чем выше пористость катализатора и чем меньше диаметр пор, тем больше внутренняя поверхность. Современные катализаторы характеризуются большими значениями удельной поверхности (до 10-100м 2 /г). Однако распределение пор по размерам может оказаться таким, что часть поверхности катализатора окажется недоступной для молекул большого размера и, кроме того, скорость превращения реагентов в конечные продукты может уменьшаться вследствие затруднения диффузии реагентов внутри пор. Для получения катализаторов с развитой пористой структурой используют специальные методы их приготовления. Стараются применять в качестве катализаторов природные или искусственные высокопористые адсорбенты (алюмосиликаты, цеолиты, силикагель, активированный уголь и т. д.). Эти вещества употребляют также как носители, на поверхность которых наносят активные компоненты.
5) Кристаллическая структура катализатора – различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью. Например, переход -Аl2О3 в -А12О3 (это происходит при температуре около 1200 о С) на несколько порядков снижает активность этого вещества как катализатора.
Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором – об отравлении.
Механизм промотирования твердых катализаторов может быть различным. Добавки могут вступать с основным катализатором в химическое взаимодействие, образуя на поверхности продукты, обладающие более высокой каталитической активностью. Они могут изменять условия взаимодействия с реагентами в местах контакта основного компонента и промотора, а также увеличивать дисперсность или стабилизировать пористую и кристаллическую структуру катализатора и т.п.
Например, каталитическая активность V2O5 по отношению к реакции окисления диоксида серы повышается в сотни раз при добавлении небольших количеств сульфатов щелочных металлов; введение 2-3 % А12О3 в катализатор синтеза аммиака (пористое железо) позволяет создать стабильную геометрическую структуру, не меняющуюся под воздействием реакционной среды в течение длительного времени.
Практическому использованию каталитических процессов часто препятствует снижение активности катализатора при воздействии на него веществ, называемых каталитическими ядами. Это объясняется в соответствии с теорией активных центров, согласно которой каталитическую активность проявляет не вся поверхность катализатора, а лишь некоторые ее участки, обладающие определенным энергетическим и геометрическим соответствием реагирующим молекулам – активные центры. Каталитические яды блокируют эти активные центры, образуя с ними поверхностные химические соединения.
Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора постепенно восстанавливается, если в реакционной смеси больше не содержится каталитического яда. При необратимом отравлении действием свежей реакционной смеси активность восстановить не удается. Одно и то же вещество может вызвать как обратимое, так и необратимое отравление в зависимости от продолжительности его действия, концентрации в реакционной смеси, температуры процесса. С целью удлинения срока службы промышленных катализаторов в технологических схемах предусматривают тщательную очистку реагирующих веществ от примесей, являющихся каталитическими ядами.
Часто ядами выступают соединения серы, сероводород, диоксид серы, мышьяк.
Для железного катализатора синтеза аммиака каталитическими ядами являются кислород и кислородосодержащие соединения (СО, СО2, Н2О). При содержании
1∙10 –2 % СО в газовой смеси, поступающей на катализатор, работающий при давлении 30 МПа и температуре 450°С, через 6 сут. активность катализатора уменьшается на 25 %. Его активность можно полностью восстановить за 1 сут. работы с чистым газом. При содержании 5∙10 –2 % СО в исходном газе через 3 сут. активность катализатора падает на 67 %, а через 4 сут. работы на чистом газе полностью восстанавливается. При температуре 500°С и содержании 5∙10 –3 % О2 концентрация в газе на выходе падает на 4 % и применение чистого газа уже не восстанавливает прежнюю активность катализатора.
В ряде случаев катализатор отравляется побочными продуктами реакции. Так, в реакциях органических соединений (крекинга, дегидрирования, изомеризации) отравление катализаторов часто происходит в результате образования высокоуглеродистых полимерных соединений – так называемого кокса, покрывающего поверхность катализатора. Для его удаления цикл каталитической реакции сменяют циклом регенерации – катализатор продувают при высокой температуре около 500-700 о С воздухом для выжига кокса (перевода в СО2).
4. Основные стадии гетерогенно-каталитических процессов
Гетерогенно-каталитическая реакция на поверхности твердого катализатора - это сложный многостадийный процесс. Наблюдаемая общая скорость каталитической реакции зависит от относительных скоростей нескольких различных по своей физической и химической природе стадий. Основные стадии взаимодействия газообразных реагентов с зерном пористого катализатора показаны на рис. 2.
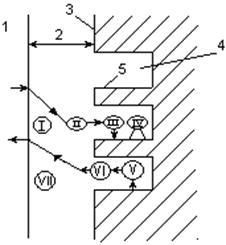
Рисунок 2 – Элементарные стадии гетерогенного катализа в системе Г–Т
Общая скорость гетерогенно-каталитического процесса лимитируется наиболее медленной из перечисленных элементарных стадий. Иногда наиболее медленной стадией оказывается химическое взаимодействие на поверхности катализатора, а иногда – диффузионные процессы. В зависимости от лимитирующей скорость стадии различают каталитические процессы, происходящие в кинетической, внутридиффузионной и внешнедиффузионной области.
В кинетической области (стадии 3-5) протекают, как правило, процессы на малоактивных катализаторах с малыми размерами зерен и крупными порами при турбулентном режиме движения потока реагентов и сравнительно низких температурах. Увеличение скорости каталитических процессов в кинетической области достигается, прежде всего, повышением температуры.
Во внутридиффузионной области (стадии 2 и 6) ускорить процессы можно путем применения катализаторов с меньшим размером зерен и более крупными порами. Однако при увеличении размеров пор резко уменьшается удельная поверхность катализатора. Поэтому надо находить оптимальную структуру катализатора, при которой поры достаточно доступны для участников реакции. Внутридиффузионная область характерна для проведения процессов в стационарном (фильтрующем) слое катализатора.
Во внешнедиффузионной области (стадии 1 и 7) протекают процессы на высокоактивных катализаторах. Для увеличения скорости процесса применяют высокие линейные скорости потока реагентов, создают его турбулизацию путем перемешивания.
В основе отравления лежит блокировка части поверхности катализатора ядами. В результате блокированная часть поверхности устраняется от участия в процессе. При этом на поверхности не создаются ни какие новые участки, а часть поверхности, оставшаяся неотравленной, работает с теми же показателями, что и до отравления. С этой точки зрения можно сформулировать основные особенности, которые должны проявляться при отравлении однородной и неоднородной поверхности. Отравление однородной поверхности равноценно простому уменьшению абсолютной величины поверхности или уменьшению количества катализатора.
1. Механизм реакции и соотношение между скоростями параллельных и последовательных стадий, из которых слагается суммарный каталитический процесс, не должен изменяться. Отравление не должно вызывать изменения в составе продуктов реакций.
2. Основные кинетические характеристикипроцесса не должны меняться.
где с – концентрация яда, α - коэффициент отравления.
При отравлении блокировкой неоднородной поверхности исчезает однозначная зависимость между количеством блокирующего яда и активностью катализатора. В качестве существенного параметра возникает зависимость активности от характера размещения яда на поверхности катализатора. Располагаясь по-разному на поверхности, одно и то же количество яда может по - разному влиять на активность. Здесь следует рассмотреть 3 случая:
1. Яд равномерно распределяется по поверхности активных центров. В этом случае будет наблюдаться пропорциональное уменьшение активности с концентрацией яда.
2. Блокировка начинается с наименее активных участков, в то время как реакция осуществляется на наиболее активных участках с наименьшей энергией активации. В этом случае активность катализатора до некоторого предела не будет зависеть от концентрации яда, и только при достижении некоторой критической концентрации яда будет наблюдаться резкое отравление катализатора и соответственно изменение энергии активации.
3. При отравлении яд заполняет поверхность, начиная с самых активных участков. Первые порции яда действуют наиболее сильно. Изменение активности от количества яда определяется функцией распределения активности участков на поверхности.
Каков механизм промотирования?
Для активирующего (промотирующего) действия добавок допускается ряд возможных механизмов.
Во-первых, промотирование связывают с появлением на поверхности новых границ раздела между кристаллами катализатора и промотора или с образованием поверхностного сплава промотора с катализатором. При этом величина поверхности не изменяется. Это отвечает тому, что число активных центров на поверхности не изменяется, но создаются активные центры нового типа, на которых реакция идет с меньшей энергией активации. Механизм действия добавки связан со снижением энергии активации.
Во-вторых, промотору приписывается способность влиять на кинетику процесса приготовления катализатора, обеспечивая образование более дисперсных или более дефектных твердых тел. В этом случае основное влияние добавки обусловлено изменением числа активных центров, увеличением поверхности без значительного изменения свойств активных центров и энергии активации реакции.
1. Обратимое отравление
2. Необратимое отравление
СО убивает Pt катализатора необратимо.
3. Накапливающееся отравление
S отравляет Fe катализатор синтеза NH3, причем это отравление накапливается до определенной степени, после определенной концентрации активность резко снижается.
4. Благоприятствующее отравление.
Сl2, Br2, J2 могут подтравливать катализатор, в результате подавляется второй процесс.
Читайте также:

