Протезирование клапанов сердца инфекционный эндокардит
Обновлено: 18.04.2024
Чувашский государственный университет им. И.Н. Ульянова, Вторая городская больница, Чебоксары
ФГБУ "Российский научный центр хирургии им. акад. Б.В. Петровского" РАМН, Москва
ФГБУ Российский научный центр хирургии РАМН им. акад. Б.В. Петровского, Москва
РНЦХ им. акад. Б.В. Петровского РАМН, Москва
Повторные хирургические вмешательства на клапанах сердца у взрослых пациентов
Журнал: Кардиология и сердечно-сосудистая хирургия. 2014;7(6): 82‑91
Иванов В.А., Мьйо С.Х., Евсеев Е.П., Айдамиров Я.А. Повторные хирургические вмешательства на клапанах сердца у взрослых пациентов. Кардиология и сердечно-сосудистая хирургия. 2014;7(6):82‑91.
Ivanov VA, M'ĭo SKh, Evseev EP, Aĭdamirov IaA. Repeated surgical interventions on the heart valves in adults. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2014;7(6):82‑91. (In Russ.).
Чувашский государственный университет им. И.Н. Ульянова, Вторая городская больница, Чебоксары
Проанализированы непосредственные результаты повторных хирургических вмешательств у пациентов, ранее перенесших операцию по поводу клапанной патологии в условиях искусственного кровообращения. За период с 2003 по 2012 г. повторные вмешательства на клапанном аппарате сердца выполнены 90 (6,8%) пациентам. Возраст пациентов варьировал от 18 до 70 лет (в среднем 54,6±9,5 года). Показаниями к проведению повторной операции были: рецидив порока ранее реконструированного клапана или формирование порока на другом клапане сердца - 43 (47,8%) пациента; дисфункция механических протезов клапанов сердца - 43 (47,8%); дисфункция биологических протезов вследствие дегенеративной инволюции - 4 (4,4%). Изолированное репротезирование митрального или аортального клапана сердца выполнено 36 (40%) больным, ушивание парапротезной фистулы с пластикой трехстворчатого клапана по Де Вега - 2 (2,2%). Повторные вмешательства на митральном и аортальном клапанах были проведены 14 (15,6%) пациентам. Летальность составила 2,2% (2 пациента). Продемонстрированы хорошие результаты по летальности и количеству послеоперационных осложнений.
Чувашский государственный университет им. И.Н. Ульянова, Вторая городская больница, Чебоксары
ФГБУ "Российский научный центр хирургии им. акад. Б.В. Петровского" РАМН, Москва
ФГБУ Российский научный центр хирургии РАМН им. акад. Б.В. Петровского, Москва
РНЦХ им. акад. Б.В. Петровского РАМН, Москва
Развитие кардиохирургии за последние десятилетия позволило в значительной степени расширить показания к коррекции пороков сердца и улучшить выживаемость пациентов в отдаленные сроки после операции. В значительной степени увеличилось количество операций при клапанной патологии сердца, выполняемых в условиях искусственного кровообращения (ИК). В силу ряда объективных причин растет и количество повторных вмешательств, что связано с рецидивом порока после реконструктивных пластических операций, дисфункцией механического протеза, обусловленной эндокардитом или неадекватной антикоагулянтной терапией, дегенерацией биологических протезов и т.д. В то же время повторные операции на клапанах сердца технически намного сложнее и многими авторами рассматриваются как фактор риска [1, 3, 8].
Цель исследования - анализ непосредственных результатов повторных хирургических вмешательств у пациентов, ранее перенесших операцию при клапанной патологии в условиях ИК.
Материал и методы

За период с 2003 по 2012 г. в отделении хирургии пороков сердца ФГБНУ РНЦХ им. акад. Б.В. Петровского повторные вмешательства на клапанном аппарате сердца выполнены 90 (6,8%) пациентам. У 51 (56,7%) пациента первичная операция выполнялась в других медицинских учреждениях. Возраст пациентов варьировал от 18 до 70 лет (в среднем 54,6±9,5 года). Среди больных были 33 (36,7%) мужчины и 57 (63,3%) женщин (табл. 1).
В исследование были включены пациенты, поступившие для проведения повторного вмешательства после успешной первичной коррекции. Из исследования исключались пациенты, которым проведение повторного вмешательства требовалось в результате возникшего осложнения в течение их пребывания в стационаре после первичной операции. Сроки между первой операцией и повторным вмешательством колебались от 2 мес до 36 лет, в среднем 11,6±8,5 года. Трем пациентам в нашем исследовании операция на клапанах сердца была выполнена в третий раз, интервал между вторым и третьим вмешательствами составил 9, 12 и 15 лет.
Среди первичных вмешательств реконструктивные пластические операции на митральном клапане были выполнены 34 (37,8%) пациентам; изолированное протезирование митрального клапана - 32 (35,6%); изолированное протезирование аортального клапана - 20 (22,2%); протезирование митрального и аортального клапанов сердца проведено 4 (4,4%). У 50 (89,2%) пациентов при первичной операции использовались механические протезы клапанов сердца, биологические протезы были имплантированы у 6 (10,8%).
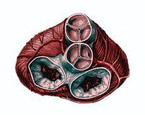
Показания к проведению повторной операции представлены в табл. 2. Рецидив порока сердца в большинстве случаев (43 пациента, 47,8%) был вызван прогрессированием ревматического процесса с фиброзной деформацией и кальцинозом створок клапана, подклапанных структур и фиброзного кольца. У 10 больных за прошедшие годы после операции сформировался порок ревматической этиологии на неоперированном клапане. Среди причин дисфункции механических протезов клапанов были выявлены: тромбоз (см. рисунок на цв. вклейке) - 16 (17,8%) случаев, паннус - 14 (15,6%), парапротезные фистулы - 13 (14,4%). Рисунок 1. Обструкция механического клапана сердца тромбом. У 10 больных образование парапротезных фистул было связано с протезным инфекционным эндокардитом, у 3 признаков эндокардита выявлено не было.
Рестернотомия выполнялась по стандартной методике с удалением проволочных лигатур и использованием осциллирующей пилы. Этот этап операции был в значительной степени облегчен, если при первичной операции было выполнено ушивание перикарда на всем протяжении. Спаечный процесс в перикарде различной степени выраженности наблюдался у всех пациентов. Кардиолиз осуществляли тупым и острым путем. В первую очередь выделяли структуры, необходимые для подключения аппарата ИК. Подключение аппарата ИК проводили по схеме аорта-полые вены. В случае нарушений гемодинамики кардиолиз продолжали на параллельном ИК и осуществляли только в объеме, необходимом для проведения основного этапа операции, что позволило минимизировать кровопотерю на этом этапе операции.
И только в 5 случаях выполняли доступ по Дюбосту, который обладает максимальной обзорностью митрального клапана в условиях неполного кардиолиза, но в то же время является наиболее травматичным. Для доступа к аортальному клапану производили аортотомию в типичном месте.
При повторном вмешательстве во всех случаях после реконструктивной пластической операции прибегали к протезированию клапана. Изолированное репротезирование митрального или аортального клапана сердца выполнено 36 (40%) пациентам, ушивание парапротезной фистулы с пластикой трехстворчатого клапана по Де Вега - 2 (2,2%). Повторные вмешательства на митральном и аортальном клапанах были проведены 14 (15,6%) пациентам, из них протезирование митрального и аортального клапанов после первичной пластики выполнены 6 (6,7%). Протезирование митрального и трикуспидального клапанов сердца выполнено 1 (1,1%) пациенту, репротезирование митрального и аортального клапанов - 2 (2,2%), репротезирование митрального клапана и протезирование аортального клапана - 3 (3,3%), репротезирование аортального клапана и протезирование митрального клапана - 2 (2,2%) пациентам. Кроме того, 3 (3,3%) больным дополнительно выполнено аортокоронарное шунтирование, 31 (34,4%) - пластика трикуспидального клапана по Де Вега.
При протезировании клапанов сердца у 11 (12,2%) пациентов были использованы биопротезы, механические протезы имплантированы 79 (85,9%).
Время ИК составило в среднем 113,6±34,7 мин (от 50 до 212 мин), время пережатия аорты - 80,4±29,3 мин (32-172 мин). Интраоперационная кровопотеря в среднем составила 1024,5±110,2 мл (400-2000 мл). Применение системы для возврата аутологичной крови Cell Saver, а также дооперационная заготовка аутоплазмы позволили более чем в половине случаев избежать применения донорских компонентов крови.
Результаты
Летальность составила 2,2% (2 пациента). Причинами летальных исходов были в первом случае массивная кровопотеря вследствие спонтанного разрыва миокарда левого желудочка в 1-е сутки после репротезирования митрального и аортального клапанов сердца, во втором - тромбоэмболия легочной артерии и аритмогенная остановка сердца в 1-е сутки после протезирования аортального и митрального клапанов сердца.

Среди нелетальных осложнений в ближайшем послеоперационном периоде (табл. 3) наиболее часто встречались нарушения ритма сердца - у 35 (38,9%) пациентов. У 6 (6,5%) больных вследствие сохраняющегося узлового ритма был установлен временный электрокардиостимулятор на срок более 10 сут. В 9 (10%) случаях развилось трепетание предсердий, в 8 из них была успешно проведена кардиоверсия. У 1 пациента трепетание предсердий было резистентно к электроимпульсной терапии, и впоследствии была выполнена радиочастотная абляция. Установка постоянного электрокардиостимулятора была произведена 5 пациентам, показаниями являлись полная поперечная блокада, узловая брадикардия, дисфункция синусового узла и фибрилляция предсердий с паузами больше 2,5 с.
Второе место по частоте развития заняла сердечная недостаточность, которая отмечалась у 30 (33,3%) пациентов. У 10 (11,1%) больных выраженная сердечная недостаточность, потребовавшая кардиотонической поддержки более 2 сут, была обусловлена исходно тяжелым состоянием пациентов, объемом или сочетанным характером повторного вмешательства.
Дыхательная недостаточность отмечалась у 10 (11,1%) пациентов. Осложнения со стороны центральной нервной системы в ближайшем послеоперационном периоде отмечены у 4 (4,4%) пациентов: у 3 диагностирована энцефалопатия, острое нарушение мозгового кровообращения в системе левой средней мозговой артерии на 2-е сутки после репротезирования митрального клапана - у 1 (1,1%). У 2 (2,2%) больных возникла транзиторная печеночная недостаточность, у 3 (3,3%) - почечная недостаточность, причем в одном наблюдении потребовалось проведение сеансов гемодиализа. Инфекционные осложнения возникли у 2 пациентов: в одном случае был диагностирован медиастинит, во втором - нагноение мягких тканей послеоперационной раны. Послеоперационное кровотечение, потребовавшее проведения рестернотомии, развилось у 1 (1,1%) больного.
Число повторных операций на клапанах сердца ежегодно возрастает. Повторные вмешательства на митральном клапане составляют около 10% от всех операций на митральном клапане в США [9]. В нашем центре в 2012 г. повторные операции на клапанах составили 6,8% от всех операций на клапанном аппарате.
Повторная хирургия сердца остается сложной проблемой для сердечно-сосудистых хирургов. Она несет множество рисков во время рестернотомии помимо самой операции. Многие хирурги предпочитают проведение торакотомии для снижения частоты осложнений и уменьшения продолжительности пребывания больного в отделении реанимации и общей продолжительности госпитализации, в особенности у больных, которым ранее была выполнена открытая операция на сердце [9].
F. Casselman и соавт. [1] опубликовали результаты исследования 80 пациентов, которым провели эндоскопическую повторную операцию на митральном клапане через мини-торакотомный доступ без разведения ребер. Летальность в их серии составила 3,8%.
По данным исследования R. Umakanthan и соавт. [10], включающем 90 пациентов, минимально инвазивная правосторонняя торакотомия без пережатия аорты может быть хорошей альтернативой традиционной рестернотомии при выполнении повторных вмешательств на митральном клапане. В своей работе авторы сделали выводы о безопасности и эффективности минимально инвазивного доступа, снижении операционной летальности у пациентов высокого риска.
M. Ghoreishi и соавт. [5] предпочитают доступ путем рестернотомии при повторных вмешательствах на митральном клапане, но проводят перед операцией компьютерную томографию органов грудной клетки для определения риска ранения крупных сосудов во время рестернотомии. В серии повторных операций на митральном клапане они разделили больных на две группы по результатам компьютерной томографии: низкого риска (крупные сосуды находились на расстоянии более 1 см от задней поверхности грудины) и высокого риска (крупные сосуды располагались на расстоянии менее 1 см от задней поверхности грудины). По данным авторов, ранение крупных сосудов во время стернотомии оказывает существенное негативное влияние на результаты хирургического вмешательства. Интраоперационная летальность была существенно выше при ранении крупных сосудов. Больным, входящим в группу высокого риска, перед рестернотомией выполняли канюляцию периферических сосудов для возможности экстренного перевода на ИК.
По данным P. Ellman и соавт. [2], установка ИК перед рестернотомией не снижала риск интраоперационного ранения крупных сосудов. В исследовании повторных операций на клапанах сердца мы не выполняли канюляцию периферических сосудов перед рестернотомией, случаев возникновения массивного кровотечения при проведении рестернотомии не наблюдалось.
Согласно результатам M. Murzi и соавт. [8], объем гемотрансфузии при повторных операциях на клапанах сердца выше при применении минимально инвазивного доступа по сравнению со стандартной рестернотомией (4,1 ЕД против 2,7 ЕД). Операционная летальность при минимально инвазивном доступе составила 5,7%, при рестернотомии - 5,9%. Частота перехода на стандартную рестернотомию во время выполнения минимально инвазивного повторного вмешательства на клапанах составила 1,7%. В настоящем исследовании при использовании исключительно традиционной рестернотомии летальность была 2,2%.
В 10-летнем одноцентровом исследовании H. Vohra и соавт. [13] выявили факторы риска летальности и послеоперационных осложнений, среди которых наиболее значимые: фракция выброса левого желудочка менее 50%, необходимость выполнения многоклапанной коррекции и экстренность вмешательства.
В исследовании P. Vogt и соавт. [12], посвященном повторным операциям при дегенерации биологических протезов аортального клапана, факторами риска экстренной повторной операции были: активный инфекционный эндокардит перед проведением первичной операции, послеоперационная пневмония после первичной операции, длительно существующая дисфункция биологического протеза, острая регургитация на биопротезе и легочная гипертензия. Независимыми факторами риска летальности при операции репротезирования биологического клапана названы: экстренная операция, высокий трансвальвулярный градиент при первичной операции и двух- или трехсосудистое поражение коронарных артерий. По нашим данным, повторные операции в первые 3 года после проведения первичной операции выполнены у 18 пациентов, они были связаны с эндокардитом перед первичным вмешательством, тромбозом протеза клапана, парапротезной фистулой и высоким трансвальвулярным градиентом перед первичной операцией. Общая летальность в течение 30 сут после репротезирования аортального клапана составила 5,2% (9 из 172 пациентов). При этом летальность в группе планового репротезирования была всего 1,4% (2 из 141), тогда как экстренное репротезирование сопровождалось летальностью 22,6% (7 из 31) [12]. В нашем исследовании не было летальных исходов при выполнении экстренных повторных вмешательств на клапанах. У обоих умерших выполнялось двухклапанное протезирование.
По данным исследований [5], одновременное выполнение операций на двух клапанах отличается более высокой летальностью. Основной причиной ранней летальности при одновременном репротезировании митрального и аортального клапанов была тяжелая сердечная недостаточность с низкой фракцией выброса [7]. По нашим данным, первой причиной летального исхода был спонтанный разрыв миокарда левого желудочка 2-го типа, при этом кардиолиз левых отделов сердца не выполнялся, и не было предпосылок для травмы миокарда в зоне разрыва. Причиной второго летального исхода была тромбоэмболия легочной артерии.
Парапротезная фистула была причиной повторной операции у 13 (10,9%) пациентов. У 10 из них парапротезная фистула возникла после протезирования митрального клапана и у 3 - после протезирования аортального клапана. У 2 больных после протезирования митрального клапана удалось выполнить ушивание парапротезной фистулы, хотя размер парапротезных фистул был более 1 см.
N. Fukunaga и соавт. [4] провели ретроспективный анализ 118 повторных операций протезирования митрального клапана, проведенных на протяжении 20 лет. Ухудшение выживаемости после повторной операции на митральном клапане наблюдалось у пациентов с трикуспидальной регургитацией 2+ и выше. По результатам исследования был сделан вывод о необходимости поддержания уровня трикуспидальной регургитации в послеоперационном периоде не выше 2+ для улучшения долгосрочной выживаемости. В нашей серии из 90 повторных операций на клапанах сердца мы выполнили аннулопластику трикуспидального клапана по Де Вега во время повторного вмешательства 31 пациенту. Аннулопластику трикуспидального клапана проводили у больных, имеющих 2 и выше степень трикуспидальной регургитации на момент повторной операции.
Заключение
Повторные операции на сердце являются одной из самых сложных категорий хирургических вмешательств, сопровождаются высокой летальностью и большим количеством осложнений. В нашей группе пациентов нам удалось получить хорошие результаты по летальности и количеству послеоперационных осложнений. Эти успехи мы связываем прежде всего со слаженной работой всех служб, обеспечивающих хирургическое вмешательство и послеоперационный уход. С хирургической точки зрения выбор методики доступа для визуализации структур сердца индивидуален, однако мы наиболее часто отдаем предпочтение стандартной рестернотомии, которая имеет ряд неоспоримых преимуществ: обеспечивает наиболее полный обзор всех структур сердца, позволяет выполнить сопутствующие вмешательства на сердце и имеет высокий уровень безопасности при правильной технике ее выполнения.
В 3-летний период после первичной операции наиболее частыми причинами для повторной операции были: инфекционный эндокардит, тромбоз механического протеза, парапротезная фистула.
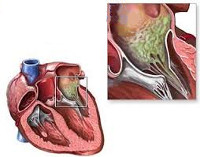
Общие сведения
Инфекционный эндокардит возникает при наличии следующих условий: транзиторной бактериемии, повреждения эндокарда и эндотелия сосудов, изменения гемостаза и гемодинамики, нарушения иммунитета. Бактериемия может развиваться при имеющихся очагах хронической инфекции или проведении инвазивных медицинских манипуляций.
Ведущая роль в развитии подострого инфекционного эндокардита принадлежит зеленящему стрептококку, в острых случаях (например, после операций на открытом сердце) – золотистому стафилококку, реже энтерококку, пневмококку, кишечной палочке. За последние годы изменился состав инфекционных возбудителей эндокардита: возросло число первичных эндокардитов острого течения, имеющих стафилококковую природу. При бактериемии золотистым стафилококком инфекционный эндокардит развивается почти в 100% случаев.
Эндокардиты, вызванные грамотрицательными и анаэробными микроорганизмами и грибковой инфекцией, имеют тяжелое течение и плохо поддаются антибактериальной терапии. Грибковые эндокардиты возникают чаще при длительном лечении антибиотиками в послеоперационном периоде, при долго стоящих венозных катетерах.
Адгезии (прилипанию) микроорганизмов к эндокарду способствуют определенные общие и местные факторы. В число общих факторов входят выраженные нарушения иммунитета, наблюдающиеся у пациентов при иммунносупрессивном лечении, у алкоголиков, наркоманов, людей пожилого возраста. К местным относятся врожденные и приобретенные анатомические повреждения клапанов сердца, внутрисердечные гемодинамические нарушения, возникающие при пороках сердца.
Большинство подострых инфекционных эндокардитов развивается при врожденных пороках сердца или при ревматических поражениях сердечных клапанов. Гемодинамические нарушения, вызванные пороками сердца, способствуют микротравме клапанов (преимущественно митрального и аортального), изменению эндокарда. На клапанах сердца развиваются характерные язвенно-бородавчатые изменения, имеющие вид цветной капусты (полипозные наложения тромботических масс на поверхности язв). Микробные колонии способствуют быстрому разрушению клапанов, может происходить их склерозирование, деформация и разрыв. Поврежденный клапан не может функционировать нормально - развивается сердечная недостаточность, которая очень быстро прогрессирует. Отмечается иммунное поражение эндотелия мелких сосудов кожи и слизистых, приводящее к развитию васкулитов (тромбоваскулитов, геморрагического капилляротоксикоза). Характерно нарушение проницаемости стенок кровеносных сосудов и появление мелких кровоизлияний. Нередко отмечаются поражения более крупных артерий: коронарных и почечных. Часто инфекция развивается на протезированном клапане, в этом случае возбудителем чаще всего бывает стрептококк.
Развитию инфекционного эндокардита способствуют факторы, ослабляющие иммунологическую реактивность организма. Заболеваемость инфекционным эндокардитом постоянно растет во всем мире. К группе риска относятся люди, имеющие атеросклеротические, травматические и ревматические повреждения сердечных клапанов. Высокий риск заболевания инфекционным эндокардитом имеют пациенты с дефектом межжелудочковой перегородки, коарктацией аорты. В настоящее время увеличилось число больных с протезами клапанов (механическими или биологическими), искусственными водителями ритма (электрокардиостимуляторами). Количество случаев инфекционного эндокардита увеличивается по причине применения длительных и частых внутривенных вливаний. Часто инфекционным эндокардитом болеют наркоманы.

Классификация инфекционных эндокардитов
По происхождению различают первичный и вторичный инфекционный эндокардит. Первичный обычно возникает при септических состояниях различной этиологии на фоне неизмененных клапанов сердца. Вторичный - развивается на фоне уже имеющейся патологии сосудов или клапанов при врожденных пороках, заболевании ревматизмом, сифилисом, после операции по протезированию клапанов или комиссуротомии.
По клиническому течению выделяют следующие формы инфекционного эндокардита:
- острая - длительность до 2 месяцев, развивается как осложнение острого септического состояния, тяжелых травм или медицинских манипуляций на сосудах, полостях сердца: нозокомиальный (внутрибольничный) ангиогенный (катетерный) сепсис. Характеризуется высокопатогенным возбудителем, выраженными септическими симптомами.
- подострая – длительность более 2 месяцев, развивается при недостаточном лечении острого инфекционного эндокардита или основного заболевания.
- затяжная.
У наркоманов клиническими особенностями инфекционного эндокардита являются молодой возраст, стремительное прогрессирование правожелудочковой недостаточности и общей интоксикации, инфильтративное и деструктивное поражение легких.
У пожилых пациентов инфекционный эндокардит обусловлен хроническими заболеваниями органов пищеварения, наличием хронических инфекционных очагов, поражением сердечных клапанов. Различают активный и неактивный (заживленный) инфекционный эндокардит. По степени поражения эндокардит протекает с ограниченным поражением створок сердечных клапанов или с поражением, выходящим за пределы клапана.
Выделяют следующие формы течения инфекционного эндокардита:
- инфекционно-токсическая - характерна транзиторная бактериемия, адгезия возбудителя на измененный эндокард, образование микробных вегетаций;
- инфекционно-аллергическая или иммунно-воспалительная - характерны клинические признаки поражения внутренних органов: миокардита, гепатита, нефрита, спленомегалии;
- дистрофическая – развивается при прогрессировании септического процесса и сердечной недостаточности. Характерно развитие тяжелых и необратимых поражений внутренних органов, в частности - токсическая дегенерация миокарда с многочисленными некрозами. Поражение миокарда возникает в 92 % случаев затяжного инфекционного эндокардита.
Симптомы инфекционного эндокардита
Течение инфекционного эндокардита может зависеть от срока давности заболевания, возраста пациента, типа возбудителя, а также от ранее проводимой антибактериальной терапии. В случаях высокопатогенного возбудителя (золотистый стафилококк, грамотрицательная микрофлора) обычно наблюдается острая форма инфекционного эндокардита и раннее развитие полиорганной недостаточности, в связи с чем клиническая картина характеризуется полиморфизмом.
У большинства пациентов с инфекционным эндокардитом выявляется поражение сердечной мышцы (миокардит), функциональные шумы, связанные с анемией и повреждением клапанов. При поражении створок митрального и аортального клапанов развиваются признаки их недостаточности. Иногда наблюдается стенокардия, изредка отмечается шум трения перикарда. Приобретенные пороки клапанов и поражение миокарда приводят к сердечной недостаточности.
При подострой форме инфекционного эндокардита возникают эмболии сосудов мозга, почек, селезенки оторвавшимися со створок сердечных клапанов тромботическими наложениями, сопровождающиеся образованием инфарктов в пораженных органах. Обнаруживаются гепато- и спленомегалия, со стороны почек - развитие диффузного и экстракапиллярного гломерулонефрита, реже - очагового нефрита, возможны артралгии и полиартрит.
Осложнения инфекционного эндокардита
Осложнениями инфекционного эндокардита с летальным исходом являются септический шок, эмболии в головной мозг, сердце, респираторный дистресс-синдром, острая сердечная недостаточность, полиорганная недостаточность.
При инфекционном эндокардите часто наблюдаются осложнения со стороны внутренних органов: почек (нефротический синдром, инфаркт, почечная недостаточность, диффузный гломерулонефрит), сердца (пороки клапанов сердца, миокардит, перикардит), легких (инфаркт, пневмония, легочная гипертензия, абсцесс), печени (абсцесс, гепатит, цирроз); селезенки (инфаркт, абсцесс, спленомегалия, разрыв), нервной системы (инсульт, гемиплегия, менингоэнцефалит, абсцесс головного мозга), сосудов (аневризмы, геморрагический васкулит, тромбозы, тромбоэмболии, тромбофлебит).
Диагностика инфекционного эндокардита
При сборе анамнеза у пациента выясняют наличие хронических инфекций и перенесенных медицинских вмешательств. Окончательный диагноз инфекционного эндокардита подтверждается данными инструментальных и лабораторных исследований. В клиническом анализе крови выявляется большой лейкоцитоз и резкое повышение СОЭ. Важной диагностической ценностью обладает многократный бакпосев крови для выявления возбудителя инфекции. Забор крови для бактериологического посева рекомендуется производить на высоте лихорадки.
Данные биохимического анализа крови могут варьировать в широких пределах при той или иной органной патологии. При инфекционном эндокардите отмечаются изменения в белковом спектре крови: (нарастают α-1 и α-2-глобулины, позднее – γ-глобулины), в иммунном статусе (увеличивается ЦИК, иммуноглобулин М, снижается общая гемолитическая активность комплемента, нарастает уровень противотканевых антител).
Ценным инструментальным исследованием при инфекционном эндокардите является ЭхоКГ, позволяющее обнаружить вегетации (размером более 5 мм) на клапанах сердца, что является прямым признаком инфекционного эндокардита. Более точную диагностику проводят при помощи МРТ и МСКТ сердца.
Лечение инфекционного эндокардита
При инфекционном эндокардите лечение обязательно стационарное, до улучшения общего состояния пациента назначается постельный режим, диета. Главная роль в лечении инфекционных эндокардитов отводится медикаментозной терапии, главным образом, антибактериальной, которую начинают сразу после бакпосева крови. Выбор антибиотика определяется чувствительностью к нему возбудителя, предпочтительнее назначение антибиотиков широкого спектра действия.
В терапии инфекционного эндокардита хороший эффект оказывают антибиотики пенициллинового ряда в комбинации с аминогликозидами. Трудно поддается лечению грибковый эндокардит, поэтому назначается препарат амфотерицин В в течение длительного времени (несколько недель или месяцев). Также используют другие средства с антимикробными свойствами (диоксидин, антистафилококковый глобулин и др.) и немедикаментозные методы лечения – плазмаферез, аутотрансфузию ультрафиолетом облученной крови.
При сопутствующих заболеваниях (миокардите, полиартрите, нефрите) к лечению добавляются негормональные противовоспалительные средства: диклофенак, индометацин. При отсутствии эффекта от медикаментозного лечения показано хирургическое вмешательство. Проводится протезирование клапанов сердца с иссечением поврежденных участков (после стихания остроты процесса). Оперативные вмешательства должны проводиться кардиохирургом исключительно по показаниям и сопровождаться приемом антибиотиков.
Прогноз при инфекционном эндокардите
Инфекционный эндокардит — одно из наиболее тяжелых сердечно-сосудистых заболеваний. Прогноз при инфекционном эндокардите зависит от множества факторов: имеющихся поражений клапанов, своевременности и адекватности терапии и др. Острая форма инфекционного эндокардита без лечения заканчивается смертельным исходом через 1 – 1,5 месяца, подострая форма - через 4–6 месяцев. При адекватной антибактериальной терапии летальность составляет 30%, при инфицировании протезированных клапанов — 50%. У пожилых пациентов инфекционный эндокардит протекает более вяло, часто сразу не диагностируется и имеет худший прогноз. У 10-15% больных отмечается переход болезни в хроническую форму с рецидивами обострения.
Профилактика инфекционного эндокардита
За лицами с повышенным риском развития инфекционного эндокардита устанавливается необходимое наблюдение и контроль. Это касается, прежде всего, пациентов с протезированными клапанами сердца, врожденными или приобретенными пороками сердца, патологией сосудов, с инфекционным эндокардитом в анамнезе, имеющих очаги хронической инфекции (кариес, хронический тонзиллит, хронический пиелонефрит).
Развитие бактериемии может сопровождать различные медицинские манипуляции: оперативные вмешательства, урологические и гинекологические инструментальные обследования, эндоскопические процедуры, удаление зубов и др. С профилактической целью при этих вмешательствах назначают курс антибиотикотерапии. Необходимо также избегать переохлаждения, вирусных и бактериальных инфекций (гриппа, ангины). Необходимо проведение санации очагов хронической инфекции не реже 1 раза в 3 - 6 месяцев.
При инфекционном эндокардите (воспалении внутренней оболочки сердца) в случае неэффективности антибактериальной терапии (особенно часто это бывает при грибковой этиологии), при постоянной бактериемии или фунгемии, при рецидиве эндокардита после успешно проведенной антимикробной терапии, построенной исходя из чувствительности возбудителя заболевания к назначаемым препаратам, при неуклонно нарастающей сердечной недостаточности, при остро прогрессирующих нарушениях сердечной проводимости (атриовентрикулярной блокаде первой или второй степени), эхокардиографических признаках массивных микробных вегетаций или при необратимой деструкции (разрушении) клапанного аппарата показано его протезирование.
Протезирование клапана также выполняют, если на фоне проводимой антибиотикотерапии возникают повторные эмболии (хотя в основном с началом антимикробной терапии частота данного осложнения резко снижается). При эндокардитах нестрептококковой (стрептококк - наиболее распространённый возбудитель) этиологии иногда возникает необходимость в замене уже протезированного клапана. Чаще всего это обусловлено околоклапанной недостаточностью (вследствие отрыва пришивного кольца) либо же переходом воспалительного процесса на миокард (мышечную оболочку сердца). К слову, миокардит является довольно распространённым осложнением инфекционного эндокардита протезированных клапанов. К его симптомам относят лихорадку, продолжающаяся после десяти суток антибиотикотерапии, вновь появившийся при аускультации систолический шум, атриовентрикулярную блокаду.
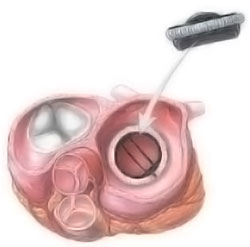
Замена поражённого клапана при активном инфекционном эндокардите преследует своей целью восстановить внутрисердечную гемодинамику и провести непосредственную санацию камер сердца. Операция предполагает иссечение патологически изменённых клапанов, вегетаций, а также тромбов и абсцессов при их наличии, антисептическую обработку камер сердца; установку механических протезов, ксенобиологических имплантатов, криоконсервированных аллографтов либо ксенографтов.
За несколько суток до хирургического вмешательства пациенту обязательно назначают антибактериальные средства. Причём при наличии метастатических очагов инфекции продолжительность курса антибиотикотерапии должна быть достаточной, чтобы произошло их устранение. Согласно статистическим данным, после протезирования сердечного клапана инфекционный эндокардит, как правило, излечивается.
Что касается нестандартных ситуаций, если произошло развитие сердечной недостаточности в результате выраженной клапанной регургитации (обратного движения крови), пациента направляют на экстренное (иногда уже в первые часы от начала лечения) протезирование сердечного клапана. При абсцессе миокарда либо абсцессе клапанного кольца обязательно проводят дренирование. В принципе, оперативная тактика всегда разрабатывается, исходя из конкретной клинической ситуации, и требует строго дифференцированного подхода.
(495) 506-61-01 - где лучше оперировать клапаны сердца
Протезирование сердечных клапанов в Израиле
Операции по протезированию сердечных клапанов в последнее десятилетие занимают все большее место в израильской кардиохирургии. Крупные больницы страны проводят ежегодно более 400 подобных операций.Подробнее

Центр сердечной хирургии Дуйбурга - Германия
В кардиоцентре г. Дуйсбурга проводятся все виды операций по восстановлению сердечного клапана, в частности - реконструкция митрального и трёхстворчатого клапанов (также при тяжёлых пороках клапанов, таких как эндокардит), в том числе малоинвазивным методом. Центр принадлежит к числу пяти крупнейших кардиологических клиник Германии. В Центре имеется четыре операционных зала, где ежегодно проводится более 3500 сердечно-сосудистых операций. Подробнее
Центр сердечной хирургии Карлсбурга - Германия
Операция на клапанах сердца занимает второе место по частоте выполняемых операций на сердце в Германии после аортокоронарного шунтирования. Центр сердечной хирургии г.Карлсбург - один из из ведущих кардиохирургических центров Германии. Ежегодно в центре проводится около 7500 операций на сердце и сосудах.Подробнее
Операции на сердечных клапанах - Берлинский Кардиоцентр
Особое внимание в Берлинском кардиоцентре уделяется операциям, которые позволяют сохранить собственный клапан. В центре были разработаны усовершенствованные методики протезирования митрального и аортального клапанов сердца. Директором Кардиологического Центра со дня его основания является профессор, д-р медицины, почетный доктор многих медицинских Университетов Роланд Хетцер. Подробнее
РНЦХ им. акад. Б.В. Петровского РАМН
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
Клиника аортальной и сердечно-сосудистой хирургии (дир. — акад. РАН Ю.В. Белов) Первого Московского государственного медицинского университета им. И.М. Сеченова (ректор — член-корр. РАН П.В. Глыбочко)
ГБОУ ВПО Первый МГМУ им. И.М. Сеченова, Университетская клиническая больница №1, Клиника аортальной и сердечно-сосудистой хирургии, Москва
Клиника аортальной и сердечно-сосудистой хирургии (дир. — акад. РАН Ю.В. Белов) Первого Московского государственного медицинского университета им. И.М. Сеченова (ректор — член-корр. РАН П.В. Глыбочко)
Вариант хирургического лечения вторичного бактериального эндокардита с поражением протеза аорты и аортального клапана
РНЦХ им. акад. Б.В. Петровского РАМН
РНЦХ им. акад. Б.В. Петровского РАМН
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
Клиника аортальной и сердечно-сосудистой хирургии (дир. — акад. РАН Ю.В. Белов) Первого Московского государственного медицинского университета им. И.М. Сеченова (ректор — член-корр. РАН П.В. Глыбочко)
ГБОУ ВПО Первый МГМУ им. И.М. Сеченова, Университетская клиническая больница №1, Клиника аортальной и сердечно-сосудистой хирургии, Москва
Клиника аортальной и сердечно-сосудистой хирургии (дир. — акад. РАН Ю.В. Белов) Первого Московского государственного медицинского университета им. И.М. Сеченова (ректор — член-корр. РАН П.В. Глыбочко)
Инфицирование сосудистых протезов является достаточно частым осложнением аортальных реконструкций и формирует одну из самых сложных проблем в сердечно-сосудистой хирургии. Частота инфекционного поражения протезов составляет от 0,2 до 5% [1]. При повторных операциях частота инфицирования достигает 5—11% [3], при этом она намного выше в случае ранних повторных вмешательств (менее чем через 1 мес после первичной операции). Инфекция протезов аорты сопровождается высокой смертностью, достигающей 40—75% [6] и обусловленной развитием фатального кровотечения, сепсиса, кардиальных и тромбоэмболических осложнений. Причинами развития инфекции могут стать интраоперационная контаминация операционного поля, отсутствие адекватного дренажа раны или гематогенное распространение возбудителя.
Материал и методы
Представляем случай хирургического лечения вторичного бактериального эндокардита с поражением протеза аорты и аортального клапана.
Пациент Ю., 46 лет, поступил в отделение хирургии аорты УКБ № 1 Первого МГМУ им. И.М. Сеченова 20.03.13 с диагнозом: вторичный бактериальный эндокардит, острое течение. Степень активности II, с поражением протеза восходящего отдела аорты, аортального клапана. Недостаточность аортального клапана II степени. Состояние после операции: аневризмэктомия, линейное протезирование восходящего отдела аорты синтетическим протезом, экзопротезирование дистального анастомоза (от 06.12.12).
При поступлении пациент предъявлял жалобы на волнообразное повышение температуры до 38,2 °С в вечернее время, сопровождающееся ознобом, общую слабость, чувство сердцебиения.
Из анамнеза известно, что считает себя больным с апреля 2012 г., когда при проведении эхокардиографии (ЭхоКГ) выявлена аневризма восходящего отдела аорты диаметром 5,6 см. По этому поводу пациенту выполнено оперативное лечение в объеме: аневризмэктомия, линейное протезирование восходящего отдела аорты синтетическим протезом. Экзопротезирование дистального анастомоза (06.12.12). После проведенного оперативного лечения выписан в удовлетворительном состоянии. В дальнейшем с февраля 2013 г. пациент стал отмечать эпизоды повышения температуры тела до 38,2 °С. Самостоятельно принимал нестероидные противовоспалительные средства (НПВС) (нимесулид, кетопрофен), на фоне чего состояние больного незначительно улучшалось, достигнута нестойкая нормотермия. Находясь на реабилитации в медицинском центре, консультирован кардиологом, поставлен диагноз: постперикардиотомный синдром, рекомендовано лечение метилпреднизолоном в высоких дозах. На фоне лечения состояние больного улучшилось, температура нормализовалась. После окончания курса глюкокортикоидов пациент отметил ухудшение общего состояния, возобновление гипертермии до 38 °C, в связи с чем он обратился в отделение хирургии аорты УКБ № 1 Первого МГМУ им. И.М. Сеченова.
По данным мультиспиральной компьютерной томографии (МСКТ) выявлено: лимфатические узлы средостения не увеличены. Состояние после протезирования восходящего отдела аорты. В парапротезном пространстве, циркулярно от уровня безымянной вены до корня аорты, с распространением в верхние отделы правой предсердно-желудочковой борозды, определяются массы пониженной плотности толщиной до 17 мм, с накоплением контрастного препарата по периферии, преимущественно в паренхиматозную фазу. В начальном отделе дуги аорты и в области перешейка по передней поверхности в парапротезном пространстве определяются мелкие воздушные участки, выраженная инфильтрация парааортальной клетчатки. В области проксимального анастомоза протеза выявлены выраженные неровности внутреннего контура с наличием вегетаций, по задней стенке определяется дефект стенки размером 13 мм с затеком контрастного препарата в парапротезное пространство размером 17×19 мм. В области дистального анастомоза протеза в просвете визуализируются множественные вегетации. Аорта дистальнее протеза заполнена контрастным препаратом без признаков тромбоза и расслоения, признаков экстравазации не выявлено. Сопоставление краев грудины правильное. Клетчатка переднего средостения не инфильтрирована. Листки перикарда тонкие, жидкости в полости перикарда нет. Заключение: состояние после протезирования восходящей аорты. Нагноение парапротезной гематомы с формированием парапротезной фистулы.
При ЭхоКГ: синусы Вальсальвы 4,8—4,9 см, протез аорты диаметром 3 см. Левое предсердие — 3,3 см, объем — 50 мл. Правый желудочек — 3,3 см, не увеличен. Правое предсердие — 66 мл. Левый желудочек (ЛЖ) увеличен, конечный диастолический размер (КДР) — 5,7 см, конечный диастолический объем (КДО) — 173 мл, конечный систолический объем (КСО) — 79 мл, фракция изгнания — 54%. Межжелудочковая перегородка 1,0 см; задняя стенка ЛЖ 1,0 см. Зон асинегрии нет. Аортальный клапан (АК): двустворчатый, уплотнен, расхождение не снижено. Скорость кровотока 102 см, регургитация II степени. Митральный клапан (МК): передняя створка несколько пролабирует в левое предсердие. Подвижность не ограничена, регургитация I степени. Трикуспидальный клапан (ТК): регургитация I степени, легочной гипертензии нет, давление в легочных артериях 23 мм рт.ст. Нижняя полая вена не расширена. Заключение: умеренное увеличение ЛЖ, врожденный порок сердца, двустворчатый А.К. Аортальная регургитация II степени, глобальная и локальная сократимость ЛЖ не снижена. Диастолическая функция ЛЖ не нарушена. Митральная регургитация I степени. Трикуспидальная регургитация I степени. Четких данных о наличии вегетаций на АК и других клапанах не выявлено.
По данным чреспищеводной ЭхоКГ определяется хорошая визуализация двустворчатых АК и МК, вегетаций на них нет. ТК — четкие вегетации не выявлены. АК — регургитация до II степени, МК — регургитация 0—I степени.
Посев крови на стерильность: выделен Аcinetobacter baumannii.
21.03.13 выполнена операция: рестернотомия. Кардиолиз. Санация полости перикарда и парапротезного пространства. Удаление синтетического протеза восходящего отдела аорты. Некрэктомия. Протезирование аортального клапана и восходящей аорты клапансодержащим кондуитом St. Jude 29 мм с имплантацией коронарных артерий в бок протеза по методике Бенталла—Де Боно в условиях искусственного кровообращения (ИК), фармакохолодовой кардиоплегии (ФХКП) и гипотермии 28 °C. Экзопротезирование дистального анастомоза.

Рис. 1. Выраженный спаечный процесс. Над аортой отмечается конгломерат хрящевидной плотности.

Рис. 2. Бактериальные вегетации на стенках сосудистого протеза.

Рис. 3. Протез после обработки Бетдамином.
В послеоперационном периоде отмечалась гипертермия с максимальной температурой тела 38,6 °С и ознобом. Пациент переведен в отделение кардиологии, где проведен курс иммуномодулирующей терапии (пентаглобин 5 мг/кг/сут в течение 5 сут), продолжительный курс антибактериальной терапии с учетом чувствительности флоры (сульперазон 8 г в сутки, тиенам 1 г 4 раза в сутки, флуконазол 200 мг 1 раз в сутки) — 6 нед. На фоне консервативного лечения в послеоперационном периоде самочувствие пациента улучшилось, наблюдалось снижение температуры тела до 37 °C, отсутствие озноба в течение 7 дней, снижение уровня лейкоцитов в крови. Раны зажили первичным натяжением. Подобрана доза варфарина. Пациент выписан в удовлетворительном состоянии на 60-е сутки после операции.
Результаты и обсуждение
Отдельные признаки способствуют повышению вирулентности Acinetobacter spp. К ним относятся: формирование капсулы; способность к адгезии на клетках эпителия за счет имеющейся фимбрии и/или капсульного полисахарида; продукция ферментов, разрушающих липиды тканей; потенциальная токсичность липополисахаридного компонента клеточной стенки и присутствие липида А; наличие токсина, вызывающего гибель и разрушение лейкоцитов [1]. Патогенность A. baumannii проявляется лишь у наиболее тяжелых больных стационара. Факторами риска развития инфекции, вызванной A. baumannii, являются пребывание в ОИТ, тяжелое основное заболевание, недавно проведенная кардиохирургическая операция, массивная аспирация, острый респираторный дистресс-синдром, длительная ИВЛ и применение цефалоспоринов [3].
Развитие заболевания, вызванного эндогенным штаммом A. baumannii у 1 пациента, может привести к вспышке инфекции в отделении вследствие кросс-контаминации, которая заключается в передаче возбудителя от одного пациента к другому через промежуточный резервуар, которым служит медицинское оборудование, предметы ухода, перчатки и руки медицинского персонала [3]. Так осуществляется динамическое взаимодействие возбудителей, населяющих экзогенный и эндогенный резервуары.
Инфекционные осложнения у больных — одна из актуальнейших проблем современной кардиохирургии. Важность ее обусловлена не только медицинской, но и большой социально-экономической значимостью [5, 6, 8].
В связи с тем что мы не всегда располагаем информацией о возбудителе инфекционного процесса и его антибиотикочувствительности, эмпирическое назначение антибактериальных препаратов основывается на результатах анализа подобных сведений применительно к основным видам микроорганизмов, вызывающих инфекционные осложнения у кардиохирургических больных. Анализ чувствительности клинически значимых видов бактерий к антибиотикам показал, что число активных препаратов к настоящему времени значительно сократилось. Количество препаратов, активных в отношении грамположительных бактерий, также существенно уменьшилось — нозокомиальные штаммы A. baumannii характеризуются высокой резистентностью к антибиотикам. Достаточной клинической и микробиологической эффективностью обладают лишь имипенем, меропенем, цефоперазон/сульбактам и, в некоторых стационарах, ампициллин/сульбактам. Эти препараты обязательно должны быть включены в фармакологический формуляр стационара.
До сих пор продолжаются дискуссии о подходах к разработке схем антибактериальной профилактики. В качестве выбора оптимальной антибактериальной терапии для профилактики и лечения интраоперационной и послеоперационной инфекции (A. baumannii) в кардиохирургии мы считаем целесообразным использовать препарат Колистин.
В случае подтверждения бактериальной этиологии эндокардита возбудителем A. baumannii в послеоперационном периоде необходима длительная антибактериальная терапия подобранными по чувствительности двумя или тремя антибиотиками в сочетании с иммуномодулятором пентаглобином (как в нашем случае).
Однако считаем, что в случае инфицирования синтетического протеза аорты, наличия вегетаций на его стенке с целью профилактики повторного инфицирования целесообразнее выполнить его удаление в пределах здоровых тканей с последующей заменой.
Некоторые авторы сообщают, что при инфицировании сосудистого протеза возможно его сохранение с помощью vacuum-assisted closure (VAC) [9], однако только в случае отсутствия внутрипротезных вегетаций. Наш опыт применения VAC небольшой, однако некоторым пациентам действительно удалось сохранить инфицированный протез, избежав повторного оперативного вмешательства, тем самым снизив риск множественных осложнений: в 2 случаях реконструктивных операций в бассейне бедренных артерий и в 1 случае после протезирования восходящей аорты.
Выводы
Таким образом, комплексный подход к профилактике и лечению послеоперационных осложнений в кардиохирургии должен включать:
— многокомпонентный анализ результатов бактериологических исследований как больного, так и предметов окружающей среды;
— анализ результатов фармакокинетического мониторинга;
— объективную оценку состояния больного с учетом показателей состояния функций всех органов и систем;
— оценку возможности сочетания антибактериальных препаратов с различными фармакологическими средствами, используемыми в послеоперационном периоде.
Все изложенное позволяет разработать рациональные схемы профилактики, а в случае возникновения инфекционного процесса — оптимальные схемы лечения. В нашем случае в качестве оптимальной схемы лечения при инфекции (A. baumannii) был использован антибактериальный препарат Колистин в сочетании с иммуномодулятором пентаглобином.
Описанное наблюдение иллюстрирует тот факт, что вторичный бактериальный эндокардит с поражением протеза аорты и аортального клапана (протезный аортит) при своевременном комплексном лечении (хирургическом и медикаментозном) не приводит к развитию угрожающих жизни состояний. Что в свою очередь требует от врача, распознавшего данное осложнение, безотлагательного направления пациента в стационар, специализирующийся на аортальной хирургии.
Читайте также:

