Прямым бинарным делением делятся клетки туберкулезной палочки
Обновлено: 18.04.2024
Свойства туберкулезной палочки и передача возбудителя. Инфекционность туберкулеза.
В какой мере эти особенности возбудителя отражаются на частоте заражения и заболевания туберкулезом, а также на характере его течения? Отдельные авторы утверждают, что снижение инфицированности и заболеваемости туберкулезом и особенности его течения в последнее время отчасти обусловлены понижением вирулентности и малой патогенностью изониазидоустоичивых и каталазоотрицательных микобактерии, которыми заражаются теперь некоторые взрослые и дети при контакте с больными, лечившимися без достаточного эффекта препаратами ГИНК. Эта гипотеза основывается, с одной стороны, на результатах экспериментальных исследований, установивших слабую патогенность таких штаммов микробов для некоторых видов лабораторных животных, а с другой — па отдельных клинических наблюдениях о якобы меньшей зараженности и заболеваемости лиц, соприкасающихся с больными, в мокроте которых находят тубазидоустойчивые микобактерии туберкулеза (А. Ш. Шерман, 1962).
Однако такая точка зрения не имеет достаточных обоснований. Установлено, например, что микобактерии туберкулеза, даже высокоустойчивые к препаратам ГИНК, характеризующиеся отрицательной каталазной и пероксидазной активностью, а также слабопатогенные и маловирулентные для морских свинок, вызывают генерализованный туберкулез у белых мышей, золотистых хомяков и патогенны для человека.
Gerbeaux и соавт. (1962) обнаружили в спинномозговой жидкости у нескольких детей, больных туберкулезным менингитом, микобактерии, устойчивые к изониазиду и вместе с тем обладавшие различной степенью вирулентности при испытании на морских свинках. У части привитых животных они вызывали генерализованный туберкулез, у других — слабо выраженные специфические изменения; у третьей группы морских свинок не только отсутствовали морфологические признаки процесса, но оставались отрицательными туберкулиновые пробы, а из внутренних органов не удавалось высеять возбудителя.
Аналогичные данные получили Ж. К. Кантарбаева и соавт. (1963) при изучении первично устойчивых к фтивазиду микобактерий, выделенных из мокроты больных фиброзно-кавернозным, инфильтративным и дис-семинированным туберкулезом легких. У 80% привитых этими микробами морских свинок развились ограниченные специфические изменения во внутренних органах, а у остальных образовался генерализованный туберкулез.
Вместе с тем наблюдения показали, что формы туберкулеза легких у больных, выделяющих первично устойчивые микобактерий, не отличаются от таковых у лиц, в мокроте которых были обнаружены лекарственночувствительные микробы (Canetti е. а., 1967).
На материале нашей клиники и диспансера № 13 мы в свою очередь смогли убедиться, что характер и частота различных форм туберкулеза легких среди 54 детей и взрослых, в мокроте которых были обнаружены микобактерий, первично устойчивые к основным туберкулостатическим препаратам, были такими же, как и среди больных, выделявших с мокротой чувствительные штаммы микобактерий.
В то же время хорошо известно, что течение различных форм туберкулеза при наличии лекарственнорезистентных микобактерий нередко оказывается неблагоприятным из-за недостаточной эффективности в этих случаях химиотерапии. Следует, наконец, указать, что некоторые данные о меньшей инфицированности и заболеваемости лиц, состоящих в контакте с больными, выделяющими микобактерий, устойчивые к изониазиду, не подтверждаются большинством авторов и, в частности, наблюдениями Н. Ю. Маргулис, Т. И. Виноградовой и др. (1971), Н. М. Рудого (1969, 1975).
Клиническое значение лекарственной зависимости микробов недостаточно выяснено вследствие ограниченности наблюдений. Кроме того, лекарственная зависимость — нестойкий признак, так как быстро теряется при пересевах таких штаммов. Тем не менее, по некоторым данным, применение препаратов, к которым развилась лекарственная зависимость, неблагоприятно отражается на течении болезни и состоянии организма больного. Таким образом, следует признать, что как лекарственная устойчивость, так и лекарственная зависимость микобактерий отрицательно отражаются на течении туберкулеза.
Известную роль в клинических проявлениях туберкулеза играет заражение микобактериями различного типа. Как известно, патогенными для человека являются главным образом микобактерий млекопитающих, т. е. человеческий, бычий и в меньшей степени птичий типы. Наибольшее этиологическое значение из них имеет первый тип возбудителя. По сводным данным Gervois (1966), на протяжении 1954—1966 гг. в различных странах он был обнаружен в среднем у 96,6% взрослых и детей, больных туберкулезом органов дыхания, и у 85% — при других локализациях процесса. По обобщенным материалам отечественных авторов за 1934— 1968 гг., микобактерий бычьего типа были выделены у 6,4% больных туберкулезом легких и у 14,8% — при кожном и костно-суставном процессах. При всех формах заболевания этот вид возбудителя у детей и подростков встречается чаще, чем у взрослых.
Таким образом, при заражении микобактериями бычьего типа чаще, чем при инфицировании человеческим типом возбудителя, развиваются различные внелегочные формы процесса: волчанка, периферический лимфаденит, костно-суставной и мочеполовой туберкулез, менингит. Тем самым структура клинических форм туберкулеза в какой-то мере зависит от эпидемической ситуации, т. е. от степени распространенности туберкулеза среди рогатого скота и других видов домашних животных и от условий контакта с ними человека.
Вот почему раньше, когда инфицированность домашних животных была высокой, у больных туберкулезом, особенно у детей, в мокроте и другом материале сравнительно часто обнаруживали микобактерии бычьего типа. С тех пор как во многих странах, особенно за последние 15— 20 лет, инфицированный и больной туберкулезом рогатый скот был забит, этот тип возбудителя стали реже находить у больных людей, в особенности у детей и подростков. Об этом свидетельствуют, например, данные, накопленные в ФРГ, где на протяжении 1952—1962 гг. был забит рогатый скот, больной туберкулезом, и осталось лишь 0,3% инфицированных животных. В результате этого мероприятия, указывает Meissner (1974), резко уменьшилась частота обнаружения микобактерии бычьего типа у больных туберкулезом легких, внутригрудных и наружных лимфатических узлов, а у детей, кроме того, — кожи, костей и суставов.
Однако и теперь, даже в тех странах и районах, где проводится энергичная борьба против туберкулеза у рогатого скота, встречаются больные, которые выделяют микобактерии бычьего типа. Такое явление наблюдается чаще среди сельских жителей. Так, в Саксонии этот тип возбудителя был обнаружен в среднем у 5,2% всех бацилловыделителей. Но среди проживавших в сельских местностях его находили у 17,2%, между тем как среди больных в небольших городах — у 1,4%, а в крупных городских центрах — всего у 0,2%. Надо полагать, что выделение больными в этих случаях микобактерии бычьего типа было обусловлено обострением туберкулезного процесса, который возник в свое время в результате заражения от больных животных.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Морфология туберкулёза человека. Палочка Коха. Тинкториальные свойства туберкулеза. Культуральные свойства возбудителя туберкулеза.
М. tuberculosis (палочка Коха) — тонкая, прямая или слегка изогнутая палочка, размером 1-10*0,2-0,6 мкм, со слегка закруглёнными концами (рис. 22-1). В молодых культурах палочки более длинные, а в старых склонны к ветвлению.
Бактерии туберкулёза способны образовывать L-формы, сохраняющие способность к инфицированию, а также фильтрующиеся формы, патогенетическая роль которых остаётся плохо изученной. Капсул не имеют, но образуют микрокапсулу.
Методом Циля-Нильсена окрашиваются в ярко-красный цвет. Содержат кислотонеустойчивые гранулы (зёрна Муха), располагающиеся в цитоплазме.
Культуральные свойства возбудителя туберкулеза
Туберкулёзные палочки могут расти как в аэробных, так и факультативно анаэробных условиях. Повышенное содержание СО2 (5-10%) способствует более быстрому росту. Оптимальная температура 37-38 °С; рН 7,0-7,2. Нуждаются в присутствии белков, глицерина, факторов роста (биотин, никотиновая кислота, рибофлавин и др.), ионов (Mg2+ K+, Na+ Fe2+) и др.
Для выращивания бактерий туберкулеза наиболее часто применяются глицериновые, картофельные с жёлчью, яичные, полусинтетические и синтетические среды. Наиболее оптимальна среда Лёвенштайна-Йёнсена.
На средах туберкулёзные палочки обычно образуют R-колонии; под влиянием антибактериальных препаратов бактерии могут диссоциировать с образованием мягких и влажных S-колоний.
В жидких средах палочки туберкулеза образуют сухую морщинистую пленку (на 7-10-е сутки), поднимающуюся на края пробирки; среда остаётся прозрачной. В жидких средах выявляют корд-фактор — важный дифференциальный признак вирулентности. Наличие корд-фактора обусловливает сближение бактериальных клеток в микроколониях и их рост в виде серпантинообразных кос.
На плотных средах рост палочек туберкулеза отмечают на 14-40-е сутки в виде сухого морщинистого налёта желто-, вато-кремового цвета. Зрелые колонии напоминают цветную капусту, крошковатые, плохо смачиваются водой и имеют приятный запах. Культуры плохо снимаются со среды, а при прокаливании трещат. Отличительная особенность М. tuberculosis— способность к синтезу значительного количества никотиновой кислоты (ниацина); ниациновый тест — важный метод дифференцировки микобактерий.
• На заключительной стадии деления клеточная оболочка сжимается и разрушается или участвует в синтезе септы с последующим автолизом, образуя две отдельных клетки
• Процесс деления у бактерий контролируется гомологом тубулина, белком FtsZ, который образует кольцевую структуру в месте деления
• Вместе с FtsZ, в месте деления образуется набор, состоящий примерно из 8 белков, участвующих в делении
• Место деления клетки определяется двумя системами отрицательной регуляции: блокирующим эффектом нуклеоида и системой Min
Большинство клеток эукариот делятся точно посередине, образуя две одинаковые дочерние клетки. Деление скоординировано с завершением репликации ДНК и сегрегацией хромосом. Обычно деление происходит по завершению периода роста, во время которого масса клеток удваивается. После сегрегации хромосом наступает цитокинез, в результате которого клетка разделяется на две. Во время цитокинеза все слои клеточной мембраны локально принимают кольцеобразную форму. Как показано на рисунке ниже, цитокинез осуществляется, по крайней мере, двумя различными путями.
У грамотрицательных микроорганизмов, таких как Е. coli, деление происходит при сокращении слоев существующей оболочки, с последующим разрывом образующейся перемычки. У других бактерий, например у грамположительных В. subtilis, новообразованные кольцевые структуры материала клеточной стенки растут внутрь клетки, образуя перегородку. Когда образование перегородки завершилось, между сестринскими клетками образуется двойная мембрана, но клетки остаются связанными друг с другом. Разделение клеток представляет собой самостоятельное событие, которое включает в себя автолиз материала перегородки. В зависимости от условий роста, автолиз перегородки может происходить достаточно медленно и сопровождаться возникновением длинных цепей связанных между собой клеток.
Ключевой белок деления, FtsZ, представляет собой гомолог тубулина эукариот, белка, входящего в состав цитоскелета и формирующего микротрубочки. Подобно тубулину, этот белок является ГТФазой и в присутствии ГТФ полимеризуется с образованием линейных прото-филаментов, in vitro формирующих пучки и плоские структуры. Кольцевая структура белка FtsZ крайне динамична, и in vivo постоянно подвергается переформированию (с полупериодом
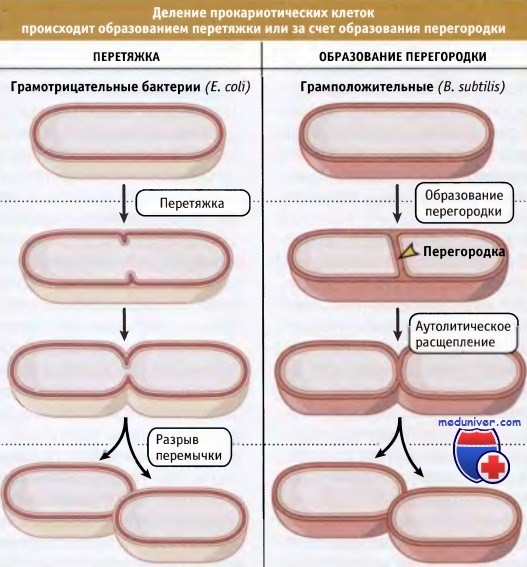
У прокариот деление происходит либо путем образования перетяжки, либо с помощью перегородки.
Для простоты, капсульный слой клеточной оболочки не показан.
В Z-кольце с белком FtsZ непосредственно взаимодействует белок FtsA, функция которого, вероятно, состоит в стабилизации кольца. Белок FtsA напоминает актин клеток эукариот, однако обладает дополнительным доменом, функции которого неизвестны. Этот белок образует димеры, но, по-видимому, не полимеризуется. Хотя он не участвует в формировании Z-кольца, клетки двойного мутанта, дефектного по белкам FtsA и ZipA, не способны образовывать кольцевые структуры. Таким образом, функции белков FtsA и ZipA частично перекрываются, и, по крайней мере, один из них необходим для стабилизации Z-кольца. Также показано, что белок ZipA непосредственно взаимодействует с FtsZ и, в отличие от последнего и FtsA, представляет собой трансмембранный белок. Поэтому ZipA может обеспечивать сопряжение Z-кольца с клеточной мембраной.
Остальные белки деления представляют собой трансмембранные белки. Функции белков FtsL и FtsQ неизвестны. Белок FtsW, вероятно, поставляет предшественники для белка FtsI, который является ферментом, участвующим в синтезе перегородки. Последний обладает способностью связывать пенициллин и взаимодействует с аппаратом синтеза клеточной стенки, функционирующим при делении. Белки FtsK и FtsN необходимы для деления клеток Е. coli, однако у B. subtilis гомолог белка FtsK (SpoIIIE) не участвует в делении, а гомолог белка FtsN у этих клеток отсутствует.
Между двумя хорошо изученными микроорганизмами, Е. coli и В. subtilis, существуют интересные различия в процессе сборки белков деления. Так, у E. coli этот процесс носит почти линейный характер, в то время как у В. subtilis сборка белков на Z-кольцевой структуре является взаимозависимой. Эти различия, вероятно, отражают различную организацию клеточной оболочки у грамотрицательных и грамположительных микроорганизмов. Пока мы мало знаем о том, каким образом полностью собранный аппарат деления влияет на цитокинез, и выяснение этих вопросов представляет собой обширное поле деятельности для исследователей.
Деление контролируется, главным образом, на уровне образования кольца FtsZ. Предполагают, что положение сайта деления, и, вероятно, протекание этого процесса во времени находятся под контролем двух факторов: блокирования нуклеоидом и системы Min. Оба этих фактора обеспечивают наступление деления только после завершения репликации ДНК, а также одинаковую величину образующихся клеток.
Фактор блокирования нуклеоидом исследован недостаточно. Он проявляется в том, что из-за своего объема нуклеоид может предотвращать деление. Поэтому деление клетки происходит только после завершения раунда репликации ДНК и расхождения сестринских хромосом с образованием отдельных нуклеоидов. При блокировании процессов репликации или сегрегации, присутствие нуклеоида в середине клетки предотвращает образование перегородки. В принципе отрицательный эффект нуклеоида может объясняться просто отсутствием в этой области исключением из его состава белка FtsZ. При этом белок не накапливается до критической концентрации, необходимой для его полимеризации.
Значимость фактора блокирования нуклеоидом для клетки представляет собой потенциальную проблему, которая заключается в том, что полюса клетки (по крайней мере у палочковидных бактерий) не защищены нуклеоидом, и поэтому возможно наступление аберрантного полярного деления. Для предупреждения этого, у многих бактерий присутствуют белки, входящие в систему Min, которая препятствует делению на полюсах.Название этой системы происходит от названия мини-клеток, образуемых мини-мутантами, для которых характерно деление на полюсах.
Ключевой эффектор системы Min представляет собой ингибитор клеточного деления, который называется MinC. Этот белок обладает способностью ингибировать образование Z-кольца, вероятно, непосредственно ингибируя полимеризацию FtsZ. Активность MinC находится под контролем белка MinD. Вероятно, этот белок контролирует внутриклеточную локализацию MinC по двум различным механизмам. Один из них состоит в том, что MinD транспортирует MinC на периферию клетки (ближе к цитоплазматической мембране) туда, где происходит сборка кольцевой структуры FtsZ. Второй механизм заключается в том, что MinD ограничивает активность MinC полюсами клетки, тем самым предотвращая наступление полярного деления, но способствуя делению клетки по средней линии.
У многих палочковидных бактерий система MiniCD используется для контроля за местонахождением сайта деления. Эта система хорошо охарактеризована у бактерий Е. coli и В. subtilis. Интересно, что у двух этих микроорганизмов существуют совершенно разные механизмы, посредством которых MinD ограничивает эффект MinC на полюса клетки. У В. subtilis используется простой механизм, при котором полярный якорный белок DivIVA транспортирует комплекс MinCD к полюсам клетки и в течение всего клеточного цикла удерживает его там в статичном положении. Как показано на рисунке ниже, DivIVA и MinD локализуются у полюсов вновь образованной клетки, и присутствие ингибитора MiniC предотвращает формирование FtsZ-кольца у полюсов.
По-видимому, после завершения репликации ДНК, в середине клетки создается новый потенциальный сайт деления. Концентрация ингибитора MiniC у полюсов позволяет провести сборку FtsZ-кольца в середине клетки и обеспечивает мобилизацию других белков деления. В этот момент аппарат деления, вероятно, становится нечувствительным к ингибирующему действию MinC Затем белки DivIVA и MinD перемещаются на середину клетки. Поэтому, когда при делении образуется новая пара клеточных полюсов, DivIVA встраивается в новые полюса и образует новую область проявления ингибирующего эффекта MinCD. Когда произошло сокращение оболочки, наступает разборка FtsZ-кольца, однако DivIVA и MinCD остаются на вновь образованных полюсах, тем самым предотвращая деление на этих полярных сайтах.
Таким образом, транспортировка DivIVA к сайту деления и затем его удержание на полюсах клетки являются ключевыми событиями этого механизма.
Интересно, что белок DivIVA локализуется на сайтах деления, когда он экспрессируется в эукариотических клетках (делящиеся дрожжи). Эта позволяет предполагать, что DivIVA может узнавать топологические характеристики, например кривизну мембраны, а не специфические белковые мишени.
В противоположность этому, в клетках Е. coli существует динамическая система MinCD, которая на какое-то время собирает комплекс у одного полюса. Затем он разбирается и собирается вновь у противоположного полюса. Так повторяется много раз. Этим процессом управляет кольцо белка MinE, которое, в свою очередь, каждый раз перемещается к тому или иному полюсу, смещая MinCD и обеспечивая ему возможность собраться у противоположного полюса. Изменение локализации MinCD от одного полюса к другому происходит с частотой порядка десятков секунд. Как показано на рисунке ниже, MinD поочередно накапливается на периферии мембраны с каждой стороны кольца MinE. Быстрое изменение локализации MinD не позволяет кольцу FtsZ собраться на полюсах.
Присутствие MinE в центральной области исключает проявление там ингибирующего эффекта MinD и дает возможность собраться в этом месте кольцу FtsZ. Остается невыясненным, почему для контроля MinCD и установления полюсов у Е. coli выработался такой энергетически невыгодный механизм.
MinD относится к интересной группе белков, обладающих общей функцией связывания нуклеотидов, которая также включает белок разделения хромосом, ParA. Близкий к ParA белок, Soj, также проявляет динамические свойства. Вероятно, общей для этих белков является их способность связывать и гидролизовать нуклеотиды и контролировать реакции полимеризации и деполимеризации. Это напоминает механизм контроля динамической нестабильности актиновых филаментов и микротрубочек у эукариот . Поэтому эти белки относятся еще к одному классу белков цитоскелета бактерий, обладающих широкими функциями, которые особенно связаны с вопросами морфогенеза на разных стадях клеточного цикла.
Недавно у грамположительных бактерий был идентифицирован белок, участвующий в блокировании клеточного деления нуклеоидом. Это Noc, представляющий собой белок, неспецифически связывающийся с ДНК, который локализован в нуклеоиде. Он также является ингибитором клеточного деления. Если не нарушена репликация хромосом, то мутанты noc растут нормальным образом. При этом в noc- клетках деление происходит с участием нуклеоида, а клетки дикого типа не делятся. Как показано на рисунке ниже, Noc и система MiniCD определяют местоположение кольца FtsZ в середине клетки. В клетках дикого типа, DivIVA запускает процесс полимеризации белка MinD, который распространяется от полюсов к середине клетки вдоль мембраны.
Белок MinC, связанный с белком MinD, предотвращает накопление FtsZ или полимеризацию поблизости от полюсов клетки. Предполагается, что белок Noc связывается с нуклеоидом и ингибирует накопление FtsZ или проявление его активности поблизости от нуклеоида. В клетках noc-, система Min предотвращает сборку кольца FtsZ, исключая область середины клетки, и клетки растут нормально. Однако у min- клеток Noc ингибирует сборку FtsZ только вокруг нуклеоида, и FtsZ образует кольцевую структуру в середине клетки и на полюсах, где нет нуклеоида. У клеток с отсутствующими топологическими ингибиторами (двойные мутанты min-noc-) сборке FtsZ ничего не препятствует, и по всей клетке образуются многочисленные вкрапления, состоящие из этого белка. Их образование приводит к утрате клеткой способности к делению. У грамотрицательных бактерий Noc отсутствует, однако у Е. coli обнаружен белок, контролирующий систему блокирования деления нуклеоидом по механизму, аналогичному Noc.
Сбока белков деления в клетке Е. coli.
Белки FtsZ образуют кольцевую структуру, к которой в указанном порядке присоединяются остальные белки.
Порядок присоединения белков установлен методами молекулярной генетики. Отрицательная пространственная регуляция клеточного деления
за счет блокирующего эффекта нуклеоида. Локализация ключевых белков в сайте деления на разных стадиях клеточного цикла, начиная со новообразованных клеток и заканчивая делением,
в результате которого образуются две дочерних клетки.
На срезах показаны половины каждой клетки, но целые кольцевые структуры FtsZ и MinC.
Для простоты нуклеоиды не показаны. Модель пространственного контроля аппарата клеточного деления у грамположительной бактерии В. subtilis.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Обзор
Деление клетки. Клеточный цикл.
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
В организме человека присутствует примерно 300 типов клеток, и все они делятся на две большие группы: одни могут делиться и размножаться (то есть, они митотически компетентны), а другие — постмитотические — не делятся: это достигшие крайней стадии дифференцировки нейроны, кардиомиоциты, зернистые лейкоциты и другие.
В нашем организме существуют обновляющиеся ткани, в которых есть пул постоянно делящихся клеток, которые заменяют отработанные или погибающие клетки. Такие клетки есть в криптах кишечника, в базальном слое эпителия кожи, в костном мозге (кроветворные клетки). Обновление клеток может происходить довольно интенсивно: так, клетки соединительной ткани в поджелудочной железе заменяются каждые 24 часа, клетки слизистой желудка — каждые три дня, лейкоциты — каждые 10 дней, клетки кожи — каждые шесть недель, примерно 70 г пролиферирующих клеток тонкого кишечника удаляется из организма ежедневно [1].
Стволовые клетки, существующие практически во всех органах и тканях, способны делиться неограниченно. Регенерация тканей происходит за счет пролиферации стволовых клеток, которые могут не только делиться, но и дифференцироваться в клетки той ткани, регенерация которой происходит. Стволовые клетки есть в миокарде, в головном мозге (в гипокампе и в обонятельных луковицах) и в других тканях. Это открывает большие надежды в плане лечения нейродегенеративных заболеваний и инфаркта миокарда [2–4].
Постоянно обновляющиеся ткани способствуют увеличению продолжительности жизни. При делении клеток происходит омоложение тканей: новые клетки приходят на место поврежденных, при этом интенсивнее происходит репарация (устранение повреждений ДНК) и возможна регенерация при повреждении тканей. Не удивительно, что у позвоночных значительно выше продолжительность жизни, чем у беспозвоночных — тех же насекомых, у которых во взрослом состоянии клетки не делятся.
Но в то же время обновляющиеся ткани подвержены гиперпролиферации, что ведет к образованию опухолей, в том числе — злокачественных. Это происходит из-за нарушений регуляции деления клеток и повышенной частоты мутагенеза в активно делящихся клетках. По современным представлениям, чтобы клетка приобрела свойство злокачественности, ей необходимо 4–6 мутаций . Мутации возникают редко, и для того, чтобы клетка стала раковой — это подсчитано для фибробластов человека — должно произойти около 100 делений (такое число делений обычно происходит у человека примерно в возрасте 40 лет) [5].
В целях защиты от самого себя, в организме сформировались специальные клеточные механизмы супрессии опухолей. Один из них — репликативное старение клеток (сенесценция), заключающееся в необратимой остановке деления клетки в стадии G1 клеточного цикла. При старении клетка перестает делиться: она не реагирует на ростовые факторы и становится устойчивой к апоптозу.
Лимит Хейфлика
Феномен старения клеток был впервые открыт в 1961 г. Леонардом Хейфликом с коллегами на культуре фибробластов. Оказалось, что клетки в культуре фибробластов человека при хороших условиях живут ограниченное время и способны удваиваться примерно 50±10 раз, — и это число стали называть лимитом Хейфлика [6], [7]. До открытия Хейфлика господствовала точка зрения, что клетки бессмертны, а старение и смерть — это свойство организма в целом.
Эта концепция считалась неопровержимой во многом благодаря экспериментам Карреля, который поддерживал культуру клеток сердца цыпленка 34 года (ее выбросили лишь после его смерти). Однако, как выяснилось впоследствии, бессмертие культуры Карреля было артефактом, поскольку вместе с эмбриональной сывороткой, которая добавлялась в культуральную среду для роста клеток, туда попадали и сами эмбриональные клетки (и, скорее всего, культура Карреля стала уже далеко не тем, чем была в начале).
По-настоящему бессмертными являются раковые клетки. Так, клетки HeLa, выделенные в 1951 г. из опухоли шейки матки Генриетты Лакс , до сих пор используются цитологами (в частности, c помощью клеток HeLa была разработана вакцина против полиомиелита). Эти клетки даже побывали в космосе.
Еще один важный фактор биологического старения — строение хромосом и их кончиков — теломеров.
Теломерная теория старения
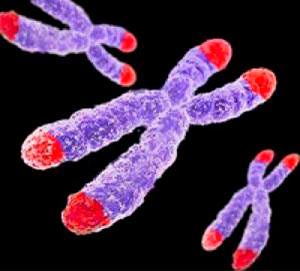
Рисунок 1. Теломеры — концевые участки хромосом. Поскольку хромосом у человека 23 пары (то есть, 46 штук), теломер получается 92.

Рисунок 2. Состав и структура теломер. Многократное деление клетки в случае отсутствия активности теломеразы ведет к укорочению теломер и репликативному старению.

Рисунок 3. Строение теломерного комплекса (шелтерина). Теломеры находятся на концах хромосом и состоят из тандемных повторов TTAGGG, которые заканчиваются 32-членным выступающим одноцепочечным фрагментом. С теломерной ДНК связан шелтерин — комплекс из шести белков: TRF1, TRF2, RAP1, TIN2, TPP1 и POT1.
Любопытно, что у мышей очень длинные теломеры (50–40 т.н.п., по сравнению с 10–15 т.н.п. у человека). У некоторых линий лабораторных мышей длина теломер достигает 150 т.н.п. Более того, у мышей теломераза всегда активна, что не дает теломерам укорачиваться. Однако это, как всем известно, не делает мышей бессмертными. Мало того: у них опухоли развиваются намного чаще, чем у людей, что позволяет предположить, что укорачивание теломер как механизм защиты от опухолей у мышей не работает [15].
При сравнении длины теломер и теломеразной активности у разных млекопитающих оказалось, что виды, для которых характерно репликативное старение клеток, имеют большую продолжительность жизни и большой вес. Это, например, киты, продолжительность жизни которых может достигать 200 лет. Таким организмам репликативное старение просто необходимо, поскольку слишком большое число делений порождает множество мутаций, с которыми необходимо как-то бороться. Предположительно, репликативное старение и есть такой механизм борьбы, который сопровождается к тому же репрессией теломеразы [16].
Старение диференцированных клеток происходит иначе. Стареют и нейроны, и кардиомиоциты, а ведь они не делятся! Например, в них накапливается липофусцин — старческий пигмент, который нарушает функционирование клеток и запускает апоптоз. В клетках печени и селезенки с возрастом накапливается жир.
Связь репликативного старения клеток со старением организма, строго говоря, не доказана, но возрастная патология сопровождается и старением клеток (рис. 4). Злокачественные новообразования пожилого возраста в большинстве своем связаны с обновляемыми тканями. Онкологические заболевания в развитых странах — одна из основных причин заболеваемости и смертности, причем независимым фактором риска раковых заболеваний является просто. возраст. Число смертей от опухолевых заболеваний увеличивается с возрастом по экспоненте, так же как и общая смертность. Это говорит нам, что между старением и канцерогенезом существует фундаментальная связь.
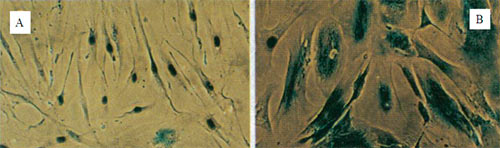
Рисунок 4. Гистохимически окрашенные на наличие β-галактозидазной активности фибробласты человека линии WI-38. A — молодые; B — старые (сенесцентные).
Теломераза — фермент, который был предсказан
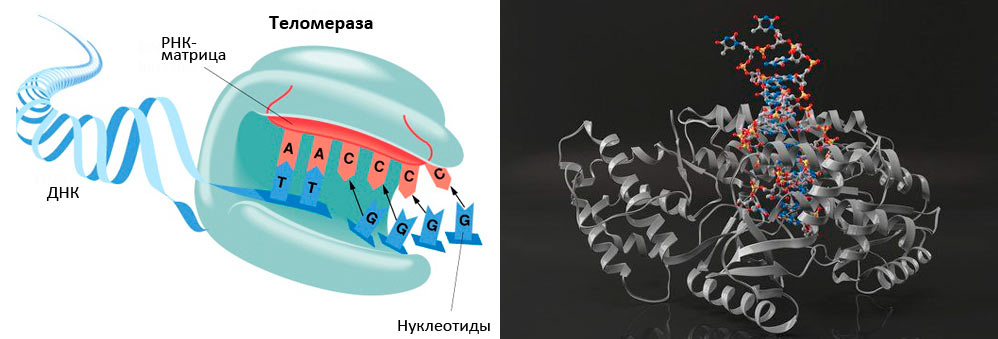
Рисунок 5. Теломераза содержит каталитический компонент (обратную транскриптазу ТERT), теломеразную РНК (hTR или TERC), содержащую две копии теломерного повтора и являющуюся матрицей для синтеза теломеров, и белок дискерин.
По данным Э. Блекберн, теломераза участвует в регуляции активности примерно 70 генов. Теломераза активна в зародышевых и эмбриональных тканях, в стволовых и пролиферирующих клетках. Ее обнаруживают в 90% раковых опухолей, что обеспечивает неудержимое размножение раковых клеток. В настоящее время среди препаратов, которые используют для лечения рака, есть и ингибитор теломеразы. Но в большинстве соматических клеток взрослого организма теломераза не активна.
В состояние сенесценции клетку могут привести многие стимулы — дисфункция теломер, повреждения ДНК, причиной которых могут быть мутагенные воздействия окружающей среды, эндогенные процессы, сильные митогенные сигналы (сверхэкспрессия онкогенов Ras, Raf, Mek, Mos, E2F-1 и др.), нарушения хроматина, стрессы и др. Фактически, клетки перестают делиться — становятся сенесцентными — в ответ на потенциально вызывающие рак события.
Страж генома
О молекулярных механизмах старения клеток

Рисунок 6. Схема клеточного цикла. Клеточный цикл подразделяют на четыре стадии: 1. G1 (предсинтетическая) — период, когда клетка готовится к репликации ДНК. В этой стадии может произойти остановка клеточного цикла в случае обнаружения повреждений ДНК (на время репарации). Если обнаруживаются ошибки в репликации ДНК, и они не могут быть исправлены репарацией, клетка не переходит на стадию S. 2. S (cинтетическая) — когда происходит репликация ДНК. 3. G2 (постсинтетическая) — подготовка клетки к митозу, когда происходит проверка точности репликации ДНК; если обнаружены недореплицированные фрагменты или другие нарушения в синтезе, переход на следующую стадию (митоз) не происходит. 4. М (митоз) — формирование клеточного веретена, сегрегация (расхождение хромосом) и формирование двух дочерних клеток (собственно деление).
Чтобы были понятны молекулярные механизмы перехода клетки в состояние сенесцентности, я напомню вам, как происходит деление клетки.
Процесс размножения клеток называют пролиферацией. Время существования клетки от деления до деления именуют клеточным циклом. Процесс пролиферации регулируется как самой клеткой — аутокринными ростовыми факторами, — так и ее микроокружением — паракринными сигналами.
Активация пролиферации происходит через клеточную мембрану, в которой присутствуют рецепторы, воспринимающие митогенные сигналы — это в основном ростовые факторы и межклеточные контактные сигналы. Ростовые факторы обычно имеют пептидную природу (к настоящему времени их известно около 100). Это, например, фактор роста тромбоцитов, который участвует в тромбообразовании и заживлении ран, эпителиальный фактор роста, различные цитокины — интерлейкины, фактор некроза опухолей, колониестимулирующие факторы и т.д. После активации пролиферации клетка выходит из фазы покоя G0 и начинается клеточный цикл [19] (рис. 6).
Сенесценция клеток и возраст-зависимые заболевания

Рисунок 7. Взаимосвязь между старением клеток и старением организма.
Сенесцентные клетки накапливаются с возрастом и способствуют возрастным заболеваниям. Они снижают пролиферативный потенциал ткани и истощают пул стволовых клеток, что приводит к дегенеративным нарушениям ткани и снижает способность к регенерации и обновлению.
Сенесцентные клетки характеризуются специфической экспрессией генов: они секретируют воспалительные цитокины и металлопротеиназы, разрушающие межклеточный матрикс. Получается, что старые клетки обеспечивают вялотекущее старческое воспаление, а накопление старых фибробластов в коже служит причиной возрастного снижения способности к заживлению ран (рис. 7). Старые клетки также стимулируют пролиферацию и малигнизацию близлежащих предраковых клеток, благодаря секреции эпителиального фактора роста [20].
Сенесцентные клетки накапливаются во многих тканях человека, присутствуют в атеросклеротических бляшках, в язвах кожи, в пораженных артритом суставах, а также в доброкачественных и пренеопластических гиперпролиферативных поражениях простаты и печени. При облучении раковых опухолей некоторые клетки также переходят в состояние сенесценции, тем самым обеспечивая рецидивы заболевания.
Таким образом, клеточное старение демонстрирует эффект отрицательной плейотропии, суть которого состоит в том, что хорошее для молодого организма, может стать плохим для старого. Самый яркий пример — процессы воспаления. Выраженная реакция воспаления способствует быстрому выздоровлению молодого организма при инфекционных заболеваниях. В пожилом же возрасте активные воспалительные процессы приводят к возрастным заболеваниям. Сейчас принято считать, что воспаление играет определяющую роль практически при всех возраст-зависимых заболеваниях, начиная с нейродегенеративных.

Обзор
Содружество клеток – основа жизни
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Братство без свободы и равенства

Рисунок 1. Схема развития ланцетника. 1 — оплодотворенная яйцеклетка (зигота) — аналог одноклеточных организмов; 2–5 — дробление (стадии 2–32 бластомеров) — серия делений клеток — аналог неустойчивых, легко распадающихся на отдельные клетки колоний; 6 — бластула (в разрезе) — многоклеточный зародыш — аналог устойчивых колониальных организмов. Межклеточные взаимодействия в ходе эмбрионального развития усиливаются и усложняются.
Естественный отбор сохранил клетки, которые не просто выживали, избавляясь от излишков своего тела, а наделяли их генетическим материалом, создавая собственную копию. Очевидно, так сформировалось деление, известное для прокариот как бинарное деление, а для эукариот — как митоз (рис. 2).


Рисунок 3. Формы колоний: I — нитевидная, II — однослойный клеточный пласт, III — многослойный клеточный пласт, IV — шаровидная (с дифференцированными клетками).
Клетки существуют в устойчивых группах не поневоле. Им выгодно держаться вместе, разделяя функции между собой. Отбор шел на закрепление механизмов группового существования клеток, т.е. эволюция колониальных одноклеточных была сопряжена с совершенствованием межклеточных взаимодействий (рис. 4).

Рисунок 4. Эволюция межклеточных взаимодействий. а — Путем диффузии химических сигналов. б — Через внеклеточный матрикс. в — Через специализированные межклеточные контакты.
Клетки колонии все теснее и прочнее соединялись друг с другом, жертвуя своей свободой. Они становились частью целого — истинно многоклеточного организма (рис. 5). Причем происходило это неоднократно. Например, эукариоты, по оценкам специалистов, переходили к уровню многоклеточного организма в разных эволюционных ветвях минимум 24 раза [13].

Итак, межклеточные взаимодействия — это универсальный по своей природе биологический механизм. Он лежит в основе существования и развития всех многоклеточных форм, обеспечивая структурно-функциональное постоянство многоклеточного организма.
Родства не помнящие?
Современное представление о раке следующее: клетка после ряда определенных мутаций начинает интенсивно размножаться, образуя опухоль. Это не какая-то одна определенная мутация. Для того, чтобы нормальная клетка стала на путь злокачественного перерождения, должно набраться значительное количество генетических повреждений [17]. Поначалу опухоль компактна, но по мере своего быстрого роста она начинает распадаться. Происходит миграция отдельных клеток опухоли в разные части тела, где каждая из них продолжает расти и размножаться. Такие множественные опухоли, разбросанные по всему телу, называются метастазами. Весь этот процесс нарушает нормальную работу организма, который, в конечном счете, погибает [18].
Нормальные клетки как было сказано выше, находятся в сложной системе межклеточных взаимодействий (рис. 7). Они постоянно выделяют специфические вещества, которые регулируют жизненный цикл клеток, их деление и апоптоз. В нормальной ткани клетки подавляют склонность соседок к злокачественному перерождению [19].

Благодаря межклеточным взаимодействиям клетки здоровой ткани как бы прилипают друг к другу. Это называется клеточной адгезией. Причем родственные клетки прилипают друг к другу намного охотнее, словно узнают своих родственников. Такое специфическое соединение клеток так и называют — узнавание. Поэтому клетка здоровой ткани, как правило, малоподвижна из-за связывающих ее свободу межклеточных контактов, что называется контактным торможением клеток. Контактное торможение, адгезия клеток и их узнавание — причины, сохраняющие структурную целостность организма.
Позже оказалось, что клетки раковой опухоли, как потомки одной материнской клетки, все же взаимодействуют между собой и манипулируют здоровыми клетками. Однако делают они это исключительно путем выделения сигнальных веществ. Так, например, клетки глиобластомы — агрессивной опухоли головного мозга — в условиях недостатка кислорода, питательных веществ и других ресурсов, выделяют в межклеточную среду экзосомы — особые мембранные пузырьки с веществами, которые стимулируют деление клеток, блокируют апоптоз и посылают другим клеткам опухоли химический сигнал к миграции. К сигнальным веществам относится и т.н. фактор роста эндотелия сосудов, который стимулирует прорастание в область опухоли новых кровеносных сосудов, усиливая в ней кровообращение. Так клетки глиобластомы активно манипулируют здоровыми клетками прилегающих тканей [23].

Рисунок 8. Смоделированный график развития опухоли крыс — карциномы Герена — до летального исхода. Пунктиром отмечен график развития опухоли до лечения. Экспоненциальный рост опухоли наблюдается на ранних стадиях рака, преимущественно в изолированной культуре (in vitro). В живом организме (in vivo) злокачественная опухоль на средних и поздних стадиях развития характеризуется сниженной активностью клеток и высоким уровнем их генетической разнородности. Исследование 15 разных типов опухолей как in vitro, так и in vivo, показало, что рост этих новообразований носит не экспоненциальный, а линейный характер [26].
Таким образом, клетки злокачественной опухоли благодаря межклеточным взаимодействиям реагируют на давление среды, активно приспосабливают ее под свои нужды, мигрируют в поисках новых мест обитания и даже немного приостанавливают темпы своего роста.
Империя невидимых
Если появление многоклеточных организмов — это результат усиления в ходе эволюции межклеточных взаимодействий, то самые древние одноклеточные организмы — бактерии — должны характеризоваться слабыми межклеточными взаимодействиями или вообще их отсутствием.
Рост колонии микроорганизмов описывается S-образной кривой логистического роста (рис. 9, слева), которая образуется из-за ограничивающего непрерывный рост давления среды (например, старения клеток, истощения пищевых ресурсов и жизненного пространства, внутривидовой конкуренции, отравления отходами жизнедеятельности). Логистическая кривая хорошо описывает не только рост колонии микроорганизмов, но и индивидуальный рост многоклеточных организмов (рис. 9, в центре). Это происходит также под давлением среды и усиливающихся межклеточных взаимодействий. Клетки уже не могут беспрепятственно потреблять ресурсы, расти и размножаться. Они вынуждены считаться со своими соседями, вступая с ними в сложные физико-химические взаимодействия.
Получается, что рост колонии одноклеточных и рост многоклеточного организма описывается однотипной логистической кривой. Следовательно, в обоих случаях группы клеток растут, подчиняясь единым закономерностям (рис. 9, справа). Тогда можно предположить наличие в растущей колонии бактерий сложной системы межклеточных взаимодействий, подобных тем, что обеспечивают тканевую организацию многоклеточных.

Рисунок 9. Кривые роста. Слева: кривая роста микроорганизмов при периодическом культивировании: I — лаг-фаза: бактерии приспосабливаются к окружающей среде, скорость роста колонии незначительная; II — фаза ускорения роста; III — фаза экспоненциального роста (лог-фаза): скорость роста колонии высокая, а количество клеток увеличивается экспоненциально; IV — фаза замедления роста; V — фаза стационарная: скорость роста колонии практически равна нулю, деление и гибель конкурирующих за ресурсы клеток компенсируют друг друга; VI — фаза отмирания культуры: скорость роста колонии снижается, т.к. увеличивается количество гибнущих клеток и уменьшается количество делящихся клеток. В центре: Кривая абсолютного роста длины тела в эмбриональном и раннем постэмбриональном периодах. Справа: Кривые роста (штриховка — давление среды). При неограниченных ресурсах среды (идеальные условия отсутствия давления среды), рост колонии описывается экспоненциальной кривой (а), выражающей т.н. биотический потенциал. В естественных условиях (при ограниченных ресурсах среды) рост колонии микроорганизмов описывается логистической кривой (б).

Объединение отдельных клеток в единый многоклеточный организм, размножающийся как целое, — это одно из фундаментальных направлений эволюции живой материи. Чем разнороднее объединяющиеся клетки (крайний случай — объединение одноклеточных организмов разных видов), тем сильнее выражены межклеточные взаимодействия в форме симбиоза (например, лишайники — многоклеточные симбиотические организмы, объединяющие в себе грибы и водоросли). Если же объединяются клетки одного вида (чаще — потомки одной материнской клетки), то межклеточные взаимодействия строятся в форме альтруизма.
Напротив, все истинно многоклеточные организмы сформировались из потомков одной материнской клетки, т.е. генетически идентичных клеток. Альтруизм пронизывает всю эволюцию многоклеточных организмов [41]. Так, у млекопитающих уже в процессе оплодотворения сперматозоиды объединяются в небольшие плотные стайки, которые позволяют им двигаться к яйцеклетке быстрее сперматозоидов-одиночек. Это можно рассматривать как пример межклеточных взаимодействий в форме альтруизма, так как только одному сперматозоиду суждено оплодотворить яйцеклетку [42].
Таким образом, вполне можно считать многоклеточность выражением крайней степени социальности, при которой поведение индивидуума подчиненно интересам группы [40]. Естественно, что в таком случае наиболее развитые межклеточные взаимодействия и высокая степень выраженности альтруизма будет присуща клеткам-потомкам одной материнской клетки [43].
Заключение
Межклеточные взаимодействия — это универсальный по своей природе биологический механизм, который лежит в основе существования и развития всех клеточных форм жизни. Это не особенность многоклеточных организмов, а наследие первых клеточных форм жизни, которые спонтанно начали идти по единственно возможному пути прогрессивной эволюции: взаимодействовать с себе подобными, подчиняя индивидуальное поведение интересам группы.
Читайте также:

