Пульс капельницы при волчанке
Обновлено: 24.04.2024
Системная красная волчанка (СКВ) - классическое аутоиммунное ревматичес кое заболевание, в основе патогенеза которого лежат дефекты иммунорегуляции, приводящие к неконтролируемой гиперпродукции В лимфоцитами аутоантител к компонентам собственных тканей и развитию хронического вос паления, затрагивающего многие органы и системы. Прогрессирующее поражение жизненно важных органов определяет жизненный и социальный прогноз больных СКВ, при "катастрофическом" течении летальность достигает 40% в год, в связи с чем принципиальное значение имеет разработка новых методов патогенети ческой терапии этого заболевания.
В последние десятилетия сформиро ваны основные принципы терапии СКВ, в основе которых лежит применение раз личных режимов глюкокортикоидной (ГК) терапии и цитотоксических препаратов. Современные терапевтические схемы с использованием пульс-терапии метилпреднизолоном и циклофосфаном (ЦФ) значительно улучшили отдаленную выжи ваемость и высокоэффективны при развитии угрожающих состояний у больных СКВ. Наиболее ярким примером повыше ния качества лечения СКВ является более чем пятикратное увеличение 5-и летней выживаемости у больных с волчаночным нефритом. Однако, отдаленный жизненный прогноз у этой категории больных остается неблагоприятным. Так, 20-и летняя выжи ваемость при развитии люпус-нефрита, даже при использовании современных терапевтических программ, не превышает 20%. Значительно отягощает кратко срочный и отдаленный жизненный прогноз у больных СКВ развитие таких угрожающих состояний как цитопенических криз, поражение центральной и периферической системы, пневмонит, катастрофическое течение АФС и генерализованный (криоглобулинемический) васкулит. Основными факторами, влияющими на развитие неблагоприятного исхода при СКВ, является резистентность к высоким дозам ГК и циклофосфана и торпидное, прогрес сирующее течение болезни. В тоже время применение высоких доз ГК и ЦФ ассоциируется с повышением риска воз никновения тяжелых вирусных и бакте риальных инфекций, что в значительной степени лимитирует их назначение.
Безусловно, "сверхзадачей" терапии СКВ и других аутоиммунных заболеваний, является создание препаратов селективно влияющих на ключевые звенья патогенеза. В этой связи перспективным направ лением фармакотерапии СКВ являются препараты, блокирующие пролиферацию В - клеток, среди которых одним из наиболее изученных, безусловно является Ритуксимаб (Rituxumab, MabTHera, Roch,), который представляет собой рекомби-нантные химерные (мышь-человек) моноклональные антитела к поверхностным рецепторам В-лимфоцитов - CD20. Пред полагаемый механизм действия ритуксимаба, направленный на подавление активности В клеток, может реализовываться за счет антитело-зависимой клеточной цитотоксичности, комплемент-зависимой цитотоксичности, ингибиции клеточной пролиферации и индукции апоптоза В лимфоцитов. Молекулярные взаимодействия связывания CD20 могут приводить к перестройке мембранных липидов, активации ферментов и регу ляции синтеза интерлейкина 10. Основной мишенью ритуксимаба являются клетки предшественники, незрелые, зрелые и "наивные" В-лимфоциты. На плазмати ческие клетки препарат не оказывает влияния, из-за отсутствия их на мембране CD20.
Впервые ритуксимаб был применен для лечения больных злокачественной В-клеточной лимфомой в 1997 г. Моно терапия ритуксимабом В-клеточных лимфом эффективна у 50% больных и в 10% случаев наблюдается клиническая ремис сия, в тоже время при комбинации его с химиотерапией эффективность лечения возрастает до 81-97%, а частота ремиссий достигает 74%.
В настоящее время, по данным литературы, ритуксимаб применялся в лечении более чем 200 больных СКВ. Назначение препарата в дозах от 1000 до 2000 мг (обычно РМ назначается по 375 мг/м 2 еженедельно в течение 4 недель) оказалось высокоэффективным у больных с поражением суставов, кожи, слизистых оболочек, полисерозитом, лихорадкой и гематологическими нарушениями. Особо го внимания заслуживает тот факт, что высокая эффективность ритуксимаба (око ло 80%) отмечалась при развитии прогрессирующего волчаночного нефрита, тяжелом поражении ЦНС, гематоло гическом кризе, пневмоните и катастро фическом течении АФС - при неэффек тивности пульс-терапии ГК, ударных доз циклофосфана, иммуносорбции, плазмафереза, мофетила микофенолата и цик лоспорина.
В настоящее время проведено нес колько открытых пилотных испытаний эффективности ритуксимаба у больных с волчаночным нефритом. Так, в одном из них (P. Sfikakis et al.) препарат был назначен 10 больным с активным пролиферативным люпус-нефритом (III-IV класс по класси фикации ВОЗ), без признаков почечной недостаточности. До включения в ис следование все пациенты получали вы сокие дозы глюкокортикоидов (ГК), пульс-терапию циклофосфаном (ЦФ) или мофетила-микофенолат (МФ) без существен ного эффекта. Инфузии РМ по 375 мг/м - проводились еженедельно в течение 4-х недель. В результате проведенного лечения частичная ремиссия (улучшение на 50% клинико-лабораторных параметров нефрита) зафиксирована у 8 больных через 1-4 месяца. В последующем полная ремиссия (протеинурия В большинстве исследований пока зано, что эффект терапии этим препаратом при волчаночном нефрите развивается не сразу, как правило значимое уменьшение протеинурии, повышение клубочковой фи льтрации, увеличение содержания альбу мина в сыворотке крови, наблюдается на 2-3 месяце от начала лечения и достигает своего максимума к 5-6 месяцу. Одно временно наблюдается уменьшение ин дексов активности СКВ (BILAG, SLEDAI), антител к ДНК, повышение комплемента. Напротив, применение Ритуксимаба у больных с высокой активностью, обус ловленной внепочечными проявлениями СКВ - цитопенией, полиартритом, серозитом, пневмонитом и АФС, может при вести к развитию положительной динамики уже через несколько дней.
Отчетливый быстрый эффект ритукси маба отмечен у больных с критическим течением СКВ, обусловленным пораже нием ЦНС. Поражение ЦНС (нейролюпус), сопровождающееся развитием состояния угрожающего жизни у больных СКВ, наблюдается достаточно редко, в 2-4% случаев. Терапия таких тяжелых прояв лений волчаночного поражения ЦНС, как судорожный синдром, демиелинизирующая нейропатия, поперечный миелит, психоз - представляет большие трудности, стандартных терапевтических алгоритмов не существует, а летальность превышает 50%. В этой связи особый интерес вызывает публикация Tokunaga, в которой сообщается о применении ритуксимаба у 10 больных СКВ по жизненным пока заниям. У всех описываемых больных наблюдались различные проявления пора жения ЦНС: потеря сознания, судороги, дезориентация, атаксия, сенсорная ней ропатия, психоз. Во всех случаях наз начение ритуксимаба привело к быстрому улучшению, развившемуся в течение нес кольких дней от начала лечения. Авторы отмечают быстрый выход из коматозного состояния, уменьшение и исчезновение двигательных и чувствительных наруше ний, купирование судорожного синдрома, психоза и депрессии. Нарастание поло жительной динамики, переходящее в стабильное улучшение наблюдалось в течение 6-7 месяцев, у всех больных за этот период удалось существенно снизить дозу преднизолона и отменить иммунодепрессанты. Полученные данные свидетельствуют о высокой эффективности инфузий ритуксимаба при СКВ с развитием критических состояний, непосредственно угрожающих жизни пациентов. Особенно важным представляется то, что высокая эффективность терапии наблюдалась у больных с тяжелым, прогрессирующим поражением ЦНС с неэффективностью интенсивной терапии, включающей ударные дозы ГК, ЦФ в комбинации с плазмаферезом и иммуносорбцией.
Применение ритуксимаба у больных СКВ не только индуцирует развитие клинического улучшения, продолжитель ностью от нескольких месяцев до 1 года, но и приводит к появлению различных иммунологических феноменов. Практи чески все исследователи отмечают развитие лимфопении, подавление В-лимфоцитов, наблюдаемое практически сразу после проведения курса лечения ритуксимабом. Leandro, Anolik сообщают о значительном подавлении В лимфоцитов, продолжающееся в среднем около 4 месяцев от начала терапии и корре лирующее с развитием клинического эффекта, нормализацией гемоглобина, СОЭ, комплемента. По мнению авторов, появление на фоне терапии антихиме рических антител может провоцировать развитие аллергических реакций. Те же авторы не выявили достоверного снижения антител к ДНК. Оценивая влияние ритуксимаба на активность люпус-нефрита Stifakis et al. так же обращают внимание на подавление 99% В лимфоцитов у 8 из 10 больных, наблюдаемое от 1 до 7 месяцев. Продолжительность угнетения В клеток соответствовала длительности ремиссии и, напротив, их регенерация предшество вала развитию обострения.
Большинство исследователей отме чают достаточно хорошую переносимость препарата. Подавляющее большинство побочных реакций возникающих во время или после проведения инфузий, так или иначе могут быть связаны с "биоло гической", белковой основой препарата. Как правило, наблюдаются такие явления как озноб, лихорадка, гипотензия, одышка. Обычно такие побочные реакции устра няются более медленной скоростью введения, дробным введением. Для профилактики может использоваться пара цетамол, антигистаминовые препараты или ГК в небольших дозах. Сложившимся правилом, позволяющим практически пол ностью устранять "инфузионные" реакции, является использование инфузомата и внутривенное введение 100-250 мг метипреда непосредственно перед инфузией.
В большинстве исследований посвя щенных применению ритуксимаба как в онкологии, так и при аутоиммунных заболеваниях, не находит свое под тверждение концепция об увеличении риска развития оппортунистических инфекций. Вероятно это связано с тем, что несмотря на значительное снижение циркулирующих В лимфоцитов после инфузии РМ, не наблюдается сколь либо существенного снижения продукции иммуноглобулинов, что в свою очередь можно объяснить наличием значительного количества долгоживущих плазматических клеток.
Российский регистр больных СКВ получающий терапию ритуксимабом
Прогностически неблагоприятные варианты течения СКВ и состояния угрожающие жизни
| • Прогрессирующий нефрит (III-IV класс по ВОЗ) • Поражение ЦНС (поперечный миелит, судороги, кома, психоз) • Геморрагический альвеолит • Гематологический криз • КАФС (тромбозы, мультиорганное поражение) • Генерализованный (fulminant) некротизирующий васкулит | • "Стандартные" методы терапии • Пульс-терапия метилпреднизолоном и циклофосфаном • Внутривенный иммуноглобулин • Плазмаферез • Антикоагулянты • Реанимационные мероприятия Смертельные исходы в течение 1-го года до 40% |
Изменение 5-и летней выживаемости у больных С IV классом ВН (J.Cameron 1998)
| Годы | Выживаемость % |
| 1953-1969 отсутствие патогенетической терапии | 17% |
| 1970-1979 средние и большие дозы ГКС, пульс-терапия | 55 (в 3 раза!) |
| 1980-1983 + циклофосфан | 80 |
| 1990-1995 + мофетила микофенолат, циклоспорин, комбинированная ПТ | 82 |
| XXI век: МабТера, А-BLyS, Октембра . | ? |
20-летняя выживаемость больных СКВ
Анти-В клеточная терапия Ритуксимаб (МабТера, ROCHE)
Показания для назначения Ритуксимаба при СКВ
Неконтролируемая активность болезни
Влияние ритуксимаба на показатели активности СКВ
| Британский Индекс активности СКВ | Антитела к двухспирапьной ДНК |
Эффективность РМ у больных с волчаночным нефритом
Показатели активности волчаночного нефрита после терапии Ритуксимабом
Изменение морфологической активности нефрита через год после терапии Ритуксимабом
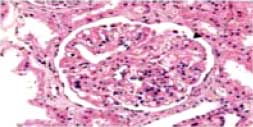 | До лечения Индекс активности 10 |
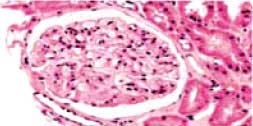 | Через год Индекс активности 1-2 |
Эффективность Ритуксимаба при неиролюпусе
М. Тikunаgа et al. 2006
| Клинические проявления | Результат и скорость достижения эффекта | Длительность эффекта |
| 6 больных Кома, судороги, каталепсия, психоз, нейропатия, галлюцинации, головные боли | Выздоровление 2- 5 дней | 4-29 месяцев |
| 4 больных Депрессия, психоз, нейропатия | Улучшение 1-4 недели | 7-14 месяцев |
Побочные эффекты и осложнения ритуксимаба
- Инфузионные реакции (озноб, гипотония, отеки, высыпания, зуд, лихорадка) могут наблюдаться у 10-20% больных. Возможно обусловлены образованием антихимерных антител (антител против РМ). Вероятность развития при повторных инфузиях уменьшается. Профилактика - метилпреднизолон 100 мг в/в до инфузии.
- Тяжелые, требуюшие антимикробной терапии инфекции редки. Чаще наблюдаются ОРВИ, герпетичекая инфекция.
ЛИТЕРАТУРА
1. Lipsky PE. Systemic lupus erythe matosus: an autoimmune disease of B cell hyperactivity. Nat Immunol. 2001;2:764-766.
2. Silverman GJ. Anti-CD20 therapy in systemic lupus erythematosus: a step closer to the clinic. Arthritis Rheum. 2005;52:371-377
3. Vasoo S, Hughes GRV Perspectives on the changing face of lupus mortality. Autoimmun Rev. 2004;3:415-417.
4. Pryor BD, Bologna SG, Kahl LE. Risk factors for serious infection during treatment with cyclophosphamide and high-dose corti costeroids for systemic lupus erythemato sus. Arthritis Rheum. 1996;39:1475-1482.
5. Chambers SA, Isenberg DA Anti - B cell therapy (Rituximab) in the treatment of autoimmune disease. Lupus. 2005;14:210-214.
6. John Looney, Jennifer H. Anolik, Debbie Campbell, Raymond E. Felgar et al. B Cell Depletion as a Novel Treatment for Systemic Lupus Erythematosus A Phase I/II Dose-Escalation Trial of Rituximab Arthritis Rheum. 2004;Aug;8:2580-2589.
7. Sfikakis PP, Boletis JN, Lionaki S., Vigklis V., Fragiadaki KG, Iniotaki A., and Moutsopoulos HM Remission of Proliferative Lupus Nephritis Following B Cell Depletion Therapy Is Preceded by Down-Regulation of the T Cell Costimulatory Molecule CD40 Ligand An Open-Label Trial. Arthritis Rheum. 2005;52(2):501-513.
8. Mikiko Tokunaga et al. Efficacy of rit uximab (Anti-CD20) for refractory systemic lupus erythematosus involving the central nervous system. 15 Nov 2006; Ann Rheum Dis
9. С.К. Соловьев, Е.Л. Насонов, М.А.Котовская. Ритуксимаб в лечении системной красной волчанки. Русский Медицинский журнал, 2005, 26, 1731-1736.
10. Е.Л. Насонов, С.К. Соловьев. Перспективы применения моноклональных антител к В-лимфоцитам (ритуксимаб) при воспалительных ревматических заболеваниях. Научно-практическая ревматология 1, 2007, 4-8.
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Системные васкулиты — гетерогенная группа заболеваний, основной морфологический признак которых — воспаление сосудистой стенки, а спектр их клинических проявлений зависит от типа, размера, локализации пораженных сосудов и тяжести сопутствующих воспалител
Системные васкулиты — гетерогенная группа заболеваний, основной морфологический признак которых — воспаление сосудистой стенки, а спектр их клинических проявлений зависит от типа, размера, локализации пораженных сосудов и тяжести сопутствующих воспалительных изменений.
Этиология большинства первичных системных васкулитов неизвестна. В их развитии одновременно участвуют несколько иммунных, а также и неиммунных, патологических механизмов (P. A. Bacon, 1996; F. C. Breedveld & M. R. Daha,1996). Большое значение отводится активации клеточного иммунитета, характеризующейся в некоторых случаях преобладанием Th1-типа иммунного ответа (ИЛ-2, ИФ-γ), с увеличением выработки провоспалительных цитокинов, инфильтрацией Т-лимфоцитами и макрофагами стенки сосуда, образованием гранулем. Не менее важное звено патогенеза васкулитов связано с нарушениями в гуморальном звене иммунитета, проявляющимися выработкой аутоантител (антитела к компонентам цитоплазмы нейтрофилов, эндотелию сосудов, фосфолипидам), образованием иммунных комплексов, включая криоглобулины. В патогенезе васкулитов также важную роль играет активация сосудистого эндотелия, потеря им поверхностных компонентов с антикоагулянтной активностью и высвобождение прокоагулянтных субстанций, увеличение экспрессии на его поверхности молекул адгезии, нарушение нормальных механизмов апоптоза эндотелиальных клеток, а также взаимодействия между ними и лейкоцитами.
Наиболее перспективным направлением в лечении васкулитов считается этиотропная терапия. Однако назначение специфических этиотропных препаратов при этих заболеваниях ограничено из-за отсутствия четких данных относительно этиологии основных их нозологических форм, вследствие чего в большинстве случаев предпочтение отдается патогенетической терапии, которая в настоящее время носит весьма активный характер (Е. Л. Насонов и соавт., 1998). Ее агрессивность определяется не столько нозологической формой васкулита, сколько быстротой прогрессирования деструктивных изменений в сосудистой стенке, наличием висцеритов, прежде всего поражением почек и активностью иммунного воспаления (J. S. Cameron, 1996).
В настоящее время для лечения васкулитов используют разнообразные лекарственные средства. При этом глюкокортикостероиды (ГКС), оказывающие мощное воздействие на иммунную систему, являются одними из основных препаратов. Возможные механизмы их иммуномодулирующей и противовоспалительной активности при васкулитах представлены ниже.
Известно, что ГКС применяются в терапии васкулитов уже более 50 лет. Так, после использования P. S. Hench и соавт. в 1949 году кортизона для лечения ревматоидного артрита, A. H. Baggenstoss и соавт. (1950) рассказали о его применении при узелковом полиартериите.
ГКС широко используются для лечения практически всех форм васкулитов. Существует несколько схем их назначения: монотерапия, альтеринирующий прием, комбинация этих препаратов с другими лекарственными средствами и введение высоких (мегадоз) ГКС — пульс-терапия.
История пульс-терапии начинается с 70-х годов XX века, когда появились данные о возможности подавления синдрома отторжения после пересадки почки путем внутривенного введения больным больших доз 6-метилпреднизолона. Этот методический подход к лечению и получил название пульс-терапии, под которой обычно подразумевают быстрое, в течение 30–60 минут, внутривенное введение больших доз ГКС (около 1 г) один раз в день на протяжении трех суток.
Показания к проведению пульс-терапии при системных васкулитах
В настоящее время при системных васкулитах подавление активности заболевания предусматривает более раннее назначение пульс-терапии 6-метилпреднизолоном. Полагают, что при этих заболеваниях одним из ее преимуществ является возможность более быстрого перевода больного на поддерживающую дозу ГКС. В ряде случаев повторные процедуры пульс-терапии 6-метилпреднизолоном (один раз в месяц) служат альтернативой назначения цитостатиков.
При системных васкулитах пульс-терапия 6-метилпреднизолоном особенно показана на ранних этапах развития воспалительных изменений в сосудистой стенке, до возникновения необратимых ишемических, некротических изменений в органах и тканях (этап индукции ремиссии). Этот метод лечения также применяется и на втором этапе ведения (поддержание ремиссии) больных васкулитами. В этот период обычно проводятся мероприятия, направленные на достижение клинической и лабораторной ремиссии заболевания и быстрое купирование его обострений. И в этих случаях роль пульс-терапии в ведении больных системными васкулитами трудно переоценить. Показания к проведению пульс-терапии 6-метилпреднизолоном при системных васкулитах даны в таблице 1.
Основные схемы пульс-терапии при системных васкулитах
Известно, что у большинства больных артериитом Такаясу наблюдается положительный эффект при монотерапии ГКС. Однако часть пациентов стероидорезистентна. В этих случаях, как правило, проводят комбинированную пульс-терапию 6-метилпреднизолоном и циклофосфаном (Е. Н. Семенкова,1988; P. A. Bacon,1996). Применение пульс-терапии при этом васкулите позволяет быстро подавить иммунное воспаление (А. В. Покровский и соавт.,1990; А. А. Баранов и соавт.,1996).
Комбинированная пульс-терапия также показана при облитерирующем тромбангиите, особенно при быстро прогрессирующем течении заболевания, до развития полной облитерации магистральных артерий нижних или верхних конечностей.
До сих пор дискутируется вопрос относительно длительности пульс-терапии при системных васкулитах. Обычно при гранулематозе Вегенера, микроскопическом полиангиите, узелковом полиартериите, СКВ и ревматоидном васкулите ее проводят ежемесячно в течение 9–24 месяцев без перерыва (С. К. Соловьев, В. А. Насонова, 1997; D. G. I. Scott & P. A. Bacon, 1984; R. A. Luqmani et al., 1996). В отечественной литературе первый опыт использования пульс-терапии циклофосфаном и 6-метилпреднизолоном при артериите Такаясу представили А. В. Покровский и соавт. (1990). Авторы назначали однократный курс пульс-терапии обычно для предоперационной подготовки больных. Однако, по нашим данным, при этом заболевании предпочтительнее повторять такие курсы один раз в месяц на протяжении 7–12 месяцев (А.А.Баранов и соавт.,1996). Мы также предпочитаем проводить повторные курсы пульс-терапии 6-метилпреднизолоном и циклофосфаном ежемесячно в течение шести–девяти месяцев и при облитерирующем тромбангиите (А. А. Баранов и соавт., 1996).
В ряде случаев введение преднизолона и циклофосфана комбинируют с процедурами плазмафереза. Полагают, что такая тактика предпочтительнее для ведения больных с эссенциальным криоглобулинемическим васкулитом при наличии у них прогрессирующего поражения почек и полинейропатии (D. Geltner,1988). Она также используется при фульминантном течении васкулита, сопровождающемся нарушением функции жизненно важных органов (C. M. Lockwood, 1996; C. Savage et al., 1997). Сочетанное лечение ГКС и малообъемным плазмаферезом проводят и при артериите Такаясу (T. Zhdanova et al.,1995).
С. К. Соловьев и В. А. Насонова (1997) сформулировали принципы применения синхронной интенсивной терапии с последовательным назначением экстракорпоральных процедур — плазмафереза или гемосорбции — и ударных доз 6-метилпреднизолона и циклофосфана для лечения СКВ. Аналогичная схема используется и педиатрами при острых и молниеносных формах узелкового полиартериита (Г. А. Лыскина и соавт., 1994). Однако для других форм васкулитов пульс-синхронизация еще не разработана.
В целом при системных васкулитах пульс-терапию 6-метилпреднизолоном назначают в следующих ситуациях:
- при индукции ремиссии васкулита;
- для подавления обострений васкулита;
- в качестве поддерживающей терапии (во время ремиссии заболевания).
Особенности проведения пульс-терапии при васкулитах
- Преимущественное назначение при некротизирующих васкулитах, реже при артериите Такаясу, гигантоклеточном артериите, облитерирующем тромбангиите и др.
- Сочетание пульс-терапии 6-метилпреднизолоном с цитотоксиками (циклофосфан).
- В ряде случаев показано сочетание курсов пульс-терапии 6-метилпреднизолоном и цитотостатиками с постоянным приемом преднизолона, метотрексата, сандиммуна и др.
- Синхронизация пульс-терапии 6-метилпреднизолоном и цитотостатиками с процедурами плазмафереза или введение внутривенного иммуноглобулина.
Побочные эффекты и осложнения пульс-терапии 6-метилпреднизолоном
Исходя из нашего опыта, основанного на данных, полученных при наблюдении за более чем 50 больными с различными формами системных васкулитов, побочные явления пульс-терапии 6-метилпреднизолоном обычно ограничиваются тахикардией, гиперемией лица, нарушением сна, причем эти нарушения, выраженные в большей или меньшей степени, наблюдаются в 20–30% случаев. Большинство из них появляется во время инфузии препарата или несколько часов спустя и крайне редко — на вторые или третьи сутки; как правило, эти побочные эффекты проходят самостоятельно или после однократного применения седативных препаратов или бета-блокаторов.
Значительно реже (3–5%) наблюдаются брадикардия и гипотония, которые также проходят самостоятельно. Однако при ухудшении состояния рекомендуется немедленно начать терапию кардиотониками, а в тяжелых случаях применять дексаметазон (от 16 до 40 мг внутривенно).
В литературе приводятся случаи развития у больных СКВ таких тяжелых осложнений пульс-терапии, как анафилаксия, желудочковые аритмии, а также внезапной смерти в результате острых метаболических нарушений в миокарде. В связи с этим не рекомендуется проведение пульс-терапии при ИБС с нарушением ритма, тяжелой сердечной недостаточности и неконтролируемой артериальной гипертензии. С целью уменьшения риска развития острых электролитных нарушений в миокарде запрещается сочетать пульс-терапию с внутривенным введением лазикса.
Как отмечалось выше, необходимо осторожно назначать пульс-терапию у лиц пожилого и старческого возраста, а при наличии показаний для данного метода лечения по возможности уменьшать дозу препарата (мини-пульс-терапия).
Заключение
Интерметирующая пульс-терапия 6-метилпреднизолоном рассматривается как наиболее эффективный метод лечения большинства нозологических форм системных васкулитов, причем его эффективность во многом зависит от своевременной диагностики этих заболеваний. Пульс-терапию 6-метилпреднизолоном при системных васкулитах необходимо начинать на ранних стадиях заболевания, до развития необратимых изменений в сосудистой стенке и внутренних органах. Обычно ее проводят в комбинации с иммуносупрессантами цитотоксического действия типа циклофосфана.
Н. П. Шилкина, А. А. Баранов
Ярославская государственная медицинская академия
На сервисе СпросиВрача доступна консультация ревматолога онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Конечно. Нет показаний для пульс-терапии при улучшении состояния на фоне базисной терапии. А вот дозу гормона меньше, чем 2 таб в день, снижать не стоит. Почему не приведен анализ мочи? Контроль за состоянием почек обязателен при СКВ. Уровень тромбоцитов тоже не указали, за ним обязательно следить. Анализы на антифосфолипидный синдром сданы?
Екатерина, в вопросе добавила скрины анализов. Последнего анализа мочи на руках нет, но там все в норме. От госпитализации сама отказалась, в данный момент абсолютно не с кем оставить ребенка. Тромбоциты подскачили с началом лечения. Внешних признаков СКВ не наблюдается.

СКВ не лечат в дневном стационаре. Постановка диагноза СКВ, это обязательная и немедленная госпитализация в больницу.
Екатерина, я также прохожу лечение, назначенное ревматологом. Его же мне проводили бы в больнице. Все предписания соблюдаю, все дополнительные обследования и сложные анализы прохожу. И препараты могу купить хорошие, а не аналоги, которые часто дают в больницах. Вот насчет Пульс-терапии не совсем уверена в данный момент(

Половина попадающих ко мне на прием пациентов с дебютом СКВ к вечеру оказываются в реанимации. Есть с кем, просто нет понимания, как этот диагноз опасен а дебюте.
Екатерина, понимаю. Врач тоже не сильно настаивала, просто предложила стационар. Потом согласилась, что в принципе в моем состоянии можно и в дневном стационаре пройти курс.

Екатерина, к сожалению с медициной в нашей республике все не так радужно, как хотелось бы( А в больницах и того хуже. И это не мое субъективное мнение, это мнение многих Московских врачей.

Екатерина, еще врач говорил, что при смешанном диагнозе болезнь протекает менее агрессивно, чем любое аутоиммунное по-отдельности. Хотелось бы узнать Ваше мнение на этот счет.

Смешанное заболевание соединительной ткани или синдром Шарпа, это не СКВ, это другая патология. Оно протекает мягче. У вас не Шарп, у вас СКВ. При Шарпе совсем другая иммунология.

И антитела к нуклеосомам говорят о поражении почек. Следить за анализом мочи минимум раз в месяц в течении года!

Почитала диагноз. Сзст, очень надеюсь, у вас врачи имеют ввиду как системное, а не смешанное заболевание соединительной ткани. Потому что , если вам пытаются выставить диагноз смешанного, это ошибка. И надо найти ревматолога на уровень выше и опытнее.
Екатерина, спасибо огромное за консультацию! В своем вопросе я добавила фото диагноза, врач пишет именно смешанное.
Выходит и лечение не верно подобрано тогда?
И поражение почек будет видно на УЗИ ? Или еще какие-то доп. анализы надо сдавать? Заранее благодарю за ответ!

Лечение как раз в сторону волчанки больше назначено, при Шарпе назначают метотрексат, а не плаквенил. Но нельзя убирать гормон ниже 2 таб. Тут нюансы, но они очень важны. Наблюдать за синдромом Шарпа и за волчанкой надо по разному.
Екатерина, спасибо! Гормон начнут убирать с четвертой недели приема по 1,4 таб. через каждые 7 дней. Выходит гормон по 2 таб *4мг нужно пить пожизненно?
Еще последний вопросик: есть ли смысл наблюдаться еще и у иммунолога? Если честно пока не нашла ревматолога лучше своего (в поиске теперь), а вот иммунолог хороший в городе вроде как есть. И еще раз спасибо Вам огромное!
Насчет пульс-терапии думаю я правильно поняла, что именно сейчас ее добавлять не стоит?)


Иммунолог не имеет понятия об этих болезнях. Сейчас убирать меньше 2 таб точно нельзя. Вас должны смотреть раз в три месяца и корректировать лечения. Сейчас абсолютно неясно, что будет через пару месяцев, какие препараты вам будут нужны. А пожизненные планы точно строить смысла нет.
Екатерина, еще раз спасибо! Очень надеюсь, что результат от лечения будет и наступит долговременная ремиссия.
Ведь это возможно?)
Ато судя по нашему "диалогу" прогнозы у меня совсем не радужные..



Кстати, о прогнозе. я не нагнетаю краски. Просто изначально видно непонимание ситуации. С СКВ в большинстве случаев вы будете вести обычный образ жизни с оговоркой бережного отношения к себе, контроля анализов и постоянного приема препаратов. Но это тогда, когда заболевание будет смирным на правильно подобранной терапии. А в дебюте, когда лечение только подбирается, болезнь активничает и может вести себя непредсказуемо, в первый год, надо держать руку на пульсе.
Екатерина, спасибо еще раз! Теперь кажется понимаю, что Вы имели ввиду. Какие еще анализы Вы бы посоветовали сдать? и какие обследования дополнительные нужно пройти?

Раз в месяц анализ мочи и крови, биохимия с почечными и печеночные и пробами. Это в первые полгода. Потом надо разбираться. Дополнительные обследования по показаниям, у каждого свои. Как у вас, не могу сказать сейчас вроде кроме афс ничего дополнительно не надо. Снимок лёгких и УЗИ сердца , УЗИ органов брюшной полости вам должны были сделать.
Екатерина, спасибо! Я так понимаю АлАТ и АсАТ это и есть печеночные пробы? Сдавала эти анализы.
Результаты анализа крови:
АлАТ - 13 (при норме до 31)
АсАТ - 25 (при норме до 31)
Билирубин общ - 14 (при норме 3,4-20,5)
глюкоза - 5,5 (норма 4,1-5,9)
Креатинин - 64 (норма 50-98)
Мочевина - 3,7 (норма 2,1-7,1)
Мочевая кислота - 251 (норма 150-350)
Холестерин - 3,63 (норма 3,63 - 6,27)
Фосфатаза щелочная - 49 (норма 40-150)
Кальций - 2,6 (норма 2,10-2,55)
Магний - 0,78 (норма 0,66-1,07)
Фосфор неорг. - 0,79 (норма 0,74 - 1,52)
АСЛ-О - 70 (норма до 200)
Общий белок - 86 (норма 64-83)
С-реактивный белок - 0,7 (норма до 5,0)
Ревматоидный фактор - 242,4 (норма до 30)
АЦЦП - 1 (норма до 5)
Флюорографию делала - Без видимых R-признаков патологических изменений.
ЭхоКГ - Незначительное уплотнение стенок аорты. Сократительная функция левого желудочка удовлетворительная. Камеры сердца не увеличены. Дополнительная хорда в левом желудочке.
ФГДС: Умеренно выраженный катаральный рефлюкс-эзофагит.
Атрофический гастрит.
УЗИ ОБП и почек:
Негрубые диффузные изменения поджелудочной железы. Эхопризнаки удвоения правой почки и ее опущение без нарушения оттока.
На сервисе СпросиВрача доступна консультация ревматолога онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!


Оак .оам.
Поподробнее опишите какие именно суставы.когда больше меньше болят их внешний вид( отечность краснота местная температура)
Наличие сопут заболеваний аллергии если есть
Маргуба, дебют был в июне 2018г. после прививки от энцефалита. симптомов очень много было,я думала что просто простуда. началось с боли в горле,с последующими болями в мышцах,болели затылочные мышцы, шеи,плеч,верхней части спины,потом присоединились остальные мышцы,боли были такие сильные что уже с трудом двигалась. Суставы на руках отекли,пальцы и скованность была,иногда на ногах мелкие. боли блуждали. температура на тот период была выше 38 практически сутками на протяжении мес,сбивалась на пару часов и снова. Ломило все тело.К врачу не сразу обратищалась,лечилась сама антибиотками и вирусными,ничего не помогало. в больнице уже провели пульс терапию и посадили на гормоны. но боли в мышцах в верхней части (спины,шей,руках) бывают,и ноющие боли в мелких суставах сохраняются. Была лейкопения,анемия, СОЭ до 60,каких-то внешних признаков нет,кроме выпадения волос и небольшой пигментации на лице. Сейчас общий анализ крови в пределах нормы,иногда падают лейкоциты и держится незначительная анемия


Антитела и не обязаны снижаться, они говорят только о верно поставленном диагнозе и нужны для первичной диагностики. Сдавать повторно их абсолютно не нужно. Качество лечения оценивается не по антителам. По самочувствию, общему анализу крови и мочи, биохимическому анализу крови с почечными показателями, СРБ. Лечение у вас правильное, если на нем нет жалоб, ничего менять не надо.
Читайте также:

