Путь от дисбактериоза к бронхиальной астме
Обновлено: 23.04.2024
В предлагаемом обзоре обобщены последние достижения в области изучения респираторной микробиоты, взаимосвязи микробиома верхних дыхательных путей и легкого, обсуждения возможных механизмов влияния микробиома на астму и аллергию. Идентификация не только па
The role of the respiratory tract microbiome in respiratory health N. G. Astafieva, D. Yu. Kobzev, I. V. Gamova, I. A. Perfilova, E. N. Udovichenko, L. V. Skuchaeva, I. E. Michailova
The proposed review summarizes recent advances in the study of respiratory microbiota, the relationship between the upper respiratory tract microbiome and the lung, and a discussion of the possible mechanisms of influence of the microbiome on asthma and allergies. Identifying not only pathogenic bacteria, but also commensals in the respiratory tract and gastrointestinal tract (Gut- Lung axis) is an innovative approach to finding out their role in the development of inflammation and modulation of the immune response in respiratory allergies.
Легочный микробиом и астма
Астма является наиболее распространенной респираторной хронической патологией в любой возрастной группе. Точные механизмы, которые приводят к различным клиническим фенотипам и эндотипам и присущим специфическим воспалительным процессам при астме, по-прежнему в значительной степени неизвестны. Несмотря на это, в свете современных публикаций можно думать о том, что барьерная функция слизистой оболочки носа и микробиота носа являются ключевыми элементами, связывающими респираторный дисбиоз с клеточными и молекулярными процессами, которые приводят к воспалению и поддерживают его. Повышенная проницаемость слизистой оболочки может, в свою очередь, способствовать перемещению бактерий в подслизистый слой, где происходит встреча антигена с соответствующими иммунными клетками и его распознавание, с последующим запуском локальных или системных реакций.
У здоровых людей микробиота легкого детерминируется в основном балансом иммиграции и элиминации с относительно небольшим вкладом от дифференциального коэффициента воспроизводства микробного сообщества [36].
Основными маршрутами микробной иммиграции в легкие являются микроаспирация, вдыхание воздуха и прямая дисперсия вдоль поверхностей слизистой оболочки. Из них микроаспирация, вероятно, является доминирующим маршрутом иммиграции.
Исследования микробиомов носа, полости рта, легкого и желудка у индивидуумов иллюстрируют микробиологическую непрерывность аэродигестивного тракта у здоровых взрослых, что обосновывает микробиологическую поддержку концепции о распространенности микроаспирации у здоровых людей [37, 38]. Таким образом, даже в норме постоянно наблюдается бактериальная контаминация нижних дыхательных путей. Очищение дыхательных путей происходит за счет мукоцилиарного клиренса, кашля. Известно, что при отсутствии инфекции здоровые люди кашляют примерно один раз в час, стимулируя продвижение бактерий в глотку, где они либо проглатываются, либо отхаркиваются.
Элиминация микроорганизмов (кроме кашля и мукоцилиарного клиренса) осуществляется разнообразным арсеналом врожденной и адаптивной иммунной защиты, который избирательно распознает некоторые микроорганизмы, вызывая их гибель или тормозя размножение. Доказано, что содержание иммунных клеток в легких связано с особенностями микробиоты [39].
В отличие от других систем дыхательные пути имеют гомогенную микробиоту, которая уменьшается в биомассе от верхних отделов к нижним. Здоровое легкое не имеет обособленного микробиома, но вместо этого содержит низкие уровни бактериальных сиквенсов, которые в значительной степени неотличимы от верхней дыхательной флоры [33].
Стремительное накопление информации о микробиоме дыхательных путей из-за выраженной гетерогенности исследований не позволяет сформулировать единую четкую концепцию роли микробиома при астме, поскольку микробиом может быть как фактором риска развития астмы, так защиты от нее. Патогенез астмы разнообразен и включает экспозицию аллергенов, другие экспосомы, факторы окружающей среды, взаимодействующие с генетикой во время беременности и в первые годы жизни. Микробный дисбиоз в дыхательных путях все чаще ассоциируется с частотой и тяжестью астмы. Более точному эндотипированию пациентов с астмой может помочь дальнейший анализ состава и метаболической активности индивидуального микробиома. При разных фенотипах астмы наблюдаются отличия в формировании бактериальной колонизации дыхательных путей определенным спектром бактерий, которые можно трактовать как возможности микробиома, определять время дебюта и тяжесть астмы, чувствительность к глюкокортикостероидам (ГКС) и макролидам, коморбидностям [40].
При нейтрофильном Th17-ответе наблюдается преобладание Proteobacteria, принадлежащих к семействам Pasteurellaceae, Enterobacteriaceae и Bacillaceae [41].
Дыхательные пути пациентов с устойчивостью к ГКС и тяжелым течением заболевания колонизируются Moraxella сatarrhalis, Haemophilus или Streptococcus [42, 43].
У пациентов с ГКС-резистентной астмой в составе микробиома преобладали Neisseria, виды Haemophilus, виды Campylobacter и Leptotrichia, которые отсутствовали у пациентов с астмой, чувствительной к ГКС [44].
Использование ГКС, особенно сочетание ингаляционных и пероральных, связано с увеличением численности Proteobacteria и рода Pseudomonas и уменьшением численности видов Bacteroides, Fusobacteria и Prevotella [45].
Лечение ингаляционными глюкокортикостероидами было связано с изменениями профиля цитокинов и воспалительного ответа дыхательных путей на микробиоту. При атопической астме характер воспаления коррелировал с составом микробиоты и серьезностью обструкции дыхательных путей. У пациентов с тяжелой бронхиальной астмой наблюдались снижение концентрации ИЛ-2 и ИЛ-10, высокие концентрации ФНО-α и MIP-1β, колонизация Actinomyces, Neisseria menigiditis и Streptococcus pneumoniae.
У пациентов с более легкими вариантами бронхиальной астмы были значительно снижены концентрации ИФН-γ, ИЛ-17F и G-CSF, повышен ИЛ-2, отмечена колонизация видами Enterococcus. После терапии ингаляционными ГКС в течение 6 недель отмечалась положительная динамика в отношении бронхиальной обструкции, выявлено значительное увеличение видового разнообразия в фенотипах с выраженной и умеренной обструкцией — снижение численности патогенных видов, улучшение качественного состава микробиома [46].
Последние несколько лет привели к ключевым исследованиям, которые позволили четко связать изменения в микробиоме с повышенным риском развития астмы и аллергии. В рамках существующей концепции иммунной солидарности слизистых не только микробиом дыхательных путей несет ответственность за развитие воспаления, но и кишечный микробиом влияет на анатомически удаленные слизистые и иммунную систему в целом. Ассоциации между кишечной и респираторной микробиотой, называемые кишечно-легочной осью, играют центральную роль в динамических изменениях, происходящих при астме и аллергии [47].
Микробиота кишечника питается и созревает в кишечном эпителии и участвует в иммунитете. Основная роль микробиоты легкого — ориентация и баланс аспектов иммунной и эпителиальной реакции [37].
Перенос акцента на роль эпителия нацеливает исследователей и клиницистов обращать большее внимание на защиту уязвимых дыхательных путей от воздействия окружающей среды и восстановление дефектных функций эпителия, а не только на подавление воспаления дыхательных путей или модуляции иммунного ответа [49].
Эпителиальное/мезенхимальное взаимодействие через экспрессию эпителиальных генов периостина (POSTN), регулятора хлористых каналов 1 (CLCA1) и ингибитора серпин-пептидазы B2 (SERPINB2) специфическим образом изменяется при астме и ассоциируется с ИЛ-13-связанным воспалением дыхательных путей [50]. ИЛ-13 продуцируется Т-хелперами (Th2), а также клетками врожденного иммунитета (Innate Lymphoid Cells, ILC2) [51].
Врожденные лимфоидные клетки
ВЛК имеют общего предшественника, охарактеризованного как клетка, экспрессирующая транскрипторный фактор — ингибитор ДНК-связывающего белка (inhibitor of DNA binding 2, ID2).
ВЛК1 специализируются на ИФН-γ и ФНО-α (защищают слизистую от внутриклеточных паразитов и вирусов); ВЛК2 синтезируют ИЛ-4, ИЛ-5, ИЛ-9 и ИЛ-13 (защита слизистой от многоклеточных паразитов, участие в астме и аллергии); ВЛК3 — преимущественно ФНО-α, интерлейкин-17α и ИЛ-22 (быстро отвечают на инфекцию грибами и внеклеточными бактериями) [54].
Изменение иммунного ответа под влиянием микробиоты может иметь контактный и дистанционный механизм через Т-регуляторные клетки (Treg), рецепторы врожденного иммунитета (TLR), метаболиты и т. д. [40]. Кишечные бактерии могут модулировать иммунный ответ, непосредственно воздействуя на Tregs через TLR. Комменсальная микробиота способствует дифференцировке индуцированных Tregs (iTreg) из наивных CD4+ T-клеток с помощью независимого механизма первичного ответа TLR и миелоидной дифференцировки TLR и MyD88. Короткоцепочечные жирные кислоты (КЦЖК, или Short-chain fatty acids, SCFA) действуют на Т-клетки через рецептор, связанный с G-белком (GPR43), и защищают макроорганизм от воспаления слизистой кишечника путем увеличения Treg. КЦЖК также способствуют генерации клеток Treg кишечника из наивных CD4+ T-клеток с помощью собственных эпигенетических механизмов Т-клеток. Диета с высоким содержанием клетчатки защищает дыхательные пути от аллергического воспаления, изменяя состав биоты, что приводит к увеличению SCFA. Резидентная микробиота может способствовать развитию Th17-зависимого типа воспаления (показано на мышиной модели астмы, вызванной овальбумином).
Перспективы развития вмешательств при астме и аллергии на основе коррекции микробиоты
Является ли гипотеза использования пробиотиков при астме и аллергии перспективным направлением? Лейтмотивом исследований с пробиотиками являются доказательства их влияния на иммуномодуляцию. Есть доказательства эффективности пробиотиков in vitro, на животных моделях [56], но индустрия клинических исследований сегодня не успевает за индустрией пробиотиков.
Из-за значительной неоднородности в дизайне исследований, размеров выборки, возраста сбора образцов для изучения микробиоты, методах анализа кишечного микробиома и географического положения в настоящее время нет положительных рекомендаций от научных обществ по использованию пре- или пробиотиков для лечения пищевой аллергии, других аллергических проявлений. Исследования в этой области продолжаются, и некоторые из них показывают возможные преимущества ПБ, которые, по-видимому, практически не имеют риска. Хотя эти исследования предполагают, что использование ПБ может быть многообещающим для профилактики или лечения аллергии, необходимы дополнительные доказательства для определения его эффективности, оптимальной дозировки и штаммов, необходимых для лечения [57].
Cовременные данные не подтверждают пользы рутинного использования ПБ в качестве вмешательства для предотвращения любой формы аллергического заболевания, за исключением группы детей с высоким риском экземы — в соответствии с рекомендацией Всемирной организации по аллергии (World Allergy Organization, WAO) [58].
Оптимальные штаммы, дозы, сроки и продолжительность введения ПБ остаются неизвестными. Тем не менее исследования в этой области продолжаются и позволяют надеяться, что можно прийти к лучшему пониманию роли про-, пре- и синбиотиков в профилактике или лечении аллергии и астмы.
Заключение
В ходе реализации крупных проектов, связанных с микробиомом человека (HMP), произошло радикальное изменение представлений о сложных взаимодействиях организма человека и микрофлоры (микробиоты).
Иммунная система слизистых находится в постоянной связи с огромным разнообразием микробов, присутствующих в организме человека. Открытие новых молекулярных механизмов, обеспечивающих связь между хозяином и микробами, дает нам ключ к пониманию роли микробиома в сохранении респираторного здоровья.
Литература
Н. Г. Астафьева* , 1 , доктор медицинских наук, профессор
Д. Ю. Кобзев**, доктор медицинских наук, профессор
И. В. Гамова*, кандидат медицинских наук
И. А. Перфилова*, кандидат медицинских наук
Е. Н. Удовиченко*, кандидат медицинских наук
Л. В. Скучаева*, кандидат медицинских наук
И. Э. Михайлова*
* ФГБОУ ВО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
** Лидс Тринити университет, Лидс, Великобритания
Антибактериальная терапия при бронхите, бронхиальной астме.
Назначение антибактериальной терапии, как правило, показано при обострении хронического бронхита. Верификация инфекционного воспаления достигается тщательным клиническим обследованием больных, цитологическим и бактериологическим исследованием мокроты, а также определением уровня специфических антител к микроорганизмам в сыворотке крови. Ориентировочное представление о характере возбудителя можно получить при окраске мазков мокроты по Граму. Более точная идентификация возможна при ее бактериологическом исследовании. Диагностически значимым является выделение из мокроты микрофлоры в количестве 106 микробных тел и более, грибов - 102 и более в 1 мл. Выбор антибактериального препарата зависит как от чувствительности микроорганизма, так и от особенностей больного. Чрезвычайно важное значение имеет хорошо собранный аллергологический анамнез с указанием непереносимых пациентом лекарственных препаратов и вида побочных реакций. При непереносимости лекарственных средств важно учитывать возможные перекрестные реакции на другие соединения.
В случае нерезко выраженного обострения можно использовать пероральные препараты; при тяжелом состоянии больных, а также при наличии у них сопутствующих заболеваний пищеварительной системы показано парентеральное введение этих средств. В случае гнойного бронхита целесообразно выполнение санационных бронхоскопий.
Назначаемые больным антибиотики должны удовлетворять следующим требованиям:
1. Иметь широкий спектр действия и быть активными в отношении Streptococcus pneumoniae, Hemophilus influenzae и Moraxella catarrhalis.
2. Накапливаться в трахеобронхиальном секрете.
3. Обладать низкой токсичностью.
Наиболие высокой эффективностью при обострениях хронического обструктивного бронхита обладают антибиотики из группы пенициллина, макролиды, тетрациклины и комбинированные препараты (аугмен-тин). В качестве препаратов резерва могут рассматриваться цефалоспо-рины и фторхинолоны. Продолжительность курса лечения, как правило, составляет 7-14 дней.

Антибактериальная терапия не является обязательным компонентом лечения больных БА. Однако ее использование не противоречит положениям, сформулированным в международных согласительных документах.
Назначение антибактериальных средств при астме показано только в случаях убедительного доказательства инфекционного воспаления органов дыхания (см. выше). Продолжительность курса лечения обычно не превышает 5-7 дней. Важно помнить, что длительная и необоснованная терапия антибиотиками может вызывать развитие лекарственной сенсибилизации и ухудшать течение астмы. Следует подчеркнуть, что больным БА противопоказаны антибиотики из группы пенициллина из-за их высокой аллергизирующей активности. В процессе лечения важно следить за количеством эозинофилов в крови и мокроте. Его нарастание должно быть поводом для отмены препарата.
Как правило, необходимость назначения антимикробных средств возникает в следующих клинических ситуациях:
1. При обострении инфекционно-зависимой БА, развившемся на фоне острой пневмонии или обострения хронического бронхита.
2. В случае сочетания астмы с активными очагами инфекции в ЛОР-органах.
3. У больных гормонозависимой БА, осложненной кандидозом верхних дыхательных путей.
Наиболее часто в клинической практике используются макролиды, линкомицин, клиндамицин и цефалоспорины.
В последние годы показано, что макролиды (эритромицин, рокситромицин) помимо антибактериального действия оказывают противовоспалительный эффект и снижают неспецифическую гиперреактивность бронхов у больных БА. Установлено, что они уменьшают продукцию свободных радикалов и секрецию "воспалительных" цитокинов (IL 3, 4, 5, TNFa) Т-лимфоцитами и моноцитами крови и легких.
При использовании антибактериальных средств следует помнить, что эритромицин, линкомицин, фторхинолоны (ципрофлоксацин, пефлоксацин, норфлоксацин) замедляют печеночный клиренс теофиллина. Поэтому в случае их совместного применения доза последнего должна быть уменьшена.
Из противогрибковых средств наиболее часто используются леворин, нистатин, кетоконазол (низорал) и флуконазол (дифлюкан).
- Вернуться в оглавление раздела "Пульмонология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Можно ли вылечить астму? Как полноценно жить с астмой?
К сожалению, мы начинаем ценить что-то только тогда, когда возникает беспокойство, что его можем скоро потерять. Так и с дыханием. Вдох-выдох, вдох-выдох …. Это процесс нам кажется так естественным, что мы не обращаем внимания на него до тех пор, пока не ощущаем затруднения в дыхании.
В норме по продолжительности вдох должен быть равен выдоху, если же в дыхательных путях имеется воспаление, бронхи резко сужаются, и человек не может сделать полноценный выдох. Такой симптом уже может быть сигналом начала бронхиальной астмы - хронического воспаления бронхов. Однако ставить себе этот диагноз самостоятельно нельзя, даже врач не может быть в этом уверенным без проведения спирографии, клинического анализа крови и мокроты.
По официальной статистике в нашей стране больных бронхиальной астмой насчитывается около 1,5 миллионов человек, но как показали результаты недавних исследований на самом деле их число в 7 раз больше. В проведении исследования участвовали пациенты, которые проходили в своей поликлинике различные обследования по поводу наличия одышки, затрудненного дыхания и мучительного кашля. У каждого 4-го имелись симптомы астмы, но в амбулаторной карте такой диагноз стоял менее чем у 7% обследованных.
Диагноз "бронхиальная астма" у нас ставят слишком поздно, когда болезнь уже "набрала обороты". Причина этого вовсе ни в том, что больные астмой должны получать льготные лекарства, а в том, что во многих поликлиниках в настоящее время нет пульмонологов и аллергологов, а терапевты чаще всего пациентам, которые жалуются на одышку, свистящее дыхание и кашель, ставят диагноз "обструктивный бронхит".
И проблема здесь не только в квалификации участкового терапевта, а в отсутствии стимула. Ведь сегодня врачи этой специальности настолько загружены писаниной, беготней по вызовам и приемом больных, на прием каждого из которых им отводится не более 15 минут, что у них просто не остается времени думать об эффективности лечения. Да и размер зарплаты у них этому никак не способствует…

Мы сами тоже относимся не очень внимательно к своему здоровью, отсюда и многие проблемы. Бронхиальная астма не всегда начинается с приступов удушья, в начале развития болезни могут беспокоить только одышка, кашель, чувство заложенности в горле и свистящее дыхание. Большинство из нас не придает значения этим симптомам и идет к врачу только тогда, когда возникают резкие проявления удушья.
Принято различать три вида астмы: атопическая, инфекционно-аллергическая и лекарственная. Самой распространенной является атопическая астма, вызванная реакцией организма на аллергены. Инфекционно-аллергическая астма развивается на фоне хронической инфекции в дыхательных путях. Это может быть осложнения после бронхита, синусита и тонзиллита. Лекарственная астма возникает после длительного употребления определенных препаратов. Например, аспирина или нестероидных противовоспалительных средств.
Поэтому прежде чем назначить лечение, врач должен выявить первопричину развития астмы и поставить правильный диагноз, и только потом порекомендовать избегать контакта с аллергенами, пролечить инфекцию дыхательных путей или прекратить прием препаратов, способствующих возникновению кашля и приступов удушья.
При атопической астме обязательно нужно делать специальный анализ крови на выявление чувствительности организма к "попавшим под подозрение" аллергенам. Диагностика астмы по анализу крови - один из самых достоверных способов. Если в крови определяются повышение уровня иммуноглобулина Е (IgE) или иммуноглобулина G (IgG), то первый показатель указывает на наличие аллергической реакции, а второй - на непереносимость определенного пищевого аллергена.
Бронхиальная астма - болезнь неизлечимая, но управляемая. Это значит, астму вылечить нельзя, но человек больной астмой может жить полноценно и долго, если будет держать болезнь в узде. Для этого он должен каждый день контролировать свое состояние, принимать лекарства, назначенные врачом и вести обычный образ жизни. В этом случае больные астмой могут даже заниматься спортом, их жизнь ничем не будет отличаться от жизни здоровых людей.
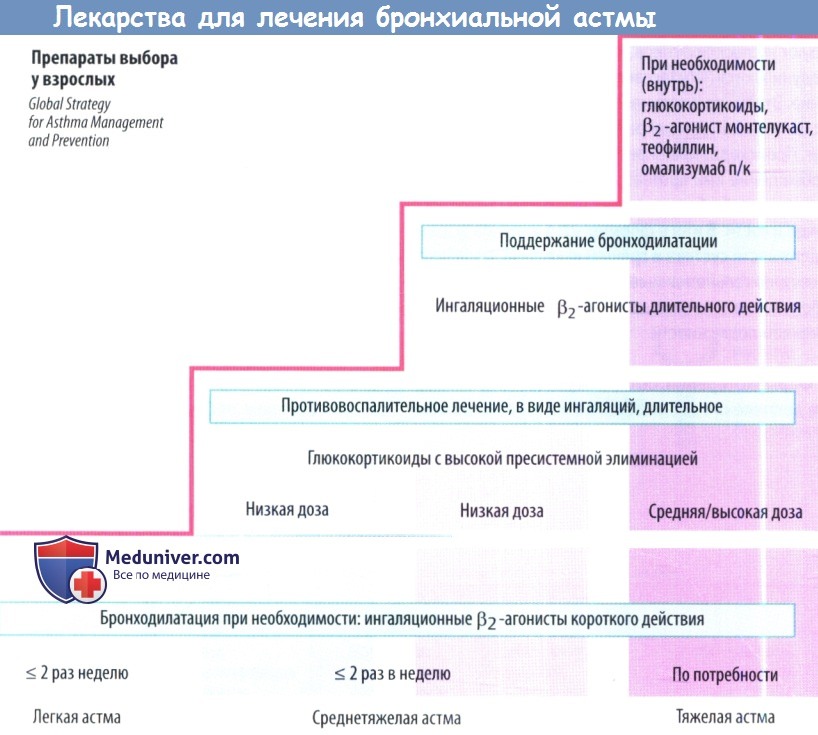
Главное в лечении астмы - не купирование приступов удушья, а их профилактика. Правильное лечение астмы состоит из 3-х схем:
1. Начальный этап развития астмы. Симптомы болезни проявляются не чаще 2-х раз в неделю, а ночные приступы случаются примерно 1 раз в месяц. Для лечения назначаются противовоспалительные негормональные препараты, стабилизирующие мембрану тучных клеток, "запускающих аллергический процесс". На этой стадии болезни нельзя злоупотреблять бронхорасширяющими средствами, такими как эуфиллин и теофиллин.
2. Средняя степень развития астмы. Кашель, одышка и выделение прозрачной мокроты из дыхательных путей уже наблюдается каждый день, а примерно 1 раз в неделю случается и приступы удушья. На этом этапе развития астмы уже необходимо пользоваться и глюкокортикостероидами - ингаляционными гормонами и препаратами группы бета-агонистов. Они улучшают работу легких, расширяют бронхи и снимают одышку.
3. Тяжелая степень развития астмы. Уже наблюдаются частые приступы удушья в ночное время. На этом этапе необходимо добавлять к описанной выше терапии астмы прием глюкокортикостероидов в таблетках, обычно один раз в день.
Чем эффективнее будет проводиться лечение противовоспалительными средствами на начальном этапе развития астмы, тем выше шанс вести полноценный образ жизни и реже будет возникать потребность в ингаляционных гормонах и бронхорасширяющих препаратах. Поэтому и важно начать лечение астмы при появлении первых симптомов.
Дополнением ко всем 3-м схемам лечения должно стать постоянный контроль за состоянием своего здоровья - измерение скорости вдоха и выдоха с помощью пикфлоуметра, ведение дневника приема лекарственных средств и реакции на них.
Представлены результаты обследования 92 больных бронхиальной астмой в стадии обострения, находившихся на стационарном лечении в клинике. В результате клинико-инструментального обследования установлено, что у 73,9 % больных бронхиальной астмой имеется сопутствующая патология верхних отделов пищеварительного тракта. У пациентов с сочетанной патологией пищеварительного тракта имеет место снижение функции Т- и В-звеньев иммунитета, что свидетельствует о нарушении индуктивной и эффекторной фаз иммунного ответа. При изучении кишечной микрофлоры больных бронхиальной астмой, имеющих сочетанное поражение органов пищеварительного тракта, в 58,7 % наблюдений обнаружены дисбиотические сдвиги различной степени выраженности.

Бронхиальная астма (БА) является серьезной медицинской проблемой, многие аспекты которой далеки от своего разрешения. Распространение астмы растет как в России, так и за рубежом [1,2]. Не менее 300 млн населения планеты в настоящее время страдают от астмы, а еще 100 млн, согласно прогнозу специалистов, астма настигнет к 2025 г. [3,4]. На астму приходится 1 из 250 летальных исходов во всем мире [5]. Отмечается, что БА, сочетающаяся с заболеваниями желудочно-кишечного тракта (ЖКТ), протекает более тяжело. Патология желудочно-кишечного тракта при БА встречается весьма часто [1]. Особый интерес представляет патологический гастроэзофагеальный рефлюкс (ГЭР), рассматриваемый в качестве триггера приступов астмы, преимущественно в ночной период.
В настоящее время ни у кого не вызывает сомнения, что морфологической основой БА является аллергическое воспаление бронхов. В его развитии существенную роль играют нарушения функций местной системы иммунитета, представленной лимфоидной тканью, ассоциированной со слизистыми оболочками (MALT - mucosa-associated lymphoid tissue). Это относительно автономный орган иммунной системы, причем эволюционно он формируется прежде всего в ЖКТ и раньше, чем другие органы, как центральные, так и периферические, не связанные с кишечником. Центральные органы иммунной системы в онтогенезе формируются из кишечной ткани, в частности, из глоточных карманов. Пейеровы бляшки тонкой кишки являются важнейшими поставщиками Т- и В-лимфоцитов для лимфоидных образований всех слизистых оболочек и эндокринных органов [8]. В связи с этим понятен интерес исследователей к состоянию слизистой оболочки кишечника у больных БА и к особенностям течения БА у больных, имеющих различные воспалительные заболевания желудочно-кишечного тракта. По мнению B. Wallaert et al. [6], имеются доказательства диффузного вовлечения MALT у больных БА, поскольку у них найдены субклинические воспалительные изменения слизистой ЖКТ.
Таким образом, несомненна связь между воспалительным процессом в слизистой бронхов и желудочно-кишечного тракта. С одной стороны, различные аллергены, попадая в кишечник и имея своей мишенью, как и в бронхах, эпителий, могут вызывать развитие аллергического воспаления в эпителиальных тканях пищеварительной системы. Развитию патологического процесса в дыхательных путях могут способствовать и изменения иммунной системы (нарушение соотношения Т- и В-лимфоцитов, дефицит ряда компонентов комплемента, повышение уровня IgG, M, A и др.), выявленные некоторыми авторами у пациентов с H. Pylori-ассоциированной патологией [8].
Целью нашего исследования явилось изучение распространенности патологии желудочно-кишечного тракта среди больных бронхиальной астмой средней степени тяжести и изучение состояния кишечного биоценоза у больных БА.
Материал и методы исследования
Результаты и их обсуждение
Результаты проведенного нами исследования указывают на наличие взаимосвязи между развитием БА и патологии ЖКТ. Применение различных методов обследования пациентов с БА выявило следующую распространенность патологии ЖКТ в этой группе больных.
Анамнестически: указания на перенесенные ранее или имеющиеся хронический гастрит, дуоденит, язвенную болезнь желудка и двенадцатиперстной кишки, хронический холецистит и панкреатит отметили 55 пациентов БА(59,8%).
При рентгенэндоскопическом обследовании больных БА: поверхностный гастрит, гастродуоденит выявлен у 19 человек (20,7%), эрозии двенадцатиперстной кишки - у 6 (6,5%), дуодено-гастральный рефлюкс - у 20 (21,8%), атрофический гастрит - у 8 (8,9%), дискинезия желчевыводящих путей - у 10 (10,9%) пациентов с БА.
Состояние основных звеньев иммунитета у больных бронхиальной астмой
Читайте также:

