Пути передачи гельминтозов тест
Обновлено: 23.04.2024
Определение специфических антител к гельминтам Opistorchis, Toxocara, Trichinella и Echinococcus, используемое для скрининга паразитических заболеваний человека.
Синонимы русские
Скрининговое обследование на возбудителей описторхоза, токсокароза, трихинеллеза и эхинококкоза.
Синонимы английские
Gastrointestinal parasites screening test;
Screening for Opisthorchiasis, Toxocariasis, Trichinosis, and Echinococcosis.
Метод исследования
Иммуноферментный анализ (ИФА)
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Opistorchis, Toxocara, Trichinella и Echinococcus – это паразитические черви, являющиеся возбудителями гельминтозов. Описторхоз возникает при попадании в организм плоских червей рода Opistorchis при употреблении зараженной речной рыбы. При этом заболевании преимущественно поражаются желчевыводящие пути и протоки поджелудочной железы. Возбудителями токсокароза являются круглые черви рода Toxocara. При токсокарозе могут вовлекаться самые разнообразные органы, в том числе легкие, глаза, головной мозг и кишечник. Трихинеллез возникает при употреблении мяса, содержащего цисты круглых червей рода Trichinella, и протекает с преимущественным поражением скелетной мускулатуры. Возбудителями эхинококкоза являются ленточные черви Echinococcus granulosus. При этом заболевании может поражаться практически любой орган, в том числе головной мозг, костная ткань, печень, глаза. В этой группе гельминтозов наиболее часто в России встречается описторхоз.
Несмотря на наличие особенностей течения разных гельминтозов, дифференциальная диагностика этой группы заболеваний не может быть осуществлена на основании клинической картины. Кроме того, часто гельминтозы протекают в стертой форме или бессимптомно. Поэтому в основе скрининга гельминтозов лежит лабораторное обследование. Скринингу этой группы гельминтозов подлежат пациенты с наличием в анамнезе указаний на употребление в пищу сырой речной рыбы (описторхоз), сырого мяса (трихинеллёз), а также контактирующие по роду деятельности с зараженными животными, почвой и водой (ветеринары, работники коммунальных служб, садоводы – токсокароз и эхинококкоз). Для идентификации возбудителей используют разные методы, в том числе микроскопический анализ кала на наличие яиц паразитов, микроскопический анализ аспирата дуоденального содержимого и мокроты на наличие личиночных форм, методы молекулярной диагностики, а также серологические тесты. Одним из наиболее точных методов диагностики гельминтозов является иммуноферментный анализ (ИФА), позволяющий определять специфические антитела к разным возбудителям.
Метод ИФА имеет несколько преимуществ по сравнению с анализом кала. С помощью анализа кала паразитов удается выявить только при достаточном их количестве. Напротив, если инфекция носит ограниченный характер, можно получить ложноотрицательный результат. С другой стороны, если гельминтоз протекает тяжело и сопровождается поражением и обструкцией желчевыводящих путей, яйца или личинки паразита могут вовсе не попадать в кишечник и поэтому не определяться в кале. Метод ИФА основан на определении в крови специфических антител к паразитам, что обуславливает его более высокую по сравнению с микроскопией кала чувствительность, которая составляет 91-92 %.
Следует отметить некоторые ограничения метода ИФА. Так, положительный результат исследования не позволяет дифференцировать текущую инфекцию и инфекцию в прошлом. По этой причине исследование не предназначено для оценки эффективности проведенного лечения. Также исследование не позволяет уточнить локализацию процесса. Результат исследования антител к эхинококку будет положительным как при изолированном поражении печени, так и при диссеминированном эхинококкозе. Следует помнить, что титр антител не всегда отражает объем поражения.
Специфичность исследования несколько уступает его чувствительности. Из-за наличия сходств в антигенной структуре этих и других гельминтов иногда могут наблюдаться ложноположительные реакции. По этой причине интерпретацию результата следует производить с учетом дополнительных клинических и лабораторных данных, в том числе результата микроскопии кала.
Так как в исследовании определяют уровень антител, результат анализа в значительной степени зависит от состояния иммунной системы организма. При наличии у пациента иммуносупрессии (ВИЧ-инфекция, прием глюкокортикоидов и других иммуносупрессантов, старческий возраст) возможен ложноотрицательный результат. Следует помнить, что иммуноглобулины класса IgG могут быть определены через 2-4 недели от начала инфекции.
Для этой группы гельминтозов характерна эозинофилия, типичная для всех инвазивных гельминтозов. Также при длительно текущей инфекции могут наблюдаться нарушения показателей общеклинических тестов (признаки мальабсорбции, анемия), поэтому при обследовании пациента с подозрением на гельминтозы из этой группы проводят дополнительные лабораторные тесты.
Для чего используется исследование?
- Для скрининга описторхоза, токсокароза, трихинеллёза и эхинококкоза.
Когда назначается исследование?
- При обследовании пациентов с указанием на употребление в пищу сырой речной рыбы (описторхоз), сырого мяса (трихинеллёз), а также контактирующих по роду деятельности с зараженными животными, почвой и водой (ветеринары, работники коммунальных служб, садоводы – токсокароз и эхинококкоз);
- при оформлении ребенка в детский сад, лагерь, бассейн, при госпитализации;
- при устройстве на работу декретированных групп населения.
Что означают результаты?
Референсные значения: отрицательно.
- описторхоз, токсокароз, трихинеллёз или эхинококкоз, текущая инфекция;
- описторхоз, токсокароз, трихинеллёз или эхинококкоз, инфекция в анамнезе;
- ложноположительный результат (другие гельминтозы).
Что может влиять на результат?
- Состояние иммунной системы организма;
- время, прошедшее с момента заражения.
Важные замечания
- Результат анализа следует оценивать вместе с данными дополнительных анамнестических, лабораторных и инструментальных исследований;
- исследование не позволяет дифференцировать текущую инфекцию и гельминтоз в анамнезе и не предназначено для оценки эффективности лечения;
- исследование не позволяет определить локализацию и объем поражения.
Также рекомендуется
12 Общий анализ крови
6 Анализ кала на цисты простейших
125 Аскаридозы, ДНК [ПЦР] (кал, мокрота)
8 Ascaris lumbricoides, IgG, титр
39 Anisakis, IgG
13 Гистологическое исследование биоптатов органов и тканей (за исключением печени, почек, предстательной железы, лимфатических узлов)
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гельминтоз (глистная инвазия): причины появления, симптомы, диагностика и способы лечения.
Определение
Гельминтозы - болезни человека, животных и растений, вызываемые паразитическими червями (гельминтами).
Причины появления гельминтозов
В настоящее время в России встречается более 70 видов из известных 250 гельминтов, паразитирующих в организме человека. Наиболее распространены круглые черви (аскариды, острицы, трихинеллы, власоглав), ленточные черви (свиной, бычий и карликовый цепни, широкий лентец, эхинококки), сосальщики (печеночная и кошачья двуустки).
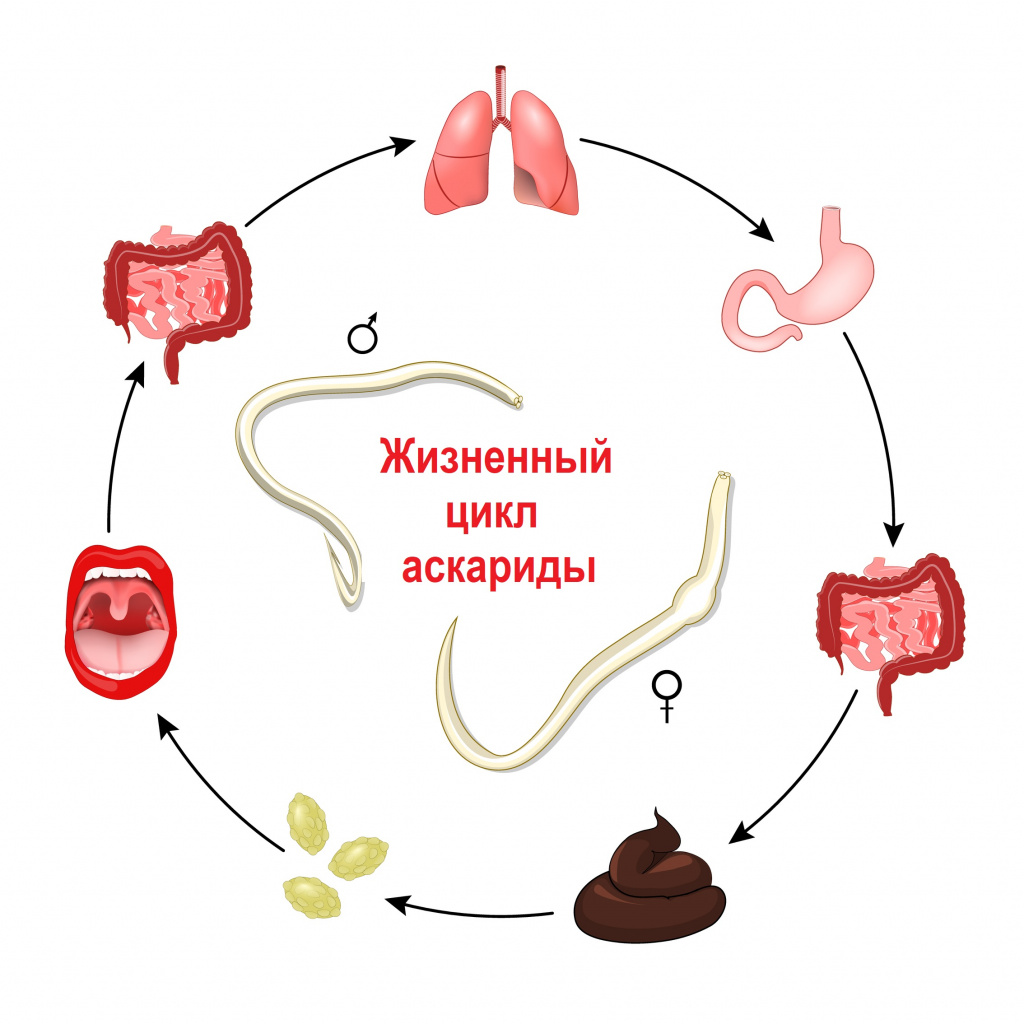
Заражение гельминтами чаще всего происходит после попадания в организм их яиц и/или личинок. В зависимости от механизма заражения и путей передачи гельминтозы подразделяются на: геогельминтозы, биогельминтозы и контактные гельминтозы. Геогельминты развиваются без промежуточных хозяев, биогельминты - с последовательной сменой одного-двух-трех хозяев, контактные гельминты передаются контактным путем.
Свиной цепень, бычий цепень, эхинококк и другие виды червей развиваются с последовательной сменой одного-двух-трех хозяев. Промежуточными хозяевами могут быть рыбы, моллюски, ракообразные, насекомые. Человек заражается этими гельминтами, употребляя в пищу продукты, не прошедшие полноценную термическую обработку:
- мясо говядины, инфицированную финнами (личинками) бычьего цепня;
- свинину, пораженную финнами свиного цепня;
- малосоленую и сырую рыбу с личинками описторхиса или широкого лентеца;
- сырую воду или обработанные этой водой овощи, фрукты.
Контактным путем - то есть при личном контакте здорового человека с зараженным, при пользовании общей посудой, предметами туалета, бельем, при вдыхании пыли в помещении, где находится зараженный человек - передаются энтеробиоз (возбудитель – острица) и гименолепидоз (возбудитель – карликовый цепень). В случае энтеробиоза часто случается самозаражение.
Гельминты определенного вида паразитируют в определенных органах, вызывая различные гельминтозы:
- в толстой кишке - свиной, бычий, карликовый цепни, нематоды (анкилостомы, аскариды, стронгилоиды), острицы, власоглав. Из просвета кишки личинки свиного цепня могут попадать в кровоток и распространяться по организму, оседая в жировой клетчатке, сосудах мышц, камерах глаза, мозге;
- в печени и желчных путях - трематоды (описторхис, клонорхис, фасциола). В печени первично располагаются эхинококковые кисты, а после их разрыва дочерние пузыри можно обнаружить в брыжейке, листках брюшины, селезенке и других органах;
- в органах дыхания - эхинококки, альвеококки, легочные сосальщики, вызывающие парагонимоз;
- в нервной системе - шистосомозы, парагонимоз, эхинококкоз и альвеококкоз;
- в органах зрения - онкоцеркоз, лоаоз, осложненные формы тениоза;
- в органах кровообращения - некатороз, шистосомозы, дифиллоботриоз;
- в лимфатической системе - филяриатозы, трихинеллез;
- в коже и подкожной клетчатке - анкилостомидоз, онкоцеркоз, лоаоз, личиночная стадия шистосомозов;
- в костной системе - эхинококкоз;
- в скелетной мускулатуре - трихинеллез, цистицеркоз мышечной ткани.
Срок жизни гельминтов в организме окончательного хозяина может быть различным, зависит от вида паразита и колеблется от нескольких недель (острицы) до нескольких лет (цепни) и десятилетий (фасциолы).
Классификация заболевания
У человека паразитируют черви двух видов:
- Nemathelminthes – круглые черви, класс Nematoda;
- Plathelminthes – плоские черви, которые включают в себя классы
- Cestoidea – ленточных червей,
- Trematoda – класс сосальщиков.
- биогельминтозы;
- геогельминтозы;
- контактные гельминтозы.
На организм человека гельминты оказывают различное воздействие:
- антигенное воздействие, когда развиваются местные и общие аллергические реакции;
- токсическое действие (продукты жизнедеятельности гельминтов вызывают недомогание, слабость, диспепсические явления);
- травмирующее действие (при фиксации паразитов к стенке кишечника происходит нарушение кровоснабжения с некрозом и последующей атрофией слизистой оболочки; могут нарушаться процессы всасывания; механическое сдавление тканей гельминтами);
- вторичное воспаление в результате проникновение бактерий вслед за мигрирующими личинками гельминтов;
- нарушение обменных процессов;
- в результате поглощения крови некоторыми гельминтами возникает анемия;
- нервно-рефлекторное влияние - раздражение гельминтами нервных окончаний провоцирует бронхоспазм, дисфункцию кишечника и т.д.;
- психогенное действие, проявляющееся невротическими состояниями, нарушением сна;
- иммуносупрессивное действие.
Для гельминтозов характерна стадийность развития. Каждая стадия характеризуется своими клиническими симптомами.
Жалобы пациентов в острой стадии:
- повышение температуры от нескольких дней до двух месяцев (субфебрильная или выше 38ºС, сопровождающаяся ознобом, резкой слабостью и потливостью);
- зудящие рецидивирующие высыпания на коже;
- локальные или генерализованные отеки;
- увеличение регионарных лимфатических узлов;
- боли в мышцах и суставах;
- кашель, приступы удушья, боль в грудной клетке, длительные катаральные явления, бронхит, трахеит, симптомы, симулирующие пневмонию, астматический синдром, кровохарканье;
- боль в животе, тошнота, рвота, расстройства стула.
Для кишечных гельминтозов характерны следующие синдромы:
- диспепсический (дискомфорт в животе, чувство переполнения после еды, раннее насыщение, вздутие живота, тошнота);
- болевой;
- астеноневротический (чувство сильной усталости, повышенная нервная возбудимость и раздражительность).
Кишечные цестодозы (тениаринхоз, дифиллоботриоз, гименолепидоз, тениоз и другие) протекают бессимптомно или с малым количеством симптомов (с явлениями диспепсии, болевым синдромом, анемией).
Трематодозы печени (фасциолез, описторхоз, клонорхоз) вызывают:
- хронический панкреатит;
- гепатит;
- холецистохолангит;
- неврологические нарушения.
Мочеполовой шистомоз проявляется появлением в самом конце мочеиспускания крови, частыми позывами к мочеиспусканию, болью во время мочеиспускания.
Альвеококкоз, цистицеркоз, эхинококкоз могут длительное время протекать бессимптомно. На позднем этапе нагноение или разрыв кист, содержащих паразитов, приводит к анафилактическому шоку, перитониту, плевриту и другим тяжелейшим последствиям.
Для заболеваний, обусловленных паразитированием мигрирующих личинок зоогельминтов, когда человек не является естественным хозяином, различают кожную и висцеральную формы. Кожная форма обусловлена проникновением под кожу человека некоторых гельминтов животных: шистосоматид водоплавающих птиц (трематоды), анкилостоматид собак и кошек, стронгилид (нематоды). При контакте человека с почвой или водой личинки гельминтов проникают в кожу. Возникает чувство жжения, покалывания или зуда в месте внедрения гельминта. Может наблюдаться кратковременная лихорадка, признаки общего недомогания. Через 1-2 недели (реже 5-6 недель) наступает выздоровление.
Висцеральная форма развивается в результате заглатывания яиц гельминтов с водой и пищевыми продуктами. В начале заболевания может быть недомогание, аллергическая экзантема (кожная сыпь). В кишечнике человека из яиц гельминтов выходят личинки, которые проникают через кишечную стенку в кровь, достигают внутренних органов, где растут и достигают 5-10 см в диаметре, сдавливают ткани и нарушают функцию органов. При расположении личинок цепней (цистицерки, ценура) в оболочках и веществе головного мозга наблюдается головная боль, признаки церебральной гипертензии, парезы и параличи, эпилептиформные судороги. Личинки также могут располагаться в спинном мозге, глазном яблоке, серозных оболочках, межмышечной соединительной ткани и др.
Исходом гельминтозов может быть полное выздоровление с ликвидацией гельминтов или развитие необратимых изменений в организме хозяина.
Диагностика гельминтоза
Диагноз гельминтоза устанавливается на основании совокупности жалоб, полученных от пациента сведений о течении болезни, данных лабораторных и инструментальных методов обследования.В острой фазе гельминтозов имеется реакция крови на присутствие гельминта в организме, поэтому рекомендованы следующие исследования:
-
клинический анализ крови: общий анализ, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Паразитарные заболевания и в XXI веке остаются одним из самых частых видов патологии и представляют собой медико-социальную проблему. К настоящему времени из 1415 известных возбудителей заболеваний человека 353 возбудителя вызывают протозойные заболевания
Паразитарные заболевания и в XXI веке остаются одним из самых частых видов патологии и представляют собой медико-социальную проблему. К настоящему времени из 1415 известных возбудителей заболеваний человека 353 возбудителя вызывают протозойные заболевания и гельминтозы. Экспертная оценка ВОЗ свидетельствует, что более 4,5 млрд человек в мире поражено возбудителями этой группы болезней [1]. Из них 2 млрд человек инфицированы Ascaris lumbricoides [2]. Ежегодно в мире аскаридозом заражаются около 650 млн человек, энтеробиозом — 460 млн [3]. По оценкам специалистов, ежегодно число заболевающих паразитарными болезнями в России превышает 20 млн человек и имеет тенденцию к увеличению [4]. По мнению ряда авторов, в последнее время под воздействием различных факторов происходит изменение картины паразитарных заболеваний, проявляющееся в неспецифичности проявлений глистно-протозойных инвазий у детей [5], в бессимптомном течении паразитарных заболеваний [6, 7, 8], в формировании у паразитов клеточных структур, способных изменять иммунный ответ хозяина на присутствие в организме паразита [9, 10, 11]. Особенностью большинства паразитарных болезней является хроническое течение, не сопровождающееся развитием острых симптомов.
Из числа протозойных инвазий наиболее массовой является лямблиоз. До сих пор проблемой является разработка эффективных лечебных мероприятий в отношении хронически рецидивирующего лямблиоза у детей. Устойчивость к противопаразитарным препаратам может быть обусловлена антигенными различиями видов лямблий с разной восприимчивостью к разным противопаразитарным препаратам [12, 13]. Наиболее массовыми гельминтозами в России являются нематодозы, возбудителями которых служат круглые гельминты: острицы, аскариды и др. [14]. Одной из актуальных задач в борьбе с паразитарными инвазиями на сегодняшний день является разработка эффективных, безопасных, недорогих методов лечения гельминтно-протозойной инвазии у детей. Лечение паразитарных инвазий эффективно при проведении комплексного подхода под контролем исследования кала, т. к. целью лечения является эрадикация паразита из кишечника [15, 16, 17]. Однако применение медикаментов широкого спектра действия не обеспечивает полного излечения при однократном курсе терапии и у ряда больных вызывает побочные эффекты аллергического, диспепсического и неврологического характера.
Учитывая сложности в диагностике паразитарных инвазий у детей, актуальной является проблема поиска новых, чувствительных, экономически эффективных и доступных методов диагностики. Полимеразная цепная реакция [ПЦР] [18, 19] нашла широкую область применения в паразитологии, ДНК-технологии имеют большое значение во многих областях паразитологии включая идентификацию и систематизацию паразитов, анализ генетической структуры, генной организации, изучение лекарственной устойчивости [20, 21, 22]). Метод ПЦР позволяет прямо обнаружить инфекционный агент или генетическую мутацию в любой биологической среде организма (слюна, мокрота, кровь, моча, кал).
Современные взгляды зарубежных и отечественных ученых на взаимоотношения паразит–хозяин с позиции колебательных и волновых процессов, присущих всем живым организмам, позволили разработать новый подход к диагностике различных заболеваний, в том числе и паразитарных. Одним из таких методов является вегетативный резонансный тест (ВРТ), позволяющий определить наличие паразитов в организме человека на разных стадиях развития: яйца, личинки, взрослых особей. Маркерами для диагностики являются резонансные электромагнитные частоты, характеризующие индивидуальный спектр электромагнитного излучения паразитов [23, 24]. Метод является гигиеническим, неинвазивным, безболезненным, что особенно важно для детей. ВРТ официально разрешен и рекомендован к медицинскому применению Министерством здравоохранения Российской Федерации (Методические рекомендации № 98/232, 99/96, 2000/74) [25].
Цель нашего исследования — совершенствование диагностики и лечения паразитозов у детей на современном этапе.
Материалы и методы исследования
В основу работы положены результаты обследования 540 детей в возрасте от 2 месяцев до 17 лет с различными гастродуоденальными заболеваниями: хроническим гастродуоденитом (53,5%), функциональным расстройством желудка (8,2%), дискинезиями желчевыводящих путей (30%). Среди сопутствующих заболеваний были диагностированы: аномалии желчного пузыря (4,8%), аллергические заболевания (10%), последствия перинатальной патологии ЦНС (7,7%), хронический иерсиниоз (1,8%), заболевания ЛОР-органов (1,8%).
Для постановки диагноза использовался тщательный сбор анамнеза, анализ жалоб, объективный осмотр, проведение необходимых лабораторных и инструментальных исследований (копроовоскопический метод диагностики, исследование кала с консервантом Барроуза, ПЦР-диагностика кала, вегетативно-резонансное тестирование).
Результаты исследования и их обсуждение
По возрасту дети были распределены на четыре группы: группа I — дети от 2 месяцев до 3 лет, группа II — от 3 до 7 лет, группа III — от 7 до 12 лет, группа IV — от 12 до 17 лет. Кроме того, в зависимости от наличия или отсутствия подтвержденной гельминтно-протозойной инвазии каждая группа была разделена на две подгруппы: А — без паразитарной инвазии, В — с подтвержденной паразитарной инвазией.
Среди обследованных детей преобладали жалобы на отрыжку, тошноту, рвоту, снижение аппетита, боли в животе в околопупочной области, неустойчивый стул (табл. 1).
Обследованные дети с подтвержденной паразитарной инвазией имели три вида моноинвазий (лямблиоз, аскаридоз, энтеробиоз) и четыре вида сочетанной глистно-протозойной инвазии (лямблиоз/энтеробиоз, лямблиоз/аскаридоз, аскаридоз/энтеробиоз, лямблиоз/аскаридоз/энтеробиоз). Характеристика жалоб и объективного осмотра детей в зависимости от вида паразитарной инвазии представлена в табл. 3. Как видно из таблицы, лишь головная боль и болезненность в околопупочной области при объективном осмотре достоверно (р < 0,05) чаще встречались у детей с сочетанной паразитарной инвазией лямблиоз/аскаридоз/энтеробиоз, по сравнению с другими видами инвазий. Кроме того, нарушение сна достоверно (р < 0,05) чаще отмечалось у детей с моноинвазией аскаридами, а боли в околопупочной области достоверно (р < 0,05) чаще встречались у детей с сочетанной гельминтной инвазией аскаридоз/энтеробиоз, по сравнению с другими видами глистно-протозойной инвазии. Различия между группами паразитарных инвазий в преобладании тех или иных диспептических жалоб не достигали уровня значимости.
В нашем исследовании мы изучали диагностическую значимость различных методов диагностики гельминтно-протозойной инвазии у детей.
При диагностике лямблиоза при копроовоскопии 540 мазков цисты лямблий были обнаружены менее чем в 1% случаев. При исследовании кала на цисты лямблий с консервантом Барроуза лямблиоз диагностирован у 38,33% обследованных детей. Методом ПЦР кала лямблии были обнаружены у 28,83% обследованных детей. Методом ВРТ обследованы 136 детей, лямблии обнаружены у 31,62% детей (рис. 1).
Наиболее ценным диагностическим методом при исследовании на лямблиоз оказался метод исследования кала с консервантом Барроуза, данный метод был принят нами в качестве стандарта. Диагностические характеристики других методов диагностики определяли относительно стандарта с помощью четырехпольной таблицы. Для оценки эффективности диагностических тестов рассчитывали следующие показатели: чувствительность (Se), специфичность (Sp), точность (test eff.), прогностическая ценность отрицательного результата теста (–PV), прогностическая ценность положительного результата теста (+PV).
Как известно, от значений чувствительности и специфичности зависит прогностическая ценность (посттестовая вероятность) положительного и отрицательного результатов теста. Чем чувствительнее тест, тем выше прогностическая ценность его отрицательного результата (т. е. возрастает уверенность врача в том, что отрицательные результаты теста отвергают наличие заболевания). Чем специфичнее тест, тем выше прогностическая ценность его положительного результата (то есть врач может с большей уверенностью считать, что положительные результаты теста подтверждают предполагаемый диагноз).
Как видно из табл. 3, методы ПЦР и ВРТ обладают хорошими диагностическими показателями и высокими показателями точности теста (для ПЦР — 82,42%, для ВРТ — 69,92%). Копроскопический метод диагностики характеризовался чрезвычайно низкими диагностическими показателями (все показатели менее 1%), что ставит под сомнение целесообразность его использования для диагностики лямблиоза у детей.
При диагностике аскаридоза мы исследовали кал на яйца глист микроскопическим методом у 540 детей, аскариды обнаружены в 2,04% исследований. Методом ПЦР кала обследовано 434 ребенка, аскариды обнаружены у 1,15% детей, а методом ВРТ обследовано 135 детей, аскариды обнаружены у 7,14% детей (рис. 2).
В качестве стандарта в диагностике аскаридоза в нашем исследовании использовали ПЦР-диагностику кала.
Как известно, не существует абсолютно чувствительных и абсолютно специфичных тестов. Стопроцентные показатели получены, вероятно, из-за того, что в исследовании принимало участие относительно небольшое количество инфицированных аскаридами пациентов (табл. 4). Вероятно, с этим связаны и низкие показатели прогностической ценности положительного результата теста (12,5%). Тем не менее, полученные нами данные позволяют сделать вывод о высокой информативности ВРТ-диагностики аскаридоза у детей (чувствительность теста — 100%, специфичность — 93,96%). При оценке диагностических показателей копроскопического метода диагностики все показатели оказались менее 1%, что не позволяет рекомендовать копроскопический метод для диагностики аскаридоза у детей.
При диагностике энтеробиоза проводились однократные соскобы у 540 детей, острицы диагностированы у 0,2% детей. При исследовании кала на яйца глист у всех обследованных детей, острицы были обнаружены также у 0,2% детей. При проведении ПЦР-диагностики кала у 434 пациентов, острицы обнаружены у 9,68% детей, при вегетативно-резонансном тестировании (обследовано 135 детей) — у 12,59% (рис. 3).
В нашем исследовании стандартом в диагностике энтеробиоза являлась ПЦР-диагностика кала.
Как видно из табл. 5, копроскопический метод диагностики энтеробиоза и однократные соскобы на энтеробиоз не имеют диагностической значимости в диагностике энтеробиоза у детей. Вместе с тем метод ВРТ обладает высокой специфичностью (93,2%) и точностью теста (88,88%) в диагностике энтеробиоза.
При лечении лямблиоза процент успешной эрадикации паразита при использовании метронидазола (20 мг/кг/сут в 3 приема 10 дней) составил 58%, макмирора (15 мг/кг/сут в 2 приема 10 дней) — 53%, албендазола (200 мг/сут в 2 приема 7 дней) — 50%, фуразолидона (10 мг/кг/сут в 3 приема 10 дней) — 20%.
При лечении хронически рецидивирующего лямблиоза у 143 детей были назначены биорезонансные препараты (Танаксол с Пара-уолнат-плас или инверсионный нозод лямблий — предварительно протестированные гомеопатические препараты) с положительным эффектом. Эрадикация простейших при использовании Танаксола с Пара-уолнат-плас оказалась успешной в 47,5% случаев. При лечении хронически рецидивирующего лямблиоза инверсионным нозодом лямблий эффективность терапии была еще выше и составила 71,95% (различия между эффективностью данных методов лечения были достоверными (p < 0,01%)).
При лечении аскаридоза — у 4 детей применялся Вермокс (мебендазол) (для детей от 2 до 10 лет 0,05 г/сут в 3 приема, детям старше 10 лет — 0,1 г в сутки в 3 приема во время еды. Курс лечения 3 дня), у 1 ребенка — Пирантел (12,5 мг/кг однократно), при лечении энтеробиоза 22 ребенка получали Вермокс, 20 детей — Пирантел. Данные препараты оказались эффективными у всех детей с нематодозами. Пациенты с сочетанной паразитарной инвазией получали терапию препаратом Немозол (альбендазол) в случае сочетанной гельминтно-протозойной инвазии (лямблиоз/аскаридоз, лямблиоз/энтеробиоз) в дозе 15 мг/кг/сут в 1 прием 10 дней; при сочетанной инвазии аскаридоз/энтеробиоз Немозол назначался в дозе 400 мг внутрь однократно.
Выводы
Для детей с паразитарной инвазией наиболее характерными клиническими проявлениями являются жалобы на тошноту и боли в околопупочной области. Головная боль и болезненность в околопупочной области достоверно более характерны для детей с сочетанной паразитарной инвазией лямблиоз/аскаридоз/энтеробиоз. Нарушение сна достоверно чаще отмечается у детей с моноинвазией аскаридозом, а боли в околопупочной области — у детей с сочетанной гельминтной инвазией аскаридоз/энтеробиоз.
Число эозинофилов в периферической крови у обследованных детей во всех возрастных группах было в пределах нормы и существенно не отличалось у детей с подтвержденной гельминтно-протозойной инвазией и у детей без паразитарной инвазии.
Метод копроовоскопии без использования консерванта для диагностики лямблиоза малоинформативен, что не позволяет использовать его в широкой практике. Наиболее информативными в диагностике лямблиоза оказались метод исследования кала с консервантом Барроуза и метод ВРТ. При исследовании кала на цисты лямблий с консервантом Барроуза лямблиоз диагностирован у 38,33% обследованных детей, методом ВРТ лямблии обнаружены у 31,62% детей.
ВРТ является неинвазивным, высокоинформативным, удобным и недорогим методом диагностики гельминтно-протозойной инвазии у детей. В диагностике энтеробиоза и аскаридоза метод ВРТ имел высокую диагностическую значимость наряду с методом ПЦР.
Стандартное медикаментозное лечение лямблиоза было эффективным лишь у 20–58% детей. При лечении хронически рецидивирующего лямблиоза у 143 детей максимальной эффективностью обладал инверсионный нозод лямблий (71,95%).
Литература
Savioli L., Gabrielli A. F., Ramsan M. et al. Soil-transmitted helminths and haemoglobin status among Afghan children in World Food Programme assisted schools // J. Helminthol. 2005. Vol. 79 (4). P. 381–384.
Chan M. S. The global burden of intestinal nematode infections — fifty years on // Parasitol. Today 1997. Vol. 13 (11). P. 438–443.
Онищенко Г. Г. О мерах по усилению профилактики паразитарных болезней в России // Медицинская паразитология. 2003. № 3. С. 3–7.
Озерецовская Н. Н., Зальнова Н. С., Тумольская Н. И. Клиника и лечение гельминтозов. М.: Медицина.1985. 183 с.
Horowicz M., Korman S., Shapiro M. et al. Asymptomatic Giardiasis in children // Pediatr. Inf. Dis. 1989. Vol. 87. P. 733–779.
Morrow A. L., Reves R. R., West M. S. et al. Protection against infection with Giardia lamblia by breast-feeding in a cohort of Mexican infants // J. Pediatr. 1992. Vol. 121. P. 363–370.
Pickering L. K., Engelkirk P. G. Giardia lamblia // Pediatr. Clin. Nort. Am. 1988. Vol. 35. P. 565–577.
Kulakova L., Singer S. M., Conrad J., Nach T. E. Epigenetic mechanisms are involved in the control of Giardia lamblia antigenic variation // Mol. Microbiol. 2006. Vol. 61 (6). 1533–1542.
Nash T. E. Antigenic variation in Giardia lamblia and the host’s immune response // Philos. Trans. R. Soc. London Ser. B. 1997. Vol. 352. P. 1369–1375.
Sun C. H., McCaffery J. M., Reiner D. S., Gillin F. D. Mining the Giardia lamblia genome for new cyst wall proteins // J. Biol. Chem. 2003. Vol. 278 (24). P. 21701–21708.
Carnaby S., Ketelaris P. H., Neem A., Farthing M. J. G. Genotypic heterogeneity within Giardia lamblia isolates demonstrated by M13 DNA fingerprinting // Infect. Immun. 1994. Vol. 62. P. 1875–1880.
Majewska A. C., Kasprzak W., De Jonckheere J. F., Kaczmarek E. Heterogeneity in the sensitivity of stocks and clones of Giardia to metronidazole and ornidazole // Trans. R. Soc. Trop. Med. Hyg. 1991. Vol. 85. P. 67–69.
Тимченко В. Н., Леванович В. В., Абдукаева Н. С., Васильев В. В., Михайлов И. Б. Паразитарные инвазии в практике детского врача. СПб. ЭЛБИ 2005. С. 60–68.
Озерецовская Н. Н. Современные проблемы терапии гельминтозов // Мед. паразитология. 1975. 33. С. 271–276.
Lohiya G. S., Tan-Figueroa L. et al. Epidemiology and control of enterobiasis in a developmental center // West. J. Med. 2000. Vol. 172 (5). P. 305–308.
Saiki R. K., Scharf S., Faloona F., Mullis K. B. et al. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia // Science. 1985. Vol. 230 (4732). P. 1350–1354.
Mullis K., Faloona F., Scharf S. et al. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction // Cold. Spring. Harb. Symp. Quant. Biol. 1986. Vol. 51. P. 263–273.
Zhu X., Chilton N. B., Jacobs D. E. et al. Characterisation of Ascaris from human and pig hosts by nuclear ribosomal DNA sequences // Int. J. Parasitol. 1999. Vol. 29 (3). P. 469–478.
Gasser R. B., Rossi L., Zhu X. Identification of Nematodirus species (Nematoda: Molineidae) from wild ruminants in Italy using ribosomal DNA markers // Int. J. Parasitol. 1999. Vol. 29 (11). P. 1809–1817.
Zhang L., Gasser R. B., Zhu X., McManus D. P. Screening for different genotypes of Echinococcus granulosus within China and Argentina by single-strand conformation polymorphism (SSCP) analysis // Trans. R. Soc. Trop. Med. Hyg. 1999. Vol. 93 (3). P. 329–334.
Электропунктурный вегетативный резонансный тест. Под ред. А. М. Василенко, Ю. В. Готовскиго, Е. Е. Мейзерова, Н. А. Королевой, В. С. Каторгина. Метод. реком. № 99/96. М.: МЗ РФ, ИПЦ ТМГФ, 2000. 27 с.
В. А. Александрова, доктор медицинских наук, профессор
В. Е. ОдинцеваСПб МАПО, Санкт-Петербург
Комплексное лабораторное обследование для выявления основных гельминтозов и протозойных инфекций человека, включающее общеклинические и специфические тесты.
Синонимы русские
Анализы для диагностики гельминтозов и протозойных инфекций.
Синонимы английские
Laboratory diagnosis of protozoal and helminthic infections; CBC, Stool Ova and Parasites test, Cellulose tape test, Protozoal and Helminthic Serology.
Какой биоматериал можно использовать для исследования?
Венозную кровь, кал, отпечаток с перианальной области.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Исключить прием слабительных препаратов, введение ректальных свечей, масел, ограничить (по согласованию с врачом) прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др.), и препаратов, влияющих на окраску кала (железо, висмут, сернокислый барий), в течение 72 часов до сбора кала.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
- Сбор биоматериала на исследование проводится только утром (до 10:00), до дефекации. Накануне взятия биоматериала не проводить туалет кожных покровов в области ануса и ягодиц.
Общая информация об исследовании
Гельминтозы и протозойные инфекции наблюдаются повсеместно и особенно распространены среди детей и людей, по роду деятельности контактирующих с домашними и дикими животными. Как правило, инфицирование человека является одним из этапов развития гельминтов или простейших. Многие из паразитов имеют фекально-оральный механизм передачи инфекции и по крайней мере на одном этапе жизненного цикла поражают различные отделы пищеварительного тракта. Несмотря на то что некоторые гельминтозы и паразитозы человека имеют специфические клинические признаки, в целом дифференцировать эти заболевания на основании клинической картины очень сложно. Основную роль в диагностике этих заболеваний играют лабораторные тесты. С учетом того, что у одного и того же человека может наблюдаться сочетание нескольких гельминтозов и паразитозов, рекомендуется выполнение сразу нескольких тестов или, что более удобно для врача и пациента, комплексного анализа на распространенные гельминтозы и паразитозы.
Комплексное лабораторное обследование включает общеклинические и специфические анализы на самые распространенные и важные в клиническом плане гельминтозы и протозойные инфекции. Общеклинические тесты: общий анализ крови, лейкоцитарная формула, анализ кала на яйца гельминтов и анализ кала на цисты простейших.
Общий анализ крови и лейкоцитарная формула используются для того, чтобы определить, является ли гельминтоз или паразитоз инвазивным, и также позволяет выявить возможные осложнения, связанные с инфекцией (анемию). Об инвазивности гельминтозов и паразитозов свидетельствует эозинофилия. Она характерна для амебиаза, эхинококкоза, описторхоза, токсокароза, трихинеллеза и аскаридоза (в фазу миграции личинок). Эозинофилия не характерна для кишечного аскаридоза, энтеробиоза и лямблиоза. Любая длительно текущая инфекция может приводить к развитию анемии (анемии хронического заболевания). Гельминтозы и паразитозы, протекающие с изъязвлением слизистой оболочки пищеварительного тракта (например, амебиаз), приводят к развитию железодефицитной анемии.
Анализ кала на яйца гельминтов и анализ кала на цисты простейших включают макроскопическую оценку кала (цвет, консистенция, наличие крови, избытка слизи, макроскопически определяемых паразитов), микроскопию нативного образца кала (наличие цист простейших – трофозоитов, личинок и взрослых особей гельминтов) и микроскопию окрашенного мазка кала (наличие цист и трофозоитов). Анализ кала на яйца гельминтов позволяет выявить большинство кишечных нематод, цестод и трематод. Анализ кала на цисты простейших позволяет выявить Giardia lamblia, Entamoeba histolytica, Balantidium coli и других простейших. Учитывая, что поступление яиц гельминтов или цист простейших в кал может носить непостоянный характер, однократное исследование кала малоинформативно - рекомендуется исследование трех образцов кала. Следует учитывать, что при некоторых гельминтозах (например, описторхоз) появление яиц в кале начинается только через 2-4 недели после возникновения симптомов заболевания. Отрицательный результат исследований не позволяет полностью исключить наличие гельминтоза или паразитоза.
К специфическим тестам для диагностики гельминтозов и паразитозов относятся серологические тесты и анализ на энтеробоз.
Echinococcus, IgG – определение специфических антител IgG к возбудителю эхинококкоза (Echinococcus granulosus или Echinococcus multilocularis). Чувствительность серологических тестов в отношении E. granulosus при поражении печени (самая частая локализация) составляет около 80 %, при поражении других органов (легкие, головной мозг, кости скелета) – несколько ниже.
Opistorchis, IgG - определение специфических антител IgG к возбудителю описторхоза (Opistorchis felineus или Opistorchis viverrini). Из-за невысокой специфичности серологические тесты являются дополнительным способом диагностики описторхоза (главный тест – анализ кала на яйца гельминта).
Toxocara, IgG, титр - количественное определение специфических антител IgG к возбудителю токсокароза (Тохосаra canis). Серологические тесты обладают достаточно высокой чувствительностью (78 %) и специфичностью (92 %) и могут служить хорошим дополнением или даже альтернативой "золотому стандарту" диагностики данного заболевания - микроскопическому исследованию биопсии ткани, содержащей личинки гельминта (частая локализация – печень и легкие), учитывая, что многие пациенты с токсокарозом - маленькие дети.
Учитывая системный характер таких инфекций, как эхинококкоз, описторхоз и токсокароз, при подозрении на эти заболевания проводят дополнительные обследования, в том числе оценку функции печени.
Trichinella, IgG - определение специфических антител IgG к возбудителю трихинеллеза (Trichinella spiralis и родственные виды). Серологические тесты становятся положительными через 3 недели после инфицирования. Учитывая, что личинки гельминта поражают мышечную ткань, при данном заболевании также могут быть повышены следующие клинико-лабораторные маркеры: креатинкиназа (КК), лактатдегидрогеназа (ЛДГ) и аспартатаминотрансфераза (АСТ).
Ascaris lumbricoides, IgG - определение специфических антител IgG к возбудителю аскаридоза. Аскаридоз – это самый распространенный гельминтоз человека. Серологические тесты являются дополнительным способом диагностики аскаридоза (главный тест – выявление взрослых особей в области рта и ануса, а также анализ кала на яйца гельминта).
Giardia lamblia, антитела - определение специфических антител к возбудителю лямблиоза. Серологические тесты являются дополнительным способом диагностики лямблиоза (главный тест - анализ кала на цисты паразита). Серологический тест становится отрицательным через 1 год после перенесенной инфекции. Также может быть использован тест на антиген G. lamblia в кале.
Энтеробиоз – распространенный гельминтоз, вызываемый Enterobius vermicularis (острица). Яйца остриц не выделяются с калом, поэтому микроскопическое или любые другие исследования кала не применяются. Лабораторная диагностика энтеробиоза осуществляется с помощью специального метода - микроскопического исследования мазков-отпечатков с кожи перианальной области. Микроскопическое исследование позволяет произвести дифференциальную диагностику энтеробиоза с аскаридозом, а также другими неинфекционными заболеваниями, сопровождающимися зудом перианальной области (контактным дерматитом, сахарным диабетом). Учитывая повышенную активность самки в ночные часы, оптимально производить мазок-отпечаток с утра, до совершения утреннего туалета.
Комбинация общеклинических и специфических тестов позволяет достичь наибольшей точности при диагностике гельминтозов и паразитозов. При эффективном лечении изменения, выявленные в общеклинических тестах, нормализуются, а яйца/личинки/взрослые особи гельминтов или цисты простейших перестают определяться, но серологические тесты могут оставаться положительными в течение некоторого времени даже при эффективном лечении.
Для чего используется исследование?
- Для диагностики кишечных гельминтозов и протозойных инфекций.
Когда назначается исследование?
- При обследовании детей и людей из группы риска заражения гельминтами и простейшими (ветеринары, фермеры, работники, занятые в санитарно-гигиентической сфере);
- при наличии признаков глистной инвазии или протозойной инфекции: хронической диареи, мальабсорбции, тошноты, потери веса, а также признаков реакции гиперчувствительности (крапивницы и других сыпей);
- при оформлении ребенка в детский сад, лагерь, бассейн, при госпитализации.
Что означают результаты?
Для каждого показателя, входящего в состав комплекса:
В норме яйца, личинки и взрослые особи гельминтов, цисты и вегетативные формы простейших в кале отсутствуют. Их обнаружение свидетельствует о текущей инфекции.
Серологические тесты могут оставаться положительными в течение некоторого времени даже при эффективном лечении.
Читайте также:

