Рациональная антибиотикотерапия инфекционных заболеваний
Обновлено: 24.04.2024
Причины устойчивости к антибиотикам. Механизмы
Устойчивость к действию антибиотиков отмечают в случае, когда ранее восприимчивые микроорганизмы теряют свою чувствительность к антибактериальному препарату при использовании клинически безопасной дозы. Это происходит в результате генетических изменений, часто возникающих в быстро делящихся клетках с гаплоидным набором хромосом.
Факторы определяющие устойчивость бактерий к антибиотикам
Трансформация бактерий и утойчивость к антибиотикам. Трансформация — процесс захвата бактериями свободной цепи ДНК и встраивания её в собственный геном.
Например, Streptococcus pneumoniae способен захватывать у близкородственных видов часть генов, кодирующих пенициллинсвязывающие белки (обладают меньшим сродством к лекарственному препарату). При продукции изменёнными генами этих белков чувствительность к действию пенициллина заметно снижается, т.е. бактерии продолжают синтезировать пептидогликан, сохраняя структуру клеточной стенки, даже в присутствии препарата.
Устойчивость к действию бензилпенициллина у Neisseria gonorrhoeae развивается по такому же механизму.
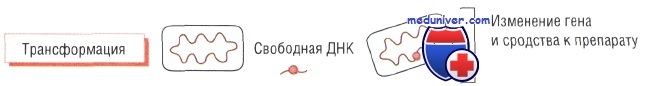
Конъюгация бактерий и утойчивость к антибиотику
Плазмиды — кольцевые структуры ДНК, расположенные в цитоплазме бактерий. Их может быть достаточно много. Именно поэтому при делении клеток одни и те же плазмиды обнаруживают у всех дочерних микроорганизмов. Плазмиды содержат информацию о различных генах бактерии, в том числе о генах, кодирующих метаболические ферменты, и факторах, определяющих вирулентность и устойчивость к действию антибиотиков.
Конъюгация — процесс передачи плазмид от одной бактерии к другой. В этом случае гены, кодирующие устойчивость, быстро распространяются среди бактерий, находящихся в одной среде обитания (например, в кишечнике). Комбинированное воздействие отдельных антибиотиков (например, в госпитальных условиях) приводит к появлению мультирезистентных штаммов.
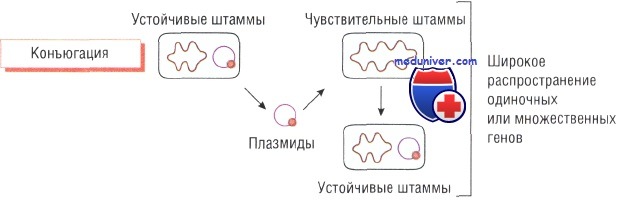
Транспозоны и интегроны бактерий и утойчивость к антибиотику
Транспозоны и интегроны — подвижные гены, способные кодировать транспозицию (внутрихромосомную транслокацию). Они могут перемещаться как между хромосомами и плазмидами, так и между бактериями и содержат большое количество генетической информации (например, антибиотикорезистентность).
Считают, что в основе развития устойчивости к метициллину у Staphylococcus aureus и к тетрациклину у Neisseria gonorrhoeae лежит передача именно этих генетических структур. Интегроны играют важную роль в передаче мультирезистентности у грамположительных микроорганизмов. Кроме того, передачу генов резистентности могут осуществлять бактериофаги.
Механизмы возникновения утойчивости к антибиотикам
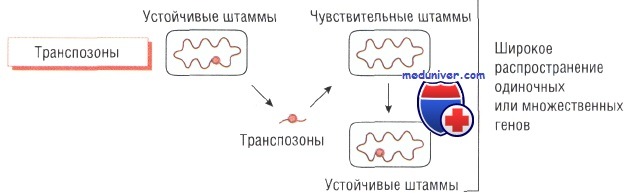
Изменение структуры антибактериального препарата. Ферментативная инактивация. Наиболее распространённый механизм развития устойчивости к действию антибиотика — спонтанное продуцирование фермента, разрушающего препарат.
Большинство штаммов Staphylococcus aureus продуцирует экстрацеллюлярный фермент бета-лактамазу, которая инактивирует пенициллины, разрушая бета-лактамное кольцо в их структуре. Ферменты, разрушающие пенициллины и цефало-спорины, синтезируют многие микроорганизмы, в том числе Escherichia coli, Haemophilus influenzae и некоторые представители рода Pseudomonas.
Гены, кодирующие эти ферменты, обычно расположены в подвижных генетических элементах (транспозонах) и могут передаваться как между бактериями одного вида, так и между видами. Распространение различных видов бета-лактамаз расширенного спектра (например, CTXm или АтрС) среди представителей семейства энтеробактерий приводит к возникновению устойчивости к эффектам пенициллинов и цефалоспоринов широкого спектра действия и возникновению внутрибольничных инфекций. Кроме того, эти микроорганизмы могут вызывать опасные внебольничные заболевания.
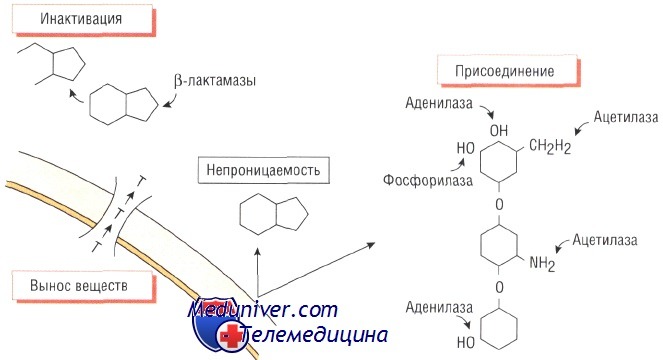
Ферментативное присоединение. Бактерии могут вырабатывать ферменты, способные угнетать активность антибиотиков путём присоединения к последним различных химических групп. Например, устойчивость к действию аминогликозидов возникает в результате присоединения ацетилового, аминового или аденозинового радикала к молекуле препарата.
Влияние такой модификации на эффективность лекарственных средств группы аминогликозидов различно. Так, амикацин наименее восприимчив к этому способу инактивации. Присутствие ферментов, обусловливающих устойчивость к действию аминогликозидов, характерно как для грамположительных (Staphylococcus aureus), так и для грамотрицательных (микроорганизмы рода Pseudomonas) возбудителей.
Непроницаемость клеточной стенки и утойчивость к антибиотику
Устойчивость некоторых бактерий к действию антимикробных средств связана с непроницаемостью их клеточной стенки для молекул препарата. Например, клеточная стенка грамо-трицательных микроорганизмов (особенно рода Pseudomonas) непроницаема для некоторых бета-лактамов.
В то же время аминогликозиды проникают внутрь бактерии посредством кислородозависимой транспортной системы (а потому анаэробы к ним невосприимчивы), в связи с этим анаэробы обладают небольшой чувствительностью к аминогликозидам.
Механизмы выведения веществ из бактериальной клетки и утойчивость к антибиотику
Некоторые бактерии, например Е. coli, становятся невосприимчивыми к действию тетрациклинов, когда приобретают внутримембранный белок, активно выводящий антибиотик из клетки. Устойчивость стрептококков к действию макролидов обусловлена подобным механизмом.
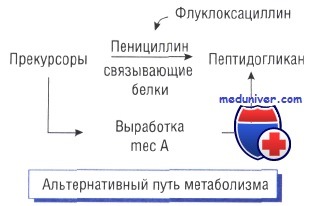
Альтернативные пути метаболизма и утойчивость к антибиотикам
Один из наиболее распространённых механизмов возникновения устойчивости к действию антибактериальных препаратов — развитие альтернативных путей метаболизма, помогающих обходить метаболический блок, вызываемый антибиотиком. Так, Staphylococcus aureus становится невосприимчивым к метициллину или флуклоксациллину, когда у него появляется ген тесА, кодирующий альтернативный пенициллинсвязывающий белок (РВР2), не чувствительный к метициллину.
Несмотря на то что состав бактериальной клеточной стенки изменяется, микроорганизм сохраняет способность к делению. Снижение восприимчивости к бензилпенициллину у Streptococcus pneumoniae также вызвано наличием пенициллинсвязывающих белков.
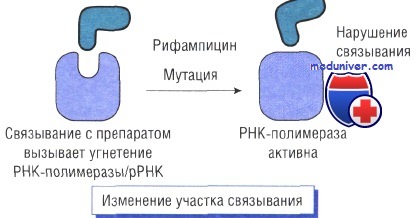
Изменение участка связывания антибиотика
В основе механизма действия рифампицина лежит угнетение бета-субъединицы РНК-полимеразы. Устойчивость возникает при изменении гена РНК-полимеразы в результате точечных мутаций, инсерции или делеции.
При этом новая РНК-полимераза невосприимчива к рифампицину.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Воспалительные заболевания верхних дыхательных путей (ВДП) и дыхательного тракта остаются одним из самых частых видов патологии как взрослого, так и детского населения. В амбулаторной практике с ними встречаются не только отоларингологи, но терапевты и педиатры. В России острыми респираторными заболеваниями (ОРЗ), при которых поражается слизистая оболочка полости носа, глотки, придаточных пазух, в год страдают около 35 млн человек. Численность больных увеличивается в осенне-зимний период.
ВДП подвергаются такому массированному воспалительному поражению из-за ряда располагающих факторов. Прежде всего, воздействие факторов внешней среды, с которыми первой встречается слизистая оболочка полости носа и глотки. К ним относятся микроорганизмы (вирусы, бактерии), аллергены, загрязняющие частицы (сигаретный дым, вещества, содержащиеся в воздухе и т.д.) – все что может вызвать воспалительную реакцию. К внешним факторам можно отнести высокую влажность воздуха и его низкую температуру. Особенность анатомического строения полости носа, придаточных пазух, глотки и гортани заключается в том, что воспалительный процесс локализуется в узких карманах, щелях и синусах и создаются благоприятные условия для активной жизнедеятельности и размножения патогенной флоры.
Возбудителями острых инфекций ВДП могут быть как вирусы, так и бактерии. Наиболее частыми бактериальными возбудителями респираторной инфекции являются пневмококк (Streptococcus pneumoniae), грамотрицательная гемофильная палочка (Haemophilus influenzae), Streptococcus pyogenes, микоплазма (Мycoplasma pneumoniae). В последнее время отмечается бурный рост заболеваний, микоплазменной этиологии, наиболее интенсивный в крупных городах и промышленных центрах.
Основными вирусными возбудителями являются риновирусы (25–40% всех вирусов), коронавирусы, вирусы гриппа и парагриппа. Реже встречаются респираторно-синцитиальный вирус, аденовирусы, энтеровирусы, реовирусы и пикорнавирусы. Наличие вирусного компонента в этиологической структуре заболеваний верхних отделов дыхательных путей следует учитывать при назначении терапии, поскольку широко назначаемые системные антибиотики не действуют на вирусы.
По данным различных фармакоэпидемиологических исследований, практически в 50% случаев признано неоправданным назначение системных антибиотиков при острых респираторных инфекциях [1–3].
Переоценка врачами общей практики эффекта системных антибиотиков при острых инфекциях ВДП объясняется высокой частотой спонтанного выздоровления пациентов при этих инфекциях и ошибочным мнением, что системные антибиотики предотвращают развитие бактериальной суперинфекции при вирусных заболеваниях [1, 2, 4].
В плацебоконтролируемых исследованиях не выявлено существенных преимуществ системных антибиотиков, как в частоте выздоровления, так и в сроках исчезновения симптомов заболевания пациентов с острыми инфекциями ВДП [1, 5–7]. Получены убедительные доказательства того, что системная антибактериальная терапия при вирусных инфекциях ВДП не предотвращает бактериальные осложнения, такие как пневмония или острый средний отит. Некоторые серьезные осложнения острого риносинусита, такие как менингит и абсцесс мозга, очень редки, и в настоящее время отсутствуют данные, подтверждающие эффективность системных антибиотиков в профилактике этих осложнений [6, 8].
Трудно переоценить потенциальный вред от неоправданного назначения антибактериальной терапии. К наиболее опасным следует отнести:
- аллергические реакции (в том числе жизнеугрожающие, например, синдром Стивена-Джонса);
- культивирование резистентных штаммов микроорганизмов, особенно среди наиболее значимых респираторных антигеннов (Streptococcus pneumoniae, Streptococcus pyogenes) [1, 9, 10];
- развитие серьезных побочных эффектов, таких как удлинение интервала QT, наблюдающееся при применении макролидов и некоторых фторхинолонов.
Наиболее значимой является резистентность S. pneumoniae к пенициллину, макролидам, ко-тримоксазолу, S. pyogenes – к макролидам, тетрациклину. Резистентность S. pneumoniae к пенициллину и макролидам в некоторых странах Европы достигает 40–50%, резистентность S. pyogenes к макролидам – 30–40%, что ограничивает возможности эффективной терапии инфекций ВДП. В частности, показано снижение клинической и бактериологической эффективности макролидов при респираторных инфекциях, вызванных резистентными штаммами S. pneumoniae или S. pyogenes [11–13]. Уровень резистентности (высокой и умеренной) S. pneumoniae к пенициллину в России составляет около 20%, сходный уровень резистентности (в пределах 20%) отмечается среди S. pyogenes к макролидным антибиотикам [14].
Активная ограничительная политика на уровне государства по использованию системных антибиотиков способствует уменьшению распространенности резистентных штаммов. Ряд неправительственных организаций, включая ВОЗ, сформулировали стратегию ограничения применения в амбулаторной практике антибактериальных препаратов при наличии респираторной инфекции у пациентов.
Однако не следует забывать, что у пациентов с хроническими заболеваниями ЛОР-органов, у часто болеющих детей возможны дисбиотические нарушения, при которых на слизистой оболочке постоянно персистирует и патогенная микрофлора. Существует вероятность активации патогенной бактериальной флоры при острой респираторной вирусной инфекции (ОРВИ) и основным этиологическим фактором становятся не просто вирусы, а вирусно-бактериальные ассоциации.
В тех случаях, когда имеется высокая вероятность вирусно-бактериальной этиологии инфекций ВДП или высокий риск осложнений, показано применение антибиотиков.
Системная антибиотикотерапия при инфекциях ВДП показана, в основном, только в следующих случаях:
- острый синусит средне-тяжелого/тяжелого течения или синусит с длительно сохраняющейся симптоматикой;
- острый тонзиллофарингит предполагаемой или установленной стрептококковой этиологии (возбудитель – бета-гемолитический стрептококк группы А-БСГА).
Учитывая современные рекомендации по ограничению назначения системных антибиотиков при острых неосложненных инфекциях ВДП, наиболее предпочтительным видом терапии воспалительных заболеваний ЛОР-органов является применение местных антимикробных средств, позволяющее обеспечивать достаточные концентрации препарата в ограниченной анатомической зоне. Среди подобных препаратов следует выделить фузафунгин.
Фузафунгин – антибиотик, полученный из грибов французскими учеными Ж.Герийо, А.Ж.Гирийо-Вине, М.Гийо и Ж.Монтегю более 40 лет назад. Источник фузафунгина – гриб Fusarium lateritium (штамм WR 437), который является родственником других известных продуцентов антибиотиков, в частности, грибов пеницилла и аспергилла.
Препарат обладает специфическим сбалансированным спектром действия. Биопарокс эффективен в отношении практически всех респираторных патогенов грамположительной и грамотрицательной флоры. Фузафунгин оказывает бактериостатическое действие на грамположительные кокки, часто вызывающие инфекции дыхательных путей, такие как Streptococcus (в том числе S. pneumoniae) и Staphylococcus, включая метициллин-устойчивые штаммы. Биопарокс активен в отношении Haemofillus influenzae, Legionella pneumoniae, а также Mycoplasma pneumoniae и Candida albicans, что позволяет снизить риск развития вторичного кандидоза.
На фоне применения фузафунгина не отмечено селекции штаммов, устойчивых к нему или другим антибиотикам. Местное применение фузафунгина при острых инфекциях ВДП отвечает современным рекомендациям по сдерживанию антибиотикорезистентности в популяции, так как в результате целенаправленной доставки антибиотика к очагу инфекции отсутствует системное воздействие и имеется меньший риск селекции резистентных штаммов нормальной микрофлоры.
По уровню антимикробной активности против основных возбудителей острых респираторных инфекций фрамицетин и комбинированные препараты, содержащие неомицин и полимиксин, уступают фузафунгину.
Следует отметить, что широко распространенная в некоторых медицинских учреждениях практика введения в околоносовые пазухи растворов системных антибиотиков, предназначенных для парентерального применения, не может быть признана рациональной. Эти препараты не предназначены для полостного введения. При их местном применении создаются неравномерные концентрации в разных участках околоносовых пазух, что может способствовать селекции резистентных штаммов. Кроме того, режим дозирования системных антибиотиков при местном применении не изучен и следует помнить о возможном неблагоприятном воздействии больших доз антибиотиков на функцию мерцательного эпителия.
Этих недостатков лишен фузафунгин. Важным его свойством является наличие противовоспалительного действия. Эффективность Биопарокса при острых респираторных инфекциях (ринофарингит, риносинусит) подтверждена в четырех двойных слепых плацебоконтролируемых исследованиях [15–17]. Показано, что фузафунгин при местном применении приводит к достоверно более быстрому, чем плацебо, исчезновению симптомов инфекции. Кроме того, при назначении фузафунгина на ранних стадиях острых респираторных инфекций достоверно снижается частота назначения практикующими врачами системных антибиотиков, а также уменьшается потребность в анальгетиках и местных глюкокортикоидах [17].
Таким образом, при острых нетяжелых бактериальных инфекциях ВДП возможно излечение пациентов при назначении фузафунгина без добавления системных антибиотиков.
При применении Биопарокса не наблюдается приобретенная и перекрестная устойчивость к другим препаратам. Показаниями к использованию Биопарокса являются воспалительные и инфекционные заболевания глотки, дыхательных путей (от полости носа и околоносовых пазух до трахеи и бронхов).
Хорошая переносимость препарата, удобство применения, точное дозирование в виде аэрозоля позволяют рекомендовать его к широкому использованию в клинической практике при отоларингологических заболеваниях и острой респираторной инфекции.
New Possibilities of Antibacterial Therapy of Infections in Surgical Practice
A. A. ZAITSEV, 0. I. KARPOV, A. YU. STREKACHEV
Institute of Pharmacology, St.Petersburg I. P. Pavlov State Medical University © Коллектив авторов, 2003
Эмпирический подход к антибиотикотерапии внебольничных инфекций в стационаре является определяющим, по крайней мере на начальном этапе лечения. От грамотного решения врача в выборе средств и методов стартовой терапии зависит самое главное — удастся ли остановить инфекционный процесс на начальной фазе его развития или же допустить его прогрессирование. Правильная врачебная тактика обусловливает возможность борьбы с внебольничной условно-патогенной микрофлорой, тогда как ее недостаточная эффективность приводит к пролонгации пребывания больного в стационаре и, соответственно, повышает риск присоединения внутригоспитальных патогенов, возможности борьбы с которыми более ограничены. Иными словами, эффективная стартовая антибиотикотерапия — это чрезвычайно важный фактор, от которого во многом зависит исход болезни.
Преобладающие микроорганизмы и рекомендуемые антибактериальные средства
Все сказанное имеет прямое отношение к осложненным внебольничным интраабдоминальным инфекциям, требующих не только оперативного лечения, но и назначения антибактериальных средств. Эти инфекции, как правило, имеют полимикробную этиологию, включающую ассоциации грамположительных и грамотрицательных аэробов и анаэробов. Частота встречаемости анаэробов неодинаково оценивается разными авторами, но главное, что эти микроорганизмы единодушно признаются ведущими возбудителями инфекций брюшной полости и, следовательно, антианаэробный компонент в спектре антибиотика является одним из определяющих критериев в его выборе. Немаловажное значение имеют также фармакокинетика антибактериального препарата, его переносимость и фармакоэкономические аспекты лечения. Применение антибиотиков направлено на предупреждение интраабдоминального реинфицирования и формирование экстраабдоминальных очагов. Даже при наличии микробиологических данных существуют сложности их клинической оценки, затрудняющие установление ведущего возбудителя.
Среди аэробных микроорганизмов при внебольничных интраабдоминальных инфекциях преобладают грамположительные кокки — золотистый стафилококк, обычно чувствительный к метициллину, пиогенный и другие стрептококки. Грамотрицательные микроорганизмы представлены бактериями семейства Enterobacteriaceae — прежде всего E.coli, реже другими видами (Klebsiella spp., Proteus spp.). К сожалению, даже внебольничные штаммы энтеробактерий способны продуцировать различные бета-лактамазы, инактивирующие незащищенные пенициллины и цефалоспорины I—II, а иногда и III поколения.
Среди анаэробных возбудителей внебольничных интраабдоминальных инфекций встречаются различные бактероиды, клостридии, фузобактерии, пептострептококки и некоторые другие. Важно еще раз подчеркнуть, что необходимо приостановить инфекционный процесс именно на этом этапе, поскольку его прогрессирование сопровождается риском присоединения госпитальных резистентных штаммов микроорганизмов (например, метициллинорезистентных стафилококков, клебсиеллы, продуцирующих бета-лактамазы расширенного спектра), в том числе новых, не характерных для внебольничных инфекций, таких как Enterobacter spp., Serratia spp., Citrobacterspp. и неферментирующих бактерий — псевдомонад и ацинетобактера, характеризующихся высокой устойчивостью ко многим группам антибактериальных препаратов.
Внебольничные интраабдоминальные инфекции рассматриваются как весьма серьезные заболевания, до сих пор характеризующиеся вариабельной, но высокой летальностью (3—30%). Анализ эффективности различных схем антибиотикотерапии показывает, что при эмпирическом подходе успех стартовой терапии достигается не более чем в 65% случаев [1]. В остальных случаях необходимо назначение антибактериальных препаратов второй линии, иногда — повторное оперативное вмешательство, а часть больных погибает. При неуспехе стартовой терапии значительно удлиняются сроки госпитализации и существенно — в 3—10 раз — возрастает стоимость излечения одного больного (затраты на дополнительные парентеральные антибиотики + новая операция + дополнительные дни пребывания в стационаре).
Клинико-фармакологическая характеристика моксифлоксацина
Заслуженной популярностью при лечении интраабдоминальных инфекций пользуются синтетические противомикробные средства фторхинолоны и, в первую очередь, наиболее активный из них ципрофлоксацин. В целом, по антимикробному спектру ципрофлоксацин сопоставим с аминогликозидами, но не обладает присущей последним нефро— и ототоксичностью. К сожалению, он характеризуются низкой активностью в отношении стрептококков и отсутствием реального эффекта против анаэробов — клостридий и бактероидов.
Учитывая ключевую роль полимикробных ассоциаций в этиологии интраабдоминальных инфекций, большие надежды в их лечении возлагаются на фторхинолоны последнего поколения. Из них в нашей стране разрешены к клиническому применению препараты левофлоксацин (Таваник) и моксифлоксацин (Авелокс). Они обладают повышенной активностью против пневмококков, стрептококков и стафилококков, сопоставимы с ципрофлоксацином по активности против Enterobacteriaceae, а моксифлоксацин характеризуется также высокой антианаэробной активностью.
Моксифлоксацин обладает широким антибактериальным спектром, включающим большинство клинически значимых возбудителей интраабдоминальных инфекций. Среди грамположительных бактерий к нему высокочувствительны стрептококки, пневмококки, стафилококки, причем моксифлоксацин превосходит другие фторхинолоны по активности в отношении пенициллинорезистентных штаммов пневмококков и метициллино-резистентных стафилококков. Для большинства представителей Enterobacteriaceae МПК90 моксифлоксацина составляет < 1 мг/л, хотя он, по сравнению с ципрофлоксацином, менее активен in vitro против Pseudomonas spp. и некоторых штаммов энтеробактера и цитробактера. По действию на анаэробы моксифлоксацин не уступает метронидазолу, ингибитор-защищенным пенициллинам и карбапенемам [2].
Важной фармакодинамической особенностью моксифлоксацина является приблизительно одинаковое сродство к топоизомеразам I и II типов — мишеням фторхинолонов в бактериальной клетке, что в наибольшей степени предотвращает селекцию устойчивых штаммов [3]. Надежность эффекта препарата подтверждается также данными in vitro о том, что его активность лишь незначительно снижается при сдвигах рН среды в диапазоне 5,6—8,4 и практически не изменяется при значениях инокулюма 10 4 —10 6 КОЕ/мл [4].
С этой точки зрения перспективным представляется использование современных фторхинолонов, в частности, моксифлоксацина, для профилактических целей, что нами сделано, например, при гистерэктомии. 30 больных были рандомизированы на 2 равные группы. Больные первой группы получали моксифлоксацин внутрь в дозе 0,4 г за 2 часа до операции, больные второй группы — цефуроксим в дозе 1,5 г и метронидазол в дозе 0,5 г внутривенно за 60 мин до операции. В обеих группах пациенток эффективность периоперационной профилактики составила 100%. Побочные эффекты при профилактике не возникли.
Анализ минимизации стоимости профилактики говорит в пользу моксифлоксацина, поскольку профилактика обходится в среднем в 170 руб./чел., а при использовании цефуроксима с метронидазолом (с учетом расходных материалов) — 207 руб./чел. [7]. По результатам этого исследования нами сделан вывод, что моксифлоксацин эффективен и безопасен в качестве средства периоперационной профилактики при абдоминальной гистерэктомии и имеет фармакоэкономические преимущества перед комбинацией цефуроксим + метронидазол.
ЛИТЕРАТУРА
1. Cattan P., Yin D. D., Satfati E. et al. Cost of care for inpatients with community-acquired intra-abdominal infections. Eur J Clin Microbiol Infect Dis 2002; 21: 787-793.
2. Яковлев С. В., Мохов О. И., Суворова М. П. Моксифлоксацин: антимикробная активность, фармакокинетика и клиническое применение при внебольничных респираторных инфекциях. Клин фармакол тер 2001; 2: 51—56.
3. Сидоренко С. В. Перспективы применения моксифлоксацина для лечения инфекций мочеполовых путей. Антибиотики и химиотер 2002; 1:2-8.
4. Herrington J. A., Federici J. A., Remy J. M. Factors affecting the in vitro activity of moxifloxacin. Moxifloxacin in practice/ Adam D., Finch R. eds. New York 2000; 3: 73-79.
5. Praise A. P., Bass S., Cunningham B. etal. An outbreak of enterococcal infection controlled by encouraging quinolone usage. Clin Microbiol Infect 1999; 5: 3: 309.
6. Карпов О. И., Зайцев А. А., Суисси Р. Фармакоэпидемиология ан-тибиотикопрофилактики. X Национальный конгресс: Человек и лекарство. М.: 2003; 32.
7. Карпов О. И., НиауриД. А., Зайцев А. А. и др. Эффективность моксифлоксацина для профилактики инфекции при абдоминальной гистерэктомии. Там же; 209—210.
8. Sologub Т., Karpov О., ZaytsevA. Susceptibility of problem respiratory pathogens to levofloxacine. Europ Resp J 2002 .20: Suppl.38: 526—527.
Выбор антибиотика при инфекциях. Рекомендации, критерии
Основные принципы антибактериальной терапии — избирательная токсичность в отношении патогенного микроорганизма и относительная безопасность для организма человека. Для их выполнения большое значение имеет использование в качестве мишеней для лекарственных препаратов тех компонентов бактериальной клетки, которые отсутствуют у человека.
Примером такого компонента может быть клеточная стенка, воздействие на которую оказывает слабое влияние на макроорганизм и в то же время губительно для бактерии. Правильно подобранная антибиотикотерапия всегда эффективна и достаточно безопасна.
Несмотря на то, что почти все антибиотики обладают рядом побочных эффектов, серьёзные нарушения возникают достаточно редко. Кроме того, препараты этой группы имеют достаточно высокий терапевтический индекс, а потому побочные эффекты манифестируют только при назначении доз, намного превышающих терапевтическую. Важное исключение — аминогликозиды, наблюдение за концентрацией которых в сыворотке крови имеет первостепенное значение.
Выбор антибиотика
Выбор антибиотика зависит от локализации очага инфекции, чувствительности микроорганизмов, тяжести заболевания и аллергического анамнеза, вероятности возникновения побочных эффектов, стоимость препарата рассматривают в последнюю очередь. Рациональный выбор терапии зависит от знания локализации возбудителя и профиля его чувствительности к антибиотикам.
Локализация очага инфекции. Способность проникать в ткани (костную, суставную) или спинномозговую жидкость у всех антибактериальных препаратов различна. При абсцессах, а также в тканях с низким кровотоком достаточно трудно достичь высокого уровня антимикробной активности. Кроме того, эффект некоторых антибиотиков (например, аминогликозидов) снижается при низких значениях рН. В связи с этим абсцесс, возникающий внутри костной ткани или в спинномозговом канале, очень тяжело поддаётся лечению.
Чувствительность микроорганизмов. Streptococcus pyogenes высокочувствителен к действию бензилпенициллина, но другие бактерии, например, рода Acinetobacter и Pseudomonas. не восприимчивы к действию большинства антибиотиков, а потому подобрать эффективный препарат бывает достаточно сложно.
Вероятность возникновения аллергических реакций или побочных эффектов. Многие пациенты имеют в анамнезе наличие аллергических реакций к одному или более антибиотикам (наиболее чаще к пенициллину). В таких случаях обычно назначают альтернативное лечение. Возникновение аллергии — основное противопоказание не только к применению препарата, вызвавшего её, но и к назначению других родственных лекарств этой группы.
Противопоказание к использованию аминогликозидов — нарушение функции почек. Применение препаратов цефалоспоринового ряда ограничивается возрастом пациента, так как эти лекарственные средства повышают риск развития суперинфекции (например, в случае С. difficile).

Методы введения антибиотиков в организм при инфекциях
В настоящее время наиболее распространён приём препаратов внутрь (как при амбулаторном, так и при стационарном лечении). Кроме того, антибиотики можно применять местно (при кожных инфекциях), ректально (метронидазол для профилактики осложнений после хирургических операций) или вагинально (в виде пессариев). При тяжёлых инфекционных заболеваниях (септицемия и др.) для обеспечения терапевтического эффекта рекомендовано внутривенное введение антибактериальных препаратов.
Этот метод также показан пациентам, которые не могут принимать лекарства внутрь (например, при повторной рвоте). В педиатрии следует также учитывать вкусовые свойства антибиотиков. Кроме того, для многих пациентов большую роль играет кратность приёма и сложность режима лечения.
Многие пациенты имеют в анамнезе наличие аллергических реакций к одному или более антибиотикам (наиболее чаще к пенициллину).
Контроль антибактериальной терапии инфекции
Для контроля достижения и поддержания терапевтической дозы препарата, а также для снижения риска возникновения токсического эффекта при лечении антибиотиками необходимо наблюдение за состоянием пациентов. Это особенно важно в случаях, когда терапевтическая и токсическая дозы антибиотика отличаются незначительно. Перед внутривенным введением ванкомицина и аминогликозидов, а также по истечении часа после их введения необходимо измерять концентрацию препаратов в сыворотке крови.
Для обеспечения терапевтического эффекта и снижения риска интоксикации полученные результаты анализов должны соответствовать установленным нормам. Например, если концентрация высока, то дозу необходимо уменьшить. Кроме того, понизить уровень препарата в крови помогает снижение частоты его приёма. При приёме пролонгированных форм (когда для обеспечения терапевтического эффекта достаточно однократного приёма в сутки) анализы интерпретируют при помощи нормограммм и сравнивают результаты с общепринятыми нормами.
При лечении инфекций, вызванных частично устойчивыми микроорганизмами, также необходимо измерять концентрацию препаратов в сыворотке крови. Если рост бактерий ингибирует высокая концентрация антибиотика, то важно поддерживать её в сыворотке на постоянном уровне. Если инфекция возникает в труднодоступных местах (например, менингит, вызванный штаммами Pseudomonas), то содержание препарата можно измерить в спинномозговой жидкости.
Побочные эффекты антибиотиков
Наиболее распространённый побочный эффект при приёме антибиотиков — незначительные желудочно-кишечные расстройства. В исключительных случаях наблюдают тяжёлые аллергические реакции, приводящие к анафилактическому шоку или сывороточной болезни.
Желудочно-кишечный тракт при антибактериальной терапии. Антибактериальные препараты (особенно бета-лактамы) нарушают баланс нормальной микрофлоры кишечника, вызывая активный рост условно-патогенных микроорганизмов, таких, как род Candida. Таким образом, антибактериальная терапия может привести к острой диарее или более серьёзному осложнению — пневдомембранозному колиту.
Кожа при антибактериальной терапии. Кожные реакции могут быть различны: от лёгкой крапивницы или пятнисто-папулёзной эритематозной сыпи до мультиформной эритемы и крайне опасного синдрома Стивенса— Джонсона. В большинстве своём они не носят угрожающего характера и исчезают при отмене препарата.
Система кроветворения при антибактериальной терапии. У пациентов, принимающих хлорамфеникол или ингибиторы фолиевой кислоты, наблюдают дозозависимое угнетение функции костного мозга. При тяжёлых осложнениях вследствие лечения хлорамфениколом возникает апластическая анемия. Высокие дозы р-лактамных препаратов вызывают гранулоцитопению. Иногда при приёме антибиотиков развивается гемолитическая анемия. Большинство антибактериальных препаратов вызывают обратимую тромбоцитопению или угнетение функции костного мозга.
Мочевыводящая система при антибактериальной терапии. Нефротоксичность аминогликозидов обусловлена их способностью повреждать клетки проксимальных извитых канальцев почек. В группу риска входят пожилые пациенты, лица с заболеваниями почек, а также пациенты, принимающие помимо аминогликозидов другие нефротоксичные препараты (например, антибиотики тетрациклинового ряда).
Печень при антибактериальной терапии. Изониазид и рифампицин могут быть причиной развития гепатита, особенно если у пациентов ещё до приёма этих препаратов были заболевания печени. Другие препараты, связанные с развитием гепатита, — тетрациклины, эритромицин, пиразинамид, этионамид и реже ампициллин или фторхинолоны. Кроме того, при приёме тетрациклинов или высоких доз фузидовой кислоты возникает холестатическая желтуха.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Назначение антибактериальных препаратов требует соответствующих знаний клинической фармакологии и изучения основ сравнительно новой дисциплины -- клинической микробиологии. Только тогда терапию инфекционных заболеваний можно будет отнести к истинно этиот
Назначение антибактериальных препаратов требует соответствующих знаний клинической фармакологии и изучения основ сравнительно новой дисциплины -- клинической микробиологии. Только тогда терапию инфекционных заболеваний можно будет отнести к истинно этиотропному виду лечения, в отличие от других видов фармакотерапии. Сталкиваясь с проблемой выбора антибактериального препарата, врач должен определить ряд факторов, связанных с пациентом (макроорганизм), возбудителем заболевания (микроорганизм) и с лекарственным препаратом.
 |
В настоящее время проблема рациональной антибиотикотерапии представляет серьезные трудности и остается одной из самых сложных в практической фармакотерапии. Это связано во-первых, с огромным количеством существующих и вновь создаваемых лекарственных препаратов антибактериального действия (только одних цефалоспоринов известно около 2 тыс. соединений), во-вторых, изменением спектра возбудителей инфекционных заболеваний, а также увеличением и распространением их резистентности.
Следует отметить, что около 30-40% госпитальных больных терапевтического профиля нуждаются в проведении антибактериальной терапии и, по данным зарубежной статистики, 45-50% из них получают неадекватную терапию. По-видимому, это обусловлено тем, что для правильного выбора антибактериального препарата необходимо располагать не только данными анамнеза и результатами обследования конкретного пациента, но также уметь интерпретировать и применять на практике существующие представления о вероятном патогенном микроорганизме, что принципиально отличает антибактериальную терапию от фармакотерапии других видов.
Из клинической практики хорошо известно, что показанием для назначения антибактериальных препаратов часто служит повышение температуры, необъяснимая слабость, утомляемость и некоторые другие, неспецифические признаки инфекционных заболеваний. В то же время причиной данной симптоматики могут быть и иные, не связанные с инфекцией заболевания, такие как ревматизм, аутоиммунные заболевания, опухоли, естественно не требующие назначения антибактериальных препаратов. Но и не редки случаи, когда в амбулаторных условиях при определении диагноза ОРВИ уже подразумевается вирусная этиология заболевания, что тем не менее не ограничивает применение антибактериальных препаратов. Их назначение при вирусной природе заболевания объясняется необходимостью профилактики присоединения бактериальной инфекции, однако это лишено каких-либо разумных обоснований. Говорить о целесообразности подобной профилактики можно лишь в случае крайне тяжелых вирусных заболеваний, в том числе гриппа, при тяжелой сопутствующей патологии, когда врач вправе ожидать у больного значительного снижения иммунитета. В случае легкого и среднетяжелого течения ОРВИ назначение антибиотиков и других антибактериальных препаратов может не только оказаться бесполезным, но и причинить больному вред. Таким образом, поводом для назначения антибактериальных препаратов должно служить наличие инфекционного процесса именно бактериального происхождения.
Сопутствующие заболевания и неблагоприятный социальный профиль больного. Сопутствующие хронические заболевания можно рассматривать как фактор дополнительной иммунодепрессии, чаще всего требующей коррекции проводимой антибактериальной терапии. Такие заболевания, как сахарный диабет, недостаточность кровообращения, хроническая почечная и/или печеночная недостаточность, особенно де- и субкомпенсированные формы, хронический алкоголизм, заболевания, требующие назначения стероидных препаратов, — типичные состояниями, влияющие и иногда определяющие течение инфекционного процесса. Больным с сопутствующими заболеваниями целесообразно рекомендовать антибактериальные препараты с большей активностью, особенно в отношении таких возбудителей, как E.coli, Proteus, Klebsiella, Staphylococcus, поскольку они чаще встречаются у данной категории пациентов. Асоциальный профиль больного (наркоманы, бомжи, проститутки и др.), длительный авитаминоз, угнетенный иммунитет извращают реакцию больного на инфекционный агент и значительно снижают эффективность традиционной антибактериальной терапии.
Таблица 1. Частота встречаемости возбудителей пневмонии у детей в зависимости от возраста.
Возраст больного. Влияние возрастного фактора при выборе антибактериального препарата определяется, с одной стороны, фармакокинетикой препарата, с другой – изменяющимся с возрастом спектром вероятной микрофлоры, вызывающей те или иные заболевания (табл. 1). Назначение некоторых лекарственных препаратов противопоказано детям и новорожденным в связи с недостаточностью ферментов печени: левомицетин может вызвать развитие острой сердечно-сосудистой недостаточности; сульфаниламиды — нарушение обмена билирубина, желтуху; тетрациклин и фторхинолоны — нарушение роста костной и хрящевой ткани. У пожилых и престарелых пациентов в связи с нарушением элиминации должно быть ограничено применение аминогликозидов и полимиксина. Возрастные изменения физиологии желудочно-кишечного тракта могут приводить к нарушению всасывания, метаболизма и других фармакокинетических процессов превращения лекарственных препаратов.
Среди свойств, характеризующих патогенный микроорганизм, следует особо отметить патогенность, чувствительность и резистентность. Под патогенностью и степенью ее выраженности — вирулентностью — подразумевают способность микроорганизма в результате инфекционного процесса вызывать развитие инфекционного заболевания. В связи с этим можно выделить две группы микроорганизмов: патогенные и условно-патогенные. К первой относятся некоторые виды Shigella, ко второй — Streptococcus группы A, E coli и ряд других. Следует отметить, что основная причина возникновения неспецифических инфекционных заболеваний в клинике внутренних болезней — именно условно-патогенная флора.
С точки зрения практикующего врача, больший интерес представляет чувствительность микроорганизмов и их резистентность к проводимой антибактериальной терапии. О чувствительных бактериях говорят тогда, когда рост возбудителя прекращается при создании терапевтических концентраций лекарственного препарата в крови. К резистентным относят те штаммы, антибактериальный эффект в отношении которых может быть достигнут лишь в условиях эксперимента при высоких концентрациях, неприемлемых для клинического применения. В случае когда группа или вид бактерий не чувствительны к антибактериальному препарату, говорят о так называемой природной резистентности (устойчивость кишечной палочки к пенициллину, грибов к антибиотикам, атипических бактерий к цефалоспоринам). Все другие случаи развития устойчивости, связанные с мутацией и селекцией таких микроорганизмов, относят к приобретенной резистентности. О первичной резистентности в этом случае говорят, когда она возникает до начала проведения антибактериальной терапии у конкретного больного (нарастающая резистентность пневмококка к пенициллину, гонококка к ампициллину, гемофильной палочки к цефаклору). Вторичная развивается непосредственно в процессе конкретного курса проводимой антибактериальной терапии (устойчивость респираторных патогенов к макролидам). Именно проблема резистентности требует ограничения необоснованно широкого использования антибактериальных препаратов, разработки стандартов и алгоритмов проведения антибактериальной терапии.
Таблица 2. Наиболее часто встречающиеся возбудители неспецифической инфекции в клинике внутренних болезней.
Последнее время в литературе особое внимание уделяется проблеме атипической инфекции и трудностям терапии заболеваний, вызываемых этими возбудителями. Еще 25—30 лет назад их удельный вес среди прочих патогенов был значительно ниже и не представлял серьезной проблемы. Сложности терапии такой инфекции (хламидия, микоплазма и легионелла) связаны с внутриклеточным расположением микроорганизмов, что диктует необходимость использования антибактериальных средств, проникающих внутрь клетки (например, тетрациклины, фторхинолоны, макролиды, в меньшей степени ко-тримоксазол). Однако следует отметить и тот факт, что реальный вес атипической флоры в этиологической структуре респираторных заболеваний не превышает 8—12% в течение календарного года. Если говорить об атипической инфекции как причине летальных исходов, то данная цифра не превышает 2—6% в год. В то же время в период эпидемий, описываемых каждые три-четыре года, частота такой инфекции достигает 25—35%. Хотя утверждать, что эти данные отражают истинную картину, трудно, так как на амбулаторном этапе микробиологические и серологические исследования, необходимые для этиологической диагностики, проводятся крайне редко.
По-видимому, именно в периоды верифицированной эпидемии, а также в соответствующие месяцы года следует внимательнее относиться к диагностике атипических инфекций (табл. 3).
Гр- бактерии
Выбор конкретного антибиотика должен строиться на основании следующих данных.
Таблица 3. Частота встречаемости наиболее вероятных респираторных патогенов в зависимости от времени года.
2. Накопление препарата в тканях призвано обеспечивать достаточную концентрацию антибиотика против конкретного возбудителя. Например, широко используемые в клинической практике пенициллин и ампициллин не создают достаточно высоких концентраций к основным респираторным патогенам в мокроте, придаточных пазухах носа и барабанной полости, что значительно ограничивает целесообразность их использования при лечении инфекций верхних и нижних дыхательных путей.
Таким образом, для адекватной антибиотикотерапии важно выбрать антибиотик, с одной стороны, действующий на верифицированного или вероятного возбудителя, с другой — накапливающийся в пораженном органе в необходимой концентрации.
4. Связь с белками для практического врача, как правило, не представляет большого интереса, хотя иногда знание этого параметра может оказаться необходимым. Связь с белками учитывается при определении терапевтической дозы препарата. В то же время при назначении двух и более лекарственных препаратов с высокой связью с белками дозу препаратов необходимо уменьшать. Рассмотрим случай одновременного использования цефтриаксона (связь с белками — 99%) и нестероидного противовоспалительного препарата — бутадиона (связь с белками — 97—98%). Терапевтическая доза бутадиона рассчитывается исходя из 1—2% активной фракции. При появлении цефтриаксона с высоким сродством к альбуминам плазмы значительно большая доля бутадиона (в норме не более 1—2% от общей сывороточной концентрации) высвободится из связи с белками. Это приведет к резкому повышению концентрации его свободной активной фракции в плазме, что, в свою очередь, грозит серьезными побочными эффектами.
 |
6. Элиминация препарата представляет интерес для практического врача с точки зрения возможного влияния других лекарственных средств на выведение антибактериального препарата и с позиции выбора препарата, элиминируемого через здоровый орган (например, при заболевании почек со сниженной функцией предпочтение следует отдавать препаратам с печеночной элиминацией).
- Оценка эффективности антибактериальной терапии
Оценка клинической эффективности антибактериальной терапии позволяет сориентироваться в отношении выбора антибиотика и рекомендовать его замену в случае недостаточного антибактериального эффекта. Оценка эффективности антибактериальной терапии должна проводиться у каждого больного не менее трех раз: вторые и третьи сутки с момента ее начала с целью убедиться в правильности выбора препарата; по окончании курса для решения вопроса об ее отмене и к 3-му месяцу — после ее окончания во избежание персистенции, рецидива инфекционного заболевания.
Для наиболее полной оценки эффективности антибактериальной терапии необходимо контролировать не только данные клинического состояния больного, но и результаты бактериологического исследования.
Смена антибактериального препарата, как указывалось выше, проводится на вторые-третьи сутки, однако при ургентной ситуации, а именно при крайне тяжелом состоянии больного, такую замену можно произвести уже к концу первых суток.
Учитывая объективные трудности при выборе антибактериальных препаратов, а также недостаточный уровень подготовки врачей в вопросах практической химиотерапии, весьма целесообразной может оказаться разработка необходимых стандартов терапии инфекционных заболеваний на первичных этапах лечения. Это позволит определить оптимальный перечень наиболее эффективных и безопасных антибактериальных препаратов, контролировать сложный процесс антибиотикотерапии и создать условия для профилактики бактериальной резистентности. В то же время процесс выбора антибактериальной терапии — это творческий процесс, несомненно предполагающий определенный уровень компетентности врачей в вопросах практической химиотерапии.
Читайте также:

