Рал это в инфекциях
Обновлено: 24.04.2024
Антитела (другое название – иммуноглобулины) – это специальные белки, которые вырабатываются и (или) продуцируются плазматическими клетками.
Что делают иммуноглобулины?
Иммуноглобулины образуются в ответ на попадание в организм чужеродных бактерий или вирусов. Они взаимодействуют с антигеном (специфическим участком вредителя) и обезвреживают его.
Таким образом наш иммунитет стоит на страже нашего здоровья.
Какие классы иммуноглобулинов существует?
Выделяют 5 классов иммуноглобулинов, некоторые из которых содержат подклассы.
IgA – секретируются на поверхности эпителия и присутствуют в слюне, слезе, на поверхности слизистых.
IgM – обнаруживается при первичном попадании антигена. Указывает на острый инфекционный процесс у человека.
IgG – основной класс иммуноглобулинов, защищающий от вирусов, бактерий, токсинов.
IgD – обнаруживают на поверхности развивающихся B-лимфоцитов. Функция не установлена.
IgE – секретируются при аллергической реакции немедленного типа.
Методы определения антител к коронавирусу
Существуют два метода определения иммуноглобулинов к коронавирусу в организме человека – ИФА и ИХА.
Иммуннохроматографический анализ – это качественный метод определения иммуноглобулинов классов М и G.
Качественный метод – это метод, позволяющий только определить наличие антител в организме. Иными словами, ответить на вопрос – есть они или нет.
Иммуноферментный анализ – это количественный метод определения иммуноглобулинов.
Количественный метол – не просто говорит о наличии антител, но и показывает их количество в единице объема крови.
Для анализов проводят забор венозной крови, следовательно, подготовка к процедуре стандартная:
Проводить исследование на пустой желудок (не есть за 8 часов до процедуры).
Воздержаться от питья воды за час до забора крови.
Для курильщиков – не курить за 2 часа до процедуры.
Что выбрать – качественный или полуколичественный анализ?
Для чего проводится качественный и количественный анализ?
Качественный анализ позволяет ответ на 2 вопроса:
Как давно болел?
Полуколичественный тест позволяет ответить на эти вопросы, а также определить количество иммуноглобулинов в организме.
Для чего определять количество иммуноглобулинов?
Определение количества антител позволяет определить, сформирован ли долговременный иммунитет. Именно он защищает на организм от повторного заболевания коронавирусом.

Показания к проведению исследования
Показаниями к проведению анализа является:
Наличие симптомов общего недомогания. В этом случае тестирование проводится для подтверждения диагноза.
Медицинская микробиология:
Методика проведения реакции латекс-агглютинации (РЛА)
Реакция латекс-агглютинации (РЛА) является одним из видов реакции агглютинации, в которой в качестве носителя антигена или антитела используются синтетические полимерные (латексные) частицы.
Обычно иммунологически активный компонент адсорбируется на полимерных частицах (микросферах) за счет физического взаимодействия между молекулами антигенов (или антител) и поверхностью частиц, но может быть использовано и ковалентное связывание через соответствующие активные группы.
Такие сенсибилизированные латексные носители в присутствии гомологичного иммунореагента образуют агглютинат, хорошо видимый невооруженным глазом.
Впервые метод реакции латекс-агглютинации (РЛА) был предложен Severin V. и соавт. в 1956 г. и использован для определения ревматоидного фактора при помощи полистирольных латексных микросфер с узким распределением но размеру частиц, сенсибилизированных иммуноглобулином человека. Сообщалось, что взаимодействие антигенов, находящихся в сыворотке крови пациента, с иммуноглобулином, адсорбированным на поверхности гидрофобных микросфер суспензии, привело к агглютинации полимерных частиц и образованию крупных агломератов, легко различимых невооруженным глазом. В последующие годы метод РЛА получил широкое распространение как в клинических диагностических тестах, так и в биохимических и иммунологических исследованиях.
В настоящее время РЛА применяют как для определения количества антител к конкретному возбудителю, так и для диагностики наличия в биологических жидкостях бактериального, паразитарного или вирусного агента (антигена).
Для получения диагностических препаратов используют полистирольные латексные частицы, несущие на своей поверхности различные функциональные группы (карбоксильные, эпоксидные, альдегидные и др.) и полиакролеиновые, имеющие на своей поверхности альдегидные функциональные группы, способные вступать в реакцию с первичными аминогруппами. Все латексные диагностикумы (ЛД) по принципу работы делятся на две большие группы: антигенные и антительные. Антигенные ЛД на поверхности частиц латекса несут антигены возбудителя, антительные—антитела к конкретному возбудителю или группе возбудителей и используются для обнаружения последних в любых биологических жидкостях.
В нашей стране и за рубежом в настоящее время выпускают латексные коммерческие диагностические тест-системы, предназначенные как для обнаружения и идентификации микроорганизмов, так и для определения растворимых антигенов в биологических жидкостях.
Объектами исследования РЛА могут быть сыворотка крови, слюна, молозиво, моча, фекалии и др.
РЛА с использованием латексных диагностикумов ставятся как в планшетах для иммунологических реакций, так и на предметном стекле. Последние занимают мало времени и легко учитываются; они незаменимы при работе в полевых условиях и чаще всего используются для быстрого скрининга на наличие какого-либо заболевания.
РЛА особенно удобна для применения в качестве сигнального экспресс-теста для выявления антигенов в первые дни заболевания, когда еще не успел развиться иммунный ответ организма, и серологическая диагностика не дает положительного результата. К преимуществам РЛА можно отнести следующие:
— простота и быстрота выполнения;
— высокая специфичность и чувствительность;
— отсутствие необходимости в сложной аппаратуре для постановки и визуальный учет результатов;
— сведение к минимуму количества компонентов реакции;
— возможность получения инертных носителей с заданными характеристиками.
а) Постановка РЛА на предметном стекле с целью обнаружения антигена. На чистую обезжиренную стеклянную пластинку наносят по 1 капле (10-20 мкл) латексного диагностикума и исследуемого материала. В качестве контроля используют:
• культуру бактерии + гомологичный латексный диагностикум (положительный контроль);
• питательную среду для культивирования возбудителя + латексный диагностикум (отрицательный контроль);
• предметные стекла или специальные тест-пластины.
Компоненты в каждой капле тщательно перемешивают углом предметного стекла, используя каждый раз новый угол.
Учет результатов реакции проводят визуально через 2-3 мин после смешивания компонентов. В случае положительной реакции отмечают образование агглютинатов и просветление фона. При отрицательном результате реакции суспензия остается гомогенной, без хлопьев агглютината и без просветления фона.
Появление агглютината позднее, чем через 7-10 мин после постановки реакции, расценивают как неспецифический результат.

Результаты реакции латекс-агглютинации на предметном стекле:
а — положительная реакция; б — отрицательная реакция (контроль).
б) Постановка РЛА с целью выявления антител в планшетах для иммунологических реакций. Для постановки реакции необходимы:
— диагностикум латексный антигенный;
— сыворотка крови обследуемых лиц;
— фосфатно-солевой буферный раствор (ФСБ), pH 7,2-7,4 или изотонический раствор натрия хлорида в качестве электролита;
— планшеты для иммунологических реакций с 96 лунками с круглым дном;
— микропипетки.
В один ряд лунок планшета (с первой по шестую) вносят по 0,05 мл ФСБ. Затем в первую лунку добавляют равное количество (0,05 мл) исследуемой сыворотки больного в разведении 1:25 (0,1 мл цельной сыворотки + 2,4 мл ФСБ), перемешивают и путем последовательных переносов титруют до пятой лунки. Из последней удаляют 0,05 мл смеси, чтобы количество разведенной сыворотки было одинаковым во всех лунках. Затем вносят по 0,05 мл 0,05% раствора известного латексного диагностикума в лунки 1-6. Контролем диагностикума на отсутствие спонтанной агглютинации служит шестая лунка, в которой содержится только диагностикум и ФСБ. Схема постановки такой реакции представлена в таблице ниже.
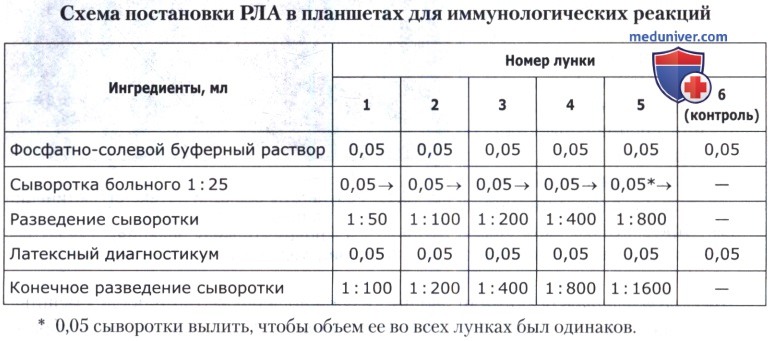
Учет результатов начинают с контролей. Затем оценивают диагностические реакции по четырехплюсовой системе:
++++ резко положительная реакция (полная агглютинация); все частицы латекса равномерно выстилают дно лунки в виде перевернутого зонтика с неровными краями;
+++ положительная реакция с неполной агглютинацией; частицы латекса покрывают дно лунки в виде слегка спавшегося перевернутого зонтика, в центре которого просматривается небольшое кольцо частиц, не вступивших в реакцию;
++ частичная агглютинация. Агглютинат в виде широкой зоны вокруг четкого кольца частиц латекса, не вступивших в реакцию;
+ слабая сомнительная агглютинация; частицы латекса, не вступившие в агглютинацию, оседают на дно лунки в виде широкого кольца, вокруг которого узкий ободок агглютината;
- отрицательная реакция; осадок частиц латекса в центре лунки в виде компактного диска (пуговки).
Титром антител считают разведение сыворотки, в котором РПГА положительна не менее чем на +++ в самом большом разведении при полном отсутствии агглютинации в отрицательном контроле.
Впервые метод реакции латекс-агглютинации (РЛА) был предложен в 1956 году и использован для определения ревматоидного фактора с помощью полистирольных латексных микросфер с узким распределением частиц по размеру, покрытых гамма-глобулином человека. Сообщалось, что взаимодействие антигенов, находящихся в сыворотке крови пациента, с гамма-глобулином, адсорбированным на поверхности гидрофобных микросфер суспензии, привело к агглютинации полимерных частиц и образованию крупных агломератов, легко различимых невооруженным глазом. В последующие годы метод РЛА получил широкое распространение, как в клинических диагностических тестах, так и в биохимических и иммунологических исследованиях. Особенно широкое применение РЛА наблюдается в инфекционной патологии.
Описание метода реакции латексной агглютинации
Реакция латексной агглютинации используется в клинической химии в течение многих лет как простой, быстрый и недорогой метод определения белков, гормонов и других биологически активных соединений. Белки, являясь поливалентными антигенами, вступают в реакцию с антителами с образованием иммунных комплексов, или агглютинатов. Как правило, иммунные комплексы слабо визуализируются не только невооруженным глазом, но и с помощью фотометрических методов. Использование дисперсионных полимеров (латексов), сенсибилизированных антителами или антигенами, позволяет значительно облегчить детекцию реакции агглютинации, которая в этом случае называется реакцией латексной агглютинации.
Носители для метода реакции латексной агглютинации
Наиболее часто для получения диагностических препаратов используют полистирольные микросферы, несущие на своей поверхности различные функциональные группы (карбоксильные, эпоксидные, альдегидные и др.) и полиакролеиновые микросферы, содержащие на своей поверхности альдегидные функциональные группы, способные вступать в реакцию с первичными аминогруппами, образуя основание Шиффа Применение инертных синтетических носителей для иммобилизации антител (или антигенов) является широко распространенным методическим подходом в иммуноанализе.
Полимерные микросферы с узким распределением частиц по размерам и функциональными группами на поверхности представляют большой интерес для биологии и медицины, в частности для использования в качестве носителей биолигандов вместо эритроцитов при создании диагностических тест-систем на различные виды заболеваний. Замена эритроцитов на полимерные микросферы является решением проблем, связанных с недостатками эритроцитарных диагностикумов, а именно:
- 1) эритроциты получают из крови животных, содержание которых трудоемко и дорогостояще
- 2) эритроциты содержат много антигенных детерминант, которые реагируют с компонентами сывороток человека и животных, что обуславливает протекание неспецифических реакций и приводит к ложноположительным результатам
- 3) свойства эритроцитов часто зависят от источника и способа их выделения
- 4) диагностикум на основе клеток одних и тех же животных не дает постоянный титр и после длительного хранения не сохраняет прежнюю степень агглютинации.
Для замены эритроцитов, полимерные микросферы должны обладать определенными свойствами: скорость седиментации 3 – 8 мм/час, диаметр частиц порядка 5 мкм., агрегативная устойчивость в воде и буферных растворах высокой ионной силы, наличие в поверхностном слое функциональных групп, доступных для ковалентного связывания с функциональными группами белков.
Одним из преимуществ применения полимерных микросфер в качестве носителей биолигандов является возможность получения полимерных частиц с заданным комплексом свойств. Для устранения проблем, связанных с применением эритроцитов, используются полимерные микросферы с определенными свойствами:
- 1) монодисперсное распределение по размерам
- 2) сферическая форма
- 3) устойчивость к электролитам в широком интервале pH
- 4) способность присоединять биологические макромолекулы без значительного изменения их функциональной активности
- 5) воспроизводимые свойства и характеристики
Однородность частиц по размерам позволяет достаточно точно определить площадь поверхности носителя и установить степень ее покрытия биолигандом, кроме того, она обусловливает сходный характер их поведения во время агглютинации, что облегчает “прочтение” результатов реакции латекс-агглютинации(РЛА). Впервые, для создания диагностических тест-систем были использованы полистирольные микросферы. Полистирол, благодаря своей оптической прозрачности, высокой адсорбционной способности, прочности и хорошей воспроизводимости свойств, успешно используется в качестве носителя.
Главной проблемой полимерных микросфер, используемых при создании диагностикумов является неспецифическая агглютинация(частицы отрицательного контроля образуют ореол из частиц вокруг центра дна лунки) , причины которой и факторы ее вызывающие во многом еще не ясны. Наибольшее распространение в качестве способов уменьшения неспецифического связывания нашли значительное разбавление образцов, добавление детергентов, экранирование поверхности частиц низкомолекулярными белками. Однако применение данных методов чаще всего приводит к уменьшению чувствительности и точности реакции латексной агглютинации.
При тщательной отработке методики получения латексных диагностикумов, соблюдении оптимальных условий их приготовления и постановки самой реакции, РЛА может приближаться к самым современным иммунологическим методам.
РЛА сходна с РНГА по принципу сорбции антител на поверхности более крупных частиц.
Преимущества метода РЛА
Реакция РЛА — экспресс-метод диагностики инфекционных болезней (время проведения — до 10 мин, возможно обнаружение антигена в небольшом объёме исследуемого материала). Для постановки РЛА используют стеклянные или темнопольные пластины.
- - высокую специфичность и чувствительность;
- - отсутствие необходимости в сложной аппаратуре для постановки и реакции и регистрации результатов;
- - сведение до минимума количества компонентов реакции;
- - возможность получения инертных носителей с заданными характеристиками.
Относительная дешевизна метода реакции латексной агглютинации (РЛА), простота и возможность постановки теста практически в любых условиях делают его очень удобным как при одиночных, так и при массовых исследованиях даже в небольших клинических мало оборудованных лабораториях.
Применение метода реакции латексной агглютинации
РЛА применяют для индикации антигенов Streptococcus pneumoniae, Haemophilus influenzae типа b( Neisseria meningitidis в СМЖ, выявления стрептококков группы А в мазках из зева, в диагностике сальмонеллёзной инфекции, иерсиниозов и других заболеваний. Чувствительность метода — 1-10 нг/мл (103-106 бактериальных клеток в мл). Недостаток метода — возможность получения артефактов, особенно в присутствии ревматоидных факторов и продуктов фибринолиза плексы с участием комплемента — преципитаты. Простейший пример качественной реакции преципитации — образование непрозрачной полосы преципитации в пробирке на границе наслоения антигена на иммунную сыворотку (реакция кольцепреципитации). Реакцию преципитации проводят в гелях агара, агарозы. Их используют для выявления и изучения свойств разнообразных антигенов и антител.
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере ВЭБ и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икоса-дельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека. По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (ВПГ-1, ВПГ-2, ВВЗ, ЦМВ, ВЭБ, ВГЧ-6, ВГЧ-8). Доказаны воздушно-капельный, контактный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции. Таким образом, источником герпетической инфекции является человек, инфицированный вирусом герпеса.
ВПГ – наиболее известные представители герпес-вирусов, так как вызывают поражения практически у каждого человека. Имеются две разновидности ВПГ – ВПГ-1 и ВПГ-2, они обладают генетическим сродством (примерно 50% их ДНК схожи), но различаются антигенным свойством (различие в строении наружной мембраны). Ранее считалось, что штаммы ВПГ-1 чаще удается выделить при поражении кожи лица (лабиальный герпес), верхних конечностей, а штаммы ВПГ-2 – при генитальной локализации высыпаний. В настоящее время установлено, что несмотря на то что ВПГ-2 играет лидирующую роль в герпетическом поражении аногенитальной области, серотип ВПГ-1 при генитальном герпесе стал обнаруживаться все чаще.
Патогенез
Образование антител к оболочечным структурам вируса и мембранам пораженных им клеток является лишь первым этапом в создании организмом защиты от ВПГ [5–9]. Гуморальные механизмы иммунитета не могут полностью предупредить активацию латентного ВПГ и возникновение рецидивов заболевания, развивающихся на фоне значительного содержания специфических к возбудителю антител [5]. В связи с этим диагностическое и прогностическое значение гуморального иммунитета при герпетической инфекции не вызывает сомнения. При этом его контролирующий эффект, выражающийся в способности предупреждать обострения заболевания, сведен к минимуму. Так, C.Lopes и R.O’Relly (1977 г.), наблюдая за больными со злокачественными опухолями, получавшими иммуносупрессивную терапию (цитостатики, глюкокортикостероиды), подавлявшую в основном Т-клеточный иммунитет, отмечали нарастание тяжести течения простого герпеса с частым переходом в генерализованные формы.
L.Rasmussen (1974 г.) указал на связь частых рецидивов герпетической инфекции с низкой интерфероносинтезирующей способностью лейкоцитов. Позднее было установлено, что содержание интерферона (ИФН)-a в сыворотке крови, а также способность к продукции лейкоцитами ИФН-a in vitro у больных ВПГ снижены по сравнению с показателями здоровых доноров в 4–5 раз. Снижение цитотоксичности NK-клеток (нормальных киллеров) определяется в основном в период рецидива, и уровень цитотоксичности близок к норме во время ремиссии [10]. Повышение выработки лейкоцитами ИФН-a происходит главным образом в ответ на заражение или обострение хронической инфекции. В связи с этим ему отводится ведущая роль в естественном иммунитете при купировании клинических проявлений вирусных заболеваний [6, 7, 11]. ИФН-a (лимфоцитарный) имеет решающее значение в предотвращении рецидивов инфекций, вызванных хронически персистирующими возбудителями [6, 7, 12]. Наряду с высокой цитотоксической активностью NK-клетки сами способны продуцировать лимфокины (ИФН-g) и цитокины (фактор некроза опухоли – ФНО). Их также относят к клеткам, осуществляющим контроль иммунной клеточной дифференцировки [5, 13, 14].
Клиническая картина
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах: выявление вируса per se (электронная микроскопия); выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках); выявление и идентификация вирусов с помощью антител (метод флюоресцирующих антител, иммуноферментный анализ – ИФА, реакция агглютинации латекса – РАЛ, иммуноблот – ИБ, реакция нейтрализации– РН, реакция связывания комплемента – РСК); выявление и идентификация нуклеиновых кислот (метод полимеразной цепной реакции – ПЦР, молекулярная гибридизация – МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить герпес-вирусы или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпесвирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке. Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ. Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из разных клеточных культур. Для обнаружения вируса герпеса используют молекулярно-биологические методы: ПЦР и реакцию МГ, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение
Основной целью лечебных мероприятий является: а) подавление репродукции ВПГ в период обострения; б) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции; в) предотвращение развития или восстановление тех нарушений, которые вызывает активация ВПГ в организме.
Наиболее перспективным направлением как в лечении первичного эпизода или рецидива ВПГ, так и профилактики герпес-вирусной инфекции является противовирусная химиотерапия с использованием ациклических нуклеозидов – высокоспецифичных препаратов, обладающих доказанным противовирусным эффектом. Такая этиопатогенетическая терапия является мировым стандартом лечения герпетической инфекции [15–20]. Уникальность противогерпетического действия ациклических нуклеозидов обусловлена несколькими моментами. Во-первых, ациклические нуклеозиды активируются специфическим ферментом герпес-вирусов, что обусловливает их высочайшую избирательность по отношению к ВПГ без вмешательства в биохимию свободных от вируса клеток. Во-вторых, тимидинкиназа (гуанилаткиназа) герпес-вирусов связывается с химиопрепаратами в тысячу раз быстрее, чем клеточная, что приводит к накоплению действующего вещества исключительно в инфицированных клетках и объясняет отсутствие мутагенных, тератогенных, цитотоксических свойств даже при длительном приеме. В-третьих, ДНК-полимераза герпес-вирусов всегда ошибочно включает фосфорилированные ациклические нуклеозиды в концевые участки синтезируемых новых вирусных ДНК вместо естественного дезоксигуанозинтрифосфата, в результате чего блокируется репликация ВПГ [21–23].
В настоящее время в группу ациклических нуклеозидов входят: ацикловир, валацикловир и фамцикловир (см. таблицу).
Основные группы антигерпетических препаратов*
Первым из группы ациклических нуклеозидов был создан ацикловир. Механизм действия препарата основан на нарушении репликации вируса посредством образования ацикловира трифосфата из тимидинкиназы ВПГ в инфицированных клетках. Однако недостатком препарата стала низкая биодоступность ацикловира и вытекающая отсюда необходимость многократного приема в течение 1 сут строго через каждые 4–5 ч.
Фамцикловир трансформируется в организме в активное противовирусное соединение – пенцикловир. Его биодоступность после перорального приема составляет 77%, профиль безопасности близок к ацикловиру. Однако фамцикловир имеет пока малый опыт применения в клинической практике.
Клиническая фармакокинетика и фармакодинамика
Доказанная эффективность
В настоящее время существует два варианта терапии ВПГ с использованием ациклических нуклеозидов: эпизодическая (терапия первичной герпетической инфекции или ее рецидива) и превентивная (супрессивная). Многочисленными наблюдениями показано, что применение валацикловира в дозе 500 мг 2раза в сутки в течение 5 дней значительно уменьшает дискомфорт в зоне поражения, сокращает время рецидива и период вирусовыделения. Длительную терапию рекомендуют людям с частыми рецидивами.
Прием валацикловира в дозе 500мг 1 раз в сутки ежедневно в течение 4–12 мес предотвращает рецидивы заболевания (они становятся достаточно редкими, а у некоторых пациентов возможна ремиссия в течение нескольких лет) и обеспечивает психологическое преимущество над лечением, проводимым во время обострений. Впоследние годы во всем мире широкое применение нашли методики коротких курсов супрессивной терапии – эпизодическая супрессивная терапия, когда лечение назначается на определенный период (например, на период отпуска, экзаменов, косметических или стоматологических процедур). Несмотря на необходимость при супрессивной терапии длительного приема препарата, доказано, что валацикловир обладает оптимальным профилем безопасности (противопоказания связаны с жизнеугрожающими состояниями или тяжелыми инфекциями, побочные эффекты встречаются редко).
Другие показания
Кроме лечения орофациального и генитального герпеса, как впервые выявленного, так и рецидивирующего, препарат Валвир может использоваться в профилактике инфицирования генитальным герпесом здорового партнера, если его принимать в качестве супрессивной терапии в сочетании с использованием барьерной контрацепции; профилактике инфекции ЦМВ, возникающей при трансплантации органов.
Противопоказания
Противопоказаниями являются: клинически выраженные формы ВИЧ-инфекции при содержании СD4+-лимфоцитов менее 100 на мкл; трансплантация костного мозга; трансплантация почки; детский возраст (до 12 лет при ЦМВ, до 18лет – по остальным показаниям); повышенная чувствительность к валацикловиру, ацикловиру и другим компонентам препарата. С осторожностью следует назначать препарат при печеночной недостаточности (в высоких дозах), почечной недостаточности, при беременности и в период лактации.
Побочные эффекты
При примении Валвира из побочных реакций возможны головная боль, тошнота, реже развитие лейкопении, апластической анемии, лейкопластического васкулита, тромботической тромбоцитопенической пурпуры, повышение уровня печеночных ферментов, развитие острой почечной недостаточности и неврологических нарушений. Со стороны дыхательной системы – иногда диспноэ. Со стороны кожи и подкожной клетчатки – иногда высыпания, включая проявления фоточувствительности; редко зуд. Возможно (очень редко) развитие крапивницы, ангионевротического отека.
Лекарственное взаимодействие
Циметидин и пробенецид после приема 1 г валацикловира повышают AUC ацикловира, снижая его почечный клиренс (однако коррекции дозы валацикловира не требуется из-за широкого терапевтического индекса ацикловира). Необходимо соблюдать осторожность в случае одновременного применения валацикловира в высоких дозах (4 г/сут и выше) и лекарственных средств, которые конкурируют с ацикловиром за путь элиминации (последний элиминируется с мочой в неизмененном виде в результате активной канальцевой секреции), поскольку существует потенциальная угроза повышения в плазме уровня одного или обоих препаратов или их метаболитов. При одновременном применении ацикловира с микофенолатом мофетила было отмечено повышение AUC первого и неактивного метаболита второго. Необходимо также соблюдать осторожность при сочетании валацикловира в высоких дозах (4 г/сут и выше) с препаратами, влияющими на функции почек (например, циклоспорин, такролимус).
Заключение
Специфическое лечение необходимо начинать как можно раньше после появления первых симптомов заболевания. Применение ациклических нуклеозидов сокращает длительность эпизода и уменьшает остроту симптомов. Решение о необходимости применения того или иного препарата принимается совместно с пациентом, исходя из удобства применения и стоимости препарата, так как ни один из препаратов не имеет преимущества в эффективности воздействия на заболевание [25].
Реакция агглютинации латекса (РАЛ), или реакция латекс-агглютинации, разработана давно, однако она не нашла достаточно широкого применения в медицине и в ветеринарии.
Тем не менее усиливающаяся тенденция использовать в качестве носителей антигенов и антител инертные синтетические материалы привела к оживлению интереса к РАЛ и широкому изучению возможностей ее применения.
Принцип метода. Механизм РАЛ аналогичен РИГА, в которой используют сенсибилизированные антигенами или антителами эритроциты человека или животных. Для постановки РАЛ применяют сенсибилизированные частицы полистирольного латекса, которые в присутствии гомологичного реагента склеиваются. Обычно эта реакция проходит очень быстро (3…8 мин), что позволяет применить ее в качестве экспресс-метода для выявления антигенов и антител.
Преимущества РАЛ в том, что частицы латекса в отличие от эритроцитов не имеют перекрестно реагирующих антигенов, поэтому она специфичнее РИГА.
Материалы и реагенты. 1. Суспензия латекса. Для приготовления диагностикумов обычно используют частицы латекса диаметром 0,81…1 мкм. При применении более крупных частиц диаметром 0,22…0,3 мкм затруднен учет реакции и технологический процесс получения диагностикумов резко усложняется, а частиц более 1 мкм хотя не влияет на активность латексных диагностикумов, но существенно увеличивает частоту неспецифических реакций.
Для постановки РАЛ лучше использовать очищенные латексы с гомогенными частицами правильной сферической формы. Густота суспензии латекса обычно составляет 1 %, но может достичь в отдельных случаях 1,3…1,4 %.
3. Антитела. Для сенсибилизации частиц латекса пригодны гипериммунные сыворотки, полученные при иммунизации лабораторных животных (кроликов, крыс, мышей и др.). Повышению специфичности РАЛ и уменьшению числа ложноположительных и перекрестных реакций способствует применение очищенных иммуноглобулиновых фракций.
Методика исследования. Основные этапы постановки РАЛ. В настоящее время РАЛ обычно ставят на стеклянных или полистироловых пластинках, используя коммерческие диагностикумы или препараты. Реже применяют пластинки с лунками для постановки РИГА или пробирочный вариант реакции. Манипуляции выполняют в определенной последовательности.
1. Делают ряд серийных разведений исследуемого материала. Сыворотки крови необходимо предварительно прогреть в течение 30 мин при 56 °С или 20 мин при 60 °С. При постановке РАЛ на пластинках для РИГА при разведении материала используют петли микротитратора. На плоские ровные пластины наносят по одной капле соответствующих разведений.
2. Добавляют к каждому разведению равный объем суспензии сенсибилизированного латекса. Смешивают 1 каплю исследуемого материала и диагностикум, в лунки вносят по 15, 25 или 50 мкл ингредиентов реакции.
При постановке РАЛ в пробирочном варианте используют 0,25 мл исследуемого материала и 0,05 мл (или 0,1 мл) диагностикума.
3. Помещают пластинки на вращающийся столик или в шуттель-аппарат на 3…5 мин, после чего производят регистрацию результатов реакции.
Учет результатов. Независимо от вида диагностикума и количества антител (антигена) в исследуемом материале результаты РАЛ могут быть учтены уже через несколько минут после смешивания реагентов. При наличии в исследуемом образце искомого микроорганизма склеивающиеся частицы латекса образуют агглютинат, хорошо видимый невооруженным глазом. Можно использовать лупы с небольшим увеличением. При отрицательных результатах реакции суспензия латекса остается гомогенно-мутной, без глыбок агглютината и участков просветления. При малой или низкой активности диагностикума, а также невысокой концентрации антигена пластинки лучше инкубировать при 37 °С, что несколько ускоряет образование агглютината.
Результат реакции оценивают по трехбалльной системе:
Ставят несколько контролей: 1) исходное разведение исследуемого материала + суспензия несенсибилизированного латекса (отрицательный контроль); 2) нормальная сыворотка, не содержащая антител + суспензия сенсибилизированного латекса (проверка специфичности диагностикума); 3) гомологичная иммунная сыворотка + суспензия сенсибилизированного латекса (проверка активности диагностикума).
При постановке РАЛ с антительными латексными диагностикумами в контрольных положительной и отрицательных реакциях используют соответствующий антигенсодержащий материал.
Техника приготовления диагностикумов. Сенсибилизация латекса антигенами. Для приготовления антигенного латексного диагностикума желательно иметь в распоряжении растворимые антигены. В этом случае хорошие результаты получают при использовании буферных растворов (например, глицинового или боратного с pH 8,2). В таком буфере готовят раствор антигена в концентрации 2,5…5,0 мг/мл к 1 объему суспензии латекса. Если раствор антигена приготовлен на изотоническом растворе натрия хлорида, то буфер добавляют к смеси латекс — антиген.
Сенсибилизацию проводят в течение 2 ч при 37 °С в термостате или (лучше) на водяной бане. По истечении этого времени сенсибилизированный латекс осаждают центрифугированием в течение 5…10 мин при частоте оборотов 2000…2500 мин -1 и ресуспензируют в этом же буферном растворе до получения 1%-й суспензии.
Сенсибилизация латекса антителами. Суспензию латекса смешивают с равным объемом иммунной сыворотки или очищенной гамма-глобулиновой фракции в соответствующем буферном растворе. Смесь инкубируют в течение 30 мин при комнатной температуре или при 37 °С, центрифугируют в течение 30 мин при частоте оборотов 3…5000 мин -1 и дважды промывают осадок 0,01 М трис-солянокислым буфером с добавлением 200 мг/л поливинилпирролидона. Сенсибилизированный латекс ресуспензируют в этом же буферном растворе с поливинилпирролидоном и 0,05 % азида натрия и хранят в холодильнике при 2…4 °С.
При выборе оптимальной дозировки антител для сенсибилизации латекса следует учитывать, что одна его частица диаметром 0,8 мкм может адсорбировать на своей поверхности до 7,5 ∙ 10 4 молекул гамма-глобулина.
Необходимо отметить, что во многом требуется предварительно эмпирическим путем подбирать оптимальные условия для получения высококачественного латексного диагностикума. Режим сенсибилизации зависит от сорта и размера частиц латекса, pH и вида буферных растворов и ряда других факторов.
Для уменьшения частоты ложноположительных результатов рекомендуется к готовой суспензии сенсибилизированных частиц латекса добавлять нормальную сыворотку того вида животного, который был использован для приготовления гипериммунной сыворотки.
Получение латексных диагностикумов с помощью белка А стафилококка. Применение для изготовления диагностикумов на основе частиц латекса, покрытых белком А стафилококка, позволяет использовать для сенсибилизации латекса любые иммунные сыворотки без какой-либо их предварительной обработки.
Раствор белка А (1 мг/мл) готовят на дистиллированной воде с добавлением 0,05 % азида натрия. Перед применением его разводят в 200 раз 0,1 М глициновым буфером (pH 8,2), содержащим 1 % хлорида натрия. Стандартную коммерческую суспензию латекса разводят в 15 раз изотоническим раствором хлорида натрия, смешивают с равным объемом разведенного раствора белка А, инкубируют при постоянном перемешивании в течение 2…4 ч при 20 °С, а затем 16…18 ч при 4 °С. Частицы латекса, покрытые белком А, осаждают центрифугированием при частоте вращения 6000 мин -1 в течение 30 мин и дважды промывают половинным объемом глицинового буфера с добавлением 0,02 % поливинилпирролидона. Полученную суспензию после добавления 0,05 % азида натрия можно хранить при 4 °С в течение 4 мес.
Иммунную сыворотку разводят до титра глициновым буфером и смешивают с равным объемом суспензии латекса, покрытого белком А. Инкубацию и промывку сенсибилизированного антителами латекса проводят по методике, описанной выше.
Эту же методику можно использовать и для сенсибилизации латекса гамма-глобулиновыми фракциями, выделенными из иммунных сывороток посредством их насыщения сульфатом аммония. В этом случае продолжительность сенсибилизации антителами частиц латекса, покрытых белком А, можно сократить до 2 ч, исключив длительный 2-й этап, проводимый при 4 °С. Приготовленный таким образом диагностический препарат в 4…16 раз активнее обычного антигельного латексного диагностикума.
Практическое использование. К сожалению, в практических ветеринарных лабораториях РАЛ практически не используют, несмотря на то что она по чувствительности и специфичности превосходит многие классические серологические методы.
Безусловные преимущества РАЛ: 1) простота постановки; 2) отсутствие какого-либо специального оборудования; 3) достаточно высокие чувствительность и специфичность.
Читайте также:

