Распространенность токсоплазмоза в россии
Обновлено: 19.04.2024
Токсоплазмоз - это паразитарное заболевание, характеризующееся поражением нервной системы, глаз, скелетной мускулатуры и мышцы сердца, а также увеличением лимфоузлов, печени и селезенки. Склонно к хроническому течению.
Распространенность токсоплазмоза в мире невероятно высока, в основном за счет стран Африки, а также Латинской и Южной Америки, в которых инфицированность населения доходит до 90%. Показатели в Европе и Северной Америке ниже – 25-50% населения.
Что провоцирует / Причины Токсоплазмоза:
Возбудитель токсоплазмоза Toxoplasma gondii относится к типу простейших (Protozoa), классу споровиков (Sporozoa), отряду кокцидий (Coccidia). Токсоплазмы подвижны и имеют форму дуги, арки или напоминают дольку апельсина. Встречаются также овальные и округлые формы. Тип движения у токсоплазмы скользящий.
Патогенез (что происходит?) во время Токсоплазмоза:
Жизненный цикл токсоплазмы включает стадии полового и бесполого размножения. Токсоплазмоз распространен во многих странах. Человек заражается от домашних животных, чаще всего от кошек, которые являются окончательным хозяином паразита. В их организме происходит половое размножение возбудителя. Больные токсоплазмозом животные выделяют паразитов с мочой, слюной, молоком. Человек является промежуточным хозяином. Заражение происходит алиментарным (наиболее часто), капельным, через поврежденные кожу и слизистые оболочки, трансмиссивным (при укусе членистоногих) путем. Возможно, внутриутробное заражение при проникновении паразита от матери к плоду через плаценту. Токсоплазмой инфицированы от 50 до 80% взрослого населения.
Пути заражения токсоплазмозом
Заражение человека происходит при употреблении мясных продуктов и яиц, не прошедших достаточную термическую обработку. Не исключена возможность заражения при попадании возбудителя на слизистые оболочки и поврежденные кожные покровы, трансмиссивным и др. путём. Наблюдается и внутриутробное заражение.
Факторы, которые могут способствовать появлению в организме паразита и повышают риск возникновения токсоплазмоза:
• Дотрагиваться грязными руками до рта после контакта с землей, после уборки кошачьего туалета, или любого другого контакта с кошачьими экскрементами.
• Принимать в пищу сырое или не до конца приготовленное мясо, особенно свинину, мясо ягненка или оленину.
• Прикасаться ко рту после контакта с сырым или непрожаренным/непроваренным мясом.
• Пересадка органов или переливание крови (очень редко).
• Если женщина беременна, и она заразилась токсоплазмозом, инфекция может от нее передаться ребенку, что может привести к серьезным последствиям.
В организме человека токсоплазмы размножаются в кишечнике, распространяются лимфогенным и гематогенным путем. Фаза лимфогенного заноса (увеличиваются и воспаляются лимфатические узлы) сменяется гематогенной диссиминацией. Стадия нахождения паразита в крови короткая (несколько дней). Попадая во внутренние органы, токсоплазмы вызывают в них воспалительные явления. Особенно часто поражаются нервная система, сетчатка, печень, миокард. В этих органах токсоплазмы находятся внутриклеточно и экстрацеллюлярно. Скопления паразитов называются псевдоцистами. Токсоплазмы способны образовывать цисты в тканях, вызывая состояние латентной инфекции. Активизация паразита происходит при неблагоприятных для макроорганизма условиях и снижении его иммунологической реактивности. В патогенезе токсоплазмозного поражения нервной системы имеют значение очаговые воспалительные явления (некротизирующий энцефалит), дисциркуляторные нарушения, связанные с васкулитом, обструкция ликворных путей, приводящая к гидро- и микроцефалии.
Наиболее грубые морфологические изменения нервной системы наблюдаются у детей. При макроскопическом исследовании выявляется расширение желудочков с перивентрикулярной зоной некроза. Обнаруживаются рубцы, замещающие участки некроза, облитерация межжелудочкового отверстия и латеральной апертуры IV желудочка. Гидроцефалия может быть выражена, приводя к истончению и деформации вещества полушарий.
Морфологические проявления токсоплазмоза мозга у взрослых многообразны. При микроскопическом исследовании наиболее характерны рассеянные по всему головному и спинному мозгу милиарные гранулемы, состоящие из больших эпителиоидных клеток, лимфоцитов, моноцитов, иногда эозинофилов. Гранулемы содержат многочисленных паразитов, окружены зоной отека с некротическими очажками, обусловленными васкулитом. Типично для токсоплазмоза обызвествление мелких очагов. При наличии токсоплазм в субарахноидальном пространстве возникает серозно-продуктивный лептоменингит.
У большинства зараженных нет клинических проявлений заболевания. У части больных наблюдается вялотекущие хронические формы и крайне редко - острые, с тяжелым течением заболевания. При внутриутробном заражении в первые месяцы беременности часто происходит выкидыш и гибель плода. Не исключается возможность внутриутробных уродств плода и рождения детей с дефектами развития. Если заражение произошло в поздние сроки беременности, рождается ребенок с генерализованным токсоплазмозом.
Симптомы Токсоплазмоза:
Токсоплазмозом заболевают лица любого возраста, однако наиболее часто - дети. Выделяют приобретенный и врожденный токсоплазмоз.
Приобретенный токсоплазмоз. Инкубационный период - от 3 до 14 дней. Продромальный период с общим недомоганием, мышечными и суставными болями - обычно несколько недель, иногда месяцев. Острая стадия заболевания проявляется повышением температуры, ознобом, лимфоаденопатией. Появляется генерализованная макулопапулезная сыпь, отсутствующая только на подошвах, ладонях, волосистой части головы. Наряду с общими признаками инфекционного заболевания имеется клиническая картина поражения различных органов: миокардит, пневмония, очаговый некротический нефрит, гепатит. Поражение нервной системы проявляется менингитом, энцефалитом, менингоэнцефалитом, энцефаломиелитом. Редко наблюдаются радикулоневритическая и малосимптомная формы (последняя может быть обнаружена лишь с помощью серологических реакций).
Наиболее типичной формой токсоплазмоза является менингоэнцефалит, в клинической картине которого имеются общемозговые и менингеальные симптомы, парезы конечностей, тонико-клонические судороги, глазодвигательные (диплопия) и координаторные нарушения. Иногда развиваются одиночные или множественные токсоплазмозные абсцессы в головном мозге. Характерны расстройства сознания, летаргия, утрата памяти и ориентировки в пространстве. В крови обнаруживаются лейкоцитоз со сдвигом формулы влево, увеличение СОЭ, в цереброспинальной жидкости - лимфоцитарный плеоцитоз, умеренное увеличение содержания белка.
Выделяют острую, хроническую и латентную формы с подразделением последней на первично-латентную, без клинических проявлений, и вторично-латентную, возникающую после острой формы или рецидива хронической.
Острый токсоплазмоз характеризуется внезапным началом, лихорадкой, явлениями общей интоксикации. У больных отмечаются лимфаденопатия, макулопапулезная сыпь, увеличиваются печень, селезенка. Могут развиться признаки энцефалита, менингоэнцефалита и миокардита.
В зависимости от преобладающего синдрома выделяют энцефалитическую, тифоподобную и смешанную формы острого токсоплазмоза.
После стихания процесса острый токсоплазмоз переходит во вторично-хроническую или, реже, вторично-латентную формы.
Хронический токсоплазмоз может развиться как первично-хроническое, так и вторично-хроническое заболевание. Он характеризуется торпидным, длительным течением, при котором наблюдаются периоды обострения и ремиссии. Основные клинические симптомы - интоксикация, субфебрилитет, миалгии, артралгии. У больных отмечаются раздражительность, снижение памяти, невротические реакции. Частым симптомом является генерализованная лимфаденопатия. Вследствие мезаденита возникают ноющие боли и вздутие живота, запор, тошнота. К числу важных симптомов заболевания относятся специфический миозит (в толще мышц иногда можно прощупать уплотнения и даже кальцификаты) и миокардит. У многих больных обнаруживают признаки вегето-сосудистой дистонии, эндокринные нарушения (расстройства менструального цикла, импотенция, вторичная надпочечниковая недостаточность и др.). Нередко встречается поражение глаз в форме хориоретинита, ретинита, увеита. В периферической крови - лейкопения, нейтропения, относительный лимфоцитоз, тенденция к эозинофилии. СОЭ в пределах нормы.
Однако преобладающей формой течения приобретенного заболевания является латентный токсоплазмоз. Он чаще имеет первично-латентный и, значительно реже, вторично-латентный характер. Латентный токсоплазмоз диагностируется только при серологическом исследовании. Латентная и хроническая формы болезни могут переходить в тяжелое генерализованное течение, что встречается при ВИЧ-инфекции и других состояниях, приводящих к иммунодефициту. Наиболее часто у больных ВИЧ/СПИДом встречаются менингоэнцефалит и абсцессы мозга, вызванные токсоплазмами. В диагностике большое значение имеет компьютерная томография. В процесс также вовлекаются легкие, сердце, миокард и другие органы. Токсоплазмоз - одна из причин гибели больных ВИЧ/СПИДом.
Врожденный токсоплазмоз. При заболевании матери токсоплазмозом в первой половине беременности плод, как правило, погибает вследствие несовместимых с жизнью пороков развития. При инфицировании матери во второй половине беременности ребенок рождается с тяжелым поражением мозга. Острая стадия заболевания протекает внутриутробно, рождается ребенок с активно текущим менингоэнцефалитом или его последствиями. Неврологические проявления менингоэнцефалита разнообразны: полиморфные эпилептические припадки, клонико-тонические судороги, спастические парезы, тремор, миоклонии, парезы глазных и мимических мышц, нистагм, контрактуры мышц, менингеальные явления. Иногда имеются симптомы поражения спинного мозга.
Для врожденного токсоплазмоза характерна триада признаков: гидроцефалия, хориоретинит и интрацеребральные кальцификаты. При гидроцефалии увеличиваются размеры головы, кости черепа истончаются, роднички напряжены. Гидроцефалии обычно сопутствует микрофтальмия. Если гидроцефалия развивается до рождения ребенка, то в родах приходится прибегать к краниотомии. Однако во многих случаях увеличение объема головы не обнаруживается и гидроцефалия выявляется только при пневмоэнцефалографии. Хориоретинит часто бывает двусторонним, фокальным, включающим макулярную область. Возможны также ирит, увеит, катаракта, первичная или вторичная атрофия зрительных нервов. Интрацеребральные кальцификаты диаметром 1-3 см располагаются в коре и базальных ганглиях и выявляются на краниограммах КТ и МРТ головного мозга.
Дети с врожденным токсоплазмозом отстают в умственном развитии вплоть до олигофрении. У них наблюдаются также разнообразные психотические состояния (депрессия, психомоторное возбуждение, галлюцинации, кататония). Иногда у детей с врожденным токсоплазмозом обнаруживаются желтуха, увеличенные печень и селезенка. Температура обычно остается нормальной. Ликворное давление при люмбальной пункции обычно нормальное. Отмечается высокое содержание белка и умеренный мононуклеарный плеоцитоз, иногда ксантохромия.
Осложнения врожденного токсоплазмоза - следствие поражения мозга и глаз, ведущего к истощению, параличам, умственной отсталости, слепоте. Присоединение вторичной инфекции обусловливает развитие гнойного менингоэнцефалита и пиоцефалии. Смерть наступает от прогрессирующего поражения головного мозга.
Течение токсоплазмоза
Ранее считалось, что врожденный токсоплазмоз приводит к смерти в течении первых лет жизни ребенка. В настоящее время возможны стабилизация инфекции и даже полное выздоровление с остаточными явлениями, выраженность которых зависит от степени поражения центральной нервной системы (кальцификаты, хореоретинит, эпилептический синдром, отставание в умственном развитии и др.). У взрослых наряду с острым течением часто отмечается подострое или даже хроническое развитие заболевания. Нередко приобретенный токсоплазмоз, особенно у взрослых, протекает без выраженных в той или иной степени клинических симптомов (инаппарантная форма).
Диагностика Токсоплазмоза:
Диагноз токсоплазмоза устанавливают на основании комплекса показателей, которые включают клинические данные и результаты лабораторного подтверждения. Относительное значение имеют эпидемиологические предпосылки, такие как контакт с кошками, условия общения с ними, особенности пищевых привычек (употребление сырого, полусырого мяса, проба сырого фарша, немытых овощей, фруктов), соблюдение личных гигиенических навыков, профессия и др.
Чрезвычайное многообразие клинических проявлений, отсутствие симптомов, характерных только для токсоплазмоза, затрудняет клиническую диагностику и позволяет в определенных случаях только предположить диагноз, который формируется при проведении полноценной дифференциальной диагностики и при анализе результатов лабораторного исследования.
Методы лабораторной диагностики токсоплазмоза делят на две группы: паразитологические и иммунологические.
Паразитологические методы основаны на возможности обнаружения возбудителя или выделении его при заражении восприимчивых животных - биопроба.
К ним относится прямая микроскопия мазков - отпечатков пораженных органов (миндалины, биоптат лимфоузлов, головного мозга, внутренние органы погибших эмбрионов или плодов) или мазков из осадка спинномозговой жидкости, крови, окрашенных по Романовскому - Гимзе. Можно исследовать гистологические препараты этих органов.
К сожалению, технические сложности обнаружения post mortum, а также редкие случаи обнаружения токсоплазм в крови, спинномозговой жидкости затрудняют использование этих методов.
Биологическая проба на белых мышах, хомяках, зараженных исследуемым материалом и проведением последующих 5-6 слепых пассажей, требует особых условий содержания животных, лабораторий со специальным режимом работы и применяется только в научных целях.
В широкой практике используют преимущественно иммунологические методы, которые включают серологические реакции и внутрикожную пробу. Эти методы, достаточно специфичные и чувствительные, определяют, прежде всего, состояние инфицированности, а серореакции - и заболеваемости. Эти понятия неоднозначны, ибо заболеваемость во много раз ниже инфицированности.
Из методов серологической диагностики используют реакцию связывания комплемента (РСК), реакцию непрямой иммунофлюоресценции (РНИФ) и иммуноферментный анализ (ИФА). Диагноз подтверждается достоверным нарастанием титра антител - динамикой титров в парных сывороротках, взятых с интервалом 2-4 недели.
РСК становится положительной со 2-й недели после заражения и наибольших титров - 1:16 - 1:320 достигает через 2-4 месяца. Через 1-3 года может стать отрицательной или сохраниться в низких титрах (1:5, 1:10), которые не имеют самостоятельного значения.
РНИФ становится положительной с 1-й недели инфекции и максимальных показателей (1:1280 - 1:5000) достигает на 2- 4 месяце. В низких титрах 1:10 - 1: 40 может сохраняться 15-20 лет.
ИФА в соответствии с ориентацией на международный стандарт ВОЗ является наиболее объективным методом. О положительной реакции свидетельствуют оптические показатели более 1,5, в иммуноферметных единицах - больше 60; в международных - больше 125, в титрах антител - 1:1600 и больше.
Диагностика врожденного токсоплазмоза у ребенка начинается с акушерского анамнеза матери, эпиданамнеза и показателей серологических реакций. Обязательны консультации специалистов для дифференциации с герпетической, цитомегаловирусной, листериозной, хламидийной инфекциями, а также рентгенография черепа и обследование в медикогенетическом центре.
Следует напомнить, что 20 - 30% женщин имеют антитела - это здоровые носители антител. Они не требуют лечения. 70 - 80%, показавших отрицательные серореакции, составляют группу риска и нуждаются в повторном обследовании.
На протяжении первого года жизни ребенка необходимо проводить параллельные серологические обследования матери и ребенка в динамике.
Лечение Токсоплазмоза:
При остром токсоплазмозе используются химиотерапевтические препараты.
Делагил (по 0,5г 2 раза в сутки) в сочетании с сульфаниламидами (по 0,5г 2 раза в сутки) в течение 10 дней. Фансидар назначается в количестве 5 таблеток на курс: по 1 табл. через 2 дня или в виде внутримышечных инъекций по 1 ампуле в 2,5 мг один раз в 2 дня в количестве 5 инъекций. Проводится один или два курса лечения.
Из антибиотиков назначаются: линкомицина гидрохлорид (по 0,5г 2 раза в сутки); метациклина гидрохлорид (по 0,3г 2 раза в сутки) в течение 5-7 дней в сочетании с сульфаниламидами; ровамицин.
Лечение хронического токсоплазмоза во много раз труднее, чем острого, так как химиопрепараты не оказывает значительного эффекта. Главное место занимает гипосенсибилизирующая и иммуномодулирующая терапия. В комплекс лечения включают витамины, десенсибилизирующие средства, лидазу, церебролизин и пр.
Имеются данные о положительном действии левамизола в терапии хронического токсоплазмоза. Левамизол назначается по 150 мг 3 дня подряд с перерывами 1 нед между циклами, всего 2 - 3 цикла.
Профилактика Токсоплазмоза:
Профилактика инфицирования токсоплазмами заключается в употреблении в пищу только хорошо термически обработанного мяса и мясопродуктов, чисто вымытых овощей, фруктов и ягод. В процессе приготовления пищи запрещается пробовать на вкус сырой мясной фарш. Необходимо тщательно мыть руки после обработки сырых мясопродуктов, работе в саду, огороде, детям после игры на детской площадке и, особенно, в песочнице. Следует тщательно соблюдать санитарно-гигиенические правила содержания в квартире домашних животных, не забывая мыть руки после контактов с ними.
При наступлении беременности каждая женщина должна быть обследована на токсоплазмоз в женской консультации. При выявлении у беременной клинических проявлений токсоплазмоза, а также обнаружение антител к токсоплазмам класса IgM, следует решить вопрос о необходимости лечения или прерывания беременности.
К каким докторам следует обращаться если у Вас Токсоплазмоз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Токсоплазмоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
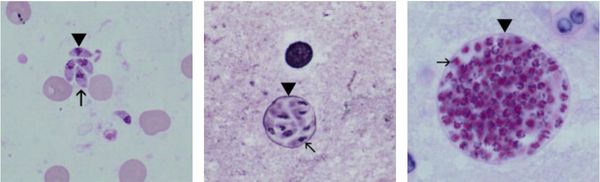
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
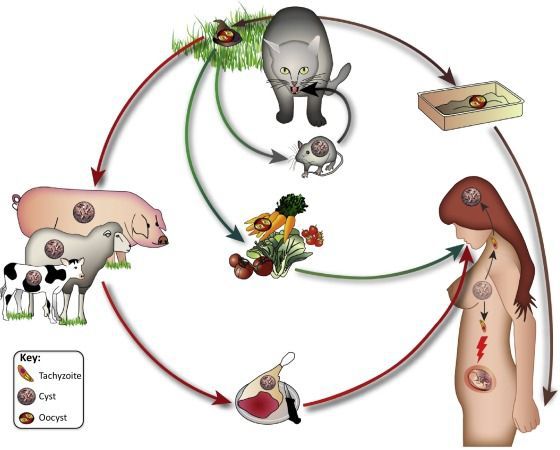
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
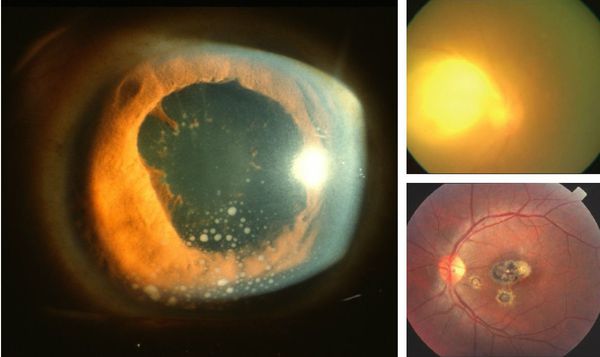
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
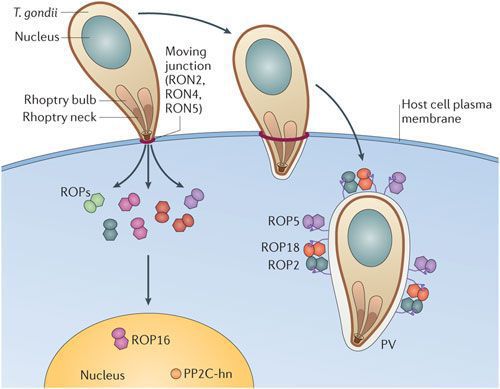
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]

ТАСС, 17 мая. Чешский исследователь выяснил, что заражение одноклеточным паразитом токсоплазмой примерно в 1,5 раза повышает вероятность заполучить коронавирусную инфекцию. Собранные данные и выводы ученый опубликовал на medRxiv.

"Учитывая его высокую распространенность, токсоплазмоз может серьезно влиять на характер развития эпидемии COVID-19. Эти паразиты сейчас не рассматриваются в качестве одного из факторов риска, способствующих распространению коронавируса, и их носители не знают о том, что они подвергаются подобной опасности, а программы вакцинации не учитывают эту уязвимость", – отметил Ярослав Флегр, профессор Карлова университета.
Токсоплазма - это внутриклеточный паразит, который обычно обитает в кишечнике домашних кошек. Он способен проникать не только в организм этих домашних питомцев, но и мышей, людей и многих других животных. Широкая распространенность этого патогена среди питомцев и их хозяев заставила ученых обратить на него внимание в последние годы.
Эти исследования указали на то, что токсоплазма меняет поведение ее промежуточного носителя, вызывая необратимые изменения в работе его мозга. В частности, эти паразиты заставляют мышей и шимпанзе не бояться вида и запаха кошек и леопардов, а люди, зараженные токсоплазмой, становятся более склонными к риску, шизофрении, нерациональным поступкам и необъяснимым приступам ярости. Вдобавок попадание токсоплазмы в организм беременной женщины в некоторых случаях приводит к развитию выкидышей и дефектов развития плода.
Новый фактор риска
Профессор Флегр заинтересовался тем, как заражение токсоплазмой и взаимодействия паразита с иммунной системой могут влиять на подверженность его носителей коронавирусной инфекции. Для ответа на этот вопрос он заручился поддержкой свыше почти 4,5 тыс. жителей Чехии, среди которых было 786 носителей токсоплазмы.
Значительная часть добровольцев заразилась SARS-CoV-2 за последние полгода, что позволило чешскому исследователю детально изучить то, какие факторы риска, в том числе и токсоплазмоз, влияли на вероятность заполучить COVID-19. Как оказалось, присутствие паразита в организме значительно повышало эту вероятность.
В соответствии с расчетами профессора Флегра, токсоплазмоз примерно в 1,5 раза повышал шансы заражения SARS-CoV-2, что делало его более серьезным фактором риска, чем вторая группы крови или наличие астмы. Аналогичным образом, присутствие паразита в организме значительно повышало риск развития тяжелых форм COVID-19.
При этом токсоплазмоз по-разному влиял на уязвимость женщин и мужчин к коронавирусной инфекции. Зараженные им мужчины примерно вдвое чаще заполучали SARS-CoV-2, тогда как для женщин этот показатель увеличивался в 1,4 раза. Как предполагает профессор Флегр, что существование подобной связи между паразитом и COVID-19 связано с тем, что токсоплазма подавляет иммунитет ее носителей.
Все это, как считает чешский исследователь, говорит в пользу того, что факт присутствия токсплазмоза в организме человека следует учитывать при разработке стратегий массовой вакцинации населения и выработке ограничительных мер, сдерживающих распространение коронавируса.
Следует добавить, что статью ученых не рецензировали независимые эксперты и не проверяли редакторы научных журналов, как это обычно бывает в подобных случаях. Поэтому к выводам из нее и аналогичных статей нужно относиться осторожно.
Российские исследователи сравнили распространенность латентного токсоплазмоза среди обычных людей и больных шизофренией. Обнаружилось, что люди, страдающие от последней болезни, показывают признаки токсоплазмоза вдвое чаще, чем здоровые. Особенно сильно это корреляция проявилась среди женщин.

Это до некоторой степени сходно с поведением, которое токсоплазмоз вызывает у кошек и мышей. Крысы и мыши с токсоплазмозом начинают игнорировать риски, в том числе запах кошек. В итоге зараженные грызуны легче убиваются кошками, а тем вместе с мясом передается и паразит. Повышение рискованности поведения человека не имеет биологического смысла для поражающих его Toxoplasma gondii, поскольку кошки редко едят сырое мясо людей и шансов попасть в кошку после смерти промежуточного хозяина-человека у паразита мало. Несмотря на это, модификация поведения людей токсоплазмозом действительно выглядит как достаточно серьезная угроза. Дело в том, что это довольно массовое заболевание: в Москве, например, латентный токсоплазмоз отмечается у четверти населения, то есть у миллионов человек. Естественно, что высокая частота ДТП и суицидов для зараженных токсоплазмой людей может быть серьезной проблемой для общества в целом.
Из 155 обследованных москвичей с шизофренией 40% оказались носителями латентного токсоплазмоза. Среди здоровых москвичей их было 25%.
Примерно такова и средняя встречаемость токсоплазмоза среди сегодняшних жителей столицы, отмечают авторы работы. Таким образом, наличие у человека токсоплазмоза показывает явную корреляцию с наличием у него шизофрении. Эта корреляция слабее у мужчин: 39% больных мужчин имели латентный токсоплазмоз, среди здоровых мужчин таких было 27%. Зато у женщин она была сильнее: 41% женщин с шизофренией показали латентный токсоплазмоз, а среди здоровых их было лишь 24%.
Авторы работы обращают особое внимание на тот факт, что сходные исследования в СССР проводились еще в 1960—1980-х годах, однако тогда доля населения с латентным токсоплазмозом была значительно меньше, чем в сегодняшней Москве. По данным прошлых исследований, среди обыкновенных горожан зараженных токсоплазмой было не больше 13%, а среди шизофреников эта доля достигала 32,1%. Это означает, что частота встречаемости токсоплазмоза за последние десятилетия в России возросла — по крайней мере, в столице.
Физиологическим механизмом, стоящим за корреляцией между токсоплазмозом и шизофренией, может быть способность Toxoplasma gondii многие годы выживать в нервных клетках мозга человека, при этом влияя на его работу каким-то пока не вполне выясненным образом.
Авторы работы отмечают, что игнорирование роли токсоплазмоза в росте риска шизофрении долгие годы основывалось на предположении, что лица с шизофренией просто плохо следят за своим питанием и гигиеной (основной источник возбудителя болезни — недостаточно прожаренное мясо некоторых животных). В такой картине токсоплазмоз не столько причина, сколько следствие шизофрении. Однако, отмечают исследователи, новые работы опровергают эту точку зрения и показывают, что токсоплазмоз может оказаться именно причиной, а не следствием шизофрении. Новое исследование показывает, что это вполне органично объясняло бы взрыв частоты заболеваний шизофренией, отмечающийся в России в последние десятилетия.
К сожалению, сам латентный токсоплазмоз лечится достаточно плохо, по-настоящему эффективных средств против него нет. Тем не менее, соблюдая общую гигиену и следя за своим питанием, можно снизить шансы на заражение возбудителем этой болезни.
Токсоплазмоз – это одна из TORCH-инфекций, инфекций которые связаны одним единственным признаком - возбудители могут передаваться внутриутробно: от матери к ребенку. Данные инфекции нередко являются причиной проблем с вынашиванием беременности и виновниками врожденных пороков развития у малыша.
Что провоцирует / Причины Токсоплазмоза у беременных:
Актуальность проблемы токсоплазмоза определяется высокой инфицированностью населения паразитом Toxoplasma gondii. Распространенность токсоплазмоза широко варьирует в зависимости от особенностей питания в тех или иных странах. Так, во Франции более 70 % женщин заражаются токсоплазмой до беременности и приобретают иммунитет еще до зачатия. Несмотря на это, подсчитано, что во Франции 1 из 140 женщин заболевает токсоплазмозом во время беременности, тогда как в Великобритании эта величина значительно ниже и составляет 1:400 женщин.
Токсоплазма является внутриклеточным паразитом из класса Sporozoa, основным хозяином которого являются животные семейства кошачьих. В эпителии кишечника кошек происходит половое размножение паразита с образованием ооцист, которые в острую фазу инфекции выделяются с испражнениями и длительно сохраняются в почве. Алиментарным путем ооцисты попадают в кишечник промежуточных хозяев - травоядных и плотоядных животных, в том числе и человека. В результате неполового деления образуется тахизоит - паразит размером 4-7 мкм, способный мигрировать и размножаться в клетках различных органов (ЦНС, лимфоидных, мышечных и др.), где быстро формируются псевдоцисты и цисты. В цистах паразит в форме брадизоита может находиться пожизненно в состоянии vita minima, активизируясь в случае значительного снижения иммунитета.
Патогенез (что происходит?) во время Токсоплазмоза у беременных:
Клеточный и гуморальный иммунитет обеспечивает надежную и пожизненную защиту от повторного инфицирования и активации брадизоитов, находящихся в цисте. Иммуногенез, в частности непрерывная продукция антител, индуцируется за счет контакта клеток иммунной системы с цистными антигенами паразита, такой иммунитет называется нестерильным. Состояние клеточного звена иммунитета учитывают только при манифестных формах заболевания.
Человек заражается тканевыми цистами при употреблении полусырого мяса или ооцистами - при употреблении немытых овощей либо непосредственно от кошек. Возможна трансплацентарная передача инфекции. До 80 % населения инфицированы токсоплазмами, они находятся в стадии латентной токсоплазменной инфекции. Риск инфекции в течение 9 мес беременности для серонегативных женщин составляет примерно 1 %.
Имеются 4 пути заражения человека токсоплазмозом.
- Прием через рот цист в мясе и колбасных изделиях, не подвергнутых достаточной термической обработке.
- Пероральное поступление ооцист в организм через продукты питания (например, салат), воду, а также через предметы и почву, которые загрязнены кошачьим калом (например, во время работы в саду); заразным кошачий кал становится только на 3-й день после экстракорпорального созревания.
- Трансплацентарная передача плоду во время острой токсоплазменной инфекции у будущей матери.
- Трансплантация органов и гемотрансфузии. Повреждение клетки паразитом приводит к ограниченному и/или генерализованному воспалению: лимфадениту, энцефалиту, гепатиту, миозиту, миокардиту. Выраженность воспалительных изменений бывает разной и, как правило, незначительной, но во всех случаях преобладает некроз с последующим фиброзом и кальцинацией ткани. В период острого процесса и цитолиза свободные формы (тахизоиты) находятся вне клеток, циркулируют в жидких средах организма, где атакуются фагоцитами с последующей быстрой элиминацией из крови.
Инфицирование и паразитемия в большинстве случаев бессимптомны, и только примерно у 10 % инфицированных людей отмечается малосимптомная картина заболевания: головная боль, небольшая лихорадка, локальный лимфаденит, легкий миозит. В редких, более тяжелых, случаях заболевание сопровождается генерализованной лимфаденопатией, пятнистой сыпью, мигрирующей артралгией и гепатоспленомегалией. Тяжелые варианты заболевания (миокардит, пневмония, увеит, хориоретинит) встречаются только у взрослых с иммунодефицитами и внутриутробно инфицированных детей.
Риск инфицирования плода значителен при первичном инфицировании беременной паразитом. Иммунитет женщины, инфицированной до беременности, надежно предохраняет плод при повторных контактах с токсоплазмой в случае возможной реинфекции в период беременности, за исключением редко встречающихся иммунодефицитных состояний. Число неиммунных беременных в России составляет 60-70 %. Во время беременности инфицируется около 11% женщин, которые в 30-40 % случаев передают инфекцию плоду. Таким образом, инфицируется 1 из 1000 плодов.
Для решения вопросов о профилактике и лечении токсоплазмоза плода и ребенка необходима своевременная диагностика инфицирования беременной, что возможно на основании результатов повторных серологических исследований, проведенных в определенные сроки беременности.
При заболевании в I и во II триместрах риск самопроизвольного аборта и преждевременных родов достигает 10-15 %. Риск врожденного токсоплазмоза и его тяжесть зависят от срока заражения беременной: чем раньше произошло заражение, тем меньше риск заболевания и больше выраженность проявлений. Так, при заражении матери в III триместре риск врожденного токсоплазмоза составляет 75-90 %, при этом у 90 % новорожденных заболевание протекает бессимптомно. При заражении же в I триместре риск врожденного токсоплазмоза всего 10-25 %, однако заболевание в 65 % случаев протекает в тяжелой форме. Если же женщина заразилась токсоплазмозом до беременности, то врожденный токсоплазмоз у ее будущего ребенка вообще маловероятен.
При внутриутробном заражении токсоплазмозом возможны смерть плода и преждевременные роды. Среди ранних проявлений врожденного токсоплазмоза следует отметить ЗВУР, микроцефалию, внутричерепные кальцификаты, гидроцефалию, хориоретинит, гепатоспленомегалию, желтуху и тромбоцитопению. Поздние проявления - задержка психического развития и эпилептические припадки. Лечение беременной снижает риск врожденного токсоплазмоза на 60 %.
При первичной инфекции у матери плод инфицируется или непосредственно, или косвенно от очагов токсоплазмоза в плаценте. После латентного периода инфекция может перейти от матери к плоду. Риск инфицирования и заболевания плода зависит от срока беременности. В ранние сроки беременности инфекция от матери к плоду переходит редко и медленно, в поздние сроки ребенок инфицируется быстрее и с более высокой вероятностью.
Только в редких случаях инфекция беременной ведет к инфицированию ребенка в I триместре. Хотя такие дети тяжело поражены, у них не отмечается аномалий закладки органов. Эмбриопатии, обусловленные токсоплазмой, у человека неизвестны, хотя имеются данные о токсическом нарушении эмбриогенеза в результате хорионита без непосредственного контакта паразита с эмбрионом. Для объяснения этого феномена есть две гипотезы: либо инфекция эмбриона ведет к выкидышу в ранние сроки, либо возбудитель переходит от матери к плоду из-за своего внутри-маточного латентного периода только после окончания периода эмбриогенеза и у ребенка есть возможность пережить инфекцию.
Симптомы Токсоплазмоза у беременных:
Заболевание часто протекает бессимптомно. Иногда по клиническому течению оно напоминает инфекционный мононуклеоз с появлением атипичных лимфоцитов в мазке крови и крайне редко приводит к скоротечно текущему пневмониту или летальному энцефаломиелиту. Как при врожденном, так и при приобретенном токсоплазмозе возможно поражение глаз в виде хориоретинита. Инфицирование детей и взрослых с недостаточностью иммунитета может вызвать генерализованный или локальный процесс с необратимыми последствиями. При ВИЧ-инфекции по мере нарастания иммунодефицита возможна реактивация токсоплазмоза, проявляющаяся множественными абсцессами головного мозга.
Размножение возбудителя ведет к воспалительным реакциям с некрозом и обызвествлением тканей. В более ранний период фетального развития при недостаточной собственной иммунокомпетентности ребенка или при массивной инфекции возможно очень сильное размножение возбудителя в плоде с гидроцефалией, асцитом, гепатозом. С тропизмом паразита к ЦНС связаны поражения мозга (менингоэнцефалит) и глаз (хориоретинит). Возможны генерализованный токсоплазмоз и поражение отдельных паренхиматозных органов (гепатит, миокардит). Если воспалительный процесс не приводит к выкидышу, то при рождении наблюдают остаточные явления: фиброзно-склеротические изменения в органах с их деформацией и нарушением функции - так называемые ложные пороки развития.
Поздняя фетопатия может проявляться широким спектром клинических признаков - от легких до крайне тяжелых вариантов. Клинически выраженные формы характеризуются лихорадкой, лимфаденитом, гепатоспленомегалией, желтухой, судорогами, анемией, тромбоцитопенией, экзантемой. Есть данные, что бессимптомные и субклинические формы также не проходят бесследно: у ряда детей спустя годы находят неврологические отклонения, последствия хориоретинита, глухоту, отставание в психическом развитии.
Диагностика Токсоплазмоза у беременных:
Если в крови беременной выявлены IgM-антитела, то это могут быть следующие ситуации:
- острая или недавно перенесенная инфекция, значимая для беременности;
- подъем специфических IgM-антител из-за нового интестинального контакта с токсоплазмой (локальная реинфекция?) или клинически значимое реактивирование;
- неспецифическая IgM-реакция (так называемые естественные IgM-антитела к токсоплазменным антигенам).
Нельзя оценивать позитивный IgM-тест при первом исследовании беременной без дальнейшего отбора признаков значимой для беременности инфекции. IgM-антитела персистируют, как правило, год, а часто даже 2-3 года. В каждом подобном случае необходимо исследование парных сывороток.
При сонографических данных, позволяющих предположить повреждение ребенка при токсоплазмозе в случае острой токсоплазменной инфекции у беременной, рекомендуется пренатальная диагностика. В большинстве случаев имеется относительное показание: при острой токсоплазменной инфекции у матери необходимо выяснить, не перешла ли инфекция на ребенка с нормальными данными сонографического исследования. При амниоцентезе исследуют околоплодные воды, при кордоцентезе - кровь.
Со времени инфицирования до момента исследования должно пройти не менее 4 нед (срок определяют по серологическим данным), потому что при более ранней пункции возбудитель, возможно, еще не достиг околоплодных вод и вероятен ложнонегативный результат. Пункцию делают не ранее 16 нед беременности. Нельзя до исследования проводить сочетанную терапию пириметамином и сульфадиазином, иначе возможны ложнонегативные результаты ПЦР. Если выявлена фетальная инфекция и одновременно имеются сонографические признаки повреждения у ребенка, с родителями следует обсудить возможность прерывания беременности. Если беременность без заметных отклонений со стороны плода не прервана, то проводят курсы терапии до родов и в течение первых 12 мес жизни ребенка (четырехнедельная комбинированная терапия пириметамином, сульфадиазином и фолиевой кислотой попеременно с четырехнедельной терапией ровамицином). После родов исследуют пуповинную кровь, плаценту методом ПЦР и сравнивают серологические пробы матери и ребенка.
Основные положения пренатальной диагностики токсоплазмоза следующие.
- Пренатальная диагностика необходима в следующих ситуациях:
- абсолютное показание: в случае острой токсоплазменной инфекции у беременной и данных УЗИ, позволяющих предположить повреждение плода;
- относительное показание: при острой токсоплазменной инфекции у беременной и "нормальных" данных УЗИ плода.
- со времени инфицирования до момента исследования должно пройти не менее 4 нед (для уменьшения количества ложноотрицательных результатов);
- амниоцентез проводят не ранее 16 нед беременности;
- нельзя до исследования проводить сочетанную терапию пириметамином и сульфадиазином (для уменьшения количества ложноотрицательных результатов).
Лечение Токсоплазмоза у беременных:
Лечение токсоплазмоза эффективно в периоды циркуляции в крови внецистных форм паразита, внутриклеточного деления тахизоитов с последующей паразитемией при остром и персистирующем процессе; на цистные формы (брадизоиты) препараты не действуют. В полной санации от паразита нет необходимости, так как цистные формы (носительство) обеспечивают нормальный нестерильный иммунитет.
Наиболее эффективны препараты пириметамина в комбинации с сульфаниламидами. Препараты блокируют функцию ферментов (редуктазы и синтетазы), участвующих в синтезе фолиевой кислоты паразита. Побочные действия всех антифолатов устраняют назначением фолиевой кислоты. На втором месте по эффективности стоят макролиды, тормозящие синтез белка на рибосомах возбудителя, учитывают также их меньшую токсичность и действие на внутриклеточные формы паразита.
При латентном токсоплазмозе (положительные результаты серологических проб в отсутствие клинических проявлений) лечение не проводят. Хотя при заражении в I триместре беременности риск врожденного токсоплазмоза невысок, в связи с возможностью тяжелого поражения плода показано прерывание беременности. Индивидуально решаются вопросы о прерывании беременности и предупреждении больной о потенциальной опасности химиотерапии, а также получения от нее письменного согласия на такое лечение.
В случае настойчивого желания женщины пролонгировать беременность в I триместре необходима терапия спирамицином. Начиная со II триместра при остром токсоплазмозе назначают пириметамин в сочетании с сульфаниламидами и чередуют их с курсами спирамицина. Терапию проводят до окончания беременности. В III триместре сульфаниламиды отменяют за 2 нед до предполагаемых родов во избежание конкурентозависимой гипербилирубинемии. Для устранения побочного действия пириметамина и сульфаниламидов (подавление функции костного мозга) назначают фолиевую кислоту до 5 мг/сут.
Схема лечения острого токсоплазмоза во время беременности следующая.
- С момента установления диагноза и до 15 нед: ровамицин 9 000000 ME в сутки.
- С 16 до 36 нед независимо от предшествующей терапии ровамицином проводят 4-недель-ную комбинированную терапию фолиевой кислоты: сульфаниламиды 4 г (по 1 г 4 раза в день), пириметамин - 1-й день 50 мг, затем 25 мг в день, лейковорин по 10-15 мг в день.
- С 36 нед и до конца беременности из-за опасности гемолиза и желтухи у новорожденного сульфадиазин заменяют ровамицином.
- Необходим еженедельный контроль клинического анализа крови и общего анализа мочи.
- Новорожденного обследуют (серология, клинические данные), при подтверждении врожденного токсоплазмоза проводят терапию чередующимися 4-недельными курсами под контролем неонатолога, офтальмолога, невропатолога, инфекциониста.
Профилактика Токсоплазмоза у беременных:
Профилактику внутриутробного токсоплазмоза следует проводить с учетом того факта, что только первичное заражение женщины во время беременности может привести к инфицированию плода. Методы профилактики подразделяют на санитарные и специальные методы. Первые включают информацию о соблюдении следующих правил: не пробовать сырой фарш, употреблять только термически хорошо обработанное мясо, тщательно вымытые фрукты, овощи, зелень, санировать кошачьи испражнения, следить за чистотой рук, работая в саду.
Специальные методы состоят в обследовании с использованием диагностического алгоритма всех женщин перед беременностью и во время беременности. При первом обращении беременной к врачу исследуют титр антител к Toxoplasma gondii. При положительном результате в том же образце сыворотки определяют содержание специфических IgM для исключения острой инфекции. При их обнаружении назначают лечение или рекомендуют прервать беременность. В отсутствие специфических антител обследование повторяют на 10-12-й неделе и 20-22-й неделе, так как серонегативные беременные будут составлять группу риска по острому токсоплазмозу.
За инфицированными, но "практически здоровыми детьми", родившимися от матерей с точно установленным первичным инфицированием во время беременности, необходимо диспансерное наблюдение до 10-летнего возраста, включающее регулярное клинико-лабораторное обследование для выявления возможной трансформации инфицирования в заболевание.
Основные положения профилактики врожденного токсоплазмоза следующие.
- Первичная профилактика - просвещение серонегативных по токсоплазмозу беременных:
- хорошая термическая обработка мяса и мясных изделий;
- тщательная обработка кипяченой водой салатов и фруктов;
- если у беременной дома есть кошка, необходимо применять консервированный или сухой корм, кошку держать в квартире, ящик для кала ежедневно чистить и ошпаривать кипятком;
- при припухании лимфатических узлов или жалобах, напоминающих грипп, для уточнения симптомов немедленно обратиться к врачу.
К каким докторам следует обращаться если у Вас Токсоплазмоз у беременных:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Токсоплазмоза у беременных, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Читайте также:

