Расшифровка маркеров внутриутробных инфекций
Обновлено: 19.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);
Одной из важнейших проблем современной перинатологии является прогрессирующий рост инфекционной патологии у плода и новорожденного. Целью данной работы являлась комплексная ультразвуковая оценка фето-плацентарной системы у беременных с высоким инфекционным индексом для прогнозирования степени тяжести внутриутробного инфицирования у новорожденного. Обследовано 123 беременных в сроке гестации 30-36 недель. В зависимости от тяжести состояния все новорожденные ретроспективно были разделены на 4 группы. В контрольную (1 группа) вошли новорожденные от матерей с неосложненной беременностью, состояние ребенка при рождении удовлетворительное. В основную (1 – 4 группы) вошли новорожденные от матерей с высоким инфекционным индексом, с локальными или генерализованными проявлениями внутриутробной инфекции. В результате проведенного исследования выявлены эхографические маркеры амнионита, плацентита и собственно инфекционного поражения плода, которое наиболее значимо для прогнозирования рождения ребенка с ВУИ. Патологические показатели биофизической активности, допплерометрия отражают системные нарушения в состоянии плода, его дисстресс. Таким образом, чем больше эхографических маркеров внутриутробного инфицирования встречается у плода, тем более вероятно рождение ребенка с признаками ВУИ.

Одной из важнейших проблем современной перинатологии является прогрессирующий рост инфекционной патологии у плода и новорожденного. В структуре заболеваемости новорожденных внутриутробные инфекции (ВУИ) занимают второе место после гипоксии и асфиксии в родах [4].
В структуре перинатальной смертности удельный вес ВУИ достигает 65,6% [11]. В настоящее время насчитывается более 2500 возбудителей, способных вызывать внутриутробное инфицирование плода, при этом количество их постоянно пополняется [14]. Чаще диагностируется смешанное инфицирование вирусно-бактериальной, вирусно-вирусной природы и их различные ассоциации с трихомонадами и дрожжевыми грибами рода Candida [12].
Возбудители этих инфекций обладают прямым и непрямым действием на фето-плацентарную систему. Дегтярев Д.Н. и соав. (1998) утверждают, что чем меньше гестационный возраст плода, тем более выражена альтерация тканей. В результате этого основным клиническим проявлением инфекции плода, возникающих на ранних сроках беременности являются пороки развития [2]. По мере увеличения сроков беременности в клинической картине инфекционного заболевания плода начинают преобладать симптомы классического системного воспаления, обусловленные выраженной пролиферацией и экссудацией, что проявляется в виде гепатита, пневмонии менингита, энтероколита и других заболеваний [6].
Учитывая неспецифичность клинических проявлений ВУИ во время беременности, диагностика ее затруднена и возможна лишь в результате сочетания клинических и лабораторно-инструментальных методов исследования [5]. Метод ультразвуковой диагностики является доступным, высоко информативным, не инвазивным и позволяет провести эхографическую оценку структурной патологии плода, плаценты, амниона, а также определить степень гемодинамических нарушений фето-плацентарного комплекса у беременных с высоким инфекционным индексом [3,12].
Материалы и методы
Под наблюдением находились 123 беременных женщины, которым проводились все необходимые клинико-лабораторные обследования, а также ультразвуковое исследование в сроке 30-36 недель гестации. В зависимости от выраженности ВУИ и степени тяжести состояния все новорожденные разделены на 4 клинические группы.
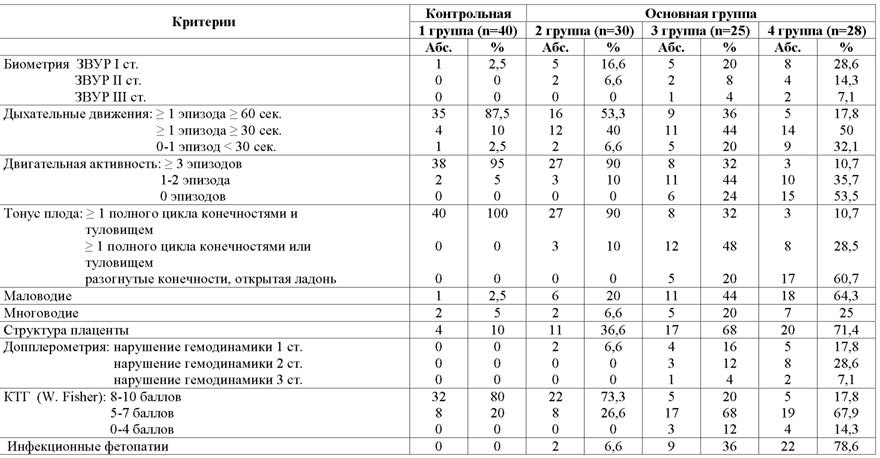
1 группа (n=40) - контрольная, новорожденные от матерей с неосложненной беременностью, состояние ребенка при рождении удовлетворительное. 2-я группа (n=30) - состояние ребенка при рождении удовлетворительное или средней степени тяжести с локальными проявлениями ВУИ в виде пиодермии, ринита, отита, конъюнктивита, пневмонии. 3-я группа (n=25) - состояние ребенка при рождении тяжелое или средней степени тяжести с ухудшением в раннем неонатальном периоде с локальными формами ВУИ в виде пневмонии, энтероколита, менингита, фетального гепатита и др. заболеваний. 4-я группа (n=28) - состояние ребенка при рождении тяжелое или крайней степени тяжести с генерализованными или локальными проявлениями ВУИ, потребовавшими проведения искусственной вентиляции легких. Матери детей 2-4 групп имели высокий инфекционный индекс.
Таблица 1.
Фетометрия позволила установить соответствие размеров плода гестационному сроку, диагностировать задержку внутриутробного развития.
При исследовании сердечной деятельности плода использовали шкалу Фишера, 1976., основными показателями которой были: базальная частота сердечных сокращений, амплитуда осцилляций, частота осцилляций, акцелерации, децелерации. Критерии состояния плода следующие: 8 - 10 баллов - нормальное состояние; 5 - 7 баллов - сомнительное; 0 - 4 балла - неудовлетворительное.
Таблица 2. Заболеваемость беременных урогенитальными инфекциями
Диагностическими критериями нарушения маточно-плацентарного и плодово-плацентарного кровотока при доношенной беременности считали следующие числовые значения СДО: в артерии пуповины 3,0 и выше, а также нулевые и отрицательные значения диастолического кровотока; в маточных артериях 2,4 и выше; в аорте плода 8,0 и выше; для средней мозговой артерии менее 4 и более 7 у.е. [10].
Для оценки степени нарушений маточно-плацентарно-плодовой гемодинамики пользовались шкалой А.Н. Стрижакова (1991).
I А степень - изолированное нарушение кровотока в маточных артериях; I Б степень - изолированное нарушение кровотока в артерии пуповины; II степень - сочетанное нарушение кровотока в маточных артериях и артерии пуповины; III степень - критическое нарушение плодового кровотока, характеризующееся нулевым или ретроградным диастолическим компонентом в артерии пуповины.
Результаты исследований
На основании ранее проведенных исследований [1] выделяют 3 группы эхографических маркеров внутриутробного инфицирования: 1) маркеры внутри-утробного инфицирования плаценты (плацентит); 2) маркеры внутриутробного инфицирования околоплодных вод (амнионит); 3) маркеры внутриутробного
инфицирования плода (инфекционные фетопатии).
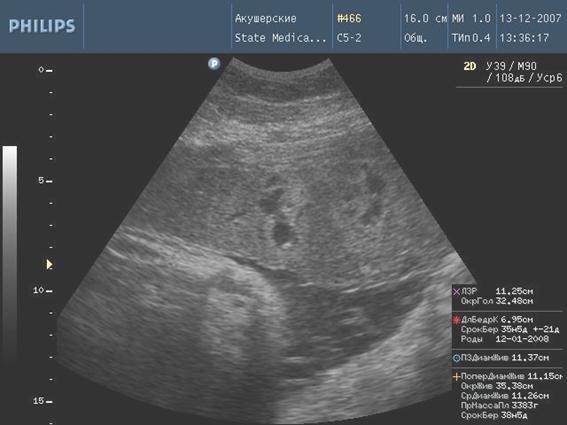
Рис. 1. Формирование псевдокист
Рис. 2. Эхографический маркер внутриутробного инфицирования околоплодных вод (свободно расположенный амниотический тяж)
Рис. 3. Эхографический маркер внутриутробного инфицирования плода (правосторонняя пиелоэктазия)
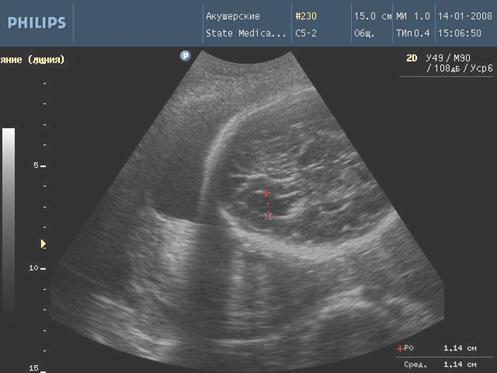
Рис. 4. Вентрикуломегалия
Во 2 клинической группе снижение дыхательной активности наблюдалось у 14 (46,6%) плодов, из них у 2 (6,6%) она не регистрировалась вообще. Снижение тонуса и двигательной активности отмечалось одномоментно у 3 (10%) плодов.
В 3 клинической группе снижение дыхательной активности наблюдалось у 16 (64%) плодов, из них у 11 (44%) продолжительность одного эпизода дыхательных движений составила от 30 до 60 сек., а у 5 (20%) плодов - менее 30 сек. В 4 группе в 82,1% случаев отмечалось снижение дыхательной активности, у 9 (32,1%) плодов - резкое снижение данного параметра. Тонус и двигательная активность плода являются наиболее точными маркерами тяжести внутриутробного страдания плода. Так в 3 клинической группе снижение данных показателей отмечалось у 17 (68%) плодов, в 4 группе - у 25 (89,2%) плодов, причем отсутствие общей двигательной активности за время наблюдения определялось у 6 (24%) плодов 3 группы и у 15 (53,5%) плодов 4 группы.
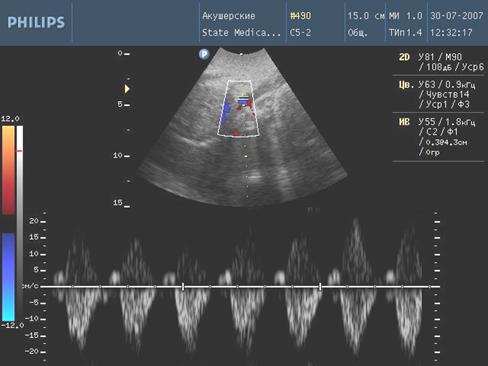
Рис. 5. Нарешение гемодинамики III ст. (ретроградный кровоток)
С целью изучения особенностей гемодинамических нарушений в фетоплацентарном комплексе у беременных с высоким инфекционным индексом были использованы значения систоло-диастолического отношения (СДО) в маточных артериях, артерии пуповины и средней мозговой артерии.
Таблица 3. Средние значения СДО в изучаемых сосудах
В1:В4 (p <0,005)
С1:С4 (p <0,001)
С2:С4 (p <0,05)
Средняя мозговая артерия
D1:D3 (p <0,05)
Таблица 4.
Сравнительный анализ полученных результатов показал, что чем более выражены инфекционные осложнения у новорожденных, тем чаще имеет место повышение сосудистой резистентности в артериях пуповины и маточных артериях.
Достоверность показателей в артериях пуповины определялась между 1 - 4 и 2 - 4 клиническими группами, а в маточных артериях только между 1 и 4 клиническими группами.
Увеличение мозгового кровотока является проявлением централизации плодового кровообращения в условиях сниженной плацентарной перфузии. Достоверность показателей в средней мозговой артерии отмечалось при сравнении 1 и 3 клинических групп.
Исходя из стадийности течения инфекционного процесса при внутриутробном инфицировании (амнионит, плацентит и собственно инфекционное поражение плода) эхографические маркеры в нашем исследовании разделились на 3 группы.
К ультразвуковым маркерам амнионита отнесены: многоводие, маловодие, гиперэхогенные включения в околоплодных водах. Аномальное количество околоплодных вод является типичным признаком внутриутробной инфекции плода. Многоводие встречается с частотой от 4,9 % (при инфекционно-воспалительных заболеваниях матери) до 67,2 % (при доказанной внутриматочной инфекции) [9]. Одной из причин возникновения многоводия является нарушение функции амниона - избыточная продукция околоплодных вод амниотическим эпителием и задержка их выведения [7]. Ж.Е. Пахомова (1996) делает акцент на уменьшении заглатывания околоплодных вод плодом, вследствие нарушения его функционального состояния и уменьшения основных параметров биофизического профиля. Механизм развития маловодия до конца не изучен, возможно, на фоне кислородной недостаточности происходит перераспределение кровотока для обеспечения жизненно важных органов, минуя легкие и почки, которые являются основными источниками продукции амниотической жидкости в конце беременности. Гиперэхогенная взвесь является фрагментами отторгшегося амнионального эпителия, она крупнодисперсная малоподвижная, в отличие от мелкодисперсных подвижных элементов сыровидной смазки плода, появляющиеся в норме после 32 недели беременности. Амниотические тяжи, несвязанные с мелкими частями плода, свободно располагающиеся в амниотической полости, также являются маркерами амнионита. В основной группе данный показатель определялся в 6 (7,2%) случаях, из них у двух детей после рождения был диагностирован врожденный порок развития конечностей в виде ампутаций пальцев на кистях, сочетающийся с расщелиной твердого неба.
К ультразвуковым маркерам плацентита отнесли увеличение толщины плаценты (отек) по сравнению с гестационной нормой; расширение межворсинчатого пространства; появление кистозных полостей в плаценте или формирование псевдокист, эхографическими особенностями которых является неправильная форма, наличие гиперэхогенного венчика по периферии кисты, отсутствие турбулентного движения жидкости во внутренней структуре. Ультразвуковая картина плацентита зависит от стадии процесса. Отек плаценты чаще всего носит транзиторный характер, наблюдается в период разгара заболевания, длится около 2 - 8 недель [12]. Обратные изменения в плаценте проявляются постепенным снижением ее эхогенности, нормализацией толщины и структуры.
Эхографическими маркерами собственно инфекционного поражения плода были пиелоэктазия, вентрикуломегалия, гепатомегалия, кардиомегалия с гидроперикардом, появление линейных гиперэхогенных включений перивентрикуляр-ных зон головного мозга плода. Именно эти маркеры наиболее значимы для прогнозирования рождения ребенка с ВУИ, так как мы видим, что при наличии эхо-признаков плацентата и амнионита у беременных далеко не всегда рождались дети с ВУИ.
Патологические допплерометрические показатели, также как и оценка дыхательной и двигательной активности, отражают системные нарушения в состоянии плода, его дистресс [13]. Они не являются специфичными и указывают на то, что в системе жизнеобеспечения плода произошел сбой, в связи с чем необходимо рассматривать вопрос о тактике ведения беременной женщины, а также о сроках и методах родоразрешения.
Рассмотрена проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода, факторы риска внутриутробных инфекций, патогенетические механизмы возникновения, развития и воздействия ВУИ, подходы к диагностике и лечению.
The issue of fetal intrauterine infecting and intrauterine infection (IUI) was considered, as well as the risk factors of intrauterine infections, pathogenic mechanisms of their occurrence, development and effect of IUI, and approaches to the diagnostics and treatment.
Проблема внутриутробной инфекции особо актуальна в современных условиях в связи с распространенностью и тяжестью воспалительных процессов. Проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода является одной из ведущих в акушерской практике и в перинатологии в связи с высоким уровнем инфицирования беременных, рожениц и родильниц, опасностью нарушения развития плода и рождения больного ребенка. Наличие инфекции у матери является фактором риска ВУИ плода, но не всегда означает его заболевание [1, 5–7, 13].
Внутриутробная инфекция — группа инфекционно-воспалительных заболеваний плода и детей раннего возраста, которые вызываются различными возбудителями, но характеризуются сходными эпидемиологическими параметрами и нередко имеют однотипные клинические проявления. Заболевания развиваются в результате внутриутробного (анте- и/или интранатального) инфицирования плода. При этом в подавляющем большинстве случаев источником инфекции для плода является мать. Истинная частота врожденных инфекций до настоящего времени не установлена, но, по данным ряда авторов, распространенность данной патологии в человеческой популяции может достигать 10%. В структуре перинатальной смертности ВУИ составляет более 30% [1, 5–7].
Кроме этого, ВУИ относятся к тяжелым заболеваниям и во многом определяют уровень младенческой смертности.
Согласно данным многих авторов, причиной внезапной смерти грудных детей является инфекционное заболевание, протекающее без ясной симптоматики. В числе причин или фоновых состояний скоропостижной смерти могут быть ВУИ [2].
Под внутриутробным инфицированием понимают процесс внутриутробного проникновения микроорганизмов к плоду, при котором отсутствуют признаки инфекционной болезни плода. Как правило, инфекционный процесс затрагивает плаценту, в которой развивается плацентит, хориоамнионит и т. д. Диагноз внутриутробного инфицирования у новорожденного устанавливается на основании выделения возбудителя из клеток крови, ликвора и других источников, выявления IgM и низкоавидных IgG в пуповинной крови, а также при морфологическом исследовании плаценты [1, 5–7].
Внутриутробное инфицирование не означает неизбежного развития инфекционного заболевания. Для выявления ВУИ необходимо наличие данных лабораторного исследования в сочетании с клинической картиной инфекционного заболевания. Под ВУИ подразумевают не только процесс распространения инфекционных агентов в организме плода, но и вызванные ими морфофункциональные нарушения различных органов и систем, характерные для инфекционной болезни (сепсис, пневмония, менингит, гепатит и т. д.), возникшей анте- или интранатально и выявляемой пренатально или после рождения [10, 11].
Инфекционно-воспалительные заболевания во время беременности имеют особенности: инфицирование плода и новорожденного может быть вызвано как острой инфекцией матери, так и активацией хронической, персистирующей инфекции во время беременности; большая часть заболеваний беременных, приводящих к внутриматочной инфекции, протекает в латентной или субклинической форме; активация персистирующей инфекции возможна при любом нарушении гомеостаза в организме беременной (стресс, острые респираторные вирусные инфекции, переохлаждение и др.) [1, 2].
Возможный спектр возбудителей внутриутробной инфекции весьма разнообразен и широк. Это бактерии (грамположительные и грамотрицательные; аэробные и анаэробные), грибы, простейшие, внутриклеточные микроорганизмы (микоплазмы, хламидии), вирусы. Чаще всего наблюдается сочетание возбудителей — бактериально-вирусная смешанная инфекция [3, 4, 10, 11].
Зачастую ВУИ ассоциируются с наличием инфекций TORCH — то есть синдромом комплекса. Данный термин образован первыми буквами латинских названий наиболее часто верифицируемых врожденных инфекций: T — токсоплазмоз (Тoxoplasmоsis), R — краснуха (Rubella), С — цитомегалия (Cytomegalia), Н — герпес (Herpes) и О — другие инфекции (Оther). К последним относят сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекцию, микоплазмоз и др. [9, 11].
Принимая во внимание, что источником инфекции для плода всегда является его мать, особое значение приобретают следующие факторы риска внутриутробных инфекций:
- хронические очаги инфекции в организме матери (в том числе наличие воспалительных заболеваний органов малого таза, урогенитальные инфекции);
- первичное инфицирование во время беременности, активация инфекционного процесса;
- патологическое снижение общего и местного иммунитета;
- наличие экстрагенитальной патологии (анемия, тромбофилии, аутоиммунные заболевания);
- повышение проницаемости плацентарного барьера во II и III триместрах беременности при невынашивании беременности и плацентарной недостаточности;
- отягощенный акушерско-гинекологический диагноз;
- неблагоприятные социально-бытовые факторы [1, 9, 11].
Патогенетические механизмы возникновения, развития и воздействия ВУИ разнообразны и зависят от многих факторов:
- срока беременности, при котором происходит инфицирование (чем раньше, тем прогноз будет более неблагоприятным);
- вида возбудителя, его вирулентности, массивности обсеменения;
- первичности или вторичности инфекционного процесса у беременной;
- путей проникновения инфекции к плоду (восходящий, нисходящий, гематогенный);
- степени распространенности и интенсивности воспалительного процесса;
- состояния организма матери, его иммунологической толерантности.
Влияние инфекции на эмбрион и плод заключается в воздействии комплекса следующих факторов:
- патологическое воздействие микроорганизмов и их токсинов (инфекционное заболевание, гипоксия плода, задержка развития плода);
- нарушение процесса имплантации и плацентации (низкая плацентация, предлежание плаценты);
- снижение метаболических процессов и иммунологической защиты плода [1, 9, 11].
Таким образом, реализуется ли внутриутробное инфицирование в ВУИ или нет, зависит от ряда факторов, которые мы представили выше.
Учитывая неспецифичность клинических проявлений ВУИ во время беременности, диагностика данной патологии в большинстве случаев затруднена и возможна лишь в результате сочетания клинических и лабораторно-диагностических методов обследования.
Клинический метод исследования позволяет выявить различные осложнения гестационного периода, такие как невынашивание беременности и синдром задержки роста плода (СЗРП). Кроме этого, немаловажное значение имеет наличие проявлений инфекции у матери (отит, гайморит, пиелонефрит, цистит и т. д.).
Методы, позволяющие оценить состояние фетоплацентарной системы:
- эхография (плацентометрия, поведенческая активность плода, его тонус, количество околоплодных вод, степень зрелости плаценты);
- допплерография (МПК, ФПК);
- кардиотокография (КТГ).
Микробиологические и серологические исследования:
- микроскопия влагалищных мазков (повышенное содержание лейкоцитов, кокковая флора, признаки дисбиоза, грибковая флора);
- бактериальный посев (наличие анаэробных и аэробных бактерий, грибковой флоры);
- ПЦР-диагностика (геномы ВПГ-1, ВПГ-2, ЦМВ, микоплазмы, уреаплазмы, хламидии);
- иммуноферментный анализ (ИФА): обнаружение в сыворотке специфических антител к возбудителям (IgM, IgG, IgA) в диагностически значимых титрах.
Исследование хориона (биопсия хориона): бактериологический метод, ПЦР-диагностика.
Исследование околоплодных вод (амниоцентез): бактериологический метод, ПЦР-диагностика.
Исследование пуповинной крови плода (кордоцентез): бактериологический метод, ПЦР-диагностика и специфический иммунный ответ (IgM) плода.
Морфологическое исследование плаценты, данные аутопсии.
Предположительный диагноз внутриутробного инфицирования и ВУИ помогают поставить косвенные методы:
- наличие у матери клиники инфекционного заболевания;
- наличие специфического иммунного ответа;
- результаты УЗИ, допплерометрии, КТГ.
К прямым методам диагностики внутриутробного инфицирования и ВУИ относятся: выявление возбудителя в материале, полученном при биопсии хориона, амниоцентезе (ПЦР, бактериологический метод), кордоцентезе (ПЦР, бактериологический метод и определение уровня специфических IgM).
Характер течения беременности при внутриутробной инфекции зависит от срока воздействия возбудителя.
На ранних этапах зародыша (1–3 недели беременности) из-за отсутствия механизмов взаимодействия инфекционного агента и плодного яйца реализации воспалительной реакции чаще всего не происходит. Контакт с инфекцией может закончиться альтернативным процессом и гибелью плодного яйца. Повреждение эмбриона инфекцией на 4–12 неделях беременности связано с вирусной инфекцией, проникновением микроорганизмов через хорион. Плод еще не имеет защитных механизмов. Нарушение закладки органов и систем вызывает тератогенный и эмбриотоксический эффект [13, 15].
В I триместре беременности специфических клинических признаков наличия ВУИ нет, косвенно о ней свидетельствуют некоторые эхографические признаки:
- повышенный локальный тонус матки;
- отслойка хориона;
- изменение формы плодного яйца (деформация);
- прогрессирование истмико-цервикальной недостаточности (функционального характера);
- гипоплазия хориона;
- увеличение или персистенция желточного мешка;
- несоответствие размеров эмбриона размерам полости плодного яйца (увеличение, уменьшение);
- отсутствие редукции хорионической полости.
Инфекционные фетопатии возникают с 16-й недели, когда происходит генерализация инфекции у плода. Могут возникать такие пороки развития, как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии) [12–15].
В III триместре плод реагирует на внедрение возбудителя локальной реакцией. Могут возникнуть энцефалит, гепатит, пневмония, интерстициальный нефрит. Влияние вирусов чаще всего проявляется признаками незрелости, дисэмбриогенетическими стигмами, затяжным адаптационным периодом, значительной потерей массы тела в раннем постнатальном периоде. Данные эхографии во II и III триместрах беременности, указывающие на развитие инфекции у плода:
- СЗРП;
- гипоксия плода;
- фетоплацентарная недостаточность;
- многоводие или маловодие;
- неиммунная водянка плода;
- увеличение или уменьшение толщины плаценты, наличие патологических включений;
- контрастирование базальной мембраны;
- наличие взвеси в околоплодных водах;
- кальцификаты в печени и селезенке и головном мозге плода;
- поликистоз легких, почек плода;
- эхогенные фиброзные включения на папиллярных мышцах и створках клапанов сердца плода;
- расширение петель кишечника плода (гипоксия, энтерит) [12–15].
После верификации диагноза ВУИ лечебные мероприятии проводят с помощью этиотропной, антимикробной терапии: препараты пенициллинового ряда и макролиды. Целесообразность назначения антимикробных препаратов не вызывает сомнения, если ВУИ обусловлено наличием патогенных возбудителей (бледная спирохета, токсоплазма, хламидии, гонококк и т. д.) [8, 14].
В настоящее время одним из наиболее дискутабельных вопросов в акушерстве является выяснение истинной этиологической роли генитальных микоплазм (Mycoplasma hominis, Mycoplasma genitalis, Ureaplasma urealyticum) в развитии патологии матери и плода. Инфицирование плода генитальными микоплазмами происходит преимущественно интранатально: в 18–55% — у доношенных новорожденных и в 29–55% — у недоношенных [3, 16, 20].
Актуальность проблемы урогенитального микоплазмоза обусловлена не только значительным распространением этой инфекции в популяции, но и неоднозначностью ее оценки как эпидемиологами, так и клиницистами [16].
По данным различных исследователей, микоплазмы являются возможной причиной развития конъюнктивитов, врожденных пневмоний, респираторного дистресс-синдрома, хронических заболеваний легких, менингита и неонатального сепсиса. Вопрос о терапии микоплазменной инфекции до настоящего времени остается открытым. В схемах терапии предусматривается 7–10-дневные курсы макролидов [1, 3, 21, 22].
Во время беременности противовирусная терапия при генитальном герпесе, цитомегаловирусной инфекции, вирусе ветряной оспы проводится с помощью этиотропных препаратов (ацикловир) начиная со II триместра гестационного периода. Целью лечения является профилактика рецидивирования и антенатального инфицирования [14, 17, 19].
Трихомонадная инфекция относится к группе негонококковых воспалительных заболеваний мочеполовых органов. Лечение трихомониаза во время беременности осуществляется с помощью метронидазол-содержащих препаратов начиная со II триместра гестационного периода [8].
Появление новых методов диагностики, разработка и внедрение новых лекарственных средств не изменяют ситуацию с внутриутробными инфекциями, оставляя это по-прежнему актуальной проблемой в акушерстве. Все это обуславливает неуклонный рост инфекции в человеческой популяции, высокий процент рецидивов инфекции даже у пациентов, получавших курс антибиотикотерапии в соответствии с действующими инструкциями и схемами лечения. Проблема осложняется тем, что в настоящее время отсутствует единая концепция механизма рецидивирования, недостаточно изучена роль микст-инфекции в возникновении, течении и персистировании инфекции, не учитываются особенности гормонального и иммунного статуса больного, не сформированы диагностические критерии контроля излеченности патологического процесса. Это все вместе взятое является стимулом для продолжения исследований, направленных на решение данных проблем. Несмотря на то что роль вирусных и бактериальных инфекций в этиологии и патогенезе многих патологических процессов не вызывает сомнений, вопрос о значении инфекций в качестве моновозбудителя на сегодняшний день окончательно не решен. Актуальным по-прежнему остается вопрос разработки алгоритма лабораторной диагностики заболеваний.
Только совершенствование диагностических подходов, разработка оптимальных алгоритмов и методов обследования и предупреждение распространения резистентных штаммов путем адекватного отношения к каждому пациенту индивидуально (обязательное проведение посевов на определение чувствительности к антибиотикам до назначения терапии) может изменить данную ситуацию.
Исследование выполнено за счет гранта Российского научного фонда (проект № 15-15-00109).
Литература
В. Н. Кузьмин 1 , доктор медицинских наук, профессор
К. Н. Арсланян, кандидат медицинских наук
Э. И. Харченко, кандидат медицинских наук
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Лабораторная диагностика токсоплазмоза основана только на определении специфических антител, так как антиген Toxoplasma gondii присутствует в крови очень непродолжительное время. При попадании возбудителя в организм человека в течение 7 - 14 дней начинается первичный иммунный ответ-выработка IgM антител. Максимальный уровень IgM антител достигается к 20-му дню от начала заболевания. Полное их исчезновение в большинстве случаев происходит в течение 3 - 4 месяцев. В этот же период в крови отмечаются максимальные значения IgG антител. После выздоровления происходит постепенное снижение титра IgG антител до определённого уровня, который сохраняется пожизненно и свидетельствует о наличии устойчивого иммунитета.
При определении IgG и IgM антител к токсоплазмозу в сыворотке крови возможны следующие варианты результатов:
- +IgG, -IgM - свидетельствует о бессимптомном здоровом носительстве (до 30% взрослого населения). Данное сочетание антител в крови беременных женщин не представляет угрозы для плода.
- -IgG, +IgM либо +IgG, +IgM - первичное инфицирование, острое или субклиническое течение. Во время беременности данная ситуация указывает на возможность внутриутробного инфицирования. В сомнительных случаях необходимо повторить анализ через 7 - 14 дней для подтверждения сероконверсии.
- -IgG, -IgM - отсутствие инфицирования. Беременные женщины с таким результатом должны быть включены в группу риска и обследоваться каждый триместр.
Вероятность врождённого токсоплазмоза составляет 1 на 1000 - 3500 родившихся детей. Это возможно при свежем случае инфицирования менее чем за 6 месяцев до наступления беременности и во время беременности. По данным НЦ АгиП РАН до 5 - 7% женщин заражаются во время беременности. Риск внутриутробного заражения плода увеличивается от 17% в первом триместре до 80% - в третьем триместре в случае острого токсоплазмоза беременной. Тяжесть поражения плода находится в зависимости от срока инфицирования (стадии внутриутробного развития).
| Срок беременности (недели) | Риск заражения (%) | Исход |
| 0 - 8 | 17 | Тяжёлые аномалии развития, в/у гибель плода |
| 8 - 18 | 25 | Поражения ЦНС (гидроцефалия, кальцификаты в ткани мозга), печени, хориоретинит, судорожный синдром. |
| 18 - 24 | 65 | Нарушения функций различных органов (гепатоспленомегалия, желтуха, анемия, тромбоцитопения) |
| 24 - 40 | 80 | Субклинические проявления болезни с манифестацией через несколько лет (глухота, хориоретинит) |
Наиболее тяжёлые последствия возникают при заражении до 24 недель. При подтверждении первичного инфицирования матери в первые 8 недель рекомендуется прерывание беременности. В более поздние сроки необходимы дополнительные исследования (УЗИ, забор пуповинной крови плода путём кордоцентеза с целью определения специфических антител IgM класса) для выработки тактики лечения и решения вопроса о возможном прерывании беременности.
Для установления диагноза определяются IgM антитела в сыворотке крови, максимальный титр которых наблюдается через 2 -3 недели от начала заболевания, а полное их исчезновение происходит через 1 - 3 месяца. IgG антитела определяются с 7-го дня заболевания, а максимальный титр - на 21-й день. Затем происходит снижение титра до определённого уровня, свидетельствующего об устойчивом иммунитете.
Возможны следующие сочетания IgG и IgM антител в сыворотке крови:
- +IgG, -IgM - свидетельствует о перенесённом заболевании и устойчивом иммунитете. Иммунитет вырабатывается в результате перенесённых клинически выраженных и бессимптомных форм. В последнее время появились данные, что иммунитет после перенесённой краснухи не такой прочный как считали ранее, так как взрослые иногда заболевают краснухой (5% случаев), несмотря на то, что болели ею в детстве. В таком случае в сыворотке крови наблюдается прирост вируснейтрализующих антител (IgG).
- -IgG, +IgM либо +IgG, +IgM - первичное инфицирование, острая форма или бессимптомное течение, которое наблюдается в 30% случаях. В данной ситуации велика опасность внутриутробного инфицирования. При заражении в первом триместре рекомендуется прерывание беременности. В сомнительных случаях анализ необходимо повторить через 7 - 14 дней для подтверждения сероконверсии.
- -IgG, -IgM - отсутствие иммунитета. По последним данным 10 - 20% женщин детородного возраста не имеют иммунитета к вирусу краснухи. Поэтому необходимо обследовать женщин до беременности и при отсутствии иммунитета рекомендовать вакцинацию. Беременные женщины, не имеющие IgG антител к вирусу краснухи, включаются в группу риска и обследуются каждый триместр.
Для подтверждения диагноза врождённой краснухи можно исследовать кровь плода, полученную с помощью кордоцентеза, на наличие специфических IgM антител. Данные антитела могут определяться в сыворотке крови плода с 23 недели гестации и сохраняются в крови внутриутробно инфицированного ребёнка в течение 6 - 12 месяцев после рождения. Иммунитет после врождённой краснухи менее стоек, так как формирование иммунитета происходит в условиях незрелой иммунной системы плода.
Для профилактики краснушной инфекции рекомендуется проведение вакцинации всех детей до 2-х лет и ревакцинация девочек в 12 - 14 лет для обеспечения иммунитета к вирусу краснухи в детородном возрасте, а также вакцинация женщин детородного возраста не имеющих иммунитета. Оценка эффективности вакцинации осуществляется с помощью определения в сыворотке крови специфических антител к вирусу краснухи IgG класса.
Цитомегаловирусная инфекция
Лабораторная диагностика ЦМВИ основана на определении специфических антител в сыворотке крови и других биологических жидкостях наряду с различными методами определения антигена и ДНК вируса. Наличие в крови специфических антител IgG и IgM класса зависит от формы и стадии ЦМВИ.
ЦМВ не выводится из организма полностью, поэтому при суперинфицировании нельзя говорить о реинфекции, так как повторное заражение возможно другими штаммами вируса. При первичном инфицировании сначала возрастает титр IgM антител, а затем IgG. Через 3 - 4 месяца IgM антитела исчезают, но при обострении ЦМВИ возможно незначительное и кратковременное увеличение их уровня (до 30% случаев), в то время как рост титра IgG антител во время реактивации инфекции более значительный.
Возможны следующие варианты сочетания IgG и IgM антител при ЦМВИ:
- -IgG, -IgM - отсутствие инфицирования. Наблюдается у 5 - 10% взрослого населения. Беременные женщины, не имеющие IgG антител к ЦМВ, включаются в группу риска и обследуются каждый триместр.
- ±IgG, +IgM - первичное инфицирование. Первичная ЦМВИ, возникающая у беременных в 1 - 4% случаях, сопровождается большим риском заражения плода, чем реактивированная.
- +IgG, ±IgM - персистирующая инфекция, реактивация. Можно рассматривать как косвенный признак вирусемии и обострения инфекции. Риск заражения плода составляет 0,5 - 2,5%. В большинстве случаев ЦМВИ протекает бессимптомно и при этом в анамнезе женщины имеются сведения о неблагоприятных исходах беременностей: выкидыши, мёртворождения, рождения детей с пороками развития.
- +IgG, -IgM - инфицированность, состояние ремиссии. Установлено, что наличие специфических IgG антител против ЦМВ в крови пациента указывает скорее на его инфицированность, чем на защищённость от инфекции. Данная ситуация не представляет непосредственной опасности для плода, но так как во время беременности развивается состояние физиологического иммунодефицита, в группу риска должны быть включены и серопозитивные и серонегативные женщины.
Герпесвирусная инфекция
Лабораторная диагностика ВПГИ включает в себя определение специфических антител к ВПГ в сыворотке крови наряду с определением антигена ВПГ в клетках крови, осадка мочи, слюне. Так как ВПГ I и ВПГ II имеют общие антигенные детерминанты, раздельное определение антител возможно только с помощью моноклональных антител. Поэтому для скрининговых обследований удобнее определять суммарные IgG к ВПГ I и ВПГ II и суммарные IgM антитела. При постановке диагноза необходимо учитывать лабораторные данные и клинические симптомы.
Возможны следующие варианты при определении специфических антител к ВПГ:
- -IgG, -IgM - отсутствие инфицирования. Наблюдается у 5 - 10% взрослого населения. Беременные женщины, не имеющие IgG антител к ВПГ, включаются в группу риска и обследуются каждый триместр.
- ±IgG, +IgM - первичное инфицирование. Клинические симптомы выявляются в 33% случаев. Возможна трансплацентарная передача. Риск заражения ребёнка во время родов - 50 - 70%. ВПГ передаётся через плаценту в 10 раз реже чем цитомегаловирус.
- +IgG, ±IgM - персистирующая инфекция, реактивация. Как и при ЦМВИ, можно рассматривать как косвенный признак вирусемии и обострения инфекции. В данном случае во время беременности риск заражения плода составляет 5%. В большинстве случаев ВПГИ имеет атипичное течение, и при этом в анамнезе женщины имеются сведения о неблагоприятных исходах беременностей: выкидыши, мёртворождения, рождения детей с пороками развития. Женщины с таким анамнезом подлежат обследованию до беременности.
- +IgG, -IgM - инфицированность, состояние ремиссии. Установлено, что наличие специфических IgG антител к ВПГ, как и при ЦМВИ, в крови пациента указывает скорее на его инфицированность, чем на защищенность от инфекции. Данная ситуация не представляет непосредственной опасности для плода, но так как во время беременности развивается состояние физиологического иммунодефицита, в группу риска должны быть включены и серопозитивные и серонегативные женщины (возможно и первичное инфицирование и обострение ВПГИ). При необходимости обследуют обоих супругов.
Чаще всего заражение происходит во время родов. Максимальный риск наличия ВПГ в родовых путях - рецидив за 6 - 8 недель и менее перед родами. Инкубационный период составляет 2 - 14 суток. Неонатальный герпес проявляется везикулами на кожных покровах, конъюктивитом, неврологическими симптомами, герпетическим энцефалитом. Летальность при генерализованной ВПГИ - до 75%. Для диагностики используют определение суммарных антител к ВПГ в крови новорождённого в динамике в течение первых 3 - 4 недель жизни. В случае обнаружения IgM антител можно предположить инфицирование.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Читайте также:

