Реабилитация системной красной волчанки
Обновлено: 24.04.2024
Системная красная волчанка (СКВ) - хроническое, прогрессирующее полисиндромное заболевание, характеризующееся генетически обусловленным несовершенством иммунорегуляторных процессов, приводящим к неконтролируемой продукции антител к собственным клеткам и их компонентам, с развитием аутоиммунного и иммунокомплексного хронического воспаления.
Код МКБ 10 - М.32.
Этиология и патогенез СКВ недостаточно изучены. Предполагается сочетанное воздействие факторов внешней среды (фотосенсибилизации, стресса, нарушений питания, курения), генетических и гормональных. Возможно, что пусковым механизмом СКВ является активация вирусов (в первую очередь ретровирусов и близких к ним).
Среди конкретных механизмов развития болезни доказано влияние иммунных нарушений в Т-клеточном репертуаре и в продукции цитокинов, которые принимают участие в активации и дифференциации В-лимфоцитов в антителопродуцирующие клетки. Последнее ведет к гиперпродукции различных антител (в том числе и аутоантител), образованию циркулирующих иммунных комплексов, которые, откладываясь на базальных мембранах клеток различных органов, вызывают повреждение тканей с воспалительной реакцией и высвобождением новых антигенов, к которым формируются антитела, образуются иммунные комплексы, создавая порочный круг.
Клиническая картина СКВ характеризуется полиморфизмом симптомов и прогрессированием, при отсутствии лечения возможен летальный исход в связи с недостаточностью функции того или иного органа или присоединением вторичной инфекции.
В клинической практике при постановке диагноза СКВ используются диагностические критерии Американской ревматологической ассоциации, включающие 11 признаков:
1) эритема на лице ("бабочка");
2) дискоидная волчанка;
3) фотосенсибилизация;
4) язвы полости рта;
5) артрит;
6) серозит;
7) поражение почек (протеинурия 0,5 и более грамм в сутки, наличие цилиндров в моче);
8) неврологические нарушения (судороги или психоз);
9) изменения крови:
-
а) гемолититческая анемия,
б) содержание лейкоцитов 4х10 9 /л и ниже при двух и более исследованиях,
в) лимфопения 1,5х10 9 /л при двух и более исследованиях,
г) тромбоцитопения 100х10 9 /л;
При наличии любых 4 критериев диагноз СКВ считается достоверным.
СКВ поражает преимущественно женщин детородного возраста (20-30 лет). Многие годы беременность при СКВ считалась противопоказанием из-за существовавшего мнения, что она может быть причиной обострения и летального исхода заболевания, а также высокой частоты неонатальных осложнений. Однако совершенствование диагностики болезни, разработка современных методов ее лечения и, как следствие этого, - улучшение прогноза заболевания позволили изменить представления о беременности при СКВ.
Влияние беременности на СКВ
У многих больных СКВ беременность завершается успешно и не приводит к обострению заболевания вообще или обострение не сопровождается существенным ухудшением состояния больной и легко подавляется.
Среди факторов, определяющих вероятность обострения СКВ в период гестации, первое место занимает активность заболевания на момент зачатия.
Установлено, что наступление беременности при низкой активности СКВ в большинстве случаев не ухудшает заболевание. На прогноз заболевания не влияют длительность болезни и дозы кортикостероидных препаратов, предшествующие наступлению гестации. Зачатие в период высокой активности волчаночного процесса с тяжелыми органными поражениями почек, центральной нервной системы, легких и сердца, тем более симптомы функциональной недостаточности любого из этих органов резко увеличивают вероятность неблагоприятного исхода и СКВ, и беременности.
Для определения степени активности СКВ применяется классификация В.А.Насоновой (1972), учитывающая ряд клинико-лабораторных показателей заболевания (см. таблицу). Отсутствие активности СКВ или I (минимальная) степень активности позволяют разрешить беременить больной СКВ.
"Критическими" с точки зрения обострения заболевания, когда велика вероятность активации СКВ являются I триместр и первая половина беременности. Заслуживают внимания и первые 2-3 месяца после родоразрешения.
Клиническо-лабораторная характеристика активности патологичекого процесса при СКВ.
Влияние СКВ на течение беременности
Фертильность (способность к зачатию) у больных СКВ обычно не страдает, но тяжелые обострения заболевания и использование высоких доз кортикостероидов, умеренная почечная недостаточность вызывают субфертильность (олиго- и аменорею). К потере фертильности у больных СКВ может привести использование цитостатика циклофосфамида. Данных о влиянии других лекарственных препаратов, обычно используемых при лечении СКВ, на фертильность не имеется.
СКВ может неблагоприятно сказываться на беременности и ее исходе, что проявляется повышенной частотой самопроизвольных абортов, преждевременных родов, мертворождений и гипотрофий новорожденных, а также высоким процентом аномалий родовой деятельности и послеродовых осложнений. Поздний токсикоз у беременных с СКВ встречается в 2,8 раз чаще, чем у здоровых беременных, у 18,6% больных в последовом и раннем послеродовом периодах возникают кровотечения. Клиника гестоза может напоминать таковую при волчаночном гломерулонефрите. Только учет клинико-лабораторной картины заболевания, времени ее проявления могут быть решающими при проведении дифференциального диагноза. Различная тактика ведения больных с активным волчаночным нефритом (назначение иммуносупрессивной терапии) и гестозом (симптоматическая терапия) обусловливает практическую значимость правильной и своевременной диагностики этих состояний.
Большое значение в улучшении течения и исходов беременности и родов при СКВ имеет предшествующая гестации длительная (не менее 6-12 месяцев) ремиссия заболевания.
СКВ и антифосфолипидный синдром.
В последнее десятилетие проблема неблагоприятных акушерских исходов при СКВ приобрела новое направление, связанное с обнаружением у 30-40% больных СКВ особой группы антител - антифосфолипидных (АФА), к которым относятся: волчаночный антикоагулянт, антикардиолипиновые антитела и антитела, обусловливающие появление ложноположительной реакции Вассермана. Присутствие АФА у больных СКВ может приводить к формированию антифосфолипидного синдрома, одним из проявлений которого является привычное невынашивание беременности.
Антифосфолипидный синдром (АФС) впервые был описан при СКВ, а затем при некоторых других (преимущественно аутоиммунных) заболеваниях и состояниях. Основными диагностическими критериями АФС считают:
-венозные и артериальные тромбозы,
-привычное невынашивание беременности,
-тромбоцитопению.
При этом под "привычным невынашиванием беременности" подразумевается не менее двух случаев плодных потерь, не связанных с гинекологической или сугубо акушерской патологией.
Наличие одного из этих клинических признаков и повторных положительных анализов на волчаночный антикоагулянт и/или IgG-, IgM-антикардиолипиновые антитела позволяет диагностировать АФС.
Одновременное присутствие волчаночного антикоагулянта и антикардиолипиновых антител имеется у 60-80% больных. АФА могут исчезать или их титры уменьшаются в период между беременностями, а затем вновь появляться в очередную беременность.
Присутствие АФА у больных СКВ обусловливает до 90% случаев плодных потерь, при этом риск последних нарастает при наличии в анамнезе самопроизвольных выкидышей. Если гестация у беременных с АФС и не заканчивается смертью плода, которая чаще наступает в первой половине беременности, то у таких больных нередко наблюдаются поздний гестоз (в том числе пре- и эклампсия) и преждевременные роды. Описан и "послеродовый АФА-зависимый синдром", который проявляется тромбозами крупных и средних сосудов с соответствующей симптоматикой.
Таким образом, обнаружение АФА у беременных с СКВ в большинстве случаев осложняет течение беременности и послеродового периода и является одной из главных причин плодных потерь. Поэтому своевременная диагностика АФС, адекватная терапевтическая и акушерская тактика необходимы для улучшения исходов беременности у больных СКВ с сопутствующим АФС.
Влияние СКВ на плод (неонатальная волчанка)
Неонатальная волчанка (НВ) - следствие пассивно приобретенного аутоиммунного заболевания, серологическими маркерами которого являются антитела к растворимым антигенам тканевых рибонуклеопротеинов - Ro/Lа-антитела. С НВ связано около 1% всех случаев плодных потерь при "СКВ-беременности".
Пассвная трансплацентарная передача Ro/Lа-антител во время беременности плоду ведет к развитию у него поражения кожи и/или сердца -двум основным признакам НВ. Редко НВ сопровождается другими проявлениями (гепатомегалией, печеночной дисфункцией, спленомегалией, лимфоаденопатией, пневмонитом, тромбоцитопенией, анемией), которые обычно носят преходящий характер.
Кожные высыпания - наиболее частый синдром НВ, появляются обычно в течение первых 2-х месяцев жизни, типично - на лице и верхних конечностях, нередко после инсоляции или ультрафиолетового облучения по поводу неонатальной желтухи. Часто по форме сыпь представлена ограниченными округлыми пятнами и бляшками, нередко имеет сходство с подострой кожной красной волчанкой. Поражение обычно регрессирует в течение 6 месяцев, оставляя в отдельных случаях гипопигментацию.
Терапии НВ в большинстве случаев не требует, симптоматика стихает по мере естественного выведения материнских антител (кроме, ВППБ). Профилактическое назначение медикаментозных средств также не рекомендуется. Необходимость в дополнительной терапии возникает при наличии у матери ранее рожденных детей с НВ и предполагает применение высоких доз дексаметазона (как неинактивирующегося в плаценте) и плазмафереза в течение беременности.
Акушерская и терапевтическая тактика
1. Наступление и вынашивание беременности у больной СКВ могут быть разрешены при клинической ремиссии или минимальной клиникоиммунологической активности заболевания (I степени, по классификации В.А.Насоновой), продолжающейся не менее 6-12 месяцев до зачатия, и отсутствии симптомов функциональной недостаточности любого органа или системы.
2. Противопоказаниями для беременности при СКВ являются наличие высокой активности заболевания, симптомы волчаночного нефрита (протеинурия более 3 г/сут.), нефротический синдром, почечная недостаточность (сывороточный креатинин более 130 мкмоль/л), артериальная гипертензия, недостаточный сердечно-легочный резерв, также как функциональная недостаточность любого органа и поражение центральной нервной системы.
3. Использование медицинского аборта при СКВ как метода предупреждения обострения болезни в период гестации неоправдано. Более того, он может явиться провоцирующим фактором активации СКВ. Однако терапевтический аборт показан в случаях тяжелой почечной, сердечной или легочной недостаточности у больных СКВ.
4. Наличие АФС или отдельных его синдромов у больной СКВ требует проведения повторных исследований на АФА (как на волчаночный антикоагулянт, так и на антикардиолипиновые антитела) на этапе планирования беременности и мониторинг их при наступлении последней с целью своевременной коррекции титров АФА во избежание осложнений течения заболевания и гестационного процесса.
5. У анти-Rо/Lа-позитивных беременных с СКВ показано повторное проведение ультразвукового исследования плода и допплерометрии пупочных сосудов после 18 недели гестации для ранней диагностики нарушений сердечной деятельности плода и определения показаний для срочного родоразрешения.
6. Доза кортикостероидного препарата при условии стабильности состояния больной должна оставаться неизменной в течение всей беременности и не менее 2-х месяцев после родоразрешения. При обострении СКВ - терапия кортикостероидами усиливается до адекватной степени активности болезни. Вопрос о прерывании беременности решается индивидуально.
7. Госпитализация в родильный дом должна быть не позднее 36-37 недели гестации. В более ранние сроки при обострении течения болезни женщину целесообразно госпитализировать в ревматологический или терапевтический стационар.
8. При наличии клинических признаков активности заболевания родоразрешение производится преждевременно, что следует учитывать при определении срока госпитализации в родильный дом. В период родов показано дополнительное парентеральное введение гидрокортизона (30-100 мг/сут.) с последующим постепенным снижением этой дозы в течение 3-5 дней после родов или аборта.
9. Показаниями для оперативного родоразрешения (кесарева сечения) беременных с СКВ, кроме акушерской патологии, являются:
СПИСОК ЛИТЕРАТУРЫ
Системная красная волчанка (СКВ) — это аутоиммунное мультисистемное заболевание, которое может поражать такие жизненно важные органы, как почки и головной мозг. Хотя в последние десятилетия выживаемость больных СКВ значительно улучшилась в результате использования кортикостероидов и иммуносупрессантов, современное лечение сопровождается значительными побочными эффектами. И сама болезнь, и побочные эффекты лечения приводят к кумуляции органных повреждений, что снижает и качество, и продолжительность жизни пациентов. Международная экспертная группа сформулировала рекомендации для достижения хороших результатов лечения СКВ с учетом клинического течения, накопления необратимых органных изменений и функционального статуса. Рабочая группа установила четыре всеобъемлющих принципа ведения больных СКВ, подчеркивая важность вклада пациента в процесс принятия решений, мультидисциплинарного подхода, регулярного мониторинга и корректировки терапии с целью повышения продолжительности жизни, предотвращения повреждения внутренних органов, оптимизации качества жизни путем снижения активности СКВ, минимизации проявлений сопутствующей патологии и токсичности лекарственных препаратов.
Ключевые слова: системная красная волчанка, лечение, ремиссия, активность, качество жизни.
Challenges in treating-to-target in systemic lupus erythematosus
Mok T.M.
City University of Hong Kong
North District Hospital, New Territories, Hong Kong
Systemic lupus erythematosus (SLE) is an autoimmune multi-systemic disease that can affect such vital organs as the kidneys and the brain. Although the survival rate of SLE patients has dramatically improved over the past few decades as a result of the use of corticosteroids and immunosuppressants, the current treatment is associated with significant adverse effects. Both the disease itself and the side effects from treatment are associated with cumulative organ damage, which reduces both the quality and expectancy of patients’ life. The international expert group on treat-to-target in SLE has formulated recommendations with the goals to yield superior outcomes in terms of clinical course, long-term damage and functional status. The working group established four overarching principles for managing SLE patients, emphasizing the importance of contribution of the patient in the decision making, the multidisciplinary approach, the regular monitoring and adjustment of therapy with the goals towards ensuring long-term survival, preventing organ damage, optimising health-related quality of life by controlling disease activity, minimising comorbidities and drug toxicity.
Key words: systemic lupus erythematosus, treatment, remission, activity, quality of life.
For citation: Mok T.M. Challenges in treating-to-target in systemic lupus erythematosus // RMJ. 2018. № 4(I). P. 6–9.
Введение
Системная красная волчанка (СКВ) — это системное аутоиммунное заболевание, распространенное среди азиатов несколько больше, чем в европейской популяции. СКВ затрагивает преимущественно женщин в репродуктивном возрасте и связана со значительной заболеваемостью и смертностью [1]. Это мультисистемное воспалительное заболевание, которое может поражать такие жизненно важные органы, как почки и головной мозг. Хотя в последние десятилетия выживаемость больных СКВ значительно улучшилась в результате использования кортикостероидов и иммуносупрессантов, современное лечение сопровождается значительными побочными эффектами. И сама болезнь, и побочные эффекты лечения приводят к кумуляции органных повреждений, что снижает качество и продолжительность жизни пациентов. Пациенты с СКВ также имеют повышенный стандартизированный коэффициент смертности, прежде всего за счет сердечно-сосудистой патологии и инфекционных осложнений [2].
Проблема ведения больных СКВ далека от разрешения
Несмотря на то, что СКВ по большей части имеет волнообразное течение клинической картины, у значительной доли пациентов (46–52%) имеет место постоянно высокая активность болезни [3]. Около четверти пациентов (24,5%) демонстрируют рефрактерное к проводимой терапии течение СКВ [4]. Рефрактерное течение СКВ, несмотря на современный арсенал терапии, часто проявляется симптомами изъязвления кожи (дискоидной волчанки), волчаночного нефрита и нейропсихиатрической симптоматикой. Пациенты с активным волчаночным нефритом, которые не отвечают на индукционную терапию, имеют худший долговременный прогноз по сравнению с теми, у кого имеется полностью или частично ранний положительный эффект лечения. В целом поражение внутренних органов при СКВ обусловливает неблагоприятный прогноз болезни и более высокую летальность [5].
В настоящее время единственным утвержденным биологическим препаратом для лечения активной СКВ является белимумаб. Он показан при легкой и умеренной степени активности заболевания. В связи с этим возникает насущная потребность в разработке стратегий для лучшего ведения больных СКВ и создания терапевтических подходов с более высокой клинической эффективностью и меньшим количеством побочных эффектов.
Трудности, стоящие на пути внедрения стратегии Т2Т при СКВ
Критерии Европейской антиревматической лиги (EULAR) для стратегии Т2Т при СКВ
Международная целевая группа сформулировала рекомендации с целями достижения превосходных результатов лечения СКВ с учетом клинического течения, накопления необратимых изменений и функционального статуса. Рабочая группа установила 4 всеобъемлющих принципа ведения больных СКВ, подчеркивая важность:
вклада пациента в процесс принятия решений;
мультидисциплинарного подхода;
регулярного мониторинга и корректировки терапии;
повышения продолжительности жизни, предотвращения повреждения внутренних органов, оптимизации качества жизни путем снижения активности СКВ, минимизации проявлений сопутствующей патологии и токсичности лекарственных препаратов.
Ниже представлен упрощенный вариант этих рекомендаций:
Ремиссия или как можно более низкая активность болезни, если ремиссия не может быть достигнута, являются терапевтическими мишенями, измеряемыми с помощью надежного индекса активности СКВ.
Предотвращение обострений.
Лечение больных СКВ с признаками серологической активности без явной клинической активности не рекомендуется.
Предотвращение накопления необратимых изменений в органах.
Решение проблемы факторов, влияющих на здоровье и связанных с качеством жизни больного: усталость, боль, депрессия.
Раннее распознавание и лечение волчаночного нефрита.
Как минимум 3-летняя поддерживающая иммуносупрессивная терапия волчаночного нефрита после успешного ответа на начальный курс терапии.
Использование, насколько возможно, низких доз кортикостероидов и, при возможности, их полная отмена.
Профилактика и лечение проявлений антифосфолипидного синдрома.
Применение противомалярийных препаратов у всех больных СКВ, если нет противопоказаний.
Контроль сопутствующей патологии.
Заключение
При СКВ необходимо мобилизовать усилия врачей для разработки стратегии Т2Т в целях оптимизации лечения этого заболевания. С разработкой удобных в клинической практике методик для измерения степени органоспецифических поражений, при конкретизации реалистичных и достижимых терапевтических целей, с выработкой критериев эффективности лечения поражения органов, с созданием системы строгого мониторинга пациентов с серологической активностью и созданием новых, высокоэффективных биологических агентов можно предположить, что цели профилактики обострений и органных повреждений при СКВ, а в конечном итоге — улучшение качества жизни и снижение смертности могут быть достигнуты.
Оригинал статьи: Mok T.M. Challenges in treating-to-target in systemic lupus erythematosus // Hong Kong Medical Diary. 2017. Vol. 22(10). P. 15–19. Перевод и публикация согласованы с редакцией издания. This reprint was authorized by The Federation of Medical Societies of Hong Kong. The Hong Kong Medical Diary May Issue 2017.
Статью перевел к.м.н. М.В. Головизнин
1. Mok M.Y., Li W.L. Do Asian patients have worse lupus? // Lupus. 2010. Vol. 19(12). P. 1384–1390.
2. Bernatsky S., Boivin J.F., Joseph L. et al. Mortality in systemic lupus erythematosus // Arthritis Rheum. 2006. Vol. 54(8). P. 2550–2257.
3. Conti F., Ceccarelli F., Perricone C. et al. Flare, persistently active disease, and serologically active clinically quiescent disease in systemic lupus erythematosus: a 2-year follow-up study // PLoS One. 2012. Vol. 7. P. e45934.
4. Pego-Reigosa J.M., Rua-Figueroa I., Lopez-Longo F.J. et al. Analysis of disease activity and response to treatment in a large Spanish cohort of patients with systemic lupus erythematosus // Lupus. 2015. Vol. 24. P. 720–729.
5. Bruce I.N., O’Keeffe A.G., Farewell V. et al. Factors associated with damage accrual in patients with systemic lupus erythematosus: results from the Systemic Lupus International Collaborating Clinics (SLICC) Inception Cohort // Ann Rheum Dis. 2015. Vol. 74. P. 1706–1713.
6. Atar D., Birkeland K.I., Uhlig T. ‘Treat to target’: moving targets from hypertension, hyperlipidaemia and diabetes to rheumatoid arthritis // Ann Rheum Dis. 2010. Vol. 69. P. 629–630.
7. Smolen J.S., Breedveld F.C., Burmester G.R. et al.Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force // Ann Rheum Dis. 2016. Vol. 75. P. 3–15.
8. Gibson K.L., Gipson D.S., Massengill S.A. et al. Predictors of relapse and end stage kidney disease in proliferative lupus nephritis: focus on children, adolescents, and young adults // Clin J Am Soc Nephrol. 2009. Vol. 4. P. 1962–1967.
9. Urowitz M.B., Feletar M., Bruce I.N. et al. Prolonged remission in systemic lupus erythematosus // J Rheumatol. 2005. Vol. 32. P. 1467–1472.
10. Medina-Quinones C.V., Ramos-Merino L., Ruiz-Sada P., Isenberg D. Analysis of Complete Remission in Systemic Lupus Erythematosus Patients Over a 32-Year Period // Arthritis Care Res. 2016. Vol. 68. P. 981–987.
11. Carlavilla A., Gutierrez E., Ortuño T. et al. Relapse of lupus nephritis more than 10 years after complete remission // Nephrol Dial Transplant. 2005. Vol. 20. P. 1994–1998.
12. Golder V., Kandane-Rathnayake R., Hoi A.Y. et al. Association of the lupus low disease activity state (LLDAS) with health-related quality of life in a multinational prospective study // Arthritis Res Ther. 2017. Vol. 19. P. 62.
13. Mikdashi J., Nived O. Measuring disease activity in adults with systemic lupus erythematosus: the challenges of administrative burden and responsiveness to patient concerns in clinical research // Arthritis Res Ther. 2015. Vol. 17. P. 183.
14. Romero-Diaz J., Isenberg D., Ramsey-Goldman R. Measures of adult systemic lupus erythematosus: updated version of British Isles Lupus Assessment Group (BILAG 2004), European Consensus Lupus Activity Measurements (ECLAM), Systemic Lupus Activity Measure, Revised (SLAM-R), Systemic Lupus Activity Questionnaire for Population Studies (SLAQ), Systemic Lupus Erythematosus Disease Activity Index 2000 (SLEDAI-2K), and Systemic Lupus International Collaborating Clinics/American College of Rheumatology Damage Index (SDI) // Arthritis Care Res. 2011. Vol. 63 Suppl. 11. P. S37–S46.
15. Isenberg D.A., Gordon C., Group BGBILA. From BILAG to BLIPS — disease activity assessment in lupus past, present and future // Lupus. 2000. Vol. 9. P. 651–654.
16. Steiman A.J., Gladman D.D., Ibanez D., Urowitz M.B. Prolonged serologically active clinically quiescent systemic lupus erythematosus: frequency and outcome // J Rheumatol. 2010. Vol. 37. P. 1822–1827.
17. Steiman A.J., Gladman D.D., Ibañez D., Urowitz M.B. Outcomes in patients with systemic lupus erythematosus with and without a prolonged serologically active clinically quiescent period // Arthritis Care Res. 2012. Vol. 64. P. 511–518.
18. Tseng C.E., Buyon J.P., Kim M. et al. The effect of moderate-dose corticosteroids in preventing severe flares in patients with serologically active, but clinically stable, systemic lupus erythematosus: findings of a prospective, randomized, double-blind, placebo-controlled trial // Arthritis Rheum. 2006. Vol. 54. P. 3623–3632.
19. Mok M.Y., Chan E.Y., Fong D.Y. et al. Antiphospholipid antibody profiles and their clinical associations in Chinese patients with systemic lupus erythematosus // J Rheumatol. 2005. Vol. 32. P. 622–628.
20. Mikdashi J., Handwerger B. Predictors of neuropsychiatric damage in systemic lupus erythematosus: data from the Maryland lupus cohort // Rheumatology. 2004. Vol. 43. P. 1555–1560.
Для цитирования: Соловьев С.К., Насонова В.А. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ ОБ ИНТЕНСИВНОЙ ТЕРАПИИ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ. РМЖ. 1998;18:6.
Даны подробные сведения об интенсивной терапии системной красной волчанки, ее современном содержании и перспективе.
The paper gives detailed information on intensive therapy for systemic lupus erythematosus, its present-day content and perspectives.
С.К. Соловьев, В.А. Насонова — Институт ревматологии РАМН, Москва
S.K.Solovyev, V.A.Nasonova, Institute of Rheumatology, Russian Academy of Medical Sciences, Moscow
С истемная красная волчанка (СКВ) является классическим примером аутоиммунного заболевания. Прогрессирующее поражение жизненно важных органов и систем определяет жизненный и социальный прогноз больных СКВ [1]. За последние два десятилетия принципы терапии СКВ претерпели существенные, практически революционные изменения. На смену прерывистому назначению малых и средних доз глюкокортикостероидных гормонов (ГКС) пришли схемы длительного, многомесячного приема “подавляющих” доз – от 1 до 1,5 мгкгдень и цитотоксические иммунодепрессанты. Комбинированная терапия преднизолоном, циклофосфамидом или азатиоприном позволила увеличить до 40 – 60% 5-летнюю выживаемость в различных группах больных СКВ. Начиная с середины 70-х годов, в практическую ревматологию активно внедряется внутривенное введение сверхвысоких доз метилпреднизолона (МП) и циклофосфана (ЦФ), обозначаемое впоследствии термином “пульс-терапия” (ПТ). С начала 80-х годов для купирования острой моно- или полиорганной недостаточности у больных СКВ все чаще с успехом применяется экстракорпоральная терапия – гемосорбция (ГС) и плазмаферез (ПФ), внутривенное введение мегадоз иммуноглобулина G(ВИГ). Вскоре различные схемы и комбинации экстракорпоральных методов лечения и внутривенного введения ударных доз ГКС, ЦФ и иммуноглобулина послужили основой для определения принципов интенсивной терапии (ИТ) СКВ.
Пульс-терапия метилпреднизолоном
Наиболее известным и распространенным методом ИТ, безусловно, является ПТ. Традиционным, классическим вариантом ПТ считается внутривенное введение 1г МП за 30 – 40 мин в течение 3 последующих дней [2]. Патофизиологическим обоснованием для применения ударных доз ГКС является их способность активно взаимодействовать с системой иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ПТ – подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную лимфопению. Тормозящее воздействие ПТ на b-лимфоциты приводит к достаточно стойкому (2 – 4 нед) снижению уровня иммуноглобулинов и иммунных комплексов в плазме крови, что важно в случаях гиперпродукции аутоантител и повышенным уровнем циркулирующих иммунных комплексов (ЦИК). Иммуномодулирующее действие ПТ определяется и ингибированием экспрессии и функциональной активности Fc и C3 рецепторов мононуклеаров, что, видимо, и обусловливает клинический эффект у больных с цитопениями.
Противовоспалительный и иммунорегуляторный эффект ПТ в значительной степени обусловлен ее воздействием на систему цитокинов (в особенности на противовоспалительные цитокины – интерлейкины -1,-6 и -8), фактор некроза опухоли и подавлением транскрипции генов металлопротеиназ и липокортина.
Впервые ПТ 6-МП была с успехом применена у больных с активным волчаночным нефритом Kimberly в 1976 г. В дальнейшем 3-дневная ПТ оказалась высокоэффективным способом лечения при многих внепочечных проявлениях СКВ – лихорадке, полисерозите, полиартрите, в некоторых случаях волчаночной церебропатии и цитопении [1, 2]. Лихорадочный синдром, полиартрит и полисерозит обычно бывают полностью купированы на 2 – 3 день от начала ПТ. Эффективность ПТ при церебропатии подтверждается в случаях органического поражения мозга. При появлении первых симптомов (головные боли, зрительные расстройства) 1 г МП вводится в течение 3 – 7 последующих дней. В случаях поперечного миелита эффективность ПТ невысока, около 50%, и зависит от сроков начала лечения. ПТ высокоэффективна у больных СКВ с лейкопениями, в том числе и лекарственными, в некоторых случаях аутоиммунной анемии и тромбоцитопении (синдром Верльгофа). При лечении наиболее прогностически неблагоприятного и сложного для курации волчаночного нефрита ПТ, безусловно, занимает одно из центральных мест. Эффективность лечения во многом зависит от длительности нефрита, морфологической стадии и выраженности почечной недостаточности. Наиболее эффективно назначение 3-дневной ПТ МП на самых ранних стадиях нефрита, без признаков серьезного изменения почечной ткани и почечной недостаточности. В этих случаях длительность “почечной” ремиссии может достигать многих месяцев и даже лет. У больных с активным быстропрогрессирующим люпус-нефритом стандартная ПТ приводит к быстрому уменьшению протеинурии, мочевого осадка и отеков, улучшению функции почек и стабилизации АД. Для повышения клинической эффективности ПТ при прогрессирующем нефрите используется ежемесячное, повторное внутривенное введение 1 г МП в течение 6 – 12 мес [3, 4]. Программное проведение ПТ у больных люпус-нефритом способствует стойкому улучшению азотовыделительной функции почек, уменьшению протеинурии и уровня антиядерных антител в сыворотке крови. Нестабильный клинический эффект ПТ наблюдается у больных с длительным, многолетним течением люпус-нефрита, преобладанием склероза клубочкового аппарата (Y класс по классификации ВОЗ), стойкой артериальной гипертензией и прогрессирующей азотемией.
Побочные явления ПТ МП обычно ограничены тахикардией, гиперемией лица и небольшим эмоциональным возбуждением. Значительно более редко можно наблюдать брадикардию, артериальную гипер- или гипотензию, кратковременный артрит крупных суставов, икоту. Известны единичные случаи внезапной смерти, желудочковые аритмии, вероятно, обусловленные острыми метаболическими нарушениями в миокарде. Для уменьшения риска кардиальных осложнений запрещено сочетание ПТ и фуросемида.
Ударные дозы циклофосфана
Алкилирующий цитотоксик ЦФ по частоте применения у больных с острым и неблагоприятным течением СКВ прочно занимает второе место после ГКС. Наиболее эффективным в настоящее время считается внутривенное введение ударных доз ЦФ [1, 5]. При активном волчаночном нефрите ЦФ назначают из расчета 1000 мг/м2 поверхности тела или 15 – 20 мг на 1 кг массы тела. Наилучшие результаты достигаются при ежемесячном назначении 1 г препарата в течение 6 мес, и далее по 1 г каждые 3 мес до 1,5 лет. Существует и более интенсивная схема внутривенного применения ЦФ – по 500 мг еженедельно, длительностью до 10 нед. У больных СКВ с одновременным поражением почек, кожи, ЦНС и высокой иммунологической активностью целесообразно комбинированное назначение ударных доз МП и ЦФ. Добавление 1 г ЦФ во 2-й или 3-й день стандартной ПТ МП существенно повышает эффективность лечения, приводит к быстрому улучшению клинической картины, нормализации иммунологических и воспалительных показателей активности [6]. Одновременно назначение ударных доз МП и ЦФ может быть высокоэффективным в лечении аутоиммунной волчаночной тромбоцитопении, анемии, распространенном поражении кожи и слизистых оболочек. Особенно актуальна комбинированная ПТ у больных с геморрагическим пневмонитом и такими поражениями ЦНС, как поперечный миелит и поражение зрительного нерва. Внутривенное введение МП в дозах от 250 до 1000 мг одновременно с ЦФ не только значительно усиливает противовоспалительный эффект терапии, но и обладает определенным протективным действием, нивелируя цитотоксические проявления ЦФ. Интенсивная терапия ЦФ, значительно расширяя возможности курации СКВ с полиорганнной недостаточностью, имеет свои особенности и ограничения. Так, у больных с люпус-нефритом, успешно пролеченных ЦФ, может развиться обострение вскоре после отмены препарата. Значительно снижается эффективность ПТ ЦФ при преобладании фиброзных и склеротических изменений в гломерулах (IY класс классификации ВОЗ), нарушении азотовыделительной функции почек с развитием креатининемии. Среди побочных реакций и осложнений наиболее часто можно наблюдать лейко- и нейтропению, учащение вторичной инфекции и аменорею. Ударные дозы ЦФ, вводимые внутривенно, практически никогда не приводят к развитию геморрагического цистита, а угроза развития опухолей реально рассматривается только при суммарной дозе более 60 г.
Внутривенный иммуноглобулин G
ВИГ является препаратом нормального полиспецифического иммуноглобулина, полученного из пула сывороток не менее чем 5000 доноров. Коммерческий ВИГ должен содержать не менее 97% очищенной фракции IgG с сохранной функцией фрагментов F(ab) и Fc, без спонтанной агрегации, быть безопасным по ВИЧ и гепатиту и с периодом полужизни – 21 день. Стандартными препаратами ВИГ, отвечающими этим требованиям, являются сандоглобулин, октагам и некоторые другие препараты IY поколения. Основные механизмы действия ВИГ сводятся к блокаде Fc-рецепторов клеток, ингибированию синтеза антител, модуляции Т-лимфоцитов и влиянию на синтез цитокинов. Большое значение в реализации лечебного эффекта имеет наличие в препарате антиидиотипических антител. При СКВ наибольшую эффективность препарата наблюдают у больных с аутоиммунными цитопениями и при развитии тяжелой церебропатии, сопровождающейся комой, судорогами и психозом [2]. ВИГ в этих случаях назначают как “последнее средство” по 0,5 г на 1 кг массы тела в течение 5 последующих дней. Описаны единичные наблюдения успешного применения ВИГ у больных с генерализованным кожным васкулитом, рецидивирующим полисерозитом и в случаях привычного невынашивания беременности при антифосфолипидном синдроме (АФС).
У больных с волчаночным нефритом назначение ВИГ требует большой осторожности из-за опасности резкого прогрессирования почечной недостаточности. Встречаются аллергические реакции в виде озноба, сыпи, лихорадочной реакции, головокружения и тошноты. Абсолютным противопоказанием для применения ВИГ является дефицит IgA.
Плазмаферез. Сорбционные методы лечения
В современном исполнении ПФ осуществляют с помощью центрифужной или мембранной технологии, с удалением за одну процедуру 40 – 60 мл/кг плазмы. Рекомендуемые курсы ПФ состоят из 3 – 6 процедур, проводимых последовательно или с короткими интервалами. ПФ у больных СКВ показан как “острое вмешательство” при осложненной криоглобулинемии, гипервязком синдроме и тромбоцитопенической пурпуре [2]. ПФ может быть использован как дополнительное высокоэффективное средство при состояниях, непосредственно угрожающих жизни: молниеносный васкулит, полимиелорадикулоневрит, церебральная кома, геморрагический пневмонит. Оправдано подключение ПФ в случаях волчаночного нефрита, рефрактерного к ГКС и цитотоксикам, у больных с АФС с привычными викидышами [7].
Среди сорбционных методов лечения различают селективное и неселективное удаление из циркуляции патологических белковых структур. К неселективным относится ГС, в основе которой лежат физико-химические свойства активированного угля. Помимо прямого удаления ЦИК, аутоантител и цитокинов, ГС стимулирует антиидиотипическую активность, фагоцитоз и повышает чувствительность клеточных рецепторов к лекарственным препаратам. В лечении больных СКВ ГС имеет те же показания, что и ПФ.
Селективная сорбция осуществляется с помощью селективных иммуносорбентов (биологических или химических), способных целенаправленно удалять РФ, антитела к ДНК и ЦИК. Экспериментальные исследования в этой области свидетельствуют о высокой эффективности иммуносорбентов у больных СКВ с высокой иммунологической активностью. Побочные проявления экстракорпоральной терапии обычно сводятся к транзиторной гиповолемии и ознобу, противопоказанием является язвенная болезнь в стадии обострения, маточное кровотечение, непереносимость гепарина. Несмотря на подчас фантастические результаты в критических ситуациях при СКВ, ПФ и ГС как самостоятельные методы лечения редко находят свое место в плановой терапии. Их применение в значительной степени сдерживается развитием так называемого синдрома рикошета, возникающим непосредственно после процедуры и характеризующимся рецидивом клинической активности и резким повышением уровня антител и ЦИК. Подавление активности антителопродуцирующих b-лимфоцитов и предотвращение синдрома рикошета достигается путем последовательного, синхронного применения ПФ и ПТ МП-ЦФ [2]. Синхронизация интенсивной терапии в виде многомесячной программы, возможно, превосходит по эффективности все известные способы лечения СКВ с неблагоприятным жизненным прогнозом [8]. Существует несколько методик синхронной интенсивной терапии: 1) серия плазмаферезов из 3 – 6 последовательных процедур с дальнейшим коротким курсом мегадоз ЦФ внутривенно; 2) начальная серия процедур ПФ (обычно 3) синхронно с внутривенным введением ЦФ 1 г и МП 3 г и в дальнейшем по 1 процедуре ПФ в 1 – 3 мес в течение года, синхронно с 1 г ЦФ и 1 г МП. Вторая схема синхронной интенсивной терапии представляется более убедительной, так как обеспечивает программный контроль в течение года. Программное назначение комбинации ПФ и ПТ МП и ЦФ показано в первую очередь больным СКВ с неблагоприятным жизненным прогнозом, обусловленным началом заболевания в подростковом и молодом возрасте [9], быстрым развитием нефротического синдрома, быстропрогрессирующим типом нефрита [8], стойкой артериальной гипертензией и с развитием угрожающих жизни состояний (церебральный криз, поперечный миелит, геморрагический пневмонит, тромбоцитопения и др.).
В последние годы агрессивные методы лечения перестают быть “терапией отчаяния”, уделом реанимационных отделений и ургентных ситуаций. Плановое назначение этих методов способно существенно улучшить отдаленный жизненный прогноз у значительной части больных СКВ.
В ближайшей перспективе вполне очевидно появление новых схем и программ интенсивной терапии СКВ, например, синхронизация ВИГ и ПФ, иммуносорбции и ЦФ, ударные дозы препаратов интерферона и антицитокиновых антител.
1. Иванова М. М. Системная красная волчанка. В кн. Ревматические болезни. М., Медицина, 1997;160–72.
2. Cоловьев С.К. В кн. Ревматические болезни. М., Медицина. 1997;106–7;125–7;100–2.
3. Harisdangkul V, Rockhold L, Myers A. Lupus nephritis: efficacy of monthly pulse therapy with intravenous methylprednisolone. South Med J 1989;82(3):321–7.
4. Liebling MR, McLaughlin K, Boonsue S, Kasdin J, Barnett EV. Monthly pulses of methylprednisolone in SLE nephritis. J Rheumatol 1982;9(4):54.
5. Steinberg AD. Cyclophosphamide in lupus nephritis. J Rheumatol 1995;22(10):1812–5.
6. Соловьев С.К., Иванова М.М., Насонов Е.Л. и др. Комбинированное применение ударных доз 6-метилпреднизолона и циклофосфана у больных системной красной волчанкой. Тер. Арх., 1985;8:7–12.
7. Wallace DJ. Plasmapheresis in Lupus. Lupus 1993;2:141–3.
8. Euler HH, Schroeder JO, Harten P, et al. Treatment-free remission in severe systemic lupus erythematosus following synchronization of plasmapheresis with subsequent pulse cyclophosphamide. Arthr Rheum 1994;37(12):1784–94.
9. Соловьев С.К., Шайков А.В., Чикликчи А.С. и др. Программная интенсивная терапия у подростков с неблагоприятным вариантом течения системной красной волчанки. Детск. ревматология. 1995;1:52–8.

17.09.1998 СИНДРОМ ФИБРОМИАЛГИИ: КЛИНИКА, ДИАГНОСТИ.
Статья посвящена синдрому фибромиалгии (СФ) — одному из наиболее частых ревматологич.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
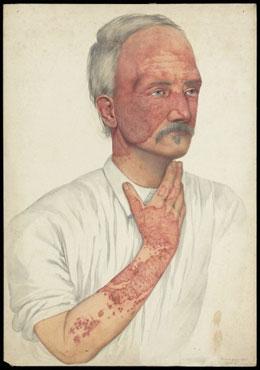
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Читайте также:

