Ребенок потеет после кишечной инфекции у
Обновлено: 19.04.2024
Острая кишечная инфекция (ОКИ) — это инфекционное воспаление желудка и кишечника, которое проявляется диареей (жидкий стул более 3 раз в сутки), иногда тошнотой, рвотой и повышением температуры тела. Примерно в 80% случаев кишечная инфекция вызывается вирусами (очень часто это ротавирус), то есть применение антибиотиков не будет иметь никакого эффекта.
Чего нужно бояться при кишечной инфекции и как не попасть в больницу
Самое опасное для ребенка с поносом и рвотой — обезвоживание. Именно из-за него приходится госпитализировать ребенка, если родители не смогли его отпоить. Как этого не допустить, мы с вами очень подробно разберем ниже.
Что мне делать, если мой ребенок заболел ОКИ?
Чаще всего нетяжелые кишечные инфекции можно лечить в домашних условиях. При появлении симптомов заболевания желательно связаться со своим врачом и предупредить его, что ваш ребенок заболел, и подробно описать всю ситуацию. Диарея и рвота (плюс еще и повышение температуры) — это потеря воды и солей, а значит, первое и основное, что должны сделать родители — восполнить уже имеющиеся потери и постоянно компенсировать то, что будет теряться дальше.
Сколько давать жидкости?
В среднем для отпаивания ребенка при острой кишечной инфекции нужно примерно 100 мл на каждый килограмм массы тела (1000 мл для малыша весом 10 кг), но может понадобиться и больше. Чтобы было более удобно, вам нужно следить за тем, чтобы у ребенка была влажная кожа и писал он примерно раз в три часа. Если писаете реже – значит, недоработали, давайте больше пить, пока мочеиспускания не участятся.
Чем отпаивать?
Чем кормить?
Пока у ребенка рвота, ему вообще нет смысла давать еду — только жидкость. Когда рвота прекратится, то параллельно с отпаиванием вы можете предлагать уже и еду, но строго по аппетиту! Не нужно кормить насильно — это только вызовет рвоту и усилит понос. Дети на грудном вскармливании прекрасно обходятся грудным молоком + солевые растворы или компот при необходимости. Более старшие дети могут начинать с легко усваиваемых продуктов: фруктовые кисели, сухари с чаем, галетное печенье, рисовая каша (с компотом, например), супы не на бульоне.
Основное правило — давайте часто, но понемногу. Через день-два уже можно возвращаться к прежним продуктам (тому, что ел до болезни), исключив на некоторое время жареное, жирное и острое.
Какое еще лечение эффективно при кишечной инфекции?
Всемирная организация здравоохранения и другие крупные медицинские организации рекомендуют помимо восполнения жидкости и продолжения кормления принимать препараты цинка. Многочисленные исследования показали, что прием препаратов цинка (10–20 мг в сутки вплоть до прекращения диареи) существенно снижает тяжесть и продолжительность диареи у детей младше 5 лет. В настоящее время на основании проведенных исследований рекомендуется вводить цинк (10–20 мг/день) в рацион всех детей с диареей в течение 10–14 дней.
Также вы много слышали о пробиотиках. Доказано, что пробиотики снижают длительность диареи у детей на фоне кишечной инфекции в среднем на 24 часа. Это все, на что вы можете рассчитывать.
Можно ли детям назначать противодиарейный препарат лоперамид?
Нет. Это лекарство запрещено для применения детям в связи с риском развития угрожающих жизни побочных эффектов.
Если почти 80 % всех кишечных инфекций вызываются вирусами, значит, будут очень полезны противовирусные препараты?
А когда нужно давать антибиотики?
Антибиотики при острых кишечных инфекциях показаны довольно редко, в основном это так называемые инвазивные диареи, когда в кале появляется кровь. Еще их применяют в случае заболевания холерой, а также внекишечными бактериальными инфекциями, которые приводят к развитию диареи (пневмония, средний отит и т. д.). Как вы уже поняли, примерно в 80 % всех случаев кишечных инфекций антибиотики назначаются зря. И это как минимум.
Я не хочу, чтобы мой ребенок заболел. Как предотвратить это?
Как все запутано! А можно на примере объяснить, как же все-таки правильно лечить острую кишечную инфекцию?
А если у ребенка поднимается температура?
Вы можете дать жаропонижающий препарат для облегчения состояния — ибупрофен или парацетамол в обычной дозировке. Подробнее о лихорадке и методах борьбы с ней можете почитать Правда и мифы о лихорадке.
Малыш отказывается пить. Как поступить?
Сколько будет длиться этот понос?
В большинстве случаев самая острая фаза диареи прекращается за 5–7, реже — 9 дней. После этого у ребенка может оставаться на некоторое время жидковатый неоформленный стул, пока не восстановится кишечник, но это уже не профузный понос 10–20 раз за сутки.
Когда нужно немедленно обращаться к врачу?
По большому счету, в двух ситуациях:
1) если у ребенка в кале появилась кровь. Появление крови в кале говорит о поражении толстого кишечника, что чаще всего бывает при бактериальных кишечных инфекциях, — в таком случае может понадобиться антибиотик;
2) если вы не справились с отпаиванием, то есть, вопреки всем вашим стараниям, у ребенка кожа стала сухой и он не писал в течение 6 часов (у грудных детей памперс сухой на протяжении 6 часов), вам нужно обратиться за медицинской помощью, поскольку, скорее всего, понадобится внутривенное восполнение жидкости.
опубликовано 02/05/2016 16:26
обновлено 03/03/2019
— Инфекционные болезни
По данным экспертов ВОЗ, практически каждый ребенок до 5 лет переносит ротавирусную инфекцию (РВИ). Ежегодно в мире регистрируется до 25 млн случаев ротавирусной диареи, из них 3% заканчиваются летальным исходом. В России в год регистрируется около 300 тыс. ротавирусных гастроэнтеритов. В эпидемический период до 80% острых кишечных инфекций (ОКИ) приходится на РВИ, которая регистрируется в виде спорадических заболеваний или вспышек в семье и детских коллективах. Наиболее высокая восприимчивость у детей до 5 лет, и она обусловлена анатомо-физиологическими особенностями органов желудочно-кишечного тракта, незрелостью как специфических, так и неспецифических факторов иммунной защиты. Максимальная заболеваемость РВИ приходится на зимне-весенний период.
В типичных случаях клиническая картина РВИ характеризуется острым началом, лихорадкой, гастроэнтеритом, развитием токсикоза с эксикозом на фоне осмотической диареи, вторичной дисахаридазной недостаточностью. Практически у всех детей отмечаются изменения в микрофлоре кишечника (снижение индигенной флоры, рост условно-патогенной флоры), что существенно усугубляет клиническую симптоматику и элиминацию ротавирусов из кишечника.
В лечении больных РВИ используются принципы комплексной терапии, включающие диету и применение препарата Лактаза Бэби, этиотропные средства, патогенетические средства (энтеросорбенты, пероральная и инфузионная регидратация, пробиотики, ферменты). В современных условиях длительное использование одних и тех же этиотропных средств, долговременное использование одних и тех же пробиотиков и ферментов приводит к снижению их эффективности. Поэтому оправдан поиск эффективных препаратов, позволяющих сократить сроки элиминации вируса, избежать развития осложнений и возможных побочных действий.
Цель исследования — изучение клинико-эпидемиологических особенностей РВИ у детей в современных условиях и оценка эффективности проводимой терапии.
Материалы и методы
Из 1386 больных, поступивших в 2011 г. в ДИБ № 3 г. Санкт-Петербурга с диагнозом ОКИ неуточненной этиологии (ОКИНЭ), у 241 ребенка (17,4%) подтверждена РВИ.
Обнаружение ротавирусных антигенов группы А проводилось с помощью иммуноферментного анализа (ИФА) однократно в образцах стула, собранного в первые сутки с момента поступления ребенка в стационар. Для расшифровки диагноза проводилось бактериологическое исследование фекалий у всех детей на предмет энтеропатогенов (Shigella spp., Salmonella spp., патогенные Escherichia coli, Yersinia spp., Campylobacter spp.) и оппортунистических бактерий (Gram-negative bacteria, staphylococci). Подтверждение условно-патогенной этиологии заболевания осуществляли дважды — при поступлении и через 15 дней после выписки из стационара. Также в стандарт обследования входили исследования с дизентерийным, сальмонеллезным и иерсиниозным эритроцитарными антигенными диагностикумами в РНГА с целью обнаружения специфических антител в динамике заболевания. Потеря воды со стулом свыше 10 мл/кг массы тела в сутки расценивалась как диарейный синдром. Тяжесть дегидратации определяли клинически.
В день поступления в стационар всем больным назначалась базисная терапия, которая включала: диету (низколактозная и Лактаза Бэби — для детей на грудном вскармливании); оральную регидратацию; по показаниям инфузионную терапию (глюкозосолевыми растворами); этиотропные средства (интерфероны, противоротавирусный иммуноглобулин); энтеросорбенты; ферменты; пробиотики.
40 больным с РВИ проводилась пробиотическая терапия. В зависимости от применения пробиотика все дети были разделены на две группы.
Первая группа — основная (20 детей) получала пробиотик Примадофилус Детский, содержащий Bifidobacterium infantis, B. longum, Lactobacillus rhamnosus, L. acidophilus. Данный препарат не содержит лактозу, может назначаться с рождения, устойчив к антибиотикам, содержит пребиотик мальтодекстрин. Препарат назначался в дозе: детям от одного мес до одного года — 0,5 чайной ложки, от одного года до пяти лет — 1 чайная ложка 1 раз в день до еды в условиях стационара и после выписки из клиники общей продолжительностью 16–18 дней.
Вторая группа — группа сравнения (20 детей) получала пробиотики (Лактобактерин — 5 детей, Линекс — 5 детей, Бифиформ — 10 детей) в возрастной дозировке, в условиях стационара и после выписки из клиники общей продолжительностью 16–18 дней. Группы были репрезентативны по полу, возрасту, срокам поступления в стационар, преморбидному фону, тяжести заболевания, базисной терапии.
Возрастной состав групп: от одного мес до одного года — 42,5%, от одного года до трех лет — 42,5%, от трех до пяти лет 25%. Из 40 больных: мальчиков — 62,5%, девочек — 37,5%. Госпитализированы в первые сутки от начала заболевания — 67,5%, во вторые сутки — 15%, на третьи сутки и позже — 17,5%.
Преморбидный фон у 80% детей был отягощен ранним переходом на искусственное вскармливание, недоношенностью, перинатальной энцефалопатией, анемией, дисбактериозом кишечника, дискинезией желчевыводящих путей. Все 40 детей поступили в стационар в среднетяжелом состоянии с умеренно выраженными симптомами интоксикации (беспокойство, слабость, вялость, снижение аппетита и др.), развитием токсикоза с эксикозом I ст. у 65%, II ст. — у 35%. Начальными проявлениями РВИ было повышение температуры. У всех больных отмечались признаки поражения ЖКТ, включающие срыгивания, рвоту, болевой синдром, метеоризм, диарею. Рвота отмечалась у 85%, с частотой от одного до 3 раз/сут — у 35,3%, от 4 до 10 раз/сут — у 64,7%. Нелокализованные абдоминальные боли отмечались у половины больных, явления метеоризма — у 77,5%. Одновременно или через несколько часов после рвоты у всех больных появлялся жидкий обильный водянистый стул: с частотой до 5 раз/сут — у 35%; от 6 до 10 раз/сут — у 57,5%; свыше 10 раз/сут — у 7,5% детей. Патологические примеси в стуле (слизь, зелень) визуально определялись у 65%, у трети их них наблюдались прожилки крови. У всех больных в копроцитограмме отмечались различной степени выраженности нарушения: жирные кислоты, нейтральный жир, крахмал, клетчатка, йодофильная флора, свидетельствующие о развитии синдрома избыточного бактериального роста (СИБР). У 65% детей, наряду с признаками нарушения переваривания и всасывания в копроцитограмме, определялся колитический синдром (лейкоциты и эритроциты). У всех детей с РВИ в посевах кала на условно-патогенную микрофлору (УПМ) выявлено снижение роста полноценной кишечной палочки и активация Е. coli с измененными свойствами. У 80% высевалась УПМ (Staphylococcus aureus, Proteus mirabilis, P. vulgaris, P. rettgeri, Klebsiella pneumoniae, K. oxytoca, Citrobacter freundii, Enterobacter cloacae), превышающая допустимые концентрации в 1,5–2 раза. У 30% одновременно высевалось несколько возбудителей.
Результаты исследования, обсуждение и заключение
Из поступивших в стационар 1386 детей с диареей ротавирусный антиген обнаружен у 17,4%. Пик регистрации детей с ротавирусной диареей приходился на март-апрель, составляя соответственно 27,4% и 15,4%. В летние месяцы РВИ встречалась с частотой от 2,9% до 5,4%. С декабря отмечался сезонный подъем РВИ (8,7%). Наиболее часто ротавирусы выявлялись в фекалиях детей в возрасте от одного мес до двух лет, составляя в сумме 66,3%, с возрастным пиком от одного года до двух лет (43,1%). Результаты клинико-лабораторного исследования позволили установить моно-РВИ у 47,9% и микст-РВИ у 52,1% детей. Структура микст-ротавирусной диареи была следующей: у 44,2% детей обнаружена УПМ, у 27,9% — энтеропатогенный эшерихиоз (ЭПЭ), у 15,5% — сальмонеллы, у 12,4% — шигеллы.
У детей в возрасте до одного года моно-РВИ диагностирована у 12,1% детей, микст-РВИ у 87,9%. В большинстве случаев была выявлена УПМ — 59,7%, ЭПЭ — 25,9%, сальмонелла — 13,8%. Среди УПМ наиболее часто выделялись стафилококки, клебсиеллы, протей, цитробактер, синегнойная палочка. У детей в возрасте от одного года до двух лет также был выявлен высокий процент микст-инфекции (72,2%), но УПМ выделялись реже — 29,2%, шигеллы — 29,8%, сальмонеллы — 39,5% и только ЭПЭ — 1,5%. Среди детей старше двух лет моноинфекция встречалась у большинства больных (85,3%), микст-инфекция — у 14,7%. Ассоциантами были, как правило, шигеллы и ЭПЭ.
Клинические проявления моно-РВИ во всех возрастных группах характеризовались острым началом. Повышение температуры отмечалось у 93,7% больных, в большинстве случаев лихорадка была в пределах 38–39 °C (52,7% детей) общей продолжительностью 2–3 дня, только у 5,4% детей лихорадка сохранялась до 8–10 дней.
Постоянным признаком РВИ была рвота или срыгивание, наблюдаемые у всех больных. Ведущим симптомом заболевания, отмечавшимся у всех больных, была диарея. Характер стула — частый, обильный, водянистый, желтого цвета, пенистый, с резким запахом и незначительной примесью зелени. Кратность стула до 5 раз в сутки отмечена у 41,1%, от 6 до 10 раз — у 53,6%, более 10 раз — у 5,4%. Длительность диареи в среднем составила 4–6 дней у 73,2%. Боли в животе умеренные, без четкой локализации, метеоризм, урчание по ходу кишечника отмечены у половины больных.
В группе детей (20 чел.), получающих Примадофилус Детский, достоверные различия выявлены в динамике диарейного синдрома. Продолжительность диареи в основной группе, получающей Примадофилус Детский, составила 4,1 ± 1,2 дня, в группе сравнения — 5,6 ± 1,0 дня (Р ≤ 0,05). Одновременно с нормализацией частоты и характера стула у больных, получавших Примадофилус Детский, быстрее исчезали патологические примеси в стуле (слизь, зелень, примесь крови), что свидетельствовало о положительном влиянии препарата на процессы репарации кишечника. При изучении количественного содержания УПМ установлено, что в обеих группах по окончанию применения пробиотиков у больных повышалось количество ПКП до нормы и уменьшалось количество E. coli с измененными свойствами. В основной группе, получавшей Примадофилус Детский, у всех больных имело место достоверное снижение УПМ, а у 7 (41%) отмечалась полная санация от УПФ. В группе сравнения по окончанию курса лечения пробиотиками у 12 из 15 больных была отмечена тенденция к снижению количества УПМ, однако у 8 больных (53,3%) возбудители S. aureus, P. mirabilis, P. vulgaris, Kl. pneumoniae выделялись повторно в диагностически значимых концентрациях.
Заключение
За период проведенных исследований в стационаре ДИБ № 3 из 1386 больных с диагнозом ОКИНЭ у 241 (17,4%) верифицирована РВИ. Заболевание протекало в виде моно- и микст-РВИ преимущественно в среднетяжелой форме с возрастным пиком от одного года до двух лет.
Включение в комплексную терапию среднетяжелых форм РВИ у детей синбиотика Примадофилус Детский, в сравнении с применением других пробиотиков (Линекс, Бифиформ, Лактобактерин), способствовало более быстрому купированию диарейного синдрома и нормализации копроцитограммы. Препарат имеет высокие органолептические свойства, хорошо переносится больными, не дает побочных эффектов. Примадофилус Детский обладает более высоким санирующим эффектом в отношении УПМ (стафилококков, клебсиелл, энтеробактеров, цитробактеров, протея), у 41% отмечалась полная санация, что согласуется с литературными данными.
Литература
- Мазанкова Л. Н., Рыбалко Г. А. Профилактика ротавирусной инфекции у детей // Актуальные вопросы инфекционной патологии и вакцинопрофилактики у детей. V конгресс педиатров-инфекционистов России: тезисы. М., 2006. С. 99.
- Кафарская Л. И., Ефимов Б. А., Постникова Е. А. и др. Особенности становления микрофлоры у детей раннего возраста // Детские инфекции. 2006. Т. 5, № 1, с. 6–12.
- Учайкин В. Ф., Новокшонов А. А., Мазанкова Л. Н. и др. Острые кишечные инфекции у детей: пособие для врачей. М., 2005. 36 с.
В. Н. Тимченко, доктор медицинских наук, профессор, академик МАНЭБ
Е. Б. Павлова, кандидат медицинских наук, доцент
М. Д. Субботина, кандидат медицинских наук, доцент
СПбГПМА, Санкт-Петербург
Контактная информация об авторах для переписки: 194100 Санкт-Петербург, ул. Матросова, 5
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых кли
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых клинических признаков болезни. В этот период происходит мобилизация защитных сил организма, направленных на компенсацию возможных нарушений, на уничтожение болезнетворных агентов и удаление их из организма. Продромальный период представляет собой временной интервал от первых симптомов заболевания до полного проявления. Период выраженных проявлений заболевания характеризуется полным развитием клинической картины. При различных инфекционных заболеваниях может страдать нервная система ребенка, что клинически проявляется синдромом нейротоксикоза. Нейротоксикоз — ответная неспецифическая реакция детского организма на воздействие вирусной, бактериальной или вирусно-бактериальной флоры, характеризующаяся преимущественным поражением центральной (ЦНС) и вегетативной нервной системы. С истощением функциональных возможностей органов и систем в результате перенесенного заболевания, особенно нервной системы при ее перенапряжении, а также вследствие аутоинтоксикации или экзогенного токсикоза связывают возникновение астенического синдрома. Это наиболее частое клиническое проявление периода реконвалесценции. Утомление в течение длительного времени, которое не компенсируется полным восстановлением, вызывает синдром перегрузки, следом за которым развивается состояние истощения. Субъективно ощущаемое чувство утомления — прежде всего сигнал о перегрузке центральных регуляторных систем, неудовлетворительном состоянии энергетических ресурсов организма и аутоинтоксикации продуктами метаболизма. Длительное утомление, приводящее к истощению, по сути своей является результатом стрессорного воздействия на организм, вызывающего нарушение функций регуляторных систем — вегетативной, эндокринной и иммунной. Если стрессорные факторы действуют в течение длительного времени, может развиться реакция организма, при которой возможны функциональные изменения в виде вегетативной дисфункции [1, 6]. Синдром вегетативной дисфункции (СВД) включает в себя проявление всех форм нарушения вегетативной регуляции. Наряду с соматическими проявлениями: головокружением, головными болями, сердцебиением, одышкой, жаждой, булимией, рвотой после еды, непереносимостью отдельных видов пищи, субфебрилитетом неясного происхождения, кожными высыпаниями и др., у пациентов с СВД выявляют эмоциональные расстройства разной степени выраженности в виде тревожности, нарушения сна, беспричинного плача, а также расстройства поведения, в частности, импульсивности, повышенной двигательной активности и возбудимости, дефицита внимания, что клинически определяется как астеновегетативный или психовегетативный синдром [Вейн А. М., 1981].
Интерес и сложность проблемы астеновегетативного синдрома заключается в том, что она является комплексной: медицинской, психологической и педагогической. Однако все специалисты сходятся в том, что такое состояние существует, его необходимо диагностировать и правильно корректировать.
Задачи исследования
Данное исследование посвящено изучению динамики состояния вегетативной нервной системы детей с астеновегетативным синдромом после перенесенных инфекционных заболеваний, а также оценке эффективности препарата Тенотен детский при названной патологии.
Тенотен детский содержит сверхмалые дозы антител к мозгоспецифическому белку S-100, создан по особой технологии специально для детского возраста, оказывает успокаивающее, нормализующее настроение и поведение действие, а также выраженное вегетостабилизирующий эффект [3, 5].
Критерии включения больных в исследование:
Критерии исключения больных из исследования:
Наличие декомпенсированных заболеваний или острых состояний, которые могут влиять на проведение исследования.
Применение вегетотропных и ноотропных препаратов в период исследования и в последние две недели перед исследованием.
Участие в других клинических исследованиях в течение четырех недель перед включением в данное исследование.
Материал исследования
Для исследования методом случайной выборки дети были распределены в две группы. В основной группе (30 человек) дети в периоде реконвалесценции наряду с симптоматической витаминотерапией получали Тенотен детский по 1 таблетке 3 раза в день в течение 4 недель в сочетании со стандартной терапией. В контрольную группу (20 человек) вошли дети, получавшие стандартную витаминотерапию и симптоматическую терапию за исключением препаратов, обладающих вегетотропной активностью.
Достоверных различий по половозрастным показателям между основной и контрольной группами детей не было.
По спектру перенесенных заболеваний, их тяжести, характеру осложнений выделенные группы детей также значительно не отличались. Спектр заболеваний включал вирусные и вирусно-бактериальные инфекции дыхательных путей (этиологически подтвержденные формы гриппа и другие респираторные вирусные инфекции, тяжелые формы бронхитов и пневмоний и др.), острые средние отиты, тяжелые и осложненные формы инфекционного мононуклеоза, висцеральные формы ветряной оспы, протекающие с нейротоксикозом и везикулезными высыпаниями на внутренних органах. Данные о заболеваниях приведены в таблице.
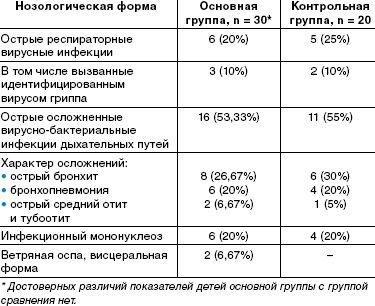
Диагностическое обследование включало в себя клиническую оценку проявлений вегетативной дисфункции, психологическое исследование, неврологическое обследование, электрокардиографию (ЭКГ).
Состояние вегетативной нервной системы определялось по исходному вегетативному тонусу, вегетативной реактивности и вегетативному обеспечению деятельности. Исходный вегетативный тонус, характеризующий направленность функционирования вегетативной нервной системы в состоянии покоя, оценивался по анализу субъективных жалоб и объективных параметров. Оценивалась степень выраженности психопатологических проявлений: утомляемость, тревожность, эмоциональная неустойчивость и др. (модифицированный опросник А. М. Вейна). Определялся внутрисистемный вегетативный тонус по индексу Кердо и межсистемный вегетативный тонус по коэффициенту Хильдебранта. Для оценки вегетативного обеспечения деятельности, отражающего в основном состояние автономной системы регуляции, проводилась клиноортостатическая проба (КОП). Функциональное состояние сердечно-сосудистой системы рассматривалось также на основании данных электрокардиографии.
Уровень внимания оценивался с использованием шкалы SNAP-IV, таблиц Шульте, по результатам модифицированного метода Пьерона–Рузерапо. Выявление расстройств кратковременной и долговременной памяти, косвенно отражающей выраженность астении, проводилось с помощью методики 10 слов и пиктограммы.
Для определения состояния эмоциональной сферы обследуемых (тревоги, депрессии) использовался ахроматический и цветовой тесты Люшера.
После окончания лечения всем детям было проведено повторное комплексное обследование для оценки эффективности терапии. Кроме того, родителям детей предлагалось оценить результаты лечения при помощи десятибалльной аналого-визуальной шкалы, где 0 — это очень плохая оценка, 10 — очень хорошая.
Результаты исследования
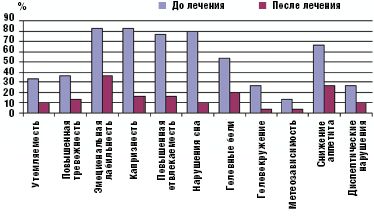
Перед началом исследования у всех обследуемых детей (без достоверных различий в обеих группах) с помощью опросника А. М. Вейна определялись умеренно выраженные психопатологические расстройства, в виде неустойчивости эмоционального фона (84%), повышенной тревожности (34%), утомляемости (38%), отвлекаемости (86%), нарушений сна (74%), снижения памяти, а также различные соматические проявления в виде периодических головных болей (52%), головокружения (24%), метеозависимости (12%), снижения аппетита (64%), диспептических нарушений в виде тошноты, рвоты, вздутия живота (44%).
Индекс Кердо позволил определить наличие внутрисистемной дистонии у детей, перенесших тяжелые инфекционные заболевания, он составил в среднем 32,89 ± 0,99 в обеих исследованных группах, что свидетельствовало о превалировании симпатических влияний на организм в покое.
Межсистемный вегетативный тонус, оцениваемый с помощью коэффициента Хильдебранта (средние значения составили 3,98 ± 0,03), имел, в основном, эйтонический характер.
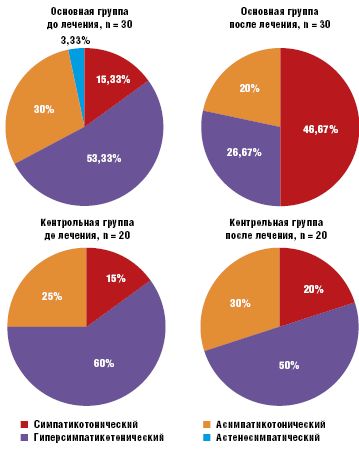
КОП, определяющая вегетативное обеспечение автономной системы регуляции, наряду с нормальным симпатикотоническим вариантом КОП, отражающим устойчивость гемодинамики в ортостазе (14% случаев), выявила и патологические варианты. Гиперсимпатикотонический вариант КОП, характеризующийся резким повышением систолического артериального давления (САД) и диастолического артериального давления (ДАД) и частоты сердечных сокращений (ЧСС) и обусловленный избыточным включением симпатико-адреналовой системы, встречался в преобладающем количестве случаев — у 58% детей. Асимпатикотонический вариант КОП, обусловленный недостаточным подключением симпатического отдела вегетативной нервной системы, при котором САД и ДАД не изменяются или падают, ЧСС остается нормальной или компенсаторно увеличивается, встречался у 28% детей с СВД. Астеносимпатический вариант КОП с падением САД и ДАД и резким увеличением ЧСС в первые минуты ортостаза, с последующей гиперсимпатикотонической реакцией был выявлен в 2% случаев.
Основными психопатологическими проявлениями СВД являлись невнимательность, гиперактивность, импульсивность. Их оценка производилась с помощью шкалы-опросника SNAP-IV (Swanson J., 1992). Показатель невнимательности в двух группах по этой шкале достоверно не отличался и составил в среднем 53,33% (норма (Swanson J., 1992) — 0,40–1,82), средний показатель гиперактивности — 1,96 ± 0,32 (норма (Swanson J., 1992) — 0,27–1,59) и импульсивности 2,13 ± 0,37 (норма (Swanson J., 1992) — 0,26–1,52) (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Выраженность астении косвенно отражается на интеллектуально-мнестических показателях, в частности на оперативной памяти: чем выше утомляемость ребенка в период после перенесенного инфекционного заболевания, тем больше страдает процесс запоминания. Оценка памяти у детей проводилась с помощью методики запоминания десяти слов. Регистрировались следующие показатели: 1) количество повторений, необходимых для воспроизведения 10 слов; 2) количество слов, воспроизведенных через 1 час.
В большинстве случаев обследуемым обеих групп (достоверных различий показателей детей основной группы с группой сравнения нет) для воспроизведения 10 слов требовалось 3 и более повторений, что свидетельствовало о снижении показателей механического запоминания. В то же время количество воспроизводимых слов через час после начала исследования значительно снизилось, что явилось признаком нарушения динамической памяти у детей с вегетативной дистонией.
В качестве методики для исследования опосредованного запоминания использовалась пиктограмма. Регистрировались следующие показатели: 1) количество воспроизведенных понятий; 2) динамика воспроизведенных понятий через 1 час.
Оценка результатов пиктограмм в целом показала, что у детей с СВД дистонией изображаемые образы часто не соответствовали реальным объектам, что впоследствии затрудняло их интерпретацию. Показатели по критерию адекватности (обоснованности связи между предложенным понятием и его пиктограммой) в среднем составили около 50%.
Проведенное по методике Люшера тестирование отразило статистически значимое отклонение преимущественно выбираемой обследуемыми цветовой гаммы от аутогенной нормы. В то же время величина вегетативного показателя не имела столь значимых различий по сравнению с возрастными нормами. Среднестатистические показатели тревожности и напряжения, определенные с помощью теста Люшера, также не имели значительных отклонений от стандартных показателей (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Таким образом, проведенное клиническое обследование детей, перенесших инфекционные заболевания, выявило наличие у них различной степени выраженности проявлений СВД. Безусловно, такие психовегетативные нарушения отражались на периоде реконвалесценции, ухудшали качество жизни и требовали их адекватной коррекции.
В качестве альтернативного препарата для коррекции проявлений СВД был использован Тенотен детский с успокаивающим и выраженным вегетостабилизирующим действием (Лобов М. А., 2008). Основная группа детей (30 человек) получала Тенотен в дозе 3 таблетки/сутки курсом 1 месяц в сочетании со стандартной витаминотерапией. Контрольная группа детей (20 человек) получала стандартную терапию с применением лекарственных средств, не обладающих психотропной и вегетотропной активностью. По окончании курса лечения были проведены повторные клинические исследования.
Прием препарата Тенотен детский в течение месяца обеспечил достоверное (в сравнении с контрольной группой) улучшение показателей психовегетативного статуса и снижение частоты соматоневрологических расстройств у детей, принимавших Тенотен детский, тогда как в контрольной группе детей эти показатели оставались практически на прежнем уровне (рис. 1, 2).
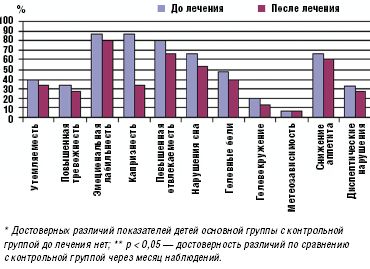
Улучшение показателей вегетативного тонуса отмечалось не только в его психоэмоциональной (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна), но и соматоневрологической (головные боли, головокружение, снижение аппетита, диспептические нарушения) составляющей. Полученные данные отражены на рис. 1.
Качественно изменились результаты КОП. У детей, принимавших Тенотен детский, отмечалась нормализация показателей вегетативного обеспечения (симпатикотонический вариант КОП) с 15,33% детей в начале терапии до 46,67% (p < 0,05), у остальных наметилась четкая тенденция к улучшению. В контрольной группе показатели КОП остались практически на прежнем уровне. Данные отражены на рис. 3.
Была выявлена положительная динамика в отношении патопсихологических проявлений. После курсового применения препарата уменьшение выраженности мнестических и поведенческих симптомов (невнимательность, гиперактивность, импульсивность) отмечалось в среднем у 85% детей. Все показатели шкалы SNAP-IV у детей основной группы после лечения Тенотеном достоверно снизились (p < 0,05). Показатели гиперактивности и невнимательности снизились до нормальных значений, абсолютные показатели импульсивности также значительно уменьшились в наблюдаемой группе.
По данным психометрического исследования у пациентов с СВД основной группы были выявлены достоверные положительные изменения при проведении тестов на память и внимание в сравнении с контрольной группой. Данные тестирования выявили отчетливое улучшение показателей механической и динамической памяти у 30% детей (p < 0,05), а также опосредованной памяти в тестах с пиктограммой — повышение показателя адекватности до 75% (p < 0,05).
Динамическая оценка результатов цветового теста Люшера выявила относительную стабилизацию психоэмоционального состояния у детей основной группы, что отразилось на предпочитаемой цветовой гамме и приближении ее к аутогенной норме (по коэффициенту суммарного отклонения от аутогенной нормы — p < 0,05). У детей контрольной группы определяемые показатели не имели статистически значимых изменений.
По окончании исследования родители оценили результаты лечения при помощи десятибалльной аналого-визуальной шкалы. В среднем успешность лечения в основной группе была оценена на 7–8 баллов, в контрольной — на 4–5 баллов.
Выводы
Проведенное исследование показало, что у детей, перенесших инфекционные заболевания, имеются в различной степени выраженные симптомы астеновегетативного синдрома (СВД) в виде психоэмоциональных (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна) и соматоневрологических (головные боли, головокружение, снижение аппетита, диспепсия) нарушений.
Астеновегетативные нарушения отрицательно влияют на процесс реконвалесценции у детей после перенесенных тяжелых инфекционных заболеваний, удлиняя этот период и ухудшая качество жизни пациентов.
Применение препарата Тенотен детский после перенесенных инфекционных заболеваний в дозе 1 таблетка 3 раза в день приводит к нормализации показателей вегетативного тонуса и обеспечения, уменьшает частоту соматоневрологических проявлений вегетативной дисфункции, что способствует более быстрому завершению периода восстановления.
Тенотен детский устраняет проявления астении, стабилизирует психоэмоциональное состояние детей: улучшает настроение, успокаивает, способствует снижению раздражительности и капризности, облегчает процессы обучения (запоминание, концентрацию внимания, усидчивость).
Препарат Тенотен детский безопасен у пациентов старшего дошкольного и младшего школьного возраста. Побочных эффектов во время применения препарата не было отмечено.
Доказанное успокаивающее, выраженное вегетотропное и антиастеническое действие препарата Тенотен детский позволяет рекомендовать его для применения у детей с различными проявлениями вегетососудистой дисфункции после перенесенных инфекционных заболеваний.
По вопросам литературы обращайтесь в редакцию.
Е. В. Михайлова, доктор медицинских наук, профессор
Т. Ильичева
Cаратовская областная детская инфекционная клиническая больница,
Саратовский государственный медицинский университет, Саратов
Это новый материал, но когда-то Тигренок уже писал на эту тему - "Ротавирусная инфекция". (Учитывайте, что информация содержащаяся в более ранней статье может быть не совсем актуальной.)
Сейчас мы предлагаем Вам ознакомиться с современным взглядом на данную проблему.
Статью подготовил коллектив педиатров детской клиники Тигренок
Что такое ротавирус и каковы его симптомы? Чем опасна ротавирусная инфекция и как помочь заболевшему ребенку, насколько эффективна вакцинация от данного вируса?
О болезни.
Заразиться малыш может от больного человека через игрушки, дверные ручки, посуду, предметы обихода. Вирус чрезвычайно заразен. Специфический иммунитет к ротавирусу хоть и вырабатывается, но почти не имеет значения, поскольку этот вирус имеет массу штаммов и разновидностей - науке их известно уже как минимум 9, а мутации все еще продолжаются.
Все разновидности этого вируса довольно устойчивы к низким температурам, воздействию солнечных лучей и воздуха. Довольно долгое время ротавирус выживает в родниковой и морской воде.
Инкубационный период — это время, которое проходит после того, как вирус попадает в организм, до момента, когда начинается острая стадия заболевания. У разных детей этот промежуток времени различается.
Вирус накапливается, реплицируется, как правило, в течение 3-7 дней. Само заболевание длится около 2-3 дней, еще минимум 5 суток организм восстанавливается после выздоровления.
Заразен ребенок все время с момента инфицирования до окончания восстановительного периода. Даже если малыш уже чувствует себя хорошо, с каловыми массами все равно продолжают выделяться вполне жизнеспособные микрочастицы вируса. Именно по этой причине мы настоятельно не рекомендуем сразу после того, как ребенку стало лучше, отправлять его в детский сад или в школу. Это с очень высокой вероятностью приведет к массовому заражению в детском коллективе.
Вероятность заражения ротавирусом ни в коей степени не зависит от чистоплотности семьи. Даже если мама по нескольку раз в сутки моет и пылесосит весь дом, если заставляет чадо каждый час мыть ручки с мылом, внимательно следит за качеством каждого продукта, который попадает на стол, не дает пить воду сомнительного происхождения - все это почти не снижает риск заболеть ротавирусом.
Всемирная Организация Здравоохранения приводит такие цифры: каждый год на нашей планете ротавирусом заражается около 25 миллионов детей. Большинство выздоравливает довольно быстро и самостоятельно. 2 миллиона малышей попадают в больницы, что приводит к смерти около 500 тысяч детей ежегодно, но не от самой ротавирусной инфекции, а от тяжелых осложнений, которые наступают при ее протекании.
Симптомы.
Можно выделить следующие основные симптомы:
• Диарея.
• Рвота
• Боли в животе.
• Повышенный метеоризм.
• Повышение температуры тела.
• Вялость, бледность кожи.
• Отсутствие аппетита.
По нашей статистике, абсолютное большинство случаев необъяснимой диареи у малышей до трех лет — проявление ротавирусной инфекции. Иными словами, если ребенок ел все, что обычно, и у него нет признаков пищевого отравления, то расстройство стула в 99% случаев свидетельствует об атаке именно этим видом вирусов.
Ротавирус тропен (имеет особую тягу) к клеткам поджелудочной железы. В разгар заболевания нарушается ее функция. Сперва стул становится маслянистым (плохо смывается), имеет гладкую блестящую поверхность и глинистую консистенцию. Затем развивается транзиторная непереносимость лактазы (это поражаются ворсинки кишечника), стул приобретает все более водянистый характер. Характерны императивные позывы к дефекации.
При вирусном поносе каловые массы имеют сероватый окрас и очень резкий неприятный запах. На 2-3 сутки содержимое горшка приобретает глинистую консистенцию и желтовато-серый цвет. Кислый запах сохраняется.
Ротавирусной инфекции свойственно внезапное острое начало - с повышением температуры, рвотой. Иногда рвотные массы могут иметь специфический запах ацетона, аналогично может пахнуть изо рта у ребенка. На следующем этапе развивается энтерит и гастроэнтерит, диарея (до 10-12 походов в туалет в сутки). Могут появиться незначительные респираторные проявления — насморк, першение в горле, боль при глотании, кашель.
О лечении.
Диарея при ротавирусной инфекции обычно проходит за 2-3 дня, но таит в себе довольно серьезную опасность обезвоживания. Практически все летальные случаи, наступившие при этом недуге, стали возможны именно по причине критической потери жидкости, сильной дегидратации. Чем младше ребенок, тем быстрее у него развивается обезвоживание, тем опаснее для него ротавирус. Наиболее тяжело инфекция протекает у грудничков.
Тяжелое осложнение, которое дает ротавирус при сильном обезвоживании — пневмония. Многие случаи дегидратации осложняются серьезными нарушениями нервной системы. Особенно опасны ротавирус и состояние обезвоживания для детей с недостаточным весом.
Главное, что должны научиться делать родители — даже не определять, какого происхождения понос у малыша, а уметь быстро оценить, есть ли у чада признаки обезвоживания. Мы настоятельно рекомендуем во всех случаях появления диареи у маленького ребенка обращаться к врачу. Но и самим сидеть на месте без дела нельзя — надо внимательно наблюдать.
В случае начала обезвоживания ребенок, который не может пить достаточное количество жидкости для восстановления баланса в организме, нуждается в введении воды внутривенно. На этом и будет основано лечение в стационаре.
Первая помощь.
В целом, алгоритм разумных родительских действий при детском поносе должен выглядеть всегда так:
• Обильное теплое питье. Частое и дробное. Обычной водой и солевым раствором. Если ребенок каждые 3 часа писает, значит, он потребляет достаточное для недопущения обезвоживания количество жидкости. Если напоить не получается даже с помощью одноразового шприца без иглы — вызвать скорую помощь.
• Маленького ребенка положить на бок, чтобы в случае приступа рвоты он не захлебнулся рвотными массами.
• Жаропонижающие средства - только если температура выше 38,5.
• Следить за состоянием ребенка, не допускать обезвоживания. При первых симптомах дегидратации — вызвать скорую.
• Не кормить. Если очень просит — давать жидкую кашу или пюре в небольших количествах.
До приезда врача оставить подгузник с каловыми массами или сохранить образец содержимого горшка, чтобы продемонстрировать это врачу. Так доктор сможет быстрее диагностировать заболевание, и вероятность ошибки будет снижена (ротавирус, например, очень похож в начальной стадии на холеру).
Большая ошибка — давать ребенку антибиотики. Недуг имеет вирусное происхождение, а против вирусов антибактериальные препараты совершенно бессильны. Лечить ими ребенка с вирусной диареей — настоящее родительское преступление, поскольку это не только не приносит пользы, но и увеличивает вероятность наступления осложнений.
Еще одно заблуждение — эффективность противовирусных средств при кишечной инфекции. Несмотря на то, что некоторые врачи продолжают выписывать противовирусные средства при ротавирусной инфекции, мы настоятельно не рекомендуем принимать их при кишечной инфекции. Конечно, принимать или нет вышеназванные таблетки или сиропы — решать вам. Но вы должны знать, что не существует пока в природе противовирусных препаратов с клинически доказанной эффективностью. Тем более не доказана эффективность этих препаратов в отношении конкретного возбудителя - ротавируса.
Вакцинация.
Многие страны уже включили вакцинацию от ротавирусной кишечной инфекции в обязательные Национальные календари прививок. В России такой обязательной практики пока нет. Вакцинация от ротавируса, по отчетам западных специалистов, помогает на 80% снизить заболеваемость и на 45% уменьшает риск летального исхода. То есть заражение остается возможным, но протекание болезни будет более легким.
Рекомендуемые сроки вакцинации — от 1,5 месяцев до полугода. Детям старше делать прививку нецелесообразно. Всего вводятся 3 дозы вакцины. Стандартная рекомендуемая схема вакцинации РотаТек: 2 - 3 - 4,5 месяцев.
Естественно, вакцинацию не будут делать ребенку, который болен в настоящий момент, также прививка от ротавируса противопоказана малышам с врожденными пороками развития желудочно-кишечного тракта. Как и перед любой вакцинацией, перед вакцинацией РотаТеком надо показаться педиатру с результатами анализов (клинический анализ крови и общий анализ мочи). Специальной подготовки к вакцинации от ротавируса не требуется.
Советы родителям.
Во время острой фазы заболевания кормить ребенка не стоит, если только он не попросит пищу сам.
Следует придерживаться строгой диеты не только во время лечения, но и некоторое время после выздоровления: полностью исключить из меню цельное молоко и молочные продукты, сладкие фрукты, выпечку, мясо, а также жирные и жареные блюда. Полезно кушать каши на воде, овощные супы, сухари из белого хлеба, печеные в духовке яблоки. Кормить надо часто и небольшими порциями.
Совсем маленьким детям с ротавирусной инфекцией в грудном молоке не отказывают, ограничений по питанию не вводят, но следят за тем, чтобы питье было обильным. Грудное молоко само по себе содержит самой природой предусмотренные противовирусные компоненты, что поможет крохе в процессе выздоровления.
Изредка при тяжелом протекании ротавирусной инфекции у грудничка из-за возникновения ферментного дефицита может проявиться непереносимость или частичная непереносимость грудного молока. В этом случае следует снизить количество кормлений грудью и временно добавить в рацион малыша (до полного выздоровления) безлактозные детские смеси.
Больного ротавирусом ребенка не стоит обязательно укладывать в постель. Если у него высокая температура, то постельный режим необходим. Во всех остальных случаях он должен вести обычный образ жизни — играть, гулять.
Конечно, стоит держаться подальше от дворовой детской площадки, чтобы не распространять ротавирус на других детей, но прогулка в немноголюдном парке или сквере пойдет на пользу.
Самая действенная профилактика ротавируса - вакцинация. Только потом следует гигиена – обязательно нужно мыть руки, разумеется с мылом, тщательно мыть овощи и фрукты, следить за качеством воды, которую пьет ребенок.
На сервисе СпросиВрача доступна консультация педиатра онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Здравствуйте, Олеся. Как правило, улучшение при вирусных кишечных инфекциях наступает к 3-5 дню заболевания. Но при ротавирусной инфекции возможно волнообразное течение (после улучшения снова ухудшение). Питьевой режим и диету следует соблюдать не менее 7 дней от начала заболевания. Давать Регидрон Био можно без ограничения, но если ребёнок его пьёт плохо, следует выпаивать обычной водой. За счёт того, что в первые дни заболевания пила мало слабость и вялость может сохраняться до 7 дней, так как потери жидкости были значительные (повышенная температура, рвота, понос). При ухудшении состояния необходим очный осмотр педиатра. Желаю скорейшего выздоровления.

Здравствуйте. Такое бывает после перенесенной кишечной инфекции. Можете взять полоски для определения ацетона в моче. Возможно, незначительно повышен ацетон. Когда падает в крови глюкоза, организм начинает расщеплять жиры., в результате образуются кетоны. Сейчас главная задача- отпаивать ребенка. В первую очередь необходимо предложить сладкий напиток. Ребенок в 3 года должен пить 1300 мл воды в сутки. В это число входят солевые растворы, сладкие напитки, питьевая вода. Солевые растворы-около 400-500 мл. Сладкие напитки- компоты или чай с сахаром. Пить небольшими порциями по 1-2 глотка, чтобы не вызвать рвоту.Каждые 10-15 мин. Можно поить с помощью шприца от Нурофена. Количество выпитой жидкости- записывайте. Выпил ребенок 10 мл- записали. Выздоравливайте.
Гульназ, Здравствуйте! Спасибо большое. Тест полоски делали, кетоновые тела фиолетовые, и ацетоном пахнет изо рта. Но раньше при рвоте или поносе так же было, беспокоит, что вялая и сонная такая сейчас. Но пьёт много. Только воду и регидрон био. Сейчас приготовлю компот. Как раз шприцем от нурофена отпаиваю. Подскажите пожалуйста, какие лучше фрукты брать для компота, в такой ситуации?

Любые сладкие можно брать. Яблоки, сухофрукты.Можно чай с сахаром. Главное, не заменяйте сахар во время болезни медом или просто фруктами.
Читайте также:

