Ребенок при смерти из-за инфекции
Обновлено: 19.04.2024
Инфекции с осложнением в виде энцефалита у ребенка
а) Микоплазменный энцефалит. Микоплазма, хотя и не является вирусом, также нуждается в механизме репликации клетки-хозяина. Энцефалит микоплазменной этиологии иногда может иметь острое начало одновременно с респираторными симптомами или чаще в виде вторичного явления с атипичным иммунным ответом на инфекцию в ЦНС (Abramovitz с соавт., 1987). В одном из исследований были представлены плохие продолжительные неврологические последствия у пациентов с микоплазменным энцефалитом (Koskiniemi et al., 1991). Диагноз ставится при выделении ДНК из ликвора и/или серологическим методом определения продукции IgM, IgG и IgA к микоплазме в крови и/или СМЖ (Bencina et al., 2000).
Несмотря на то, что макролидные антибиотики эффективны против микоплазменного агента и должны использоваться при острой системной инфекции, в отдельных случаях трудно установить, является ли энцефалит первичным или иммунной реакцией. Однако проникновение макролидов в ЦНС недостаточно, и эффективность в преодолении гематоэнцефалического барьера не определена.
б) Респираторные вирусные инфекции:
1. Гриппозный энцефалит (грипп А и В). Несмотря на то, что у большинства новорожденных и детей, зараженных вирусом гриппа, развивается легкая респираторная инфекция, могут встречаться более тяжелые проявления болезни, включая неврологические симптомы (Wang et al., 2003; Maricich et al., 2004). Неврологическое поражение часто стойкое с серьезными последствиями или смертельным исходом, и включает острый энцефалит, синдром Рейе, острую некротическую энцефалопатию и миелит, а также аутоиммунные состояния типа синдрома Гийена-Барре. Вирусологическая диагностика основана на выделении вируса или определении антигенов в носоглоточном секрете, а так же на выявлении РНК в ликворе с помощью ПЦР или сероконверсией (Studahl, 2003).
Первоначально о повышенном уровне заболеваемости грипп-ассоциированным энцефалитом/энцефалопатией было заявлено у японских детей. В одном исследовании у 89 детей со средним возрастом 3,8 лет, ни один из которых не получал аспирин, заболевание отмечалось в течение восьми сезонов гриппа (1994-2002 гг.) (Togashi et al., 2004). После короткого респираторного продромального периода у большинства пациентов быстро развилось коматозное состояние с (или без) судорогами; 37% умерли, 19% имели неврологические последствия. В образцах плазмы и ликвора у двоих пациентов, которые умерли от молниеносного течения болезни, отмечалось значительное повышение уровня интерлейкина-6 (ИЛ-6) и фактора некроза опухоли-α (ФНО-α).
При посмертном исследовании одного летального случая выявлен вазогенный отек мозга с генерализованной васкулопатией, подтверждая повреждение эндотелия сосудов, вероятно, за счет высокой активности цитокинов. Другие исследования показали повышенный уровень системных и ликворных цитокинов при гриппозном энцефалите (ИЛ-6 и ФНО-а), так же как увеличение цитохрома С, свидетельствующего о вторичной смерти клеток путем апоптоза в результате гиперцитокинемии (Hosoya et al., 2005, Nunoi et al., 2005). Наиболее высокий уровень отмечен у пациентов с летальным исходом.
2. Энцефалит птичьего гриппа. На сегодняшний день птичий грипп A (H5N1) возникает у небольшой группы лиц, обычно там, где имеется контакт с больными птицами (de Jong et al., 2006). Как и при тяжелой респираторной инфекции, возможно сочетанное поражение многих органов с комой, в большинстве случаев с летальным исходом.
3. Аденовирусный энцефалит. Чаще встречается у детей, обычно проявляясь в виде легкой простудной или гастроинтестинальной болезни. К более тяжелым осложнениям относятся дыхательная недостаточность, энцефалопатия и хронические последствия, включая облитерирующий бронхиолит и продолжительное повреждение ЦНС (Chuang et al., 2003). Аденовирус может быть причиной асептического менингита, однако некоторые штаммы, такие как аденовирус 7 типа, часто вызывают менингоэнцефалит с более тяжелым течением. Другие неврологические синдромы, связанные с аденовирусом — миелит, подострый очаговый аденовирусный энцефалит и Рейе-подобный синдром (Straussberg et al., 2001).
У детей с ослабленным иммунитетом аденовирус может быть причиной полиорганной недостаточности с энцефалитом, печеночной коагулопатией и смертью. Диагноз выставляется на основе изоляции вируса или определения антигенов в носоглоточном секрете или стуле, так же как определение ДНК методом ПЦР в спинномозговой жидкости.
Редкие проявления энцефалопатии возникали при ротавирусных гастроэнтеритах, но, вероятно, это не связано с проникновением вирусов в ткани ЦНС (Nakagomi и Nakagomi, 2005). Энцефалитные проявления с припадками и расстройствами сознания могут быть осложнением других невирусных диарейных заболеваний, включая энтеритные инфекции Shigella (Mulligan et al., 1992) и C. jejuni (Nasralla et al., 1993).
г) Постинфекционные энцефалиты. Постинфекционные энцефалиты, вероятно, самый распространенный тип острых энцефалитов в европейских странах. Поскольку ни в одном из этих случаев не обнаруживают вирус, они скорей всего не являются результатом прямого вирусного вторжения в ЦНС, а вероятно возникают благодаря ответу иммунной системы на инфекционный агент в тканях хозяина посредством механизмов, обсуждаемых в отдельной статье на сайте при остром диссеминированном энцефаломиелите (ADEM).
Большинство случаев постинфекционного энцефалита являются осложнением заболеваний, сопровождающихся экзантематозной сыпью. Однако многие случаи возникают вследствие недиагностированных инфекционных заболеваний. Частота постинфекционных энцефалитов оценивается приблизительно, так как во многих случаях не доступны данные патогенеза и механизма острой энцефалитной картины. Так, при свинке менингит возникает очень часто, но доказательства перивенозного энцефалита представлены лишь в некоторых случаях (Johnson, 1982а). В ряде случаев болезнь, предшествующая началу энцефалита, не диагностируется и не идентифицируется ни один вирус, даже ретроспективно. Диагноз вирусной инфекции основывается на клинических проявлениях и течении продромального периода.
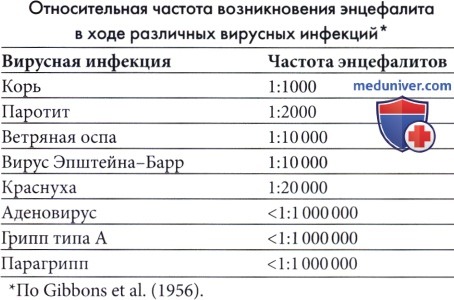
Корь — наиболее частая причина экзантематозной сыпи; таким образом, заболеваемость энцефалитом будет зависеть от заболеваемости корью и уровня иммунизации против кори среди населения. Острый коревой энцефалит начинается через 6-8 дней после первых высыпаний и встречается в 1 из 1000 случаев (Johnson et al, 1984). Несмотря на вариабельность интенсивности, заболевание часто протекает тяжело, со смертельными исходами в 10% случаев и частыми осложнениями, включая припадки, двигательные нарушения и умственную отсталость. Трудности в обучении и поведенческие расстройства характерны для детей с очевидным полным выздоровлением. Описаны редкие случаи постинфекционного энцефалита вследствие вакцинации против кори, но их частота значительно меньше, чем энцефалиты, связанные с диким вирусом кори (Landrigan и Witte, 1973). Постинфекционный энцефалит, ассоциированный с пятой болезнью (парвовирус В19) и внезапной сыпью (HHV-6 и 7) встречается очень редко.
В странах с вакцинацией против кори, свинки и краснухи, rubella (коревая краснуха) в настоящее время является редким заболеванием и случаи острого краснушного энцефаломиелита, следовательно, крайне редки. Постинфекционный краснушный энцефалит — тяжелое заболевание со смертностью примерно в 20% случаев, возникающее в 1 из 5000 острых случаев краснухи. Может развиваться одновременно с сыпью или даже через неделю или позже.
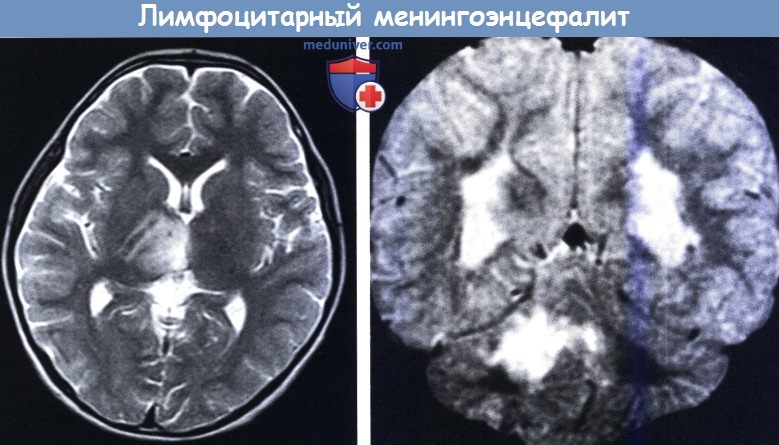
MPT (слева): патологический сигнал от правого таламуса и среднего мозга, вызванный параинфекционным лимфоцитарным менингоэнцефалитом.
12-последовательность (справа): более обширная зона интенсивного сигнала от правого полушария мозжечка и двусторонний интенсивный сигнал от супратенториального белого вещества полушарий (четырехлетняя девочка с мозжечковой атаксией с внезапным началом,
продолжающейся несколько недель, с легким ступором, который исчез через несколько дней).
1. Патология. Патогенез постинфекционного энцефалита имеет отличительные черты. Представлен множественными очагами перивенозной демиелинизации. Осевые цилиндры обычно лучше сохраняются, чем миелин. Определяются лейкоцитарные муфты вокруг вен и венул из мононуклеарных клеток, в демиелинизированных участках видны клетки микроглии и макрофаги.
2. Клинические проявления. Клинические проявления те же, что и при уже описанных типах энцефаломиелита. В большинстве случаев имеется внезапное начало с расстройствами сознания и припадками. Эти симптомы появляются в среднем через шесть дней (до 21 дня) после появления инфекции верхних дыхательных путей или экзантемы, в большинстве случаев у детей в возрасте старше двух лет. Могут быть представлены различные неврологические проявления, включая гемипарез, экстрапирамидные симптомы, атаксию, лицевые параличи, нистагм и поражение черепных нервов (Kennard и Swash, 1981; Marks et al, 1988). Результаты нейровизуализации могут быть отрицательными, а при МРТ обычно выявляются участки повышения сигнала преимущественно в белом веществе полушарий и иногда с вовлечением мозжечка. Характерны вовлечение зрительного бугра и базальных ганглиев. Течение заболевания варьирует от случая к случаю и зависит от причинных факторов. Уровень смертности низкий. Три четверти случаев протекают быстро, с выздоровлением в течение двух недель.
Другим вариантом постинфекционного энцефалита является острый геморрагический лейкоэнцефалит. Это фульминантное заболевание, которое характеризуется быстрой прогрессией очаговых неврологических симптомов и признаков, особенно гемиплегии, сопровождающейся беспокойством, комой и лихорадкой. Ликвор при этом ксантохромный в 20% случаев и показывает полиморфноядерный плеоцитоз. В периферической крови часто представлен выраженный лейкоцитоз. Возможно бифазное течение. Демиелинизирующие повреждения имеют геморрагический характер из-за некротизирующего ангиита венул и капилляров. В постановке диагноза может помочь КТ и МРТ, указывая на наличие больших гиподенсных участках иногда с геморрагическим компонентом (Watson et al., 1984, Huang et al., 1988). При некоторых случаях острого геморрагического лейкоэнцефалита удавалось выделить ДНК и РНК герпесвирусов, но до сих пор неясно, вовлекаются ли эти вирусы в патологический процесс (An et al., 2002).
Лечение постинфекционного энцефалита в основном такое же, как при всех острых энцефалитных заболеваниях. Значение стероидной терапии остается неясным, несмотря на весьма впечатляющее немедленное действие в отдельных случаях (Pasternak et al, 1980). В некоторых случаях применяли внутривенное введение иммуноглобулинов (Kleiman и Brunquell, 1995).
д) Энцефалит ствола мозга и мозжечка. При рентгенографии в случаях острого диссеминированного энцефалита может выявляться вовлечение ствола мозга. Ограниченное вовлечение ствола мозга не характерно и может встречаться при первичных энцефалитах (Kaplan и Koveleski, 1978; North et al., 1993; Duarte et al., 1994) и реже, при постинфекционных типах.
Среди клинических проявлений выделяют лихорадку, системные симптомы и асептический менингит вместе с симптомами и признаками дисфункции ствола головного мозга. Заметно поражение глазодвигательных нервов и нижней лицевой пары, что может сопровождаться заторможенностью и признаками вовлечения длинных нервных путей, что приводит к пирамидальным и мозжечковым проявлениям. Участие черепных нервов и атаксия могут имитировать синдром Миллера-Фишера, который некоторыми авторами рассматривается в качестве формы энцефалита ствола мозга. МРТ может продемонстрировать повышенный сигнал в ножках мозга, в мосте, мозжечке и продолговатом мозге (Ormerod et al., 1986, Hosoda et al., 1987) и энцефалит следует отличать от опухоли ствола мозга, абсцесса или других нейрохирургических проблем. Всегда следует помнить о возможности ромбэнцефалита, вызванного L. monocytogenes, при эффективности антибиотикотерапии (Frith et al., 1987).
е) Острый очаговый энцефалит. Острый очаговый энцефалит, поражающий ограниченный участок при инфекции коксаки-вирусом А9 (Roden et al., 1975) и ЕСНО-вирусом 25 (Peters et al., 1979), может привести к острой гемиплегии или гемихорее. Лакунарные повреждения в центральном сером веществе или внутренней капсуле могут быть результатом сосудистых инфарктов или очаговых церебритов.
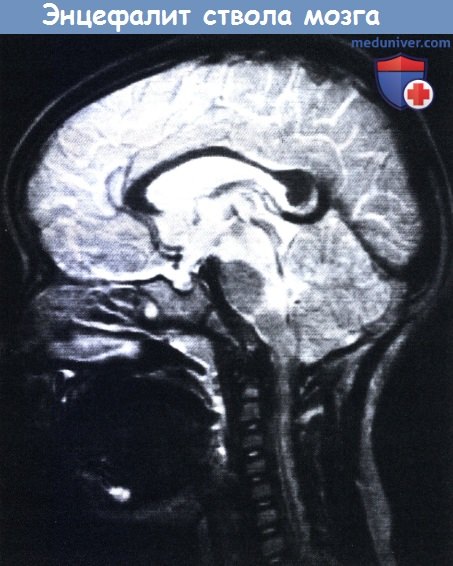
Энцефалит ствола мозга у четырехлетней девочки с клиникой ступора и множественными параличами черепных нервов.
При МРТ выявлено усиление сигнала от ножек мозга и дорсальной части моста.
При повторной МРТ через два месяца патологических изменений не обнаружено.
Что такое антенатальная гибель плода? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кондратенко Юлии Николаевны, гинеколога со стажем в 17 лет.
Над статьей доктора Кондратенко Юлии Николаевны работали литературный редактор Маргарита Тихонова , научный редактор Светлана Симанина и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Антенатальная гибель плода — это внутриутробная смерть плода, наступившая до начала родов, но после 21 недели беременности. Является причиной 39-42 % мертворождений. У таких детей отсутствует сердцебиение, дыхание, движения и пульсация сосудов пуповины [12] .
Согласно первым комплексным оценкам, каждый год на свет появляется более 7200 мертворождённых детей. Даже в высокоразвитых странах Европы и Северной Америки показатель мертворождения не опускается ниже 1,3 % [9] . Уровень мертворождения в России в 2018 году был равен 5,51 %. При этом доля антенатальной гибели плода составила 91,8 %. Однако за последние пять лет показатель перинатальной смертности (гибели ребёнка до и после родов) стал снижаться [13] .
Чаще внутриутробная гибель плода наблюдается у девочек-подростков в силу незрелости организма, а также у беременных 35 лет и старше. К этому возрасту у женщины , как правило, возникает ряд хронических заболеваний, снижается овариальный резерв — запас фолликулов в яичниках. Всё это является риском неразвивающейся беременности по причине хромосомной патологии плода.
Также риск антенатальной потери выше у женщин с более чем двумя родами в анамнезе, привычным невынашиванием беременности , искусственными абортами, многоплодными беременностями, наличием послеоперационного рубца на матке и при экстракорпоральном оплодотворении (ЭКО) [23] .
Существует множество причин внутриутробной гибели плода. Они могут быть как со стороны самого плода, так и стороны матери [8] .
Непосредственной причиной смерти является дистресс-синдром плода . Он подразумевает под собой все нарушения функционального состояния плода, в первую очередь, его движений и сердцебиения.
Опосредованные причины антенатальной гибели плода :
- Врождённые аномалии развития плода — синдром Дауна, синдром Патау, синдром Эдвардса и др. . Чаще всего это происходит при:
- инвазивной диагностике и лечении беременной — амниоцентезе (во время удаления излишков околоплодных вод, введения лекарств или пункции амниотической оболочки), пунктировании сосудов пуповины и др.;
- нарушении стерильности во время введения препаратов крови внутрь матки через сосуды пуповины (например, при переливании эритроцитарной массы плоду с гемолитической болезнью);
- преждевременном разрыве околоплодных оболочек в случае пролонгированной беременности;
- общих инфекциях беременной — TORCH-инфекциях, сифилисе , туберкулёзе, урогенитальном хламидиозе и ВИЧ-инфекции[13] .
- Экстрагенитальные заболевания матери — сахарный диабет, нарушения работы щитовидной железы, почек и надпочечников, травмы, злоупотребление алкоголем и курение , особенно при наличии воспалений урогенитального тракта.
- Особенности течения беременности :
- различные формы позднего токсикоза;
- угроза прерывания беременности;
- истмико-цервикальная и фетоплацентарная недостаточность ;
- инфекционные заболевания;
- нарушение кровотока в матке и плаценте;
- тазовое предлежании плода.
- Неустановленные причины .
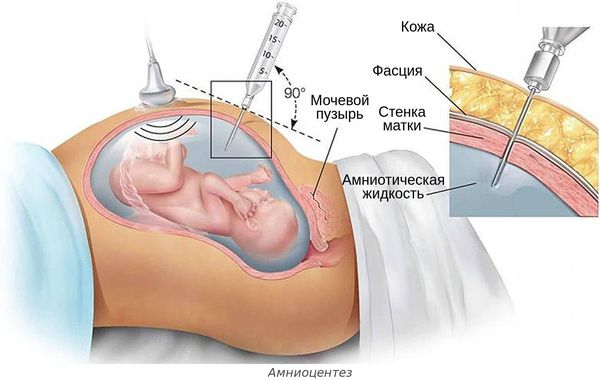
Инфекция может быть вирусной (цитомегаловирусы, вирусы простого герпеса, краснухи, Коксаки, ВИЧ), бактериальной (хламидии, микоплазмы, уреаплазмы, стрептококки группы В, энтеробактерии, кишечная палочка) и грибковой (кандидоз).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы антенатальной гибели плода
Процесс внутриутробной гибели плода далеко не всегда может сопровождаться изменениями в самочувствии женщины. Иногда беременная отмечает более частые шевеления плода, но позже происходит их полное прекращение. Это говорит об острой гипоксии плода — снижении содержания кислорода в организме [2] . Однако часто гибель малыша наступает незаметно для матери и врача, что приводит к поздней диагностике антенатальной смерти плода [4] .
В течение первых трёх дней гибели малыша пациентка может обратить внимание на изменения своего состояния:
- прекращаются шевеления плода;
- уменьшается размер молочных желёз, снижается их напряжение;
- живот перестаёт увеличиваться в объёме;
- возникает слабость, недомогание, тяжесть внизу живота.
Если с момента гибели плода в утробе матери прошло несколько недель, могут присоединяться признаки воспалительной реакции:
- повышение температуры до 38 ℃;
- сильные тянущие боли внизу живота;
- головная боль и головокружение;
- сонливость;
- нарушение сознания [16] .
Патогенез антенатальной гибели плода
Несмотря на то, что внутриутробная гибель плода является общемировой проблемой, вопросы её патогенеза остаются нерешёнными [5] [14] [21] [25] . В связи с этим проводится множество исследований, в частности исследования плаценты — предполагается, что её изменения являются основной или одной из главных причин смерти плода. Установить фактическую причину при аутопсии (вскрытии) мертворождённого довольно трудно [3] [6] [15] [22] [24] .
Суть патогенеза заключается в нарушении функции плаценты, развитии хронической плацентарной недостаточности, нарушении кровоснабжения плода, его росте и развитии. Поражаются внутренние органы плода — развивается внутриутробная пневмония, менингит и др. В какой-то момент происходит нарушение нормального функционирования плаценты, развивается острая плацентарная недостаточность и плод погибает.
Профессором И. В. Бариновой в 2015 году были представлены два типа плодовых потерь при внутриутробной гипоксии. Каждому из них характерно своеобразное сочетание патогенетических факторов, связанных с матерью, плацентой и плодом.
Патогенез первого типа отличается комплексом таких признаков, как ранняя тяжёлая преэклампсия и васкулопатия, т. е. патологическое изменение сосудов базальной пластинки плаценты (неполноценная перестройка спиральных артерий, необходимая для улучшения кровоснабжения плода, острый атероз, тромбоз и кровотечения). Всё это нарушает циркуляцию материнской крови в плаценте [1] .
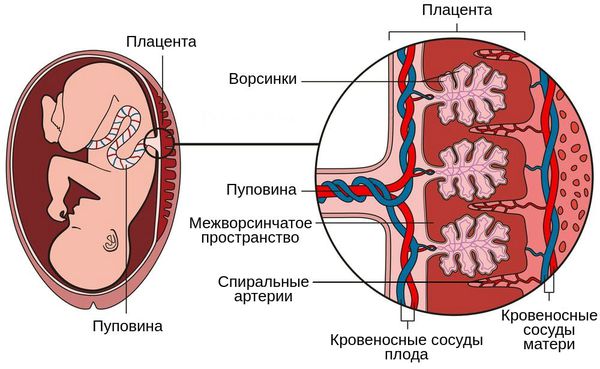
Патогенез второго типа обусловлен нарушением циркуляции в плодовой части плаценты, незрелостью ворсин относительно срока беременности, а также васкулопатией сосудов плода и тромбозом ворсин.
Эти основные звенья патогенеза антенатальной гибели позволяют своевременно профилактировать и назначать патогенетическую терапию фетоплацентарной недостаточности [1] .
Классификация и стадии развития антенатальной гибели плода
Пока не существует общепринятой классификации внутриутробной гибели плода. Однако изучение причин перинатальной смертности привело к появлению двух понятий:
- "Необъяснимое" мертворождение — внезапная гибель малыша наступает по неизвестным причинам. Установить их можно только после анатомического вскрытия плода и исследования плаценты. Зачастую выявляются аномалии опорно-двигательной и нервной системы, несовместимые с жизнью, а также поражения сердечно-сосудистой системы, в частности фатальная аритмия — нарушение сердечного ритма.
- Мертворождение, связанное с задержкой роста плода — гибель плода обусловлена нарушениями обмена веществ, поступления кислорода и кровоснабжения плода из-за материнских факторов, а также факторов, связанных с плодом и плацентой [8] .
Полноценное гистологическое исследование внутриутробно погибшего плода необходимо для установления причины его смерти. Некоторые матери отказываются от него, но это неправильно. Дело в том, что у многих женщин с гибелью плода в анамнезе повышается риск повторных потерь при следующих беременностях [26] . Поэтому исследование причин мертворождения позволит предотвратить повторение этой трагедии в будущем.
Осложнения антенатальной гибели плода
При своевременном обращении к доктору антенатальная гибель плода не приводит к осложнениям. Если же пациентка обратилась за медицинской помощью спустя больше двух недель после смерти ребёнка, то у неё с большой вероятностью могут развиваться такие осложнения, как:
- Кровотечение во время и после родов.
- Гнойно-септические осложнения:
- хориоамнионит — воспаление стенок плодного пузыря и заражение инфекцией околоплодных вод;
- послеродовой метроэндометрит — воспаление мышечной и слизистой оболочки стенки матки;
- инфекции послеоперационной раны — может возникнуть, если роды проходили путём кесарева сечения, например, при раннем отделении плаценты;
- послеродовой сепсис — заражение крови.
Чтобы избежать их, необходимо тщательно наблюдать за состоянием пациентки и выполнять профилактические мероприятия:
- плановое проведение родов при высоком риске кровотечения;
- профилактика анемии ;
- гемостатическая терапия;
- пережатие пуповины ребёнка не раньше первой минуты после рождения;
- строгое соблюдение стерильности при выполнении кесарева сечения и вагинальных исследований во время родов;
- использование индивидуальных комплектов при родоразрешении;
- отказ от катетеризации мочевого пузыря и эпизиотомии (рассечения задней стенки влагалища) без явной необходимости;
- профилактический приём антибиотиков после выполнения инвазивной диагностики или при длительном безводном периоде;
- ранняя выписка из родильного дома (на третьи сутки после родов) [16] .
Антенатальная гибель плода является серьёзным состоянием при многоплодной беременности . В случае дихориальной беременности (когда малыши развиваются независимо друг от друга: каждый имеет свои жизненно важные структуры — плодный мешок и плаценту) гибель близнеца не влияет на другого ребёнка. При монохориальной беременности (когда у малышей одна плацента на двоих) риски повреждения второго плода существенно выше:
- в 12 % случаев происходит гибель второго ребёнка;
- в 18 % случаев у него диагностируются неврологические нарушения.
В связи с этим рекомендован контроль показателей эхокардиографии (УЗИ сердца), оценка мозгового кровотока (УЗИ головного мозга) и МРТ выжившего плода [18] .
Помимо прочих осложнений у женщины может возникнуть депрессия , тревожное и посттравматическое расстройство на почве пережитой трагедии или чувства вины. У неё может развиться страх перед будущей беременностью, желание избежать её [26] . В этих случаях пациентке требуется психотерапевтическая помощь.
Диагностика антенатальной гибели плода
После того как женщина обращается к врачу с жалобами на недомогание и отсутствие шевеления плода, врач направляет пациентку на диагностическое обследование. Оно позволяет поставить точный диагноз.
Постановка диагноза внутриутробной гибели плода включает следующие этапы обследования:
- Выслушивание сердечных сокращений плода специальным стетоскопом. Обычным медицинским стетоскопом в данном случае услышать сердцебиение невозможно. Для этого существует деревянный акушерский стетоскоп. Он отличается широкой воронкой, которая плотно прикладывается к животу беременной.
- Выслушивание сердечных сокращений фетальным аудиодопплером и/или монитором . Фетальный допплер можно использовать даже в домашних условиях, начиная с 12-ой недели беременности. Для этого женщине нужно лечь на спину и для чёткого сигнала нанести гель на те участки живота, которые будут соприкасаться с датчиком. Сам допплер нужно передвигать медленно, без резких движений. Длительность исследования — 3-7 минут.
- Ультразвуковое исследование плода (УЗИ). Этот метод является одним из самых достоверных для диагностики внутриутробной гибели плода. С его помощью доктор констатирует отсутствие сердцебиения у малыша [16] .

Анализы для диагностики внутриутробной гибели плода на позднем сроке беременности не так важны. Отсутствия шевелений плода в течение нескольких дней и сердцебиения по данным УЗИ достаточно для правильной постановки диагноза.
Лечение антенатальной гибели плода
При подтверждённом диагнозе антенатальной гибели плода показана экстренная госпитализация и принятие решения о методе и сроке родоразрешения. Чем меньше интервал между установленным диагнозом и родоразрешением, тем меньше риск возникновения осложнений во время и после родов.
Выбор метода определяется индивидуально, на основании клинических данных и особенностей акушерской ситуации. Оптимальным вариантом родоразрешения при антенатальной гибели плода являются роды через родовые пути. Но иногда выполняется кесарево сечение, например при раннем отделении плаценты от стенок матки, обильном или продолжающемся кровотечении из половых путей.
При родоразрешении беременных с антенатальной гибелью плода, осложнившейся септическим состоянием, показано экстренное оперативное вмешательство. Объём операции решается индивидуально, возможна удаление матки с плодом (экстирпация).
После родов важно тщательно наблюдать за состоянием роженицы, провести профилактику послеродового кровотечения и гнойно-септических осложнений. Необходимо обратить внимание на выделения из половых путей (гнойные или кровянистые ), температуру тела, появление озноба, слабости, тянущих болей внизу живота.
Во всех случаях внутриутробной гибели плода показано патологоанатомическое исследование плода и последа (его оболочки). Отказ от исследования по желанию родственников оформляется в соответствии с нормами действующего законодательства [19] .
Самым тяжёлым остаётся вопрос о том, когда же произошла гибель плода. Раньше считалось, что в основе определения времени гибели лежит оценка выраженности процессов мацерации — размягчения и разрыхления тканей плода [20] . Однако наличие признаков мацерации не всегда позволяет достоверно судить о давности наступления гибели, т. к. время её развития зависит от причин гибели малыша.
Прогноз. Профилактика
Потеря беременности является показанием к проведению медицинской, психологической и социальной реабилитации пациенток. Необходим полный комплекс диагностических исследований для выяснения причины гибели плода. Выбор алгоритма обследования базируется на данных анамнеза, особенностях течения беременности и результатах патологоанатомического исследования плода и последа.
Женщины с внутриутробной гибелью плода в анамнезе входят в группу риска данного осложнения при последующих беременностях. Поэтому наступление беременности у таких пациенток требует выполнения комплекса мероприятий по подготовке организма женщины к полноценному зачатию, вынашиванию и рождению здорового ребёнка [10] . Оптимальный интервал между беременностями должен составлять не менее 6 месяцев, чтобы минимизировать потенциальные сложности течения последующей беременности [26] .
При неустановленной причине гибели плода в анамнезе необходимо учитывать данный факт при выработке тактики родоразрешения последующих беременностей.
Профилактика антенатальной гибели плода предполагает:
- ведение здорового образа жизни;
- диагностику и адекватное лечение соматических и хронических инфекционных заболеваний;
- своевременное выявление генетической патологии;
- лечение высокого артериального давления;
- контроль уровня глюкозы в крови при сахарном диабете [26] ;
- предупреждение травм живота;
- прекращение контакта с бытовыми токсичными веществами;
- ликвидацию профессиональных вредностей (переход на другую работу);
- адекватное назначение лекарств в период беременности;
- приём фолиевой кислоты до зачатия;
- комплексное антенатальное наблюдение за состоянием плода [7] ;
- регистрацию шевелений плода на 28 неделе беременности;
- ведение гравидограммы с 24 недели беременности (сводной таблицы данных, регистрирующей динамику течения беременности) — повышает качество диагностики задержки развития плода и снижает риск потери малыша в 1,8 раз [11] .
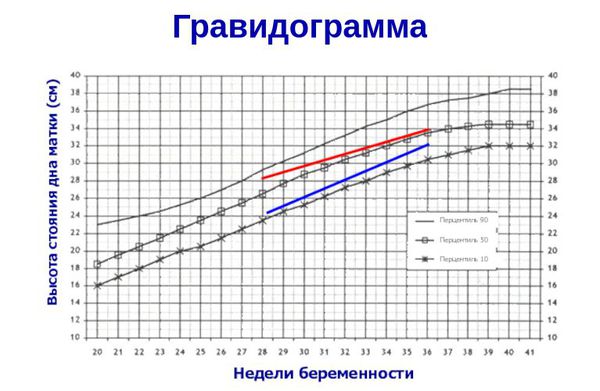
Курение увеличивает риск перинатальной смертности на 27 % [17] . Однако чаще антенатальная гибель плода наблюдается у беременных, употребляющих алкоголь — в 6,25 % случаев [8] . Поэтому отказ от вредных привычек значительно увеличивает шансы родить здорового ребёнка.
Синдром внезапной смерти младенцев
Данный синдром представляет неожиданную, ненасильственную смерть видимо здорового ребенка в возрасте от 7 дней до одного года, при которой отсутствуют адекватные для объяснения причины смерти данные анамнеза и патолого-анатомического исследования. Смерти до 7 дней относят к смертям от перинатальных причин.
Точная частота синдрома неизвестна, в разных странах она колеблется от 3 до 10 на 10 000 живых новорожденных. Среди факторов риска развития синдрома внезапной смерти младенцев (СВСМ) наиболее значимыми являются следующие.
1. Случаи предшествующей скоропостижной смерти детей.
2. Курение матери во время беременности и после родов.
3. Алкоголизм матери.
4. Четвертые и более роды.
5. Интервал между данными и предшествующими родами менее 14 месяцев.
6. Вес ребенка при рождении менее 2 кг.
7. Преждевременные роды и наличие признаков морфофункциональной незрелости ребенка.
8. Неполная семья.
Пик частоты синдрома внезапной смерти младенцев приходится на 2—4 месяца; до 1 мес и после 6 мес он встречается значительно реже; мальчики гибнут в 1,5 раза чаще девочек.
Механизмы синдрома внезапной смерти младенцев до сих пор остаются сложными и плохо изученными, однако их основой являются остановка сердца или дыхания. Считается, что фактором, предрасполагающим к указанным нарушениям, является незрелость центральной и вегетативной нервных систем новорожденного, особенно мозжечковых структур, осуществляющих контроль дыхания и артериального давления.
Для выявления факторов риска синдрома внезапной смерти младенцев проведено множество исследований, включающих электроэнцефалографию, пульсоксиметрию, ЭКГ покоя, холтеровское мониторирование, мониторинг апноэ, исследование сна детей. Однако полученные результаты не привели к существенному снижению частоты синдрома в популяции. Определенные успехи были достигнуты только после внедрения рекомендаций сна в положении на спине.
Кардиальная составляющая синдрома внезапной смерти младенцев представлена в основном развитием фатальных нарушений сердечного ритма. Морфологической основой этих нарушений могут быть резорптивная дегенерация проводящей системы сердца, интрамуральное положение правой ножки пучка Гиса. Основной клинической патологией, связанной с СВСМ считается синдром удлиненного интервала QT, приводящий к полиморфной желудочковой тахикардии. Однако его выявление у новорожденных затруднительно, так как в первые 48 часов нередко имеются транзиторные нарушения, связанные с электролитными сдвигами или с нарушениями автономного контроля.
Таким образом, ЭКГ является показательной только начиная с 3-го дня жизни. К сожалению, изменения ЭКГ в этом возрасте часто бывают ложнопозитивными и ложнонегативными. Результаты профилактического лечения бессимптомных детей с удлиненным интервалом QT практически неизвестны.
В случаях врожденного синдрома укорочения интервала QT (СУИQT) - блокаторы могут предотвратить аритмию и внезапную смерть. Но если синдром укорочения интервала QT (СУИQT) является следствием автономной нестабильности, стволовых нарушений или остановки дыхания, лечение блокаторами будет неэффективно.
Необходим дальнейший корреляционный анализ ЭКГ и клинических данных для выявления детей с высоким риском, в частности, страдающих апноэ и брадикардией и имеющих в семейном анамнезе синдрома внезапной смерти младенца (СВСМ) или синдрома укорочения интервала QT (СУИQT).
Детям, имеющим факторы риска, необходим контроль функции дыхания, особенно в ночное время с помощью респираторного монитора.

Скоропостижная смерть младенцев
Следует различать синдром внезапной смерти младенцев и неожиданную, скоропостижную смерть, причиной которой могут быть нераспознанные заболевания. Внезапная смерть внешне нормальных доношенных новорожденных представляет сравнительно редкий феномен. В США она встречается примерно у 0,1 % новорожденных.
Основной причиной подобных трагедий является инфекция, в том числе респираторная. Однако большую группу представляют и заболевания сердца. Наиболее важной патологией являются врожденные пороки с дуктус-зависимым кровообращением, а также обструктивные поражения левого сердца.
Среди ВПС с дуктус-зависимым легочным кровотоком наиболее важны варианты пороков, при которых одним из компонентов является атрезия легочной артерии или критический легочный стеноз — единственный желудочек, тетрада Фалло, трикуспидальная атрезия, атрезия легочной артерии с ДМЖП. При этих пороках первоначально хорошая функция ОАП позволяет поддерживать удовлетворительную оксигенацию крови, и клиническая симптоматика выражается лишь в легком цианозе слизистых.
Как правило, шум над областью сердца выражен незначительно и не привлекает внимания. А наличие анемии может дополнительно скрывать сниженную оксигенацию крови. В результате состояние новорожденных трактуют как следствие перенесенной перинатальной гипоксии и не проводят углубленного исследования сердца ребенка. После выписки домой возможны два основных сценария событий:
1) постепенное сужение ОАП, сопровождающееся нарастанием цианоза;
2) внезапное закрытие ОАП, приводящее к скоропостижной смерти ребенка.
Среди ВПС с дуктус-зависимым системным кровообращением наиболее важны синдром гипоплазии левого сердца, критическая коарктация аорты и критический аортальный стеноз. Обычно их распознавание происходит рано из-за симптомов сердечной недостаточности. Однако даже в таких странах как США и Англия описаны случаи их первичной диагностики у детей, уже находящихся дома. Это может быть связано с хорошей компенсацией системного кровообращения через ОАП. Понятно, что при его закрытии возникают шоковое состояние и смерть ребенка.
Если аортальный стеноз или коарктация аорты умеренно выражены, опасность представляют состояния, при которых возникает повышенная потребность в сердечном выбросе. У младенцев это, прежде всего, высокая температура тела. В сочетании с физической активностью (при беспокойстве ребенка) она может привести к резкой относительной гипоперфузии жизненно важных органов, коллапсу и смерти пациента.
Среди прочих причин неожиданного летального исхода следует указать на опухоль сердца, обтурирующую выводной отдел желудочка или отверстие атриовентрикулярного клапана. Редким, но возможным следствием опухоли является возникновение фатальной аритмии.

Отмечено, что к опасным нарушениям электрической активности сердца ребенка приводит употребление матерью кокаина, амфетамина, марихуаны, ЛСД, а также курение во время или сразу после беременности.
Значительное место среди причин внезапной смерти занимает полная атриовентрикулярная блокада, если она не распознана внутриутробно или сразу после рождения.
Редкой, но потенциально возможной, причиной остановки сердца является выраженная гипогликемия (уровень глюкозы в крови менее 2,6 ммоль/л). Чаще, однако, она предварительно проявляется такими симптомами как тремор, конвульсии, эпизоды цианоза, нарушения дыхания, состояние летаргии. Наибольшей опасности подвержены новорожденные, слишком маленькие (менее 10 процентилей) или слишком большие (более 90 процентилей) для данного срока беременности, родившиеся от матерей с сахарным диабетом, недоношенные и перенесшие перинатальную асфиксию.
Миокардит и различные виды кардиомиопатий редко сопровождаются скоропостижной смертью младенцев. Наиболее опасной при этом представляется рестриктивная форма заболевания.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Врожденные инфекции у плода и новорожденного ребенка: виды, возбудители, клиника, диагностика
Передача врождённых и перинатальных инфекций плоду происходит через плаценту (внутриутробные инфекции), во время родов или при контакте с физиологическими жидкостями матери. Длительное разрушение плодных оболочек также способствует развитию внутриутробных заболеваний. Кроме того, заражение может произойти и после рождения (при контакте с матерью и другими людьми).
Врожденная краснуха
Первый признак врождённой краснухи — желтуха, как следствие развития гепатита. Часто возникает гемолиз и тромбоцитопеническая пурпура, а также слабовыраженные клинические проявления менингоэнцефалита. У некоторых новорождённых обнаруживают признаки метафизарной дисплазии. Инфицированные дети при рождении обычно имеют сниженную массу тела и отстают в физическом развитии.
В тяжёлых случаях болезнь обычно заканчивается летальным исходом. Наиболее грозные осложнения — незаращение артериального протока, катаракта, глухота, ретинопатия.
Тест на антитела к краснухе (IgM), которые можно обнаружить в крови детей до 3-го мес жизни, даёт положительный результат. При заболевании матери в I триместре вероятность развития патологии у ребёнка составляет 60%, поэтому некоторые женщины предпочитают прерывать беременность. В дальнейшем риск заметно снижается (2% после 20-й нед), в связи с чем выбор между рождением ребенка с вероятными нарушениями в развитии и прерыванием беременности необходимо делать крайне осторожно.
Цитомегаловирус у плода и новорожденного
Инфекция проявляется примерно в 1% случаев, при этом тяжёлая форма заболевания развивается только у 1% инфицированных. Наиболее высокий риск заражения плода отмечают на сроке гестации, соответствующем I триместру беременности. Симптомы заболевания у новорождённых — сниженная масса тела, гепатомегалия, спленомегалия, тромбоцитопения, продолжительная желтуха, повышенная возбудимость, судорожный синдром, аномальный мышечный тонус и двигательные расстройства.
Наиболее частые осложнения — микроцефалия, нейросенсорная глухота. Нередко обнаруживают кальцификацию головного мозга, гемиплегию (паралич мышц одной стороны тела), замедление психомоторных реакций, хориоретинит и миопатию. Диагностика основана на обнаружении антител к цитомегаловирусу (IgM) или определении экскреции вируса в течение первых двадцати дней жизни.
Возбудитель ЦМВ инфекции
Врожденная инфекция вируса простого герпеса
Первичная инфекция, вызванная вирусом простого герпеса, сопровождается виремией. При этом может произойти трансплацентарное заражение плода. При врождённом инфицировании дети рождаются с тяжёлыми отклонениями (пневмония, менингоэнцефалит, гепатоспленомегалия, цитопения), но лишь у некоторых из них присутствуют герпетические очаги на коже и слизистых оболочках. Лечение ацикловиром позволяет снизить смертность с 80—90% до 10—15%.
Терапию следует начинать до получения результатов лабораторного анализа. Первичная инфекция также возникает при заражении от матери, страдающей генитальным герпесом. При этом в первые дни жизни ребёнка возникают очаги на коже, конъюнктиве, слизистой оболочке рта и половых органов, а в 50% случаев наблюдают генерализованное течение инфекции. Лечение: внутривенное введение ацикловира.
Ветряная оспа плода
Инфицирование плода ветряной оспой возникает при заражении беременной в I—II триместре беременности, при этом вероятность передачи инфекции плоду составляет 3%. Заболевание характеризуется развитием рубцовой контрактуры в области лимбических структур головного мозга, микроцефалии или офтальмомикрии. Непривитые беременные в течение десяти дней после возможного заражения (контакта) должны пройти профилактический курс введения иммуноглобулина (содержащим антитела к вирусу ветряной оспы).
Ветряная оспа новорождённых возникает при заболевании матери в течение одной недели до родов. Смертность составляет 40%, поэтому в первые 48 ч жизни ребёнку необходимо ввести специфический иммуноглобулин. При ухудшении состояния следует незамедлительно начать лечение ацикловиром. Применение нормального иммуноглобулина человека не защищает новорождённого от заражения. В некоторых странах применяется вакцина.
Врожденный листериоз
Трансплацентарная передача Listeria monocytogenes происходит при заражении матери инфекцией, протекающей бессимптомно. Заболевание матери на ранних стадиях беременности обычно приводит к смерти плода, а на более поздних — к преждевременным родам. Инфекцию новорождённых обычно осложняет бактериемия, гепатоспленомегалия, менингоэнцефалит, тромбоцитопения и пневмония. При интранатальном заражении инфекция развивается в течение первых двух недель жизни ребенка и сопровождается менингитом и бактериемией.
Для выделения возбудителя на анализ отбирают кровь, спинномозговую жидкость, плацентарную ткань и послеродовую жидкость из матки. Инфицированную мать и ребёнка помещают в отдельную палату, так как они могут стать причиной вспышки заболевания в родильном отделении. Препарат выбора — ампициллин (иногда в комплексе с гентамицином); длительность лечения 2—6 нед.
Врожденный сифилис
Благодаря эффективным пренатальным исследованиям случаи врождённого сифилиса в настоящее время достаточно редки. У заражённых детей обнаруживают лихорадку, а также симптомы, свойственные вторичному сифилису, сыпь, кондиломы и трещины на слизистых оболочках. При развитии остеохондритов возникает выраженный болевой синдром. Очень часто отмечают постоянный насморк (сопение, гнусавость).
Для подтверждения диагноза применяют темнопольную микроскопию образцов поражённой кожи и слизистых оболочек. Специфические IgM или другие антитела персистируют в организме свыше 6 мес после перенесённой инфекции. Поздние симптомы (глухота, атрофия зрительного нерва, паретический нейросифилис) наблюдают в возрасте 12—20 лет. Нередко возникают бугристые образования на лобных костях, хронический большеберцовый периостит, перфорация передних зубов, деформация первых постоянных коренных зубов и высокий изгиб нёба. Препарат выбора — пенициллин.
Врожденный токсоплазмоз
Вероятность врождённого токсоплазмоза варьирует в разных регионах. Например, в Великобритании его регистрируют достаточно редко, а во Франции — часто. При заражении беременной трансплацентарную передачу инфекции плоду наблюдают в каждом третьем случае. Наиболее высок риск развития патологии плода (мертворождение, смерть после рождения, кальцификация головного мозга, церебральный паралич и эпилепсия) при заражении женщины в I и II триместре беременности.
Хориоретинит может возникать только спустя некоторое время после рождения и быть единственным симптомом болезни. Токсоплазмоз у матери подтверждают при обнаружении специфических антител (IgM) или сероконверсии. IgM также обнаруживают у инфицированных новорождённых. Применение спирамицина позволяет снизить риск трансплацентарного заражения, но не влияет на исход заболевания у новорождённых.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Синдром внезапной детской смерти (СДВС) – это понятие, применяемое в отношении неожиданной смерти ребенка первого года, наступившей во сне без установленных причин. О СДВС говорят в том случае, если изучение медицинской карты и места смерти, а также патологоанатомическое исследование не дают четкого ответа о причинах гибели младенца. Для оценки риска внезапной детской смерти предложены тестовые алгоритмы (Магдебургская таблица баллов), проводится ЭКГ, полисомнография. Профилактика СДВС включает оптимизацию условий сна ребенка, выявление детей групп риска и обеспечение домашнего кардиореспираторного мониторирования.
Общие сведения
Распространенность СВДС в мире составляет 0,2-1,5 случаев (в России - 0,43 случая) на 1000 детей. В большей степени риску СВДС подвержены младенцы в возрасте до 8 месяцев; наибольшее количество внезапных детских смертей приходится на возраст 2-4 месяца. 60% детей, погибших в результате СВДС, составляют мальчики. Обычно внезапная смерть ребенка наступает во временной интервал с полуночи до 6 часов утра, преимущественно в зимнее время года. На долю СДВС приходится до 30% смертей у детей первого года жизни, что объясняет неослабевающую обеспокоенность молодых родителей и специалистов в области педиатрии данной проблемой.

Причины СДВС
Исследование проблемы внезапной детской смерти ведется уже несколько десятилетий, однако однозначного объяснения причин данного явления так и не получено. К теориям, представляющим исторический интерес, относится объяснение механизма СДВС:
- акцидентальным (случайным) удушьем (при нахождении младенца в родительской постели, непреднамеренное удушение постельными принадлежностями);
- сдавлением трахеи увеличенным тимусом (asthma thymicum);
- лимфатико-гипопластическим диатезом (status thymico-lymphaticus).
На современном этапе в детской неврологии синдром внезапной смерти младенца относится к расстройствам сна (парасомниям). В качестве базовых гипотез, объясняющих патогенез СДВС, рассматриваются:
Некоторые авторы предлагают относить СДВС к крайнему проявлению пограничных состояний новорожденных и детей первого года жизни, которое может наступить при воздействии минимальных по своей выраженности неспецифических факторов.
Факторы риска
Несмотря на множество гипотез, ни одна из них не может служить универсальным объяснением феномена СДВС. Тем не менее, многолетние наблюдения позволяют выявить ряд факторов, существенно повышающих риски внезапной смерти у младенцев. К ним относятся:
- молодой возраст матери (младше 20 лет);
- многоплодная беременность;
- преждевременные роды;
- недоношенность ребенка и масса тела менее 2500 г;
- мужской пол младенца;
- искусственное вскармливание;
- сон на животе и на мягкой поверхности;
- перегревание во время сна;
- табачный синдром плода и др.
В отношении того, повышается ли риск внезапной детской смерти при совместном сне ребенка в одной постели с родителями, однозначного ответа не существует. Большинство исследователей склонны видеть в совместном сне фактор профилактики за счет синхронизации дыхания и сердцебиения ребенка с дыханием и сердцебиением матери, а также возможностью матери быстро отреагировать на остановку дыхания у ребенка. С другой стороны, вероятность СДВС увеличивается из-за опасности чрезмерного укрывания и перегревания ребенка, сна на мягкой подушке и т. д. Вопреки заблуждениям, профилактическая вакцинация детей не является причиной внезапной детской смерти.
Абортивный СДВС
В отношении младенцев, переживших в грудном возрасте очевидный жизнеугрожающий эпизод и выжившим, используется понятие абортивный синдром внезапной детской смерти, или near-miss СВДС. Характерными признаками очевидного жизнеугрожающего эпизода являются внезапная остановка дыхания, бледная или цианотичная окраска кожи, гипотония или гипертонус мышц, возникающие у ребенка без видимых причин, при полном благополучии. Очевидные жизнеугрожающие эпизоды в течение первых месяцев жизни возникают у 0,6% младенцев.
В 50-70% случаях у таких детей удается выявить корреляцию очевидного жизнеугрожающего эпизода с каким-либо патологическим состоянием: судорожным синдромом, миопатией, инфекциями дыхательных путей, гастроэзофагеальной рефлюксной болезнью, врожденными аномалиями развития, заболеваниями обмена веществ и пр. Поэтому детям, перенесшим абортивный СДВС, необходимо проведение комплексного обследования с участием различных детских специалистов: педиатра, детского невролога, кардиолога, гастроэнтеролога, пульмонолога, детского отоларинголога и др.
Из инструментальных исследований наибольшее диагностическое значение могут представлять ЭЭГ, полисомнография, транскраниальная УЗДГ, ЭКГ, УЗИ сердца ребенку, холтеровский мониторинг ЭКГ, рентгенография грудной клетки. Лабораторные методы могут включать инфекционную диагностику (ИФА, ПЦР, микробиологическое исследование), определение КОС крови, биохимический анализ крови и др.
Оценка риска развития СДВС
Отсутствие достоверных знаний о причинах внезапной детской смерти позволяет оценивать степень риска исключительно статистическими методами. Так для идентификации детей групп риска предложена Магдебургская таблица баллов СВДС, выделяющая в качестве критериев:
- возраст матери,
- вес младенца при рождении,
- положение ребенка во сне,
- особенности постельных принадлежностей,
- курение матери,
- продолжительность грудного вскармливания.
Среди объективных методов выделения детей групп риска по развитию СДВС не первый план выходит ЭКГ и полисомнография. Алгоритм, предложенный И.А. Кельмансоном, содержит 6 клинических и 12 морфологических признаков, позволяющих проводить посмертную дифференциальную диагностику синдрома внезапной детской смерти и жизнеугрожающих заболеваний и представляет интерес, главным образом, для специалистов-патологоанатомов.
Профилактика
Профилактика СДВС включает меры первичного и вторичного характера. Принципы первичной профилактики основываются на антенатальных мероприятиях (отказе от вредных привычек до беременности, рациональном питании матери, достаточной физической активности, профилактике преждевременных родов, ранней постановке на учет и ведении беременности под наблюдением акушера-гинеколога и т. п.).
К мерам первичной профилактики также относится оптимизация условий сна грудного ребенка: сон на спине, применение спального мешка, исключающего самостоятельный переворот ребенка на животик, сон на плотном матрасе, исключение перегревания, достаточный доступ свежего воздуха, поддержание температурно-влажностного режима, отсутствие резких запахов и табачного дыма.
Вторичная профилактика СДВС предполагает выявление групп высокого риска и проведение целенаправленных мероприятий (общеукрепляющего лечения, массажа), домашнего кардиореспираторного мониторинга и др.
Читайте также:

