Рецепт при красной волчанке
Обновлено: 23.04.2024
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.

Когда иммунная система начинает атаковать собственные клетки, развивается аутоиммунное заболевание. Причиной служит плохая экология, регулярные стрессы, недолеченная вирусная или инфекционная болезнь, наследственный фактор. При аутоиммунном расстройстве назначается комплексная гормональная терапия и диетпитание. Чтобы составить правильный рацион, необходимо пройти обследование, в ходе которого выяснится состояние пациента. Назначение диетического питания зависит от индивидуальной особенности пациента, от того, в каком состоянии кости и мочевыводящая система.
Согласно научным данным, которые подтверждают взаимосвязь между кишечником и воспалительным процессом, выявлено, что при бактериальном росте в кишечнике начинает развиваться воспалительное и аутоиммунное заболевание. Диета aip подразумевает исключение некоторой пищи из привычного рациона, чтобы понизить интенсивность признаков аутоиммунного расстройства. Условием является прохождение дополнительного обследования, чтобы подтвердить, что нарушение работы стенок кишечника относится к главному фактору, относящемуся к развитию воспаления. Лечение аутоиммунных заболеваний диетой aip способна уменьшить потребность в приеме высоких доз медикаментозных препаратов. Диета аутоиммунного палео протокола относится к строгому режиму питания, поэтому перед началом необходимо проконсультироваться с лечащим врачом.
Специальное питание при аутоиммунном заболевании должно быть:
- Богато микроэлементами. Недостаток селена, магния, цинка связывают с некоторыми видами аутоиммунного расстройства, которое начинается при хроническом воспалительном процессе. Воспаление способно поглощать такие важные питательные вещества. Микроэлементы содержатся в орехах и семенах. Селен находится в фасоли, печени, горохе. Овсянка и гречка содержит магний. Большое количество цинка содержит ячменная крупа, кедровые орехи плавленый сыр.
- Содержать витамин А, который способен улучшить состояние иммунитета. Согласно научным исследованиям, недостаток такого витамина нарушает иммунную защиту слизистой оболочки. В результате в дыхательные пути и желудочно-кишечный тракт проникает инфекция. Высокое содержание ретинола встречается в рыбе, моллюсках, печени, молочном жиру коров, в рационе которых была только трава. Сладкий картофель, морковь содержат провитамин, но в человеческом организме он с низкой скоростью превращается в ретинол.
- Богато витаминов к2. Медицинские исследования доказывают, что наличие этого витамина оказывает положительный эффект во время лечения иммунитета и воспалительного процесса. Высокий процент витамина к2 содержит ферментированная японская соя. При отсутствии возможности употреблять такой продукт, альтернативой служит употребление паштета из куриной, гусиной печени, сыра, желтка, творога.
- Богато железом. Недостаток железа связывают с возникновением многих аутоиммунных расстройств. Чтобы восполнить баланс железа в организме, человеку необходимо употребление говядины, печени, шпината. Для приготовления еды используется чугунная посуда.
- Содержать витамин Д. Из-за отсутствия необходимого количества витамина Д в организме может начать развитие красная волчанка, ревматоидный артрит, сахарный диабет первого типа. При недостатке этого витамина увеличивается частота инфекционного проникновения в организм. Витамин Д находится в животном и молочном жире. Человеческий организм способен самостоятельно вырабатывать этот витамин. Для этого достаточно полчаса в сутки находиться под открытыми солнечными лучами.
Существует три фактора, которые способствуют возникновению аутоиммунной болезни. К первому фактору относится рацион, в котором недостает питательных веществ, вследствие чего нарушается усваивание пищи. В питании может не хватать:
- Клетчатки. Она помогает убрать воспаление, улучшить перильстатику.
- Жирорастворимых витаминов.
- Антиоксидантов. Они способны уменьшить воспалительный процесс. Антиоксиданты вырабатываются организмом, ими богаты овощи, фрукты.
- Минералов. При аутоиммунном расстройстве важно, чтобы в организме было достаточное количество меди, магния, цинка, железа, селена, йода. Необходимо следить как за дефицитом, так и переизбытком таких минералов. Стоит учесть, что положительное действие некоторых минералов возможно только в комплексе с другими минералами, которые присутствуют в еде, а не добавках.
- Качественного жира. Из-за недостатка плохо усваиваются важные жирорастворимые витамины. Чтобы уменьшить воспалительный процесс, следует соблюдать пропорцию омега6 и омега3.
Желудочно-кишечный тракт служит главным барьером между внутренней средой и внешними факторами. Это является причиной расположения около него значительной части иммунитета. Задача ЖКТ – осуществление пищеварения и всасывания полезных микроэлементов. Если присутствует синдром дырявой кишки, происходит травмирование стенок кишечника. Вместо фильтрации через кишечный барьер, в организм проникают токсические вещества, инфекция, патогенные микроорганизмы, непереваренная еда. Неспособность иммунных клеток, которые расположены возле кишечника, справляться с возбудителями оканчивается проникновением их в кровоток. Происходит активизация врожденного иммунитета и воспалительного процесса. Если желудочно-кишечный тракт функционирует нормально, такая ситуация исключается.
Выделяют список продуктов, употребляя которые, повышается риск возникновения дырявой кишки, дисбактериоза, и как следствие – аутоиммунного заболевания:
Диетическое питание, которое является противоположностью палео диеты при аутоиммунном заболевании, называется веганское. Безглютеновая диета при аутоиммунном заболевании предусматривает отказ от мяса, молочных продуктов, яиц, рыбы. Некоторые специалисты твердят, что соблюдение веганской диеты не обеспечивает достаточным количеством аминокислот, которые содержит растительная пища. Пациентам, у которых диагностирован аутоиммунный тиреоидит, трудно балансировать уровень витамина В12, Д, железа без употребления пищи животного происхождения. Однако Соблюдение такой диеты снижает воспаление, запущенное аутоиммунными процессами и нарушением в функционировании желудочно-кишечного тракта.
Определение диеты по группе крови
Способ, который позволяет определить тип диетического питания, основан на группе крови человека. Пациент, у которого первая группа крови, должен употреблять мясо. Им рекомендовано соблюдение аутоиммунной палеодиеты. Вторая группа крови у человека говорит о том, что нет необходимости кушать много мяса, им следует придерживаться веганского питания. Пациентам с 3 и 4 группой необходимо создать гибридную версию из вышеперечисленных видов диет. Независимо от выбора противовоспалительной диеты при аутоиммунном заболевании, следует максимально разнообразить питание и включить витаминные добавки.
Правила питания при тиреоидите
Сбой в работе иммунной системы сопровождается различными заболеваниями. К одному из них относится тиреоидит, когда аутоантителами повреждаются здоровые клетки щитовидной железы. В результате щитовидка перестает вырабатывать тиреоидный гормон. Диагностирование тиреоидита подразумевает лечебную терапию и определенное питание. При гипертиреозе ускоряются обменные протезы, нарастает энергозатрата, интенсивнее распадается жир, белок и гликоген, расходуется витаминный и минеральный запас. Отсюда следует, что диета при аутоиммунном заболевании должна восполнить измененную потребность организма в определенных веществах. Правила питания при тиреоидите следующие:
- Ввести дробный режим. Пищу принимать минимум пять раз в день для избегания чувства голода.
- Включить продукты, в которых содержится много калия. Это банан, абрикос, картофель, ананас, персик, крыжовник, капуста.
- Белковая квота повышается до полтора грамма на один килограмм массы тела пациента. Этому способствует мясо, рыба нежирных сортов, яйца, гречка, овсянка, кисломолочные продукты.
- Употребление нерыбных морепродуктов допустимо, но суточный показатель не должен превышать 0.1 миллиграмм.
- Суточный показатель калорий увеличить на тридцать процентов. Количество процентов зависит от индивидуальных особенностей пациента.
- Чтобы не появлялась жажда, следует часто пить. В качестве напитков служит компот, несладкий отвар шиповника, отвар из сухофруктов, морс, чай, молочный напиток с низким показателем жирности. Перерыв между питьем минимум десять минут, делать не более двух-трех глотков.
- Из рациона исключается пища и питье, способные активировать центральную нервную систему. Речь идет об употреблении спиртных напитков, крепких бульонов, рыбной и мясной подливы, крепкого черного чая, кофе, шоколада, пряностей.
Пациента, у которого понижена выработка тиреоидного гормона, необходимо ограничить количество легкоусваиваемого сахара, а именно сдобных продуктов, белого хлеба, рисовой каши, варенья, меда, манной каши, тортов. Рацион исключает сливки, маргарин, жирный творог, сметану, рыбную икру, рыбу жирных сортов, сала. Пациентам рекомендовано употребление продуктов, которые имеют послабляющий эффект (кефир, овощи, растительное масло, фрукты). При правильном подборе диеты, можно снизить интенсивность симптомов заболевания и улучшить состояние больного.

Эта статья была написана, чтобы помочь Вам больше узнать о дискоидной красной волчанке. Она расскажет Вам, что это такое, что ее вызывает, какие процедуры доступны, и где Вы можете узнать больше об этом.
Что такое дискоидная красная волчанка?
Что вызывает дискоидную красную волчанку?
Причина дискоидной красной волчанки до конца не изучена, но считается аутоиммунным заболеванием. У всех нас есть иммунная система, которая вырабатывает антитела, необходимые для борьбы с инфекциями.
Факторы, которые могут увеличить риск дискоидной красной волчанки или усугубить ее течение, включают стресс, инфекцию и травму. Некоторые лекарства также считаются пусковым механизмом. Состояние не является заразным и не связано с пищевой аллергией. Дискоидная красная волчанка редко поражает детей; хотя это заболевание в равной степени может развиваться у мужчин и женщин, есть доказательства того, что женщины в возрасте от 20 до 40 лет более склонны к этому состоянию.
Является ли дискоидная красная волчанка наследственной?
В некоторых семьях может быть генетическая предрасположенность, повышающая риск развития дискоидной красной волчанки. Однако не совсем ясно, как это передается или в какой степени влияет на болезнь. Считается, что сочетание факторов окружающей среды и генетики, скорее всего, способствует развитию дискоидной красной волчанки.
Каковы симптомы дискоидной красной волчанки?
Иногда пятна могут вызывать некоторый дискомфорт и зуд. Когда высыпания лопаются, они могут образовывать рубцы и постоянные изменения цвета вовлеченной кожи. У большинства пациентов нет никакого влияния на общее состояние здоровья.
Как выглядит дискоидная красная волчанка?
Дискоидная красная волчанка обычно поражает лицо и волосистые участки кожи головы, но иногда может распространяться на другие участки тела, включая руки, ноги и туловище.
Сыпь состоит из красных чешуйчатых (шелушащихся) пятен, которые, как правило, в конечном итоге очищаются, что приводит к истончению, рубцеванию или изменению цвета кожи. Уплотнение иногда может быть довольно толстым и напоминать бородавку. При распространении на кожу головы волосы в пораженной области могут быть потеряны навсегда.
Как можно диагностировать дискоидную красную волчанку?
Врач общей практики или дерматолог сможет поставить диагноз по внешнему виду Вашей кожи, однако иногда могут потребоваться исследования, и Ваш доктор может затем обратиться к дерматологу для постоянного наблюдения. Иногда исследование включает биопсию кожи (удаление небольшого образца кожи для анализа под микроскопом), анализы крови и мочи.
Можно ли вылечить дискоидную красную волчанку?
Нет. Как и многие аутоиммунные состояния, дискоидная красная волчанка обычно является пожизненным состоянием. Тем не менее, есть доступные процедуры, которые эффективны и могут помочь поддерживать состояние под контролем.
Самостоятельный уход
Если Вы курите
Мы настоятельно рекомендуем прекратить. Курение может ухудшить это состояние и привести к негативной реакции на лечение.
Защита от солнца
Это должно стать частью Вашей повседневной жизни: защитите свою кожу одеждой и не забывайте носить шляпу, которая защищает Ваше лицо, шею и уши, а также солнцезащитные очки от ультрафиолетового излучения.
Рекомендуется ежедневный солнцезащитный крем
При выборе солнцезащитного крема посмотрите на SPF (SPF 30 и более) для защиты от UVB и UVA. Нанесите достаточное количество солнцезащитного крема за 15-30 минут до выхода на солнце и повторно наносите его каждые два часа и сразу после купания или вытирания полотенцем.
Одежда может быть очень эффективным солнцезащитным средством
Особенно для Ваших плеч и рук. Однако если Ваша рубашка или блузка прозрачна, солнечный свет может проникнуть в Вашу кожу. Лучше всего использовать белую, плотную, но свободно облегающую одежду.
Постоянная нехватка солнечного света может снизить уровень витамина D, поэтому, возможно, стоит принимать добавки витамина D, доступные в аптеках и супермаркетах.
Как можно лечить красную волчанку?
Существует два основных вида лечения:
1) Местные
2) Лечение, действующее на весь организм (таблетки и инъекции)
- Антималярийные таблетки , содержащие гидроксихлорохин и мепакрин. Эти лекарства были первоначально созданы для лечения малярии, но было также обнаружено сильное влияние на воспаление, и поэтому они помогают контролировать дискоидную красную волчанку. Эти таблетки обычно безопасны в обозначенной дозировке. Вам понадобится проверить состояние зрения перед началом лечения и через 5 лет, если Вы все еще будете лечиться. Пожалуйста, сообщите своему врачу, если у Вас возникнут какие-либо проблемы с глазами при приеме лекарств.
- Стероидные таблетки . Курс таблеток может принести пользу пациентам с тяжелой, обширной или дискоидной красной волчанкой.
- Лекарства, изменяющие иммунную систему . Когда нет реакции на стандартную терапию, могут использоваться иные лекарства; например, метотрексат или мофетила микофенолат. Существуют риски, связанные с этими видами лечения, поэтому они применяются для отдельных серьезных случаев и требуют дополнительного мониторинга.
Рекомендации по витамину D
Свидетельства, касающиеся влияния уровня сыворотки витамина D, воздействия солнечного света и потребления витамина D на здоровье, остаются неубедительными. Избегая воздействия солнечного света, если Вы страдаете от легкой восприимчивости или сокращаете риск возникновения меланомы и других раков кожи, Вы можете испытать дефицит витамина D.
Лица, полностью избегающие воздействия солнца, должны рассмотреть возможность измерения уровня витамина D. Если уровень уменьшен или недостаточен, они, возможно, пожелают рассмотреть возможность приема дополнительного витамина D3, 10-25 микрограммов в день и увеличения потребления продуктов с высоким содержанием витамина D, таких как жирная рыба, яйца, мясо, обогащенные маргарины и злаки. Добавки витамина D3 широкодоступны в магазинах здорового питания.
Будьте здоровы и привлекательны!
Обращайтесь только к профессионалам.
Используйте при изучении информации о вашей проблеме только данные доказательной медицины, такие, как приведены в этой статье.
Системная красная волчанка (СКВ) – аутоиммунное заболевание, этиология которого остается неизвестной. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-
Systemic lupus erythematosus: alertness in the practice of a dermatologist / M. M. Tlish, Zh. Yu. Naatyzh1, T. G. Kuznetsova, E. A. Chernenko /State Budgetary educational institution of higher professional education Kuban State Medical University of the Ministry of Healthcare of the Russian Federation, Krasnodar, Russia
Abstract. Systemic lupus erythematosus (SLE) is an autoimmune disease, the etiology of which remains unknown. Skin syndrome in SLE is often of paramount diagnostic value – skin lesion is the earliest symptom in 20-30% of cases, and in 60-70% it manifests itself at various stages of the course of the disease, which leads to the patient's primary referral to a dermatologist. Frequent diagnostic errors are due to the absence of clinical symptoms of systemic lesions in the presence of cutaneous manifestations of lupus erythematosus (LE). In this case, laboratory tests are an integral part of the algorithm for managing patients with LE at the stage of contacting a dermatologist. The most specific laboratory test is the determination of antinuclear antibodies by an indirect immunofluorescence reaction, referred to as antinuclear factor (ANF). An elevated ANF titer is included in the list of diagnostic criteria for SLE, its detection allows one to suggest a diagnosis of SLE and determine a further algorithm for the provision of medical care. The article presents two clinical cases illustrating that against the background of an isolated skin lesion and the absence of visible somatic pathology, abnormalities in immunological tests were identified. This made it possible to suspect the systemic course of the process at an early stage and refer patients to a rheumatologist's consultation, where the diagnosis of SLE was confirmed. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Chernenko E. A. Systemic lupus erythematosus: alertness in the practice of a dermatologist // Lechaschy Vrach. 2020; vol. 23 (11): 23-26. DOI: 110.26295/OS.2020.35.78.005
Согласно современным представлениям, системная красная волчанка (СКВ) – аутоиммунное заболевание неустановленной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител с развитием иммуновоспалительного повреждения тканей внутренних органов [1]. Широкий ряд вырабатываемых аутоантител и их прямое или опосредованное воздействие на клеточные мишени обуславливают многообразие клинических проявлений при красной волчанке (КВ) [2]. СКВ может проявляться изолированным или сочетанным поражением систем и органов, включающим поражение кожи и слизистых оболочек (волчаночная бабочка, дискоидная эритема, фотосенсибилизация, алопеция, телеангиэктазии, сетчатое ливедо, язвы в полости рта), сердечно-сосудистой системы (перикардит, миокардит, эндокардит, коронарит), почек (волчаночный нефрит), центральной нервной системы (судороги, психоз), опорно-двигательного аппарата (артралгии, артриты), легких (плеврит, волчаночный пневмонит), гематологическими нарушениями (гемолитическая анемия, лейкопения, тромбоцитопения) и т. д. [3].
Ключевую роль в диагностике СКВ играет обнаружение клинических проявлений заболевания и данные лабораторной диагностики [3]. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-70% проявляется на различных этапах течения болезни, что приводит к первичному обращению больного именно к дерматологу [4]. Поражения кожи при СКВ полиморфны и представлены различными изменениями – от незначительных телеангиэктазий до буллезных поражений [2]. Выделяют волчаночно-специфичные и волчаночно-неспецифичные поражения кожи, последние встречаются в несколько раз чаще. К волчаночно-специ-фичным относят различные проявления хронической, подострой и острой КВ [5]. Группа неспецифических поражений включает: фотосенсибилизацию, лейкоцитокластический и уртикарный васкулит, телеангиэктазии, сетчатое ливедо, злокачественный атрофический папулез и синдром Рейно [5]. Широкая вариабельность клинических проявлений кожного синдрома обуславливает необходимость проведения тщательного дифференциального диагноза [1].
Важным инструментом ранней диагностики системных заболеваний является обнаружение аутоантител с помощью лабораторных тестов [3]. Наиболее специ-фичными для СКВ являются антинуклеарные антитела (АНА) – это гетерогенная группа аутоантител к компонентам клеточного ядра, среди которых выделяют антитела к двуспиральной дезоксирибонуклеиновой кислоте (ДНК), гистонам, нуклеосомам, экстрагируемым ядерным антигенам, ядрышковым антигенам и другим клеточным структурам [6]. Стандартным методом обнаружения группы АНА является непрямая реакция иммунофлюоресценции (НРИФ) с использованием линии эпителиальных клеток аденокарциномы гортани человека (HЕp-2) [7]. Определение АНА методом НРИФ принято обозначать как антинуклеарный фактор (АНФ), содержание которого оценивается по максимальному выявленному титру в сыворотке крови, с указанием интенсивности и типа флюоресценции [8]. Количественное увеличение титра свыше 1:160 входит в перечень диагностических критериев СКВ согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) и Европейской лиги борьбы с ревматизмом (European League Against Rheumatism, ULAR) и используется для оценки активности процесса, прогноза, так как является предиктором развития СКВ на доклинической стадии [8].
Длительное формирование патогномоничного клинического симптомокомплекса СКВ, отсутствие проведения необходимых лабораторных исследований и междисциплинарного взаимодействия являются причиной частых диагностических ошибок, приводящих к отсутствию своевременной противовоспалительной и иммуносупрессивной терапии у врача-ревматолога. Учитывая вышесказанное, считаем целесообразным привести собственные клинические наблюдения.
Клиническое наблюдение № 1
Данные со стороны других органов и систем: предъявляет жалобы на ноющие боли в мелких суставах кистей и коленных суставах, чувство утренней скованности. Соматически не обследована.
Объективно: кожный патологический процесс носит ограниченный симметричный характер, локализуется на коже крыльев носа, щек, подбородка. Представлен: эритематозные пятна, чешуйки, телеангиэктазии.
На коже лица (в области крыльев носа, щек, подбородка) расположены ярко-розовые эритематозные очаги, с четкими границами, слегка инфильтрированные, правильной округлой формы, диаметром 3-4 см, покрытые небольшим шелушением в центре очагов; в периферической зоне очагов визуализируются телеангиэктазии (рис. 1). Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского).
.jpg)
Определена биодоза 20 секунд.
Результаты гистоморфологического исследования кожи из патологического очага на правой щеке: фолликулярный гиперкератоз; эпидермис с тенденцией к атрофии; вакуольная дистрофия клеток базального слоя. Под эпидермисом сосуды расширены. Во всех отделах дермы – густые диффузные и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и плазмоцитов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина может соответствовать красной волчанке.
Данные общеклинических исследований: общий и биохимический анализ крови – показатели в пределах нормы; общий анализ мочи – показатели в пределах нормы.
Настораживающими факторами в плане трансформации кожной формы в системный процесс у пациентки М. явились: дебют заболевания в молодом возрасте, длительная инсоляция в анамнезе, II фототип кожи, биодоза 20 секунд, наличие выраженного суставного синдрома.
Для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 1:320 титр (норма менее 160); мелкогранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 53 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) – 10,13 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 12,68 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
С полученными данными больная направлена к ревматологу в Краевую клиническую больницу № 2, где был подтвержден диагноз СКВ. Больная взята на диспансерный учет ревматологом для определения дальнейшей тактики ведения и лечения.
Клиническое наблюдение № 2
Объективно: кожный патологический процесс носит распространенный характер, локализован на коже лица, шеи. Представлен: пятна, телеангиэктазии, чешуйки.
На коже лица в области щек, левой околоушной области и шеи расположены отечные эритематозные очаги розовато-красного цвета, диаметром 2–3 см, преимущественно правильно-округлой формы с небольшим шелушением, визуализируются единичные телеангиэктазии. Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского) (рис. 2).
.jpg)
Результаты гистоморфологического исследования кожи из патологического очага: на коже левой щеки – фолликулярный гиперкератоз; участки паракератоза; эпидермис местами атрофичен; вакуольная дистрофия клеток базального слоя эпидермиса; подэпидермальные пузыри. В сосочковом слое – отек, стенки сосудов утолщены. В дерме – густые очаговые и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина больше соответствует красной волчанке.
Данные общеклинических исследований: в общем и биохимическом анализах крови выявлены следующие отклонения – лейкоциты 3,7 × 10 9 /л; холестерин 8,7 ммоль/л.
Учитывая длительность течения кожного патологического процесса, отсутствие результатов обследования смежных специалистов, для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 12 560 титр (норма менее 160); крупногранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 0,5 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) 16,65 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 14,68 МЕ/мл (референсные значения до 10 МЕ/мл – не обнаружено).
Таким образом, иммунологические исследования и их комплексный анализ являются неотъемлемой составляющей алгоритма ведения больных с КВ уже на этапе обращения к врачу-дерматологу и способствуют высокому качеству оказания медицинской помощи данному контингенту больных.
Литература/References
М. М. Тлиш, доктор медицинских наук, профессор
Ж. Ю. Наатыж 1 , кандидат медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
Е. А. Черненко
ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
Системная красная волчанка: настороженность в практике дерматолога/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Е. А. Черненко
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Черненко Е. А. Системная красная волчанка: настороженность в практике дерматолога // Лечащий Врач. 2020; т. 23 (11), 23-26. DOI: 110.26295/OS.2020.35.78.005
Теги: аутоиммунное заболевание, кожный синдром, алгоритм лечения

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
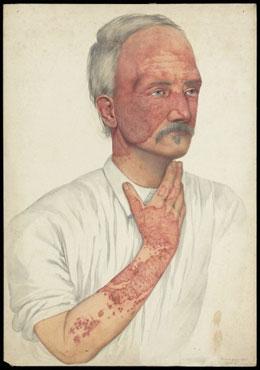
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Читайте также:

