Рекуррентные респираторные инфекции что это
Обновлено: 18.04.2024
В статье представлен анализ результатов исследований по изучению безопасности, переносимости и клинико-иммунологической эффективности препарата пидотимод (Имунорикс ® ) у детей с острыми и рекуррентными респираторными инфекциями. Отмечено достоверное снижение заболеваемости респираторными инфекциями у детей на фоне приема препарата. Представлены патогенетическое обоснование использования пидотимода для лечения и профилактики острых и рекуррентных респираторных инфекций, его механизмы действия. Лечебно-профилактическая эффективность препарата обусловлена его иммуномодулирующим влиянием на ключевые звенья врожденного и адаптивного иммунитета. Пидотимод оказывает позитивное воздействие на созревание антигенпредставляющих клеток, Т- и В-лимфоцитов, а также обладает модулирующим влиянием на синтез цитокинов как про-, так и противовоспалительной направленности. При этом изменение профиля продуцируемых цитокинов позволяет нормализовать Тh1/Тh2, переключив вектор дифференцировки Тh0 в направлении Тh1, что способствует снижению выраженности аллергического воспаления. С учетом этого намечены перспективы применения препарата Имунорикс ® у детей с аллергическими заболеваниями органов дыхания.
Ключевые слова: бронхиальная астма, острые респираторные инфекции, рекуррентные респираторные инфекции, внебольничная пневмония, иммунитет, иммунопрофилактика, пидотимод, Имунорикс.
Для цитирования: Заплатников А.Л., Гирина А.А., Леписева И.В. и др. Пидотимод: неспецифическая иммунопрофилактика острых и рекуррентных респираторных инфекций и новые аспекты клинического применения у детей. РМЖ. Медицинское обозрение. 2019;3(3):51-56.
A.L. Zaplatnikov 1,2 , A.A. Garina 3 , I.V. Lepiseva 4 , V.I. Svinitskaya 1 , N.F. Dubovets 2 , Yu.I. Ivakhnenko 1,2
1 Russian Medical Academy of Continuous Professional Education, Moscow
2 Bashlyaeva Children’s City Clinical Hospital, Moscow
3 Khanty-Mansiysk State Medical Academy
4 Children’s Republican Hospital, Petrozavodsk
The article presents an outcome analysis of safety studies, tolerability profile and clinical and immunological efficacy of pidotimod (Imunorix ® ) in children with acute and recurrent respiratory infections. A significant reduction in respiratory infections incidence in children was determined during the drug intake. The article shows the pathogenetic substantiation of pidotimod for acute and recurrent respiratory infections treatment and prevention, and its mechanisms of action. Drug therapeutic and prophylactic efficacy is due to its immunomodulatory effect on the innate and adaptive immunity key elements. Pidotimod has a positive effect on the maturation of antigen-presenting cells and T- and b-lymphocytes. It also has a modulating impact on the cytokines synthesis with both pro- and anti-inflammatory effect. At the same time, the change in the produced cytokines profile allows normalizing Th1/Th2 by switching the TH0 differentiation vector to the Th1 way. That helps to reduce allergic inflammation severity. Considering this, the Imunorix ® drug intake in children with allergic diseases of the respiratory system has future prospects.
Keywords: bronchial asthma, acute respiratory infections, recurrent respiratory infections, community-acquired pneumonia, immunity, immunoprophylaxis, pidotimod, Imunorix.
For citation: Zaplatnikov A.L., Garina A.A., Lepiseva I.V. et al. Pidotimod: nonspecific immunoprophylaxis of acute and recurrent respiratory infections and new aspects of clinical use in children. RMJ. Medical Review. 2019;3:55–60.
В статье представлен анализ результатов исследований по изучению безопасности, переносимости и клинико-иммунологической эффективности препарата пидотимод у детей с острыми и рекуррентными респираторными инфекциями.
Введение
![Рис. 1. Заболеваемость острыми инфекциями верхних дыхательных путей в Российской Федерации за период 2014–2018 гг. [1]](https://www.rmj.ru/upload/medialibrary/c00/55-1.jpg)
Острые респираторные инфекции (ОРИ) являются наиболее частыми инфекционными заболеваниями в Российской Федерации [1]. При этом эффективная профилактика и лечение острых и рекуррентных инфекций органов дыхания у детей относятся к числу актуальнейших проблем современного отечественного здравоохранения. Острота проблемы определяется широкой распространенностью данной патологии у детей, уровень заболеваемости у которых в 4 раза превышает ее уровень у взрослых (рис. 1), неблагоприятным влиянием на состояние здоровья и социализацию детей, а также существенными экономическими потерями [2]. Все это, а также значительное количество часто болеющих детей и отсутствие даже в перспективе вакцин против подавляющего большинства респираторных возбудителей определяют неподдельный интерес к методам неспецифической иммунопрофилактики [3–9]. При этом следует отметить, что в настоящее время в отечественной педиатрической практике имеется достаточно широкий выбор безопасных и эффективных лекарственных средств, используемых для неспецифической иммунопрофилактики и иммунотерапии острых и рекуррентных респираторных инфекций [6]. Особое место среди них занимает пидотимод (Имунорикс ® ).
Иммунопрофилактика и иммунотерапия
Пидотимод (Имунорикс ® ) — высокоэффективный и безопасный иммуномодулятор пептидной структуры [10, 11]. Благодаря хорошей биодоступности препарата уже через 1,5 ч после перорального приема его уровень в сыворотке крови превышает концентрацию, достигнутую при внутривенном введении [12]. Результаты многочисленных исследований, а также накопленный 30-летний практический опыт свидетельствуют о позитивном влиянии препарата на различные звенья иммунитета, действенной клинико-иммунологической эффективности, высоком профиле безопасности и хорошей переносимости. В настоящей публикации представлен анализ данных литературы и обобщены сведения об основных иммунологических и клинических эффектах Имунорикса у детей. Иммунологические показатели, которые изучались при использовании препарата, представлены в таблице 1.
Фармакодинамика пидотимода определяется его иммуномодулирующим влиянием на антигенпрезентирующие клетки, а также на ключевые звенья врожденного и приобретенного иммунитета (табл. 2). Установлено, что применение препарата сопровождается повышением функциональной активности нейтрофилов, циркулирующих моноцитов, натуральных киллеров, макрофагов, дендритных клеток, а также Т- и В-лимфоцитов [17–21, 30–38]. Особое внимание следует обратить на тот факт, что указанные эффекты сопровождаются регулирующим влиянием на процессы синтеза и продукции цитокинов как про-, так и противовоспалительной направленности. Это позволяет сделать вывод об иммуномодулирующем эффекте препарата. Установлено, что применение пидотимода характеризуется повышением продукции таких провоспалительных цитокинов, как моноцитарный хемоаттрактантный протеин 1 (MCP-1), хемокиновый лиганд 1 (CХCL1), хемокиновый лиганд 2 (CХCL2), хемокиновый лиганд 3 (CCL3), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), интерлейкин-12 (IL-12), интерлейкин-18 (IL-18), интерферон (INF), фактор некроза опухоли альфа (TNF-α) и др. Под действием указанных цитокинов повышается функциональная активность нейтрофилов, циркулирующих моноцитов, натуральных киллеров и макрофагов. Стимуляция нейтрофилов при этом сопровождается активацией их спонтанной миграции и хемотаксиса, усилением экспрессии рецепторов адгезии, повышением результативности внутриклеточного киллинга и др. Особо следует подчеркнуть, что одновременно отмечено повышение продукции антимикробных протеинов (липокалин 2 (LCN2), лактоферрин (LTF)), а также миелопероксидазы. Все это приводит к усилению фагоцитоза и эффективной бактерицидной активности. Указанные эффекты сопровождаются также возрастанием цитотоксичности и миграционной способности натуральных киллеров. Суммируя описанные результаты, можно сделать вывод о том, что пидотимод существенно потенцирует механизмы врожденного иммунитета, обеспечивающего первую линию иммунной защиты организма от инфекционных агентов.
Механизмы действия пидотимода
Результаты клинических исследований
Высокая иммунологическая эффективность пидотимода (Имунорикс ® ) определяет его положительную клиническую результативность как при профилактическом применении, так и при лечении ОРИ, особенно у часто болеющих детей [22–33]. Так, D. Passali et al. (1994) при исследовании 415 часто болеющих детей в возрасте 3–14 лет показали, что использование препарата позволило значительно снизить заболеваемость ОРИ [24]. Установлено, что ежедневный прием пидотимода (Имунорикс ® ) в суточной дозе 400 мг на протяжении 2 мес. сопровождался достоверным сокращением частоты ОРИ по сравнению с таковым в группе плацебо. При этом заболеваемость ОРИ у детей основной группы в период приема препарата была на 33,1% ниже, чем в контрольной группе (р <0,01). Отмечено также, что на протяжении последующих 3 мес. после отмены препарата частота ОРИ в основной группе оставалась значительно — на 53,2% — ниже по сравнению с таковой в группе плацебо (р<0,01). Особо подчеркивается хорошая переносимость пидотимода (Имунорикс ® ). Авторы отмечают также экономический эффект применения препарата [24].
Результаты мультицентрового плацебо-контролируемого исследования клинической эффективности пидотимода (Имунорикс ® ) у 101 часто болеющего ребенка показали, что 2-месячный курс терапии препаратом в дозе 400 мг/сут существенно уменьшил частоту ОРИ [25]. При этом было отмечено снижение количества инфекционных поражений как верхних, так и нижних дыхательных путей. Установлено, что дети, получавшие пидотимод (Имунорикс ® ), значительно реже использовали антибактериальные и жаропонижающие препараты на протяжении всего периода наблюдения. Так, в 1-й мес. терапии антибиотики были назначены 20% детей основной группы и 43% — контрольной, во 2-й мес. лечения соответственно 10% и 45% пациентов. Аналогичная закономерность сохранялась и на протяжении последующих 2 мес. наблюдения после отмены препарата. Анализ частоты использования антипиретиков в этот период также показал позитивное влияние препарата — в группе детей, получавших пидотимод (Имунорикс ® ), жаропонижающие препараты применялись значительно реже [25].
Аналогичные результаты были получены при проведении рандомизированного мультицентрового двойного слепого плацебо-контролируемого исследования по изучению эффективности пидотимода (Имунорикс ® ) у 748 часто болеющих детей и подростков в возрасте 3–16 лет [26]. Препарат или плацебо применяли ежедневно на протяжении 2 мес. с последующим наблюдением в течение 3 мес. Пидотимод назначали в суточной дозе 400 мг. В 94,3% случаев отмечена хорошая или отличная переносимость и безопасность препарата. Установлена высокая профилактическая эффективность пидотимода (Имунорикс ® ). Так, более чем у 50% детей основной группы за время использования препарата не было случаев развития ОРИ (р <0,01). Отмечено, что профилактический эффект пидотимода (Имунорикс ® ) сохраняется и после окончания терапии. При этом подавляющее большинство детей основной группы (71%) не болели ОРИ на протяжении последующих 3 мес. после отмены препарата, в то время как в группе контроля здоровыми оставались 41% детей (р<0,01). Кроме этого, установлено, что в период использования пидотимода (Имунорикс ® ) и на протяжении последующих 3 мес. достоверно снижалась частота применения антибиотиков и жаропонижающих лекарственных средств [26].
Целесообразно остановиться также на результатах исследований, посвященных изучению терапевтического эффекта пидотимода (Имунорикс ® ) при лечении острых инфекций органов дыхания у детей [29–31, 39–43]. Если применение пидотимода (Имунорикс®) при острых тонзиллитах/фарингитах и других инфекциях верхних дыхательных путей стало рутинным, то использование препарата при внебольничных пневмониях различной этиологии вызывает вполне объяснимый интерес [29–31, 39–43].
Результаты исследования, проведенного Ф.С. Харламовой и соавт. (2009), свидетельствуют о том, что назначение пидотимода (Имунорикс ® ) детям с ОРИ позволяло существенно повысить эффективность лечения. При этом отмечалось более быстрое купирование лихорадки, интоксикации, явлений крупа, что сопровождалось снижением риска патологической колонизации слизистых верхних дыхательных путей. Кроме этого, авторами установлено, что у детей, получавших пидотимод (Имунорикс ® ), в дальнейшем ОРИ развивались значительно реже [29]. В целом следует отметить, что анализ результатов серии клинических и клинико-иммунологических исследований по изучению эффективности препарата, применяющегося для лечения и профилактики острых и рекуррентных респираторных инфекций у детей, позволяет сделать вывод о его высокой результативности, безопасности и хорошей переносимости [11, 12, 17–40]. Именно это и определяет традиционные показания для использования препарата — профилактика и лечение острых и рекуррентных респираторных инфекций [10]. Однако полученные в последнее десятилетие новые и очень интересные данные о механизме действия препарата позволяют заново оценить потенциальные возможности применения пидотимода (Имунорикс ® ) в педиатрической практике [9, 53].
Оказалось, что пидотимод способствует созреванию дендритных клеток, усилению экспрессии антигенов главного комплекса гистосовместимости (HLA), активации Т- и В-лимфоцитов и др. Особо следует отметить, что при использовании препарата возрастает экспрессия СD80, СD83, СD86, HLA-DRII, а также TLR2 и TLR4 на макрофагах и дендритных клетках [35, 37, 42, 43]. Интересно, что одновременно с созреванием и активацией макрофагов и дендритных клеток был отмечен эффект модуляции процессов продукции цитокинов. Благодаря этому координируется взаимодействие различных звеньев иммунитета. Все это свидетельствует о том, что под действием препарата создаются условия для полноценного функционирования антигенпрезентирующих клеток, что позволяет адекватно и своевременно инициировать запуск механизмов приобретенного иммунитета.
Особый интерес представляют результаты исследований, в которых изучалось влияние пидотимода на клетки адаптивного иммунитета [26, 38–40, 45]. Установлено, что под действием препарата происходит активация Т- и В-лимфоцитов. Кроме этого, было отмечено, что благодаря позитивному влиянию пидотимода нормализуется соотношение продуцируемых цитокинов (IL-4, IL-12, INF-γ), регулирующих направление дифференцировки Тh0. Установлено, что применение препарата сопровождается повышением продукции IL-12, который, в свою очередь, стимулирует усиление продукции INF-γ. За счет этого происходит поляризация вектора дифференцировки наивных лимфоцитов в сторону Тh1, переключение профиля синтезируемых иммуноглобулинов. В результате на фоне использования пидотимода (Имунорикс ® ) было отмечено снижение концентрации общего IgE.
Выявленные иммунологические эффекты удалось установить в серии экспериментальных и клинических исследований. Так, С.С. Григорян и А.М. Иванова (2011) при обработке препаратом образцов крови часто болеющих детей зафиксировали 4-кратное повышение уровня интерферона. В то же время в группе детей с исходно нормальными уровнями интерферона концентрация изучаемого иммунологического показателя при использовании препарата не изменялась. Было также установлено, что под действием пидотимода повышались уровни IL-10, IL-18 при одновременном снижении уровня IL-4. На основании полученных данных авторы делают вывод о том, что препарат преимущественно активирует Th1-иммунный ответ [36].
Л.С. Намазова-Баранова и соавт. (2010) в ходе многоцентрового рандомизированного контролируемого исследования по изучению клинико-иммунологической эффективности пидотимода (Имунорикс ® ) у детей с рекуррентными респираторными инфекциями установили, что уровень IgE на фоне терапии снизился у 54% пациентов, причем у 26% данный показатель уменьшился более чем в 1,5–2 раза, в то время как в группе контроля изменений концентрации IgE отмечено не было [30]. Высказывается предположение о том, что, вероятно, снижение уровня IgE было обусловлено переключением иммунного ответа на Th1 благодаря влиянию пидотимода (Имунорикс ® ) на процессы дифференцировки наивных Th. Авторы подчеркивают, что наряду с отмеченным позитивным иммунологическим результатом был показан и положительный клинический эффект препарата — снижение частоты ОРИ и рецидивов хронических воспалительных заболеваний органов дыхания, а также уменьшение показаний для назначения антибиотиков [30].
Особое внимание следует уделить анализу результатов исследований, которые посвящены изучению терапевтической и иммунологической эффективности препарата при бронхиальной астме (БА) [45–51]. Так, D. Gourgiotis et al. (2004) провели исследование, целью которого являлось уточнение иммунологических эффектов пидотимода у пациентов с атопической БА. Было показано, что препарат в этих ситуациях проявляет иммуномодулирующее действие, благодаря чему у детей с БА уменьшается экспрессия СD30 на циркулирующих мононуклеарах. Авторы делают вывод о том, что применение пидотимода у пациентов с атопической БА сопровождается нормализацией процессов активации Т- и В-лимфоцитов [45]. Результаты исследования, проведенного Х. Ma et al. (2011), позволили сделать вывод о том, что применение пидотимода у детей с БА сопровождается повышением уровня INF-γ с одновременным снижением уровня IgE [50]. В.Н. Чернышов и соавт. (2010), F. Zhai et al. (2011), И.М. Гайдук и соавт. (2012), Y. Wu et al. (2013) также отмечают положительный эффект при использовании препарата у детей с БА [46–51]. Представленные данные свидетельствуют о позитивном влиянии пидотимода на некоторые звенья патогенеза атопической БА, что позволяет наметить новые, перспективные направления его использования в педиатрической практике [9, 52].
Таким образом, анализ литературы свидетельствует о безопасности, хорошей переносимости и высокой клинической эффективности пидотимода (Имунорикс ® ) при лечении и профилактике острых и рекуррентных респираторных инфекций у детей. При этом следует особо подчеркнуть, что терапевтическая результативность препарата объясняется его иммуномодулирующими эффектами, механизм действия которых становится все более понятным с учетом последних научных достижений. Принимая во внимание положительное влияние пидотимода (Имунорикс ® ) на антигенпрезентирующие клетки, а также на ключевые звенья врожденного и адаптивного иммунитета, следует подчеркнуть, что перспективным направлением является использование препарата у детей с БА, особенно в тех случаях, когда триггерами обострения являются ОРИ. Следует признать это направление весьма перспективным, что определяет необходимость дальнейшего изучения всех аспектов клинического применения пидотимода (Имунорикс ® ) у данной категории пациентов.
Показано положительное влияние терапии препаратом на основе генно-инженерного интерферона альфа-2b в комплексе с антиоксидантами на сроки купирования клинических симптомов острых респираторых заболеваний, а также на показатели интерферонового статуса у ча
Children with recurrent infections of respiratory tract: modified interferonotherapy of acute respiratory infections
Positive effect of the therapy with the medication was stated, based on genetically engineered interferon Alpha-2B combined with antioxidants in the period of rapid relief of the acute respiratory diseases clinical symptoms, as well as at the interferon status indicator with ailing children.
Высокий уровень заболеваемости и летальности от инфекционных заболеваний у детей представляет актуальную проблему, несмотря на достижения фундаментальной медицины и успешное внедрение в медицинскую практику инновационных технологий для улучшения качества их диагностики и лечения. При этом в общей структуре инфекционной заболеваемости у детей по-прежнему доминируют острые респираторные вирусные инфекции (ОРВИ), показатели заболеваемости которыми ежегодно остаются высокими и не имеют тенденции к снижению [1, 2]. Так, по данным Федеральной службы Роспотребнадзора в 2010 году из 28 238 271 случая острой респираторной инфекции в целом по стране более 20 млн (20 341 990) регистрировалось у детей, при этом показатель заболеваемости ОРВИ составил 77 545,9 на 100 тысяч детского населения в год, что более чем в 3,5 раза выше аналогичного показателя во взрослой популяции.
В силу имеющихся анатомо-физиологических особенностей организм ребенка не обладает достаточным уровнем резистентности к возбудителям инфекционных заболеваний [3]. Характерными возрастными отличиями иммунитета ребенка являются: относительная незрелость макрофагально-фагоцитарного звена и склонность к незавершенному фагоцитозу, сниженная продукция интерлейкинов и интерферонов, низкая цитотоксическая активность лимфоцитов и естественных киллеров. Помимо этого, у детей раннего возраста ослаблены процессы активации системы комплемента, синтез антител имеет отсроченный характер, имеет место сниженная концентрация IgA. Все перечисленные факторы обуславливают склонность детей к частым респираторным заболеваниям, их более тяжелому течению и развитию осложнений.
Тенденцией сегодняшнего дня является превалирование в общей детской популяции детей с различными нарушениями в состоянии здоровья. По мнению ведущих специалистов, только 10–15% детей, рожденных здоровыми, сохраняют такое состояние здоровья на момент поступления в дошкольные учреждения и школы, а в дальнейшем этот процент еще более снижается [5]. Дети с хронической соматической патологией, различными аллергическими заболеваниями, включая бронхиальную астму, имеющие очаги хронической инфекции, иммунодефицитные состояния, а также часто и длительно болеющие имеют потенциально высокий риск инфицирования респираторными вирусами. Респираторные инфекции у этих детей в ряде случаев сопровождаются развитием осложнений, усугубляющих течение основных заболеваний.
Другим немаловажным аспектом проблемы ЧБД является риск неадекватной, а зачастую шаблонной трактовки данного состояния, когда под маской ЧБД в течение длительного времени может не диагностироваться более серьезная, в том числе хроническая патология (пороки развития бронхолегочной системы, муковисцидоз, бронхиальная астма и др.). Поэтому в каждом случае для уточнения причин высокой восприимчивости к респираторным инфекциям требуется проведение серьезного и углубленного обследования детей этой диспансерной группы с обязательным уточнением семейного анамнеза, особенностей течения каждого эпизода ранее перенесенной ОРВИ.
Иммунологические отклонения у ЧБД тесно связаны с возрастными особенностями созревания и становления иммунной системы ребенка. Изменения в иммунном статусе, по данным разных авторов, имеют от 15% до 39% ЧБД [8, 9]. При этом результаты исследований последних лет демонстрируют наличие у ЧБД даже в период клинического благополучия и при отсутствии признаков ОРВИ отчетливых изменений межклеточного взаимодействия компонентов иммунной системы [10]. Повышение восприимчивости ЧБД к респираторным инфекциям обусловлено особенностями иммунного ответа: его смещение в сторону Th2-типа на фоне угнетения местного иммунитета слизистых оболочек дыхательных путей, о чем свидетельствует снижение уровня IgA в слюне. Установлено, что у ЧБД спонтанная гиперпродукция провоспалительных интерлейкинов (IL-2, IL-4), в том числе интерлейкинов, участвующих в хронизации воспаления (IL-6 и IL-8), сопровождается повышением их концентраций в сыворотке крови, дисиммуноглобулинемией, снижением клеточной цитотоксичности (уменьшением числа активированных CD8DR+ клеток), а также увеличением количества клеток, экспрессирующих индуцирующие апоптоз рецепторы [11]. Кроме того, у ЧБД выявляются нарушения в системе интерферонов (ИФН). Доказано, что у 80% ЧБД вдвое снижена способность иммунокомпетентных клеток к синтезу гамма-интерферона в сравнении с редко болеющими детьми. Установлено, что даже при адекватном содержании сывороточного ИФН в этой группе детей наблюдается снижение индуцированной продукции альфа- и гамма-интерферонов, что отражает недостаточность резервных возможностей интерфероногенеза [12].
Таким образом, иммунная система ЧБД, не имеющая грубых врожденных и приобретенных дефектов, характеризуется крайней напряженностью процессов иммунологического реагирования, нарушением межклеточных взаимодействий и истощением компенсаторных возможностей на фоне частого и массивного антигенного воздействия на детский организм.
В настоящее время дети II группы здоровья составляют 35–75% детской популяции в зависимости от региона проживания, поэтому решение вопроса о повышении эффективности терапии самой распространенной инфекционной патологии является своевременным и актуальным. Принимая во внимание, что система интерферона — важнейшее звено врожденного иммунитета, использование интерферона и его индукторов при лечении детей с ОРВИ является одним из наиболее перспективных направлений [13, 14]. При этом в педиатрической практике особое место занимает препарат Виферон® (суппозитории ректальные) — генно-инженерный интерферон альфа-2b в комплексе с антиоксидантами, современная тактика применения которого для лечения острых респираторных инфекций у детей с измененным преморбидным фоном требует переосмысления.
В исследовании 1998–2000 гг. применение препарата у детей с отклонениями в состоянии здоровья больных ОРВИ в суточных дозах 500000 МЕ и 1000000 МЕ (в соответствующих возрастных группах) показало положительное влияние терапии на сроки купирования клинических симптомов заболевания, а также на показатели интерферонового статуса. Была научно доказана тесная взаимосвязь отягощенности преморбида у детей и дозозависимого клинического эффекта препарата генно-инженерного интерферона альфа-2b в комплексе с антиоксидантами [15]. В другом самостоятельном исследовании применение новой схемы дозирования препарата — по 500000 МЕ 2 раза в сутки в течение 5 дней, далее в дозе 150000 МЕ 2 раза в сутки в течение 5 дней у детей раннего возраста позволило достичь максимальных клинических и иммунологических эффектов при лечении ОРВИ по сравнению с ранее используемой схемой дозирования — 150000 МЕ 2 раза в сутки в течение 10 дней [16]. При применении обеих схем в исследовании сопоставимым оказалось влияние препарата Виферон® на симптомы синдрома интоксикации и респираторного синдрома: достоверно сократились длительность периода лихорадки 1,0 ± 0,2 суток и 1,3 ± 0,2 суток против 2,1 ± 0,4 суток в группе контроля, p < 0,05; длительность интоксикации 2,7 ± 0,3 и 2,5 ± 0,2 суток по сравнению с 3,8 ± 0,4 в группе контроля, p < 0,05; ускорение купирования затрудненного носового дыхания 4,2 ± 0,3 и 4,6 ± 0,3 суток по сравнению с 5,4 ± 0,4 суток в группе контроля, p < 0,05; ринореи, длительность которой сократилась более чем на 1,5 дня в обеих основных группах по сравнению с группой контроля. Преимущество новой схемы применения препарата генно-инженерного интерферона альфа-2b в комплексе с антиоксидантами проявилось в сокращении катарального синдрома: длительность гиперемии слизистых оболочек небных миндалин и глотки составила 3,3 ± 0,2 по сравнению с 4,9 ± 0,4 суток в группе контроля, p < 0,05. В исследовании было показано, что у детей с ОРВИ наиболее быстрый регресс продолжительности основных клинических симптомов сопровождался восстановлением индуцированной продукции альфа-интерферона и гамма-интерферона клетками крови на фоне модифицированной схемы применения препарата. Тогда как применение стандартных доз не оказывало столь значимого иммуномодулирующего эффекта у детей с отягощенным преморбидом. Применение повышенных доз экзогенного интерферона позволило ускорить элиминацию возбудителей со слизистой оболочки дыхательных путей, что достоверно продемонстрировано в исследовании при оценке назальных смывов в динамике болезни методом полимеразной цепной реакции.
Следует отметить, что модифицированная схема применения препарата Виферон®, суппозитории ректальные позволила также существенно снизить госпитальное суперинфицирование и развитие осложнений. Отдаленная оценка эффективности терапии в течение 6 месяцев после терапии показала уменьшение количества заболевших впоследствии детей в 2,5 раза и уменьшение количества повторных эпизодов ОРВИ у заболевших детей на 27%. Корреляция положительных клинических и иммунологических эффектов проводимой терапии препаратом генно-инженерного интерферона альфа-2b, суппозитории ректальные, в комплексе с антиоксидантами, при использовании увеличенных доз и длительности курса терапии позволяет констатировать целесообразность модификации терапии в разных возрастных группах. Профилактический эффект терапии, проведенный в острый период ОРВИ, убедительно демонстрирует выраженные иммуномодулирующие свойства препарата у детей II группы здоровья и является дополнительным подтверждением необходимости нового оптимизированного подхода к ее проведению.
Таким образом, для достижения оптимального клинико-иммунологического эффекта терапии ОРВИ у детей с отягощенным преморбидным фоном необходимо использование более высоких разовых доз препарата Виферон®, суппозитории ректальные с последующим ступенчатым уменьшением дозы.
Литература
Т. А. Чеботарева*, кандидат медицинских наук, доцент
Л. Н. Мазанкова*, доктор медицинских наук, профессор
А. А. Чебуркин*, доктор медицинских наук, профессор
И. Н. Захарова*, доктор медицинских наук, профессор
А. Л. Заплатников*, доктор медицинских наук, профессор
Н. А. Коровина*, доктор медицинских наук, профессор
Е. Н. Выжлова**, кандидат медицинских наук
*ГБОУ ДПО РМАПО Минздравсоцразвития России,
**ФГБУ НИИЭМ им. Н. Ф. Гамалеи Минздравсоцразвития России, Москва
Представлена группа детей с аллергическим ринитом в структуре диспансерной группы часто болеющих детей. Приводятся данные частоты аллергического ринита у детей с аллергопатологией и динамика показателя за последние 5 лет. Обсуждается роль острых респирато
Rational rehabilitation for children with allergic rhinitis in recurrent infections of respiratory tract
A group of children with allergic rhinitis in the structure of clinical group of ailing children was presented. The record on the allergic rhinitis frequency in children with allergic pathology was given, as well as dynamics of this factor in the last five years. The meaning of acute respiratory infections (ARI) in allergic rhinitis exacerbation and the influence of the nasal mucous membrane allergic inflammation on susceptibility to ARI were discussed. Recommended domestic algorithms of rehabilitation measures and the schemes of patient observation in allergic rhinitis were given.
Группа часто и длительно болеющих детей весьма неоднородна. Важным аспектом проблемы часто болеющих детей является видимая взаимосвязь острых респираторных заболеваний с аллергопатологией органов дыхания. Показан значительный удельный вес среди детей с частой заболеваемостью пациентов с аллергическим ринитом и бронхиальной астмой [1], заболеваемость острыми респираторными инфекциями которых рецидивирует и регистрируется более 6–8 раз в течение года [1–3]. К сожалению, до настоящего времени существует гиподиагностика аллергических болезней [4] и в первую очередь аллергического ринита у детей с рекуррентными (повторными) заболеваниями.
Однако в настоящее время влияние респираторной инфекции на течение аллергических заболеваний дыхательных путей находится в центре внимания аллергологов, а обратное воздействие аллергического воспаления на течение ОРИ — изучено в гораздо меньшей степени.
При частых ОРИ не происходит быстрого восстановления иммунитета [5, 6]. Нередко у часто и длительно болеющих детей наблюдается продолжительная персистенция типичных респираторных вирусов и вирусов оппортунистических инфекций (вирус Эпштейна–Барр, цитомегаловирус, вирус простого герпеса) в клетках иммунной системы, которые оказывают супрессирующее влияние на систему противовирусной защиты. Изменения в иммунном статусе, по данным разных авторов [1, 7, 8], имеют от 15% до 39% часто болеющих детей, у них выявляется картина напряженности процессов иммунного реагирования, недостаточность резервных возможностей. Изучение у них интерферонового статуса констатирует частые нарушения в системе интерферона, однако грубых дефектов не обнаруживается. Дисбаланс в работе системы интерферонов способствует высокой восприимчивости к вирусам респираторных инфекций, генерализации воспалительного процесса, тяжелому течению, задерживается элиминация вирусов, развиваются бактериальные осложнения ввиду активации оппортунистической микробной флоры ротоносоглотки ребенка. Повторные и затяжные ОРИ повышают риск формирования хронических очагов инфекции ЛОР-органов (хронические тонзиллит, отит, синусит, аденоидит). Поэтому частые ОРИ являются маркером снижения иммунной резистентности.
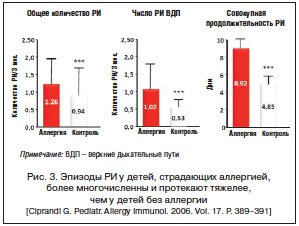
Данные статистики ежегодных отчетов отделения (2010–2014 гг.) свидетельствуют о высокой частоте регистрации аллергического ринита у детей с аллергическими заболеваниями — от 62% до 88% (рис. 1).
Доказано регулирующее влияние системы интерферона на воспалительные и иммунные реакции и на аллергическое воспаление в частности [6]. Так, интерферон-гамма (ИФН-γ), оказывая провоспалительное действие при инфекционном процессе, активирует макрофаги, стимулирует фагоцитоз, способствует адгезии гранулоцитов к эндотелиальным клеткам, в то же время способен тормозить аллергический ответ, оказывая угнетающее действие на продукцию IgE. При недостаточной продукции ИФН-γ происходит поляризация иммунного ответа в направлении Th-2, что при антигенном воздействии может приводить к гиперпродукции IgE и одновременно снижению противовирусной и противомикробной защиты. Заметим, что у атопиков ингибирующий эффект интерферона на синтез IgE может быть недостаточным, что определяет тяжесть аллергопатологии [6, 9].
Известно, что обострения аллергического ринита возникают не только под воздействием нагрузки причиннозначимыми аллергенами, но и на фоне ОРИ. Банальное воспаление под влиянием различных вирусов создает условие для длительной фиксации аллергенов на поверхности слизистой носа, нарушает их элиминацию со слизистой оболочки, способствует инициации иммунопатологического каскада. Провоцируемое вирусами аллергическое воспаление в слизистой носа в свою очередь задерживает элиминацию вирусов, а значит, затягивает выздоровление после ОРИ. Поэтому дети, склонные к аллергии, болеют ОРИ чаще и тяжелее сверстников. Последние научные данные свидетельствуют о наличии у больных аллергией повышенного уровня межклеточных адгезивных молекул (ICAM-1), которые являются рецепторами для большой группы (90%) респираторных вирусов. Так, риновирусы используют ICAM-1 для проникновения в эпителиальные клетки человека, что повышает склонность больных аллергией к частым ОРИ [11, 12]. В то же время частые ОРИ у детей без проявлений атопии могут предшествовать клинической манифестации атопического заболевания. Известно, что у 60% часто болеющих детей выявляются положительные результаты кожных скарификационных проб, а многие респираторные вирусы (респираторно-синтициальный вирус, риновирус, парагрипп, грипп) индуцируют синтез IgE и образование специфических IgE-антител.
Эти факты подчеркивают важность адекватной терапии ОРИ у детей с наличием аллергического ринита и бронхиальной астмы.
Другой необычайно важной проблемой аллергического ринита является частота бактериальных осложнений и хронических заболеваний ЛОР-органов. У 70% детей, страдающих аллергическим ринитом, поражаются околоносовые пазухи, у 40% выявляются аденоидиты [1, 13]. Длительно текущее аллергическое воспаление слизистой носа, нарушение дренажной функции способствуют изменению локального микробиоциноза, приводят к обсеменению слизистой ротоносоглотки патогенной микробной флорой (в том числе атипичной — 32%), длительной персистенции вирусов, что еще более снижает иммунную резистентность и провоцирует высокую заболеваемость ОРИ.
Вышесказанное дает основание говорить о серьезной проблеме проведения адекватных лечебных и реабилитационных мероприятий при возникновении ОРИ у детей с аллергическим ринитом. Важными целями реабилитации таких пациентов являются быстрая и полная элиминация вирусов, профилактика суперинфекции и осложнений со стороны ЛОР-органов, купирование аллергического воспаления в слизистой носа, а также профилактика обострений (или формирования) бронхиальной астмы. Поскольку этиологическая верификация ОРИ не проводится ввиду недоступности для практики экспресс-методов диагностики, применение противовирусных лекарственных средств при ОРИ ограничено. В этой связи значительно повышается интерес к иммунотропным препаратам [14–16].
Приоритетные схемы реабилитации детей, часто и длительно болеющих ОРИ, акцентируются прежде всего на восстановлении иммунной резистентности, в частности, интерферонового статуса [13–17]. Научные исследования показали высокую клинико-иммунологическую эффективность рекомбинантного интерферона альфа-2 (ИФН-α) у детей с упорно-рецидивирующими вирусно-бактериальными инфекциями респираторного тракта, имеющими различные нарушения функционирования иммунной системы и дефектность системы интерферона. К преимуществу использования интерферонов в лечении ОРИ относится их комбинированное воздействие: с одной стороны — этиотропный эффект (противовирусный, противобактериальный и антипролиферативный), с другой — иммуномодулирующий.
ИФН-α относится к семейству регуляторных цитокинов. Действие интерферона связано с индукцией синтеза протеинкиназы, которая фосфорилирует один из инициирующих факторов трансляции вируса, в результате активируется специфическая внутриклеточная рибонуклеаза, приводящая к деградации вирусных матричных РНК — ингибируется транскрипция и репликация вирусов и тормозится размножение зараженных вирусом клеток. Одновременно ИФН-α активирует фагоцитоз, влияет на Т- и В-лимфоциты, усиливает продукцию защитных антител, нормализует содержания IgE. Однако, исследования системы интерферона у детей с аллергическим ринитом и бронхиальной астмой демонстрируют низкую способность к продукции ИФН-a, что является предрасполагающим фактором к частым респираторным инфекциям и существенно ухудшает тяжесть течения и прогноз заболевания [6, 9].
В этой связи обосновано включение в схемы реабилитационных программ при ОРИ у больных с аллергическим ринитом препаратов ИФН-α.
Приоритет сегодня принадлежит отечественному препарату Виферон®, в состав которого, кроме рекомбинантного ИФН-альфа-2b, входят мембраностабилизирующие средства — антиоксиданты (витамины Е и С в терапевтически значимых дозах), нормализующие соотношение перекисное окисление липидов/антиоксидантная активность (ПОЛ-АОА) в плазме крови и способствующие возрастанию противовирусной активности рекомбинантного ИФН-альфа-2b в 10–14 раз. Установлено, что длительное применение препарата Виферон® не вызывает образование нейтрализующих антител, снижающих антивирусную активность рекомбинантного ИФН-альфа-2b. Стандартная схема применения препарата Виферон®, суппозитории ректальные: детям до 7-летнего возраста назначаются суппозитории, содержащие 150 000 МЕ ИФН в 1 свече 2 раза в сутки с интервалом 12 часов, в течение 5 дней, для детей после 7 лет Виферон® 500 000 МЕ по 1 свече 2 раз в сутки в течение 5 дней, по клиническим показаниям терапия может быть продолжена. Однако практические рекомендации последних лет для детей 2–4 группы здоровья, в т. ч. часто болеющих детей с аллергией или высоким риском ее формирования, используют схемы с увеличением дозы за счет применения суппозиториев с большей дозировкой в лекарственной форме с целью быстрого достижения высокого и эффективного уровня терапии.
Частота заболеваемости ОРИ и особенности реабилитации у детей с сочетанной и хронической патологией, в т. ч. аллергических заболеваний, диктуют необходимость поиска новых способов и схем терапии препаратами интерферона. В настоящее время широко используются различные модифицированные схемы лечения препаратом Виферон®: моноиммунокоррекция или комплексная терапия в сочетании с иммуномодулирующей, короткие (стандартные) или пролонгированные курсы с постепенным снижением дозы препарата (особенно для группы часто болеющих детей, у которых клинико-иммунологическая ремиссия после ОРИ происходит медленно, затягивается, по литературным данным, до 2,5 месяцев) [6]. Используются схемы с увеличением возрастной стандартной дозы препарата, пролонгированные схемы терапии с комбинацией системных и топических интерферонов [18]. Лекарственные формы препарата Виферон® в виде ректальных суппозиториев, мази и геля просты, безопасны и безболезненны в применении и обеспечивают высокий комплайнс [5].
Нами доказано, что усовершенствованный способ лечения ОРИ у детей раннего возраста, основанный на применении стартовых доз рекомбинантного альфа-2b-интерферона (Виферон®) 500 000 МЕ (ректально) в течение первых 5 дней с переходом на 150 000 МЕ в течение последующих 5 дней в комбинации с мазью Виферон® (интраназально), характеризуется хорошей переносимостью и высокой клинико-иммунологической эффективностью, а также способствует снижению вероятности суперинфицирования.
Таким образом, курсы виферонотерапии в остром периоде болезни демонстрируют достаточную эффективность, приводящую к элиминации вирусов, снижают тяжесть заболевания, препятствуют развитию осложнений и снижают частоту повторных заболеваний ОРИ. Короткие курсы терапии препаратом Виферон® 500 000 МЕ особенно удобны в лечебной практике в стационаре при рекуррентной респираторной инфекции, возникающей у ребенка с аллергическим ринитом, а также могут быть рекомендованы в аналогичной ситуации в амбулаторной практике. Важно раннее начало лечения рекомбинантными интерферонами в первые сутки болезни, чтобы осуществить дотацию базовому уровню эндогенного интерферона сразу в первые дни заболевания вирусной инфекцией.
Исследования, проведенные с длительным назначением препарата интерферона (Виферон®) часто болеющим ОРИ детям с бронхиальной астмой, через 6 недель от начала терапии продемонстрировали у 83,3% восстановление способности к продукции альфа-интерферона, по сравнению со средним уровнем здоровых детей того же возраста, а также уменьшение частоты ОРИ в 4 раза и снижение частоты обострений бронхиальной астмы на фоне ОРИ в 3,4 раза, что ярко свидетельствует об активации на фоне лечения скрытых резервов противовирусной защиты [5].
В то же время для дифференцированного подхода к иммунореабилитации при ОРИ у больных с аллергическим ринитом в некоторых случаях может потребоваться специализированная помощь квалифицированного аллерголога-иммунолога.
Заключение
Таким образом, рациональная реабилитация при рекуррентных инфекциях респираторного тракта у детей с аллергическим ринитом должна проводиться с учетом генетически обусловленной дисфункции иммунорегуляторных процессов, в том числе системы интерферона. Раннее включение препарата Виферон® в комплексную терапию ОРИ пациентам с аллергическим ринитом позволит улучшить течение основного и сопутствующих заболеваний, предупредить развитие осложнений.
Литература
- Самсыгина Г. А., Коваль Г. С. Проблемы диагностики и лечения часто болеющих детей на современном этапе // Педиатрия. 2010, т. 89, № 2.
- Зайцева О. В. Качество жизни пациентов с аллергическими заболеваниями. Основные принципы эффективной и безопасной терапии. Рук-во для врачей. М., 2007.
- Нестерова И. В., Малиновская В. В., Тараканов В. А., Ковалева С. В. Интерфероно- и иммунотерапия в практике лечения часто и длительно болеющих детей и взрослых. Capricorn Publishing Inc. 2004, 160 c.
- Савенкова М. С., Афанасьева А. А., Абрамова Н. А. Иммунотерапия: лечение и профилактика вирусных инфекций у часто и длительно болеющих взрослых и детей // Аллергология и иммунология. 2012; 1 (1): 20–27.
- Зайцева О. В., Малиновская В. В. Роль системы интерферона в патогенезе бронхиальной астмы у детей.
- Караулов А. В., Кокушков Д. В. Иммуномодуляторы: классификация, принципы и практика применения при инфекции дыхательных путей у детей // Детские инфекции. 2007; 6 (4): 68–74.
- Заплатников А. Л., Гирина А. А., Бурцева Е. И. и др. Иммунопрофилактика гриппа и других острых респираторных вирусных инфекций в достижении контроля над течением бронхиальной астмы у детей // Педиатрия. 2013; 92 (1): 51–56.
- Малиновская В. В., Васильев А. Н., Парфенов В. В. Механизм противовирусного действия интерферонов (обзор литературы).
- Bossuyt X. Coexistence of (partial) immune defects and risk of recurrent respiratory infections // Clin Chem. 2007; 53: 124–130.
- Зайцева О. В. Острые респираторные инфекции у пациентов с аллергией // Лечащий Врач. 2006, № 9, с. 28–32.
- Захарова И. Н, Малиновская В. В., Торшхоева Л. Б., Короид Н. В., Мозжухина М. В., Лагадзе И. Б. Применение рекомбинантного альфа-2b-интерферона (ВИФЕРОН®) при острых респираторных инфекциях у детей раннего возраста // Педиатрия. 2014, № 1 (3).
- Чеботарева Т. А., Мазанкова Л. Н., Чебуркин А. А. и др. Дети с рекуррентными инфекциями респираторного тракта: модифицированная интерферонотерапия острых респираторных инфекций // Лечащий Врач. 2012; 6: 2–7.
- Нестерова И. В. Препараты Интерферона альфа в клинической практике // Российский аллергологический журнал. 2010, № 2.
- Нестерова И. В., Ковалева С. В., Колесникова Н. В. и др. Эффективность программы интерфероно- и иммунотерапии у детей с ассоциированными повторными острыми вирусными респираторными, рецидивирующими герпесвирусными инфекциями и хроническими заболеваниями ЛОР-органов // Российский аллергологический журнал. 2013; 2 (2): 213–216.
- Феклисова Л. В., Галкина Л. А., Линькова Ю. Н. Возможности использования синтетических интерферонов в терапии вирусных инфекций у детей // Педиатрия. 2013; 92 (1): 105–109.
- Нестерова И. В., Ковалева С. В., Колесникова Н. В. и др. Оптимизация интерфероно- и иммунотерапии у иммунокомпрометированных детей с ассоциированными вирусно-вирусными инфекциями: повторные острые респираторные вирусные и различные герпесвирусные инфекции // Аллергология и иммунология. 2013; 14 (2); 87–88.
- Янина М. А., Осидак Л. В., Милькинт К. К., Суховецкая В. Ф., Образцова Е. В. Аденовирусная инфекция (АДВИ) у детей. Возможность использования в терапии препарата Виферон (гель и суппозитории).
- Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA (2)LEN and AllerGen) // Allergy. 2008; 63, Suppl. 86: 8–160.
- Bousquet J., Schünemann H. J., Samolinski B. et al. World Health Organization Collaborating Center for Asthma and Rhinitis (2012) Allergic Rhinitis and its Impact on Asthma (ARIA): achievements in 10 years and future needs // J. Allergy Clin. Immunol. 130 (5): 1049–1062.
- Федоскова Т. Г. Особенности ведения больных круглогодичным аллергическим ринитом при острых респираторных вирусных инфекциях.
- Карпова Е. П., Тулупов Д. А. Местная терапия инфекционных осложнений аллергического ринита у детей // Вестник отоларингологии. 2013, 5, с. 73–75.
С. И. Барденикова* , 1 , кандидат медицинских наук
О. В. Зайцева*, доктор медицинских наук, профессор
С. Ю. Снитко*
О. Б. Довгун**, кандидат медицинских наук
В. В. Малиновская***, доктор биологических наук, профессор
В. В. Парфенов***, кандидат медицинских наук
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ДГКБ св. Владимира, Москва
*** ФГБУ НИИ ЭиМ им. Н. Ф. Гамалеи, МЗ РФ, Москва
Для цитирования: Методы диагностики и терапевтические возможности лечения рекуррентных респираторных инфекций у детей. РМЖ. 2014;26:1945.
Настоящее мероприятие было посвящено вопросам современной диагностики заболеваний уха, горла, носа у детей, передовым технологиям хирургии в оториноларингологии, новым направлениям в терапии и профилактике ЛОР-заболеваний.
В рамках мероприятия прошли доклад и интервью с профессором Джованни А. Росси –
руководителем подразделения пульмонологии и аллергологии госпиталя Гаслини в Генуе, Италия
У пациентов с фарингитом Streptococcus pyogenes образует биопленки и не поддается эрадикации. Лечение его различными антибиотиками не приводит к полной эрадикации бактерий.
Аденэктомию/тонзилэктомию проводят только по показаниям и при условиях, изложенных в действующих рекомендациях. Изменения микробной флоры носоглотки после аденотонзиллэктомии (АТЭ) у 300 детей показаны на рисунке 6. Дети были разделены на 2 группы: 1-й была проведена АТЭ, 2-я – группа динамического наблюдения (ДН). При сравнении с контрольной группой наблюдается снижение частоты эпизодов этих инфекций у детей, у которых была проведена АТЭ, но это не влияет на частоту РРИ. На рисунке 7 видно, что нет разницы в 2 группах, доля детей с РРИ на протяжении 2 лет наблюдения не отличается в обеих группах.
В 2006 г. был опубликован Кохрановский обзор, обнародованы результаты изучения эффективности Рибомунила при ОРИ у детей и взрослых: 11 исследований; 852 участника (437 человек в экспериментальных группах и 415 – в контрольных). Число эпизодов ОРИ сократилось в среднем на 43,47%.
Дополнительные исследования показали эффективность Рибомунила в предотвращении развития среднего отита у детей с РРИ верхних дыхательных путей (рис. 9), предупреждении развития РРИ верхних и нижних дыхательных путей у детей и взрослых, в лечении рекуррентного острого аденоидита у детей, в профилактике рекуррентного фаринготонзиллита у детей. Также был выполнен анализ экономической эффективности применения препарата при рекуррентном инфекционном рините у взрослых (рис. 10); хорошо изучены его переносимость и безопасность.
Таким образом, применение Рибомунила весьма эффективно для лечения РРИ у детей, а также для терапии и профилактики инфекций у взрослых.






Для цитирования: Зайцева О.В. Профилактика и лечение рецидивирующих инфекционных заболеваний дыхательных путей у детей. РМЖ. 2014;21:1497.
Наиболее высокий уровень заболеваемости респираторными инфекциями отмечается у детей дошкольного и младшего школьного возраста, которые посещают организованные коллективы. Высокая частота инфекций дыхательной системы у детей обусловлена физиологическими особенностями созревания иммунной системы ребенка, неблагоприятными анте- и перинатальными факторами; курением родителей, особенно матерей; типом конституции; высокой контагиозностью вирусных инфекций, нестойким иммунитетом к ряду возбудителей, разнообразием серо- и биотипов пневмотропных бактерий (пневмококков, стафилококков, гемофильной палочки) и многими другими факторами.
Частые повторные эпизоды инфекций респираторного тракта у детей являются значимой социально-экономической проблемой российского здравоохранения, т. к. не только приводят к ухудшению здоровья и качества жизни пациентов, но и наносят существенный экономический ущерб семье и обществу. Значительное число ОРЗ протекает легко и не требует проведения серьезных лечебных мероприятий. Известно, что контакт и взаимодействие с респираторными инфекциями – необходимые условия становления иммунной системы ребенка, приобретения им иммунологического опыта, необходимого для адекватного реагирования на микробную агрессию. Однако частые респираторные заболевания, следующие одно за другим, безусловно, оказывают на ребенка негативное воздействие. Дети с частыми повторными (рекуррентными) заболеваниями органов дыхания требуют особого внимания врача и должны наблюдаться во II диспансерной группе здоровья с соблюдением соответствующих профилактических и терапевтических стандартов. Повторные респираторные инфекции способствуют формированию хронических заболеваний и могут определить на долгие годы неудовлетворительное качество здоровья ребенка [2, 7, 10].
Профилактика респираторных инфекций ЧБД предусматривает ограничение контактов ребенка с больными гриппом и ОРВИ, проведение санитарно-гигиенических мероприятий, сокращение использования городского транспорта и удлинение времени пребывания ребенка на воздухе. Частая респираторная заболеваемость тесно связана с пассивным курением, поэтому его прекращение – важное условие лечения и профилактики [2, 5]. Все дети, склонные к частым респираторным инфекциям, должны быть осмотрены и, при необходимости, пролечены ЛОР-врачом.
Одним из основных методов повышения сопротивляемости ребенка инфекционным агентам служит закаливание. Систематическое контрастное воздушное или водное закаливание сопровождается повышением устойчивости организма к температурным колебаниям окружающей среды и увеличением иммунологической реактивности организма. Использование любых методов закаливания совершенствует работу аппарата терморегуляции и расширяет возможности приспособления организма к изменившимся температурным условиям. Закаливание не требует очень низких температур, важны контрастность воздействия и систематичность проведения процедур. Хорошо закаливает воздействие на подошвы ног и, постепенно, – на всю кожу туловища и конечностей. Максимальная длительность закаливающих процедур не должна превышать 10–20 мин, гораздо важнее их регулярность и постепенность. Было показано, что у ЧБД сочетание местных закаливающих процедур стоп и носоглотки через 3–4 мес. восстанавливало цитологические показатели носового секрета. Закаливание после нетяжелого ОРЗ можно возобновить (или начать) через 7–10 дней, при заболевании с длительностью температурной реакции более 4 дней – через 2 нед., а после 10-дневной лихорадки – через 3–4 нед. [7]. Эффективность закаливания можно оценить не ранее чем через 3–4 мес., а максимальный эффект наблюдается через 1 год от начала регулярных процедур.
Вакцинация ЧБД – одно из самых важных профилактических мероприятий. Поскольку частые ОРВИ у этой группы детей не свидетельствуют о наличии иммунодефицита, они не могут быть поводом для отвода от прививок, противопоказанием к их проведению. По окончании ОРВИ, как и других острых заболеваний, прививки можно проводить через 2–3 нед. после нормализации температуры тела [10].
С учетом ведущей роли дисфункций иммунитета в развитии повышенной восприимчивости детского организма к респираторным инфекциям кроме комплекса общеукрепляющих мероприятий с целью профилактики используется целый ряд иммуномодулирующих лекарственных средств. При этом большинство авторов подчеркивают, что такие препараты с целью предупреждения респираторных инфекций у ЧБД должны применяться с обязательным соблюдением общих принципов профилактики и оздоровления.
Из средств неспецифической профилактики респираторных инфекций в педиатрии часто применяются препараты, полученные из эхинацеи. В современной медицине чаще применяют препараты из эхинацеи пурпурной (Echinacea purpurea). Известно, что эхинацея богата полисахаридами и фитостеринами, оказывающими стимулирующее действие на иммунную систему, содержит макро- и микроэлементы: железо, цинк, селен, калий, кальций, молибден, серебро, кобальт, никель, барий, бериллий, ванадий, марганец. Эхинацея пурпурная содержит активные вещества, укрепляющие естественные защитные силы организма и действующие в качестве неспецифических стимуляторов. При назначении эхинацеи наблюдаются повышение фагоцитоза, иммунорегуляторного индекса, функциональной активности В-лимфоцитов, индукция синтеза интерферона. В эксперименте показано, что перитонеальные макрофаги мышей под влиянием эхинацеи продуцировали фактор некроза опухоли, интерлейкины (ИЛ): ИЛ-1, ИЛ-6, ИЛ-10.
Как в нашей стране, так и за рубежом хорошо известен и наиболее часто применяется препарат из высушенного сока эхинацеи Иммунал®. Повышая количество лейкоцитов (гранулоцитов) и стимулируя фагоцитоз, активные вещества препарата подавляют рост и размножение микроорганизмов в организме человека и способствуют уничтожению болезнетворных бактерий. Многочисленными исследованиями установлено противовирусное действие препаратов из эхинацеи пурпурной в отношении респираторных вирусов, а также возбудителей гриппа и герпеса.
Показания к применению препарата Иммунал® плюс С: профилактика простудных заболеваний и гриппа; комплексное лечение инфекционно-воспалительных заболеваний респираторного тракта для ускорения процесса выздоровления, в т. ч. при антибиотикотерапии хронических инфекционных заболеваний, сопровождающихся снижением иммунитета, а также в качестве источника витамина С, необходимого при ОРЗ. Но следует отметить, что начинать лечение препаратом Иммунал® плюс С необходимо как можно раньше – при первых клинических признаках заболевания.
Применять Иммунал® плюс С рекомендуется внутрь независимо от приема пищи детям старше 12 лет и взрослым по 2–3 мл 3 р./сут, детям в возрасте от 4 до 12 лет – по 1–2 мл 3 р./сут, детям в возрасте от 1 до 4 лет – по 1 мл 3 р./сут. Для достижения терапевтического эффекта препарат следует принимать в течение 7–10 дней. Повторные курсы возможны после 14-дневного перерыва.
Таким образом, целенаправленные комплексные профилактические мероприятия могут существенно снизить вероятность развития респираторных заболеваний. Однако при возникновении инфекционного процесса дети из группы часто болеющих требуют применения особых методов терапии. Существует ошибочное мнение, что ОРЗ можно не лечить – заболевание пройдет самостоятельно. Однако респираторные инфекции без адекватного лечения часто принимают затяжное или осложненное течение, легкий насморк может закончиться тяжелой пневмонией или синуситом. У ЧБД особое значение приобретает повышение эффективности терапии респираторного заболевания. Безусловно, лечение, как и профилактика ОРЗ, должны быть комплексными и проводиться индивидуально в каждом конкретном случае.
В заключение необходимо еще раз подчеркнуть, что часто болеющие дети – группа диспансерного наблюдения, достаточно многочисленная среди детей дошкольного возраста, проживающих в экологически неблагоприятных регионах и посещающих детские дошкольные учреждения. Эти дети нуждаются в проведении регулярных комплексных профилактических мероприятий, а при развитии острой респираторной инфекции – в своевременной и адекватной терапии.


Читайте также:

