Ретровирусы патогенные для человека
Обновлено: 15.04.2024
Содержательный модуль 14. Специальная вирусология.
Тема 13: Ретровирусы. Вирус иммунодефицита человека.
Актуальность темы:Первые ретровирусы были обнаружены в начале XX в. Эллерманном, Бангом и Раусом, установившими вирусную природу эритробластоза и саркомы кур.
Семейство Retroviridae, объединяющее около 150 видов однонитевых РНК-содержащих, обратнотранскрибирующихся вирусов.
Ретровирусы имеют уникальный путь передачи генетической информации. Геном ретровирусов состоит из двух идентичных молекул РНК, т.е. является диплоидным. В составе ретровирусов есть особый вирусоспецифический фермент – обратная транскриптаза или ревертаза, с помощью которой осуществляется процесс обратной транскрипции, т.е. на матрице геномной РНК синтезируется комплементарная однонитевая ДНК (кДНК). Комплементарная нить ДНК копируется с образованием двунитевой комплементарной ДНК, которая интегрирует в клеточный геном и в его составе транскрибируется в иРНК. Синтез белков для этих вирусов осуществляется по схеме:
геномная РНК вируса→комплементарная ДНК→транскрипция иРНК→транскрипция белка вируса.
В самостоятельное семейство они были выделены лишь в 1974 г. В латинском варианте их названия приставка retro(обратный) обозначает обратную направленность потока генетической информации (не от ДНК к РНК, а наоборот, от РНК к ДНК).
Таким образом, ретровирусы плюс-нитевые диплоидные РНК вирусы, содержащие фермент обратную транскриптазу, которая на матрице РНК вируса синтезирует минус-нить ДНК, с которой копируется плюс-нить ДНК с образованием двойной нити ДНК.
Ретровирусы имеют сферическую форму, размер 80-130 нм. Вирион имеет суперкапсид и нуклеокапсидную сердцевину, кубический тип симметрии (капсид икосаэдральный). Типичным является наличие обратной транскриптазы (РНК-зависимой ДНК-полимеразы),связанной с геномом – однонитевой плюс-РНК в виде комплекса из двух идентичных субъединиц.
Вирусы содержат протеины: группового антигена (gag), полимеразный протеин (pol) и белки оболочки(env).
Семейство ретровирусов включает 7 родов.
Характеристика ретровирусов (семейство Retroviridae)
Типовой вид и некоторые представители рода
Вирусы лейкоза, саркомы птиц, саркомы рауса кур
Betaretrovirus
Вирус рака молочных желёз мышей, эндогенный ретровирус человека, вирус обезьян Мезон-Пфайзера
Gammaretrovirus
Вирусы саркомы и лейкемии мышей, кошек, приматов
Deltaretrovirus
Вирус лейкемии крупного рогатого скота, лимфотропные вирусы Т-клеток человека (HTLV-1, -2)
Epsilonretrovirus
Вирус саркомы кожи
Spumavirinae
Lentivirinae
Вирус иммунодефицита человека, вирус Мэди/Висна
Следует отметить, что патогенностью для человека обладает ограниченная группа ретровирусов:
Тип поражения
Т-клеточные лимфотропные вирусы человека (HTLV):
Вызывает Т-клеточные лимфомы и миелопатии (тропи-ческий спастический парапарез)
Прямых доказательств патогенного действия нет; выделяют при хронических лимфолейкозах.
Близок к ВИЧ-1; также способен вызывать ВИЧ-инфекцию, встречается преимущественно в Западной Африке
ВИРУС ИММУНОДЕФИЦИТА ЧЕЛОВЕКА
Синдром приобретенного иммунодефицита (СПИД), или AIDS (от англ, acquired immunodeficiency Syndrome), - тяжелое заболевание, вызываемое вирусом иммунодефицита человека - ВИЧ, или HIV (от англ, human immunodeficiency virus), поражающим преимущественно иммунную систему. Болезнь характеризуется длительным течением, полиморфностью клинических проявлений, высокой летальностью, передается в естественных условиях при половых контактах, а также с кровью при медицинских манипуляциях и способна к быстрому эпидемическому распространению.
ВИЧ открыт в 1983 г. американским ученым Р. Галло и французским исследователем Л. Монтанье одновременно и независимо друг от друга. Большинство исследователей склоняются к мысли об африканском происхождении заболевания и его распространении в США через страны Карибского бассейна, т.к. ещё в начале 70-х гг. у жителей некоторых африканских стран обнаруживали ATк ВИЧ. К настоящему времени идентифицировано два вида ВИЧ.Первый превалирует при клинических формах СПИДа, первоначально обнаружен в Центральной Африке, а позднее и в других регионах. Второй преимущественно выделяют в Западной и Центральной Африке. ВИЧ-2 проявляет более низкую вирулентность. После открытия Гэлло вирус относили к лимфотропным Т-клеточным ретровирусам; но более поздние исследования выявили имеющиеся существенные отличия.
Таксономия.ВИЧ отнесен к семейству Retroviridae, подсемейству Lentivirinae.
Морфология и культивирование.ВИЧ - сравнительно просто устроенный РНК-содержащий вирус, имеет сферическую форму, размер около 100 нм. Двуслойная липидная оболочка пронизана гликопротеидными антигенами gp120 и gp41 (домены gpl60). Сердцевина вируса имеет конусовидную форму и состоит из капсидных белков р24 и р25, матриксных белков, и белков протеаз. РНК - двухспиральная, для осуществления процесса репродукции ВИЧ имеет обратную транскриптазу или ревертазу (она же РНК-зависимая ДНК-полимераза). Вирус очень трудно культивируется в искусственных условиях, размножается только в культурах лимфоцитов, накопление невысокое.
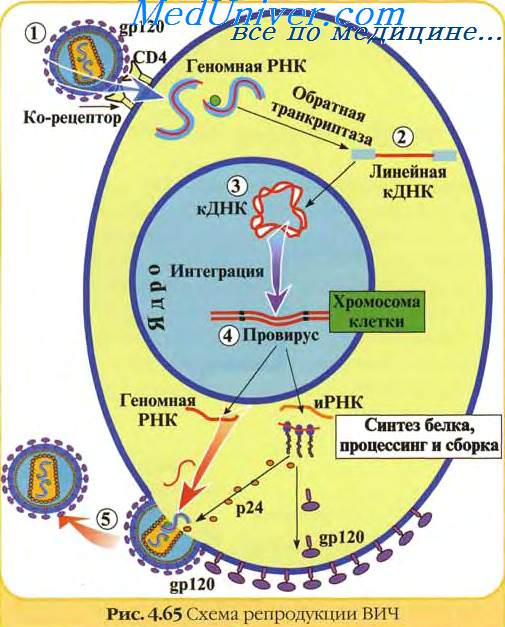
Стадии взаимодействия ВИЧ с клеткой-мишенью:
Связывание вириона с поверхностью клетки. Резекция вируса.
Слияние мембраны вируса и клетки. Проникновение вируса.
Высвобождение нуклеотида и геномной РНК-вируса.
Синтез провирусной ДНК на матрице геномной РНК-вируса.
Интеграция генома провируса в геном клетки.
Латентный период, в течении которого ДНК-провируса интегрировано в геном.
Активация процесса транскрипции с ДНК провируса, трансляция белков вируса.
Активная репликация вируса, т.е. продукция всех компонентов вируса и формирование из них зрелых дочерних вирионов.
Высвобождение вирионов и отдельных белков ВИЧ из клетки хозяина во внешнюю среду и беспрепятственное заражение других клеток. Цитопатогенные инфекции ВИЧ.
Антигенная структура.ВИЧ имеет ряд поверхностных (gp160, gp120, gp41) и сердцевинных (р24, р18 и др.) антигенов, определяющих его серологические свойства. В настоящее время выделяют две антигенные разновидности вируса: ВИЧ-1 и ВИЧ-2. Основные антигены вызывают образование антител у инфицированных людей; вначале появляются антитела к gp120, gp41, затем р24, которые длительно сохраняются в крови.
ВИЧ обладает уникальной антигенной изменчивостью, которая в сотни и тысячи раз превосходит изменчивость вируса гриппа, благодаря тому, что скорость его транскрипции значительно выше, чем у других вирусов. Это затрудняет диагностику и специфическую профилактику ВИЧ-инфекции.
Факторы патогенности.ВИЧ обладает лимфотропностью благодаря тому, что на лимфоцитах Т-хелперах существуют в норме рецепторы CD-4, имеющие сродство к белку gp120 вируса. Это создает благоприятные условия для прикрепления вируса к лимфоцитам, проникновения их в клетку и последующего размножения в лимфоците. В результате размножения ВИЧ в лимфоцитах последние разрушаются и погибают или снижают свою функциональную активность. Однако ВИЧ поражает не только Т4-лимфоциты, но и другие клетки (нервные, В-лимфоциты, макрофаги, клетки Лангерганса), которые имеют рецепторы типа CD-4, как у Т-лимфоцитов. Поражение иммунных и других клеток приводит к снижению защитных функций иммунной системы, развитию иммунодефицитного состояния и проявлению в результате этого вторичных заболеваний инфекционной и неинфекционной природы.
Культивирование.Культивируется ВИЧ на культуре клеток Т-лимфоцитов и моноцитов человека, но для этого требуется присутствие интерлейкина-2 (ИЛ-2).
Резистентность.ВИЧ сравнительно малоустойчив в окружающей среде, а также к физическим и химическим факторам. При комнатной температуре сохраняется до 4 сут; через 5-10 мин инактивируется после обработки спиртом, эфиром, гипохлоритом, быстро гибнет при действии моющих средств, губительна солнечная радиация, искусственное УФ излучение, ионизирующая радиация.. Кипячение быстро убивает вирус, прогревание до 80 0 С обезвреживает его в течение 6-7 мин, а до 60 0 С - в течение 30 мин.
Имеются данные, что ВИЧ теряет активность при воздействии ферментов слюны и пота. Однако вирус может длительно (до 2 недель) сохраняться в высушенном состоянии, в высохшей крови, а в донорской крови может сохраняться годами.
Восприимчивость животных.К ВИЧ чувствителен только человек; отдельные проявления ВИЧ-инфекции можно вызывать лишь у обезьян шимпанзе, у которых, однако, симптоматика СПИДа не развивается.
Вирус попадает в кровь при половых контактах (особенно извращенных) или указанных выше медицинских манипуляциях, проникает в клетки, размножается в них, выходит из клеток и распространяется по всему организму. Его можно обнаружить в крови, лимфе, слюне, слезах, сперме, отделяемом влагалища, коже и других жидкостях и клетках.
Патогенез.Проникая в кроветворное русло, ВИЧ инфицирует Т-хелперы и другие клетки на поверхности которых в норме существуют рецепторыCD4 , имеющие сродство к белкуgp120 ВИЧ.
Вирус прикрепляется к Т-лимфоциту, проникает путем эндоцитоза и репродуцируется в лимфоцита. В результате размножения ВИЧ в лимфоците последние разрушаются и теряют свои функциональные свойства.
ВИЧ инфицирует также моноциты, макрофаги, В-лимфоциты, клетки Лангерганса, дентритные нервные клетки и другие, которые имеют рецепторы CD4 как у Т-лимфоцитов.
В результате размножения вируса в различных клетках происходит накопление его органах и тканях, и он обнаруживается в крови, лимфе, слюне, сперме, слезах, моче, поте, каловых массах, содержимом урогенитального тракта, грудном молоке, в гное при воспалительных процессах.
При ВИЧ-инфекции снижается число Т4-лимфоцитов, а также отношение Т4/Т8, нарушается функция В-лимфоцитов, снижается и нарушается продукция комплемента, интерлейкинов, интерферона, в результате чего наступает дисфункция иммунной системы и расстройство ее деятельности. Вследствие поликлональной активации В-лимфоцитов вирусом возможно повышение уровня иммуноглобулинов. В результате иммунодепрессии, подавления клеточного и гуморального звена иммунитета организм становится беззащитным против экзогенных (бактерии, вирусы, грибы, простейшие) и эндогенных (опухолевые и другие клетки) антигенов. Этот механизм лежит в основе возникновения вторичных болезней и клинических проявлений ВИЧ-инфекции.
Клиника.ВИЧ-инфекция, по акад. В. И. Покровскому с 1989 года, характеризуется несколькими стадиями:
I. Стадия инкубации.
Установлено, что инкубационный период(от момента инфицирования до первых клинических проявлений или сероконверсии) продолжается от 2—3 нед до 1—2 мес, а по некоторым данным и до 3—5 лет.
II. Стадия первичных проявлений:
А — острая лихорадочная фаза;
Б — бессимптомная фаза;
В — персистирующая генерализованная лимфаденопатия.
Однако в крови определяются ВИЧ-антитела. Эта стадия может длиться годами (10-15 лет). В этот период защитные системы организма сдерживают репродукцию возбудителя.
III. Стадия вторичных заболеваний:
А — потеря массы тела менее 10%; поверхностные грибковые, вирусные, бактериальные поражения кожи и слизистых оболочек; опоясывающий лишай; повторные фарингиты, синуситы;
Б — прогрессирующая потеря массы тела более 10%; необъяснимая диарея или лихорадка более 1 мес; волосатая лейкоплакия; туберкулез легких; повторные или стойкие бактериальные, вирусные, грибковые, протозойные поражения внутренних органов (без диссеминации) или глубокие поражения кожи и слизистых оболочек; повторный или диссеминированный опоясывающий лишай; локализованная саркома Капоши;
В — генерализованные бактериальные, вирусные, грибковые, протозойные, паразитарные заболевания; пневмоцистная пневмония; кандидоз пищевода; внелегочный и атипичный туберкулез; кахексия; диссеминированная саркома Капоши; поражения ЦНС различной этиологии.
IV. Терминальная стадия: развиваются кахексия (резкое уменьшение массы тела), адинамия, деменция (слабоумие) и другие явления при снижении всех иммунологических показателей.
Считают, что только терминальную стадию можно относить к собственно СПИДу, все предыдущие следует трактовать как ВИЧ-инфекцию.
Летальность при СПИДе достигает 100 %.
Для людей, пораженных ВИЧ-инфекцией, характерны 3 группы заболеваний – оппортунистические инфекции, опухолевые болезни и поражение ЦНС.
Средняя продолжительность жизни инфицированного человека примерно 7-15 лет.
Иммунитет.Иммунитет носит гуморальный и клеточный характер. Роль антител недостаточно выяснена.
Лабораторная диагностика.Вирусологическая и серологическая диагностика сводится к определению в жидкостях и тканях организма (сыворотка крови, лимфоциты, макрофаги, сперма, слюна, содержимое влагалища и др.) вируса или его антигенов, а также антител к ВИЧ в сыворотке крови. Вирус выделяют в культуре клеток лимфоцитов, что довольно трудно в обычных условиях. Антитела к ВИЧ определяют в основном с помощью ИФА, подтверждая положительные результаты, используя метод иммуноблоттинга.
Наличие ВИЧ в крови можно выявить в различные сроки, обычно одновременно с появлением белка р24. Растворимый р24 антиген может быть выявлен в кровотоке не ранее чем через 5-10 суток после заражения. Вирусемия достигает пика к 10-20 суткам после заражения и продолжается до появления специфических антител. В крови больного появляются вируснейтрализующие антитела против gp120 иgp41, р24. ВИЧ антитела появляются через 2-4 недели после инфицирования и определяются на всех стадиях ВИЧ-инфекции и при СПИДе.
В настоящее время наиболее чувствительными и специфичными признаны ИФА и метод вестернблота.
Выявить ВИЧ-инфекцию, т.е. вирус, в инкубационном и раннем клиническом периоде можно при помощи ПЦР.
С помощью ИФА определяют антитела к белкам gp41,gp120,p24.
В связи с тем, что gp120 имеет структурное и антигенное сходство с рецепторами некоторых клеток человека, в организме могут появляться антитела, родственные антителам противgp120. В этом случае могут быть ложноположительные результаты ИФА. Поэтому все положительно реагирующие сыворотки исследуемых подвергаются дополнительному анализу с помощью метода иммуноблотинга или вестернблотинга. В основе этого метода лежит идентификация исследуемых антител после электрофоретического разделения их и последующего тестирования с помощью меченых антивидовых антител. Метод вестернблот позволяет обнаружить специфические антитела в сыворотке к р24,gp41 либоgp120.
Клинический и серологический диагнозы подтверждаются иммунологическими исследованиями, если они указывают на наличие иммунодефицита у обследуемого пациента.
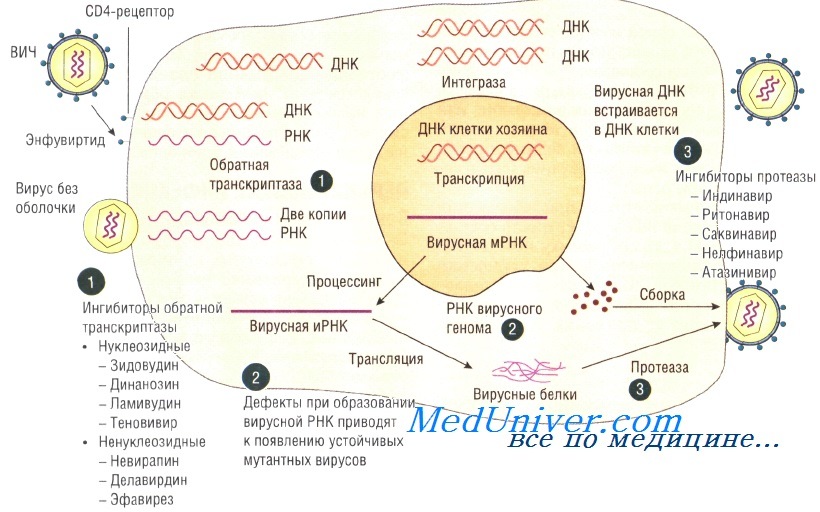
Лечение.Лечение неэффективно. Некоторые результаты дает применение азидотимидина, подавляющего репликацию вируса в клетке.
Препараты, используемые для лечения ВИЧ инфицированных пациентов, разделены согласно их действию на различные стадии репликации ВИЧ:
1. Препараты, ингибирующие обратную транскриптазу: азидотимидин, ставудин.
Лечение азидотимидином продолжает жизнь больным ВИЧ-инфекцией в среднем на 1,5-2 года. Фосфазид – отечественный препарат, более эффективен и менее токсичен, чем азидотимидин.
2. Препараты, ингибирующие протеазы: саквиновир, ритонавир и др.
Основная перспектива их терапевтического использования – совместное применение с ингибиторами обратной транскриптазы.
3. Комбинированная терапия: ингибиторами обратной транскриптазы и ингибиторами протеаз.
Профилактика.Специфическая профилактика не разработана.
В течение длительного времени предпринимаются попутки разработать вакцину против ВИЧ, однако надежной и безопасной вакцины против ВИЧ не существует. Созданы вакцины на основе методов генной инженерии. Решение вопроса об эффективности этих вакцин требует значительного времени.
Основные меры борьбы сводятся к пресечению возможностей инфицирования при половых контактах (механические способы защиты), борьбе с проституцией, наркоманией и гомосексуализмом; исключению условий передачи ВИЧ при медицинских манипуляциях (одноразовые шприцы, иглы, системы для переливания крови, проверка доноров и препаратов крови на ВИЧ и т. д.); санитарно-просветительной работе. С целью ограничения распространения ВИЧ-инфекции Минздравом утверждены соответствующие правила медицинского освидетельствования на выявление заражения вирусом иммунодефицита человека, регламентирующие комплекс профилактических мероприятий по борьбе с этой чрезвычайно опасной болезнью.
Конкретне цели:
Знать эпидемиологическую ситуацию на заболеваемость ВИЧ в Украине.
Знать классификацию ретровирусов и патогенных для человека представителей рода Lentivirus.
Объяснить почему вирусы называются ретровирусами.
Изучить пути передачи ВИЧ-инфекции и ее патогенез.
Ознакомиться с методами лабораторной диагностики и научиться трактовать результаты исследования.
Выучить препараты для лечения ВИЧ-инфекции.
Проводить отбор материала для лабораторных исследований в соответствии со стадией заболевания ВИЧ/СПИД.
Правильно оценивать результаты методов лабораторной диагностики и делать выводы.
Теоретические вопросы:
Особенности строения ВИЧ. Антигенная структура.
Группы риска, пути заражения и патогенез ВИЧ-инфекции.
Клетки-мишени ВИЧ, механизм иммуно-супрессивного действия ВИЧ.
Стадии ВИЧ-инфекции. ВИЧ-ассоциированные инфекции.
Лабораторная диагностика ВИЧ-инфекции и СПИДа.
Перспективы иммунопрофилактики ВИЧ-инфекции.
Этиотропная терапия, механизм действия антиретровирусных препаратов.
Практические задания, выполняемые на занятии:
Зарисовка в протокол структуры ВИЧ.
Изучение по таблице метода ИФА.
Ознакомление с лабораторией и аппаратурой для постановки ИФА.
Пяткін К.Д., Кривошеїн Ю.С. Мікробіологія з вірусологією та імунологією.– Київ.: Вища шк., 1992.– 431с.
Воробьев А.В., Биков А.С., Пашков Е.П., Рыбакова А.М. Микробиология.– М.: Медицина, 1998.– 336с.
Медицинская микробиология /Под ред. В.И. Покровского.– М.: ГЭОТАР-МЕД, 2001.– 768с.
Тимаков В.Д., Левашев В.С., Борисов Л.Б. Микробиология /Учебник.– 2-е изд., перераб. и доп.– М.: Медицина, 1983,- 512с.
Дополнительная литература:
Тiтов М.В. Iнфекцiйнi хвороби.- К., 1995.– 321с.
Шувалова Е.П. Инфекционные болезни.- М.: Медицина, 1990.- 559 с.
Гайдаш І.С., Флегонтова В.В. Медична вірологія.– Луганськ, 2002.– 357 с.
Короткие методические указания к практическому занятию:
В начале занятия проводится проверка уровня знаний студентов по теме.
Самостоятельная работа состоит из изучения структуры вируса по рисункам, слайдам и зарисовки ее в протокол. Дальше студенты знакомятся с лабораторией и аппаратурой для ИФА, по таблицам изучают иммуноферментный метод диагностики.
В конце занятия проводится тестовый контроль и анализ итоговых результатов самостоятельной работы каждого студента.
В 80-х гг. было установлено, что целый ряд заболеваний - от инфекционной эритемы и острого артрита у здоровых в остальном людей до апластических кризов и хронической анемии у ослабленных больных - обусловлены парвовирусной инфекцией. У беременных она может привести к внутриутробной инфекции, водянке плода и его гибели.
Многие тяжелые проявления парвовирусной инфекции связаны с размножением парвовируса в клетках эритроидного ростка костного мозга и их разрушением.
Что провоцирует / Причины Парвовирусной инфекции:
К семейству парвовирусов относится несколько видоспецифических вирусов животных.
Для человека патогенен только парвовирус В19, названный номером образца сыворотки человека, из которой он был впервые выделен. Это мелкий вирус диаметром 20-25 нм без внешней оболочки. Икосаэдрический капсид из двух структурных белков окружает одну плюс- или минус-цепь ДНК. Парвовирус В19 высокоустойчив: он сохраняет жизнеспособность при 16-часовом нагревании при 60°С. В культурах клеток, обычно применяющихся в лабораторной практике, он не размножается и инфекции у лабораторных животных не вызывает. Культивировать его удается в клетках-предшественниках эритроцитов, полученных из костного мозга человека, крови, пуповины или печени плода.
Парвовирусные заболевания встречаются в любое время года, но наиболее распространенное из них - инфекционная эритема - чаще дает вспышки в школах зимой и весной. При таких вспышках заболевает 20-60% детей и еще у многих инфекция протекает бессимптомно.
По данным массовых серологических исследований, антитела к парвовирусу В19 имеют около половины взрослых. Процент серопозитивных лиц быстро повышается с 5 до 18 лет и продолжает возрастать в дальнейшем, что указывает на заражение также и взрослых. Больные заразны в фазе виремии, когда вирус обнаруживают в мазках из зева, секрете дыхательных путей и сыворотке.
Очень заразны больные с апластическими кризами: описана вспышка инфекционной эритемы среди медицинских сестер, в которой несомненным источником инфекции был такой больной. Больные инфекционной эритемой значительно менее заразны.
Механизм передачи инфекции в естественных условиях неясен. По-видимому, она передается воздушно-капельным путем или при непосредственном контакте. Возможно также заражение при инфузии препаратов факторов свертывания, даже обработанных паром и сухим нагреванием.
Патогенез (что происходит?) во время Парвовирусной инфекции:
Благодаря исследованиям на добровольцах известно, что парвовирусная инфекция имеет две фазы.
Первая фаза совпадает с виремией, развивающейся примерно через 6 сут после интраназального введения вируса восприимчивым (серонегативным) лицам. Виремия продолжается около 1 нед; в первые 2-3 сут наблюдаются общие симптомы (головная боль, недомогание, миалгия, озноб, лихорадка, зуд), ретикулоцитопения. В этот период вирус выделяется с секретами дыхательных путей. Через несколько дней происходит незначительное снижение уровня гемоглобина, сохраняющееся в течение 7-10 сут. Исследование костного мозга в этот период выявляет значительное обеднение эритроидного ростка. Иногда бывают легкие лимфопения, нейтропения и тромбоцитопения.
Вторая фаза заболевания наступает через 17-18 сут после заражения. К этому времени виремия прекращается, появляются специфические IgM-антитела. Зги антитела через несколько месяцев исчезают. На несколько дней позже IgM появляются IgG-антитела, которые сохраняются неопределенно долго. В этой фазе вирус из секрета носоглотки исчезает, количество ретикулоцитов в крови нормализуется, в течение 2-3 сут наблюдается пятнисто-папулезная сыпь, на 1-2 сут дольше - артралгия или артрит.
Упомянутые выше исследования показали, что у здоровых людей парвовирусная инфекция быстро проходит без лечения. Ее клинические проявления - инфекционная эритема и артрит - почти несомненно обусловлены образованием иммунных комплексов. В пользу этого предположения свидетельствует развитие инфекционной эритемы у больных с хронической виремией при введении им нормальных иммуноглобулинов.
У больных с хронической гемолитической анемией или иммунодефицитом парвовирусная инфекция часто протекает тяжело, сопровождаясь обширным разрушением эритроидного ростка костного мозга. В то время как здоровые люди легко переносят прекращение эритропоэза на 7-10 сут, при гемолитической анемии, когда компенсация достигается за счет усиленного эритропоэза, разрушение клеток-предшественников эритроцитов обычно приводит к тяжелому апластическому кризу. У больных с иммунодефицитом виремия не прекращается, развивается тяжелая хроническая анемия вследствие постоянного заражения вирусом клеток эритроидного ростка.
Водянка плода при внутриутробной инфекции объясняется его потребностью в значительно более напряженном, чем у взрослых, эритропоэзе в сочетании с незрелостью иммунной системы.
Парвовирус В19 избирательно прикрепляется к мембранному рецептору эритроцитов - антигену Р, чем и объясняется тропность этого вируса к клеткам-предшественникам эритроцитов, особенно к эритробластам и нормобластам. У немногочисленных лиц, не имеющих антигена Р, парвовирус В19 инфекции не вызывает.
Симптомы Парвовирусной инфекции:
Инфекционная эритема (пятая болезнь) - это самое частое проявление парвовирусной инфекции; она встречается в основном у детей и известна также под названием "пятая болезнь", данным ей в конце XIX века как одной из шести детских инфекций, сопровождающихся сыпью.
Протекает заболевание легко. Яркая пятнистая сыпь появляется на щеках ("нашлепанные" щеки). Иногда высыпаниям предшествует субфебрильная температура. Сыпь обычно пятнисто-папулезная и имеет сетчатый, кружевной вид; она быстро распространяется на конечности. Иногда сыпь кореподобная, везикулярная, геморрагическая или сопровождается зудом. Обычно она проходит примерно через неделю, но на протяжении последующих недель могут появляться преходяшие высыпания, особенно при волнении, физической нагрузке, пребывании на солнце, купании, изменении окружающей температуры.
Острая артралгия и артрит - редкие у детей, но частые у взрослых проявления парвовирусной инфекции. Сыпь у взрослых, наоборот, нередко отсутствует или нетипичная - без характерной эритемы на лице. В большинстве случаев артрит симметрично поражает периферические суставы (коленные, суставы кисти и запястья) и обычно проходит через 3 нед, не оставляя деструктивных изменений. Однако у некоторых больных он держится несколько месяцев, в редких случаях - несколько лет. Неизвестно, обусловлен ли затяжной артрит хронической инфекцией или аутоиммунными реакциями. Описаны единичные случаи, в которых предполагается (но не доказана) связь парвовирусной инфекции с идиопатической тромбопитопенической пурпурой, гемофагоцитарным синдромом, панцитопенией, артритом, подобным поражению суставов при лаймской болезни, с рецидивирующей парестезией, фибромиалгией, СКВ, системными васкулитами (в том числе узелковым периартериитом, гранулематозом Вегенера, болезнью Кавасаки).
Парвовирусная инфекция - причина большинства внезапных апластических кризов при почти всех хронических гемолитических анемиях, в том числе серповидноклеточной анемии, ферментопатиях, наследственном микросфероцитозе, талассемиях, пароксизмальной ночной гемоглобинурии, аутоиммунной гемолитической анемии. Кроме того, парвовирусная инфекция может вызвать апластический криз у больных с острой кровопотерей.
Кризы сопровождаются тяжелой анемией с бледностью, слабостью, сонливостью. Часто за неcколько дней до криза отмечаются общие симптомы. Глубокая ретикулоцитопения держится 7-10 сут. Клетки эритроидного ростка в костном мозге отсутствуют, хотя клеток гранулоцитарно-моноцитарного ростка достаточно. Уровень гемоглобина может упасть до угрожающего жизни предела, требующего неотложного переливания крови.
В отличие от инфекционной эритемы и артрита апластический криз сопровождается виремией, и такие больные заразны.
У больных с иммунодефицитом, вероятно, из-за неспособности вырабатывать в достаточном количестве IgG-антитела, парвовирус В19 не элиминуеруется из организма. Развивается хроническая инфекция с разрушением клеток-предшественников эритроцитов в костном мозге и анемией, требующей регулярных переливаний крови. Такая анемия описана при ВИЧ-инфекции, врожденных иммунодефицитах, поддерживающей химиотерапии острого лимфобластного лейкоза, у реципиентов костного мозга.
Хроническая парвовирусная инфекция может быть причиной идиопатической аплазии эритроидного ростка. Анемия, обусловленная этой инфекцией, иногда бывает единственным проявлением нераспознанного иммунодефицита. Анемия может протекать волнообразно; ее удается излечить или добиться улучшения с помощью нормальных иммуноглобулинов. Спектр иммунодефицитов, при которых наблюдается хроническая анемия, вызванная парвовирусом В19, и распространенность подобного сочетания пока не изучены.
В большинстве случаев парвовирусная инфекция у беременных не приводит к инфицированию плода и вредного воздействия на него не оказывает. Однако почти у 10% беременных, перенесших парвовирусную инфекцию, плод погибает от неиммунной водянки. Смерть плода наступает от тяжелой анемии и сердечной недостатости. Вирус обнаруживают в тканях плода, особенно в эритробластах и нормобластах. Беременным, которые могут заразиться парвовирусом В19, необходимо периодически определять титр IgM и уровень альфа-фетопротеина и проводить повторные УЗИ, чтобы своевременно выявить водянку плода. В некоторых случаях плод переносит водянку и рождается здоровым или, реже, - с врожденной анемией и гипогаммаглобулинемией, не поддающейся лечению нормальными иммуноглобулинами.
Диагностика Парвовирусной инфекции:
Парвовирусную инфекцию обычно подтверждают измерением титров специфических IgM и IgG с помощью готовых наборов для ИФА. Иногда выделяют вирус из сыворотки или тканей или выявляют в них вирусные антигены и ДНК. Об острой инфекции свидетельсвуют характерная клиническая картина и высокий титр IgM или выделение самого вируса, о давно перенесенной - высокий титр IgG.
При инфекционной эритеме и остром артрите вирус из сыворотки обычно не удается выделить, но титр IgM высокий. При апластических кризах параллельно с высоким титром IgM в сыворотке определяют большое количество вируса или eго ДНК. В костном мозге обнаруживают характерные гигантские эритробласты и гипоплазию эритроидного ростка. У больных с иммунодефицитом антитела часто не удается определить но в сыворотке обнаруживают вирус или его ДНК.
Диагноз внутриутробной инфекции подтверждает водянка плода при наличии в околоплодных водах или крови плода вирусной ДНК в сочетании с высоким титром специфических IgM у беременной.
Лечение Парвовирусной инфекции:
Инфекционная эритема и артрит в большинстве случаев лечения не требуют. При тяжелом, в частности затяжном, артрите используют НПВС. При апластическом кризе обычно требуются переливания эритроцитарной массы. При анемии у больных с иммунодефицитом применяют нормальный иммуноглобулин для в/в введения, содержащий антитела к парвовирусу В19. С его помощью удается добиться излечение или хотя бы подавления парвовирусной инфекции.
Профилактика Парвовирусной инфекции:
При контакте с парвовирусной инфекцией профилактическое применение этого препарата показано больным с иммунодефицитом и хронической гемолитической анемией и беременным, однако действенность такой иммунопрофилактики, проведенной непосредственно перед или сразу после заражения, не установлена.
Чтобы уменьшить вероятность заражения, лицам группы риска следует мыть руки перед едой и после контакта с больными.
Больные с апластическим кризом и хронической инфекцией, вызванной парвовирусом В19, в отличие от больных инфекционной эритемой и артритом представляют собой источник больничной инфекции. Их госпитализируют в отдельные палаты и соблюдают контактную и респираторную изоляцию.
Вакцина против парвовируса В19 пока не создана, но исследуется возможность ее получения с помощью зараженной рекомбинантным бакуловирусом линии клеток насекомых, которая экспрессирует белки капсида парвовируса В19, не вызывающие заболевание, но обладающие иммуногенными свойствами.
К каким докторам следует обращаться если у Вас Парвовирусная инфекция:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Парвовирусной инфекции, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Ретровирусы. Семейство ретровирусов. Виды ретровирусов.
Ретровирусы содержат две идентичные молекулы геномной РНК и РНК-зависимую ДНК-полимеразу (обратную транскриптазу, ревертазу). Ретровирусы выделены от множества видов животных и проявляют разнообразный спектр патогенного потенциала. Семейство включает вирусы 7 родов: альфа-, бета-, гамма-, дельта-, эпсилонретровирусы, лентивирусы и спумавирусы. Семейство включает вирусы, патогенные для человека и многих видов животных.
Большинство ретровирусов обладают выраженным тропизмом к клеткам лимфОретикулярной и гемопоэтической системы. Ретровирусы у специфических для них видов животных встречаются повсеместно. В борьбе с ретровирусными инфекциями основной мерой является предотвращение передачи вируса.
Вирионы ретровирусов представляют собой округлые оболочечные частицы диаметром 80—100 нм, обладающие уникальной трехслойной структурой. Центральная часть вириона представлена нуклеопротеиновым комплексом, который включает около 30 молекул ревертазы и имеет спиральную симметрию. Эта структура окружена икосаэдрическим капсидом диаметром около 60 нм, покрытым оболочкой, происходящей из мембраны клетки, от которой отходят гликопротеиновые пепломеры. Лентивирусы имеют на поверхности примерно 72 шишкоподобных пепломера длиной около 10 нм с яйцевидным концевым уплотнением.
Ретровирусы имеют диплоидный геном, представляющий инвертированный димер из двух молекул линейной позитивной полярности, оцРНК; каждая молекула содержит 7-11 тн и имеет полиА последовательность на З'-конце и КЭП-структуру на 5'-конце. Детальная организация геномов разных ретровирусов широко варьирует.
Геном ретровирусов уникален в следующих отношениях:
1) является единственным диплоидным;
2) вирусная РНК синтезируется и изменяется с помощью механизма, изменяющего клеточную мРНК;
3) это единственный геном, связанный со специфическим переносом функции РНК целиком к первичной репликации;
4) это единственная оц(+)РНК, которая не является мРНК вскоре после инфекции;
5) это единственный геном, кодирующий обратную транскриптазу, которая сама по себе уникальна.
Среди многих своих функций обратная транскриптаза служит в качестве РНК-зависимой ДНК полимеразы, а ДНК-зависимая ДНК полимераза, интеграза и РНКаза, каждая в меру своей определенной функции, представляют различную часть белковой молекулы. Геном недефектных ретровирусов содержит три разных гена, каждый из которых кодирует два и более белка. Gag ген кодирует вирионные коровью белки, pol ген кодирует обратную транскриптазу, a env ген кодирует вирионные пепломерные белки. Геном кодирует также несколько определенных вирионных компонентов.
Геном быстро трансформирующих ретровирусов содержит четвертый ген — вирусный онкоген (v-onc). Присутствие онкогена обычно связано с делецией в другом месте генома, обычно в env гене, так что большинство v-onc содержащих вирусов не способны синтезировать полностью оболочку и поэтому являются дефектными по репликации. Они всегда находят связь с недефектными вирусами, которые реплицируются полностью и функционируют в качестве помощников. Вирус саркомы Рауса является исключением. Его геном содержит вирусный онкоген v-src и также полные gag, pol и env гены, и поэтому является репликативнокомпетентным.
Vpu, vpr и vpx найдены в лентивирусах приматов. Vpu способствует созреванию вирусных гликопротеинов и освобождению вирионов почкованием; Vpr -слабый активатор транскрипции; Vpx, по-видимому, способствует репликации в Т-лимфоцитах и макрофагах.
При продуктивной инфекции вирионы формируются и освобождаются почкованием через плазматическую мембрану. Некоторые ретровирусы вызывают образование опухолей.
Спумавирусы являются необычными ретровирусами во многих отношениях. Они выделены от человека, обезьян, КРС, кошек, морских львов и хомяков. Они представляют проблему, когда контаминируют клеточные культуры, но их связь с заболеваниями неизвестна. Существует мнение, что пенящие вирусы ближе стоят к ДНК гепаднавирусам.
Эндогенный ретровирус свиней (PERV) найден у всех исследованных пород свиней. Известны три субгруппы этого вируса: А, В и С. Все свиньи содержат множественные провирусы (около 50) в своем геноме. PERVлатентно инфицирует многие культуры клеток свиньи и, реже, человека. Патогенность этого вируса не установлена.
Онковирусы, в отличие от лентивирусов, реплицируются в делящихся клетках. В составе ретровирусов обнаружено 11-13 белков. Часть из них локализована в сердцевине, а главный внутренний белок Р27 - Р30 - в мембране, окружающей РНК. В составе липопротеиновой оболочки 2-5 гликопротеинов, из которых более крупный образует головку шипика и является главным компонентом оболочки, а более мелкие белки образуют отросток, погруженный в билипидный слой. Различные белки ответственны за групповую и типовую специфичность. Подгрупповые и типоспецифические антигены связаны с наружными гликопротеинами и выявляются в РН, РСК, ИФ и РИД. Группоспецифические антигены связаны с белками сердцевины. Их обнаруживают в РСК, ИФ и РИД. Главный внутренний белок Р27 - РЗО - основной группоспецифический антиген, общий для всех ретровирусов птиц или млекопитающих, относящихся к одной группе.
Согласно предложенной ранее номенклатуре структурные белки ретровирусов обозначали следующим образом: МА - матриксный, СА - капсидный, NC -белок нуклеокапсида, SU - поверхностный, ТМ - трансмембранный, PR- протеаза, RT - ревертаза, IN - белок интеграции.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инфекция вируса иммунодефицита человека (ВИЧ): диагностика, лечение, профилактика
Вирус иммунодефицита человека (ВИЧ) — сферический оболочечный РНК-ретровирус, образующий при помощи обратной транскриптазы ДНК-копию вирусной РНК. Последняя встраивается в ядро клетки хозяина и служит шаблоном для производства последующих вирусных РНК. Для репликации возбудителя необходимы три гена: gag, pol и env. ВИЧ определяют как лентивирус.
Патогенными для человека считают ВИЧ-1 (наиболее распространённый) и ВИЧ-2 (регистрируют в основном на территории Западной Африки), которому свойственна меньшая вирулентность.
Эпидемиология ВИЧ-инфекции. ВИЧ-инфекция распространена во всём мире. Передача вируса осуществляется парентеральным и половым путём. В группу риска входят пациенты, ведущие беспорядочную половую жизнь (особенно при наличии изъязвлений на слизистой оболочке половых органов). В развитых странах чаще всего жертвами ВИЧ становятся мужчины (гомосексуалисты и наркоманы).
Передачу вируса между гетеросексуальными партнёрами встречают реже. В развивающихся странах ВИЧ обычно распространяется при гетеросексуальных связях, переливании неисследованной заражённой крови и использовании инфицированного медицинского инструментария. Возможна передача инфекции от матери к плоду.
Патогенез инфекции вируса иммунодефицита человека. Сначала вирус поражает клетки, обладающие СD4-рецепторами (например, Т-лимфоциты, макрофаги). Затем следует репликация, приводящая к сокращению количества здоровых Т-лимфоцитов и снижению клеточного иммунитета. Различные штаммы вируса имеют разное сродство к клеткам с различными хемокиновыми рецепторами.
При снижении Т-клеточного иммунитета также уменьшается активность В-лимфоцитов. Кроме того, ВИЧ поражает нейроны, стимулирует выделение большого количества цитокинов, способствующих дальнейшему повреждению нервной системы. Большинство клинических признаков при ВИЧ-инфекции связано со вторичными инфекционными заболеваниями, возникающими вследствие снижения иммунитета (уменьшение СD4-клеток).
Клинические признаки инфекции вируса иммунодефицита человека. Через несколько недель после заражения возникает мононуклеозоподобный синдром, сопровождающийся появлением сыпи, лихорадки и лимфаденопатии. Затем следует латентный период, который может продолжаться 10—15 лет.
ВИЧ-инфекция
Диагностика инфекции вируса иммунодефицита человека. Диагноз ВИЧ-инфекции подтверждают двумя серологическими методами: ИФА и постановкой иммуноблоттинга (вестерн-блоттинга), направленных на определение специфических антител. РНК вируса определяют с помощью ПЦР.
При обследовании пациенты с подозрением на ВИЧ должны получать исчерпывающую консультацию врача. Поскольку сероконверсия может продолжаться в течение 3 мес, при первоначальном отрицательном результате необходимо провести повторный анализ.
Лечение необходимо сопровождать регулярным измерением вирусной нагрузки. Вирус может расти в лимфоцитах, но это не используют в диагностических целях.
Лечение инфекции вируса иммунодефицита человека
Для лечения ВИЧ-инфекции применяют:
• нуклеозидные ингибиторы обратной транскриптазы (например, зидовудин);
• ненуклеозидные ингибиторы обратной транскриптазы (например, невирапин);
• ингибиторы протеаз (например, индинавир). Основные три направления лечения:
• торможение вирусной репликации;
• предупреждение появления устойчивых форм;
• повышение иммунитета пациента.
Терапию начинают проводить пациентам с выраженными симптомами, при развитии заболеваний, вызванных условно-патогенной микрофлорой, а также при снижении количества клеток с CD4-рецепторами ниже 0,2x10 9 /л. При показателях выше 0,2x10 9 /л и ниже 0,35x10 9 /л необходимо тщательно продумать тактику лечения (с учётом риска развития побочных эффектов и состояния пациента).
Существуют разнообразные режимы лечения ВИЧ-инфекции. На начальном этапе обычно применяют:
• ненуклеозидный ингибитор обратной транскриптазы + два препарата из группы нуклеозидных ингибиторов обратной транскриптазы;
• ингибитор протеазы + нуклеозидный ингибитор обратной транскриптазы.
При заражении устойчивыми штаммами слудует соблюдать осторожность и применять нестандартные методы, основанные на индивидуальном подходе. В связи с тем что РНК-вирусы не имеют достаточно эффективных генетических механизмов коррекции, мутации, приводящие к образованию устойчивых штаммов, происходят достаточно быстро.
В начале лечения происходит повышение иммунитета, поэтому в связи с усилением иммунного ответа симптомы сопутствующих заболеваний могут усилиться.
Профилактика ВИЧ-инфекции. Для профилактики заражения необходимо избегать половых контактов с лицами, входящими в группу риска, и незащищённых половых связей (без использования барьерной контрацепции). Кроме того, необходимо тщательно исследовать донорскую кровь и уничтожать её образцы, подозрительные на ВИЧ-инфекцию.
Снижению риска заражения среди наркоманов способствуют программы медицинского просвещения и пропаганда использования одноразовых шприцев и игл. К сожалению, разнообразие антигенов вируса делает невозможным создание эффективной вакцины. При случайных проколах кожи медицинскими иглами необходимо проходить профилактический курс антиретровирусной терапии. Риск передачи инфекции от матери к плоду можно снизить с помощью проведения эффективной антиретровирусной терапии, правильно выполненного кесарева сечения и отказа от кормления грудью.
При отсутствии возможности проведения высокоактивной антиретровирусной терапии (в развивающихся странах) лечение проводят коротким курсом для снижения риска передачи инфекции.
У пациентов с ВИЧ-инфекцией развиваются тяжёлые кандидозы кожи и слизистых оболочек, сопровождающиеся изъязвлением слизистой оболочки ротовой полости и поражением пищевода, что приводит к дисфагии и существенной потере массы тела. Для лечения острой инфекции назначают приём внутрь флуконазола, но при длительной терапии часто развивается устойчивость возбудителей. Кроме того, очень серьёзной проблемой считают криптококковый менингит.
Инфекция Toxoplasma gondii у ВИЧ инфицированных. Инфекция персистирует в организме на протяжении длительного времени. Снижение иммунитета приводит к активации возбудителя и развитию различных патологических процессов (объёмные образования головного мозга, сопровождающиеся энцефалитом и др.).
При энцефалите отмечают высокую температуру, головные боли, судороги, неврологические расстройства. Возможно развитие комы. При компьютерной томографии обнаруживают множественные фокальные очаги кольцевидной формы. Исследуемый материал — биоптат мозга. Методы диагностики — культивирование возбудителя, полимеразная цепная реакция. Для лечения энцефалита применяют пириметамин + сульфадиазин. После выздоровления необходимо проведение курса поддерживающей терапии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Экзогенные ретровирусы. Эндогенные ретровирусы. Свойства ретровирусов.
Экзогенные ретровирусы распространяются горизонтально, и большинство из них не содержит ген onс. К экзогенным вирусам относят вирус саркомы Рауса, Т-лимфотропные вирусы человека и др. Т-лимфотропные вирусы человека I и II типов, или HTLV-I и HTLV-II [от англ. human t-lymphotropic virus, Т-лимфотропный вирус человека], получили своё название из-за избирательной тропности к су б популяции СБ4+-лимфоцитов.
HTLV стали первыми вирусами, участие которых в развитии опухолей человека было более или менее достоверно доказано. HTLV-I вызывает Т-клеточные лимфомы и миелопатии (тропический спастический пара парез) у взрослого населения юго-запада Японии и стран Карибского бассейна. Эпидемиология инфекций, вызванных HTLV-I, напоминает эпидемиологию ВИЧ-инфекции, так как вирус передаётся половым путём и парентерально.
Основные группы риска — наркоманы, пациенты с гемофилией, гомосексуалисты и лица, практикующие бисексуальные контакты. Прямых доказательств патогенного действия HTLV-II нет, однако инфицирование вирусом связывают с развитием волосатоклеточного лейкоза.
Т-лимфотропные вирусы обладают сравнительно низким онкогенным потенциалом и не проявляют непосредственного трансформирующего действия, так как не содержат ген onс. Вирусный геном интегрируется рядом с геном, кодирующим синтез ИЛ-2. Вирусный промотор активирует избыточную продукцию цитокина, усиливающего пролиферацию Т-лимфоцитов. Кроме генов gag, pol и env, общих для всех ретровирусов, HTLV имеют дополнительный ген рХ. Продукты генов env, рХ задействованы в индукции бесконтрольной пролиферации Т-клеток.

Эндогенные ретровирусы
Часть ретровирусов приобрела способность передаваться вертикально, а их генетическая информация стала составной частью клеточного генома всех органов и тканей человека и животных. Интегрированный онкогенный ировирус может содержать гены, необходимые для формирования полноценного вириона, но в большинстве случаев ведёт себя как группа генов, находящихся под регуляторным контролем клетки. Однако клеточный контроль обычно приводит к частичному или полному подавлению экспрессии вирусных генов.
Активация эндогенных ретровирусов может возникать спонтанно либо под воздействием внешних факторов. По своей организации (расположение кодирующих нуклеотидных последовательностей и др.) эндогенные и экзогенные провирусы ретровирусов сходны; но эндогенные вирусы не патогенны для природных хозяев и редко инфекционны для родительских клеток.
В эксперименте онкогенный потенциал эндогенных ретровирусных последовательностей может реализоваться через трансформацию клеток (после захвата вирусами клеточных протоон ко генов) либо активацию клеточных протоонкогенов вирусными LTR.
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

