Риккетсии окраска по романовскому гимзе
Обновлено: 23.04.2024
Для окраски отдельных групп микроорганизмов используют специальные методы окраски: Романовского-Гимзы, Здродовского и др.
Метод Романовского-Гимзы.Относится к сложным, универсальным методам окраски Его применяют для обнаружения нуклеоида бактерий, а также окраски спирохет, хламидий, риккетсий, простейших и мазков крови. Этапы окраски:
1. На мазок нанести рабочий раствор красителя (2 капли красителя на 1 мл дистиллированной воды), состоящего из смеси основного метиленового синего, азура и кислого эозина на 10-20 минут.
2. Препарат промыть и высушить.
ДНК нуклеоида окрашивается метиленовым синим и азуром в сине-фиолетовый цвет, цитоплазма клетки - эозином в розовый цвет. Представители разных родов спирохет окрашиваются в разные цвета по методу Романовского-Гимзы: боррелии – в сине-фиолетовый, трепонемы – бледно-розовый (T.pallidum – бледная трепонема), лептоспиры – красно-розовый.
Метод Здродовского используется для окраски риккетсий, являющихся облигатными внутриклеточными паразитами и вызывающими различные риккетсиозы. Этапы окраски:
1. Окрасить мазок разведенным фуксином Циля (10-15 капель на 10 мл дистиллированной воды) в течение 5 минут, промыть водой
2. Обработать мазок 0,5% раствором лимонной кислоты или 0,01% раствором хлористоводородной кислоты, промыть водой.
3. Окрасить метиленовым синим в течение 1 минуты.
4. Промыть водой и высушить препарат.
Риккетсии, окрашенные по методу Здродовского, имеют красный цвет, цитоплазма клеток, в которых они паразитируют – голубая, ядра – синие.
3. Изучение подвижности микроорганизмов
Виды микроскопии
Иммерсионная микроскопия.Применяется для увеличения разрешающей способности метода световой микроскопии. Разрешающая способность системы светооптической микроскопии определяется длиной волны видимого света и числовой апертурой системы. Числовая апертура показывает величину угла максимального конуса света, попадающего в объектив, и зависит от оптических свойств (преломляющей способности) среды между объектом и линзой объектива. Погружение объектива в среду (минеральное масло), имеющую высокий коэффициент преломления, близкий к таковому у стекла, препятствует рассеиванию света от объекта. Таким образом достигается увеличение числовой апертуры и соответственно разрешающей способности. Для иммерсионной микроскопии применяют специальные иммерсионные объективы, маркированные черной полосой и снабженные меткой (МИ – масляная иммерсия).
Фазово-контрастная микроскопия.Предназначена для изучения нативных (живых и неокрашенных) препаратов за счет повышения их контрастности. При прохождении света через окрашенные объекты происходит изменение амплитуды световой волны, а при прохождении через неокрашенные объекты – фазы световой волны, что используют для получения высококонтрастного изображения. Для повышения контрастности фазовые кольца покрывают металлом, поглощающим прямой свет, не влияя на сдвиг фазы. В оптической системе микроскопа применяют специальный конденсор с револьвером диафрагм и центрирующим устройством. Неокрашенные объекты выглядят темными на светлом поле (позитивный фазовый контраст) или светлыми на темном фоне (негативный фазовый контраст).
Люминесцентная (флюоресцентная) микроскопия. Метод основан на явлении фотолюминесценции. Люминесценция (флюоресценция) – это способность некоторых объектов или веществ светиться при воздействии ультрафиолетового или другого коротковолнового излучения. При этом испускаемые световые волны длиннее волны, вызывающей свечение. Иными словами, флюоресцирующие объекты поглощают свет одной длины волны и излучают в другой области спектра. Например, если индуцирующее излучение синее, то образующееся свечение может быть красным или желтым. Различают первичную и вторичную люминесценцию. Первичная люминесценция (биолюминесценция) наблюдается без предварительного окрашивания за счет собственных люминесцирующих веществ, вторичная – возникает после окрашивания флюорохромами (ауромин, корифосфин).
Люминесцентная микроскопия по сравнению с обычными методами обладает рядом преимуществ: возможностью исследовать живые микробы и обнаруживать их в исследуемом материале в небольших концентрациях вследствие высокой степени контрастности. Люминесцентная микроскопия нашла широкое применение для визуализации результатов иммунохимических реакций, основанных на специфическом взаимодействии меченых флюоресцирующими красителями антител с антигенами изучаемого объекта.
Наиболее широко используются два способа электронной микроскопии: просвечивающая (трансмиссивная) и сканирующая. Просвечивающая электронная микроскопия применяется для изучения ультратонких срезов микробов, тканей, а также строения мелких объектов (вирусов, жгутиков и др.), контрастированных фосфорно-вольфрамовой кислотой, уранилацетатом, напылением металлов в вакууме и др. Сканирующая электронная микроскопия применяется для получения трехмерного изображения поверхности исследуемого объекта.
Эпидемический вшивый сыпной тиф. Возбудитель сыпного тифа R. prowazekii был открыт в 1913 г. чешским исследователем Провачеком, который погиб в результате лабораторного заражения сыпным тифом. Эпидемический сыпной тиф — антропоноз. Источник инфекции — человек, больной сыпным тифом или болезнью Брилля-Цинссера, который заразен с последних 2–3 дней инкубационного периода.
Передача инфекции осуществляется трансмиссивно через платяных, реже — головных вшей. Вошь, насосавшись крови больного, приобретает красный цвет (кровяная имбибиция вши) и через 3–4 часа становится заразной. Теоретически вошь способна передавать инфекцию в течение своей жизни (вошь живет 40–45 дней), но практически заразительный период вши значительно короче, так как через 2 нед после инфицирования она погибает от риккетсиозной инфекции.
Риккетсии, попавшие при сосании крови в желудок, размножаются в клетках эпителия желудка или тонкой кишки вши. Пораженные клетки разрушаются, возбудитель выделяется с испражнениями вши. При самом укусе вши заражения человека не происходит, так как возбудитель в слюнных железах отсутствует. Необходимо втирание экскрементов или раздавливание кишечника вши и попадание содержимого кишечника в ранки от укусов или в расчесы и ссадины на коже. Слюна вшей вызывает жжение и зуд, при расчесывании мест укуса риккетсии поступают в организм, при этом также открываются ворота для вторичной инфекции.
Описаны случаи аэрогенного заражения людей сыпным тифом при вдыхании пыли с высохшими испражнениями, содержащими риккетсий.
В организме человека риккетсии адгезируются на эндотелии сосудов, проникают в эндотелиоциты и размножаются. В течение инкубационного периода (12–14 дней) происходит накопление возбудителя. Сильнейший эндотоксин риккетсий проявляет действие при их жизни, после гибели интоксикацию не вызывает.
При разрушении эндотелиоцитов риккетсии поступают в кровь и повреждают интактные эндотелиальные клетки. В наибольшей степени поражаются капилляры, на стенках которых возникают специфические узелки-гранулемы, развиваются васкулиты. Образование тромбов приводит к нарушению микроциркуляции. Наиболее выраженные изменения капилляров происходят в ЦНС, особенно в головном мозге, что приводит к сильным головным болям. Из-за поражения сосудов кожи появляется розеолезно-петехиальная сыпь.
Болезнь Брилля-Циннсера — рецидив эпидемического сыпного тифа. При недостаточно напряженном иммунитете риккетсии в виде покоящихся малых форм могут длительно персистировать в клетках ретикулоэндотелиальной системы. При снижении резистентности организма носителя возможна эндогенная активация покоящихся форм: малые формы переходят в вегетативные, давая рецидив заболевания (болезнь Брилля-Цинссера). Присоединение в этот период переносчика-вши может способствовать распространению свежих случаев сыпного тифа.
Эндемический крысиный сыпной тиф — природно-очаговый зооноз. Резервуаром возбудителей являются крысы, переносчики — блохи, вши, клещи. Пути заражения людей: трансмиссивный, воздушно-капельный, алиментарный.
Методы изучения морфологии риккетсий:
Микроскопия препаратов из крови, органов (трупный материал), вшей, окрашенных по Романовскому-Гимзе (риккетсии сиренево-синие на фоне голубой клетки) или методом серебрения по Морозову ( риккетсии черные).
Для дифференциации риккетсий применяется метод окраски по Здродовскому:
тонкие фиксированные мазки окрашиваются водным карболовым фуксином Циля 5 мин;
промывают водой и 1–3 сек обрабатывают 0,5% раствором лимонной кислоты;
промывают водой и докрашивают 10 сек 0,5% водным раствором метиленового синего;
промывают водой, высушивают и микроскопируют: риккетсии окрашиваются в рубиново-красный цвет и легко обнаруживаются на фоне голубой цитоплазмы и синего ядра клеток (рис. 50).
Техника. Препарат обрабатывают I N раствором НС1 7 мин при подогревании до 60С. После промывания мазок окрашивают по Романовскому.
Микроскопическая картина. Ядерные элементы темно-красные, цитоплазма розовая.
Окраска риккетсий Метод Романовского-Гимза
Окраска по Романовскому-Гимза является одним из основных методов при изучении морфологии риккетсий, хламидий, спирохет, простейших, а также при исследовании форменных элементов крови.
Техника. Краситель Романовского-Гимза состоит из азура, эозина и метиленового синего. Непосредственно перед употреблением к 10 мл дистиллированной воды нейтральной реакции прибавляют 10 капель краски и тотчас же наливают на препарат, предварительно фиксированный жидким фиксатором, на один час. Затем краску сливают, препарат промывают водой, высушивают на воздухе и микроскопируют. Окрашивание происходит быстрее (30-40 минут), если препарат с краской поместить в термостат при 37С. К 10 мл дистиллированной воды нейтральной или слабо щелочной реакции непосредственно перед окраской препарата прибавляют 10 капель краски и тот час же наливают на фиксированный препарат (или погружают препарат в стаканчик с краской). Через 1 час краску сливают, препарат промывают водой, высушивают на воздухе и исследуют. Если поместить препарат с краской в термостат при 37º, то окрашивание происходит быстрее (30-40 минут).
Результаты окрашивания зависят от свойства воды, поэтому следует проверять ее реакцию.
Микроскопическая картина. Риккетсии окрашиваются в розово-красный цвет, ядра эукариотических клеток – в красно-фиолетовый, а цитоплазма – в голубой.
Метод Здродовского
Техника. Препарат тонким слоем наносят на стекло, фиксируют на пламени и окрашивают разведенным карболовым фуксином (10-15 капель фуксина на 10 мл дважды дистиллированной воды) в течение 5 минут; затем препарат слегка обесцвечивают погружением на 1-3 секунды в слабую (0,01%) соляную кислоту, промывают водой и докрашивают в течение 30 секунд 1% раствором водного метиленового синего. Тонкий мазок фиксируют на пламени горелки. Окраску производят разведенным карболовым фуксином (10-15 капель фуксина на 10 мл дистиллированной воды) в течение 5 минут. Окрашенный препарат промывают водой, а затем обесцвечивают в растворе органической или минеральной кислоты (0,5% лимонная кислота, 0,01% соляная кислота) в течение 2-3 секунд. Затем препарат промывают водой и докрашивают 0,5% раствором метиленовой синьки в течение 0,5 минуты.
Микроскопическая картина. Риккетсии окрашиваются в рубиново-красный цвет, в то время как клетки хозяина обесцвечиваются кислотой и дополнительно окрашиваются в голубой (протоплазма) или синий (ядра) цвет (рис.20).
Окраска хламидий
Метод Романовского-Гимза
Техника (см. выше).
Микроскопическая картина. На разных стадиях развития способность воспринимать окраску у хламидий меняется:
- “Элементарные тельца” (инфекционные частицы) окрашиваются краской Гимза в пурпурный цвет.
- “Первоначальные тельца” (неинфекционные частицы) окрашиваются по Гимза в синий цвет.
- Полностью сформировавшиеся зрелые внутриклеточные включения окрашиваются краской Гимза в пурпурный цвет (рис.21).
Метод Грама
Техника (см. выше).
Микроскопическая картина. Окраска по Граму дает вариабельные результаты. Поэтому не имеет диагностического значения.
Окраска водным разбавленным раствором Люголя
Придает внутриклеточным формам хламидий коричневый цвет из-за гликогеноподобной оболочки частиц.
Окраска микоплазм
Метод Романовского-Гимза
Техника (см. выше).
Микроскопическая картина. Исследование нативных препаратов не дает результата. Окрашивают препарат из культуры после агаровой фиксации: кусочек среды с колонией помещают на предметное стекло и накрывают покровным стеклом с каплей спиртового раствора метиленового синего и азура, затем препарат высушивают.
Окраска спирохет
Методы окраски спирохет делятся на две группы: методы позитивной окраски, когда окрашивается сама клетка, и методы негативной окраски, когда окрашивается фон препарата, а спирохета остается бесцветной.
Из методов позитивной окраски наиболее употребителен метод Романовского-Гимза.
Метод Романовского-Гимза
Техника. См. выше. Особенностью техники окрашивания препаратов спирохет является длительность окраски – в течение 12-15 часов.
Микроскопическая картина. Трепонемы окрашиваются в бледно-розовый, лептоспиры – розово-красный, а боррелии – сине-фиолетовый цвет.
Ускоренная модификация Шерешевского
Микроскопическая картина. См. метод Романовского-Гимза.
Окраска разведенным фуксином
Используется для окраски боррелий.
Реактив: фуксин Циля разводят 1:4 или 1:5. Краситель наносят на фиксированный мазок на 1-2 минуты.
Микроскопическая картина. В мазках крови боррелии окрашиваются в розово- красный цвет, эритроциты – в ярко-красный.
Серебрение по Морозову
Техника. См. выше.
Микроскопическая картина. Спирохеты окрашиваются в буро-черный цвет (рис.22).
Для негативной окраски спирохет используют несколько методов.
Негативный метод Бурри
Техника. См. выше.
Микроскопическая картина. На темно-сером тушевом фоне – бесцветные клетки.
Негативная окраска колларголом
Этот метод отличается простотой, доступностью и хорошей эффективностью.
Техника. На фиксированный мазок наливают на 3 минуты 2% раствор колларгола. После этого препарат ставят в наклонное положение (водой не смывают) и подсушивают.
Микроскопическая картина. На золотисто-оранжевом фоне отчетливо контурируется бесцветная спирохета.
Негативный метод Бурри
Техника. См. выше.
Микроскопическая картина. На темно-сером тушевом фоне – бесцветные клетки.
Окраска простейших
Метод Романовского-Гимза
Техника. См. выше.
Микроскопическая картина. Клеточная цитоплазма окрашивается в голубой цвет, а ядра клеток и жгутики – в красно-фиолетовый цвет (рис.23).
Метод Райта
Реактивы. Способ приготовления: 1% раствор щелочного метиленового синего на 0,5% растворе двууглекислого натрия наливают в сосуд таким образом, чтобы высота слоя жидкости не превышала 6 см, и нагревают при 100 С в течение часа. Затем жидкость охлаждают и фильтруют. Охлажденный фильтрат в тонком слое при искусственном освещении должен иметь пурпурно-красный оттенок. К 100 мл фильтрата добавляют 500 мл 0,1% водного раствора эозина. При смешивании обеих жидкостей образуется обильный осадок; последний отфильтровывают и высушивают. Полученный таким образом краситель растворяют в ступке в метиловом спирте в соотношении 0,1:60,0.
На сухой нефиксированный мазок наливают несколько капель красителя. Спустя 1 минуту прибавляют столько же капель дистиллированной воды. Через 2-3 минуты препарат промывают в воде около 0,5 минуты, пока он в тонком слое не приобретет розоватого оттенка.
Микроскопическая картина. Ядра простейших окрашиваются в вишнево-красный цвет, цитоплазма – в голубоватый, жгутики – в красный цвет.
Окраска по Романовскому-Гимза является одним из основных методов при изучении морфологии риккетсий, хламидий, спирохет, простейших, а также при исследовании форменных элементов крови.
Техника. Краситель Романовского-Гимза состоит из азура, эозина и метиленового синего. Непосредственно перед употреблением к 10 мл дистиллированной воды нейтральной реакции прибавляют 10 капель краски и тотчас же наливают на препарат, предварительно фиксированный жидким фиксатором, на один час. Затем краску сливают, препарат промывают водой, высушивают на воздухе и микроскопируют. Окрашивание происходит быстрее (30-40 минут), если препарат с краской поместить в термостат при 37°С. К 10 мл дистиллированной воды нейтральной или слабо щелочной реакции непосредственно перед окраской препарата прибавляют 10 капель краски и тот час же наливают на фиксированный препарат (или погружают препарат в стаканчик с краской). Через 1 час краску сливают, препарат промывают водой, высушивают на воздухе и исследуют. Если поместить препарат с краской в термостат при 37º, то окрашивание происходит быстрее (30-40 минут).
Результаты окрашивания зависят от свойства воды, поэтому следует проверять ее реакцию.
Микроскопическая картина. Риккетсии окрашиваются в розово-красный цвет, ядра эукариотических клеток – в красно-фиолетовый, а цитоплазма – в голубой.
Метод Здродовского
Техника. Препарат тонким слоем наносят на стекло, фиксируют на пламени и окрашивают разведенным карболовым фуксином (10-15 капель фуксина на 10 мл дважды дистиллированной воды) в течение 5 минут; затем препарат слегка обесцвечивают погружением на 1-3 секунды в слабую (0,01%) соляную кислоту, промывают водой и докрашивают в течение 30 секунд 1% раствором водного метиленового синего. Тонкий мазок фиксируют на пламени горелки. Окраску производят разведенным карболовым фуксином (10-15 капель фуксина на 10 мл дистиллированной воды) в течение 5 минут. Окрашенный препарат промывают водой, а затем обесцвечивают в растворе органической или минеральной кислоты (0,5% лимонная кислота, 0,01% соляная кислота) в течение 2-3 секунд. Затем препарат промывают водой и докрашивают 0,5% раствором метиленовой синьки в течение 0,5 минуты.
Микроскопическая картина. Риккетсии окрашиваются в рубиново-красный цвет, в то время как клетки хозяина обесцвечиваются кислотой и дополнительно окрашиваются в голубой (протоплазма) или синий (ядра) цвет (рис.20).
Гимза пятно это тип окрашивания клинических образцов, основанный на смеси кислотных и основных красителей. Его создание было вдохновлено работой, проделанной Романовским, где Густав Гимса, химик и бактериолог из Германии, усовершенствовал его, добавив глицерин для стабилизации соединений..
Изменения, внесенные в оригинальную технику Романовского, позволили значительно улучшить микроскопические наблюдения, поэтому метод был крещен с именем окраски Гимзы..
Поскольку это простой метод для выполнения, высоко функциональный и экономичный, в настоящее время он широко используется в клинической лаборатории для гематологических мазков, образцов костного мозга и срезов тканей..
Техника окрашивания по Гимзе очень полезна для цитологических исследований, так как позволяет наблюдать специфические структуры клеток. Этот метод окрашивает цитоплазмы, ядра, ядрышки, вакуоли и гранулы клеток, что позволяет различать даже мелкие следы хроматина.
Кроме того, могут быть обнаружены значительные изменения в размере, форме или окраске ядра, где можно визуализировать потерю связи ядро-цитоплазма..
С другой стороны, он позволяет выявлять незрелые клетки в костном мозге и периферической крови, что важно для диагностики серьезных заболеваний, таких как лейкемия. Также возможно обнаруживать гемопаразиты, экстра- и внутриклеточные бактерии, грибы и др..
В цитогенетике это вполне используется, так как можно изучать митоз клеток.
- 1 Основа окраски Гимзы
- 2 Материалы
- 2.1 Материалы для приготовления материнского раствора
- 2.2 Режим приготовления материнского раствора
- 2.3 Материалы для приготовления буферного раствора
- 2.4 Окончательная подготовка красителя
- 2.5 Дополнительные материалы, необходимые для выполнения окраски
- 3.1 Процесс окрашивания
- 4.1 Гематология
- 4.2 Микология
- 4.3 Бактериология
- 4.4 Паразитология
- 4.5 Цитология
- 4.6 Цитогенетика
- 7.1 Чрезвычайно синяя окраска
- 7.2 Чрезмерно розовая окраска
- 7.3 Наличие осадков в мазке
- 7.4 Наличие морфологических артефактов
Основание окраски Гимзы
Красители типа Романовского основаны на использовании контраста между кислотными и основными красителями для достижения окрашивания основных и кислотных структур, соответственно. Как можно видеть, существует сродство кислотных красителей к окрашиванию основных структур и наоборот..
Основной используемый краситель - метиленовый синий и его окисленные производные (Azure A и Azure B), в то время как кислотный краситель - эозин..
Кислотными структурами клеток являются, среди прочего, нуклеиновые кислоты, гранулы сегментированных базофилов, поэтому они будут окрашены метиленовым синим..
В этом же смысле основными структурами клеток являются, среди прочего, гемоглобин и некоторые гранулы, такие как те, которые содержатся в сегментированных эозинофилах; они будут окрашены эозином.
С другой стороны, из-за того, что метиленовый синий и лазурь характеризуются метахроматическими красителями, они могут придавать переменный тон различным структурам в зависимости от нагрузки на полианионы, которыми они обладают..
Таким образом, стратегическое сочетание основных и кислотных красителей способно создавать широкий спектр цветов в соответствии с биохимическими характеристиками каждой структуры, проходя через бледно-голубой, темно-синий, сиреневый и фиолетовый тона в случае кислотных структур..
В то время как окраска, обеспечиваемая эозином, является более стабильной, образуются цвета между красновато-оранжевым и лососевым.
материалы
Материалы для приготовления материнского раствора
Приготовление исходного раствора требует взвешивания 600 мг порошкообразного красителя Гимза, измерения 500 см 3 безметонового метилового спирта и 50 см 3 нейтрального глицерина.
Режим приготовления материнского раствора
Поместите тяжелый порошок Гимзы в ступку. Если есть комки, их следует опрыскивать. Затем добавьте значительное количество отмеренного глицерина и очень хорошо перемешайте. Полученную смесь разливают в очень чистую янтарную бутылку.
Остальная часть глицерина помещается в ступку. Смешайте еще раз, чтобы очистить оставшийся краситель, прилипший к стенкам раствора, и вылейте в ту же бутылку..
Бутылку накрывают и выдерживают в течение 2 часов на водяной бане при 55ºC. Находясь в ванне на водяной бане, слегка перемешивайте смесь каждые полчаса или около того.
Затем смеси дают остыть для размещения спирта. Ранее часть отмеренного спирта помещают в ступку, чтобы закончить промывание остатка красителя, а затем добавляют к смеси вместе с остальным спиртом..
Этот препарат должен быть выдержан в течение не менее 2 недель. Часть, которая используется материнского раствора должна быть отфильтрована.
Чтобы избежать загрязнения препарата, рекомендуется передавать порцию, которая будет постоянно использоваться, в небольшую янтарную бутылочку с капельницей. Подзаряжайте каждый раз, когда заканчивается реагент.
Материалы для приготовления Буферного раствора
С другой стороны, буферный раствор при рН 7,2 готовят следующим образом:
Взвешивают 6,77 г фосфата натрия (безводного) (NaHPO4), 2,59 г дигидрофосфата калия (KH)2ПО4) и дистиллированная вода до 1000 куб..
Окончательная подготовка красителя
Для приготовления конечного окрашивающего раствора измеряют 2 см 3 отфильтрованного маточного раствора и смешивают с 6 см 3 буферного раствора. Смесь перемешивают.
Важным фактом, который необходимо учитывать, является то, что методы приготовления красителя могут меняться в зависимости от коммерческого дома.
Дополнительные материалы, необходимые для выполнения окраски
Помимо описанных материалов, он должен быть снабжен цветными мостиками, водяными экранами или буфером для стирки, листами для предметов или крышек, секундомером для контроля времени окрашивания и промокательной бумагой или некоторым материалом, который можно использовать для сушки ( марля или хлопок).
техника
Процесс окрашивания
1) Перед окрашиванием необходимо нанести образец на чистое предметное стекло..
Образцы могут быть кровью, костным мозгом, срезами гистологических тканей или шейно-вагинальными образцами. Рекомендуется, чтобы наружная сторона была тонкой и имела 1 или 2 часа высыхания перед окрашиванием.
2) Все листы, которые вы должны раскрасить, помещены на цветной мост. Всегда работайте в одном и том же порядке и хорошо идентифицируйте каждый лист.
3) Поместите несколько капель 100% метилового спирта (метанола) на мазок и оставьте на 3-5 минут, чтобы зафиксировать и обезвоживать образец..
4) Откажитесь от метанола, присутствующего в листе, и дайте высохнуть на воздухе.
5) После высыхания поместите окончательный окрашивающий раствор капельницей, пока весь лист не будет покрыт. Оставить на 15 минут. Некоторые авторы рекомендуют до 25 мин. Зависит от коммерческого дома.
6) Слейте краситель и промойте мазок дистиллированной водой или 7,2 буферным раствором..
7) На промокательной бумаге дайте листам высохнуть на открытом воздухе, расположив их вертикально с помощью подставки..
8) Протрите заднюю часть слайда марлей или ватным тампоном, смоченным в спирте, чтобы удалить оставшийся краситель..
коммунальные услуги
Техника окрашивания Гимзы используется в нескольких областях, в том числе: гематология, микология, бактериология, паразитология, цитология и цитогенетика..
гематология
Это наиболее частая полезность, которая дается для этого окрашивания. С его помощью мы можем идентифицировать каждую из клеток, присутствующих в образцах костного мозга или периферической крови. А также оценка количества каждой серии, возможность обнаружить лейкоцитоз или лейкопению, тромбоцитопению и т. Д..
Поскольку он чувствителен для выявления незрелых клеток, он имеет отношение к диагностике острых или хронических лейкозов. Также возможно диагностировать анемию, такую как серповидно-клеточная анемия, серповидно-клеточная анемия и др..
микология
В этой области обычно используют его для поиска Histoplasma capsulatum (внутриклеточный диморфный гриб) в образцах тканей.
бактериология
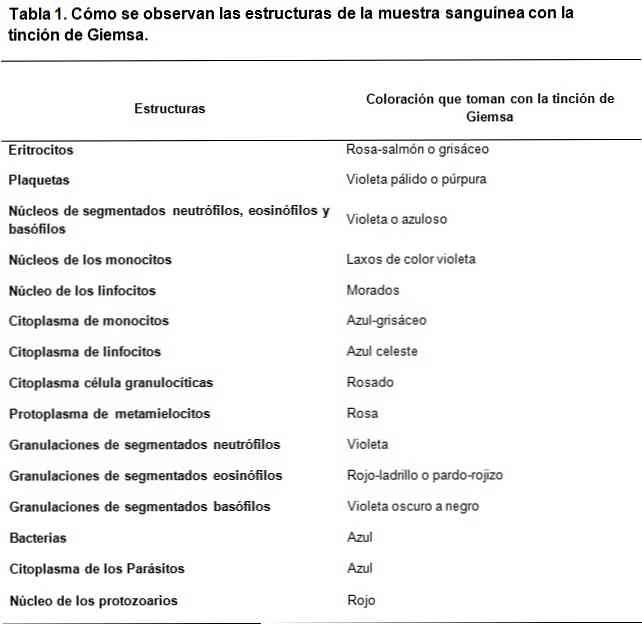
В гематологических мазках, окрашенных по Гимзе, можно обнаружить Borrelias sp у пациентов, которые имеют заболевание под названием лихорадка рецидивирующая. Спирохеты распространены среди эритроцитов в образцах, взятых на фебрильном пике..
Также можно визуализировать внутриклеточные бактерии как Rickettsias sp и Chlamydia trachomatis в инфицированных клетках.
паразитология
В области паразитологии окрашивание по Гимзе позволило диагностировать такие паразитарные заболевания, как малярия, болезнь Шагаса и лейшманиоз..
В первых двух паразитах Plasmodium sp и Трипаносома Крузи соответственно они могут быть визуализированы в периферической крови инфицированных пациентов, они могут быть обнаружены на разных стадиях в зависимости от фазы, в которой заболевание.
Для улучшения поиска паразитов крови рекомендуется использовать краситель Гимза, смешанный с красителем Май-Грюнвальд.
Кроме того, кожный лейшманиоз можно диагностировать при оценке образцов биоптатов кожи, окрашенных по Гимзе, где обнаружен паразит..
цитология
Окрашивание по Гимзе также используется для цитологического исследования эндоцервикальных образцов, хотя это не самый часто используемый метод для этой цели..
Но в случаях нехватки ресурсов можно использовать, имея функциональность, аналогичную той, которая предлагается по методике Папаниколау, и с меньшими затратами. Тем не менее, это требует экспертизы со стороны эксперта.
цитогенетики
Важной особенностью окрашивания Гимзы является его способность сильно связываться с областями, богатыми аденинами ДНК и тиминами. Это позволяет визуализировать ДНК во время митоза клеток, в разных состояниях конденсации.
Эти исследования необходимы для выявления хроматических аберраций, таких как дупликации, делеции или транслокации различных областей хромосом..
Исследование, демонстрирующее эффективность окрашивания по Гимзе
Cannova et al. (2016) сравнили 3 метода окраски для диагностики кожного лейшманиоза.
Для этого они использовали образцы, полученные от экспериментального животного (Mesocrisetus auratus) экспериментально привит с лейшмании.
Авторы продемонстрировали, что окрашивание по Гимзе было лучше, чем по окрашиванию Pap-mart® и Gaffney. Поэтому они считали, что пятно Гимзы идеально подходит для диагностики кожного лейшманиоза..
Отличные результаты, полученные авторами, объясняются тем, что комбинация красителей, составляющих смесь Гимзы, создает необходимые условия для создания благоприятного контраста, позволяющего четко различать структуры амастигота как внутри, так и вне клетки..
Другие методы (Pap-mart® и Gaffney) также делали это, но более слабым способом и, следовательно, более трудным для визуализации. Вот почему пятно Гимзы рекомендуется для паразитологической диагностики лейшманиоза.
Аналогичным образом, исследование, проведенное Ramírez и соавторами (1994), оценило валидность пятен Гимзы и Лендрума в мазках из конъюнктивы для идентификации Chlamydia trachomatis.
Авторы определили, что окрашивание Гимзы и Ледрума имеет одинаковую специфичность, но Гимза была более чувствительной.
Это объясняет, почему в настоящее время окрашивание по Гимзе является наиболее часто используемым для диагностики хламидийных инфекций, особенно если ресурсов мало.
![]()
Рекомендации по хорошему окрашиванию
Сушка листов не должна быть ускорена. Пруденциальное время следует ждать, чтобы высушить его на открытом воздухе. Примерно 2 часа.
Цвет сразу после 2 часов для достижения наилучших результатов.
Для лучшего закрепления и окрашивания мазков образец должен быть распределен на листе таким образом, чтобы остался тонкий и равномерный слой..
Предпочтительным образцом крови является капилляр, так как мазок сделан непосредственно из капли крови, и поэтому в образце нет добавки, которая способствует поддержанию клеточных структур..
Однако, если используется венозная кровь, ЭДТА следует использовать в качестве антикоагулянта, а не гепарина, поскольку последний обычно деформирует клетки.
Распространенные ошибки в раскраске Гимзы
В практике этой раскраски могут быть допущены ошибки. Об этом свидетельствуют внезапные изменения оттенков конструкций.
Чрезвычайно синяя окраска
Это может быть связано с:
- Очень густые мазки
- Превышение времени окрашивания
- Слишком мало стирки.
- Использование реагентов значительно выше нейтрального рН (щелочной).
В этих условиях цвета следующих структур искажаются, так что эритроциты вместо умирающего розового лосося будут выглядеть зелеными, гранулы эозинофилов, которые должны быть окрашены в красный кирпич, станут синими или серыми и так далее, отклонение в обычных тональностях.
Чрезмерно розовая окраска
Это может быть связано с:
- Недостаточное время окрашивания.
- Длительная или чрезмерная стирка.
- Плохая сушка.
- Использование очень кислых реагентов.
В этом конкретном случае структуры, которые обычно окрашены в синий цвет, будут почти не видны, в то время как структуры, которые окрашены в розовый цвет, будут иметь очень преувеличенные тональности.
Пример: эритроциты приобретут ярко-красный или ярко-оранжевый цвет, ядерный хроматин будет выглядеть бледно-розовым, а гранулы эозинофилов станут ярко-красными..
Наличие осадков в мазке
Причины могут быть:
- Используйте грязные или плохо вымытые простыни.
- Не позволяйте мазку хорошо высохнуть.
- Оставьте решение для фиксации слишком долго.
- Неадекватная стирка в конце окрашивания.
- Неадекватная фильтрация или отсутствие фильтрации используемого красителя.
Наличие морфологических артефактов
В мазках могут появляться морфологические артефакты, что затрудняет визуализацию и интерпретацию имеющихся структур. Это связано с:
- Тип используемого антикоагулянта, такой как гепарин.
- Использование грязных, поврежденных или жирных листов.
Режим хранения
После приготовления краситель должен храниться при комнатной температуре (15-25 ° C), чтобы предотвратить выпадение красителя. Хранить в закрытой янтарной таре.
Читайте также: