Риск гнойно септических заболеваний
Обновлено: 18.04.2024
Кафедра акушерства и гинекологии факультета повышения квалификации и последипломной подготовки специалистов Читинской государственной медицинской академии
Кафедра акушерства и гинекологии факультета повышения квалификации и последипломной подготовки специалистов Читинской государственной медицинской академии
Профилактика септических осложнений в акушерстве: рекомендации Министерства здравоохранения Российской Федерации и Всемирной организации здравоохранения 2015 г.
Журнал: Российский вестник акушера-гинеколога. 2016;(3): 79‑84
Кафедра акушерства и гинекологии факультета повышения квалификации и последипломной подготовки специалистов Читинской государственной медицинской академии
Септические осложнения в родах являются одной из ведущих причин материнской летальности в мире и в России (в 2014 г. показатель был одинаковым и составил 10,7%). Представлен обзор современных клинических рекомендаций Министерства здравоохранения Российской Федерации и ВОЗ по профилактике септических осложнений в акушерстве, цель которых — улучшение исходов родов для матери и новорожденного. Авторы информируют об отсутствии конфликта интересов.
Кафедра акушерства и гинекологии факультета повышения квалификации и последипломной подготовки специалистов Читинской государственной медицинской академии
Кафедра акушерства и гинекологии факультета повышения квалификации и последипломной подготовки специалистов Читинской государственной медицинской академии
Согласно сведениям, приведенным в этом документе, в 2013 г. в мире умерли 289 000 женщин в связи с беременностью и родами, каждые 2 мин погибало более одной женщины. Более половины случаев (52%) материнской смертности были обусловлены тремя ведущими предотвратимыми причинами — кровотечением, сепсисом, гипертензивными расстройствами [4].
По данным экспертов ВОЗ ]5—7], несмотря на значительные успехи в диагностике и антимикробной терапии, в мире в структуре материнской летальности сохраняется высокий удельный вес послеродового сепсиса: в 2000 г. он составил 15%, в 2014 г. — 10,7%. В России доля сепсиса в структуре материнских потерь составила в 2013 г. 11,2% [7], в 2014 г. — 10,7% (Росстат, 2014).
По данным J. Barton, B. Sibai [8], частота развития тяжелого сепсиса с летальными исходами ежегодно увеличивается на 10%, чему способствуют поздний возраст матери, ожирение, имеющиеся хронические заболевания, ВРТ и многоплодная беременность, высокая частота кесаревых сечений.
Рекомендации Минздрава Р.Ф. и ВОЗ 2015 г. имеют общую цель — утвердить эффективные клинические вмешательства, которые позволят снизить частоту родовых инфекций и их осложнений у матери, что является частью стратегии по охране здоровья женщин, предупреждению материнской летальности и улучшению исходов для новорожденных [7, 9].
Рекомендации ВОЗ и Минздрава Р.Ф. по профилактике инфекционных осложнений родов
1. Не рекомендуется сбривание волос на лобке и промежности при вагинальных родах (условная рекомендация) * [9, 10].
Эта рекомендация касается только сбривания всех волос с наружных половых органов при вагинальных родах [9, 10] и не применяется к пациенткам, которые готовятся к кесареву сечению [9, 11]. Решение о бритье волос на промежности/лобке принимает женщина, а не работник здравоохранения. Если женщина еще до родов решает сбрить волосы на промежности/лобке, ей следует посоветовать сделать это в наиболее комфортном для нее месте (например, дома незадолго до наступления родов).
Доказательной базой для данной рекомендации послужил Кохрановский систематический обзор (3 рандомизированных исследования, 1039 женщин), показавший, что рутинное бритье промежности не снижает риск развития инфекционно-воспалительных заболеваний у матери и неонатальных инфекций. Кроме того, не выявлено существенных различий между сравниваемыми группами по частоте развития инфекции в ране (после разрыва промежности или эпизиотомии) или расхождения швов на промежности [12, 13].
2. Влагалищное исследование рекомендуется проводить с интервалом 4 ч в активную фазу родов у женщин с низкой степенью риска развития инфекционно-воспалительных заболеваний (строгая рекомендация) * * [9].
3. Не рекомендуется рутинная обработка влагалища хлоргексидином в родах с целью предупреждения послеродовых инфекций (строгая рекомендация) [9].
В основу этой рекомендации ВОЗ положены результаты Кохрановского систематического обзора, выявившего, что при обработке влагалища в родах хлоргексидином в сравнении с плацебо нет различий в частоте развития хориоамнионита, послеродового эндометрита, неонатального сепсиса, неонатальной пневмонии или неонатального менингита [15]. В доказательную базу этой рекомендации не входят женщины, колонизированные стрептококком группы В, и с ВИЧ-инфекцией (см. рекомендацию 4).
4. Не рекомендуется рутинная обработка влагалища хлоргексидином в родах женщинам—носителям стрептококка группы В для предупреждения ранней неонатальной стрептококковой инфекции (условная рекомендация) [9].
5. Рекомендуется введение антибиотика в родах пациенткам—носителям стрептококка группы В для предупреждения ранней неонатальной стрептококковой инфекции (условная рекомендация) [7, 9].
Данное вмешательство, рекомендованное протоколами Минздрава Р.Ф. и ВОЗ, распространяется на матерей, генитальный тракт которых колонизирован стрептококком группы В, и не касается женщин со стрептококком группы В, обнаруженным в посевах мочи [7, 9]. В качестве доказательной базы использован Кохрановский систематический обзор 2014 г. (4 исследования, 852 женщины), который выявил клинические преимущества для новорожденных при введении антибиотика (ампициллина или пенициллина G) матерям, генитальный тракт которых колонизирован стрептококком группы В [17]. Введение в родах антибиотиков женщинам—носителям стрептококка группы В статистически значимо снижает число ранних неонатальных инфекций (в возрасте
6. Не рекомендуется рутинная антибиотикопрофилактика всем женщинам во II или III триместрах беременности с целью снижения инфекционной заболеваемости (строгая рекомендация) [9].
Рекомендация ВОЗ не относится к женщинам из группы высокого риска развития инфекционных заболеваний и осложнений в родах, а применима к общей популяции беременных во II или III триместрах беременности. Доказательства для рекомендации получены на основе метаанализа 2015 г. (8 исследований, 3663 женщины), который не выявил статистически значимого снижения частоты послеродового эндометрита или хориоамнионита у беременных, получавших антибиотикопрофилактику во II—III триместрах беременности по сравнению с теми, кто таковую не получал [19].
7. Не рекомендуется рутинная антибиотикопрофилактика женщинам с преждевременными родами при целых плодных оболочках (строгая рекомендация) [9, 18].
В Кохрановском систематическом обзоре 2013 г. показано, что рутинная антибиотикопрофилактика у женщин с преждевременными родами при целых плодных оболочках не дает преимуществ в перинатальных исходах по сравнению с пациентками, которым антибиотики не вводились: в сравниваемых группах не выявлено статистически значимых различий по перинатальной смертности (10 исследований, 7304 женщины) и частоте мертворождений (8 исследований, 7080 женщин) [20]. Заслуживают внимания и требуют дальнейшего изучения выявленные факты увеличения неонатальной смертности (9 исследований, 7248 младенцев) и повышения частоты развития детского церебрального паралича (одно исследование, 3173 ребенка) у детей, матери которых получали антибиотики с профилактической целью [20]. По мнению членов рабочей группы ВОЗ [9], эти недостатки существенно перевешивают клинические преимущества для матери в виде снижения частоты развития инфекционных осложнений, в том числе хориоамнионита/эндометрита.
8. Рекомендуется введение антибиотиков женщинам с преждевременными родами при преждевременном излитии околоплодных вод (строгая рекомендация) [7, 9, 18].
Рекомендация основана на выявленных клинических преимуществах профилактического введения антибиотиков для матери и новорожденного при преждевременных родах и преждевременном излитии околоплодных вод. В Кохрановском систематическом обзоре 2013 г. (22 исследования, 6872 женщины) продемонстрировано, что по сравнению с плацебо при использовании антибиотиков снижается риск развития хориоамнионита у матери и неонатальных инфекций, включая пневмонии. Более того, введение антибиотиков привело к уменьшению числа новорожденных, которым потребовалось введение сурфактанта и оксигенотерапии, а также сократило длительность пребывания младенцев в отделениях интенсивной терапии в среднем на 5,05 дня [21]. В соответствии с клиническими рекомендациями ВОЗ [22] и Минздрава России [18] антибиотиком выбора в этой ситуации является эритромицин.
9. Не рекомендуется рутинное введение антибиотиков женщинам с преждевременным излитием околоплодных вод при родах в срок или близких к сроку (строгая рекомендация) [9].
Доказательства этой рекомендации ВОЗ основаны на исследованиях, которые включали женщин с длительностью безводного промежутка менее 12 ч. Рабочая группа отмечает, что в настоящее время недостаточно доказательств относительно отказа от антибиотикопрофилактики при длительности разрыва плодных оболочек более 18 ч, поскольку риск инфицирования таких пациенток может быть выше [9].
Кохрановский метаанализ 2014 г. не выявил существенных различий между группами пациенток, получавшими и не получавшими антибиотики в связи с преждевременным излитием околоплодных вод при родах в срок или близких к сроку [23]. Отсутствие антибиотикопрофилактики не увеличивало риск развития хориоамнионита, эндометрита или раневой инфекции у матери, не повышало частоту раннего неонатального сепсиса [23].
Клинический протокол Минздрава Р.Ф. 2015 г. рекомендует проведение антибиотикопрофилактики при доношенной беременности и безводном промежутке более 18 ч [7].
10. Не рекомендуется рутинное введение антибиотиков женщинам с мекониальными водами (условная рекомендация) [9].
Данная рекомендация основана на заключении систематического обзора 2013 г.: введение матери антибиотиков при наличии мекониальных вод не снижает частоту неонатального сепсиса и госпитализаций детей в отделение реанимации и интенсивной терапии, т. е. не улучшает исходы для новорожденных. Для матери преимущества введения антибиотиков обусловлены значительным уменьшением риска хориоамнионита, при этом не выявлено отличий в частоте послеродового эндометрита [24]. Члены рабочей группы ВОЗ отмечают, что клиническую эффективность для матери следует интерпретировать с осторожностью из-за низкого качества исследования и малого размера выборки [9].
11. Рекомендуется рутинная антибиотикопрофилактика женщинам после ручного удаления плаценты (строгая рекомендация) [7, 9].
В основу рекомендации положены сведения систематического обзора 2015 г. (3 ретроспективных когортных исследования), включившего наблюдения за 567 женщинами, не имевшими лихорадки до проведения ручного удаления плаценты [25]. По сравнению с отсутствием антибиотикопрофилактики введение антибиотиков снижало частоту лихорадки после родов и эндометрита [25].
12. Не рекомендуется рутинная антибиотикопрофилактика женщинам с оперативными влагалищными родами (условная рекомендация) [9].
13. Рекомендуется рутинная антибиотикопрофилактика женщинам с разрывами промежности III и IV степени (строгая рекомендация) [7, 9].
Качество доказательств этой рекомендации низкое, что обусловлено малым размером выборки: в одном исследовании с участием 147 женщин показано существенное снижение частоты развития раневой инфекции на фоне антибиотикопрофилактики [27]. По мнению членов рабочей группы ВОЗ, использование антибиотиков для снижения риска инфекционных осложнений при разрыве промежности III или IV степени обосновано и связано с потенциальным загрязнением раны (учитывая анатомическую близость и бактериальную флору прямой кишки) [9].
14. Не рекомендуется рутинная антибиотикопрофилактика женщинам с эпизиотомией (строгая рекомендация) [7, 9].
Поиск информации в международных медицинских базах данных продемонстрировал полное отсутствие рандомизированных исследований для оценки пользы от рутинного назначения антибиотиков женщинам с эпизиотомией в родах. По мнению экспертов ВОЗ, эпизиотомия, выполненная в условиях должного инфекционного контроля, имеет низкую степень инфицирования. Кроме того, необоснованное назначение антибиотиков оказывает негативное влияние на здоровье населения, приводит к формированию устойчивости к противомикробным препаратам и повышает бремя экономических затрат [9].
15. После неосложненных влагалищных родов рутинная антибиотикопрофилактика не рекомендуется (строгая рекомендация) [7, 9].
В систематическом обзоре 2015 г. (2 рандомизированных контролируемых исследования, 1653 женщины) показано, что у матерей, получавших антибиотикопрофилактику после неосложненных вагинальных родов, значительно ниже заболеваемость эндометритом, при этом не отмечено статистически значимых различий по частоте развития лихорадки после родов, раневой инфекции, инфекций мочевыводящих путей и продолжительности пребывания в стационаре [28].
Рабочая группа ВОЗ обеспокоена широким применением антибиотиков после вагинальных родов у женщин без значимых факторов риска развития пуэрперальных инфекций. Эксперты особо отмечают, что рутинная антибиотикопрофилактика негативно влияет на прилагаемые глобальные усилия по сдерживанию прогрессирования развития устойчивости к противомикробным препаратам [9].
16. Рекомендуется обработка влагалища повидоном-йодом непосредственно перед кесаревым сечением (условная рекомендация) [9].
Рекомендация ВОЗ по использованию в качестве антисептика именно повидона-йода обусловлена тем, что это был единственный агент, изученный во всех рандомизированных контролируемых исследованиях. У женщин, получивших обработку влагалища повидоном-йодом непосредственно перед кесаревым сечением, существенно снижался риск развития эндометрита после кесарева сечения [29].
17. Выбор антисептика для обработки кожи перед кесаревым сечением и способ его применения должен быть основан в первую очередь на клиническом опыте его использования, стоимости и наличия (условная рекомендация) [9].
18.0. Рекомендуется рутинная антибиотикопрофилактика женщинам при плановом и экстренном кесаревом сечении (строгая рекомендация) [7, 9, 11].
Эффективность рутинной антибиотикопрофилактики перед плановым и экстренным кесаревым сечением подтверждена большим количеством исследований (95 исследований с участием 15 000 женщин): у матерей статистически значимо уменьшалось число тяжелых инфекционных осложнений, лихорадки после родов, эндометритов, инфекций в ране и мочевыводящих путях [31].
18.1. При кесаревом сечении профилактическое введение антибиотиков должно быть произведено до разреза кожи, а не интраоперационно после пережатия пуповины (строгая рекомендация) [7, 9].
18.2. Для антибиотикопрофилактики при кесаревом сечении должно отдаваться предпочтение использованию разовых доз цефалоспоринов первого поколения или пенициллина в отличие от других классов антибиотиков (условная рекомендация) [9].
Заключение
У клинических рекомендаций Минздрава Р.Ф. 2014—2015 гг. [7, 10, 11, 18] и руководства ВОЗ 2015 г. [9] по профилактике гнойно-септических заболеваний в акушерстве общие цели — улучшение здоровья матери и ребенка посредством снижения рисков развития инфекционно-воспалительных заболеваний, связанных с беременностью и родами, на основе использования сведений доказательной медицины и эффективных клинических технологий, признанных на международном уровне. Распространение и внедрение рекомендаций экспертов по профилактике инфекционных осложнений позволят существенно продвинуться в достижении 4-й и 5-й целей тысячелетия, сформулированных ООН, сохранить и приумножить репродуктивный потенциал нации.
* — условными (conditional recommendations) являются рекомендации ВОЗ, имеющие в настоящее время недостаточный уровень доказательности.
* — строгими (strong recommendations) являются директивные рекомендации ВОЗ, имеющие высокий уровень доказательности.
Акушерский сепсис – это системное осложнение инфекций женской мочеполовой системы и молочной железы, развившееся во время беременности, изгнания плода и в послеродовом (послеабортном) периоде. Проявляется тяжёлым общим состоянием, нарастающей слабостью, лихорадкой, сердцебиением, одышкой, снижением артериального давления. По мере прогрессирования присоединяются помутнение сознания, выраженное затруднение дыхания, резкое уменьшение объёма отделяемой мочи. Диагноз устанавливается на основании данных физикального осмотра, УЗИ, лабораторных исследований крови. Лечение комплексное: хирургическая санация гнойников, антибиотикотерапия, интенсивная терапия.
МКБ-10
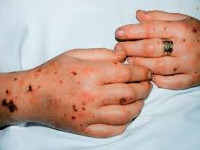
Общие сведения

Причины
Акушерский сепсис всегда вторичен, его источником является локальная инфекция. Основные возбудители гнойно-воспалительных заболеваний – представители оппортунистической флоры (пиогенный стрептококк, стрептококк группы B, золотистый стафилококк, кишечная палочка, клебсиелла, протей, пептококк, пептострептококк, бактероид, грибок кандида), чаще всего населяют нижние отделы мочеполовой сферы и кишечника и приводят к патологии только под воздействием определённых факторов. К основным причинам и источникам инфицирования относятся:
- Хирургические операции и травмы тканей. Раневая поверхность служит воротами инфекции и способствует значительному снижению местного иммунитета. Гнойный процесс может стать исходом кесарева сечения, раннего отхождения околоплодных вод (при неправильном положении плода, многоплодии), полученных в родах разрывов и оперативных вмешательств на промежности.
- Лечебно-диагностические манипуляции. Возбудитель передаётся при контакте с обсеменённым инструментом, кроме того, микротравмы, полученные при исследовании, создают благоприятные условия для лимфо- и гематогенного заражения. В группе факторов риска - цервикальный серкляж, амниоцентез, кордоцентез, уретральная катетеризация, экстракорпоральное оплодотворение, многократные влагалищные исследования в ходе родов.
- Физиологические изменения, вызванные беременностью. Растущая матка сдавливает и смещает окружающие анатомические структуры, а прогестерон снижает тонус гладкой мускулатуры. Эти факторы приводят к нарушению уродинамики и создают предпосылки для развития гестационного пиелонефрита и уросепсиса.
- Застой грудного молока. В результате лактостаза происходит активный рост стафилококков, вызывающих мастит. Нарушение оттока молока – основная причина послеродовых абсцессов и флегмон.
С другой стороны, гнойные процессы могут осложниться сепсисом лишь при условии гипо- или гиперреактивности иммунного ответа. Функциональные расстройства иммунной системы приводят к усилению активности оппортунистических микроорганизмов и формированию патологической реакции на гнойное воспаление. К факторам риска относятся ожирение, сахарный диабет, анемия, острые и хронические воспаления (генитальные и экстрагенитальные), недостаток питания, возраст старше 35 лет.
Патогенез
Массивное поражение ткани инфекцией сопровождается перманентным или периодическим выбросом в кровоток медиаторов воспалительного ответа, что истощает регуляторную функцию иммунной системы и запускает ряд неконтролируемых реакций в дистантных органах и тканях. В результате повреждается эндотелий, ухудшается микроциркуляция (перфузия), снижается транспорт кислорода. Эти изменения приводят к нарушениям гомеостатической регуляции, развитию синдрома острой полиорганной недостаточности (СПОН) и ДВС-синдрома.
Желудочки сердца расширяются, происходит снижение сердечного выброса, нарушается сосудистый тонус. В лёгких образуются ателектазы, развивается респираторный дистресс-синдром. В результате снижения объёма циркулирующей крови (ОЦК) и гемостатических нарушений ухудшается микроциркуляция почечной ткани и кровоснабжение коркового слоя с последующей острой функциональной недостаточностью. В печени нарушаются обменные процессы, а недостаток кровоснабжения влечёт формирование некротических участков. Гипоперфузия приводит к патологической проницаемости слизистой оболочки кишечника с выбросом токсинов и микроорганизмов в лимфатическую систему, в результате ишемии на стенках органов ЖКТ образуются стрессовые язвы. Нарушение обменных процессов и микроциркуляции головного мозга обусловливает неврологические расстройства.
Классификация
Акушерский сепсис классифицируют по разным критериям: по возбудителю, по метастатическому распространению (септицемия, характеризующаяся наличием лишь первичного очага, и септикопиемия – наличие гнойных отсевов в других тканях и органах) или по клиническому течению. В современном акушерстве принята классификация, отражающая последовательные этапы формирования системной воспалительной реакции:
- Синдром системного воспалительного ответа (ССВО). Предвестник септического состояния – системная реакция на воспалительный процесс любой этиологии. Устанавливается при наличии воспалительного заболевания и на основании не менее двух клинических проявлений ССВО: тахикардии, тахипноэ или гипервентиляции, гипо- или гипертермии, лейкоцитоза (лейкопении) или повышения доли незрелых нейтрофилов. У 12% больных сепсисом признаки ССВО отсутствуют.
- Сепсис. Патологический системный ответ на первичную или присоединившуюся инфекцию. Диагноз выставляется при наличии инфекционного очага или на основании верифицированной бактериемии и остро развившихся признаков функциональной недостаточности двух и более органов (СПОН).
- Септический шок. Крайняя форма патологической реакции. Сопровождается выраженными, стойкими, плохо поддающимися медикаментозной коррекции гипотензией и нарушением перфузии.
Симптомы акушерского сепсиса
Послеродовый сепсис манифестирует на второй-третий день после изгнания плода сукровично-гнойными выделениями, явлениями общей интоксикации (тахикардией, одышкой, слабостью, потерей аппетита, иногда рвотой и диареей) и повышением температуры до 39-40°C с ознобами. Гипертермия обычно устойчивая, однако могут наблюдаться формы с постепенным повышением или большим разбросом суточной температуры и редкими приступами ознобов. Отмечаются боли в животе или молочных железах, могут регистрироваться генерализованные высыпания. Выраженность симптомов и длительность заболевания различны в зависимости от формы клинического течения.
Для молниеносного акушерского сепсиса нарастание симптоматики характерно в течение суток, при острой форме клиническая картина разворачивается в течение нескольких дней. При подострой форме признаки выражены менее ярко, процесс развивается неделями. Хрониосепсис характеризуется слабо выраженными изменениями (субфебрилитетом, повышенным потоотделением, головной болью и головокружениями, сонливостью, диареей) и вялым течением в течение многих месяцев. Рецидивирующая форма представляет череду затуханий (периодов ремиссии без заметных проявлений) и обострений (периодов с яркой симптоматикой) и характерна для септикопиемии, когда ухудшение состояния обусловлено повторными эпизодами образования вторичных гнойников.
Особенно тяжёлым течением и рядом специфических признаков отличается анаэробный сепсис, ассоциированный с гангреной матки. Заболевание протекает молниеносно или остро, сопровождается интенсивной некупируемой болью внизу живота, крепитацией и усилением боли при пальпации матки, выделением из влагалища газа и зловонной жидкости с пузырьками воздуха, бронзовой окраской кожи, бурым цветом мочи. Явления септического шока проявляются уже в самом начале болезни.
Осложнения
У больных, переживших острый период, может развиться тяжёлое, нередко летальное осложнение – суперинфекция. Значительное ухудшение качества жизни или гибель пациентки часто влекут другие последствия сепсиса: сопряжённые с ишемией или гнойным метастазированием необратимые органные изменения почек, печени, лёгких, сердца, головного мозга, прободение и кровотечения из гастроэнтеральных стресс-язв, артериальная тромбоэмболия и флеботромбоз. Сепсис у беременных может вызвать преждевременные роды, гибель плода, энцефалопатию и ДЦП рожденного ребенка.
Диагностика
В диагностике акушерского сепсиса участвуют акушер-гинеколог, терапевт, реаниматолог, микробиолог, осложнённые формы требуют привлечения нефролога, кардиолога, невролога, гепатолога. В ходе гинекологического исследования и общего осмотра по наличию очага гнойного воспаления в органах малого таза или молочной железе, а также признакам ССВО можно заподозрить септическое состояние. Проводятся следующие исследования:
- Определение возбудителя. Культуральный анализ крови и влагалищного мазка позволяют выявить инфекционный агент и подобрать эффективный препарат для лечения инфекции. Бактериемия подтверждает наличие септического процесса. При отсутствии бактериемии для дифференцирования локальной и генерализованной инфекции проводится тест на прокальцитонин.
- Инструментальные исследования. УЗИ малого таза и почек подтверждает (выявляет) наличие первичного гнойного очага в мочеполовых органах. УЗИ органов брюшной полости, рентгенография органов грудной клетки, ЭхоКГ позволяют обнаружить вторичные абсцессы в печени, лёгких, сердце.
- Клинико-биохимические анализы крови. Общий анализ крови обнаруживает лейкоцитоз, лейкопению, сдвиг лейкоцитарной формулы влево – значения, косвенно подтверждающие септическое состояние. Данные биохимического исследования говорят о нарушениях водно-электролитного баланса и функций почек, печени. Анализ газов крови выявляет нарушения КЩС и дыхательную недостаточность. По результатам коагулограммы определяются нарушения свёртывания крови. Тестирование уровня лактата в плазме позволяет обнаружить тканевую гипоперфузию и оценить тяжесть шока. Иммунограмма свидетельствует о расстройствах иммунной активности.
Акушерский сепсис следует дифференцировать с гестозами, амниотической эмболией и тромбоэмболией лёгочной артерии, острыми инфекциями (тяжёлым гриппом, бруцеллёзом, тифом, малярией, милиарным туберкулёзом), острым панкреатитом, лейкозами, лимфогранулематозом. Для дифференциальной диагностики может потребоваться консультация кардиохирурга, инфекциониста, фтизиатра, онкогематолога.
Лечение акушерского сепсиса
Лечебные мероприятия проводятся в условиях гинекологического или обсервационного акушерского отделения, больные с тяжёлыми формами сепсиса переводятся в отделение реанимации и интенсивной терапии. Лечение комплексное, включает хирургические и консервативные методы и направлено на борьбу с инфекцией и коррекцию витальных функций:
- Инфузионная терапия. Лечение предусматривает коррекцию гомеостатических расстройств (гипотонии, коагулопатии, нарушений кислотно-щелочного и водно-солевого и обмена, дефицита ОЦК), восстановление тканевой перфузии, дезинтоксикацию. С этими целями вводятся солевые и коллоидные растворы, альбумин, криоплазма, инотропы и вазопрессоры.
- Антибактериальная терапия. Направлена на уничтожение инфекционного агента с целью блокировки воспалительного каскада. Стартовое лечение включает внутривенное введение комбинации препаратов широкого спектра. После выделения возбудителя приступают к этиотропной антибиотикотерапии.
- Хирургическое лечение. Ликвидация гнойных очагов повышает эффективность интенсивной терапии и улучшает прогноз. Лечение предполагает санацию первичного и вторичных очагов – вскрытие и опорожнение абсцессов, кюретаж, вакуум-аспирацию или удаление матки (гистерэктомию).
В случае необходимости проводится искусственная вентиляция лёгких, энтеральное питание пациентки. Дополнительные методы интенсивной терапии включают применение кортикостероидов, выполнение хирургической детоксикации (плазмаферез, гемосорбция, гемофильтрация) после оперативного лечения нагноений, иммунотерапию.
Прогноз и профилактика
На ранних стадиях, когда не развились выраженные признаки СПОН, устойчивая гипотензия и ДВС-синдром, прогноз благоприятный. При развитии септического шока смертность может достигать 65% (в среднем – 45%). Профилактические мероприятия состоят в своевременном лечении воспалительных заболеваний (как на этапе планирования, так и в течение беременности), борьбе с внебольничными вмешательствами (внутриматочными и вагинальными манипуляциями, криминальными абортами, домашними родами), рациональной превентивной антибиотикотерапии при оперативных вмешательствах, полноценном питании, стабилизации уровня глюкозы в крови при сахарном диабете.
3. Клинические рекомендации по диагностике и лечению тяжелого сепсиса и септического шока в лечебно-профилактических организациях Санкт-Петербурга. – 2016.
4. Гнойно-воспалительные заболевания и сепсис в акушерстве. Клинические рекомендации (протокол лечения)/ Коллектив авторов. – 2015.
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Особенностями течения гнойных ВЗОМТ в современных условиях являются следующие:
1. Изменение характера микробного фактора, снижение его роли на последующих этапах воспалительного процесса при возрастании роли системных нарушений. Воспалительный процесс теряет специфичность и поддерживается вторичной, преимущественно условно-патогенной флорой (эпидермальный, сапрофитный стафилококк) в ассоциации с атипичными возбудителями (хламидии, микоплазмы, вирусы генитального герпеса, цитомегаловирусы) или патогенными штаммами с множественной устойчивостью к антибиотикам.
2. Высокая инфицированность девушек возбудителями инфекций, передаваемых половым путем (ИППП), начиная с подросткового возраста. Так, в последние десятилетия отмечается рост распространенности курения, пьянства, наркомании, а также свободных сексуальных отношений среди подростков. Этому способствует снижение роли семьи, многих нравственных ценностей - целомудрия, моногамного брака, не только свободный доступ к порнографической литературе, но и прямая пропаганда свободных сексуальных отношений. Так, по данным диссертационной работы Ю.М. Белой [3], 13,5% девочек-подростков Московской области сексуально активны уже в возрасте 14 лет, к 17-летнему возрасту их число увеличивается до 27,5%, более 1 /3 девочек имели 2 половых партнеров и более. Инфицированность онкогенными штаммами ВПЧ среди сексуально-активных девочек-подростков составляет 50,5%. У всех ВПЧ-позитивных девочек диагностированы другие ИППП: генитальные микоплазмы (16,6%), хламидии (6,6%), трихомонады (13,3%), гонорея (3,3%), цитомегаловирус (23,3%), генитальный герпес (16,6%); 78% опрошенных девочек курят (64% - до 10 сигарет в день, 36% - пачку и более), алкоголь употребляют 59%.
5. Преобладание инфильтративных и некротических форм воспаления, описанных еще К.П. Улезко-Строгановой (1939) как септические, в отсутствие сопряженных с тяжестью заболевания клинических и лабораторных признаков инфекции.
7. Присоединение системных нарушений:
а) тяжелых гемостазиологических нарушений с наличием тромбоза вен матки и магистральных сосудов малого таза у 35,7% больных;
б) иммунных нарушений, которые при длительном течении воспалительного процесса носят более тяжелый характер, связанный с повреждением рецепторного аппарата и присоединением аутоиммунного компонента воспаления: повышенный уровень антител к рецепторам γ-интерферона наблюдается у 81,8% больных, при этом средний уровень их концентрации превышает физиологические показатели в среднем на 71%, отражая тяжесть деструкции (при средней степени превышая физиологическую на 14%, при тяжелой - на 80%). У 65,8% больных определяется повышенный (в среднем от 35 до 85% от физиологических значений) уровень аутоантител к фосфолипидам, ДНК, коллагену, мембранам нейтрофилов, при этом также имеется достоверное сопряжение продукции данных аутоантител и тяжести гнойного воспаления;
Таким образом, течение гнойного процесса (особенно длительное) приводит к выраженным функциональным и морфологическим нарушениям (метаболическим, иммунным, аутоиммунным, гемостазиологическим, гормональным), повреждению рецепторного аппарата и тканей матки.
Тактика ведения
Поскольку гнойное воспаление всегда сопровождается необратимыми морфологическими изменениями, понятно, что тактика ведения таких больных должна быть только активной, консервативно-хирургической с обязательным хирургическим компонентом и последующим полноценным этапом реабилитации для восстановления естественной фертильности или подготовки к вспомогательным репродуктивным технологиям. Это относится как к гинекологическим, так и акушерским больным.

Проблема гестоза сохраняет свою актуальность в современном акушерстве. В настоящее время все больше беременных поступает на роды с различными формами гестоза. При этом у женщин возникает риск развития не только акушерской патологии, но и гнойно-септических заболеваний (ГСЗ). В свою очередь, возникновение ГСЗ у родильниц в послеродовом периоде также является немаловажной проблемой современного родовспоможения.
Целью данного исследования явилось определение особенностей течения послеродового периода на предмет возникновения ГСЗ у родильниц, поступающих на роды с различными формами гестоза.
Течение последнего триместра беременности в 1 группе осложнилось следующими формами гестоза: отечная форма гестоза - у 61 женщины (41 %), нефропатия 1 степени - у 53 пациенток (35 %), нефропатия 2 степени - у 15 женщин (11 %), нефропатия 3 степени - у 2 женщин (1,3 %), длительнотекущий гестоз обнаружен у 6 пациенток (4 %), сочетанный гестоз - у 12 (8 %), преэклампсия - у 1 женщины (0,6 %).
Структура ГСЗ у пациенток 1 группы выглядела следующим образом. После операции кесарево сечение хирургическая раневая инфекция (ХРИ) наблюдалась в 10 случаях (6,5 %); ХРИ после родоразрешения через естественные родовые пути - в 8 случаях (5,3%). Инфекции репродуктивных органов (ИРО) имели место в 2 случаях (1,3 %). Кроме того, в 18 случаях наблюдалось нарушение инволюции матки (12 %).Таким образом, частота возникновения ГСЗ в 1 группе женщин составила 13,3 на 100 родоразрешений (20 случаев).
Во 2 группе пациенток ХРИ после операции кесарево сечение наблюдалась в 1 случае (0,6 %); ХРИ после родоразрешения через естественные родовые пути - в 5 случаях (3,3 %); ИРО - в 1 случае (0,6 %). Нарушения инволюции послеродовой матки наблюдались у 15 женщин (9,9 %). Частота возникновения ГСЗ у пациенток 2 группы составила 8 на 100 родоразрешений (12 случаев).
Для оценки силы воздействия гестоза в последнем триместре беременности на возникновение ГСЗ у родильниц в послеродовом периоде вышеуказанные данные были занесены в четырехпольную таблицу; рассчитан показатель относительного риска. Его значение оказалось равным 1,6, что свидетельствует о наличие силы связи между гестозом в последнем триместре беременности и развитием ГСЗ у родильниц в послеродовом периоде, а также достоверной силе связи между присутствием у женщин различных форм гестоза перед родами и частотой возникновения послеродовых ГСЗ.
Результаты проведенного исследования позволяют считать, что имеется высокая вероятность того, что гестоз в последнем триместре беременности является одним из факторов, приводящих к увеличению частоты возникновения ГСЗ у родильниц в послеродовом периоде.
Читайте также:

