Salmonella and campylobacter jejuni
Обновлено: 25.04.2024
Несмотря на прогресс в лечении и профилактике инфекционных заболеваний, острые кишечные (диарейные) заболевания (ОКДЗ) продолжают оставаться весьма значимой проблемой во всех без исключения странах мира, поскольку по-прежнему стабильно удерживают второе
Несмотря на прогресс в лечении и профилактике инфекционных заболеваний, острые кишечные (диарейные) заболевания (ОКДЗ) продолжают оставаться весьма значимой проблемой во всех без исключения странах мира, поскольку по-прежнему стабильно удерживают второе место в структуре заболеваемости и смертности в мире [1, 2]. По данным Всемирной организации здравоохранения, ежегодно в мире от диарейных заболеваний умирает свыше 2 млн человек [3]. В экономически развитых странах, например США, ежегодная заболеваемость острой диареей оценивается от 211 млн до 375 млн случаев в год (показатель заболеваемости — 1,4 случая на 1 человека), что обусловливает более чем 900 тыс. госпитализаций и около 6 тыс. летальных исходов [4, 5]. Не менее актуальной проблема ОКДЗ остается и для Российской Федерации.

Как показывают многочисленные исследования [6–8], этиологическая структура ОКДЗ в последние десятилетия претерпевает определенные изменения и может существенно различаться в различных географических зонах. Так, в частности, в ряде экономически развитых стран реже стали выделяться при обследовании больных с диареями инфекционной природы Shigella spp. и Salmonella spp., тогда как удельный вес некоторых других возбудителей (например, энтеровирулентных (диареегенных) кишечных палочек) возрос. Характерной особенностью стран Западного полушария является существенный рост острых диарей вирусной этиологии. Столь разнообразная этиологическая структура ОКДЗ требует от врача дифференцированного подхода к проводимому лечению, и прежде всего к назначению антимикробных препаратов (АМП).
В связи с этим адекватность и эффективность проводимой терапии у больных ОКДЗ зависит от своевременности установления этиологии заболевания, что возможно только благодаря использованию специальных лабораторных методов исследования. Так, в частности, современные методы лабораторной диагностики при ОКДЗ позволяют повысить показатель этиологической расшифровки до 35–40%, тогда как в 70-е годы ХХ столетия он не превышал 10–15%.
АМП занимают важное место в лечебной тактике больных ОКДЗ, поскольку их своевременное назначение (естественно, при наличии показаний к применению) действительно может способствовать сокращению сроков заболевания, снижению его тяжести, летальности и устранению неблагоприятных последствий перенесенного заболевания [9]. Однако это не служит свидетельством абсолютной необходимости применения АМП у больных ОКДЗ. Более того, нерациональное применение АМП не только способствует формированию полирезистентности, но и в некоторых случаях может негативно сказываться на течении самого заболевания. К числу неблагоприятных последствий нерационального применения АМП следует отнести возможность развития дисбиоза с повышенной колонизацией слизистой кишечника условно-патогенными бактериями и грибами, формирование длительного носительства Salmonella spp. и Clostridium (C.) difficile, повышение риска развития осложнений, связанного с повышенной продукцией Shiga-подобного токсина Escherichia (E.) coli [10]. Развитие диарейного синдрома при бактериальных ОКДЗ обусловлено наличием у возбудителей определенных факторов патогенности, среди которых ключевое место занимают выработка токсинов (энтеротоксины, цитотоксины) и инвазивность. Характер формирующегося патологического процесса как раз и зависит от экспрессии возбудителем факторов патогенности.
Энтеротоксины представляют собой белковые молекулы, которые через активацию естественных внутриклеточных механизмов (циклический аденозинмонофосфат, гуанозинмонофосфат и др.) способны усиливать секрецию жидкости и электролитов в просвет кишечника, в результате чего развивается обезвоживание (дегидратация) организма. Большинство бактериальных возбудителей ОКДЗ способны вырабатывать различные типы энтеротоксинов (Vibrio (V.) cholerae, E. coli, Salmonella spp., Campylobacter jejuni, Yersinia enterocolitica, C. difficile, C. perfringens, Staphylococcus (S.) aureus, Bacillus (B.) cereus и др.). Особенностью действия этого класса токсинов является то, что они не вызывают морфологических изменений в слизистой кишечника.
Цитотоксины так же представляют собой белковые молекулы, однако механизм их действия сводится к повреждению и гибели различных типов клеток (прежде всего эпителиоцитов), развитию воспаления и повышению проницаемости мембран. К числу цитотоксинпродуцирующих бактерий-возбудителей ОКДЗ относятся Shigella dysenteriae, Salmonella spp., Yersinia enterocolitica, Campylobacter jejuni, E. coli (прежде всего E. coli О157:Н7), C. difficile, C. perfringens и др.
Под инвазивностью подразумевается способность бактерий пенетрировать мембраны, проникать в цитоплазму эпителиальных клеток и, размножаясь в ней, разрушать инвазированные клетки. В некоторых случаях инвазия проявляется транслокацией возбудителя в подслизистый слой. Штаммы бактерий, обладающие инвазивностью, вызывают развитие выраженной воспалительной реакции в подслизистом слое кишечника с возможным образованием язв и эрозий на слизистой оболочке. Инвазивностью обладают Shigella spp., Salmonella spp., Campylobacter jejuni, Yersinia enterocolitica, некоторые виды E. coli и др.
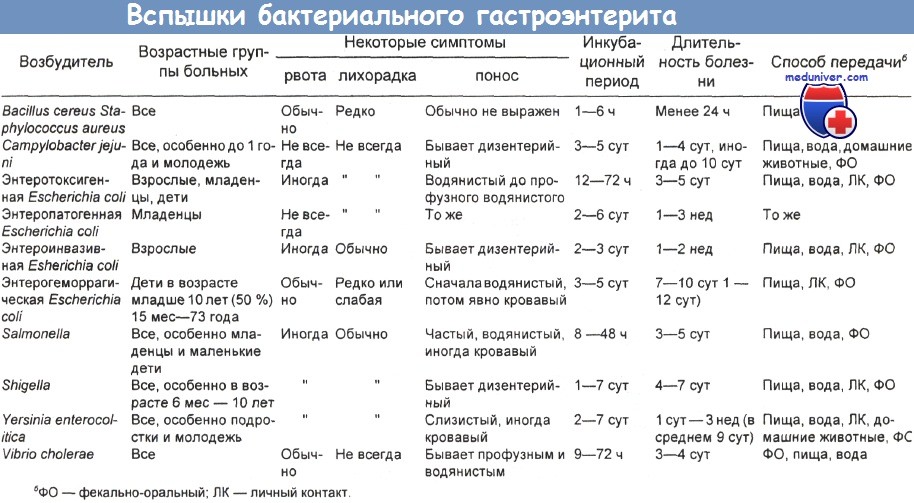
В конечном итоге характер формирующегося патологического процесса и клинические проявления заболевания непосредственно будут зависеть от тех факторов патогенности, которые экспрессирует возбудитель. По вариантам клинического течения ОКДЗ могут классифицироваться в зависимости от уровня вовлеченности в патологический процесс различных отделов желудочно-кишечного тракта (гастритический, гастроэнтеритический, энтероколитический, гастроэнтероколитический) и системных проявлений заболевания. В таблице 1 приведены основные клинико-эпидемиологические данные, характеризующие различные ОКДЗ бактериальной этиологии.
Большое значение в установлении первичного диагноза имеет определение длительности инкубационного периода. Самый короткий инкубационный период в группе ОКДЗ бактериальной этиологии типичен для пищевых токсикоинфекций (ПТИ), что объясняется поступлением в организм человека с факторами передачи (пищевыми продуктами) не только самого возбудителя, но и уже выработанных энтеротоксинов. Так, при ПТИ стафилококковой этиологии инкубационный период может составлять менее 6 ч, а при иной этиологии - от 6 до 24 ч. Более пролонгированный инкубационный период (от 16 до 72 ч) типичен для сальмонеллезов, шигеллезов, кампилобактериозов, иерсиниозов, эшерихиозов, вибрио-инфекции, в том числе холеры.
ОКДЗ, обусловленные возбудителями, способными вырабатывать только энтеротоксины, отвечают за развитие заболеваний, протекающих по гастроэнтеритическому и гастритическому вариантам (как правило, это характерно для ПТИ). В типичных случаях применение АМП у этих больных не целесообразно, поскольку микробный фактор в патогенезе заболевания играет ограниченную роль. Только в отдельных случаях, связанных с нарушением защитных свойств организма, у больных при ПТИ возможна гематогенная диссеминация возбудителя [11].
В проведении терапии АМП нуждаются прежде всего больные, у которых выявляются признаки экссудативной (воспалительной) диареи, обусловленной инвазивными штаммами бактерий; лица с тяжелым течением заболевания (в том числе и с выраженной дегидратацией); дети до 3 лет и лица пожилого возраста; пациенты, имеющие прямые и косвенные признаки иммуносупрессии (в том числе лица, перенесшие трансплантацию органов и тканей, больные сахарным диабетом, циррозом печени, хронической почечной недостаточностью и др.); лица с признаками генерализации процесса.
Важно помнить, что выбор АМП при лечении больных ОКДЗ должен основываться не на традиционных представлениях об эффективности какой-либо группы препаратов, а на результатах мониторинга чувствительности энтеропатогенных бактерий к АМП, изолированных в конкретной географической зоне. Если информация о регионарной резистентности отсутствует или недоступна, следует учитывать сведения, полученные в соседних регионах, либо результаты микробиологического анализа локальных вспышек и эпидемий последних лет. Эффективность назначаемого АМП оценивается по основным клиническим проявлениям в течение 48 ч от момента начала терапии. В качестве критериев эффективности при ОКДЗ чаще всего выступают такие клинические признаки, как снижение кратности дефекаций, уменьшение количества патологических примесей в стуле (крови, слизи, гноя), снижение тяжести лихорадки, улучшение аппетита и др. Наиболее высокая клиническая эффективность АМП отмечается при максимально раннем начале ее применения, что, кроме этого, снижает риск контактного распространения возбудителя. В таблице 2 приведены основные группы АМП и схемы их применения у взрослых с ОКДЗ бактериальной этиологии.
Наглядной иллюстрацией могут служить АМП, еще недавно широко использовавшиеся в лечении шигеллезов, но не рекомендованные к применению на современном этапе. К ним относятся:
- ампициллин, хлорамфеникол (левомицетин), триметоприм/сульфаметоксазол (ко-тримоксазол), тетрациклин. Эти препараты, широко использовались в лечении шигеллезов в прошлом. Большинство Shigella spp. резистентны к ним;
- нитрофураны, аминогликозиды, цефалоспорины I и II поколений (цефазолин, цефалотин, цефаклор, цефокситин), пенициллины (амоксициллин). Даже при определении in vitro чувствительности шигелл (к нитрофуранам) препараты обладают низкой эффективностью ввиду слабого проникновения в слизистую оболочку кишечника;
- налидиксовая кислота. Препарат использовался в прошлом, большинство Shigella spp. резистентно к нему. Его применение может ускорять формирование перекрестной резистентности к ципрофлоксацину (повышает показатель минимальной ингибиторной концентрации).
Кроме классических возбудителей ОКДЗ, необходимо помнить и о некоторых новых, недавно описанных бактериальных возбудителях, поскольку заболевания, ими вызываемые, требуют иного подхода к лечению. В связи с этим особого внимания заслуживают ОКДЗ, обусловленные штаммами E. coli, продуцирующими Shiga-подобный токсин. Типичным представителем E. coli, входящей в данную группу (энтерогеморрагические эшерихиозы) является E. coli О157:Н7, однако, как показывают наблюдения, и некоторые другие возбудители также могут вырабатывать Shiga-подобный токсин. Для заболевания, обусловленного штаммами, продуцирующими Shiga-подобный токсин, характерно развитие гемоколита на фоне отсутствия лихорадки и интоксикационного синдрома с последующим возможным развитием гемолитико-уремического синдрома. Неожиданностью стало установление того факта, что такие препараты, как фторхинолоны, триметоприм/сульфаметоксазол, использующиеся в лечении этих больных, способны стимулировать продукцию Shiga-подобного токсина [12], что, в свою очередь, может не только усугублять тяжесть состояния больных, но и увеличивает риск развития гемолитико-уремического синдрома.
Достаточно серьезную для современного здравоохранения проблему представляет группа заболеваний, обозначаемая как антибиотико-ассоциированные колиты (ААК), наиболее распространенным возбудителем которых является C. difficile. Обычно эти заболевания проявляются как нозокомиальные диареи у лиц, получавших антибактериальную терапию препаратами широкого спектра действия. В диагностике ААК, обусловленной C. difficile, важными являются не столько результаты бактериологического исследования кала (информативность которого, кстати, весьма относительна), сколько обнаружение в копрофильтрате токсинов А и В (иммунохроматографическим методом). В лечении C. difficile-ассоциированных диарей необходимо использовать достаточно узкую группу АМП, в частности метронидазол или ванкомицин (более эффективный препарат), которые следует принимать предпочтительно энтерально. Ванкомицин обеспечивал клинический эффект более чем в 90% наблюдений уже в течение 3 дней от начала лечения, однако, как и при назначении метронидазола, в этом случае не исключается возможность рецидивов, чаще развивающихся в течение 2–3 нед после окончания лечения.
Таким образом, при ОКДЗ назначение АМП требует от врача дифференцированного подхода и обязательного обоснования характера антимикробной терапии.
Независимо от этиологии заболевания, стартовая терапия у всех без исключения больных с ОКДЗ должна включить регидратацию. При обезвоживании не выше II степени больному может проводиться оральная регидратация глюкозо-солевыми растворами, содержащими на 1 л воды 3,5 г натрия хлорида, 2,5 г бикарбоната натрия, 1,5 г хлорида калия и 20 г глюкозы, что соответствует поступлению 90 ммоль натрия, 20 ммоль калия, 80 ммоль хлорида, 30 ммоль бикарбоната и 111 ммоль глюкозы. При более высокой степени дегидратации регидратация проводится парентеральными растворами в объемах, адекватных водно-электролитным потерям.
Кроме этого, в лечении больных ОКДЗ могут применяться препараты иных фармакологических групп (энтеросорбенты, обволакивающие средства, препараты, снижающие моторику кишечника, антисекреторные препараты и др.) [13]. В конечном итоге выбор средств лечения ОКДЗ у конкретного пациента должен определяться его возрастом, предполагаемой этиологией заболевания, степенью обезвоживания и тяжестью заболевания, соматическим и иммунологическим состоянием пациента и прогнозом заболевания.
Литература
- World Health Organization. The World Health report 1996: fighting disease, fostering development. Report of the Director-General. Geneva: World Health Organization, 1996.
- LeDuc J. W., Hughes J. M. Surveillance for emerging infectious diseases. In: Guerrant R. L., Walker D. H., Weller P. F., eds. Tropical infectious diseases: principles, pathogens, and practice. Philadelphia: Churchill Livingstone. 1999; 251–60.
- Kosek M., Bern C., Guerrant R. L. The global burden of diarrhoeal disease, as estimated from studies published between 1992 and 2000//Bull. World. Health. Organ. 2003; 81 (3): 197–204.
- Herikstad H., Yang S., Van Gilder T. J. et al. A population-based estimate of the burden of diarrhoeal illness in the United States: FoodNet, 1996–1997//Epidemiol. Infect. 2002; 129 (1): 9–17.
- Mead P. S., Slutsker, Dietz V. et al. Foodrelated illness and death in the United States//Emerg. Infect. Dis. 1999; 5 (5): 607-625.
- Aranda-Michel J., Giannella R. A. Acute diarrhea: a practical review//Am. J. Med. 1999; 106 (6): 670–676.
- De Wit M. A. S., Koopmans M. P. G., Kortbeek L. M. et al. Etiology of Gastroenteritis in Sentinel General Practices in The Netherlands//Clin. Infect. Dis. 2001; 33 (3): 280–288.
- Allos B. M., Moore M. R., Griffin P. M., Tauxe R. V. Surveillance for Sporadic Foodborne Disease in the 21st Century: The FoodNet Perspective//Clin. Infect. Dis. 2004; 38 (3): 115–120.
- Lindsay J. A. Chronic Sequelae of foodborne disease//Emerging. Infectious. Diseases. 1997; 3 (4): 443–452.
- Zhang X., McDaniel A. D., Wolf L. E. et al. Quinolone antibiotics induce Shiga toxin-encoding bacteriophages, toxin production, and death in mice//J. Infect. Dis. 2000; 181 (2): 664–670.
- Горобченко А. Н., Малов В. А., Пархоменко Ю. Г. и др. Миомаляция миокарда при сепсисе стафилококковой этиологии (клиническое наблюдение)//Сепсис: проблемы диагностики, терапии и профилактики: материалы научно-практической конференции с международным участием. Харьков, 29–30 марта 2006. С. 72–73.
- Белая О. Ф., Герасимова И. Е., Малов В. А. и др. Клиническое значение выявления маркера Шига-токсина у больных острыми кишечными инфекционными заболеваниями//Кремлевская медицина. Клинический вестник. 2004. № 2. С. 67–71.
- Малов В. А., Горобченко А. Н. Острые инфекционные диарейные заболевания//Лечащий Врач. 2005. № 2. С. 6–8.
В. А. Малов, доктор медицинских наук, профессор
А. Н. Горобченко, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва
Инфекция вызванная Campylobacter jejuni: диагностика, лечение, профилактика
Представители рода Campylobacter — микроаэрофильные изогнутые грамотрицательные палочки, подвижность которых обеспечивают полярно расположенные жгутики. Вызывают диареиные заболевания, при этом микроорганизмов рода Campylobacter выделяют гораздо чаще сальмонелл и шигелл. Из более чем восемнадцати видов возбудителя наиболее патогенный (определяют в 90% случаев желудочно-кишечных инфекций) — Campylobacter jejuni.
Заражение происходит при употреблении инфицированного мяса, непастеризованного молока, птицы и воды. Campylobacter coli вызывает бактериемию у пациентов со сниженным иммунитетом.
Патогенез инфекции вызвенной Campylobacter jejuni. Campylobacter jejuni поражает слизистую оболочку тонкой кишки. При развитии синдрома Гийена—Барре обнаруживают антитела к GM1-ганглиозидам.
Возбудитель инфекции Campylobakter jejuni
Клинические признаки инфекции вызвенной Campylobacter jejuni. Гриппоподобная симптоматика, спастическая боль в животе, понос с примесью крови. При возникновении сильного болевого синдрома у детей часто ошибочно диагностируют аппендицит или кишечную непроходимость. Нередко наблюдают саморазрешающуюся бактериемию. У некоторых пациентов синдром Гийена—Барре сопровождается восходящей демиелинизацией нервных волокон, двигательными и сенсорными нарушениями, которые сохраняются на протяжении нескольких недель после эрадикации возбудителя.
Возможно развитие реактивного артрита.
Лечение инфекции вызвенной Campylobacter jejuni. Диарея обычно разрешается самостоятельно, но в некоторых случаях пациентам рекомендован приём эритромицина или фторхинолонов. При развитии септицемии показано назначение аминогликозидов.
Профилактика и контроль инфекции вызвенной Campylobacter jejuni. Профилактика заболевания состоит в правильном ведении животноводческого хозяйства и соблюдении санитарно-гигиенических норм на скотобойнях, в продуктовых и молочных магазинах, а также в домашних условиях.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клиника инфекций вызванной энтеробактериями. Диагностика, лечение
Выделяют два вида сальмонелл: Salmonella enterica и Salmonella bongori. Вид Salmonella enterica включает подвиды: enterica, salamae, arizonae, diarizonae, houtenae. Наиболее патогенны для человека и других теплокровных животных серовары подвида enterica.
Сальмонеллёз. Сальмонеллы хорошо приспособлены к обитанию в организме различных животных. У человека инфекция обычно не выходит за пределы кишечника. Заболевание характеризуется саморазрешающейся диареей. В некоторых случаях микроорганизмы могут вызывать инвазивные, угрожающие жизни человека заболевания, сопровождающиеся бактериемией, септицемией и остеомиелитом.
Сальмонелл обнаруживают в организме большинства домашних животных. Важными источниками инфекции считают больных людей и реконвалесцентных носителей. Механизм передачи заболевания — фекально-оральный (при употреблении контаминированных продуктов питания). Самые тяжёлые случаи сальмонеллёза наблюдают у пациентов со сниженным иммунитетом и сниженной секрецией желудочного сока, а также у лиц, перенёсших спленэктомию. В некоторых случаях заболевание осложняется реактивным артритом или развивается хроническое носительство.
Брюшной тиф. Возбудители брюшного тифа — серовары typhi и paratyphi подвида Salmonella enterica. Заболевание характеризуется поражением стенки кишечника, затем регионарных лимфатических узлов, сопровождается первичной бактериемией и инфекцией ретикулоэндотелиальной системы. В последующем бактерии попадают в кишечник из жёлчного пузыря, размножаются в пейеровых бляшках (развивается вторичная бактериемия), вызывают изъязвление стенки кишечника, которое может привести к кровотечению или перфорации. Пациенты предъявляют жалобы на высокую температуру, нарушение функций кишечника (диарею или запор) и сыпь (розеолёзные элементы на передней брюшной стенке). Наблюдают гепатоспленомегалию. Иногда брюшной тиф осложняется остеомиелитом и реже менингитом.
Инфекции мочевыводящих путей и пиелонефрит. Большинство инфекций мочевыводящих путей вызвают определённые серотипы Escherichia coli. Они способны к повышенному образованию К-антигена и гемолизина и прикреплению к эпителию мочевыводящих путей посредством пилей (последнее свойство характерно и для некоторых видов протея). При наличии у возбудителя маннозоустойчивых пилей развивается пиелонефрит. Важный фактор вирулентности бактерий рода Proteus — уреаза, снижающая рН и стимулирующая процесс образования камней.
Менингит и абсцессы мозга. Важной причиной менингита у новорождённых (характеризуется высокой смертностью) является Escherichia coli, штаммы которой в большом количестве продуцируют капсульный Kl-антиген. Кроме того, заболевание может быть следствием нейрохирургических вмешательств, операций по протезированию. Следует отметить, что энтеробактерии очень часто присутствуют в патогенной микрофлоре, сопровождающей абсцессы головного мозга.
Возбудитель сальмонеллеза - Salmonella enterica
Остеомиелит и септический артрит. Тяжелейшее осложнение у пациентов с серповидно-клеточной анемией и ВИЧ-инфекцией — остеомиелит или септический артрит, вызванные сальмонеллами. Кроме того, сальмонеллы и другие энтеробактерии часто вызывают инфекции костей и суставов у пожилых пациентов. Иногда эти заболевания возникают вследствие проникающего ранения. Для лечения обычно применяют фторхинолоны, так как они обладают способностью проникать в костную ткань (например, ципрофлоксацин).
Инфекции, вызванные представителями рода Klebsiella. Микроорганизмы рода Klebsiella обычно вызывают внутрибольничные инфекции. Кроме того, они могут быть причиной развития пневмонии (особенно у пациентов, находящихся на искусственной вентиляции лёгких), инфекций мочевыводящих путей, раневых инфекций и бактериемии. У высоковосприимчивых пациентов известны случаи заболеваний, сопровождающихся септицемией и заканчивающихся летальным исходом. Первичная пневмония, вызванная подвидом Pneumoniae вида К. pneumoniae, — редкое и крайне тяжёлое внебольничное заболевание, характеризующееся неблагоприятным исходом. Возбудитель прогрессирующей гранулематозной инфекции слизистой оболочки полости носа — Klebsiella rhinoscleromatis. Большинство случаев заболевания регистрируют в тропических регионах мира. Другой вид — Klebsiella ozanae — возбудитель хронической бронхо-эктатической болезни.
Инфекции, вызванные бактериями родов Enterobacter, Serratia и Citrobacter. Представители этих родов обитают в окружающей среде и могут поражать пациентов лечебных учреждений, вызывая раневые инфекции, бактериемию и внутрибольничную пневмонию. Выбор антибактериального препарата осложняется тем, что большинство возбудителей устойчиво к действию антибиотиков.
Диагностика энтеробактерий:
• Бактериологическое исследование крови или костного мозга (особенно в диагностике брюшного тифа).
• Изучение биохимических свойств возбудителя (например, способности расщеплять углеводы).
• Серотипирование (серотипы различают по липополисахаридному (О) и жгутиковому (Н) антигену) и фаготипирование применяют при эпидемиологических исследованиях.
• Колицинотипирование.
• Современные молекулярно-генетические исследования.
Лечение и профилактика инфекции вызванной энтеробактериями
Большинство грамотрицательных энтеробактерии чувствительны к действию аминогликозидов, цефалоспоринов широкого спектра действия, фторхинолонов, бета-лактамов и карбапенемов (например, меропенем). Лечение назначают только после определения чувствительности возбудителя к антимикробным средствам, так как некоторые микроорганизмы способны вырабатывать бета-лактамазу и ферменты, разрушающие аминогликозидные препараты. Возросшая в последнее время устойчивость энтеробактерии к антибиотикам широкого спектра действия обусловлена появлением штаммов, обладающих бета-лактамазами широкого спектра действия.
Препараты выбора при инфекциях мочевыводящих путей — цефалексин, ампициллин, нитрофурантоин или триметоприм.
Для профилактики заболеваний, сопровождающихся диареей, необходимо соблюдать правила личной гигиены, приготовления пищи, а также использовать безопасные источники водоснабжения. Основной метод лечения — пероральная регидратация организма.
Препарат выбора при брюшном тифе — ципрофлоксацин, альтернативные средства — триметоприм или цефалоспорины третьего поколения. В некоторых странах инфекционисты сталкиваются с заболеваниями, вызванными мультирезистентными штаммами возбудителя. Для профилактики заболевания людям, посещающим эти регионы, рекомендуют использовать живую аттенуированную (Ту21А) или бесклеточную (содержит Vi-антиген) вакцины, но вакцинация лишь частично защищает от инфекции.
Видео строение, микробиология возбудителя брюшного тифа (S. typhi)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Кампилобактериоз – острая зоонозная инфекция, вызываемая энтеробактериями Campylobacter и протекающая с преимущественным поражением пищеварительного тракта. Локализованная форма кампилобактериоза в большинстве случаев протекает по типу гастроэнтерита или гастроэнтероколита; генерализованная форма сопровождается развитием септицемии или септикопиемии. Диагноз кампилобактериоза подтверждается с помощью бактериологического посева кала, крови; серологических реакций, эндоскопии кишечника. Специфическая этиотропная терапия кампилобактериоза осуществляется противомикробными препаратами (метронидазолом, антибиотиками тетрациклинового ряда, групп макролидов или фторхинолонов и др.).
Общие сведения
Кампилобактериоз – острая кишечная инфекция, возбудителями которой являются бактерии кампилобактеры. В структуре диарейных заболеваний на долю кампилобактериоза приходится 5-15%, что говорит о его распространенности и эпидемиологической значимости. Кампилобактериоз регистрируется во всех странах мира, в т. ч. в России; более высокий уровень заболеваемости отмечается в тропических широтах. Кампилобактериозом болеют представители различных возрастных групп, однако чаще инфекция диагностируется у детей-дошкольников. Возможно возникновение как спорадических, так и групповых случаев кишечной инфекции. Пик заболеваемости кампилобактериозом приходится на летне-осенние месяцы, с июня по сентябрь.

Причины кампилобактериоза
Кампилобактериоз вызывают патогенные виды кишечных бактерий, принадлежащие к семейству Enterobacteriaceae, роду Campylobacter. В настоящее время насчитывается более 14 видов кампилобактеров, выделенных от людей и животных. Наибольшую значимость в этиологии и патогенезе кампилобактериоза человека имеют C.coli, C.jejuni, C.laridis, C.fetus: из них первые два вида вызывают большинство случаев диарейных форм инфекции, а последний - гематогенно-диссеминированные формы заболевания.
Кампилобактеры являются грамотрицательными, не образующими спор бактериями, имеющими небольшие размеры (длина 0,5-0,8 мкм, ширина 0,2-0,5 мкм), изогнутую или спиралевидную форму. Подвижность бактерий обеспечивается одним или двумя жгутиками, расположенными полярно. Оптимальными условиями для роста кампилобактеров является микроаэрофильная среда с концентрацией кислорода не более 5-10% и температурой 37-42°С, однако бактерии устойчивы и к низким температурам.
Основным источником заражения человека кампилобактериозом служат сельскохозяйственные животные и птицы, а ведущим способом передачи возбудителей – алиментарный путь, реализуемый при употреблении загрязненных мясных продуктов, молока, воды. Реже возможно проникновение микроорганизмов через поврежденную кожу, например, при укусах инфицированных животных. Заражение новорожденных может происходить трансплацентарно или во время родов. В группе риска по возникновению кампилобактериоза находятся сельские жители, работники животноводческих и птицеводческих хозяйств, а также туристы, посещающие развивающиеся страны. В большей степени заболеваемости кампилобактериозом подвержены лица, страдающие иммунодефицитными состояниями, дети и беременные женщины.
При попадании в организм кампилобактеры достигают тонкой кишки, где внедряются в ее слизистую оболочку и лимфоидные образования, вызывая развитие воспалительного процесса различной выраженности. По лимфатическим путям кампилобактеры проникают в брыжеечные лимфоузлы, червеобразный отросток, толстый кишечник. В процессе своей жизнедеятельности кампилобактеры продуцируют энтеро- и цитотоксины, а при разрушении выделяют эндотоксины, обусловливающие развитие диарейного, болевого и интоксикационного синдромов. При переходе кампилобактериоза в генерализованную форму развивается септицемия и септикопиемия, приводящие к полиорганному поражению с возникновением абсцессов в печени и селезенке, полиартрита, лимфаденита, менингита, нефрита и др.
Классификация кампилобактериоза
На основании клинико-патогенетических особенностей различают локализованную (гастроинтестинальную) и генерализованная форму кампилобактериоза. К локализованным вариантам течения инфекции относятся гастроэнтерит, гастроэнтероколит, энтерит, энтероколит, мезаденит, аппендицит. Генерализованная форма сопровождается развитием кампилобактериозной септицемии и септикопиемии.
Кампилобактериоз может иметь манифестное или бессимптомное течение. Клинически выраженные формы включают легкую, среднетяжелую и тяжелую степени. Бессимптомные формы представлены субклиническим и реконвалесцентным вариантами кампилобактериоза. В зависимости от продолжительности инфекции различают острую (до 3 месяцев), хроническую (более 3 месяцев) и резидуальную фазу кампилобактериоза.
Симптомы кампилобактериоза
В большинстве случаев кампилобактериоз протекает в локализованной форме, принимая характер энтерита, энтероколита, гастроэнтероколита или колита. У заболевших часто имеются сопутствующие заболевания ЖКТ: гастриты, дуодениты, язвенная болезнь желудка и 12-перстной кишки, дискинезии желчевыводящих путей, холециститы.
Развитие генерализованных форм кампилобактериоза отмечается у лиц с неблагоприятным сопутствующим фоном: кахексией, циррозом печени, сахарным диабетом, туберкулезом, системными заболеваниями, злокачественными опухолями, ВИЧ-инфекцией, а также у детей первых месяцев жизни. Клиническая симптоматика включает стойкую лихорадку (до 40°С и выше), профузные поты, ознобы, истощение, диспепсические явления, гепатоспленомегалию, анемизацию. В некоторых случаях транзиторная бактериемия может прогрессировать в септический процесс, вызывая развитие гнойных метастатических очагов в различных органах в виде артрита, микрополилимфаденита, перитонита, эндокардита, миокардита, плеврита, пневмонии, менингита, энцефалита и др. Течение генерализованной формы кампилобактериоза тяжелое, нередко отмечается летальный исход.
Хронический кампилобактериоз обычно связан с иммунодепрессивными состояниями, в т. ч. ВИЧ-инфекцией. Больных беспокоит субфебрилитет, неустойчивый стул, боли в мезогастрии, снижение аппетита, похудание. Часто выявляются признаки конъюнктивита, кератита, фарингита; у женщин возникают рецидивирующие вагиниты или вульвовагиниты, выкидыши. В периоды обострения кампилобактериоза могут развиться органные поражения, характерные для генерализованной формы.
Диагностика кампилобактериоза
Основаниями для подозрения на кампилобактериоз могут служить эпиданамнез (контакт с животными, туристические поездки и др.), характерные симптомы. При исследовании копрограммы в испражнениях обнаруживается воспалительный экссудат, лейкоциты, эритроциты. Ректороманоскопия или колоноскопия в разгар заболевания выявляет картину катарального, катарально-геморрагического, эрозивно-язвенного проктосигмоидита или колита.
Самым точным подтверждением кампилобактериоза является бактериологическое исследование кала. Иногда материалом для культурального исследования служит кровь, гной абсцессов, ликвор, околоплодные воды. Также проводится серологическая диагностика с помощью методов РА, РНГА, РСК, ИФА, иммуноэлектрофореза, латекс-агглютинации и др.
Гастроинтестинальная форма кампилобактериоза требует дифференциации от других ОКИ, прежде всего дизентерии и сальмонеллеза, а также мезаденита и аппендицита другой этиологии. Эндоскопическая биопсия кишечника позволяет исключить неспецифический язвенный колит и болезнь Крона. Генерализованную форму кампилобактериоза необходимо отличать от сепсиса, вызванного другим возбудителем; хроническую форму – от токсоплазмоза, бруцеллеза, иерсиниозов и других хронических инфекционных заболеваний.
Лечение и профилактика кампилобактериоза
Объем лечебных мероприятий при кампилобактериозе зависит от формы и тяжести инфекции. При легкой степени локализованных форм кампилобактериоза этиотропная терапия не проводится: в этом случае ограничиваются назначением диеты, оральной регидратации, спазмолитиков, ферментов, биологических бактерийных препаратов для коррекции дисбактериоза кишечника. При среднетяжелом и тяжелом течении гастроинтестинальных форм кампилобактериоза, а также при генерализации инфекции показано применение антибактериальных препаратов, к которым чувствительны кампилобактеры (эритромицин, тетрациклин, доксициклин, хлорамфеникол, клиндамицин, фторхинолоны, аминогликозиды, макролиды, метронидазол, фуразолидон и др.) курсом 7-14 дней. Патогенетическая терапия кампилобактериоза предполагает инфузионное введение глюкозо-электролитных и полиионных растворов, назначение десенсибилизирующих средств. Лица, перенесшие кампилобактериоз, находятся на диспансерном наблюдении у инфекциониста в течение 1 месяца и подлежат двукратному бактериологическому обследованию.
При локализованных формах кампилобактериоза прогноз благоприятный. Осложнения возможны лишь при тяжелом течении заболевания и среди лиц с отягощенным сопутствующим фоном. При генерализованных формах, развивающихся у детей, беременных женщин, ослабленных пациентов, летальность может достигать 25-30%. Профилактика кампилобактериоза должна быть направлена на предупреждение инфицированности домашних животных и птиц; санитарный надзор за водоснабжением, режимом хранения и технологией переработки пищевых продуктов; обучение населения нормам личной гигиены и правилам приготовления пищи.
Пищевое отравление Campylobacter jejuni и его лечение
Campylobacter — один из трех самых частых возбудителей диареи в мире; 2 других — это ротавирус и Shigella (E.coli более распространена в слаборазвитых странах).
а) Источники. Виды Campylobacter обнаружены у многих животных, включая кур, индеек, свиней, крупный рогатый скот, овец, коз, собак, кошек, лошадей и грызунов. Диарея, вызываемая Campylobacter, распространяется через нехлорированную воду, а также сырое козье и коровье молоко. Прямая передача от человека человеку редка, хотя известно и бессимптомное носительство патогена. Недавнее доказательство его присутствия у гомосексуалистов, возможно, объясняет некоторые желудочно-кишечные расстройства, отмечаемые в этой группе пациентов.
б) Симптоматика. Инфекция, обусловленная C.jejuni, все больше сочетается с иммунными заболеваниями, включая синдром Гийена — Барре, реактивный артрит, синдром Рейтера и острый гломерулонефрит. Симптомы появляются через 1 — 8 сут после заражения (в среднем через 3 сут). Развивается водянистый или кровавый понос с лихорадкой, недомоганием, болями в животе и головной болью. У взрослых кампилобактериоз бывает клинически неотличим от шигеллеза, но у детей в возрасте до 5 лет при шигеллезе температура обычно более высокая (выше 38 °С). Кампилобактериоз может напоминать воспалительное заболевание кишечника.
Изредка при инфекции, вызванной Campylobacter, наблюдаются острый передний увеит, слабый реактивный артрит (с положительной реакцией на HLA-B27), миалгии, гемолитико-уремический синдром, узловатая эритема и крапивница. Средняя продолжительность расстройства 3-4 сут (общий диапазон 5 ч — 12 сут), но у иммунодефицитных пациентов его отдельные симптомы могут сохраняться дольше. К неврологическим осложнениям кампилобактериозного энтерита относятся припадки, менингоэнцефалит, субарахноидальное кровоизлияние, инсульт, субдуральная эмпиема и энцефалопатия. Септицемия, обусловленная C.jejuni, встречается у пациентов крайних возрастных групп и при иммунодефиците, хотя летальные исходы при ней наблюдаются главным образом у последних. До 30 % людей с таким сепсисом не страдают от симптомов гастроэнтерита.
в) Диагностика. Дифференциально-компрессионное УЗИ правой нижней области брюшной полости может демонстрировать утолщение стенки конца подвздошной и слепой кишки. Темнопольная микроскопия мазков кала иногда позволяет выявить характерные изогнутые грамотрицательные, неспорообразующие, тонкие, подвижные палочки (по-гречески Campylobacter значит "изогнутая палка"). При окрашивании по Граму необходимо применять контрастирование карболфуксином.
У пациентов с иммунодефицитом или интоксикацией полезно провести микробиологический посев крови. Сигмоскопия демонстрирует отечную гиперемическую слизистую оболочку с мелкими серыми в глубине афтозными язвами.
г) Лечение пищевого отравления Campylobacter jejuni. Без лечения кампилобактериозный энтероколит обычно проходит за 7 — 10 сут. Опиаты и антихолинергические средства противопоказаны, поскольку могут увеличить время прохождения содержимого по кишечнику или обострить симптоматику. Зачастую единственным лечением служит регидратация. Лучшим медикаментом считается эритромицина этилсукцинат; доза 400 мг 4 раза в день обычно сокращает срок выделения микроорганизма с калом. Эффективность этого средства с точки зрения облегчения симптоматики при использовании в первые 5 дней болезни остается под вопросом.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

