Сальмонеллез и сахарный диабет
Обновлено: 22.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Зеленый кал: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Кал зеленоватого цвета у людей любого возраста может быть как вариантом нормы, так и свидетельством наличия серьезных изменений в организме.
Кал – продукт жизнедеятельности организма, формируется в толстом кишечнике, состоит на 80% из воды и на 20% из сухого остатка. В сухой остаток входят непереваренная пища (40%), почти полностью нежизнеспособная микрофлора кишечника (30%), выделения желез кишечной стенки (слизь) и отмершие клетки слизистой оболочки кишечника (30%).
Состав и характер кала определяются питанием, состоянием органов пищеварительной системы, микрофлоры кишечника, наличием сопутствующих заболеваний.
В состав нормальной микрофлоры кишечника входит большое число бифидо- и лактобактерий, кишечная палочка, бактероиды. Они полезны, поскольку выполняют защитную функцию и сдерживают размножение патогенных микроорганизмов. В меньшем количестве в кишечнике присутствуют энтеробактерии, энтерококки, клостридии, стафилококки, стрептококки, грибы рода Candida. При бесконтрольном размножении они могут вызвать неприятные симптомы.
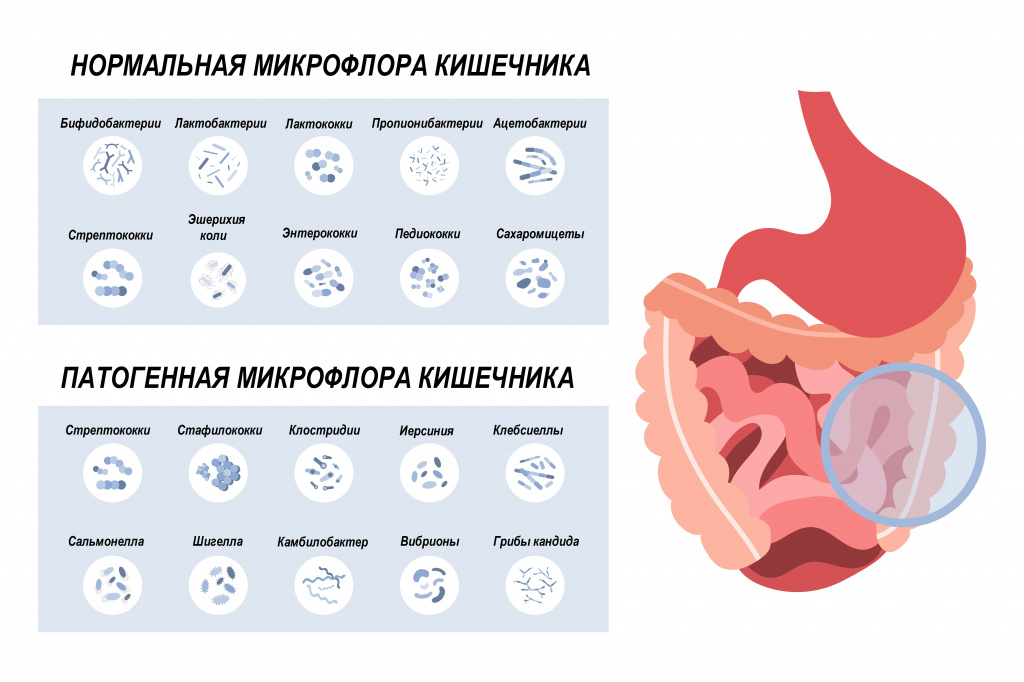
Разновидности зеленого кала
Кал зеленого цвета встречается в норме и при патологии. При патологическом характере стула меняется общее самочувствие пациента, частота дефекаций, консистенция стула, его запах, могут появляться примеси слизи, гноя, крови.
Возможные причины появления зеленого кала
Наиболее частой причиной возникновения зеленого стула без изменения других его характеристик является употребление растительной пищи зеленого цвета – шпината, щавеля, салата и т.д., а также продуктов, содержащих пищевой краситель зеленого цвета. В этом случае цвет кала нормализуется самостоятельно в течение одного-двух дней после прекращения употребления перечисленных продуктов.
Еще одним вариантом нормы является меконий – первый кал новорожденного. Он вязкий, липкий, темно-зеленого цвета, состоит из отмерших клеток кишечной стенки, слизи, околоплодных вод, желчи.
Кишечник новорожденного ребенка постепенно заселяется микроорганизмами. При этом состав микрофлоры малыша, находящегося на грудном вскармливании, несмотря на преобладание лакто- и бифидобактерий, более вариабелен, нежели у ребенка на искусственном вскармливании.
Некоторые бактерии могут влиять на цвет кала и окрашивать его в зеленый цвет. При хорошем самочувствии, аппетите и отсутствии других симптомов данные явления считаются вариантом нормы.
Стойкое нарушение состава микрофлоры кишечника (дисбактериоз) считается патологическим состоянием, влияющим на цвет каловых масс.
При приеме таблетированных и капсулированных препаратов железа избыток железа выводится естественным путем, кал приобретает темный, зеленоватый, вплоть до черного оттенок.
Кал полностью восстанавливает свои характеристики после окончания курса приема лекарств.
К возможным причинам зеленого стула относятся инфекционно-воспалительные заболевания желудка, тонкого и толстого кишечника.
При каких заболеваниях кал приобретает зеленый оттенок
Лактазная недостаточность – врожденное или приобретенное состояние, при котором отсутствует или снижается активность фермента лактазы и способность переваривать лактозу. Врожденный дефицит лактазы начинает проявляться в раннем детском возрасте и сохраняется в течение жизни; транзиторный дефицит развивается на фоне незрелости желудочно-кишечного тракта (ЖКТ) новорожденного (возникает на 3-6-й неделях жизни и снижается по мере роста и развития ребенка). Вторичная лактазная недостаточность – это следствие перенесенного заболевания, сопровождающегося повреждением клеток кишечной стенки.
Основными симптомами лактазной недостаточности являются выраженное вздутие живота, кишечные колики, жидкий пенистый стул после употребления грудного или цельного коровьего молока.
При недостаточной переработке лактозы в желудочно-кишечном тракте начинаются процессы брожения и гниения, что не может не сказаться на составе микрофлоры. При выраженном дисбалансе микроорганизмов может появиться зеленый стул.
Нарушение соотношения нормальной и патогенной микрофлоры кишечника называется дисбактериозом. Данное состояние может возникнуть на фоне резкой смены питания, при недостаточном потреблении растительной пищи и кисломолочных продуктов, из-за воспалительных процессов в ЖКТ, язвы желудка и двенадцатиперстной кишки, инфекционного поражения тонкого или толстого кишечника, после приема курса антибактериальных препаратов, на фоне снижения иммунитета.
К симптомам дисбактериоза относятся запоры или неустойчивый стул, нарушение переработки и всасывания полезных питательных веществ, вздутие и боль в животе.
Среди кишечных инфекций, для которых характерно появление зеленого стула, выделяют дизентерию, лямблиоз, сальмонеллез, ротавирус.
Дизентерию вызывают бактерии рода шигелла, которые выделяет с калом больной человек или носитель. Шигеллы проникают в организм через грязные руки, и спустя 2–3 суток начинается развитие заболевания. Размножаются бактерии в толстом кишечнике, раздражая и повреждая его стенку.
Симптомы дизентерии – ложные болезненные позывы к дефекации, а также частый скудный жидкий стул темно-зеленого цвета с примесями крови, слизи, гноя.
У больного ухудшается общее самочувствие, его беспокоит слабость, повышается температура тела. При этом из-за необильного стула риск возникновения обезвоживания остается низким, но возможно прободение стенки кишечника.
Лямблиоз вызывают простейшие – лямблии. Механизм передачи – фекально-оральный, заражение возможно при прямом контакте с больным человеком или через загрязненную воду и пищу. С момента заражения до манифестации симптомов проходит до четырех недель. Чаще болеют дети и взрослые с низкой кислотностью желудочного сока.
Простейшие вызывают симптомы воспаления тонкого кишечника: тошноту, вздутие живота, боль в верхней и средней его третях, вокруг пупка, частый (до 5 раз в сутки) жидкий, обильный, пенистый, дурно пахнущий стул зеленого цвета.
Возможны и внекишечные проявления – высыпания на коже, выраженные аллергические реакции.
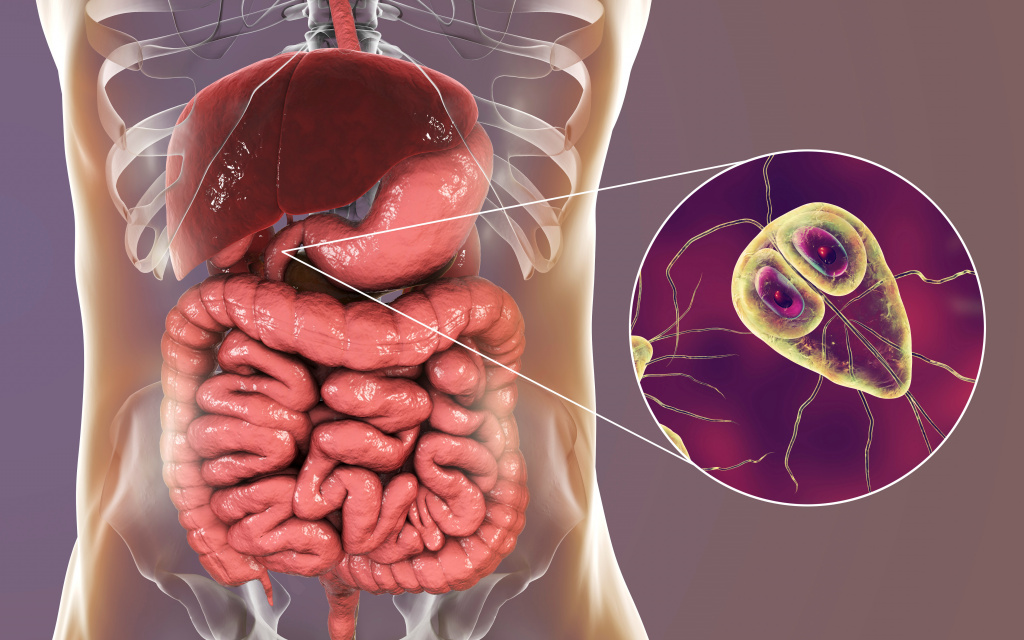
Лямблии
Сальмонеллез вызывают бактерии рода сальмонелла. В организм человека они попадают через плохо термически обработанные яйца, молочные продукты и мясо. Период от заражения до начала проявления заболевания длится до двух дней. К симптомам сальмонеллеза относят спазматическую боль в верхних отделах живота и около пупка, тошноту, рвоту (до 3 раз в сутки), а также частый (до 15 раз в сутки) обильный, жидкий, пенистый, зловонный стул цвета болотной тины.
Заболевание опасно сильной интоксикацией, обезвоживанием, возможным попаданием сальмонелл в кровь и нарушением функций многих органов и систем (сепсисом).
Ротавирус распространяется пищевым, водным, воздушно-капельным, бытовым путем. Прекрасно сохраняется во внешней среде, устойчив к большинству дезинфицирующих средств. Для развития заболевания достаточно попадания в рот всего нескольких вирусных частиц. Начинается с симптомов острой респираторной вирусной инфекции – повышения температуры тела, покраснения и болезненности горла. Затем присоединяются частая обильная рвота и частый (5–15 раз в сутки) жидкий стул, который может быть разных оттенков, в том числе желто-зеленым. На этом фоне быстро развивается обезвоживание.
К каким врачам обращаться
Если наблюдаются признаки кишечной инфекции, особенно у ребенка, лучше всего вызвать бригаду скорой медицинской помощи, которая при необходимости доставит пациента в инфекционный стационар.
Диагностика и обследования при появлении зеленого кала
Для установления причин возникновения зеленого кала врач проводит тщательный опрос и осмотр пациента, уточняет режим и характер питания, выясняет сопутствующие заболевания и состояния.
Для более полного понимания картины может потребоваться ряд лабораторных и инструментальных методов исследования:
-
общий анализ крови с развернутой лейкоцитарной формулой;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Что такое сахарный диабет 2 типа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Хитарьяна Александра Георгиевича, диабетолога со стажем в 31 год.
Над статьей доктора Хитарьяна Александра Георгиевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Эпидемия сахарного диабета (СД) длится уже достаточно долго. [9] По данным Всемирной организации здравоохранения (ВОЗ) в 1980 году на планете было около 150 миллионов человек, страдающих от СД, а в 2014 году — около 421 миллионов. К сожалению, тенденция к регрессу заболеваемости за последние десятилетия не наблюдается, и уже сегодня можно смело заявить, что СД является одним из распространённых и тяжёлых болезней.
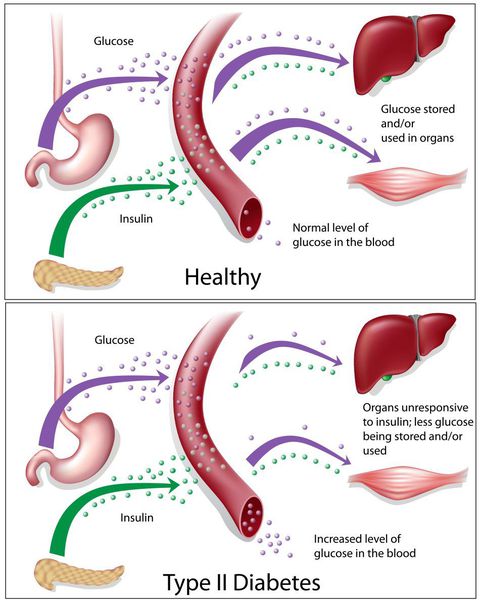
Сахарный диабет II типа (Type 2 diabetes) — хроническое неинфекционное, эндокринное заболевание, которое проявляется глубокими нарушениями липидного, белкового и углеводного обменов, связанного с абсолютным или же относительным дефицитом гормона, производимого поджелудочной железой.
У пациентов с СД II типа поджелудочная железа продуцирует достаточное количество инсулина — гормона, регулирующего углеводный обмен в организме. Однако из-за нарушения метаболических реакций в ответ на действие инсулина возникает дефицит этого гормона.
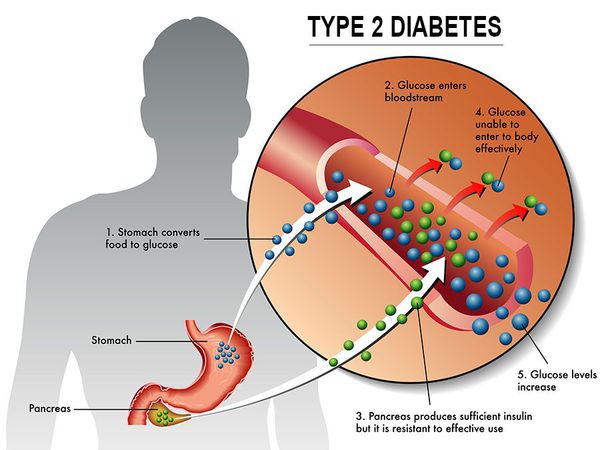
Инсулиннозависимый СД II типа имеет полигенную природу, а также является наследственным заболеванием.
Причиной возникновения данной патологии является совокупность определённых генов, а её развитие и симптоматика определяется сопутствующими факторами риска, такими как ожирение, несбалансированное питание, низкая физическая активность, постоянные стрессовые ситуации, возраст от 40 лет, бессонница. [1] [10]
Нарастающая пандемия ожирения и СД II типа тесно связаны и представляют основные глобальные угрозы здоровью в обществе. [3] Именно эти патологии являются причинами появления хронических заболеваний: ишемической болезни сердца, гипертонии, атеросклероза и гиперлипидемии.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы сахарного диабета 2 типа
Чаще всего симптоматика при СД II типа выражена слабо, поэтому данное заболевание можно обнаружить благодаря результатам лабораторных исследований. Поэтому людям, относящимся к группе риска (наличие ожирения, высокого давления, различных метаболических синдромов, возраст от 40 лет), следует проходить плановое обследование для исключения или своевременного выявления болезни.
К основным симптомам СД II типа следует отнести:
- перманентную и немотивированную слабость, сонливость;
- постоянную жажду и сухость во рту;
- полиурию — учащённое мочеиспускание;
- усиленный аппетит (в период декомпенсации (прогрессирования и ухудшения) болезни аппетит резко снижается);
- кожный зуд (у женщин часто возникает в области промежности);
- медленно заживающие раны;
- затуманенное зрение;
- онемение конечностей.
Период декомпенсации заболевания проявляется сухостью кожи, снижением упругости и эластичности, грибковыми поражениями. В связи с аномально повышенным уровнем липидов возникает ксантоматоз кожи (доброкачественные новообразования).
У больных СД II типа ногти подвержены ломкости, потере цвета или же появлению желтизны, а 0,1 – 0,3% пациентов страдают липоидным некробиозом кожи (отложения жиров в разрушенных участках коллагенового слоя).
Помимо симптомов самого СД II типа дают о себе знать также симптомы поздних осложнений заболевания: язвы на ногах, снижение зрения, инфаркты, инсульты, поражения сосудов ног и другие патологии.
Патогенез сахарного диабета 2 типа
Основная причина возникновения СД II типа — это инсулинорезистентность (утрата реакции клеток на инсулин), обусловленная рядом факторов внешней среды и генетическими факторами, протекающая на фоне дисфункции β-клеток. Согласно исследовательским данным, при инсулинорезистентности снижается плотность инсулиновых рецепторов в тканях и происходит транслокация (хромосомная мутация) ГЛЮТ-4 (GLUT4).
Повышенный уровень инсулина в крови (гиперинсулинемия) приводит к уменьшению количества рецепторов на клетках-мишенях. Со временем β -клетки перестают реагировать на повышающийся уровень глюкозы. В итоге образуется относительный дефицит инсулина, при котором нарушается толерантность к углеводам.
Дефицит инсулина приводит к снижению утилизации глюкозы (сахара) в тканях, усилению процессов расщипления гликогена до глюкозы и образования сахара из неуглеводных компонентов в печени, тем самым повышая продукцию глюкозы и усугубляя гимергликемию — симптом, характеризующийся повышенным содержанием сахара в крови.
Окончания периферических двигательных нервов выделяют кальцитонин-подобный пептид. Он способствует подавлению секреции инсулина путём активизации АТФ-зависимых калиевых каналов (K+) в мембранах β-клеток, а также подавлению поглощения глюкозы скелетными мышцами.
Избыточный уровень лептина — главного регулятора энергетического обмена — способствует подавлению секреции инсулина, приводя к возникновению инсулинорезистентности скелетных мышц к жировой ткани.
Таким образом инсулинорезистентность включается в себя различные метаболические изменения: нарушение толерантности к углеводам, ожирение, артериальная гипертензия, дислипопротеидемия и атеросклероз. Главную роль в патогенезе этих нарушений играет гиперинсулинемия, как компенсаторное следствие инсулинорезистентности. [6]
Классификация и стадии развития сахарного диабета 2 типа
В настоящее время российские диабетологи классифицируют СД по степени тяжести, а также по состоянию углеводного обмена. Однако Международная Федерация диабета (МФД) довольно часто вносит изменения в цели лечения диабета и классификации его осложнений. По этой причине российские диабетологи вынуждены, постоянно изменять принятые в России классификации СД II типа по тяжести и степени декомпенсации заболевания.
Существуют три степени тяжести заболевания:
- I степень — наблюдаются симптомы осложнений, дисфункция некоторых внутренних органов и систем. Улучшение состояния достигается путём соблюдения диеты, назначается применение препаратов и инъекций.
- II степень — достаточно быстро появляются осложнения органа зрения, происходит активное выделение глюкозы с мочой, появляются проблемы с конечностями. Медикаментозная терапия и диеты не дают эффективных результатов.
- III степень - происходит выведение глюкозы и белка с мочой, развивается почечная недостаточность. В этой степени патология не поддаётся лечению.
По состоянию углеводного обмена выделяют следующие стадии СД II типа:
- компенсированная — нормальный уровень сахара в крови, достигнутый с помощью лечения, и отсутствие сахара в моче;
- субкомпенсированая — уровень глюкозы в крови (до 13,9 ммоль/л) и в моче (до 50 г/л) умеренный, при этом ацетон в урине отсутствует;
- декомпенсированная — все показатели, характерные для субкомпенсации, значительно повышены, в моче обнаруживается ацетон.
Осложнения сахарного диабета 2 типа
К острым осложнениям СД II типа относятся:
- Кетоацидотическая кома — опасное состояние, при котором происходит тотальная интоксикация организма кетоновыми телами, а также развивается метаболический ацидоз (увеличение кислотности), острая печёночная, почечная и сердечно-сосудистая недостаточность.
- Гипогликемическая кома — состояние угнетения сознания, развивающееся при резком уменьшении содержания глюкозы в крови ниже критической отметки.
- Гиперосмолярная кома — данное осложнение развивается в течение нескольких дней, в результате которого нарушается метаболизм, клетки обезвоживаются, резко увеличивается уровень глюкозы в крови.
Поздними осложнениями СД II типа являются:
- диабетическая нефропатия (патология почек);
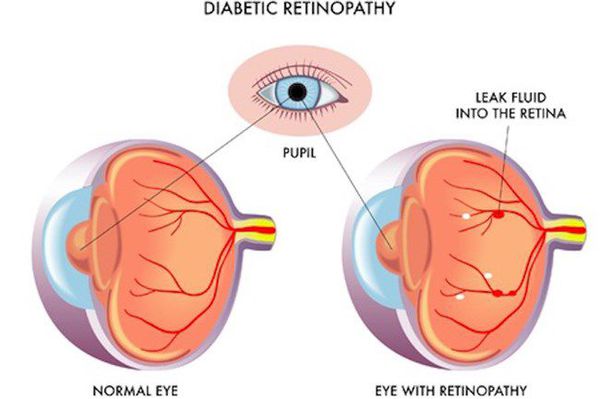
- ретинопатия (поражение сетчатки глаза, способное привести к слепоте);
- полинейропатия (поражение периферических нервов, при котором конечности теряют чувствительность);
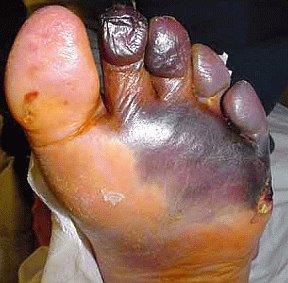
- синдром диабетической стопы (образование на нижних конечностях открытых язв, гнойных нарывов, некротических (отмирающих) тканей).
Диагностика сахарного диабета 2 типа
Для того чтобы диагностировать СД II типа необходимо оценить симптомы болезни и провести следующие исследования:
Лечение сахарного диабета 2 типа
Лечение СД II типа предполагает решение основных задач:
- компенсировать недостаток инсулина;
- скорректировать гормонально-метаболические нарушения;
- осуществление терапии и профилактики осложнений.
Для их решения применяется следующие методы лечения:
- диетотерапия;
- физические нагрузки;
- применение сахароснижающих препаратов;
- инсулинотерапия;
- хирургическое вмешательство.
Диетотерапия
Диета при СД II типа, как и обычная диета, предполагает оптимальное соотношение основных веществ, содержащихся в продуктах: белки должны составлять 16% суточного рациона, жиры — 24%, а углеводы — 60%. Отличие диеты при диабете II типа заключается в характере потребляемых углеводов: рафинированные сахара заменяются медленно усваиваемыми углеводами. Так как данное заболевание возникает у полных людей, потеря веса является важнейшим условием, нормализующим содержание глюкозы в крови. В связи с этим рекомендована калорийность диеты, при которой пациент еженедельно будет терять 500 г массы тела до момента достижения идеального веса. Однако при этом еженедельное уменьшение веса не должно превышать 2 кг, в противном случае это приведёт к избыточной потере мышечной, а не жировой ткани. Количество калорий, необходимое для суточного рациона пациентов с СД II типа, рассчитывается следующим образом: женщинам нужно умножить идеальный вес на 20 ккал, а мужчинам — на 25 ккал.
При соблюдении диеты необходимо принимать витамины, так как во время диетотерапии происходит избыточное выведение их с мочой. Нехватку витаминов в организме можно компенсировать при помощи рационального употребления полезных продуктов, таких как свежая зелень, овощи, фрукты и ягоды. В зимние и весенние периоды возможен приём витаминов в дрожжевой форме.
Физическая нагрузка
Верно подобранная система физических упражнений, с учётом течения заболевания, возраста и присутствующих осложнений, способствует значительному улучшению состояния больного СД. Эта методика лечения хороша тем, что необходимость применения инсулита практически отпадает, так как во время физических нагрузок глюкоза и липиды сгорают без его участия.
Лечение сахароснижающими препаратами
На сегодняшний день используют производные сахароснижающих препаратов:
- сульфонилмочевины (толбутамид, глибенкламид);
- бигуаниды, снижающие глюконеогенез в печени и повышающие чувствительность мышц и печени к инсулину (метформин);
- тиазолидиндионы (глитазоны), схожие по свойствам с бигуанидами (пиоглитазон, росиглитазон);
- ингибиторы альфа-глюкозидаз, снижающие темпы всасывания глюкозы в желудочно-кишечном тракте (акарбоза);
- агонисты рецепторов глюкагоноподобного пептида-1, стимулирующие синтез и секрецию инсулина, снижающие продукцию глюкозы печенью, аппетит и массу тела, замедляющие эвакуацию пищевого комка из желудка (эксенатид, лираглутид);
- ингибиторы депептидил-пептидазы-4, также стимулирующие синтез и секрецию инсулина, снижающие продукцию глюкозы печенью, не влияющие на скорость эвакуации пищи из желудка и оказывающие нейтральное действие на массу тела (ситаглиптин, вилдаглиптин);
- ингибиторы натрий-глюкозного котранспортера 2 типа (глифлозины), снижающие реабсорбцию (поглощение) глюкозы в почках, а также массу тела (дапаглифлозин,эмпаглифлозин).
Инсулинотерапия
В зависимости от тяжести болезни и возникающих осложнений врач назначает приём инсулина. Данный метод лечения показан примерно в 15-20% случаев. Показаниями к применению инсулинотерапии являются:
- быстрая потеря веса без видимой на то причины;
- возникновение осложнений;
- недостаточная эффективность других сахароснижающих препаратов.
Хирургическое лечение
Несмотря на множество гипогликемических препаратов, остаётся не решённым вопрос об их правильной дозировке, а также о приверженности пациентов к выбранному методу терапии. Это, в свою очередь, создаёт трудности при достижении длительной ремиссии СД II типа. Поэтому всё большую популярность в мире получает оперативная терапия данного заболевания — бариатрическая или метаболическая хирургия. МФД считает данный метод лечения пациентов с СД II типа эффективным. В настоящее время в мире проводится более 500 000 бариатрических операций в год. Существует несколько видов метаболической хирургии, самыми распространёнными являются шунтирование желудка и мини гастрошунтирование. [4]
Шунтирование желудка по Ру
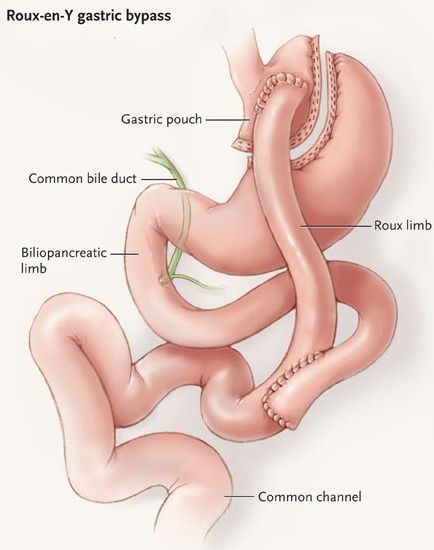
Во время шунтирования, желудок пересекается ниже пищевода таким образом, чтоб его объём сократился до 30 мл. Оставшаяся большая часть желудка не удаляется, а заглушается, предотвращая попадание в неё пищи. [5] В результате пересечения образуется маленький желудок, к которому затем пришивается тонкая кишка, отступив 1 м от её окончания. Таким образом пища будет прямиком попадать в толстую кишку, при этом обработка её пищеварительными соками снизится. Это, свою очередь, провоцирует раздражение L-клеток подвздошной кишки, способствующее снижению аппетита и увеличению роста клеток, синтезирующих инсулин.
Мини шунтирование желудка
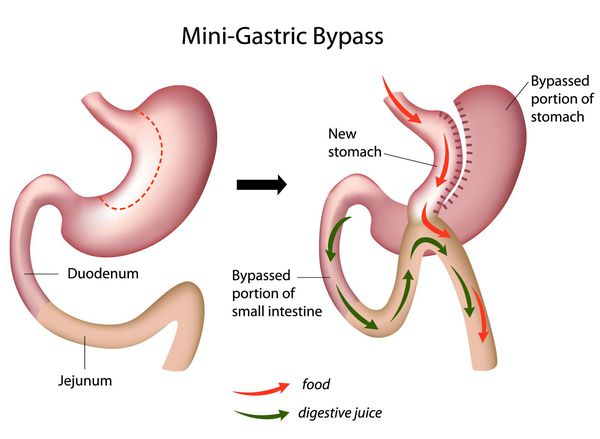
Главное отличие минигастрошунтирования от классического шунтирования желудка — сокращение количества анастомозов (соединений отрезков кишки). [2] При выполнении традиционной операции накладывается два анастомоза: соединение желудка и тонкой кишки и соединение разных отделов тонкой кишки. При минигастрошунтировании анастомоз один — между желудком и тонкой кишкой. Благодаря малому объёму вновь сформированного желудка и быстрому поступлению еды в тонкую кишку у пациента возникает чувство насыщения даже после приёма незначительных порций пищи.
К другим видам бариатрической хирургии относятся:
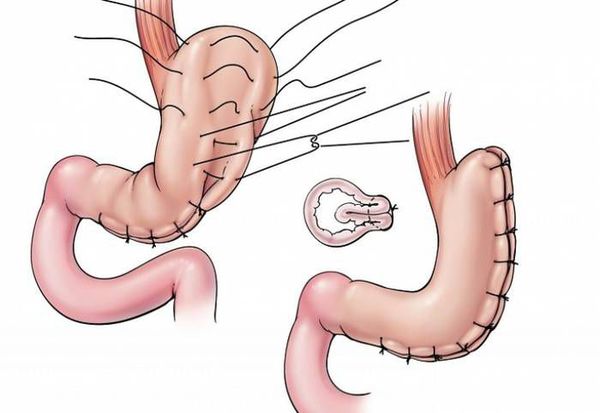
- гастропликация — ушивание желудка, предотвращающее его растягивание; [8]
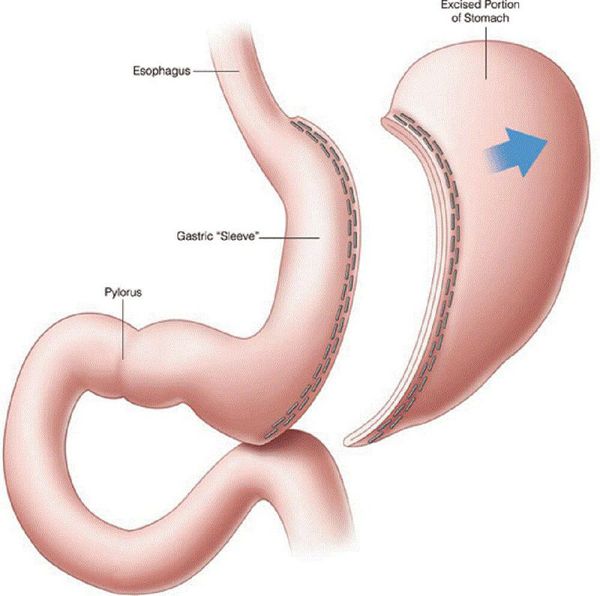
- рукавная гастропластика (иначе её называют лапароскопической продольной резекцией желудка) — отсечение большей части желудка и формирование желудочной трубки объёмом 30 мл, которое способствует быстрому насыщению, а также позволяет избежать соблюдения строгой диеты;
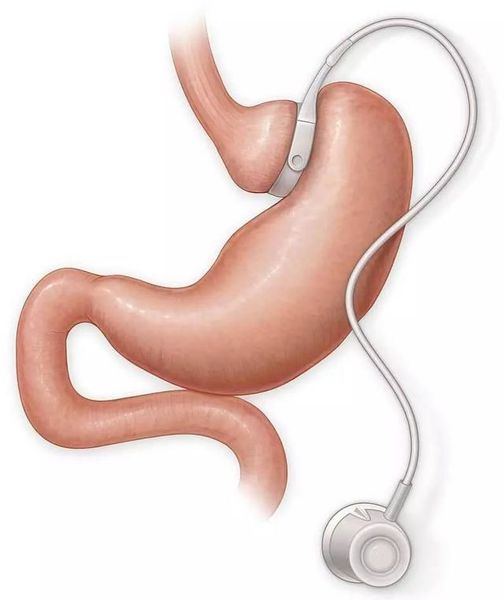
- бандажирование желудка — уменьшение объёма желудка с помощью специального кольца (бандажа), накладывающегося на верхнюю часть желудка (данное вмешательство обратимо).
Противопоказания к проведению хирургического лечения — наличие у пациента эзофагита (воспаления слизистой оболочки пищевода), варикозного расширения вен пищевода, портальной гипертенззи, цирозща печени, язвенной болезни желудка или двенадцатиперстной кишки, хронического панкреатита, беременности, алкоголизма, тяжёлых заболеваний сердечно-сосудистой системы или психических расстройств, а также длительное применение гормональных препаратов.
Прогноз. Профилактика
К сожалению, полностью излечиться от СД II типа невозможно. Однако существуют способы улучшения качества жизни пациентов с данным заболеванием.
На сегодняшний день существует большое количество “баз”, где специалисты-эндокринологи объясняют пациентам, каким должен быть их уклад жизни, как правильно питаться, какие продукты не следует употреблять, какими должны быть ежедневные физические нагрузки.
Также создано огромное количество сахароснижающих препаратов, которые ежегодно совершенствуются. Для того, чтобы они оказывали положительное влияние на организма, медикаменты необходимо принимать регулярно.
Практика показывает, что соблюдение всех рекомендаций эндокринологов улучшает процесс лечения СД II типа.
Оперативным методом, повышающим качество жизни при СД II типа по мнению МФД, является бариатрическая хирургия.
Значительно улучшить состояние пациентов с данным заболеванием позволяет проведение гастроинтестинальных операций (терапия морбидного ожирения), вследствие которой нормализуется уровень гликогемоглобина и глюкозы в крови, теряется необходимость применения антидиабетических препаратов и инсулина.
Бариатрическая хирургия может привести к значительной и устойчивой ремиссии, а также к улучшению течения СД II типа и других метаболических факторов риска у тучных пациентов. Хирургическое вмешательство в течение 5 лет после установления диагноза чаще всего приводит к долговременной ремиссии.
Для предупреждения возникновения СД II типа необходимо соблюдать следующие меры профилактики:
Что такое сальмонеллез? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Сальмонеллёз — это острое инфекционное заболевание желудочно-кишечного тракта с возможностью дальнейшей генерализации процесса (распространением заболевания по всему организму). Причина развития сальмонеллёза — различные серотипы бактерий рода Salmonella. К клиническим характеристикам сальмонеллёза относят синдром общей инфекционной интоксикации, синдром поражения желудочно-кишечного тракта (гастрит, энтерит), синдром обезвоживания, гепатолиенальный синдром (увелечение печени и/или селезёнки) и иногда синдром экзантемы (высыпания).
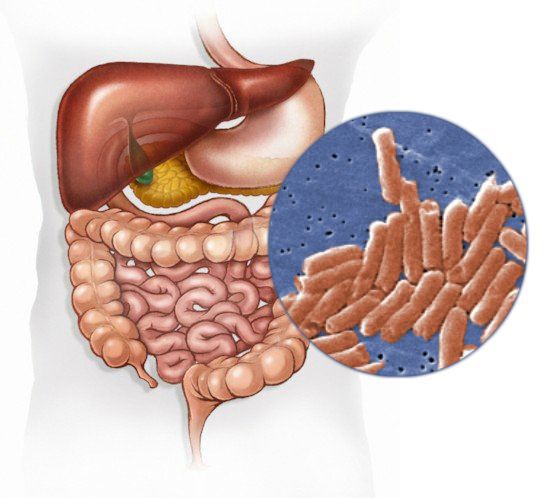
Возбудитель
семейство — кишечные бактерии (Enterobacteriaceae)
род — Сальмонелла (Salmonella)
Существует 7 подвидов (более 2500 сероваров). Наиболее актуальные серовары: typhimurium, enteritidis, panama, london.
Представлены следующей антигенной структурой:
- О-антиген (соматический, термостабильный);
- H-антиген (жгутиковый, термолабильный);
- К-антиген (поверхностный, капсульный);
- Vi-антиген (антиген вирулентности — степень способности штамма вызвать заболевание; является компонентом О антигена);
- М-антиген (слизистый).
К факторам патогенности (механизмам приспособления бактерий) относятся:
- холероподобный энтротоксин — интенсивная секреция жидкости в просвет кишки;
- эндотоксин (липополисахарид) — общее проявление интоксикации;
- инвазия — заражение.
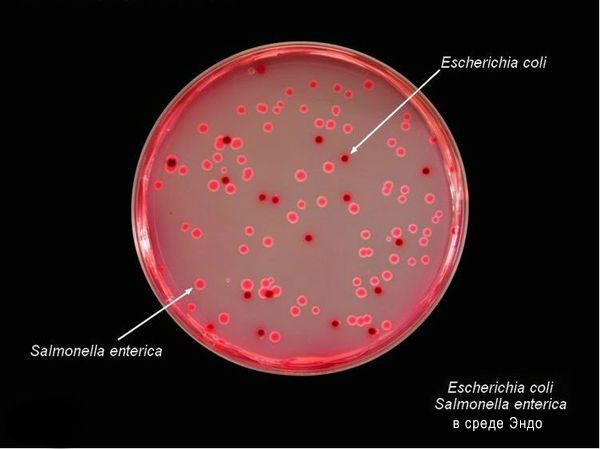
Тинкториальные свойства: разлагают глюкозу и маннит, образовывая кислоту и газ, продуцируют сероводород. Грамм-отрицательные палочки подвижны, спор и капсул не образуют. Растут на обычных питательных средах, образуя прозрачные колонии, на мясо-пептонном агаре с образованием колоний голубоватого цвета, на среде Эндо образуют прозрачные розовые колонии, на среде Плоскирева — бесцветные мутные, на висмут-сульфитном агаре — чёрные с металлическим блеском.
Высокоустойчивы во внешней среде (без агрессивных воздействий), активно размножаются в мясе и молоке (до 20 суток), в воде сохраняют жизнесособность до 5 мес., в почве — до 9 мес., в комнатной пыли — до 6 мес., в колбасе — до 1 мес., в яйцах — до 3 мес., в фекалиях сохраняются до 4 лет. При 56 °C погибают через 3 минуты, при кипячении мгновенно. Сальмонеллы, которые находятся в куске мяса массой 400 гр и толщиной до 9 см, погибают при его варке за 3,5 часа. Соление и копчение оставляет сальмонелл в живых. Воздействие кислот и хлорсодержащих дезинфицирующих средств вызывает их гибель. В последнее десятилетие появились штаммы сальмонелл, устойчивые ко многим антимикробным препаратам. [2] [5]
Эпидемиология
Зооантропоноз, распространённый повсеместно.
Источники инфекции: домашние животные (сами не болеют), птицы, человек (больной и носитель).
Резервуары инфекции и причина эпидемических вспышек сальмонеллеза: грызуны, дикие птицы, тараканы, улитки, лягушки, змеи.
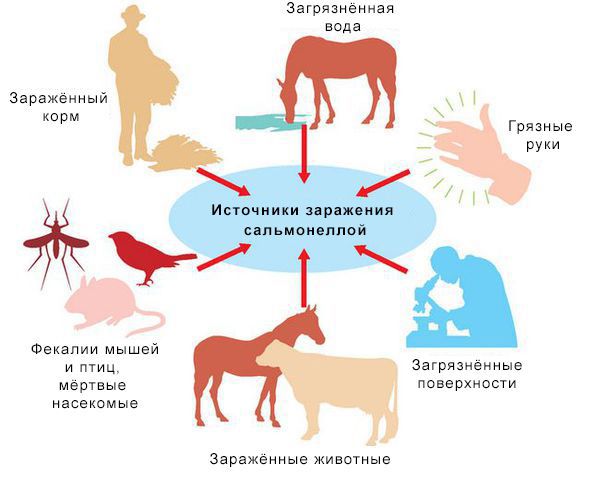
Механизм передачи: фекально-оральный (пути — алиментарный, т. е. через органы ЖКТ, водный, контактно-бытовой). В основном источниками заражения являются птицы, яйца и молочные продукты. Инфицирующая доза 10*5-10*8 микробных тел.
Факторы риска
- детский возраст до 5 лет;
- возраст до 12 месяцев, особенно высока вероятность заболеть без грудного вскармливания;
- иммунодефицит (в основном у младенцев и лиц старше 65 лет, а так же у пациентов с ВИЧ в стадии СПИДа, принимающих иммунодепрессивные препараты);
- регулярный приём препаратов, снижающих кислотность желудка;
- употребление сырого и недостаточно термически обработанного мяса, молочных продуктов и яиц;
- частый контакт с животными с несоблюдением правил гигиены;
- посещение стран с низким уровнем жизни.
В России в 2016 г. заболеваемость была – 26 на 100 тыс. населения, у детей в до 14 лет – 71 на 100 тыс. Для сравнения в США среднегодовая заболеваемость — 15 на 100 тыс. (1,35 миллиона заболеваний, 26 500 госпитализаций и 420 смертей ежегодно). Иммунитет строго типоспецифичен (возможно многократное инфицирование различными штаммами) и непродолжителен [2] [6] [9] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы сальмонеллеза
Инкубационный период — от 6 часов (при алиментарном заражении) до 3 суток. При внутрибрюшном заражении (искусственно) — до 8 дней.
Начало заболевания острое (т. е. развитие основных синдромов происходит в первые сутки заболевания).
Течение сахарного диабета (СД) 2-го типа практически никогда не удается длительно контролировать коррекцией образа жизни и очень редко — монотерапией каким-либо из пероральных сахароснижающих средств. Повсеместно применяемый на практике критерий эффективности терапии — достижение и поддержание уровня гликозилированного гемоглобина (HbA1c ) ≤ 7 % — принят на основании консенсуса ведущих экспертных организаций — Американской диабетической ассоциации (ADA) и Европейского общества по изучению сахарного диабета (EASD), но придерживаться его в реальной практике довольно трудно. В то же время экспертами по СД 2-го типа не достигнуто единого соглашения по срокам начала и оптимальному составу комбинированной терапии. В данном обзоре рассмотрены различные варианты начала комбинированной терапии с использованием наиболее популярной и патогенетически обоснованной комбинации двух классов пер-оральных сахароснижающих средств — производных сульфонилмочевины (ПСМ) и бигуанидов.
Традиционный ступенчатый подход к назначению сахароснижающих средств и проблема недостижения целевых уровней гликемии
В совместном консенсусе Американской диабетической ассоциации и Европейского общества по изучению сахарного диабета, который с момента опубликования в 2006 г. [1] стал практическим руководством для многих эндокринологов во всем мире, назначение сахароснижающей терапии пациентам с впервые выявленным СД 2-го типа рекомендуется проводить поэтапно. Согласно новой редакции этого консенсуса [2] первым препаратом, который должен получить пациент с СД 2-го типа с момента установления у него диагноза, является метформин. В случае отсутствия результата, то есть недостижения целевого уровня HbA1c ≤ 7 %, рекомендуется последовательно добавлять к метформину еще один препарат: производное сульфонилмочевины или базальный инсулин (уровень рекомендаций 1). У отдельных категорий пациентов эксперты предлагают присоединять к метформину препараты класса тиазолидиндионов (пиоглитазон) или агонистов рецепторов глюкагоноподобного пептида 1 (эксенатид) (уровень рекомендаций 2).
Врачебный фактор инерции можно представить в виде наиболее распространенных заблуждений и ошибок:
— формальный подход к выполнению клинических рекомендаций без учета всех звеньев патогенеза заболевания при подборе терапии;
— несвоевременное усиление терапии из-за боязни вызвать побочные эффекты, в результате чего лечение диабета обычно начинают с монотерапии метформином или препаратами сульфонилмочевины и только при выраженном ухудшении гликемического контроля добавляют второй препарат или инсулин [3].
В конечном итоге многие пациенты длительно получают монотерапию пероральным сахароснижающим препаратом, которым не всегда является метформин. Такая тактика приводит к тому, что большинство больных в первые годы лечения находятся в состоянии декомпенсации, а функция b-клеток постепенно снижается. Учитывая прогрессирующую природу СД 2-го типа, в дальнейшем получить эффект от лечения становится еще более затруднительным вследствие снижения количества функционирующих b-клеток. В широко цитируемом исследовании UKPDS показано, что через 3 года после установления диагноза СД 2-го типа только у половины больных на фоне монотерапии поддерживался рекомендованный уровень HbA1c, а к 9-му году наблюдения удержание целевого уровня наблюдалось менее чем у 25 % пациентов [4]. Даже в США — стране с развитой системой здравоохранения и страховой медициной — достижение целевого значения HbA1c, рекомендованного экспертами ADA и EASD, колеблется в пределах от 49,8 до 57,1 % [3, 5, 6]. Интенсификация терапии далеко не всегда улучшает результаты лечения. По результатам ретроспективного когортного исследования DARTS (Великобритания) с включением данных о лечении 2920 пациентов, доля больных, которые выполняли назначенный режим приема лекарств более чем 90 % дней в году, при монотерапии ПСМ составляла 31%, при монотерапии метформином — 34 %. В дальнейшем при усилении терапии приверженность к ней достоверно снижалась обратно пропорционально количеству дополнительно назначенных таблеток (p = 0,001) [7].
Определенные сомнения вызывает и сочетание пероральных сахароснижающих средств с инсулинотерапией. В ретроспективном исследовании, проведенном на выборке 5135 пациентов с СД 2-го типа в Германии, оценивались фактические назначения эндокринологов и их соотношение с результатами лечения. Общий анализ данных выявил, что на фоне проводимой терапии у 52,7 % больных не был достигнут целевой уровень HbA1c, при этом отмечались статистически достоверные различия в частоте нормализации гликемии между группами пациентов, получавших разные схемы лечения. Больные, которые находились на монотерапии инсулином или получали инсулин в комбинации с пероральным сахароснижающим препаратом, реже достигали целевого значения HbA1c (26,4 и 22,9 % соответственно), хотя результат в группе комбинированной пероральной терапии был не намного лучше— 31,9 % [8].
Стартовая комбинированная терапия: альтернатива или необходимость?
С другой стороны, конструктивной критике подвергается и сам ступенчатый подход к сахароснижающей терапии, задекларированный в консенсусе ADA и EASD. Основным его недостатком называют ориентированность на быстрое достижение целевого уровня HbA1c без учета всех звеньев патогенеза СД 2-го типа и клинических перспектив пациента [9–11]. Если для пациентов, не достигших целевых показателей на фоне монотерапии одним из пер-оральных сахароснижающих препаратов, необходимость перевода на комбинированную терапию не вызывает сомнения, то назначение комбинированной терапии в качестве стартовой еще не стало общепринятым, хотя активно обсуждается авторитетными зарубежными эндокринологами. По алгоритму ADA/EASD-2009 стартовую комбинированную сахароснижающую терапию необходимо назначать пациентам с уровнем HbA1c > 8,5 % или при наличии осложнений СД на момент установления диагноза. Учитывая проблему поздней диагностики СД 2-го типа, актуальную во всем мире, можно предположить, что комбинированную терапию после первого визита к эндокринологу должны получать большинство пациентов, однако на практике этого не происходит. Еще одной клинической ситуацией, в которой составители консенсуса рекомендуют переход к комбинированной терапии, является наличие противопоказаний к назначению метформина или плохая переносимость высоких доз этого препарата. В случае комбинированной сахароснижающей терапии контроль гликемии удается поддерживать меньшими дозами каждого из компонентов, что улучшает переносимость терапии.
Согласно современным представлениям о патогенезе СД 2-го типа данное заболевание рассматривается как многофакторное. При этом основной определяющий признак СД — хроническая гипергликемия — возникает как следствие сочетания инсулинорезистентности периферических тканей, нарушенной секреции инсулина b-клетками поджелудочной железы и повышенной секреции глюкагона в связи с дисфункцией инкретиновой регуляторной системы. Все перечисленные патофизиологические дефекты у большинства пациентов присутствуют уже на ранних стадиях СД. Поэтому появляется все больше сторонников назначения комбинированной сахаро-снижающей терапии, ориентированной на перечисленные звенья патогенеза, всем пациентам уже в начале лечения, а не только в ситуациях, которые перечислены в консенсусе ADA/EASD-2009 [9, 10].
Исходя из многофакторности патогенеза СД 2-го типа и рассмотренных выше проблем с достижением и удержанием целевых значений гликемии вследствие низкого комплайенса больных и врачебных ошибок, становятся очевидными следующие преимущества стартовой комбинированной терапии:
— раннее влияние на разные звенья патогенеза заболевания — инсулинорезистентность, нарушение секреции инсулина b-клетками, инкретиновую систему (при адекватном подборе препаратов с разными механизмами дейстивия);
— улучшение переносимости терапии за счет снижения доз каждого из компонентов;
— более полный контроль над симптомами диабета и профилактика осложнений с момента постановки диагноза до повторного визита;
— отсутствие необходимости объяснять пациентам причину интенсификации терапии.
Первое преимущество соответствует главному принципу лечения СД 2-го типа с точки зрения современных представлений о патофизиологии заболевания. Три последних преимущества способствуют формированию у пациентов доверия к врачу и повышению их приверженности к терапии в дальнейшем.
Выбор препаратов для комбинированной терапии
Патогенез СД 2-го типа достаточно хорошо изучен, а производители лекарств предлагают средства с разными механизмами действия, которые перекрывают весь спектр известных метаболических и молекулярно-рецепторных нарушений при данной патологии. Тем не менее вопрос оптимальной лекарственной комбинации для длительной терапии остается открытым и вызывает активные дискуссии. В последние годы предложены различные схемы комбинированной терапии, в том числе для назначения пациентам, которые только начинают лечение.
Данная комбинация хорошо вписывается в патофизиологическую концепцию лечения СД, поскольку ее компоненты действуют синергично: метформин повышает чувствительность периферических тканей к действию инсулина, а ПСМ стимулируют секрецию гормона b-клетками.
Двойная терапия метформином и ПСМ (с использованием глибенкламида, глимепирида или гликлазида) остается самой популярной в Европе. Это можно объяснить тем, что ПСМ обеспечивают выраженный эффект стимуляции секреции инсулина b-клетками, следовательно, способствуют быстрому достижению целевого уровня гликемии, а метформин является обязательным компонентом медикаментозной терапии во всех алгоритмах лечения. По количеству продаваемых упаковок сахароснижающих средств в экономически развитых европейских странах (Германии, Италии, Швеции, Дании, Норвегии) лидируют метформин, глибенкламид и глимепирид.
Косвенным показателем популярности двойной терапии метформином и ПСМ также можно считать количество фармацевтических компаний, которые производят фиксированные комбинации этих препаратов.
Преимущества фиксированной комбинации
Изначально фиксированные комбинации создавались для повышения удобства приема лекарств и приверженности больных к лечению. При лечении диабета сочетание метформина и ПСМ в одной таблетке обеспечивает следующие преимущества:
— обладает наиболее выраженным сахароснижающим эффектом и оказывает влияние на два ключевых звена патогенеза СД, что с первых месяцев терапии является залогом компенсации углеводного обмена и профилактики осложнений;
— позволяет уменьшить дозу каждого из компонентов и тем самым снизить до минимума их побочные эффекты;
— позволяет не изменять режим приема лекарств, как при добавлении второго препарата, что повышает приверженность больных к лечению;
— является наиболее доступным с экономической точки зрения;
— нет необходимости в парентеральном введении препаратов, которого так стараются избежать врачи и пациенты.
Компоненты комбинации: механизмы действия и клинические эффекты
Действие метформина на углеводный обмен осуществляется посредством нескольких механизмов, напрямую не влияющих на выделение инсулина b-клетками. Метформин подавляет продукцию глюкозы печенью за счет ингибирования глюконеогенеза и гликогенолиза, что способствует нормализации уровня гликемии натощак. В инсулиночувствительных тканях (печень, мышцы, жировая ткань) препарат повышает активность тирозинкиназы инсулиновых рецепторов, а также улучшает транспорт глюкозы белками-переносчиками — GLUT-1 и GLUT-4, за счет чего повышается чувствительность тканей к эндогенному инсулину и улучшается тканевая утилизация глюкозы. Метформин не оказывает прямого стимулирующего действия на b-клетки, поэтому не может вызывать гипогликемию. Из наиболее изученных дополнительных эффектов метформина следует отметить его свойство повышать фибринолитическую активность крови, которая у больных СД 2-го типа снижена [13].
Метформин является единственным пероральным сахароснижающим средством из применявшихся в рамках масштабного исследования UKPDS, в отношении которого было доказано снижение риска макрососудистых осложнений СД 2-го типа и увеличение продолжительности жизни больных. Интенсивный контроль гликемии с помощью метформина уменьшал показатель общей смертности больных на 42 %, а риск развития инфаркта миокарда — на 39 % по сравнению с группой диетотерапии [4].
Глибенкламид (глибурид) стимулирует постпрандиальную секрецию инсулина посредством ингибирования АТФ-зависимых калиевых каналов на плазматической мембране b-клеток поджелудочной железы. В классе ПСМ глибенкламид обладает самым высоким сродством к рецепторам сульфонилмочевины на b-клетках и самым мощным сахароснижающим эффектом. Кроме того, глибенкламид обладает экстрапанкреатическим эффектом: посредством активации рецепторной тирозинкиназы стимулирует синтез гликогена в мышечной ткани [14].
По данным исследования UKPDS, в группе интенсивной сахароснижающей терапии производными сульфонилмочевины (хлорпропамидом, глибенкламидом или глипизидом) или инсулином риск развития всех микрососудистых осложнений в среднем за 10 лет наблюдения снизился на 25% (p = 0,0099) в сравнении с группой немедикаментозного ведения больных [15].
Таким образом, восстанавливая адекватную секрецию инсулина и повышая чувствительность периферических тканей к инсулину, комбинация метформина и глибенкламида влияет на ключевые звенья патогенеза СД 2-го типа, способствует профилактике макро- и микрососудистых осложнений заболевания и увеличению продолжительности жизни больных.
Фиксированная комбинация в качестве стартовой и второй линии терапии. Доказательная база
Достижение гликемических целей и безопасность
В рандомизированном двойном слепом перекрестном исследовании, проведенном в Италии, 88 больных СД 2-го типа (исходный уровень HbA1c 8,0 ± 1,0 %; возраст 57,3±7,1 года; длительность диабета 9,8 ± 8,2 года) были распределены в три группы: монотерапии метформином (доза титровалась от 500 до 3000 мг/сут), глибенкламидом (5–15 мг/сут) и двойной терапии препаратом Глибомет от 1 до 6 таблеток в сутки (метформин от 400 до 2400 мг/сут + глибенкламид от 2,5 до 15 мг/сут). Первый период активной терапии длился 6 месяцев, после чего в группах производилась перекрестная смена назначений и лечение продолжалось еще 6 мес. Таким образом, каждый из включенных в исследование пациентов в течение определенного времени получал монотерапию или фиксированную комбинацию. Отличие данного исследования от других состоит также в более агрессивном снижении уровня HbA1c: дозы препаратов титровались для достижения цели ≤ 6 %.
80 пациентов завершили оба периода лечения и были включены в анализ эффективности. В группах монотерапии максимальная доза метформина потребовалась для достижения гликемического контроля 21 пациенту, а максимальная доза глибенкламида — 25 больным. Из них у 8 и 15 соответственно была достигнута максимальная доза Глибомета в период комбинированной терапии, то есть конечные дозы фиксированной комбинации в среднем были ниже доз монотерапии. В ходе исследования целевого уровня HbA1c ≤ 6% достигли 4 пациента группы метформина (10 %), 7 пациентов группы глибенкламида (17,1 %) и 31 пациент группы комбинированной терапии (39,2 %). Когда эффективность комбинированной терапии в сравнении с монотерапией рассчитали отдельно для каждого пациента, различия в пользу Глибомета достигли статистической достоверности: HbA1c 6,1 ± 1,1 % против 7,3 ± 1,4 % на монотерапии метформином и 6,5 ± 0,7 % против 7,6± ±1,5 % на монотерапии глибенкламидом (р < 0,0001 для всех сравнений). Таким образом, преимущество фиксированной комбинации в достижении гликемического контроля с возможностью уменьшения доз компонентов было подтверждено для каждого пациента [20].
Целью еще одного итальянского исследования было сравнить эффективность фиксированной комбинации 2,5 мг глибенкламида с 400 мг метформина (препарат Глибомет) и монотерапии глибенкламидом в дозе 5 мг/сут, то есть превышающей дозировку фиксированной комбинации в 2 раза. В исследовании участвовали 40 пациентов с избыточным весом или ожирением, средний возраст 55,86 года, средняя длительность СД 2-го типа — 9,37 года. По окончании 6-месячного периода активной терапии авторы сделали вывод о более высокой эффективности фиксированной комбинации в достижении целевых показателей углеводного обмена [21].
Учитывая вопрос, поднятый в начале статьи (оптимальное время начала комбинированной терапии), более подробно остановимся на результатах исследований с применением фиксированной комбинации метформина с глибенкламидом у первичных пациентов, то есть в качестве стартовой терапии СД 2-го типа.
Влияние на комплайенс
Доказательства улучшения приверженности больных к терапии фиксированной комбинацией по сравнению с двойной терапией разными препаратами ПСМ и метформина получены в двух ретроспективных когортных исследованиях с общим числом участников 1727 [26, 27]. В них включались пациенты, которые только начинали лечение СД, и больные, которых переводили на прием фиксированной комбинации после монотерапии или двойной терапии. Приверженность к терапии выражалась в процентах и определялась как соотношение количества дней приема прописанных препаратов к общему количеству дней в периоде наблюдения. В общей популяции больных приверженность к лечению была выше при приеме фиксированной комбинации, чем при одновременном приеме двух препаратов — глибенкламида и метформина:84 против 76 % дней без пропусков приема таблеток, р< 0,001. Уровень приверженности был достоверно выше у пациентов, которых переводили с монотерапии на прием фиксированной комбинации, чем в группе переключения на двойную терапию разными препаратами глибенкламида и метформина: 77 против 54 % (р<0,001). Кроме того, приверженность существенно улучшалась при переводе с двойной терапии на фиксированную комбинацию (с 71 до 87 %; р < 0,001).
Дополнительные преимущества
Выводы
1) все пациенты с СД 2-го типа, у которых с помощью монотерапии метформином, ПСМ или другим сахароснижающим агентом не удается достичь или поддерживать целевой уровень гликозилированного гемоглобина, рекомендованный ADA и EASD (HbA1c ≤ 7 %);
2) для стартовой терапии СД 2-го типа у пациентов с исходным уровнем HbA1c выше 8,5 %, при поздней диагностике, агрессивном течении заболевания с быстрым развитием и прогрессированием осложнений.
В обоих случаях выбор фиксированной комбинации, а не терапии двумя препаратами обоснован результатами исследований, в которых изучалось влияние различных режимов приема препаратов на комплайенс и достижение гликемических целей.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сальмонеллез: причины появления, симптомы, диагностика и способы лечения.
Определение
Сальмонеллез – инфекционное заболевание, вызываемое бактериями рода Salmonella. Чаще всего протекает с поражением органов желудочно-кишечного тракта, но описаны и случаи развития тяжелого системного процесса (с поражением других органов и систем), и бактерионосительства без клинических проявлений.
Заболевание распространено повсеместно, заразиться может человек любого возраста.
В последние годы наблюдается подъем заболеваемости во всем мире, при этом сальмонеллы становятся все менее чувствительными к антибактериальным препаратам.
Тяжелее всего сальмонеллез протекает у детей младшего возраста и характеризуется высоким риском летальности.
Причины появления сальмонеллеза
Причиной возникновения заболевания являются бактерии сальмонеллы. Они хорошо сохраняются и долго живут в окружающей среде. Им не страшен холод, поэтому заморозка продуктов не предотвращает заражение. Зато при кипячении эти бактерии погибают мгновенно.
На белье Salmonella может сохраняться до 3 месяцев, в фекалиях – до месяца, в засушенных фекалиях – годами. В водопроводной воде сальмонеллы способны жить 4–5 месяцев, в пыли – до полугода. На поверхности яйца – до 24 дней. В продуктах, даже замороженных, копченых или засоленных, сальмонеллы комфортно проживают и активно размножаются: это касается мяса крупного рогатого скота и домашней птицы, рыбы горячего копчения, колбасы, сосисок, сливочного масла, сыров, кондитерских кремов, яиц, яичного порошка и других продуктов.

Сальмонеллы проникают в желудочно-кишечный тракт с пищей, водой или через загрязненные руки, беспрепятственно проходят кислотный барьер желудка и заселяются в тонком кишечнике (реже – в толстом отделе кишечника), где и происходит дальнейшее развитие заболевания. В борьбе с клетками иммунной системы сальмонеллы разрушаются, высвобождая опасный токсин. В некоторых случаях бактерии могут с током крови и по лимфатическим путям попасть в другие органы - в печень, селезенку, легкие, кости.
Классификация заболевания
Сальмонеллез протекает в локализованной (гастроинтестинальной) или генерализованной (распространенной по всему организму) форме.
При локализованной форме сальмонеллы не выходят за пределы просвета кишечника (а если и выходят, то сразу гибнут). В зависимости от места протекания воспаления и симптоматики выделяют следующие типы сальмонеллеза:
- с преимущественным поражением желудка (гастритический);
- с преимущественным поражением желудка и тонкого кишечника (гастроэнтеритический);
- с преимущественным поражением тонкого кишечника (энтеритический);
- с преимущественным поражением тонкого и толстого кишечника (гастроэнтероколитический);
- с преимущественным поражением толстого кишечника (колитический);
- с преимущественным поражением толстого кишечника с появлением крови в кале (гемоколит).
Локализованные формы развиваются в большинстве случаев у практически здоровых взрослых и детей старше трех лет.
При генерализованной форме сальмонеллеза может наблюдаться тифоподобное (острейшее) течение с вовлечением в процесс нервной системы, септицемическое течение (с проникновением бактерий в кровь), семптикопиемическое течение (с развитием гнойных очагов поражения в органах, куда с током крови попала сальмонелла).
Генерализованные формы могут развиваться у пожилых, ослабленных людей с серьезными хроническими заболеваниями, детей раннего возраста, лиц с врожденным или приобретенным иммунодефицитом.
Возможно бессимптомное выделение сальмонелл с фекалиями – бактерионосительство. В течение трех месяцев после перенесенного заболевания носительство считается острым, более трех месяцев – хроническим, однократное выделение сальмонелл у здорового человека считается транзиторным и может наблюдаться в очаге заболевания.
Симптомы сальмонеллеза
Инкубационный период (время от вторжения сальмонелл в организм до первых клинических проявлений) составляет один-два дня, но может увеличиться до восьми дней. Это зависит от состояния организма и количества сальмонелл, попавших в желудочно-кишечный тракт.
Заболевание всегда начинается остро - с подъема температуры тела до 38–39оС и выше, интоксикации (слабости, разбитости, ломоты в мышцах и суставах). Сразу или на следующий день присоединяются симптомы поражения желудочно-кишечного тракта.
При поражении ЖКТ наблюдаются тошнота, многократная рвота, которая приносит облегчение, боли в области желудка (эпигастрия).
При поражении тонкого кишечника появляется жидкий, обильный, зловонный, зеленый, пенистый и частый стул, в котором возможна примесь слизи и прожилок крови, а также непереваренные остатки пищи. Живот болезненный в правой подвздошной области, около пупка. Усилена перистальтика (живот урчит).
При поражении толстого кишечника боли чаще разлитые и в правой, и в левой подвздошной области, в нижней части живота. Стул с примесью слизи, крови, гноя, редко бывают болезненные позывы к дефекации. Выражено вздутие живота.
Эти симптомы наблюдаются изолированно или в комбинации. Во время ультразвукового обследования может фиксироваться увеличение печени и селезенки. Риск обезвоживания возрастает при поражении желудка и тонкого кишечника. При оценке тяжести состояния обращают внимание на длительность и кратность рвоты и диареи.
Легким течением считается наличие жидкого стула в течение одного-трех дней по два-пять раз в день и рвота один-два раза в день (при этом общее состояние сильно не меняется).
Длительность заболевания более 9 дней с диареей больше 15 раз в сутки, многократной рвотой и симптомами интоксикации говорят о тяжелом течении болезни.

Диагностика сальмонеллеза
Диагностика сальмонеллеза включает осмотр и выявление жалоб больного, определение пути заражения (выявление контакта с больным инфекционной диареей или употребления воды или продуктов питания, опасных в отношении сальмонеллеза).
Наилучшим из существующих тестов для подтверждения сальмонеллеза является выявление сальмонелл в кале, рвотных массах, промывных водах желудка бактериологическим методом. Если сальмонеллы не обнаруживаются, применяют серологическое исследование крови на наличие антител к антигенам сальмонелл.
Определение этиологии ОКИЗ (острого кишечного инфекционного заболевания) и выбор рациональной антибиотикотерапии. Рациональная терапия дизентерии основана на идентификации её возбудителя - бактерий рода Shigella. Шигеллы (по имени японского учёного К. Шиги) грамотрицательные неподвижные .
Читайте также:

