Сальмонеллезные аборты у кобыл
Обновлено: 25.04.2024
Ринопневмония лошадей (Rhinopneumoniae equorum) — острая заразная болезнь лошадей, которая характеризуется кратковременной лихорадкой, угнетением, катаральным воспалением слизистой оболочки носовой полости, конъюнктивы и абортами во второй половине жеребости.
Экономический ущерб. Болезнь наносит хозяйствам большой экономический ущерб, так как вызывает массовые аборты у кобыл.
Возбудитель болезни – ДНК содержащий герпесвирус лошадей, equid (alpha) herpes virus-1. Различают 2 подтипа: первый циркулирует в западном полушарии, а второй –на евроазиатском континенте.
Диаметр вириона 100-150нм. Плавучая плотность 1,27-1,38 г/см³. ДНК составляет 10% массы вириона. Инактивируется вирус за 10 мин. при 56° С. Вирус обладает свойством агглютинировать эритроциты лошади. В культурах клеток тканей многих животных размножается с образованием внутриядерных включений и быстрым выходом вириона в среду. Высокая множественность заражения культур клеток вызывает продукцию дефектных интерферирующих частиц. При температуре 20° С вирус хранится год. Не теряет инфекционности в абортированных плодах 7дн. при 4°С. Не устойчив в среде с низким рН, инактивируется 0,3 %-ным раствором формальдегида. Переболевшие ринопневмонией животные могут выделять вирус во внешнюю среду (с истечениями из носа, их половых органов) до двух месяцев. В инфицированных органах вирус сохраняет вирулентность при температуре минус 18° в течение 457 дней.
Эпизоотологические данные. Ринопневмонией болеют лошади и пони всех возрастов и пород. Наиболее восприимчив молодняк. Лошадь является единственным известным природным хозяином для вируса данного заболевания. Из лабораторных животных к вирусу восприимчивы морские свинки, золотистые хомяки. Источником возбудителя инфекции являются больные животные и вирусоносители, выделяющие его в основном воздушно-капельным путем, с мочой, абортированным плодом, плодными водами и последом (от больных кобыл). Заражаются животные алиментарным путем. Вирус передается при контакте больного животного со здоровым, а также через инфицированные корма, воду, подстилку, предметы ухода и пр. В тех случаях, когда плодные оболочки и абортированные плоды не уничтожаются, а остаются на поверхности почвы, инфекцию могут разносить с кусками тканей плотоядные животные (собаки, лисицы и пр.) и дикие птицы. Установлено длительное вирусносительство у жеребцов — производителей, причем вирус обнаруживается в сперме. Такие жеребцы заражают здоровых животных. Заболевание среди лошадей протекает чаще в виде энзоотии, вызывая при первичном возникновении до 90% абортов. Болезнь может регистрироваться ежегодно или через различное количество лет, что зависит главным образом от условий содержания животных и от своевременности и эффективности проводимых профилактических мероприятий.
При хроническом течении заболевания процент абортов обычно бывает невысоким (не более 10). Однако стоить ввести молодняк в инфицированное помещение число абортов может увеличиться вследствие усиления болезни.
Патогенез. Вирус, попав в желудочно-кишечный тракт, проникает в кровь и заносится ею в различные органы и ткани взрослого животного. Вирус свободно проходит через плацентарный барьер, где попадает в кровь плода, которая разносит его по всему растущему организму. Во взрослом организме вирус не находит благоприятных условий для своего развития, так как ретикулоэндотелиальная система вырабатывает антитела, которые поступают в кровь и нейтрализуют вирус. Плод такими свойствами или не обладает, или реагирует на вирус очень слабо, и последний получает возможность быстро размножаться.
В этом отношении, видимо, большое значение имеет степень зрелости нервной и ретикулоэндотелиальной системы плода. В молодом возрасте данные системы еще слабо развиты, и вирус не вызывает в них защитной реакции. В более старшем возрасте рассматриваемые системы имеют определенную зрелость и соответственно реагируют на проникновение вируса в плод. Этим можно объяснить различную длительность инкубационного периода. Попадая в плод, вирус размножается во всех его тканях и органах. Вирус обладает токсическими свойствами, развитие его в стенках кровеносных сосудов нарушает их функцию, что приводит к многочисленным кровоизлияниям и отекам в органах, особенно в печени и селезенке. При размножении вируса происходит некроз мест поражения и изменения в центральной нервной системе. В печени, селезенке, мозгу и других органах возникают различной степени пролиферативные реакции. При этом в молодом возрасте преобладают некротические процессы, а в более взрослом — пролиферативные реакции со стороны ретикулоэндотелия.
При гистологическом исследовании ткани печени, эпителия желчных протоков, бронхов и эндотелия кровеносных сосудов в клетках вокруг очага некроза обнаруживаются внутриядерные тельца-включения. Они окрашиваются ацидофильно в виде гомогенной массы, но иногда вырисовывается своеобразная нежно-зернистая структура. В настоящее время принято считать эти включения тельцами вирусной природы.
Аборт происходит вследствие смерти плода, которая наступает в результате развития сепсиса.
Клинические признаки. Болезнь протекает в трех формах. Первая -сопровождается поражением верхних дыхательных путей. Вторая – абортами у кобыл. Регистрируется и нервная форма в виде параличей и парезов.
Инкубационный период до 10 суток. Болезнь может протекать остро и хронически. У животных, заболевших впервые, отмечается острое течение болезни, которая в последствие может приобретать хронический характер.
Иногда у некоторых кобыл за 7-10 дней до аборта незначительно повышается температура тела, резко снижается аппетит, отмечается угнетенное состояние. В отдельных случаях перед абортом наблюдается кашель, истечение из носа. Во время аборта возникает гиперемия слизистой оболочки глаз, ротовой и носовой полостей.
Осложненные формы болезни часто сопровождаются отеком гортани, фолликулов носоглотки, увеличением надглоточных лимфатических узлов, гнойным истечением из носа. Нередко наблюдают ослабление работы сердца, поражение центральной нервной системы, особенно у кобыл, фибринозные артриты. В ряде случаев отмечают генитальную форму ринопневмонии, орхиты у жеребцов, гиперемию с появлением пузырьковой сыпи во влагалище у кобыл.
При хроническом течении болезни отмечаются лишь аборты, и то не всегда; других симптомов заболевания не обнаруживают.
Патологоанатомические изменения обусловлены действием вируса на слизистые оболочки – обнаруживают признаки интенсивного катарального воспаления, сыпь, язвы. При септицемии отмечают признаки паренхиматозной дегенерации разной степени мышцах сердца, печени, почках. Регистрируют умеренную пролиферативную реакцию органов ретикулоэндотелиальной системы.
Отмечают признаки рассеянного менингоэнцефалита, скопление лимфоцитов и нейтрофилов в околопозвоночных ганглиях.
У абортированных плодов – конъюнктива, подкожная клетчатка и мышцы окрашены в желтый цвет. Мышечная и субплевральная соединительная ткани пропитана студенистым инфильтратом. В серозных полостях содержится прозрачная янтарная желтая или красно-желтая жидкость; количество ее в сердечной сумке достигает 50мл, а в грудной полости 1-2 л. Под эпи- и эндокардом, а также под капсулами селезенки и почек точечные или полосчатые кровоизлияния. Легкие отечны, на поверхности выступают гиперемированные геморрагические пятна.
Печень несколько опухшая и более темная, чем у здоровых плодов. На поверхности ее и в паренхиме имеется небольшое, а иногда значительное количество серых или серо-желтых очажков величиной с просяное зерно (2-3 мм в диаметре). Селезенка не увеличена, иногда на ее поверхности обнаруживаются геморрагические пятна, на разрезе — хорошо отграниченные фолликулы. Слизистая оболочка желудка, а нередко и кишок гиперемирована и содержит точечные кровоизлияния; местами обнаруживаем некрозы.
Диагноз. Диагноз ставится на основе анализа эпизоотологических, клинических данных, патологоанатомических изменений и результатов вирусологических и серологических исследований. Учитывая, что симптомов заболевания может и не быть, то при появлении абортов необходимо учитывать характер последних и выяснять эпизоотическую ситуацию. Обязательно вскрытие абортированного плода. Для установления диагноза на ринопневмонию лошадей от абортированного плода берут стерильно в пенициллиновые флаконы (пробирки) кусочки легкого, печени, селезенки, жидкость грудной и брюшной полостей, а от абортировавшей конематки – кровь в день аборта и повторно через 10-15 дней.
От лошадей с клиникой респираторного заболевания собирают слизь из носовой полости с помощью стерильных ватных тампонов, которые затем помещают во флаконы с физиологическим раствором, мясо — пептонным бульоном или раствором Хенкса. Отобранный материал помещают в термос со льдом и отправляют с нарочным для вирусологического исследования во Всесоюзный институт экспериментальной ветеринарии.
На культурах клеток выделяют вирус с последующей его идентификацией. На практике широко используют ретроспективную диагностику выявлением антител у переболевших животных в РН, ПСК и РТГА с культуральным вирусом ринопневмонии.
Дифференциальный диагноз. При дифференциальной диагностике исключают грипп, сальмонеллезный аборт, риновирусную инфекцию лошадей, вирусный артрит, кормовые интоксикации и некоторые экзотические инфекции лошадей.
Для гриппа характерна лихорадка, угнетение, конъюнктивит, катар верхних дыхательных путей. Возможно и более тяжелое течение болезни. При ринопневмонии клинические симптомы у взрослых животных обычно выражены слабо или их совсем нет.
Кормовые интоксикации исключают на основании анализа эпизоотической ситуации с учетом эффективности смены кормов и результатов токсикологического исследования скармливаемого корма.
Лечение при ринопневмонии не разработано. С целью профилактики осложнений больным лошадям вводят антибиотики, в том числе и современные цефалоспоринового ряда, а также дают сульфаниламидные препараты.
Иммунитет и иммунизация. У больных животных в крови обнаруживаются антитела. Вырабатывается иммунитет высокой напряженности, но он кратковременный и через 3-6 месяцев настолько ослабевает, что животное может вновь заболеть. Однако возможна и длительная невосприимчивость животного к повторному заражению. После очередной случки от кобылы можно получить здоровых жеребят. Сейчас широко используются вакцины из культуральных аттенуированных штаммов вируса. Вирусвакцина против ринопневмонии лошадей сухая культуральная СВ/62 (Щелковский биикомбинат). Вакцинацию проводят двукратно с интервалами 3-4 месяца. Жеребых кобыл иммунизируют на 2-3 месяце жеребости, повторно на 6-7 месяце. Жеребятам вакцину первый раз вводят в возрасте 3-4 месяцев.
Имеется вакцина Пневмеквин (Франция). Эквилис Резеквин (инактивированная вакцина против ринотрахеита и гриппа лошадей) -Голландия.
Профилактика и меры борьбы. Необходимо принять строгие меры, исключающие возможность попадания возбудителя инфекции в хозяйство.
До получения результатов лабораторного исследования:
- абортировавшую кобылу или лошадь с клиникой респираторного заболевания изолируют в отдельное помещение (изолятор);
- устанавливают тщательное клиническое наблюдение за остальными лошадьми хозяйства, фермы, табуна и в случае выявления лошадей с повышенной температурой тела, последних также изолируют;
- абортированные плоды, плодовые оболочки, навоз, подстилку, инвентарь, остатки корма из денников и станков. Где содержались абортировавшие кобылы, обеззараживают в соответствии с действующей инструкцией по проведению ветеринарной дезинфекции, дезинвазии, дезинсекции и дератизации;
- абортировавших или ожеребившихся кобыл, приплод от которых погиб в первые 72 часа подвергают симптоматическому лечению. Остальных лошадей считают подозреваемых в заражении.
Хозяйство (ферму, табун), в котором установлена ринопневмония (вирусный аборт) лошадей, Постановлением Губернатора области объявляют неблагополучным и проводят необходимые ветеринарно-санитарные и хозяйственные мероприятия в соответствии с временной инструкцией о мероприятиях по борьбе с ринопневмонией (вирусным абортом) лошадей. Утвержденной Главным управлением ветеринарии Министерства сельского хозяйства СССР 7 января 1975г.
В неблагополучном по ринопневмонии лошадей хозяйстве запрещается:
- перегруппировка, вывод (вывоз) и ввод (ввоз) лошадей;
- передача спермы от жеребцов-производителей в благополучные хозяйства;
- вывоз фуража в благополучные хозяйства, отделения и фермы, где имеются лошади.
Для ухода за больными лошадьми выделяют отдельный обслуживающий персонал, транспорт и т.д. У входов (выходов) в конюшни оборудуют дезбарьеры.
Конематок, пришедших в охоту в период нахождения их в изоляторе, осеменяют искусственно спермой здоровых жеребцов-производителей.
При вынужденном убое больных или подозрительных пот заболеванию ринопневмонией лошадей:
- мясо после проваривания может быть использовано в корм животным;
- кости и внутренние органы направляют на техническую утилизацию;
- кожи дезинфицируют путем выдерживания их в течение 12 часов в слабом растворе известкового молока (1 кг свежегашеной извести на 20 литров воды) с последующим обмыванием чистой водой и высушиванием (жидкостный коэффициент 1:4).
Перед снятием ограничений по ринопневмонии лошадей в хозяйстве проводят очистку и заключительную дезинфекцию конюшен и прилегающей территории, где находились больные животные. Для дезинфекции применяют 2%-ный горячий раствор едкого натра, 5%-ную горячую эмульсию креолина, осветленный раствор хлорной извести, содержащей 2-3% активного хлора, 2%-ный раствор формальдегида.
Дезинфекцию сбруи, спецодежды и предметов ухода за животными проводят в соответствии с действующей инструкцией по проведению ветеринарной дезинфекции, дезинвазии, дезинсекции и дератизации.
Хозяйство (ферму) объявляют благополучным по ринопневмонии и снимают ограничения через два месяца после последнего случая аборта или рождения нежизнеспособного жеребенка, а при наличии в хозяйстве конематок во второй половине жеребости-после благополучной выжеребки. Ипподромы и другие хозяйства, где нет жеребых конематок — через месяц после последнего случая выздоровления больных лошадей.
Сальмонеллезный (паратифозный) аборт кобыл-инфекционное заболевание, сопровождающееся у жеребых кобыл преждевременным прекращением беременности и изгнанием из матки мертвого или нежизнеспособного плода.
Историческая справка. Болезнь известна с конца 18 века. В России данное заболевание впервые описал в 1901году Д.В. Поляков. Сейчас данное заболевание регистрируется во многих странах мира в том числе и России, проявляясь спорадическими или энзоотическими вспышками.
Экономический ущерб состоит в том, что в коневодстве происходит нарушение цикла воспроизводства стад и идет торможение племенной работы.
Возбудитель болезни — сальмонелла абортус экви, подвижная, грамотрицательная полиморфная палочка с закругленными краями, не образующая спор. Палочка довольно устойчива к физическим факторам, так прямые солнечные лучи убивают ее на поверхности почвы через 10дней, а на глубине 0,5 см только спустя 2 месяца. Бактерия выдерживает высушивание в течение 5 месяцев, приобретая при этом сапрофитные свойства. При кипячение бактерии погибают моментально, при нагревании до 60 градусов – через 30минут; 2%-ный раствор карболовой кислоты убивает их через 5минут, 0,5%-ный раствор формальдегида-через 15минут.
Эпизоотологические данные. Данная инфекция чаще встречается у молодых кобыл. Данным заболеванием болеют также новорожденные жеребята, как бессимптомная инфекция заболевание может наблюдаться и у жеребцов.
Источником возбудителя инфекции являются абортировавшие кобылы, выделяющие вместе с плодными оболочками и истечением из влагалища большое количество вирулентных бактерий (в 1мл влагалищных истечений находится до 10млн. микробных тел), а также бактерионосители (бактериовыделение идет 10-15, иногда 60дней, доходя в отдельных случаях до 5 месяцев).
После аборта выделения больных кобыл загрязняют почву, водоемы, корма, подстилку. Заражение здоровых кобыл паратифозными микробами происходит в основном алиментарным путем через инфицированные корма и воду. Заразить здоровых кобыл могут и жеребцы, когда они сначала кроют больных, а потом здоровых кобыл. У жеребцов могут возникать орхиты, вызванные сальмонеллой абортус экви.
Возбудитель сальмонеллезного аборта длительное время может находится в желчных ходах и кишечнике. Эти бактерии с калом выделяются во внешнею среду, отличаясь от тех которые выделяются из половых органов больных кобыл (становясь не патогенными для мелких лабораторных животных). Однако при снижении резистентности организма кобыл, такой возбудитель быстро восстанавливает свою вирулентность.
На возникновение и течение сальмонеллезного аборта кобыл большое влияние оказывают неблагоприятные факторы внешней среды, к которым относится резкое похолодание в начале зимы или ранней весной, недостаточное кормление, вызывающее у кобыл нарушение минерально-витаминного обмена и ряд других неблагоприятных факторов. Наибольшее количество абортов в табунах появляется в сентябре-ноябре и в феврале-марте, с наступлением весны и выгоном лошадей на пастбище аборты, обычно прекращаются.
В коневодческом хозяйстве сначала появляются единичные случаи абортов, спустя 2-3 недели отмечаем вспышку болезни, сопровождающуюся большим количеством абортов. После такой вспышки в хозяйстве в течение 1-3лет происходит резкое сокращение или даже полное прекращение паратифозных абортов.
Патогенез. Попав в кишечник беременной кобылы возбудитель проникает в кровь, где развивается быстро проходящее септическое состояние, в результате которого бактерии заносятся в родовые пути где и размножаются. Происходит воспаление плодных оболочек, тканей плода, воспаление слизистой оболочки матки, вызывая септико-токсическое поражение плода, что приводит к гибели плода и его аборту.
Иммунитет. Установлено, что у кобыл абортировавших от паратифозной инфекции, повторные аборты наблюдаются редко, что связано с наличием у переболевших животных иммунитета. Все попытки получить эффективную вакцину, содержащих убитых паратифозных бактерий, для активной иммунизации кобыл против сальмонеллезного аборта не увенчались успехом.
При раннем внутриутробном заражении жеребята рождаются слабыми, без посторонней помощи не могут стоять на ногах, имеют слабый сосательный рефлекс.
Патологоанатомические изменения. Слабая упитанность плода, желтушное окрашивание кожи, слизистых и серозных оболочек. Утолщение пуповины. В легких, печени и селезенке кровоизлияния. Характерной особенностью являются множественные кровоизлияния в плодных оболочках. Хорион вместо обычного веса в среднем 2,5кг весит до 8кг, в стенке хориона находим гнойно-некротические участки.
Диагноз. Диагноз на сальмонеллезный аборт у лошадей ставится с учетом эпизоотической обстановки, исключения действия неинфекционных факторов (простуда, неудовлетворительное кормление). Точный диагноз на сальмонеллезный аборт можно будет поставить только при проведении бактериологического исследования патологического материала в ветеринарной лаборатории.
В лабораторию ветспециалист направляет плод, плодные оболочки и выделения из влагалища. Можно посылать кровь из сердца абортировавшего плода, кусочки печени и содержимое желудка. При обнаружение в патологическом материале возбудителя сальмонеллезного аборта диагноз считается установленным.
Дифференциальный диагноз. Сальмонеллезный аборт необходимо дифференцировать от ринопневмонии, хламидиоза и вирусного артериита лошадей, на основании данных лабораторного исследования, клинических признаков и патологоанатомических изменений в плоде.
Лечение. С целью предупреждения осложнений после аборта и уничтожения возбудителя в выделениях из матки проводят промывание родовых путей теплым 3-4%-ным раствором ихтиола, 0,1%-ным раствором перманганата калия. Для усиления тонуса матки применяют лекарственные препараты вызывающее ее сокращение. Проводят антибиотикотерапию в том числе современными антибиотиками цефалоспоринового ряда.
Профилактика и меры борьбы. Для предупреждения абортов у кобыл, в том числе и инфекционных, жеребых маток содержат в условиях, соответствующих зоогигиеническим и зоотехническим требованиям. В стойловый период необходимо им давать достаточное количество доброкачественного сена и концентратов, рацион балансировать по минеральным веществам и витаминам, систематически выгонять их на прогулки.
Для предупреждения заноса возбудителя инфекции в хозяйство всех прибывающих лошадей ставят на карантин, во время которого проводят тщательное клиническое обследование, а жеребых кобыл подвергаем гинекологическому обследованию и затем содержим отдельной группой до выжеребки. При появлении в табуне абортов у кобыл сальмонеллезной этиологии их немедленно изолируют и лечат, а остальных вакцинируют. Конюшню или хозяйство объявляют неблагополучной по сальмонеллезному аборту кобыл, запрещают всякую перегруппировку маточного поголовья. Плод, плодные оболочки, подстилку и остатки корма из денника или места где произошел аборт, сжигают. Навоз подвергают обеззараживанию биотермическим методом. В помещение проводят дезинфекцию обычными дезсредствами, дератизацию и дезинсекцию.
Конюшню, табун или хозяйство объявляют благополучным после нормальной выжеребки всех кобыл данной группы в текущем сезоне, с обязательным проведением всех ветеринарно-санитарных мероприятий.
Появление у сельскохозяйственных животных инфекционных абортов непосредственно связана с эпизоотическим неблагополучием сельскохозяйственного предприятия по тому или иному инфекционному заболеванию.
К идиопатическим инфекционным абортам сельскохозяйственных животных относят бруцеллезные аборты коров, овец и свиней при бруцеллезе.
Основным симптомом бруцеллеза у сельскохозяйственных животных является аборт, который у коров регистрируется на 5-6 месяце стельности, у овец и коз аборт отмечают на 3-4-ом месяце суягности. У свиноматки аборты при бруцеллезе регистрируются на 2-3месяце супоросности. Бруцелезные аборты у животных сопровождаюся осложнениями – задержанием последа, эндометритом, вульвитом и в итоге бесплодием. У самцов симптомом бруцеллеза являются орхиты и эпидидимиты.
Аборты при лептоспирозе у животных бывают при хронической форме лептоспироза. У коров лептоспирозные аборты регистрируем в разные сроки беременности, у свиноматок – в последние дни супоросности.
Диагноз. Для подтверждения аборта лептоспирозной этиологии ветеринарный специалист в ветеринарную лабораторию направляет на 3-5 день кровь от абортировавшего животного, мочу, кусочки паренхиматозных органов, почку, транссудат из грудной и брюшной полости, мочевой пузырь с содержимым, абортированный плод.
Сальмонеллезный аборт кобыл и овец. При этом заболевании у кобыл на 4-5-ом месяце, а у овец и коз на последнем месяце суягности возникает аборт. После аборта кобылы и овцы болеют эндометритом, в дальнейшем наступает бесплодие. Диагноз на сальмонеллезный аборт ветеринарный специалист ставит на основании серологического и бактериологического исследования абортировваших плодов и исследования органов павших животных.
Хламидиозный аборт
Хламидиоз — инфекционное заболевание, протекающее у животных в хронической форме и сопровождающееся у них абортами, рождением мертворожденного и нежизнеспособного приплода, задержанием последа, эндометритами. Родившийся молодняк болеет бронхопневмониями, гастроэнтеритами, полиартритами и кератоконънктивитами. У производителей хламидиоз проявляется – орхитами, поститами и снижением качества спермы.
Для подтверждения аборта хламидиозной этиологии ветеринарный специалист направляет в ветеринарную лабораторию: абортированные и мертворожденные плоды, плодные оболочки вместе с участками геморрагической инфильтрации. От павшего молодняка в ветеринарную лабораторию направляют кусочки паренхиматозных органов, лимфатические узлы. Для постановки диагноза в ветлабораторию направляют кровь для выявления антител в реакции связывания комплемента (РСК).
Аборты свиней при листериозе
Листериоз – инфекционная болезнь животных протекающая с симптомами поражения центральной нервной системы(менингоэнцефалиты), поражением половых органов (аборты, эндометриты), маститами и септицемией.
Аборты свиней при микоплазмозе.
Микоплазмоз свиней – инфекционное заболевание, обычно протекающее хронически. Клинически протекающее с поражением органов дыхания и мочевой системы, серозных покровов и молочной железы, изредка – головного мозга.
Для постановки диагноза на аборт микозной этиологии в ветеринарную лабораторию ветеринарный врач направляет бронхиальные лимфоузлы и кусочки легкого с очагами воспаления, кусочки головного мозга, печени и селезенки. При поражение мочеполовых органов и нарушение супоросности у свиноматок — абортированные плоды, мертворожденных поросят, сперму хряков. Сыворотку крови от больных и переболевших животных для выявления антител в РДСК в микрообъеме, РА и РНГА.
Аборты при трансмиссивном гастроэнтерите свиней.
Трансмиссивный гастроэнтерит свиней – высококонтагизное заболевание свиней, сопровождающееся симптомами рвоты, диареей и высокой смертностью среди поросят до двухнедельного возраста. Само заболевание у свиней сопровождает абортами в конце супоросности, рождением мертвых поросят и синдромом метрит-мастит- агалактия.
Для подтверждения диагноза в ветеринарную лабораторию ветврач направляет- пробы фекалий, тонкий отдел кишечника от поросят в начальной стадии диареи, легкие, печень,селезенку, почки для выделения вируса в акультуре клеток (СПЭВ, ПЭС) и его индентификации в РН и РИФ, выявления вирусного антигена с помощью РИФ и ИФА.
Аборты при энтеровирусной инфекции у свиней
Энтеровирусная инфекция свиней – инфекционное заболевание протекающее у поросят с симптомами пневмогастроэнтеритов, абортами, рассасыванием эмбрионов, мумификацией плодов, бесплодием, рождением мертвых и мало жизнеспособных поросят.
Для постановки диагноза на энтеровирусную инфекцию ветеринарный специалист направляет в ветеринарную лабораторию фекалии, ректальные смывы или соскобы со слизистой оболочки прямой кишки от больных свиней. От павших поросят – кусочки пораженных участков тощей, подвздошной, ободочной и прямой кишок, а также мезентериальные лимфатические узлы и легкие. От свиней — сыворотку крови животных – реконвалисцентов (дважды с интервалом в 14дней).
Аборты у свиней при классической чуме
Классическая чума свиней – высоко контагиозное заболевание, протекающее с постоянной лихорадкой, симптомами геморрагического диатеза, крупозного воспаления легких, крупозно — дифтеритическими воспалениями толстого отдела кишечника и абортами супоросных свиноматок.
Диагноз на классическую чуму ветеринарные специалисты ставят комплексно с учетом лабораторного исследования кусочков миндалин, селезенки, почек, легких, лимфатических узлов, абортированных плодов вирусологических отделах областных ветеринарных лабораторий.
Аборты при болезни Ауески
Ауески— инфекционное заболевание протекающее у животных с симптомами поражения центральной нервной системы, респираторного тракта у поросят различных возрастов и абортами у супоросных свиноматок.
Диагноз. Для лабораторного исследования в ветеринарную лабораторию ветеринарный врач направляет трупы поросят или головной мозг, кусочки паренхиматозных органов(легкого, печени), лимфатические узлы и миндалины. От абортирововших свиноматок направляются плоды и плацента.
Аборты при репродуктивно — респираторном синдроме свиней (РРСС)
РРСС — контагиозная вирусная болезнь свиней, сопровождающаяся массовыми абортами свиноматок на последней стадии супоросности (90-110дней), преждевременными родами (110-112 дней), рождением мертвых и нежизнеспособных поросят, а также мумифицированных и уродливых, падежом их в первые дни жизни, массовыми прохолостами свиноматок, метрит-мастит-агалактия у лактирующих свиноматок, поражением респираторных органов у свиней разных возрастов. При остром течении заболевания ветеринарные специалисты регистрируют угнетение, отказ от корма, кратковременное повышение температуры тела до 40,5-41°С. Роды у свиноматок затягиваются, происходит задержание последа.
Диагноз на РРСС в обязательном порядке подтверждается лабораторными исследованиями. В ветеринарную лабораторию ветврач направляет пробы крови, легких, экссудат из грудной полости, средостенные лимфатические узлы от двух – пяти свежее абортированных плодов или вынужденно убитых нежизнеспособных одно — трехсуточных поросят.
Аборты у свиней при парвовирусной болезни
Парвовирусная болезнь свиней – контагиозное заболевание, сопровождающееся у свиноматок нарушением воспроизводительной функции, прохолостами, пометы рождаются малоплодными, имеются мумифицированные плоды, мертвые и слабые поросята, аборты.
Диагноз на аборт парвовирусной этиологии ставиться на основании на основании обнаружения в сыворотке новорожденных поросят до приема им молозива или в жидкости грудной, брюшной полостей мертворожденных поросят специфических антител в реакции торможения гемагглютинации (РТГА) в разведении 1:64 и выше.
Аборт при кампилобактериозе
При кампилобактериозе аборты у коров происходят как в начальной так и поздней стадии развития беременности (2-8месяцев), у овец во второй половине суягности. После аборта у животного регистрируем задержание последа, эндометриты, вагиниты, неполноценные половые циклы.
К инфекционным симптоматическим (спорадическим) абортам относят все случаи прерывания беременности, которые возникают у беременных животных в результате переболевания их той или иной инфекционной болезнью. Инфекционные аборты при инфекционной анемии лошадей, туберкулезе, ящуре, сибирской язве, инфлюэнце, сапе, чуме крупного рогатого скота и других инфекционных заболеваниях.
Идиопатические инвазионные аборты у животных регистрируются при трихомонозе. У коров трихомонозный аборт наблюдается преимущественно в начале стельности (1 — 4 месяца). Для владельцев животных данные аборты протекают незаметно, так как отсутствуют всякие предвестники аборта. После аборта у животных возникают эндометриты и длительное бесплодие.
Диагноз на трихомонозный аборт ставиться на основании результатов микроскопического и культурального исследований выделений из влагалища и матки у абортировавших коров, а также содержимого околоплодных оболочек, ротовой полости и желудочно- кишечного тракта абортированных плодов.
Инвазионные симптоматические аборты у беременных животных бывают при гемоспоридиозных заболеваниях, наличия у животных глистной инвазии в результате интоксикации и общего ослабления организма животного.

In the article it was adduced the results of investigations of pathological material abortus of mare and questions of diagnostics and preventive maintenance salmonelosis abortion of mares are resulted. On the grounds of clinical-and-epizootological data, bacteriological, biochemical investigations from the foal abortus it was defined the Salmonella abortus equi the pathogen of salmonellosis abortion of mares.
В статье рассматриваются вопросы диагностики и профилактики сальмонеллезного аборта кобыл, который часто регистрируется на территории Казахстана. Мониторинговыми исследования установлено, что с 2010 по 2015 годы выход жеребят на 100 голов кобыломаток стабильно снижается. С целью выяснения причины снижения рождаемости жеребят, изучена эпизоотическая ситуация по сальмонеллезному аборту кобыл в хозяйствах Алматинской области. При вспышках болезни проводили выделение возбудителя инфекции от абортплодов кобыл. Приводятся результаты исследований по изучению культурально – морфологических, биохимических и антигенных свойств эпизоотических штаммов сальмонелл, выделенных от абортированных плодов кобыломаток. Авторами описаны биологические свойства аттенуированного вакцинного штамма, на основе которого изготавливается безопасная, высокоиммуногенная вакцина против сальмонеллезного аборта кобыл. Вакцина прививается жеребым кобылам однократно, продолжительность иммунитета – один год.
Цель – выделение культур из абортированных плодов кобыл, их идентификация на основании изучения биологических свойств, разработка методов специфической профилактики сальмонеллезного аборта кобыл.
Сальмонеллезный аборт кобыл – распространенная болезнь жеребых кобыл, сопровождающаяся преждевременными родами (абортами) и рождением нежизнеспособного плода. Возбудитель Salmonella abortus-equi открыт в 1893 году Smith и Kilborne в Америке, в 1901 году Д.В. Поляковым в России. В литературе иногда встречается под названием Salmonella abortiva-equina (синоним) [2]. Аборты могут принимать массовый характер, в табуне абортируют до 80 % кобыл. У больных сальмонеллезом кобыл изредка рождаются больные жеребята, у которых болезнь сопровождается бактериемией, тяжелым токсикозом, истощением, приводящим к гибели. Первые сведения по эпизоотологии болезни в республике были опубликованы в 1940 и 1950 годах, из которых вытекает, что инфекционные аборты среди кобыл в Казахской ССР регистрировались с начала 30-х годов прошлого века. В разные годы аборты кобыл достигали 6 – 30 %, из них свыше 50 % сальмонеллезной этиологии. В 1970 и 1971 годах в хозяйствах республики регистрировались массовые аборты сальмонеллезной этиологии: так в Енбекши-Казахском районе Алма-Атинской области аборты отмечены у 44 % конематок, Нарынколском районе – 20-40 %; Чиликском районе – 30 % конематок абортировало; Аксуском районе Талды-Курганской области – 43 %; Капальском и Каратальском районах отмечались аборты сальмонеллезной этиологии. В 1969 – 1974 годах аборты отмечались в хозяйствах Восточно-Казахстанской (около 40 %), Жамбылской (20 %), Кызылординской (до 25 %) областях. В 1981 году в хозяйствах Мангыстауской области из 1000 кобыл абортировало 384 (38, 4 %). В декабре 1985 года в Атырауской области из 260 жеребых кобыл абортировало 155 (59, 5 %).
В настоящее время в связи с тем, что основное поголовье лошадей от общего числа в республике сосредоточено в личных подворьях граждан и фермерских хозяйствах, возросла актуальность профилактики сальмонеллезного аборта кобыл, а также ведения статистического учета заболеваемости [3]. Мониторинговыми исследования установлено, что с 2010 по 2015 годы выход жеребят стабильно снижается – 59/100; 56/100; 53/100; 50/100; 45/100 голов кобыломаток соответственно. С целью выяснения причины такого снижения рождаемости жеребят нами изучена эпизоотическая ситуация по сальмонеллезному аборту кобыл в хозяйствах Алматинской области. При вспышках болезни проводили выделение возбудителя инфекции от плодов абортировавших кобыл.
В Алматинской области расположены 16 районов, во всех районах области разводятся лошади, в том числе племенные. На 10 июля 2015 г. в области содержатся 288592 головы лошадей. Наибольшее количество животных сосредоточено в частных подворьях населения (641 836 голов). В хозяйствах населения области находятся 150720 голов лошадей, в крестьянских и фермерских хозяйствах находятся 143404 головы, а в сельхозпредприятиях содержится 16 500 голов лошадей. Выход жеребят по области на 100 кобыломаток составляет не более 50. Ситуация осложняется тем, что наибольшее количество лошадей сосредоточено в хозяйствах и частных подворьях населения, где не ведется учет заболеваемости животных. Частные владельцы зачастую скрывают случаи абортов у кобыл.
В 2015 году в Алматинской области получено 64915 жеребят. Наибольшее количество лошадей находится в Кербулакском, Жамбылском и Райымбекском районах. Однако в них выход жеребят в среднем составляет 45 %. Например, в Енбекшиказахском районе в текущем году получено 2281 жеребенок, что составляет всего 34 %, в Кербулакском районе в текущем году получено 3978 жеребят, что составляет всего 41 %, в Жамбылском – 45 %, в Саркандском районе – 43 %, в Балхашском районе – 52 %, в Райымбекском – 56 %. В связи с тем, что основное поголовье лошадей от общего числа в республике сосредоточено в личных подворьях граждан и фермерских хозяйствах, возросла актуальность профилактики сальмонеллезного аборта кобыл, а также ведения статистического учета заболеваемости [4].
Материалы и методы исследования
Отбор проб из паренхиматозных органов абортплода кобылы приведен на рис 1.

Рис. 1. Отбор проб от абортплода кобылы для бактериологических исследований
Результаты исследования и их обсуждение
Диагностика заболевания осуществляется на основании клинико-эпизоотологических, патологоанатомических данных, а также результатов бактериологического и серологических исследований. Посевы из патологического материала делали на МПА, МПБ, среды Клиглера и Эндо, висмут – сульфитный агар из печени, сердца, селезенки, костного мозга из бедренной кости плода. От всех абортированных плодов выделили культуру сальмонелл, которую затем дифференцировали по культурально – морфологическим, биохимическим и антигенным свойствам [4]. На питательных средах отмечался обильный рост сальмонелл. На МПА росли круглые, блестящие, выпуклые влажные колонии с голубоватым оттенком, на среде Клиглера – ярко-желтые круглые колонии, на агаре Эндо – типичные колонии светло-розового цвета, на висмут-сульфитном агаре –бесцветные блестящие колонии. При микроскопии окрашенных по Граму мазков наблюдались полиморфные грамотрицательные мелкие палочки с закругленными концами. Культура агглютинировалась в РА (реакции агглютинации) на стекле с поливалентной и монорецепторными сыворотками производства Краснодарской биофабрики. Все выделенные культуры агглютинировались сыворотками О – IV (++++), ХII (+++), H – enx (++++) [5].
При посеве культур уколом на ПЖА наблюдалась характерная подвижность сальмонелл (подвижные палочки). Выделенные культуры идентифицировали методом изучения биохимических свойств путем культивирования на среде Гисса. Все культуры были идентичны и не изменяли инозит, глицерино – фуксиновый бульон, раффинозу, салицин; сероводород не образовывали (этот признак отличает Salmonella abortus-equi от других сальмонелл) и не продуцировали индола; ферментировали глюкозу, маннит, арабинозу, дульцит, ксилозу, рамнозу, галактозу. Для выявления протеолитической способности испытуемые штаммы засевали на МПЖ. В пробирках, где под действием ферментов бактерий проиcходил протеолиз желатина, среда разжижалась. При постановке биопробы на белых мышах гибель животных наступалв на 3-4 сутки после заражения.
На основании клинико-эпизоотологических данных, изучения культурально – морфологических, тинкториальных, биохимических и антигенных свойств выделенные эпизоотические штаммы сальмонелл отнесены к Salmonella abortus-equi. Во всех случаях возбудителем аборта у кобыл являлась Salmonella abortus-equi. По культурально – морфологическим, биохимическим и антигенным свойствам штаммы были идентичны выделенным эпизоотическим изолятам сальмонелл, выделенным ранее и эталонному коллекционному штамму Salmonella abortus-equi 7/1.
Проводили электронную микроскопию сальмонеллезной культуры, приготовленную из суточной агаровой культуры Salmonella abortus-equi. Бактериальную взвесь (концентрация 500 млн микробных клеток/см3 по оптическому стандарту ГИСК (Государственный институт стандартизации и контроля им. Л.А. Тарасевича) наносили пастеровской пипеткой на парафин в чашке Петри. При нанесении на парафин капля взвеси принимала округлую форму и не растекалась (всего 2–3 капли). Затем методом флотации погружали специальную золотистую сеточку в каплю суспензии сальмонелл на 1 минуту. Чашку Петри с сеточкой, на которой находилась бактериальная взвесь, закрывали на 24 часа и оставляли для высушивания. Через сутки капля микробной суспензии высыхала. Высохшую каплю контрастировали следующим образом: через сутки на парафин в чашке капали каплю контрастера – 2 % раствор фосфорно – вольфрамовой кислоты (ФВК) пастеровской пипеткой, сеточку топили в капле подложкой вверх. Контрастировали 1,5–2 минуты. Затем сеточку пинцетом аккуратно вынимали, удаляли лишнюю жидкость прикосновением фильтровальной бумаги. Сеточку промывали от контрастера дистиллированной водой из шприца (очень осторожно). Сеточку с бактериальной взвесью сушили в контейнере 7 суток. После высушивания препарат был готов для просмотра под электронным микроскопом.
Электронный снимок Salmonella abortus-equi представлен на рис. 2.
На рис. 2 представлена бактериальные клетка из одного клона (популяция из одной клетки без предварительной конъюгации). Стационарная фаза. На цельной клетке сальмонелл виден обрывок перитрихиально расположенного жгутика. Также видна трехслойная клеточная мембрана (наружный слой клеточной стенки). В центральной части клетки расположен нуклеоид большой величины. Зона нуклеоида заполнена фибриллярным компонентом. Вблизи нуклеоида локализованы клеточные включения округлой формы. Включения имеют мелкозернистое строение и ограничены от цитоплазмы мембраной. По всей цитоплазме расположены мелкие внутриклеточные включения. Увеличение х 80 000.
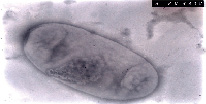
Рис. 2. Электроннограмма штамма Salmonella abortus-equi
Таким образом, выделенная культура сальмонелл была идентифицирована как Salmonella abortus-equi.
Профилактика Патентный поиск показал, что в Америке и в странах Европы не разработаны и не применяются вакцины против сальмонеллезного аборта кобыл. В Якутии применяется инактивированная формолквасцовая инактивированная вакцина против сальмонеллезного аборта кобыл с иммуномодулятором, адаптированная для местной породы лошадей [6, 7]. В Якутии также разработана и применяется ассоциированная убитая вакцина против ринопневмонии и сальмонеллезного аборта кобыл [8, 9]. Для повышения эффективности ассоциированной вакцины и повышения иммунобиологической реактивности организма к вакцине в качестве иммуномодулятора добавляют культуральную жидкость бульонной культуры штамма бактерий Bacillus subtilis ТНП-3 ДЕП, выделенного из мерзлото-переходной почвы [9]. Нами разработана и успешно апробирована на жеребых кобыломатках вакцина сухая живая против сальмонеллезного аборта кобыл из штамма Salmonella abortus – equi Е-841. Вакцинный штамм был получен методом отбора клонов, аттенуированных под влиянием химического мутагена- нитрофуранов с последующей селекцией мутантов. Штамм В-0147 Salmonella abortus – equi Е-841 утратил абортогенные свойства, имеет умеренную остаточную вирулентность (вирулентность штамма снижена в 20 раз по сравнению с природным прототипом), обладает высокой иммуногенностью. Вакцинный аттенуированный штамм обладает типичными для Salmonella abortus – equi культуральными, биохимическими и антигенными свойствами. Существенным отличием штамма В-0147 Salmonella abortus – equi Е-841 от вирулентного прототипа является ауксотрофность в отношении тиамина и никотиновой кислоты; штамм образует аргинин – декарбоксилазу и слабо – лизин–декарбоксилазу.
Вакцинный штамм В-0147 Salmonella abortus – equi Е-841 депонирован нами в Республиканской коллекции микроорганизмов (РКМ) в Национальном референтном центре по ветеринарии (коллекционный номер В-0088), г. Астана. В РКМ депонирован также контрольный (вирулентный) штамм Salmonella abortus – equi коллекционный номер В–0099), выделенный нами из абортированного плода – жеребенка в 2005 году в Алматинской области. Штамм применяется для контроля иммуногенной активности вакцины против сальмонеллезного аборта кобыл.
Вакцинный аттенуированный штамм сохраняет слабую остаточную вирулентность и не реверсирует при пассировании на восприимчивых животных (белые мыши, куриные эмбрионы). Утрата штаммом абортогенных свойств подтверждается опытами вакцинопрофилактики лиофилизированной культурой глубоко жеребых кобыл (за 2-3 месяца до выжеребки) в дозе 1,2–1,5 млрд живых м. к. (микробных клеток). Вакцинация жеребых кобыл в период 4-7 месячной жеребости проводится с профилактической целью однократно. Жеребята и молодняк прививаются по показаниям. Вакцина сообщает привитым животным иммунитет высокого напряжения. Поствакцинальная реакция у лошадей характеризуется образованием агглютининов в высоких титрах (1: 3200) и повышением количества лейкоцитов в крови.
Местная реакция проявляется в виде болезненного отека на месте введения вакцины, который рассасывается в течение 3-5 суток. Общая реакция у части кобыл характеризуется кратковременным повышением температуры и умеренным угнетением в течение первой половины суток. Аппетит у всех животных в период наблюдения сохраняется.
Вакцинальная культура высевается из органов и крови белых мышей в течение 20 суток, из селезенки и лимфатических узлов до 25 суток; от морских свинок в течение двух недель. Подкожная иммунизация морских свинок не вызывает микроскопических изменений. Сухая вакцина соответствует современным отечественным и международным стандартам: малые дозы, умеренная реактогенность, высокая иммунизирующая активность, экономичность, эффективность, удобство при транспортировке.
Отзывы специалистов опытных хозяйств свидетельствуют о безопасности и высокой эффективности вакцинации жеребых кобыл.
Заключение
На основании бактериологических, биохимических, серологических (антигенной структуры) исследований культур, выделенных из абортплодов кобыломаток, установлено, что причиной абортов у кобыл явился сальмонеллезный аборт кобыл, вызванный Salmonella abortus-equi. Систематические прививки живой вакциной из штамма В-0147 Salmonella abortus – equi Е-841 обеспечивают защиту животных от абортов сальмонеллезной этиологии, увеличивают выход жеребят, надои молока, в результате чего хозяйства получат большой экономический эффект. Вакцина в 100 % случаев защищает опытных кобыл от сальмонеллезного аборта. Иммунитет у привитых животных сохраняется в течение года.
В статье рассматриваются вопросы диагностики и профилактики сальмонеллезного аборта кобыл. Приводятся результаты исследований по изучению культурально – морфологических, биохимических и антигенных свойств эпизоотических штаммов сальмонелл, выделенных от абортированного плода кобыломатки.

1. Матвиенко Б.А. Характеристика живой сухой вакцины против паратифозного аборта кобыл из штамма Е-841// Вестн. с.-х. науки Казахстана. 1973. – № 4. – С. 107–110.
2. Юров К.П., Амирбеков М.А. Поствакцинальный иммунитет при вакцинации у жеребых кобыл // Тр. ВИЭВ. Всесоюзный институт экспериментальной ветеринарии. 1984. – Т. 61. – С. 72–76.
3. Матвиенко Б.А, Бияшев К.Б., Жанузаков Н.Ж. Вакцинопрофилактика сальмонеллезного аборта кобыл // Вестник с.-х. науки Казахстана. – 1977. – № 5. – С. 77–80.
4. Шустер Б.Ю. Вакцины из аттенуированных штаммов сальмонелл: дисс….докт. Вет. наук. – М.: 1988. – С. 103–115.
5. Определитель Bergey’s Manual of Systematic Bacteriology /Department of Microbiology and Molecular Genetics: Michigan State University: USA, 2005, Volum 2. Part В. p. 764–799.
6. Бутковский В.Ф., М.П. Неустроев и др. Профилактика и лечение болезней лошадей в Якутской АССР: Методические рекомендации. – Якутск, 1987. – 12 с.
7. Бутковский В.Ф. Изучение сальмонеллеза лошадей в Республике Саха (Якутия) // Эпизоотология и профилактика болезней животных в условиях Якутии. – Новосибирск, 1994. – С. 28–34.
8. Петрова С.Г. Иммунопрофилактика абортов лошадей сальмонеллезной и ринопневмонийной этиологии в условиях Якутии: Автореферат дисс…канд. Вет. наук. – Якутск, 2006. – С. 23–25.
9. Неустроев М.П., Тарабукина Н.П Разработка новых ветеринарных препаратов в условиях крайнего севера // Эпизоотология и профилактика болезней животных в условиях Якутии. – Новосибирск, 1994. – С. 41–45.
В статье рассматриваются вопросы диагностики и профилактики сальмонеллезного аборта кобыл, который часто регистрируется на территории Казахстана. Мониторинговыми исследования установлено, что с 2010 по 2015 годы выход жеребят на 100 голов кобыломаток стабильно снижается. С целью выяснения причины снижения рождаемости жеребят, изучена эпизоотическая ситуация по сальмонеллезному аборту кобыл в хозяйствах Алматинской области. При вспышках болезни проводили выделение возбудителя инфекции от абортплодов кобыл. Приводятся результаты исследований по изучению культурально – морфологических, биохимических и антигенных свойств эпизоотических штаммов сальмонелл, выделенных от абортированных плодов кобыломаток. Авторами описаны биологические свойства аттенуированного вакцинного штамма, на основе которого изготавливается безопасная, высокоиммуногенная вакцина против сальмонеллезного аборта кобыл. Вакцина прививается жеребым кобылам однократно, продолжительность иммунитета – один год.
Цель – выделение культур из абортированных плодов кобыл, их идентификация на основании изучения биологических свойств, разработка методов специфической профилактики сальмонеллезного аборта кобыл.
Сальмонеллезный аборт кобыл – распространенная болезнь жеребых кобыл, сопровождающаяся преждевременными родами (абортами) и рождением нежизнеспособного плода. Возбудитель Salmonella abortus-equi открыт в 1893 году Smith и Kilborne в Америке, в 1901 году Д.В. Поляковым в России. В литературе иногда встречается под названием Salmonella abortiva-equina (синоним) [2]. Аборты могут принимать массовый характер, в табуне абортируют до 80 % кобыл. У больных сальмонеллезом кобыл изредка рождаются больные жеребята, у которых болезнь сопровождается бактериемией, тяжелым токсикозом, истощением, приводящим к гибели. Первые сведения по эпизоотологии болезни в республике были опубликованы в 1940 и 1950 годах, из которых вытекает, что инфекционные аборты среди кобыл в Казахской ССР регистрировались с начала 30-х годов прошлого века. В разные годы аборты кобыл достигали 6 – 30 %, из них свыше 50 % сальмонеллезной этиологии. В 1970 и 1971 годах в хозяйствах республики регистрировались массовые аборты сальмонеллезной этиологии: так в Енбекши-Казахском районе Алма-Атинской области аборты отмечены у 44 % конематок, Нарынколском районе – 20-40 %; Чиликском районе – 30 % конематок абортировало; Аксуском районе Талды-Курганской области – 43 %; Капальском и Каратальском районах отмечались аборты сальмонеллезной этиологии. В 1969 – 1974 годах аборты отмечались в хозяйствах Восточно-Казахстанской (около 40 %), Жамбылской (20 %), Кызылординской (до 25 %) областях. В 1981 году в хозяйствах Мангыстауской области из 1000 кобыл абортировало 384 (38, 4 %). В декабре 1985 года в Атырауской области из 260 жеребых кобыл абортировало 155 (59, 5 %).
В настоящее время в связи с тем, что основное поголовье лошадей от общего числа в республике сосредоточено в личных подворьях граждан и фермерских хозяйствах, возросла актуальность профилактики сальмонеллезного аборта кобыл, а также ведения статистического учета заболеваемости [3]. Мониторинговыми исследования установлено, что с 2010 по 2015 годы выход жеребят стабильно снижается – 59/100; 56/100; 53/100; 50/100; 45/100 голов кобыломаток соответственно. С целью выяснения причины такого снижения рождаемости жеребят нами изучена эпизоотическая ситуация по сальмонеллезному аборту кобыл в хозяйствах Алматинской области. При вспышках болезни проводили выделение возбудителя инфекции от плодов абортировавших кобыл.
В Алматинской области расположены 16 районов, во всех районах области разводятся лошади, в том числе племенные. На 10 июля 2015 г. в области содержатся 288592 головы лошадей. Наибольшее количество животных сосредоточено в частных подворьях населения (641 836 голов). В хозяйствах населения области находятся 150720 голов лошадей, в крестьянских и фермерских хозяйствах находятся 143404 головы, а в сельхозпредприятиях содержится 16 500 голов лошадей. Выход жеребят по области на 100 кобыломаток составляет не более 50. Ситуация осложняется тем, что наибольшее количество лошадей сосредоточено в хозяйствах и частных подворьях населения, где не ведется учет заболеваемости животных. Частные владельцы зачастую скрывают случаи абортов у кобыл.
В 2015 году в Алматинской области получено 64915 жеребят. Наибольшее количество лошадей находится в Кербулакском, Жамбылском и Райымбекском районах. Однако в них выход жеребят в среднем составляет 45 %. Например, в Енбекшиказахском районе в текущем году получено 2281 жеребенок, что составляет всего 34 %, в Кербулакском районе в текущем году получено 3978 жеребят, что составляет всего 41 %, в Жамбылском – 45 %, в Саркандском районе – 43 %, в Балхашском районе – 52 %, в Райымбекском – 56 %. В связи с тем, что основное поголовье лошадей от общего числа в республике сосредоточено в личных подворьях граждан и фермерских хозяйствах, возросла актуальность профилактики сальмонеллезного аборта кобыл, а также ведения статистического учета заболеваемости [4].
Материалы и методы исследования
Отбор проб из паренхиматозных органов абортплода кобылы приведен на рис 1.

Рис. 1. Отбор проб от абортплода кобылы для бактериологических исследований
Результаты исследования и их обсуждение
Диагностика заболевания осуществляется на основании клинико-эпизоотологических, патологоанатомических данных, а также результатов бактериологического и серологических исследований. Посевы из патологического материала делали на МПА, МПБ, среды Клиглера и Эндо, висмут – сульфитный агар из печени, сердца, селезенки, костного мозга из бедренной кости плода. От всех абортированных плодов выделили культуру сальмонелл, которую затем дифференцировали по культурально – морфологическим, биохимическим и антигенным свойствам [4]. На питательных средах отмечался обильный рост сальмонелл. На МПА росли круглые, блестящие, выпуклые влажные колонии с голубоватым оттенком, на среде Клиглера – ярко-желтые круглые колонии, на агаре Эндо – типичные колонии светло-розового цвета, на висмут-сульфитном агаре –бесцветные блестящие колонии. При микроскопии окрашенных по Граму мазков наблюдались полиморфные грамотрицательные мелкие палочки с закругленными концами. Культура агглютинировалась в РА (реакции агглютинации) на стекле с поливалентной и монорецепторными сыворотками производства Краснодарской биофабрики. Все выделенные культуры агглютинировались сыворотками О – IV (++++), ХII (+++), H – enx (++++) [5].
При посеве культур уколом на ПЖА наблюдалась характерная подвижность сальмонелл (подвижные палочки). Выделенные культуры идентифицировали методом изучения биохимических свойств путем культивирования на среде Гисса. Все культуры были идентичны и не изменяли инозит, глицерино – фуксиновый бульон, раффинозу, салицин; сероводород не образовывали (этот признак отличает Salmonella abortus-equi от других сальмонелл) и не продуцировали индола; ферментировали глюкозу, маннит, арабинозу, дульцит, ксилозу, рамнозу, галактозу. Для выявления протеолитической способности испытуемые штаммы засевали на МПЖ. В пробирках, где под действием ферментов бактерий проиcходил протеолиз желатина, среда разжижалась. При постановке биопробы на белых мышах гибель животных наступалв на 3-4 сутки после заражения.
На основании клинико-эпизоотологических данных, изучения культурально – морфологических, тинкториальных, биохимических и антигенных свойств выделенные эпизоотические штаммы сальмонелл отнесены к Salmonella abortus-equi. Во всех случаях возбудителем аборта у кобыл являлась Salmonella abortus-equi. По культурально – морфологическим, биохимическим и антигенным свойствам штаммы были идентичны выделенным эпизоотическим изолятам сальмонелл, выделенным ранее и эталонному коллекционному штамму Salmonella abortus-equi 7/1.
Проводили электронную микроскопию сальмонеллезной культуры, приготовленную из суточной агаровой культуры Salmonella abortus-equi. Бактериальную взвесь (концентрация 500 млн микробных клеток/см3 по оптическому стандарту ГИСК (Государственный институт стандартизации и контроля им. Л.А. Тарасевича) наносили пастеровской пипеткой на парафин в чашке Петри. При нанесении на парафин капля взвеси принимала округлую форму и не растекалась (всего 2–3 капли). Затем методом флотации погружали специальную золотистую сеточку в каплю суспензии сальмонелл на 1 минуту. Чашку Петри с сеточкой, на которой находилась бактериальная взвесь, закрывали на 24 часа и оставляли для высушивания. Через сутки капля микробной суспензии высыхала. Высохшую каплю контрастировали следующим образом: через сутки на парафин в чашке капали каплю контрастера – 2 % раствор фосфорно – вольфрамовой кислоты (ФВК) пастеровской пипеткой, сеточку топили в капле подложкой вверх. Контрастировали 1,5–2 минуты. Затем сеточку пинцетом аккуратно вынимали, удаляли лишнюю жидкость прикосновением фильтровальной бумаги. Сеточку промывали от контрастера дистиллированной водой из шприца (очень осторожно). Сеточку с бактериальной взвесью сушили в контейнере 7 суток. После высушивания препарат был готов для просмотра под электронным микроскопом.
Электронный снимок Salmonella abortus-equi представлен на рис. 2.
На рис. 2 представлена бактериальные клетка из одного клона (популяция из одной клетки без предварительной конъюгации). Стационарная фаза. На цельной клетке сальмонелл виден обрывок перитрихиально расположенного жгутика. Также видна трехслойная клеточная мембрана (наружный слой клеточной стенки). В центральной части клетки расположен нуклеоид большой величины. Зона нуклеоида заполнена фибриллярным компонентом. Вблизи нуклеоида локализованы клеточные включения округлой формы. Включения имеют мелкозернистое строение и ограничены от цитоплазмы мембраной. По всей цитоплазме расположены мелкие внутриклеточные включения. Увеличение х 80 000.

Рис. 2. Электроннограмма штамма Salmonella abortus-equi
Таким образом, выделенная культура сальмонелл была идентифицирована как Salmonella abortus-equi.
Профилактика Патентный поиск показал, что в Америке и в странах Европы не разработаны и не применяются вакцины против сальмонеллезного аборта кобыл. В Якутии применяется инактивированная формолквасцовая инактивированная вакцина против сальмонеллезного аборта кобыл с иммуномодулятором, адаптированная для местной породы лошадей [6, 7]. В Якутии также разработана и применяется ассоциированная убитая вакцина против ринопневмонии и сальмонеллезного аборта кобыл [8, 9]. Для повышения эффективности ассоциированной вакцины и повышения иммунобиологической реактивности организма к вакцине в качестве иммуномодулятора добавляют культуральную жидкость бульонной культуры штамма бактерий Bacillus subtilis ТНП-3 ДЕП, выделенного из мерзлото-переходной почвы [9]. Нами разработана и успешно апробирована на жеребых кобыломатках вакцина сухая живая против сальмонеллезного аборта кобыл из штамма Salmonella abortus – equi Е-841. Вакцинный штамм был получен методом отбора клонов, аттенуированных под влиянием химического мутагена- нитрофуранов с последующей селекцией мутантов. Штамм В-0147 Salmonella abortus – equi Е-841 утратил абортогенные свойства, имеет умеренную остаточную вирулентность (вирулентность штамма снижена в 20 раз по сравнению с природным прототипом), обладает высокой иммуногенностью. Вакцинный аттенуированный штамм обладает типичными для Salmonella abortus – equi культуральными, биохимическими и антигенными свойствами. Существенным отличием штамма В-0147 Salmonella abortus – equi Е-841 от вирулентного прототипа является ауксотрофность в отношении тиамина и никотиновой кислоты; штамм образует аргинин – декарбоксилазу и слабо – лизин–декарбоксилазу.
Вакцинный штамм В-0147 Salmonella abortus – equi Е-841 депонирован нами в Республиканской коллекции микроорганизмов (РКМ) в Национальном референтном центре по ветеринарии (коллекционный номер В-0088), г. Астана. В РКМ депонирован также контрольный (вирулентный) штамм Salmonella abortus – equi коллекционный номер В–0099), выделенный нами из абортированного плода – жеребенка в 2005 году в Алматинской области. Штамм применяется для контроля иммуногенной активности вакцины против сальмонеллезного аборта кобыл.
Вакцинный аттенуированный штамм сохраняет слабую остаточную вирулентность и не реверсирует при пассировании на восприимчивых животных (белые мыши, куриные эмбрионы). Утрата штаммом абортогенных свойств подтверждается опытами вакцинопрофилактики лиофилизированной культурой глубоко жеребых кобыл (за 2-3 месяца до выжеребки) в дозе 1,2–1,5 млрд живых м. к. (микробных клеток). Вакцинация жеребых кобыл в период 4-7 месячной жеребости проводится с профилактической целью однократно. Жеребята и молодняк прививаются по показаниям. Вакцина сообщает привитым животным иммунитет высокого напряжения. Поствакцинальная реакция у лошадей характеризуется образованием агглютининов в высоких титрах (1: 3200) и повышением количества лейкоцитов в крови.
Местная реакция проявляется в виде болезненного отека на месте введения вакцины, который рассасывается в течение 3-5 суток. Общая реакция у части кобыл характеризуется кратковременным повышением температуры и умеренным угнетением в течение первой половины суток. Аппетит у всех животных в период наблюдения сохраняется.
Вакцинальная культура высевается из органов и крови белых мышей в течение 20 суток, из селезенки и лимфатических узлов до 25 суток; от морских свинок в течение двух недель. Подкожная иммунизация морских свинок не вызывает микроскопических изменений. Сухая вакцина соответствует современным отечественным и международным стандартам: малые дозы, умеренная реактогенность, высокая иммунизирующая активность, экономичность, эффективность, удобство при транспортировке.
Отзывы специалистов опытных хозяйств свидетельствуют о безопасности и высокой эффективности вакцинации жеребых кобыл.
Заключение
На основании бактериологических, биохимических, серологических (антигенной структуры) исследований культур, выделенных из абортплодов кобыломаток, установлено, что причиной абортов у кобыл явился сальмонеллезный аборт кобыл, вызванный Salmonella abortus-equi. Систематические прививки живой вакциной из штамма В-0147 Salmonella abortus – equi Е-841 обеспечивают защиту животных от абортов сальмонеллезной этиологии, увеличивают выход жеребят, надои молока, в результате чего хозяйства получат большой экономический эффект. Вакцина в 100 % случаев защищает опытных кобыл от сальмонеллезного аборта. Иммунитет у привитых животных сохраняется в течение года.
Читайте также:

