Сд4 клетки при туберкулезе
Обновлено: 24.04.2024
Цель исследования: уточнить факторы риска рецидива туберкулеза и дополнительные критерии для констатации клинического излечения туберкулеза у пациентов с коинфекцией ВИЧ/туберкулез.
Материал и методы: изучен ряд показателей у пациентов основной группы (1-я группа), состоящей из 2 подгрупп: 1А подгруппа — 104 лица с ВИЧ-инфекцией и рецидивами туберкулеза органов дыхания; 1Б подгрупп— 101 ВИЧ-негативный пациент с рецидивом туберкулеза. Проведено сопоставление их медико-социальных характеристик, длительности периода от момента констатации клинического излечения туберкулеза до его рецидива и найдены дополнительные критерии клинического излечения туберкулеза у ВИЧ-инфицированных. Они были проверены во 2-й (тестовой) группе пациентов с ВИЧ-инфекцией (68 человек), у которых в 2012–2013 гг. констатировано клиническое излечение, а оценка длительности ремиссии туберкулеза проводилась в 2018 г.
Результаты исследования: найдена зависимость между длительностью периода ремиссии, с одной стороны, и состоянием иммунного статуса (уровень CD4+) и эффективностью высокоактивной антиретровирусной терапии (ВААРТ), с другой, у пациентов 1А подгруппы. На основании полученных данных предложены дополнительные критерии констатации клинического излечения туберкулеза у больных с ВИЧ-инфекцией (уровень CD4+ 350 и более клеток/мкл, эффективная ВААРТ), которые были проверены во 2-й группе пациентов с ВИЧ-инфекцией.
Заключение: прямые (уровень CD4+) и косвенные (эффективность ВААРТ) характеристики иммунодефицита у пациентов с ВИЧ-инфекцией наиболее значимо влияют на длительность ремиссии при туберкулезе. Установлено, что использование таких показателей, как уровень CD4+ (клеток/мкл) и эффективность ВААРТ, в качестве дополнительных критериев констатации клинического излечения туберкулеза является оправданным.
Ключевые слова: туберкулез, ВИЧ, коинфекция, факторы риска, ремиссия, рецидив туберкулеза, клиническое излечение.
Senin A.M. 1 , Medvinskiy I.D. 2
1 ТB dispensary, Yekaterinburg
2 Ural research Institute of Phthisiopulmonology, Yekaterinburg
Keywords: tuberculosis, HIV, coinfection, risk factors, remission, tuberculosis relapse, clinical cure.
For citation: Senin A.M., Medvinskiy I.D. Prediction of the development of respiratory tract tuberculosis recurrence in HIV-positive patients. RMJ. Medical Review. 2019;2(I):18–22.
Статья посвящена возможностям прогнозирования развития рецидива туберкулеза органов дыхания у ВИЧ-позитивных пациентов.
Введение
Материал и методы
Результаты и обсуждение
Выводы:

1. Улюкин И.М., Болехан В.Н., Орлова Е.С. О некоторых особенностях восстановления иммунной системы на фоне специфической терапии ВИЧ-инфекции // Состояние здоровья: медицинские, социальные и психолого-педагогические аспекты. 2017. С. 252–261.
5. Федеральные клинические рекомендации по профилактике, диагностике и лечению туберкулёза у больных ВИЧ-инфекцией. М., 2016. С. 29–32.
Проблема туберкулеза продолжает оставаться актуальной, особенно в сочетании с ВИЧ-инфекцией. Данные нозологии широко распространены и являются глобальными проблемами человечества. По данным Всемирной организации здравоохранения на конец 2019 г. во всём мире туберкулезом заболели 10 млн чел. разных возрастных групп, с преимущественным преобладанием лиц мужского пола. Умерло от туберкулёза в общей сложности за 2019 г. 1,4 млн чел. (в том числе 208 000 человек с ВИЧ-инфекцией) [2].
Таким образом, все вышеизложенное определяет важность изучения различных аспектов формирования ВСВИС, возникающего у пациентов с туберкулезом в сочетании с ВИЧ-инфекцией в условиях современной эпидемической ситуации.
Цель исследования: изучить проявления синдрома восстановления иммунной системы у больных с ко-инфекцией (ТБ/ВИЧ) на современном этапе.
Материалы и методы исследования
Работа проведена на базе туберкулезной больницы г. Ижевска. Для достижения поставленной цели были изучены карты стационарного больного у 425 пациентов, находящихся на лечении с 2018 по 2020 г. с диагнозом туберкулез различных форм и локализаций с сопутствующей патологией ВИЧ-инфекция.
Был отобран 31 пациент, имеющий ВСВИС. Проведен анализ данного контингента и охарактеризован по следующим признакам: по полу, возрасту, клиническим формам туберкулеза, сопутствующим заболеваниям, наличию вредных привычек, социальному статусу, исходу госпитализации. Так же были изучены аспекты анамнеза ВИЧ-инфекции у данных пациентов: стадия заболевания, дата возникновения заболевания. Изучены жалобы и клиника, лабораторные данные пациентов до начала лечения: полный и биохимический анализ крови, полный анализ мочи, наличие бактериовыделения методом люминесцентной микроскопии и культуральным методом, наличие чувствительности и устойчивости к противотуберкулезным препаратам (ПТП). А также определялись показатели, характеризующие иммунодефицитное состояние до начала терапии и на её фоне: количество CD4-клеток и вирусная нагрузка. Далее устанавливался вид проявления ВСВИС и сроки его начала. Затем проводилась оценка влияния медикаментозной терапии на течение синдрома, была изучена этиотропная терапия пациентов по поводу туберкулеза и ВИЧ-инфекции, а также симптоматическая терапия при возникновении ВСВИС.
Результаты исследования и их обсуждение
Пациенты с ВСВИС составляли 7,2 %. Средний возраст пациентов составлял 36 лет. По гендерному распределению превалировали лица мужского пола – 61,2 %. Все пациенты имели вредные привычки, такие как курение и злоупотребление алкоголем. С наркотической зависимостью в анамнезе были 70,9 % пациентов.
У 93,5 % пациентов наблюдался туберкулез с множественной или широкой лекарственной устойчивостью. 7 пациентов (22,5 %) в ходе лечения погибли от прогрессирования процесса, полиорганной недостаточности и отёка головного мозга. 51,7 % пациентов самостоятельно прервали лечение (выписаны за отсутствие в отделении, выписаны за нарушение режима, уклонение от лечения). И только 25,8 % человек прошли полный курс химиотерапии по соответствующему режиму.
По форме туберкулезного процесса при поступлении преобладал инфильтративный туберкулёз – 61,2 %, затем диссеминированный туберкулёз – 22,5 %, фиброзно-кавернозный туберкулёз – 12,9 % и казеозная пневмония – 6,4 %. Двухсторонний процесс наблюдался в 80,6 % случаев. На диспансерном учёте по туберкулёзу пациенты находились: от 1 до 3 лет – 26 человек (83,8 %), от 4 до 6 лет – 5 человек (16,2 %). В 100 % случаев пациенты поступали в отделение с наличием бактериовыделения. На момент госпитализации у 93,5 % пациентов была выявлена устойчивость к препаратам первого ряда, и только у 6,5 % была к ним чувствительность.
Лечение пациенты получали по следующим режимам химиотерапии (РХТ): I РХТ – 6,4 %, IV РХТ – 77,4 %, V РХТ – 3,2 %, лечение по профкурсу – 12,9 %. Препараты, согласно режиму химиотерапии, были назначены в день госпитализации.
В структуре сопутствующих заболеваний преобладали: хронический гепатит смешанной этиологии (вирусный гепатит С + токсический гепатит) – 70,9 %; хронический бронхит – 41,9 %; анемия хронических болезней – 35,4 %; кандидоз слизистых – 29 %; менингоэнцефалит – 22,5 %; хронический гастрит – 16,1 %; плеврит – 9,6 %;
ВИЧ-инфекцией данные пациенты были инфицированы от 1 до 5 лет – 15 чел. (48,3 %); от 6 до 10 лет – 7 чел. (22,5 %); 11 и более лет – 9 чел. (29 %). Стадия ВИЧ-инфекции у 61,2 % пациентов – 4В, у 4Б – 38,8 %. Все пациенты на момент госпитализации не получали антиретровирусную терапию.
До прохождения терапии вирусная нагрузка у данных пациентов составляла от 3700 до 3 900 000 коп/мл; СD клетки варьировались в диапазоне от 2 до 570 кл/мкл;
Противовирусную терапию по предпочтительной схеме получали 80,6 %, по альтернативной схеме – 12,9 %, по приемлемой схеме – 6,5 %.
В общем анализе крови у половины пациентов при поступлении наблюдались анемия и ускоренная СОЭ; у трети пациентов наблюдался лейкоцитоз, у двух пациентов – лейкопения.
У 7 пациентов, которые скончались в ходе лечения, при поступлении преобладала инфильтративная форма туберкулёзного процесса (57,2 %), затем диссеминированная форма (28,6 %) и казеозная пневмония (14,2 %). В конечном результате у пациентов преобладала диссеминированная форма (57,2 %) инфильтративная форма (28,6 %) и фиброзно-кавернозная форма (14,2 %). 3 пациента были впервые выявлены по заболеванию туберкулёз, по ВИЧ инфекции – от 2 до 15 лет. Лечение получали: 4 человека – IV РХТ, 3 пациента – профкурс из трёх противотуберкулёзных препаратов второго ряда. 6 пациентов получали АРВТ по предпочтительной схеме, 1 пациент по альтернативной схеме. Все имели стадию ВИЧ-инфекции 4В. CD4-клеток на момент поступления, у данных пациентов было от 2 до 200 кл/мкл, средний показатель 91 кл/мкл (рис. 1).

Рис. 1. Динамика CD-4 лимфоцитов до АРВТ и спустя 1 месяц
Вирусная нагрузка составляла от 30500 до 1900000 коп/мл. АРВТ данные пациенты начали получать через 2–4 недели после назначения антибактериальной терапии. Вирусная нагрузка пациентов спустя месяц противовирусной терапии составляла от 1050 до 750000 коп/мл (рис. 2).

Рис. 2. Динамика РНК ВИЧ до АРВТ и спустя 1 месяц
ВСВИС развился у данных пациентов в среднем за 18 дней. По клиническим проявлениям у всех пациентов синдром проявлялся в виде интоксикационного синдрома: подъём температуры тела до 40 °С, выраженная слабость, потливость; и в 40 % случаев синдрома дыхательной недостаточности: одышка в покое. Так же у 40 % начались проявления орофарингиального кандидоза. Бактериовыделение у пациентов сохранялось.
В ходе динамического наблюдения за лабораторными показателями наблюдалось следующее.
По рентгенологической картине у 70 % пациентов была отрицательная динамика по сравнению с предыдущими снимками: увеличение инфильтрации лёгочной ткани, увеличение полостей; у 30 % не отмечалось отклонений в динамике.
В результате появления синдрома восстановления иммунной системы противотуберкулёзная и антиретровирусная терапия полностью сохранялась, назначалась терапия НПВС, гормональная терапия, в некоторых случаях бронхолитическая терапия и оксигенотерапия.
У пациентов с выраженной иммуносупрессией и высокой вирусной нагрузкой на фоне эффективной противовирусной терапии смерть наступала в течение 10–28 дней.
У остальных 24 пациентов при поступлении преобладала инфильтративная форма туберкулёзного процесса в 66,6 % случаев, затем диссеминированная форма – 16,6 %, фиброзно-кавернозная форма – 12,5 % и казеозная пневмония – 4,1 %. В конечном результате у пациентов преобладала инфильтративная форма – 50 % и на втором плане фиброзно-кавернозная форма – 25 %. 54,1 % пациентов были впервые выявлены по заболеванию туберкулёз, остальные состояли на учёте от 3 до 6 лет. Длительность заболевания ВИЧ-инфекции составляла от 1 до 12 лет. Стадия ВИЧ-инфекции у пациентов: 4Б – 11 чел., 4В – 13 чел. Лечение получали: 20 чел. по IV РХТ, 1 пациент получал профкурс, 2 чел. получали терапию по I РХТ, 1 чел. – по V РХТ.
21 пациент получал АРВТ по предпочти- тельной схеме, 1 пациент по альтернативной схеме, 2 чел. по приемлемой схеме. CD4-клеток на момент поступления, у данных пациентов было от 12 до 348 кл/мкл. Вирусная нагрузка составляла от 3700 до 3900000 коп/мл. АРВТ данные пациенты начали получать через 2–4 недели после назначения антибактериальной терапии. Вирусная нагрузка пациентов спустя месяц противовирусной терапии составляла от 150 до 500000 коп/мл.
ВСВИС развился у данных пациентов в среднем за 19 дней. По клиническим проявлениям у всех пациентов синдром проявлялся в виде интоксикационного синдрома: подъём температуры тела до 40 °С, выраженная слабость, потливость, головная боль, недомогание; и в 20,8 % случаев – синдрома дыхательной недостаточности: одышка в покое; в 16,6 % случаев наблюдалась желудочно-кишечная симптоматика: тошнота, рвота, диарея. В 8,3 % случаев наблюдалась регионарная лимфаденопатия. Бактериовыделение у пациентов сохранялось. По рентгенологической картине у 83,3 % отмечалась отрицательная динамика по сравнению с предыдущими снимками: увеличение количества очагов, нарастание инфильтрации лёгочной ткани; у 16,7 % не отмечалось отклонений в динамике.
В результате появления синдрома восстановления иммунной системы противотуберкулёзная и антиретровирусная терапия полностью сохранялась, подключалась терапия НПВС, гормональная терапия, в некоторых случаях бронхолитическая терапия, оксигенотерапия. Приём нестероидных противовоспалительных препаратов в ходе купирования синдрома не оказал существенного влияния на течение воспалительного синдрома, тогда как после назначения ГКС у пациентов отмечалось снижение температуры тела и уменьшение слабости в 87 % случаев.
Срок возникновения СВИС, в зависимости от стадии ВИЧ-инфекции:
4Б стадия – 14 дней; 4В стадия – 18 дней. Длительность синдрома в зависимости от стадии ВИЧ-инфекции: 4Б стадия – 25 дней, 4В стадия – 31 день.
Длительность СВИС в зависимости от количества CD-4 лимфоцитов до лечения (рис. 3).

Рис. 3. Длительность СВИС в зависимости от колличества CD-4 лимфоцитов

Рис. 4. Длительность СВИС в зависимости от вирусной нагрузки (РНК ВИЧ)
Пациенты с CD4 от 0 до 50 кл/ – 11 дней; длительность – 32 дня;
с CD4 от 51 до 100 кл – 8 дней; длительность – 26 дней;
с CD4 от 101 до 150 кл – 12 дней; длительность – 25 дней;
с CD4 от 151 до 200 кл – 24 дня; длительность – 25 дней;
с CD4 от 201 кл и более – 20 дней; длительность – 26 дней.
Длительность СВИС в зависимости от вирусной нагрузки (РНК ВИЧ) до начала лечения (рис. 4).
Пациенты с РНК ВИЧ от 0 до 10000 коп/мл – 11 дней; длительность – 17 дней;
с РНК ВИЧ от 10001 до 100 000 коп/мл – 13 дней; длительность – 17 дней;
с РНК ВИЧ от 100001 до 500000 коп/мл – 12 дней; длительность – 25 дней;
с РНК ВИЧ от 500 001 до 1 000 000 коп/мл – 17 дней ; длительность – 28 дней;
с РНК ВИЧ от 1 000 001 коп/мл и более – 18 дней; длительность – 35 дней.
В ходе выявления ВСВИС была сохранена этиотропная терапия туберкулёза и ВИЧ-инфекции. Всем пациентам была назначена терапия нестероидными противовоспалительными препаратами (НПВП), затем подключена терапия глюкокортикостероидами (ГКС). На фоне терапии НПВП пациенты наблюдались без динамики. На фоне ГКС симптоматика воспалительного синдрома снижалась. Проявлялось снижение воспалительной реакции улучшением клинической картины пациентов, а так же положительной лабораторно-инструментальной динамикой.
Результаты исследования и их обсуждение
По гендерному распределению превалируют лица мужского пола трудоспособного возраста и низкой приверженностью к терапии, как со стороны туберкулёза, так и со стороны ВИЧ-инфекции. У исследуемых пациентов преобладала инфильтративная форма туберкулёзного процесса (61,2 %), преимущественно двухстороннее поражение (80,6 %), со стажем заболевания от 1 до 3 лет. Бактериовыделение было получено микроскопическим, культуральным и молекулярно-генетическим методами у всех пациентов. У большинства пациентов наблюдался туберкулез с множественной лекарственной устойчивостью (93,5 %). Пациенты получали лечение преимущественно по IV индивидуализированному режиму химиотерапии (77,4 %). В структуре сопутствующих заболеваний преобладал гепатит смешанной этиологии (70,9 %). Стадия ВИЧ-инфекция у большинства пациентов – 4В (61,2 %) с длительностью заболевания от 1 до 5 лет (48,3 %). По данным иммунного профиля пациентов и анализам вирусной нагрузки можно сделать вывод о запущенном течении ВИЧ-инфекции, которое обусловлено низким количеством CD4-лимфоцитов и высокой вирусной активностью. В общем анализе крови при поступлении у половины пациентов наблюдалась анемия и ускоренная СОЭ; у трети пациентов наблюдался лейкоцитоз. Полный курс терапии получила лишь небольшая доля пациентов (25,8 %), что также свидетельствует о низкой приверженности к лечению данной категории пациентов. В ходе адекватного этиотропного и симптоматического лечения туберкулёза и ВИЧ-инфекции с появлением ВСВИС умерло 7 пациентов (22,5 %).
Во всех случаях наблюдалось усиление воспалительной реакции на проводимую этиотропную терапию, что говорит о парадоксальном варианте ВСВИС. Начало ВСВИС характеризуется появлением преимущественно интоксикационного синдрома в сочетании в 80 % случаев с отрицательной рентгенологической динамикой. По общему анализу крови в динамике существенных отклонений не выявлено. Срок начала синдрома у данных пациентов в среднем составляет 17 дней. Анализ срока возникновения ВСВИС в зависимости от стадии ВИЧ-инфекции показал более быстрое начало у пациентов со стадией 4Б на 23 %. По изученным данным, в зависимости от глубины иммунносупрессии срок возникновения синрома прямо пропорционален числу CD-4 клеток и РНК ВИЧ в крови.
Более длительный период течения синдрома наблюдался у пациентов со стадией ВИЧ-инфекции 4В. В зависмости от количества CD-4 наблюдается обратно пропорциональная связь. В зависимости от вирусной нагрузки наблюдается отличная от данных по CD-лимфоцитам. То есть чем выше вирусная нагрузка, тем дольше протекает СВИС.
Зависимости от формы туберкулезного процесса или от назначенной антибактериальной терапии зависимости выявлено не было.
Антиретровирусную терапию большинство пациентов получали по предпочтительной схеме (80,6 %). В ходе прохождения курсов ПТХТ и АРВТ возникал ВСВИС у 7,2 % пациентов, находившихся на лечении в отделении за последние 3 года.
На фоне симптоматической терапии ГКС отмечалось клиническое улучшение состояния в виде снижения температуры тела до 37,4–36,8 °С, а также менее выраженной слабости и потливости, нежели от НПВП.
Заключение
К числу инфекционных заболеваний относится туберкулез, имеющий в настоящее время глобальное распространение. Так, в докладах ВОЗ, опубликованных в последние десятилетия, подчеркивается, что около трети населения земного шара инфицированы Mycobacterium tuberculosis. Ежегодно в мире выявляется около 8 миллионов больных с различными клиническими проявлениями туберкулеза; умирает около 1,5 миллионов человек, у которых причиной смерти явились активные формы туберкулеза. Следует подчеркнуть, что большая часть инфицированных людей, переносят латентные формы туберкулеза. Реактивация латентного туберкулеза может произойти под воздействием неблагоприятных факторов, включая и заболевания, приводящие к иммуносупрессивному эффекту, как например, СПИД, системные гематологические и онкологические заболевания, хронический стресс, голод и другие состояния.
В большинстве случаев, первичное заражение человека происходит посредством ингаляционного проникновения в дыхательные пути аэрозоля, в капельках которого находятся Mycobacterium tuberculosis. Патогены, достигая альвеолярной поверхности, захватываются макрофагами. В тех макрофагах, которые не активированы, происходит репликация бактерий; нарушается процесс их элиминации из легких. Макрофаги, на ранних стадиях инфекционного заболевания, секретируют провоспалительные цитокины: интерлейкины–1, 2, 6, 12 и фактор некроза опухоли (TNF- a ), а также хемокины. С процессом экспрессии генов, ответственных за продукцию цитокинов и хемокинов, связывают и процесс возрастающей миграции макрофагов, T– и B–лимфоцитов, нейтрофилов в очаг воспалительного процесса. Перечисленные клетки участвуют в формировании гранулемы. В центре гранулемы находятся макрофаги, которые окружены T– и B–лимфоцитами. Эволюционно сложившаяся морфологическая реакция организма человека (в виде образования гранулемы) направлена на ограничение процесса диссеминации инфекционной воспалительной реакции.
В последние годы внимание было обращено на роль дендритных клеток в процессе формирования гранулемы. Дендритные клетки относят к числу антиген представляющих клеток, они играют центральную роль в инициации первичного иммунного ответа. Однако их роль в формировании гранулематозной воспалительной реакции остается мало изученной областью иммунитета при туберкулезе. Tomoyoshi Tsuchiya et al. (2003) на модели экспериментально вызванного туберкулеза у крыс, исследовали участие дендритных клеток в образовании гранулемы. Плеоморфные клетки в большом количестве аккумулируются на границе образовавшейся гранулемы. На мембране клеток экспрессированы молекулы большого комплекса гистосовместимости (MHC второй класс), к которым относят В7–1 и В7–2, а также специфические маркеры моноцит/макрофаг. Функциональная роль этих клеток проявляется в их влиянии на противоспалительную активность лимфоцитов. В частности, этот биологический эффект достигается за счет экспрессии пептида BCG. Эти данные проливают новый свет не только на участие дендритных клеток в образовании гранулемы, но раскрывают новые механизмы межклеточного взаимодействия. Получены также новые данные регулирования иммунологической активности Т–лимфоцитов и их участия в формировании гранулемы как гиперчувствительной реакции замедленного типа, возникающей в ответ на колонизацию M. tuberculosis. Следующий этап исследования – установление роли дендритных клеток в формировании туберкулезной гранулемы у человека.
В фокусе современных исследований находится также установление роли нейтрофилов в формировании противотуберкулезного иммунитета. Активация циркулирующих полиморфонуклеаров, полученных от больных с активными формами туберкулеза, ассоциируется с индуцированным апоптозом. Природу этих изменений изучала группа Mercedes Aleman et al. (2002). Авторы установили изменения в экспрессии CD11b, CD16. Биологические эффекты M. tuberculosis проявляются в ускоренном апоптозе полиморфонуклеарных клеток. Необходимо подчеркнуть, что ускоренный апоптоз можно наблюдать со стороны других клеток, в частности, макрофагов, g d Т–лимфоцитов, что также связывают с процессом колонизации микобактерий туберкулеза.
Однако следует признать, что наибольшая научная информация накоплена по изучению роли лимфоцитов и макрофагов в формировании иммунитета при туберкулезе. Межклеточное взаимодействие между T–лимфоцитами и макрофагами играет важную роль в формировании гранулемы и противоинфекционной защиты при колонизации Mycobacterium tuberculosis. Формирование эффективной иммунологической защиты зависит от клеточного взаимодействия, что определено в виде клеточного иммунитета. Следует подчеркнуть, что роль T–лимфоцитов в формировании клеточного иммунитета остается в фокусе современных исследований и постоянно пополняется новыми научными фактами. Предпосылками к активному научному исследованию роли T–лимфоцитов в формировании иммунитета при туберкулезе является их способность синтезировать интерферон g и TNF– a . С ними связывают развитие механизмов защиты при микобактериальном инфекционном процессе. Указанные цитокины играют важную роль в активации макрофагов, тем самым они оказывают патогенетическое влияние на формирование иммунитета при инфицировании микобактериями туберкулеза. За прошедшие два года были проведены научные исследования по установлению роли CD8+ T–лимфоцитов (V. Lazevic, J. Flinn, 2002).
В предварительных научных исследованиях была охарактеризована роль CD4+ T–лимфоцитов. Они играют важную роль в формировании противотуберкулезного иммунитета. Особенно их роль стала понятной в связи с ростом числа больных туберкулезом среди лиц, инфицированных вирусом СПИД. Среди этой группы больных отмечается особенно высокий рост числа больных с реактивированным латентным туберкулезом. Патогенетическая роль этой популяции лимфоцитов предопределяется их способностью распознавать антигены большого комплекса гистосовместимости (major histocompatibility complex или в сокращенной форме – MHC, так же необходимо указать класс, в данном контексте – ІІ). Так, распознаются дендритные клетки и макрофаги, в вакуолях которых находится антигенный пептид. В противоположность этим иммунологическим механизмам, MHC – І представлены молекулы антигенов, которые активируют CD8+ T–лимфоциты. Этот иммунологический механизм контролирует транспорт антигена из цитоплазмы в эндоплазматический ретикулем. Так как Mycobacterium tuberculosis первично живет в вакуолях, больше чем в цитоплазме клеток, то, казалось, маловероятна роль данной популяции лимфоцитов в формировании противотуберкулезного иммунитета. Однако в исследованиях, которые были проведены Muller et al., 1987, было показано участие CD8 Т–лимфоцитов в механизмах элиминации M. tuberculosis из ткани селезенки экспериментальной линии мышей (gene disrupted). Этим данным придается большое значение, так как впервые были получены убедительные экспериментальные данные о роли CD8 Т–лимфоцитов в формировании противотуберкулезного иммунитета. У мышей генетической линии gene disrupted выявляется генетический дефект продукции b 2–микроглобулина ( b 2m). Указанный генетический дефект оказывает большое влияние на функциональную активность MHC–I. Данные изменения снижают цитотоксическую активность CD8 Т–лимфоцитов, что проявляется в снижении контроля над инфекционным процессом, в частности, это сказывается и на туберкулезном процессе. Дефицит b 2m глобулина сказывается и на сниженной активности CD1 лимфоцитов, нарушены и другие неклассические пути участия MHC в формировании против инфекционной защиты. Однако следует подчеркнуть, что точные механизмы участия CD8 Т–лимфоцитов в формировании иммунной защиты остаются мало изученными. В экспериментальных условиях на мышах были исследованы как классический, так и неклассический MHC–І класс в формировании механизмов защиты против M. tuberculosis. Так, были исследованы механизмы дефицита b 2m глобулина, перфорины, CD1d. В этой серии работ, которые были проведены Sousa AO et al. (2000), было показано, что роль протективного механизма Т–лимфоцитов не зависит от перфорин–индуцированной цитотоксичности. Однако следует признать, что механизм дефицита b 2m глобулина не может объяснить образование гранулемы у мышей в экспериментальной модели туберкулезной инфекции. В гранулеме превалируют лимфоциты, однако доминирующую роль играют макрофаги в условиях функциональной недостаточности лимфоцитов. Таким образом, можно говорить о новом механизме участия лимфоцитов в образовании гранулемы, когда определяется дефицит b 2m глобулина. Этот механизм играет важную роль в раннем вовлечении лимфоцитов в формирование гранулемы. Необходимо подчеркнуть, что мыши с дефицитом b 2m глобулина имеют также выраженный дефект в метаболизме железа. Высокий уровень колонизации M. tuberculosis наблюдался при высоком уровне содержания железа. В тех случаях, когда были назначены хелатиновые препараты, удавалось существенно снизить колонизацию микобактерий.
Экспериментальные и клинические данные позволяют утверждать о ведущей роли CD4 Т–лимфоцитов в контроле над инфекционным процессом, вызванного микобактериями туберкулеза. В стратегии развития вакцин для лечения больных туберкулезом, как и ранее, учитывается роль CD4 Т–лимфоцитов. Активное исследование роли CD8 Т–лимфоцитов в патогенезе туберкулеза является другой областью разработки дизайна вакцин нового поколения. Эти научные предположения основаны на экспериментальных данных. Так, в случаях дефицита CD4 Т–лимфоцитов экспериментальные крысы умирали быстро от аэрозольного пути заражения микобактериями туберкулеза, что было особенно демонстративно замечено по сравнению с группой животных, у которых был дефицит CD8 Т–лимфоцитов. Однако манифестное течение экспериментальным путем вызванного туберкулеза наблюдалось при дефиците обеих популяций лимфоцитов. Интерпретация этих экспериментальных данных указывает на защитную роль CD8 Т–лимфоцитов в развитии туберкулезного процесса. Дефицит CD8 Т–лимфоцитов приводит также к реактивации латентной формы туберкулезного процесса.
Таким образом, в экспериментальных исследованиях было убедительно показано, что CD8 Т–лимфоциты играют важную роль в контроле инфекционного процесса, вызванного колонизацией микобактерий туберкулеза. Особенно эта роль заметна при хроническом процессе, а также в случаях реактивации латентных форм туберкулеза. Особое внимание было обращено на исследование антибактериальных механизмов CD8 Т–лимфоцитов. Антимикробная активность этих клеток может достигаться несколькими путями. Лимфоциты этой популяции могут быть источниками продукции таких цитокинов, какими являются интерферон–гамма (IFN– g ) и TNF- a . CD8 Т–лимфоциты могут оказывать протективный эффект прямым действием, направленным против макрофагов, находящихся в тканях и захвативших M. tuberculosis. Продукция цитокинов играет важную роль в активации макрофагов. CD4, CD8 Т–лимфоцитов секретируют INF– g и TNF- a , концентрация которых возрастает в очаге воспаления. Другой механизм, с помощью которого инфицированные макрофаги поражаются CD8 Т–лимфоцитами, связывают с способностью клеток убивать макрофаги с помощью перфорина. Перфорин является протеином, который синтезируется гранулами CD8 Т–лимфоцитов. С помощью указанного протеина перфорируется мембрана макрофагов, и через них внутрь клетки проникают такие токсические пептиды, какими являются гранзимы или гранулизин, которые ускоряют процесс апоптоза макрофагов. Апоптоз макрофагов может быть также осуществлен через механизм Fas–лиганда, который приводит к активации CD8 Т–лимфоцитов.
Следует прояснить роль CD4 и CD8 Т–лимфоцитов в продукции INF– g . В экспериментальных условиях было показано, что при раннем инфекционном процессе, вызванном M. tuberculosis, тканевые CD4 Т–лимфоциты синтезируют IFN– g около 13%, в то время как CD8 клетки только 5%. Однако следует иметь в виду, что число CD8 клеток значительно превышает в очаге воспаления число CD4 Т–лимфоцитов. Отсюда становится понятным возможный высокий потенциал цитотоксического эффекта CD8 Т–лимфоцитов в очаге туберкулезного воспалительного процесса.
Таким образом, CD8 Т–лимфоциты имеют несколько механизмов антимикробного действия, среди которых более изученными являются прямые цитотоксические эффекты, участие в продукции провоспалительных цитокинов, синтез целого ряда пептидов с выраженными токсическими свойствами. Эти клетки могут в значительной степени компенсировать функциональную неполноценность CD4 Т–лимфоцитов.
Недавними исследованиями Stenger S. еt al. (1997) было показано прямое цитотоксическое действие CD8 Т–лимфоцитов направленное против M. tuberculosis, находящихся внутриклеточно. Этот механизм прямого поражения микобактерий связывают со способностью человеческих лимфоцитов продуцировать гранулизин. Данный механизм не возможно исследовать в экспериментальных условиях, так как лимфоциты животных не вырабатывают этот тип пептида. Однако остается много неизученных вопросов, связанных с генетическими механизмами регулирования кинетики жизненного цикла лимфоцитов, особенностей формирования их воспалительной активности, продукции целого ряда цитокинов, перфорина, гранзимов и других биологически активных веществ.
Каждый Т–лимфоцит имеет специфический эпитоп или же короткую цепь аминокислот в структуре антигена. Идентификация антигенов или же эпитопов является важным этапом в расшифровке механизмов защиты, так как эта информация необходимо использовать в конструировании нового поколения вакцин. Вакцины, которые способны повысить иммунобиологические свойства против M. tuberculosis, должны быть сконструированы на основании новых данных о природе их взаимодействия с иммунокомпетентными клетками. В классическом варианте CD8 Т–лимфоциты распознаются пептидами, входящими в структуру MHC Ia. Эта популяция лимфоцитов способна также распознавать антигены MHC I; при этом имеются ввиду такие молекулы, как CD1 или MHC Ib. Исследование генома микобактерий диктует необходимость получить информацию о роли и месте классического и неклассического пути его взаимодействия с иммунной системой хозяина. Эти данные сегодня имеют значение в трактовке разных клинических проявлений туберкулеза. Так, характеристика классического и неклассического MHC позволила выделить клоны лимфоцитов с повышенной и пониженной продукцией IFN– g . Специфические антигены M. tuberculosis, которые оказывают влияние на противовоспалительную активность Т–лимфоцитов, являются секреторными антигенами и включают такие как 6, Ag85A, Ag85B, 38 kD, шоковый белок 65 и липопротеин 19 kD. CD8 Т–лимфоциты имеют специфические эпитопы для раннего секреторного антигена 6, который отсутствует в M. bovis, Bacille Calmette–Guerin (BCG). С данным антигеном связывают активацию лимфоцитов и начало продукции интерферона. В настоящее время активно исследуется способность лимфоцитов к продукции интерферона g в зависимости от активности туберкулезного процесса и участия как классического пути MHC–1a, так и неклассического MHC–1b. Lalvani A. et al. (1998) установили, что у здоровых индивиду мов, у которых была положительная реакция на туберкулин CD8, Т–лимфоциты синтезируют более низкие концентрации интерферона–гамма, чем у здоровых людей, у которых реакция на туберкулин была отрицательной. При этом было установлено, что более чем в 96% случаев наблюдался неклассический MHC–1b.
Таким образом, проведенные исследования в последние годы по установлению роли CD8 Т–лимфоцитов в патогенезе туберкулезного процесса, свидетельствуют об их активном участии в формировании иммунологических реакций. Эти данные позволяют рассматривать принципиально новые подходы в конструировании вакцин в борьбе с туберкулезом. Существующие вакцины построены, исходя из роли и значения в туберкулезном процессе CD4 Т–лимфоцитов; следует подчеркнуть их низкую эффективность в борьбе с туберкулезом у взрослых. Этот факт имеет большое значение в планировании новых подходов при конструировании вакцин нового поколения. Большое значение следует придать и такому фактору, как способность CD8 Т–лимфоцитов распознавать макрофаги, которые фагоцитировали M. tuberculosis, и приводить их к гибели непосредственно в очаге воспалительной реакции. Однако остается большое количество неизученных вопросов, к которым следует отнести взаимодействие различных популяций лимфоцитов, устойчивость иммунитета, особенно в отдаленные сроки наблюдения, оценка эффективности выработанной стратегии в разработке вакцин нового поколения.
Большой интерес вызывает изучение роли оксида азота в патогенезе туберкулеза. Интерес особенно возрос после того, как были установлены факты, которые продемонстрировали способность оксида азота проявлять бактерицидные свойства. Однако систематических исследований по этому вопросу не проведено. Choi et al. (2002) установили, что в легочной ткани, резецированной у больных с туберкулезом, повышен уровень индуцибельной синтетазы оксида азота, эндотелиальной синтетазы оксида азота и нитротирозина (маркера экспрессии оксида азота). В зоне некротического процесса регистрировалось повышение активности TNF- a . Экспрессия изоформ оксида азота и TNF- a отмечена в эпителиоидных макрофагах, в гигантских клетках, входящих в структуру гранулемы, а также в альвеолярных макрофагах, в эпителиальных клетках, вовлеченных в пневмонический процесс.
Группа экспертов ВОЗ, которую возглавил известный клинический эпидемиолог Murray CJL. (1990) приводит данные о том, что только у 10% инфицированных M. tuberculosis развиваются клинические проявления туберкулеза. Генетические исследования проливают свет на природу повышенной восприимчивости к патогену. В последние годы был предпринят целый ряд исследований по изучению различных генов, с которыми можно было бы связать повышенную чувствительность к туберкулезу. Эти исследования были предприняты с целью дальнейшего изучения взаимоотношения микроорганизма и хозяина в развитии инфекционного процесса. Больше данных было накоплено по изучению генов, регулирующих путь синтеза интерферона g в организме человека, предрасположенного к микобактериям туберкулеза. Первый ген, с которым связывают нарушение метаболизма интерферона g , контролируют функциональную активность рецептора. Дефицит проявляется в снижении способности рецептора связываться с лигандом. Этот дефект передается по аутосомно–рецессивному пути. Другое генетическое нарушение в обмене интерферона относится к полной потере способности рецептора передавать биологический сигнал. Аутосомно–доминантный тип генетического нарушения в регулировании обмена интерферона связано с нарушением передачи сигнала к трансдукции и активации процесса транскрипции. Интерлейкин 12 стимулирует продукцию интерферона g , что происходит с участием лимфоцитов. Описана мутация гена, с которым связывают нарушение синтеза р40 субъединицы интерлейкина–12. У лиц чувствительных к туберкулезу, описан также генетический дефект рецептора интерлейкина–12 (субъединица b 1).
1. Lazarevic V., Flynn J.: CD8 cells in tuberculosis, Am. J Respir Crit Care Med vol 166, pp1116 1121,2002
2. WHO. The World Health Report. 1999.
3. Aleman M., Garcia A., Saab M. et al.: Mycobacterium tuberculosis – induced activation accelerates apoptosis in peripheral blood neutrophils from patients with active tuberculosis, Am. J Respir Cell Mol. Biol. Vol 27, pp 583–592, 2002
4. Tsuchiya T., Chida K., Suda T: et al. Dendritic cell involvement in pulmonary granuloma formation elicited by bacillus Calmette–Guerin in rats Am J Respir Crit Care Med vol 165. pp 1640–1646, 2002
Проблеме туберкулеза у больных сахарным диабетом (СД) в последние годы уделяется все большее внимание. Повышенный интерес обусловлен, с одной стороны, ростом числа больных туберкулезом со множественной лекарственной устойчивостью возбудителя, а с другой ‒ неуклонным увеличением распространенности СД. Объективная реальность обусловливает актуальность проблемы сочетанной патологии, а также необходимость правильного понимания механизмов развития туберкулезного процесса у этой категории больных.
В обзоре освещены данные литературы об иммунологических и биохимических механизмах восприимчивости организма к туберкулезу при СД. Анализ результатов многочисленных исследований позволяет заключить, что наличие СД ассоциируется с отсроченным иммунным ответом при инфицировании Mycobacterium tuberculosis (МБТ). Гипергликемия вызывает нарушение функции макрофагов, лимфоцитов и нейтрофилов. В частности, снижается хемотаксическая и фагоцитарная функция макрофагов, блокируется экспрессия сигналов от инфицированных макрофагов, снижается скорость миграции лимфоцитов и нейтрофилов, а также уровень цитокинов, связанных с врожденным и приобретенным иммунитетом. Комбинация всех этих процессов на протяжении первых 2-х недель после заражения создает условия для быстрого размножения МБТ и тем самым повышает риск развития туберкулеза.
Ключевые слова: туберкулез, сахарный диабет, восприимчивость, макрофаги, нейтрофилы, лимфоциты, активированные формы кислорода.
Для цитирования: Абдуллаев Р.Ю., Комиссарова О.Г., Михайловский А.М. Иммунологические и биохимические механизмы восприимчивости туберкулеза при сахарном диабете. РМЖ. 2017;18:1324-1327.
Immunological and biochemical mechanisms of tuberculosis susceptibility in diabetes mellitus
Abdullaev R.Yu. 1, Komissarova O.G. 1,2 , Mikhailovsky A.M. 3
1 Central Research Institute of Tuberculosis, Moscow
2 Russian National Research Medical University named after N.I. Pirogov, Moscow.
3 Orenburg State Medical University
The problem of tuberculosis in patients with diabetes mellitus (DM) has been receiving increasing attention in recent years. The growing interest is due, on the one hand, to an increase in the number of patients with multidrug-resistant tuberculosis, and on the other, a steady increase in the prevalence of diabetes. Objective reality determines the urgency of the problem of the combined pathology, as well as the need for a proper understanding of the mechanisms of development of the tuberculous process in this category of patients.
The review covers literature data on the immunological and biochemical mechanisms of susceptibility to tuberculosis in diabetes mellitus. Analysis of the results of numerous studies suggests that the presence of diabetes is associated with a delayed immune response when infected with Mycobacterium tuberculosis (MTB). Hyperglycemia causes a disturbance in the function of macrophages, lymphocytes and neutrophils. In particular, the chemotactic and phagocytic function of macrophages decreases, the expression of signals from infected macrophages is blocked, the rate of migration of lymphocytes and neutrophils decreases, as well as the level of cytokines associated with congenital and acquired immunity. The combination of all these processes during the first 2 weeks after infection creates conditions for rapid multiplication of the MTB and thereby increases the risk of tuberculosis.
Key words: tuberculosis, diabetes mellitus, susceptibility, macrophages, neutrophils, lymphocytes, reactive oxygen intermediates.
For citation: Abdullaev R.Yu., Komissarova O.G., Mikhailovsky A.M. Immunological and biochemical mechanisms of tuberculosis susceptibility in diabetes mellitus // RMJ. 2017. № 18. P. 1324–1327.
Статья посвящена механизмам восприимчивости туберкулеза при сахарном диабете
Заключение
Результаты приведенных многочисленных исследований позволяют заключить, что наличие СД ассоциируется с отсроченным иммунным ответом при инфицировании МБТ. Гипергликемия вызывает нарушение функции макрофагов, лимфоцитов и нейтрофилов. В частности, снижается хемотаксическая и фагоцитарная функция макрофагов, блокируется экспрессия сигналов от инфицированных макрофагов, снижается скорость миграции лимфоцитов и нейтрофилов, а также уровень цитокинов, связанных с врожденным и приобретенным иммунитетом. Комбинация всех этих процессов на протяжении первых 2-х недель после заражения создает условия для чрезмерного размножения МБТ и тем самым повышает риск развития туберкулеза.
Вирусная нагрузка – важный показатель состояния организма ВИЧ-положительного пациента. Она рассчитывается путем подсчета количества копий РНК ВИЧ (вирусных частиц) в 1 миллилитре плазмы крови. Полученные показатели указывают на степень тяжести вирусной инфекции. Благодаря им можно оценить эффективность проводимой ВААРТ, и прогнозировать дальнейшее развитие заболевания. Для создания более полной картины болезни, анализ на вирусную нагрузку проводится вместе с тестом на уровень CD4-лимфоцитов – антигены иммунной системы, отображающие ее состояние.
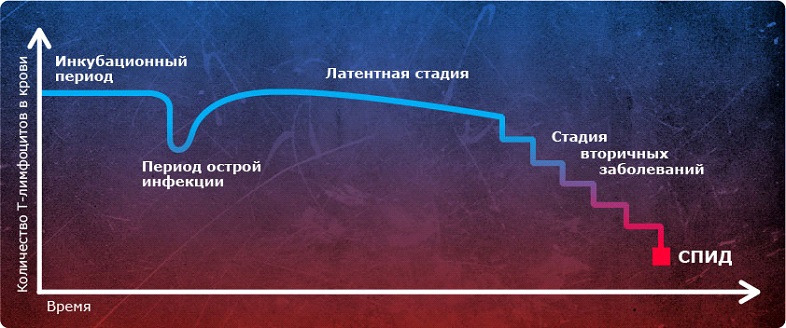
Без приёма терапии со временем снижается уровень СД4 клеток.
Как можно узнать уровень вирусной нагрузки на организм?
По сути, вирусная нагрузка отображает количество ВИЧ в крови. В то время как количество CD4 клеток демонстрирует состояние иммунной системы. Регулярный мониторинг этих двух показателей позволяет своевременно принимать решения – назначать ВААРТ и корректировать лечение, тем самым сдерживая прогрессирование ВИЧ-инфекции.
Анализ на вирусную нагрузку необходимо делать в следующих случаях.
- При подозрении на ВИЧ-инфекцию.
- При постановке диагноза ВИЧ.
- До начала антиретровирусной терапии – каждые 3-6-12 месяцев.
- Через 1 и 3 месяца после начала ВААРТ и далее каждые 3-4 месяца в ходе ее проведения.
Именно оценивая динамику вирусной нагрузки, лечащий инфекционист может сделать заключение об эффективности лечения и при необходимости корректировать ВААРТ.
Для определения вирусной нагрузки проводятся лабораторные исследования, с применением одного из нижеследующих методов.
- ПЦР (полимеразная цепная реакция) – обнаруживает вирус, начиная с 20 - 40 копий в 1 мл крови.
- Метод разветвленной ДНК – менее чувствительный и обнаруживает большое количество копий.
- NASBA (метод транскрипционной амплификации) – очень чувствительная методика, способная увеличивать белки вируса, для того чтобы определить его количество. Однако в России NASBA пока не получил широкое распространение.
Принципиальное различие методов и степень их чувствительности могут стать причиной недостоверного результата. Поэтому специалисты рекомендуют для определения вирусной нагрузки выбрать какой-нибудь один метод и использовать его на постоянной основе.
Расшифровка результатов исследований на ВИЧ
Полученные в ходе исследования вирусной нагрузки результаты расшифровываются следующим образом.
- До 10 000 копий вируса – низкая вирусная нагрузка.
- Свыше 100 000 копий – высокая вирусная нагрузка.
- 0 копий – вируса в организме нет, что считается нормой для здорового человека и указывает на необходимость повторного исследования для ВИЧ-инфицированных пациентов.
Неопределяемая вирусная нагрузка – минимальное количество копий, наличие которых невозможно зафиксировать с помощью выбранного метода исследования.
Таким образом, неопределяемая вирусная нагрузка – это показатель, к которому стремятся все ВИЧ-инфицированные пациенты. Такой результат указывает на то, что вирус в организме есть, но его количество ничтожно мало и на данный момент человеку ничего не угрожает. Одна при этом обязательно необходимо оценить общее состояние иммунной системы. Для этого нужно определить количество CD4+антигенов Т-лимфоцитов. Норма клеток и возможные отклонения приведены в нижеследующей таблице.
| Количество CD4 | Возможные действия пациента |
|---|---|
| 1500 – 500 кл/мл | норма |
| 500 - 350 кл/мл | необходимо начать ВААРТ |
| 200 кл/мл и ниже | проводят ВААРТ |
| Менее 100 кл/мл | проводят ВААРТ и симптоматическую терапию |
Оценивая показатели вирусной нагрузки и CD4 можно сделать достоверное заключение о состоянии здоровья пациента. Если зафиксирована низкая вирусная нагрузка, например, 4000 копий и показатели CD4 в норме, то ВААРТ эффективна. И наоборот – высокая вирусная нагрузка при снижении показателей CD4 свидетельствуют о низкой эффективности лечения.
Как уменьшить вирусную нагрузку?
Тест на вирусную нагрузку отражает степень тяжести ВИЧ-инфекции и состояние организма. Естественно, что столкнувшись с высокими показателями нагрузки, пациенты стремятся ее снизить. Нередко для этой цели они прибегают к альтернативным методам лечения. Но проблема в том, что единственный способ снизить вирусную нагрузку – это эффективная ВААРТ. Иммуностимуляторы, иммуномодуляторы, витаминные комплексы, отвары трав и прочие средства, не оказывают никакого влияния на развитие ВИЧ-инфекции. Снизить нагрузку можно только с помощью антиретровирусной терапии.
Преимущества неопределяемой низкой нагрузки
Низкая или неопределяемая вирусная нагрузка желательна по нескольким причинам.
- Минимальный риск прогрессирования инфекции.
- Минимальный риск развития резистентности к препаратам ВААРТ.
- Минимальный риск передачи инфекции во время незащищенного полового контакта.
- Максимальный шанс родить здорового ребенка (для женщин).
Читайте также:

