Сенсибилизированный латекс для определения пневмококков 50 тестов
Обновлено: 24.04.2024
Инфекция вызванная пневмококком (Streptococcus pneumoniae): диагностика, лечение, профилактика
Streptococcus pneumoniae (пневмококк) — грамположительный кокк, который при росте на питательных средах образует ланцетовидные пары. Чувствителен к оптохину, подвержен лизису в присутствии солей жёлчи.
При росте на кровяном агаре штаммы пневмококка обычно обладают частичным гемолизом (а-гемолиз), в то же время гемолитическая активность различных штаммов может меняться. Инфекционные заболевания, вызванные пневмококком, — одна из самых распространённых причин смерти пациентов во всём мире. В группу риска входят дети, пожилые пациенты, а также лица с сопутствующими заболеваниями.
Патогенез пневмококковой инфекции (Streptococcus pneumoniae)
Пневмококки окружены полисахаридной капсулой, препятствующей фагоцитозу. Существует более девяноста различных капсульных серотипов возбудителя с различным уровнем патогенности и способностью к инвазии. Полисахарид, входящий в состав капсулы, обладает выраженными антигенными свойствами.
Антитела к капсульным полисахаридам у различных серотипов пневмококка — протективные, в то же время возможны перекрёстные иммунные реакции между различными серотипами. Компоненты клеточной стенки микроорганизма также способны вызывать выраженный воспалительный процесс.
Кроме того, пневмококки имеют несколько факторов адгезии, способствующих прикреплению возбудителя к полисахаридам поверхности клеток, что способствует колонизации организма.
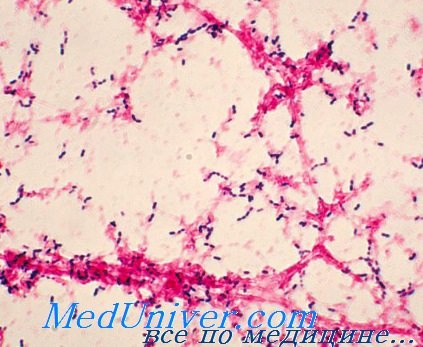
Колонизация пневмококковой инфекции (Streptococcus pneumoniae)
Единственный источник инфекции — человек; носительство обычно протекает бессимптомно. Распределение серотипов зависит от региона, возраста пациента и социальной группы. Наиболее подвержены острой пневмонии дети первого года жизни.
Факторы, предрасполагающие к развитию тяжёлой инфекции: недостаточность комплемента, агаммаглобулинемия, ВИЧ-инфекция, алкоголизм и спленэктомия (удаление селезёнки). Немаловажную роль в развитии инфекционного процесса играют пневмококковые токсины: пневмолизин, нейраминидаза, гиалуронидаза и адгезины (например, пневмококковый поверхностный белок типа А).
Бактерии способны прикрепляться к пневмоцитам и проникать в кровоток, связываясь с рецепторами фактора агрегации тромбоцитов и активируя выработку пневмолизина или комплемент-индуцированного повреждения альвеол.
Клинические признаки инфекции вызванной пневмококком (Streptococcus pneumoniae)
Чаще всего Streptococcus pneumoniae вызывает острые отиты, синуситы и пневмонию. В 50—70% случаев причиной возникновения внебольничной пневмонии становятся пневмококки, при этом у 25—30% пациентов развивается бактериемия.
Прямое или гематогенное распространение инфекции приводит к развитию менингита и реже к целлюлиту, абсцессам, перитониту и эндокардиту. Бактериемия — тяжелейшее осложнение пневмококковой инфекции с высокой летальностью даже при соответствующем лечении.
Пневмококк считают второй из наиболее распространённых причин развития внебольничного менингита у детей, вакци-низированных против Haemophilus influenzae типа В, и основной причиной менингита у пациентов старше сорока лет. При этом отмечают достаточно высокий уровень смертности и вероятности развития осложнений.
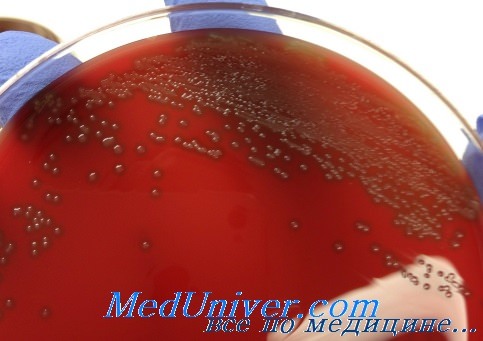
Чувствительность пневмококка (Streptococcus pneumoniae) к антибиотикам
Ранее при лечении пневмококковых инфекций самым эффективным препаратом был пенициллин, но позднее благодаря генетической модификации пенициллинсвязывающего белка большинство штаммов приобрело к нему устойчивость. В настоящее время в клинической практике используют эритромицин, цефалоспорины, тетрациклин, рифампицин и хлорамфеникол, но всё чаще сталкиваются с мультирезистентными штаммами.
Препаратом выбора продолжает оставаться пенициллин, а при менингите, вызванном менее чувствительными штаммами, применяют цефотаксим или цефтриаксон. В случае высокой устойчивости к пенициллину дополнительно назначают гликопептидные препараты (ванкомицин).
Профилактика заболевания вызванной пневмококком (Streptococcus pneumoniae)
Для профилактики пневмококковой инфекции применяют поливалентную капсульную полисахаридную вакцину для профилактики пневмококковых инфекций, эффективную при назначении пациентам в зрелом возрасте и менее действенную у лиц со сниженным иммунитетом и детей младше двух лет.
Недавно созданная конъюгированная вакцина обладает достаточно высокой иммуностимулирующей способностью у детей младшего возраста.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Вернуться в раздел "Микробиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Герпесвирусы широко распространены в человеческой популяции. После первичного инфицирования вирусы герпесгруппы переходят в латентное состояние и пожизненно персистируют в организме. При неблагоприятных условиях и снижении местного или системного иммунитета может происходить реактивация инфекции, что обусловливает развитие воспаления чаще всего на местном уровне. Разнообразие клинических форм герпесвирусных инфекций постоянно поддерживает научный интерес как в области изучения их патофизиологии, так и в области поиска эффективной противовирусной терапии. Особенно актуально это для β- и γ-герпесвирусов, т. к. группа α-герпесвирусов изучена достаточно хорошо.
Цель исследования: определить эффективность валацикловира в отношении репликации вируса Эпштейна – Барр (ВЭБ), вируса герпеса человека 6 типа (ВГЧ-6), цитомегаловируса (ЦМВ) в ротоглотке у часто болеющих взрослых с хроническими воспалительными заболеваниями верхних дыхательных путей (ВДП).
Материал и методы: нами амбулаторно обследованы 80 пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП. Всем пациентам проводились микробиологическое исследование мазков из ротоглотки и оценка вирусной нагрузки в смешанной слюне и цельной крови вне периода обострения. Пациенты получали терапию валацикловиром по схеме 500 мг 3 р./сут в течение 14 дней. Контроль вирусной нагрузки в биоматериале проводился после окончания лечения.
Результаты и обсуждение: микробный пейзаж ротоглотки часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой. В смешанной слюне обнаруживалась ДНК ВЭБ, ВГЧ-6, но не ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлялась. Применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у часто болеющих взрослых.
Выводы: целесообразно провести дальнейшие исследования по определению режима дозирования и оценке клинической эффективности ациклических нуклеозидов в лечении ВЭБ-инфекции.
Ключевые слова: герпесвирусы, вирус Эпштейна – Барр, вирус герпеса человека, цитомегаловирус, часто болеющие взрослые, вирусная нагрузка, валацикловир.
Human herpesviruses infections: clinical features and opportunities of therapy
R.V. Shubelko 1 , I.N. Zuykova 2 , A.E. Shulzhenko 2
1 JSC "K+31", Moscow
2 “National Research Center — Institute of Immunology” Federal Medical-Biological Agency of Russia, Moscow
Herpesviruses are widely spread among the human population. After the primary infection, the herpesviruses become latent and persistent in the human body for life. Adverse conditions and a low local or systemic immunity may reactivate the infection, which causes the inflammation, usually at the local level. The variety of clinical forms of herpesviruses infections constantly supports scientific interest both in the field of studying their pathophysiology and in the search for effective antiviral therapy. This is especially important for β- and γ-herpesviruses, since the α-herpesvirus group has been studied rather well.
Aim: to determine the efficacy of valacyclovir for replication of the Epstein-Barr virus (EBV), human herpesvirus type 6 (HHV-6), cytomegalovirus (CMV) in the oropharynx in frequently ill adults with chronic inflammatory diseases of the upper respiratory tract.
Patients and Methods: 80 patients with frequent recurrences of chronic inflammatory diseases of the upper respiratory tract were examined outpatiently. All patients underwent microbiological examination of swabs from the oropharynx and the viral load in mixed saliva and whole blood not in exacerbation period was assessed. Patients received valacyclovir therapy according to the scheme 500 mg x 3 times a day for 14 days. Control of viral load in the biomaterial was carried out after the end of treatment.
Results and Discussion: out of the period of exacerbation the oropharynx microflora in frequently ill adults is represented mainly by a normal or conditionally pathogenic microflora. EBV DNA, HHV-6, but not CMV DNA, were detected in the mixed saliva. The DNA of the herpesvirus was not detected in the blood samples of these patients. The use of valacyclovir in a dose
of 500 mg 3 times a day significantly reduces the replication of EBV in the oropharynx in frequently ill adults.
Conclusions: it is advisable to conduct further studies to determine the dosage regimen and evaluate the clinical efficacy of acyclic nucleosides in the treatment of EBV infection.
В статье рассмотрены клинические особенности и возможности терапии герпесвирусных инфекции человека. Определена эффективность валацикловира в отношении репликации вируса Эпштейна – Барр, вируса герпеса человека 6 типа, цитомегаловируса.
Введение
Герпесвирусы широко распространены в человеческой популяции и обладают большим разнообразием клинических проявлений, поражая различные органы и ткани. В настоящее время известно 8 видов герпесвирусов человека, разделенных на 3 группы: α-герпесвирусы — вирусы простого герпеса 1 и 2 типа (ВПГ-1, -2), вирус ветряной оспы (ВВО), β-герпесвирусы: цитомегаловирус (ЦМВ), вирус герпеса человека 6 типа (ВГЧ-6), ВГЧ-7 и γ-герпесвирусы: вирус Эпштейна – Барр (ВЭБ) и ВГЧ-8 [1, 2].
По данным ВОЗ, около 90% населения земного шара инфицированы одним или несколькими видами герпесвирусов. Первичное инфицирование, как правило, происходит в детском возрасте, после чего вирусы герпесгруппы переходят в латентное состояние, которое характеризуется отсутствием вирусной репликации и экспрессией вирусных белков. Реактивация герпесвирусов из латентной формы происходит на фоне транзиторных (инфекция, неблагоприятные факторы внешней среды, психоэмоциональные перегрузки, эндокринные нарушения и др.) или стойких (первичные или вторичные иммунодефициты, иммуносупрессивная терапия) иммунодефицитных состояний.
Распространенность герпесвирусов в мире и широкий клинический полиморфизм потенцируют проведение большого количества исследований в области изучения патофизиологии и иммунобиологии этой инфекции, а также поиск эффективной противовирусной терапии [1–3].
В своей практической деятельности врачи многих специальностей, в т. ч. и иммунологи, встречаются с заболеваниями, вызванными ВПГ 1 и 2 типа (лабиальный и генитальный герпес), ВВО (ветряная оспа, опоясывающий лишай), для которых разработаны и стандартизированы методы диагностики и терапии. Однако патофизиология и патоморфология хронических герпесвирусных инфекций, обусловленных β- и γ-герпесвирусами, недостаточно изучены, не разработаны четкие методы и стандарты их лечения, что создает определенные трудности в ведении таких пациентов.
Вирус Эпштейна – Барр
Цитомегаловирус
ЦМВ относится к семейству β-герпесвирусов. Для постнатальной цитомегаловирусной инфекции (ЦМВИ) входными воротами служат чаще всего слизистые оболочки ротоглотки и слюнные железы, где и происходит первичная репродукция вируса. Первичное инфицирование ЦМВ иммунокомпетентных лиц обычно протекает бессимптомно, лишь в 5% случаев — в виде мононуклеозоподобного синдрома (цитомегаловирусный мононуклеоз). Отличительными признаками острого процесса являются высокая лихорадка, интоксикационный синдром, сиалоаденит (чаще околоушных слюнных желез), фарингит, гепатомегалия, спленомегалия, выраженный и длительный астенический синдром. При этом для острого процесса поражение миндалин нехарактерно, увеличение регионарных лимфатических узлов отмечается редко. После разрешения первичной ЦМВИ вирус персистирует в латентном состоянии в моноцитах, эпителиальных клетках и клетках слюнных желез, которые являются резервуаром вирусных частиц.
ЦМВИ у взрослых протекает в латентной (локализованной) и генерализованной формах. Латентная форма обычно не проявляется четкими клиническими симптомами. Иногда наблюдаются легкие гриппоподобные состояния, субфебрилитет. У женщин латентно протекающая ЦМВИ может проявляться в виде повторного невынашивания беременности и мертворождения, а также в виде вульвовагинита, кольпита, цервицита, эндометрита, сальпингоофорита.
Генерализованная форма приобретенной ЦМВИ у взрослых наблюдается редко, чаще на фоне иммуносупрессии, и, безусловно, является прерогативой наблюдения инфекционистов. При этом могут поражаться желудочно-кишечный тракт (гепатит, сиалоаденит, эзофагит, гастрит, энтероколит), надпочечники (адреналит), бронхолегочная система (интерстициальная пневмония, бронхит, фиброзирующий бронхиолит, альвеолит), нервная система (энцефаловентрикулит, миелит, полирадикулопатия, полинейропатия), почки, глаза, миокард [1–3].
У иммунокомпетентных взрослых ЦМВ не поражает лимфоидную ткань, а его локальная реактивация проявляется репликацией в клетках эпителия слюнных желез, поэтому, вероятнее всего, он не играет какой-либо роли в развитии хронических воспалительных заболеваний ВДП у взрослых, характеризующихся в первую очередь поражением лимфоидных структур ротоглотки.
Вирус герпеса человека 6 типа
Еще один представитель семейства β-герпесвирусов — ВГЧ-6. Ведущий путь передачи герпесвирусной инфекции, вызванной ВГЧ-6, — воздушно-капельный. В таких случаях первичная репликация происходит в слюнных железах, лимфоидной ткани ротоглотки и шейных лимфатических узлах. Генерализация инфекции может происходить гематогенным или лимфогенным путем. Около 90% инфицированных клеток представлено Т-лимфоцитами (преимущественно CD4+), оставшаяся часть включает В-лимфоциты, моноцитарно-макрофагальные, глиальные клетки и мегакариоциты. Первичная ВГЧ-6-инфекция может протекать бессимптомно, в виде внезапной экзантемы, фебрильных или нефебрильных судорог.
На сегодняшний день считается доказанной роль ВГЧ-6 в формировании инфекционного мононуклеоза (или мононуклеозоподобного синдрома), который характеризуется непродолжительной фебрильной лихорадкой, умеренно выраженными симптомами интоксикации, умеренной лимфоаденопатией, поражением лимфоидной ткани ротоглотки (острый тонзиллит), умеренной гепатомегалией и, в половине случаев, спленомегалией, розеолоподобными высыпаниями (внезапная экзантема). В дальнейшем ВГЧ-6 переходит в латентную или персистирующую форму. Системная реактивация ВГЧ-6 чаще наблюдается у иммунокомпрометированных лиц и может приводить к развитию тяжелых органных поражений (энцефалит, пневмонит, миокардит и др.) и потенциально летальных системных поражений (вирусный сепсис) [1–3, 5].
К числу основных зон персистенции ВГЧ-6 относятся моноциты слюнных желез и лимфоидная ткань ротоглотки [2, 3, 5], поэтому реактивация хронической инфекции у иммунокомпетентных взрослых может происходить по типу мононуклеозоподобного синдрома, с воспалением слизистых оболочек и лимфоидных структур ротоглотки (тонзиллит, фарингиты). Не исключено также, что ВГЧ-6 играет определенную роль в снижении мукозального иммунитета ротоглотки и поддержании хронического воспалительного процесса на местном уровне.
Лечение герпесвирусных инфекций
Материал и методы
Результаты
Первичная герпесвирусная инфекция, обусловленная ВЭБ, ЦМВ, ВГЧ-6, протекает в большинстве случаев в виде инфекционного мононуклеоза. В дальнейшем герпесвирусы пожизненно персистируют в макроорганизме, в т. ч. и в области входных ворот инфекции (лимфоидная ткань ротоглотки). При неблагоприятных условиях и снижении местного или системного иммунитета может происходить локальная реактивация герпесвирусов, провоцируя развитие воспаления на местном уровне.
Микробный пейзаж ротоглотки у часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой.
В смешанной слюне часто болеющих взрослых вне периода обострения с высокой частотой достоверности обнаруживается ДНК ВЭБ, ВГЧ-6, и не обнаруживается ДНК ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлена, что свидетельствует не о системной, а о преимущественно местной реактивации герпесвирусной инфекции. Учитывая, что титры вирусной нагрузки ВЭБ при микст-инфекции выше (4,47 Lg, копий/10 5 клеток), чем при моноинфекции
(3,99 Lg, копий/105 клеток), можно предположить стимулирующее влияние ВГЧ-6 на активность ВЭБ.
Стандартная антибактериальная терапия без учета вирусной репликации зачастую неэффективна или недостаточно эффективна. Применение противовирусной терапии ациклическими нуклеозидами в комплексном лечении пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП позволяет повысить целенаправленность этиотропной терапии текущего воспалительного процесса.
Из ациклических нуклеозидов наиболее оптимальным и исследованным в лечении герпесвирусов является валацикловир, обладающий высокой биодоступностью и хорошим профилем безопасности. В нашей работе мы применяли дозу валацикловира в 2 раза меньшую, чем та, которая ранее апробировалась разными исследователями, главным образом потому, что мы воздействовали не на острый системный процесс, а на локальную реактивацию герпесвирусной инфекции. Выяснилось, что применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у пациентов с микст-инфекцией (ВЭБ + ВГЧ-6) — на 75%, в большей степени у пациентов с моноинфекцией (ДНК ВЭБ) — на 86%. В отношении инфекции, вызванной ВГЧ-6, не получено достоверных данных о снижении вирусной нагрузки.
Выводы
У часто болеющих взрослых микробный пейзаж вне периода обострения представлен сочетанной бактериально-вирусной микрофлорой: нормальной и/или условно-патогенной бактериальной флорой и представителями герпесгруппы (ВЭБ, ВГЧ-6), что может играть роль в хронизации воспаления в ротоглотке, способствовать снижению местного иммунитета и приводить к частым обострениям патологии ВДП.
Применение валацикловира в дозе 500 мг 3 р./сут в течение 14 дней оказалось эффективным в отношении ВЭБ — на фоне терапии вирусная нагрузка снижалась до нулевых или клинически незначимых титров.
Валацикловир обладает хорошей переносимостью и безопасностью как у молодых пациентов, так и у пациентов старшего возраста.
Дальнейшие исследования должны быть направлены на оценку клинической эффективности валацикловира в лечении реактивации ВЭБ-инфекции у часто болеющих взрослых.
1. Human Herpesviruses: Biology, Therapy, and Immunoprophylaxis / Eds A. Arvin, G. Campadelli-Fiume et al. Cambridge: Cambridge University Press, 2007. 1432 p.
2. Исаков В. А., Архипова Е. И., Исаков Д. В. Герпесвирусные инфекции человека. СПб.: СпецЛит., 2013. 670 с. [Isakov V.A., Arkhipova Ye.I., Isakov D. V. Gerpesvirusnyye infektsii cheloveka. SPb.: SpetsLit., 2013. 670 s. (in Russian)].
3. Иммунотерапия: Руководство для врачей / под ред. Хаитова Р. М., Атауллаханова Р. И., Шульженко А. Е. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2018. 768 с. [Immunoterapiya: Rukovodstvo dlya vrachey / pod red. Khaitova R. M., Ataullakhanova R. I., Shul’zhenko A. Ye. 2-ye izd., pererab. i dop. M.: GEOTAR-Media, 2018. 768 s. (in Russian)].
4. Lennon P., Crotty M., Fenton J. E. Infectious mononucleosis // British Medical Journal. 2015. Vol. 350. P. 1–7.
5. Agut H., Bonnafous P., Gautheret-Dejean A. Laboratory and Clinical Aspects of Human Herpesvirus 6 Infection // Clinical Microbiology Reviews. 2015. Vol. 28 (2).
P. 313–335. doi: 10.1128/CMR.00122–14.
6. Andersson J., Britton S., Ernberg I. et al. Effect of acyclovir on infectious mononucleosis: a double-blind, placebo-controlled study // J Infect Dis. 1986. Vol. 153. P. 283–290.
7. Andersson J., Sköldenberg B., Henle W. et al. Acyclovir treatment in infectious mononucleosis: a clinical and virological study // Infection. 1987. Vol. 15. P. 14–20.
8. Pagano J. S., Sixbey J. W., Lin J. C. Acyclovir and Epstein-Barr virus infection // J Antimicrob Chemother. 1983. Vol. 12 (Suppl B). P. 113–121.
9. Tynell E., Aurelius E., Brandell A. et al. Acyclovir and prednisolone treatment of acute infectious mononucleosis: a multicenter, double-blind, placebo-controlled study // J Infect Dis. 1996. Vol. 174. P. 324–331.
10. Van der Horst C., Joncas J., Ahronheim G. et al. Lack of effect of peroral acyclovir for the treatment of acute infectious mononucleosis // J Infect Dis. 1991. Vol. 164. P. 788–792.
11. Vouloumanou E. K., Rafailidis P. I., Falagas M. E. Current diagnosis and management of infectious mononucleosis // Current Opinion in Hematology. 2012. Vol. 19 (1). P. 14–20. doi: 10.1097/MOH.0b013e32834daa08.
12. Balfour Jr.H., Hokanson K. M., Schacherer R. M. et al. A virologic pilot study of valacyclovir in infectious mononucleosis // Journal of Clinical Virology. 2007. Vol. 39. P. 16–21.
13. Walling D. M., Flaitz C. M., Nichols C. M. Epstein-Barr Virus Replication in Oral Hairy Leukoplakia: Response, Persistence, and Resistance to Treatment with Valacyclovir // Journal of Infectious Diseases. 2003. Vol. 188. P. 883–890.
14. Cox A. J., Gleeson M., Pyne D. B. et al. Valtrex therapy for Epstein-Barr virus reactivation and upper respiratory symptoms in elite runners // Med. Sci. Sports Exerc. 2004. Vol. 36 (7). P. 1104–1110.
15. Vezina H. E., Balfour Jr. H., Weller D. R. et al. Valacyclovir pharmacokinetics and exploratory pharmacodynamics in young adults with Epstein-Barr virus infectious mononucleosis // J Clin Pharmacol. 2010. Vol. 50. P. 734–742.
16. Hoshino Y., Katano H., Zou P. et al. Long-Term Administration of Valacyclovir Reduces the Number of Epstein-Barr Virus (EBV) -Infected B Cells but Not the Number of EBV DNA Copies per B Cell in Healthy Volunteers // Journal of virology. 2009. Vol. 83 (22). P. 11857–11861.
17. De Paor M., O’Brien K., Fahey T., Smith S. M. Antiviral agents for infectious mononucleosis (glandular fever) // The Cochrane Database of Systematic Reviews. 2016. Issue 12. CD011487. doi: 10.1002/14651858.



Набор Wellcogen на менингококковые инфекции R30859602 Прямое определение антигенов в жидкостях тела (СМЖ, сыворотке, моче, крови) 30 тестов Бактериальный менингит
Набор Wellcogen для определения H. influenzae b R30858801 Прямое определение антигенов в жидкостях тела (СМЖ, сыворотке, моче, крови) 30 тестов Бактериальный менингит
Набор Wellcogen для определения N. meningitidis A, C, Y, W 135/ R30859203 Прямое определение антигенов в жидкостях тела (СМЖ, сыворотке, моче, крови) 30 тестов Бактериальный менингит
Набор Wellcogen для определения N. meningitidis B/E. coli K1 R30858701 Прямое определение антигенов в жидкостях тела (СМЖ, сыворотке, моче, крови) 30 тестов Бактериальный менингит
Набор Wellcogen для определения стрептококков группы B R30859001 Прямое определение антигенов в жидкостях тела (СМЖ, сыворотке, моче, крови) 30 тестов Бактериальный менингит
Набор Wellcogen для определения Streptococcus pneumoniaе DR0700M Прямое определение антигенов в жидкостях тела (СМЖ, сыворотке, моче, крови) 30 тестов Бактериальный менингит
Набор PathoDxtra для диагностики стрептококков групп A, B, C, D, F и G DR0701G Дифференциация групп стрептококков A, B, C, D, F и G по Лансфильду с первичных чашек с культурой. 60 тестов Бактериальный менингит
Набор PathoDxtra для диагностики стрептококков групп A DR0702G Предназначен для использования с набором DR0700M 60 тестов Streptococcus
Набор PathoDxtra для диагностики стрептококков групп B DR0703G Предназначен для использования с набором DR0700M 60 тестов Streptococcus
Набор PathoDxtra для диагностики стрептококков групп C DR0704G Предназначен для использования с набором DR0700M 60 тестов Streptococcus
Набор PathoDxtra для диагностики стрептококков групп D DR0705G Предназначен для использования с набором DR0700M 60 тестов Streptococcus
Набор PathoDxtra для диагностики стрептококков групп F DR0706G Предназначен для использования с набором DR0700M 60 тестов Streptococcus
Набор PathoDxtra для диагностики стрептококков групп G DR0706G Предназначен для использования с набором DR0700M 60 тестов Streptococcus
Набор Streptex для диагностики групп стрептококков A, B, C, D, F и G (ферментная экстракция) R30950501 Набор Streptex для диагностики групп стрептококков A, B, C, D, F и G (ферментная экстракция) Идентификация стрептококков групп A, B, C, D, F, G по Лансфильду с использованием ферментной экстракции 50 тестов Streptococcus
Набор Streptex Rapid для диагностики стрептококков групп A, B, C, F и G (кислотная экстракция) R30950555 Идентификация стрептококков групп A, B, C, F, G по Лансфильду с использованием кислотной экстракции 50 тестов Streptococcus
Набор Staphaurex Plus для идентификации Staphylococcus aureus (MRSA и MSSA) R30950102 Идентификация Staphylococcus aureus (MRSA и MSSA) 150 тестов Staphylococcus и MRSA (метициллин-резистентный стафилококк)
Набор Staphaurex Plus для идентификации Staphylococcus aureus (MRSA и MSSA) R30950201 Идентификация Staphylococcus aureus (MRSA и MSSA) 450 тестов Staphylococcus и MRSA (метициллин-резистентный стафилококк)
Набор Staphaurex Plus для идентификации Staphylococcus aureus (MRSA и MSSA) DR0595A Набор для быстрой идентификации S. aureus из чистой культуры 100 тестов Streptococcus
Staphytect Plus Набор для идентификации Staphylococcus aureus (MRSA) DR0850M Идентификация S. aureus из чистой культуры 100 тестов Streptococcus
Staphytect Plus Набор для идентификации Staphylococcus aureus (MRSA) DR0850B 500 тестов Streptococcus
Набор для диагностики C. difficilе DR1107A Идентификация Clostridium difficile из бульона или из селективной среды 50 тестов Clostridium difficile
Набор для диагностики инфекционного мононуклеоза DR0780M Набор для выявления гетерофильных антител к инфекции мононуклеоза в сыворотке и плазме 100 тестов Инфекционный мононуклеоз
Набор для дифференцировки серогрупп легионелл DR0800M Дифференциация серогрупп Legionella, выращенных на селективной среде 50 тестов Legionella
Набор для идентификации Listeria DR1126A Предварительная идентификация Listeria spp. 100 тестов Listeria
Набор для идентификации сальмонелл DR1108A Быстрый латексный для предварительной идентификации Salmonella spp. 1000 тестов Salmonella
Латексный цветной тест Wellcolex для дифференциации серогрупп сальмонелл R30858301 Быстрый латексный тест для предварительного определения серогруппы Salmonella 50 тестов Salmonella
Латексный цветной тест Wellcolex для дифференциации серогрупп сальмонелл R30858302 Быстрый латексный тест для предварительного определения серогруппы Salmonella " "Быстрый латексный тест для предварительного определения серогруппы Salmonella 200 тестов Salmonella
Латексный цветной тест Wellcolex для дифференциации серогрупп шигелл R30858401 Быстрый латексный тест для выявления видовой идентификации Shigella с плотных сред 50 тестов Shigella
Наборы для идентификации и дифференциации микроорганизмов из клинического материала или из чистой культуры методом латексной агглютинации. Метод латексной агглютинации является вариантом реакции пассивной гемагглютинации (РПГА). Латексные частицы полистирена с адсорбированными на них молекулами антител вступают в реакцию и агглютинируют с соответствующими антигенами микроорганизмов.
Качество
Все реактивы обладают высокими показателями специфичности и чувствительности.
Скорость
Время реакции – несколько минут
Удобство
Наборы содержат все необходимые реагенты, контроли и вспомогательные расходные материалы такие, как пипетки, реакционные карты, палочки для перемешивания. Латексный реагент представлен в жидкой форме, хранение при + 2-8 °С
Микробиологическая диагностика пневмококка. Диагностика пневмококковой инфекции. Выявление пневмококка. Выделение пневмококка. Лечение пневмококковой инфекции.
Основу микробиологической диагностики пневмококка составляют выделение и идентификация возбудителя. Материал необходимо исследовать как можно быстрее после его получения, так как бактерии склонны к быстрому аутолизу, обусловленному активностью внутриклеточных ферментов. На пневмококковую инфекцию указывает наличие нейтрофилов и грамположительных ланцетовидных диплококков (не менее 10 в поле зрения) в мазках клинического материала. В противном случае прибегают к выделению возбудителя.
Для дифференцировки пневмококка от прочих стрептококков наиболее широко используют тест чувствительности к оптохину. Это средство угнетает рост практически 100% клинических изолятов.
От зеленящих стрептококков S. pneumoniae отличает способность ферментировать инулин, а также чувствительность к солям жёлчных кислот (дезоксихолатная проба), в присутствии которых происходит лизис пневмококков.

Выделенные изоляты пневмококка следует серотипировать, используя коммерческие реагенты для реакций латекс-агглютинации или коагглютинации, выявляющих капсульные Аг.
При сомнительных результатах можно внутрибрюшинно заразить белых мышей материалом пневмококка, взятым от больного, а затем провести бактериологические и серологические исследования перитонеального экссудата.
Лечение пневмококковой инфекции
Терапия пневмококковой инфекции аналогична таковой при прочих стрептококковых инфекциях. Однако следует помнить, что среди пневмококков часто обнаруживают штаммы, устойчивые к пенициллинам. Для профилактики пневмококковых инфекций разработана поливалентная вакцина, включающая капсульные полисахаридные Аг 23 различных сероваров, вызывающих 90% гематогенных инфекций. Иммунизация показана группам повышенного риска; её проводят двукратно с 5-10-летним интервалом.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.


Артикул: 710-000
Производитель: Alere Inc., США
Регистрационное удостоверение
Методические рекомендации МР 3.3.1.0027-11 Пневмококк
В Методических рекомендациях МР 4.2.0114-16 Лабораторная диагностика внебольничной пневмонии пневмококковой этиологии, утвержденных Роспотребнадзором 20.10.2016 указано: При подозрении на ВП пневмококковой этиологии исследуют материал дыхательных путей (мокрота и ее индуцированный вариант, трахеальный аспират, пробы в ходе бронхоскопии), плевральную жидкость, венозную кровь, ликвор, мочу, материал, полученный при аутопсии. При недоступности материала из дыхательных путей для ряда методов допускается проведение исследования мазков из ротоглотки и носоглотки.
У госпитализированных пациентов отбор материала проводят при поступлении (не позднее вторых суток) и до назначения антибиотиков. При невозможности выполнения указанного требования материал забирают перед введением очередной дозы антимикробного препарата. (стр.13)
Из стандартизованных методов диагностики пневмококковой пневмонии (культуральные, серологический, ПЦР, ИХА) только ИХА тест по моче дает результат анализа за 15 минут, что позволяет поставить данный тест до назначения антибиотиков.
"В последние годы все всё чаще используются быстрые тесты, в частности иммунохроматографический экспресс-тест для выявления пневмококкового клеточного полисахарида (с-полисахарида) в моче. Тест адаптирован для образцов мочи взрослых пациентов, и применяется до начала антибактериальной терапии. Не рекомендуется проводить данное исследование среди лиц, ранее перенесших внебольничную пневмонию или получавшим профилактическую прививку от S. pneumoniae в течение 5 дней предшествующих тестированию. Время выполнения исследования составляет 15 минут, чувствительность теста по данным литературы – 86 - 90%, специфичность – 71 - 97%. Ряд международных сообществ рекомендует этот метод в качестве дополнительного способа диагностики пневмококковых пневмоний, прежде всего у пациентов с тяжелым течением заболевания."стр.10. Также см. информацию об ИХА тесте на стр. 21,34,35 МР 4.2.0114-16
Выявление возбудителя пневмоний в моче ИХА методом включено в руководства по пневмонии Америки, Британии, Бразилии, Франции, Европы, Швеции, Испании, Канады:
Общество инфекционных болезней Америки/Руководства американского торакального общества по управлению внебольничной пневмонией у взрослых
Руководства британского торакального общества по управлению внебольничной пневмонией у взрослых
Бразильские руководства по внебольничной пневмонии у имуннокомпетентных взрослых-2009
Французские руководства Лечение инфекций нижних дыхательных путей у иммунокомпетентных взрослы х
Европейские Руководства по управлению инфекциями нижних дыхательных путей у взрослых
Шведкие руководства по управлению внебольничной пневмонией у имуннокомпетентных взрослых
Руководства Испанского общество пульмонологии и торакальной хирургии
Канадские руководства по начальному управлению внебольничной пневмонии.
Аналогов данного теста нет ни Российского, ни Зарубежного производства
Тест Binax NOW® S. pneumoniae является быстрым in-vitro иммунохроматографическим анализом для качественного определения антигена S. pneumoniae в моче у пациентов с пневмонией и в спинномозговой жидкости у пациентов с менингитом. В сочетании с культуральным и другими методами он предназначен для диагностики пневмококковой пневмонии и пневмококкового менингита.
В настоящее время в более чем 90% случаев окончательного диагноза внебольничной пневмонии в мире устанавливается данным методом.
Разрешен к продаже FDA (США), сертифицирован CE (ЕС).
Время постановки: 15 минут
Чувствительность: моча 86%, СМЖ 97%
Специфичность: моча 94%, СМЖ 99%
Исследуемый образец: Моча, спинномозговая жидкость
Количество тестов: 22
Индивидуальный анализ: Есть
Превосходство данного метода над традиционными, включенными в стандарт бактериологическим и серологическим методами состоит, прежде всего, в сроках исследования и доступности клинического материала. Метод позволяет окончательно подтвердить диагноз в течении 1-2 ч. Бактериологический метод занимает не менее 4-5 суток, причем требуются инвазивные процедуры для получения материала (бронхоскопия, биопсия), так как из мокроты, особенно после начала элютропной терапии, возбудитель удается выделить далеко не всегда. Выявление диагностического нарастания титров антител в реакции непрямой иммунофлюоресценции возможно лишь на третьей неделе заболевания, когда проведен курс антибиотикотерапии и исход заболевания обычно уже ясен.
Экспресс-тесты Бинакс (США) предназначены для иммунохроматографического анализа, который не включен в Перечень отдельных видов медицинских изделий, происходящих из иностранных государств, в отношении которых устанавливается ограничение допуска для целей осуществления закупок для обеспечения государственных и муниципальных нужд. Поэтому закупка экспресс-тестов Бинакс (США) не регламентируется Постановлением Правительства РФ №102 от 05.02.2015 г. "Об установлении ограничения допуска отдельных видов медицинских изделий, происходящих из иностранных государств, для целей осуществления закупок для обеспечения государственных и муниципальных нужд".
Читайте также:

